Апробация метода оценки мозгового кровотока с использованием ультразвуковой флуометрии на модели односторонней перманентной церебральной ишемии на крысах линии Вистар
Луговик И.А., Симонова Е.В. , Бернацкая Е.А. Апробация метода оценки мозгового кровотока с использованием ультразвуковой флуометрии на модели односторонней перманентной церебральной ишемии на крысах линии Вистар . Лабораторные животные для научных исследований. 2022; 1. https://doi.org/10.29296/2618723X-2022-01-03
Резюме
Для определения эффективности препаратов, направленных на лечение инсульта, обычно используются косвенные показатели, свидетельствующие о процессах восстановления животных. Однако при оценке результатов восстановления мозгового кровообращения после фармакологической коррекции целесообразно количественно установить скорость кровотока в реальном времени, например, методом ультразвуковой допплерографии.
Оценка нарушений мозгового кровообращения с помощью данного метода широко применяется в экспериментальных исследованиях, однако стандартного протокола не существует, в каждой лаборатории разрабатываются отдельные методические подходы. В связи с этим целесообразно проводить адаптацию метода в конкретной лаборатории с учетом оборудования, вида и линии животных, а также модели индукции патологических изменений.
Цель работы – апробация метода оценки мозгового кровотока с помощью метода ультразвуковой флуометрии посредством допплерографа для контроля кровотока (комплектация Net, ультразвуковой компьютеризированный) ММ-Д-К «Минимакс-допплер-К» (ООО «СП Минимакс», Россия) и датчика с частотой 25 МГц на модели односторонней, перманентной церебральной ишемии на самцах крыс линии Wistar (Вистар), полученных из питомника НПО «Дом Фармации» (Россия).
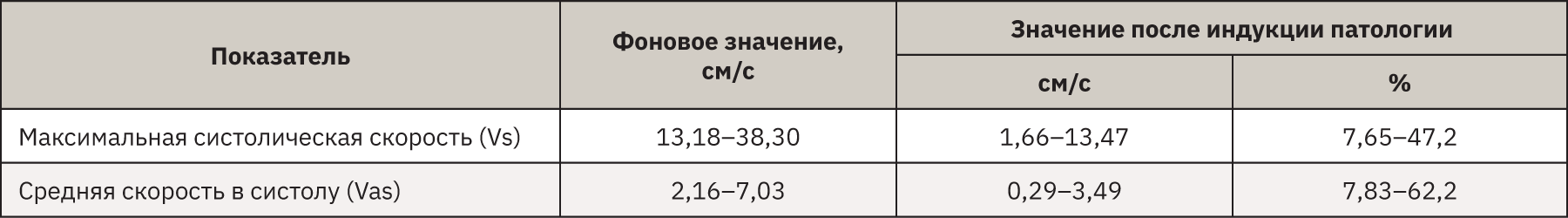
В рамках исследований определяли значения максимальной систолической скорости (Vs, см/с) и средней скорости в систолу (Vas, см/с), являющиеся наиболее информативными и часто используемыми маркерами в экспериментах при оценке фармакологической активности препаратов.
Динамику изменений показателей в течение 60 мин после индукции патологии регистрировали у 11 животных. Для более полной оценки вариативности в анализ были включены исходные данные и показатели сразу после индукции патологии, полученные в других экспериментах с аналогичным дизайном (n=93).
По результатам апробации метода показано, что скорость мозгового кровотока имеет достаточно высокую вариабельность, установлены референтные интервалы по фоновым значениям скорости кровотока и сразу после индукции патологии с учетом рекомендаций Института клинических и лабораторных стандартов (CLSI).
При анализе динамики обоих показателей скорости кровотока отмечено, что на протяжении всего эксперимента достигнуто значимое их снижение относительно исходных величин.
На 5-й минуте после индукции патологии выявлено достаточно быстрое восстановление показателей до 70% от исходных по Vs и 56% по Vas. В последующих точках скорость стабилизируется на уровне 50% от исходных значений.
Этот факт необходимо учитывать при планировании дизайна экспериментов по изучению фармакологической активности препаратов, влияющих на мозговое кровообращение, так как если введение лекарственного средства будет проведено сразу после индукции патологии, фармакологическое действие может наслоиться на результат физиологического восстановления, что затруднит оценку влияния препарата.
Введение
Нарушения мозгового кровообращения по-прежнему остаются одной из ведущих причин смерти и инвалидизации населения. Согласно информационному бюллетеню Всемирной организации здравоохранения, инсульт занимает 2-е место в мире по общему количеству смертей за 2019 г., при этом количество смертей от этого заболевания ежегодно растет [1].
В связи с этим поиск новых фармакологических методов защиты головного мозга от ишемического повреждения является одной из центральных задач современной медицины.
Изучение новых лекарственных препаратов и методов лечения начинается с доклинических исследований на лабораторных животных [2], особенно если это касается сложных систем, которые все еще невозможно или крайне проблематично воспроизвести in vitro или ex vivo [3]. Несмотря на большое количество экспериментальных подходов к изучению ишемии головного мозга, моделей, полностью воспроизводящих патогенез заболевания и обладающих высокой трансляционной ценностью, на настоящий момент не существует [4].
В современных исследованиях для моделирования ишемии мозга используются мыши, крысы, кролики, кошки, собаки, свиньи и нечеловекообразные приматы. Приблизительно в 80% исследований моделирование ишемии проводится на лабораторных крысах, это связано с тем, что физиология и анатомия крыс хорошо изучены, для них описано и отработано большое количество протоколов, их использование экономически целесообразно. Все это объясняет широкое применение экспериментальных моделей на крысах для скрининга молекул-кандидатов, направленных на коррекцию мозгового кровообращения [4].
Как правило, в исследованиях эффективности препаратов, направленных на лечение инсульта, оценивают косвенные показатели, свидетельствующие о процессах восстановления животных: неврологический статус, поведение, смертность, биохимические и иммуногистохимические маркеры, объемы повреждения головного мозга [5–7]. Однако при определении эффективности восстановления мозгового кровообращения в результате фармакологической коррекции целесообразно количественно оценить скорость кровотока в реальном времени. Одним из таких методов, позволяющих регистрировать мозговой кровоток, является ультразвуковая допплерография.
Оценка нарушений мозгового кровообращения с помощью методов допплерографии широко применяется в экспериментальных исследованиях [8–13]. Однако стандартного протокола не существует, в каждой лаборатории разрабатываются отдельные методические подходы. Зачастую в опубликованных статьях не содержится детального описания экспериментальных процедур. Также могут использоваться различные приборы, характеристики которых обусловливают вариативность результатов. Помимо этого, такие факторы, как линия, пол, масса и возраст животных, могут влиять на результаты. Все это порождает необходимость адаптации метода в условиях конкретной исследовательской лаборатории.
Цель работы – опробовать метод оценки мозгового кровотока с помощью ультразвуковой флуометрии посредством допплерографа для контроля кровотока (комплектация Net, ультразвуковой компьютеризированный) ММ-Д-К «Минимакс-допплер-К» (ООО «СП Минимакс», Россия) и датчика с частотой 25 МГц на модели односторонней, перманентной церебральной ишемии на самцах крыс линии Wistar (Вистар).
Материал и методы
В экспериментах использованы самцы крыс Wistar (Вистар) массой 180–250 г. Животных содержали в стандартных условиях вивария: температура воздуха 18–26оС, относительная влажность 46–65%, 12-часовой световой день. Крысы находились в стандартных пластиковых клетках, не более 5 животных в каждой. Площадь пола на одно животное соответствовала регламентирующим стандартам, доступ к воде не ограничивали на протяжении всего срока эксперимента. В кормлении животных использовали стандартную диету.
Данная научно-исследовательская работа рассмотрена на биоэтической комиссии АО НПО «Дом Фармации», одобрена для проведения (№ БЭК 2.70/20) (n=11). Для более полной оценки вариативности значений в анализ были включены исходные данные и показатели сразу после индукции патологии, полученные в других экспериментах с аналогичным дизайном (n=93). Они также были рассмотрены на биоэтической комиссии АО НПО «Дом Фармации», одобрены для проведения (№ БЭК 1.70/20, 1.38/21). Все исследования выполнены в соответствии с Директивой 2010/63/EU Европейского парламента и Совета Европейского союза от 22 сентября 2010 г. по охране животных, используемых в научных целях.
Животных лишали корма на ночь перед оперативным вмешательством, оставляя свободный доступ к воде. Односторонняя перманентная церебральная ишемия была индуцирована путем перевязки левой ветви общей сонной артерии. Для этого животное, наркотизированное смесью препаратов Zoletil 100 в дозе 25 мг/кг (Virbac Sante Animale, Франция) и Xila в дозе 5 мг/кг (Interchemie werken De Adelaar B.V, Нидерланды) внутримышечно, фиксировали в положении на спине на подогреваемом операционном столике. Затем проводили срединный разрез кожи по линии проекции трахеи. Тупым методом разобщали мышцы с левой стороны шеи и выделяли сонную артерию, на которую накладывали лигатуру (свободно).
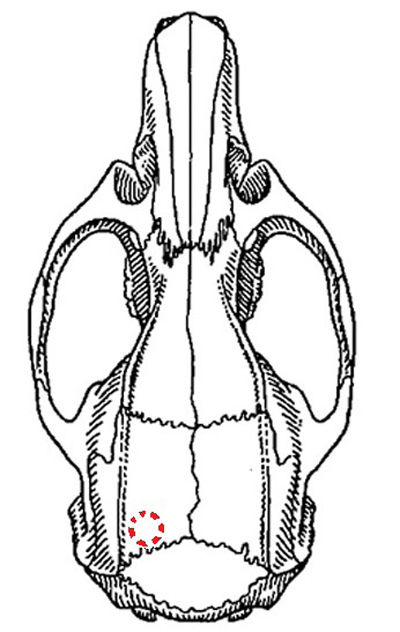
Для регистрации показателей удаляли часть черепной коробки крысы в проекции бассейна средней мозговой артерии с левой стороны (рис. 1). Наиболее удачным местом для высверливания локационного окна, согласно нашим исследованиям (данные не приводятся), является каудальная часть теменной кости в крайнем левом углу, рядом с межтеменной костью (рис. 2).
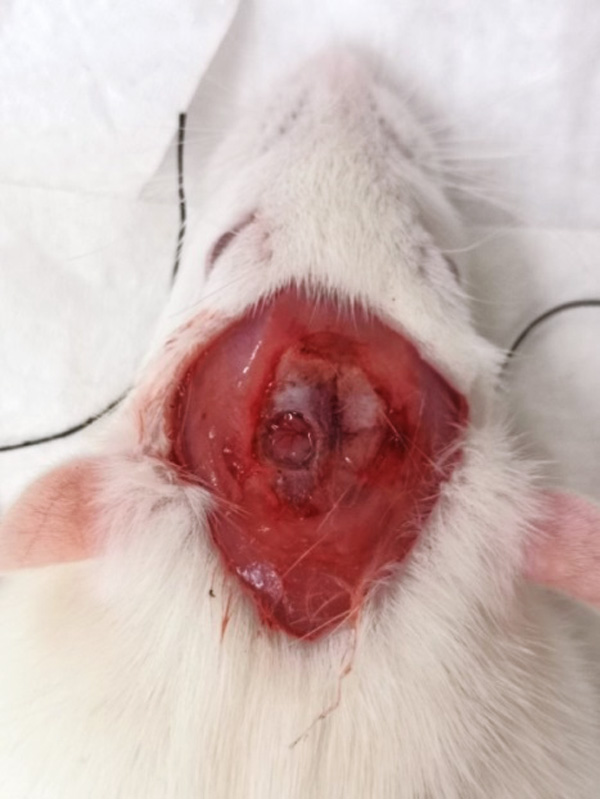
Для регистрации параметров кровотока датчик располагали непосредственно на поверхности головного мозга. Фиксировали исходные показатели, после чего наложенную ранее лигатуру затягивали. Таким образом, нарушалось кровоснабжение головного мозга через сонную артерию с левой стороны. После затягивания лигатуры показатели регистрировали на 5, 15, 30, 45 и 60-й минутах после индукции патологии.
Динамику изменений показателей в течение 60 мин после индукции оценивали у 11 животных. Для более полной картины индивидуальной вариативности показателей в анализ также включали исходные данные и результаты сразу после индукции патологии, полученные в других экспериментах с аналогичным дизайном (n=93).
Регистрацию показателей артериального кровотока проводили с помощью допплерографа для контроля кровотока (комплектация Net, ультразвуковой компьютеризированный) ММ-Д-К «Минимакс-допплер-К» (ООО «СП Минимакс», Россия) и датчика с частотой 25 МГц. Для улучшения проводимости звукового сигнала использовали эхо-гель.
Оценивали значения максимальной систолической скорости (Vs, см/с) и средней скорости в систолу (Vas, см/с), которые являются наиболее информативными и часто используемыми маркерами при анализе изменений скорости мозгового кровотока в экспериментах при оценке фармакологической активности препаратов [8–13].
По окончании эксперимента животных подвергали эвтаназии посредством передозировки анестетика без выхода из наркоза.
Для всех данных была применена описательная статистика: результаты проверяли на соответствие закону нормального распределения с помощью критерия Шапиро–Уилка. В случае нормального распределения рассчитывали среднее значение и стандартную ошибка среднего, которые вместе с количеством наблюдений представлены в итоговых таблицах. Также для определения референтных интервалов проводили расчет промежутка 2,5–97,5 процентиля вне зависимости от типа распределения данных. Для оценки данных с признаками нормального распределения при сравнении разных временных точек с исходной применяли критерий Стьюдента. Различия считали достоверными при уровне значимости р≤0,05. Статистическую обработку результатов осуществляли в программе Statistica 10.
Результаты и обсуждение
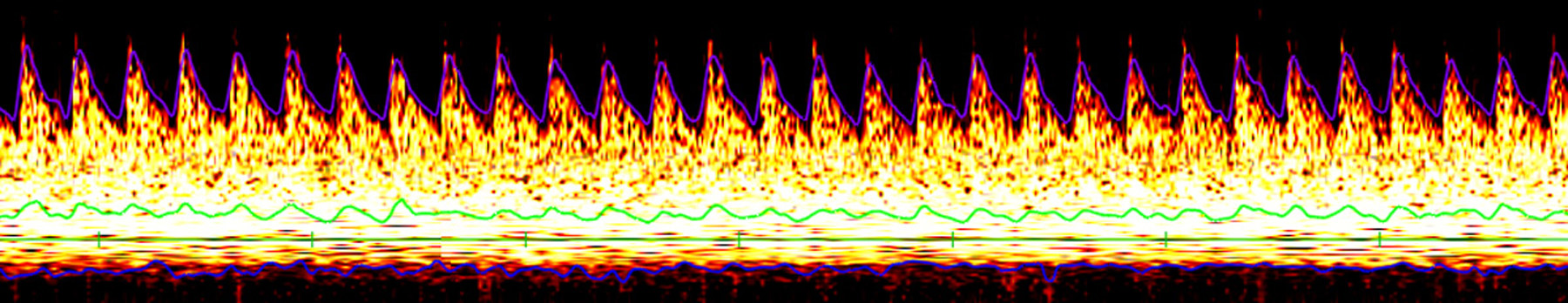
В мозговых артериях крыс отмечался постоянный поступательный монофазный кровоток, характерный для артерий головного мозга (рис. 3) [14].
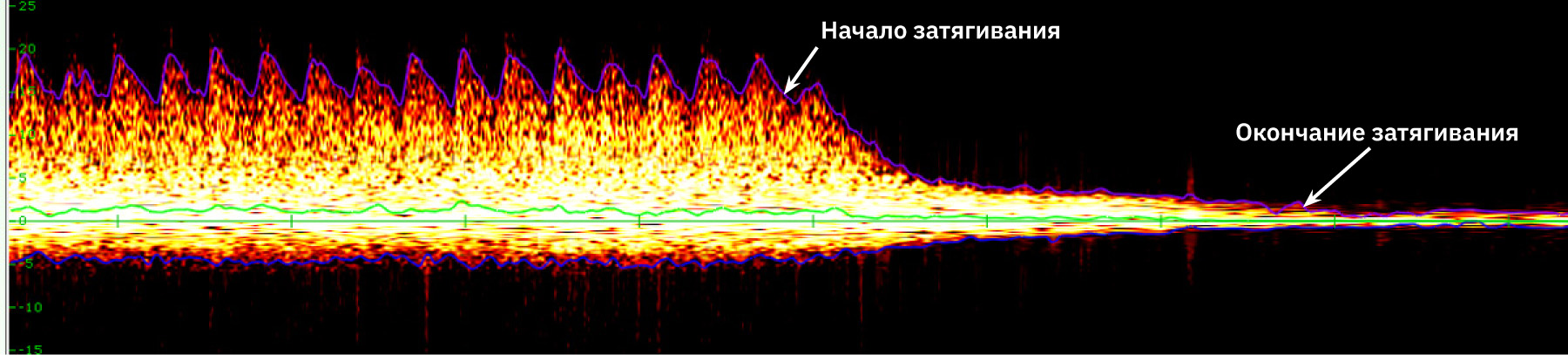
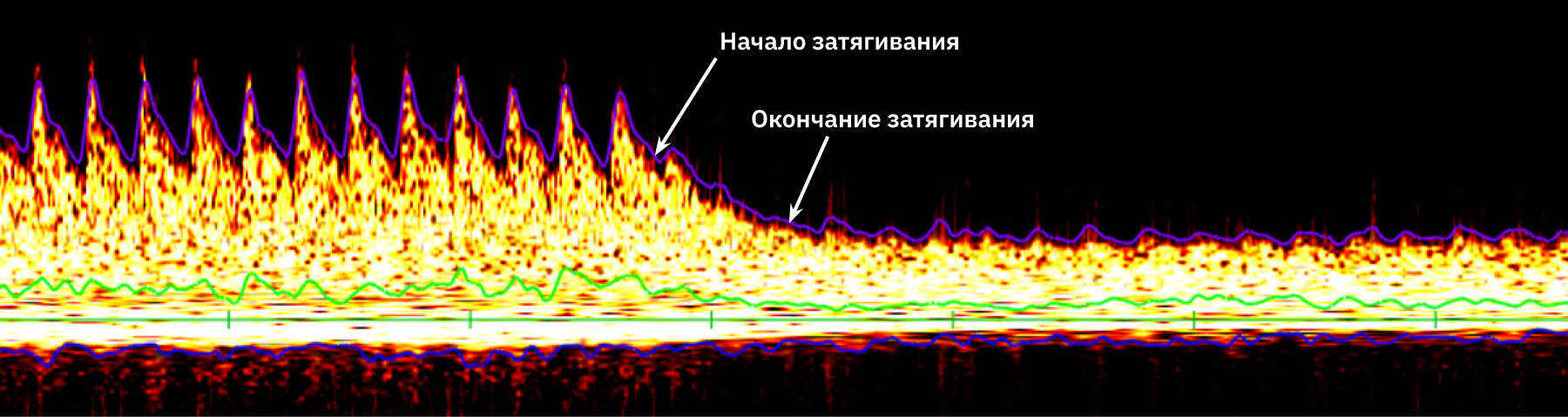
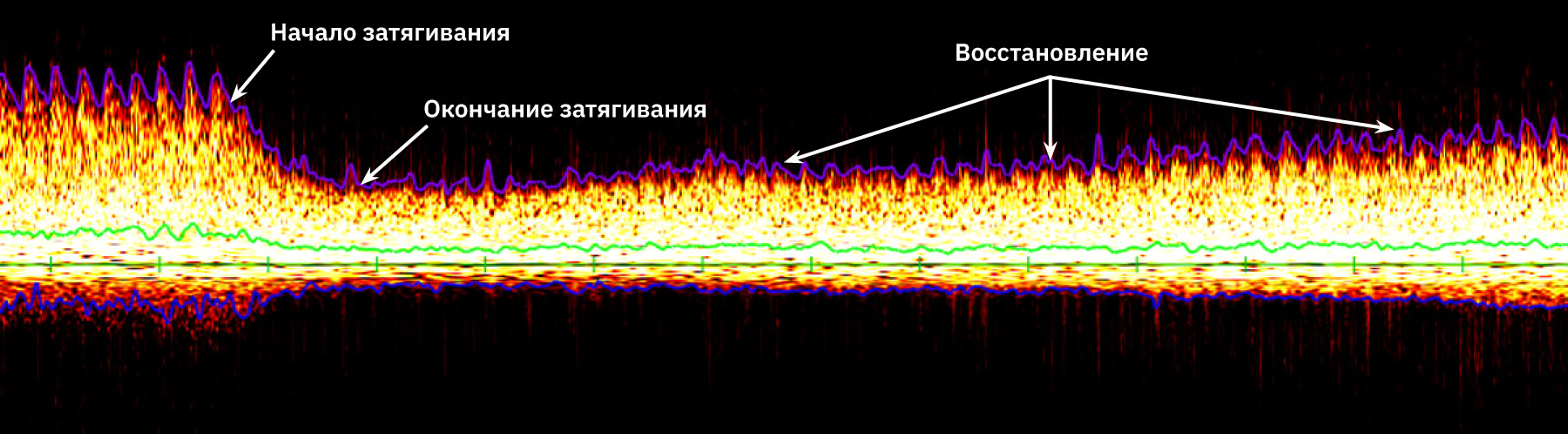
На рис. 4 и 5 представлены изменения скорости кровотока при успешном моделировании патологии (момент индукции). Как видно, спектральная кривая допплерограммы постепенно сглаживается, что говорит о существенном снижении скорости мозгового кровотока.
Несмотря на то что модель дает хорошо воспроизводимый результат, существует достаточно высокая индивидуальная вариабельность исходных показателей как при ультразвуковой флуометрии, так и сразу после индукции патологии [13], что было отмечено и в проведенных экспериментах. Данная вариабельность наиболее вероятно связана с достаточно высоким разнообразием анатомического строения сосудов головного мозга крыс [15] и различной степенью развития коллатералей у животных [16].
На рис. 6 и 7 представлен разброс индивидуальных значений до и после индукции патологии, полученных в рамках серии экспериментов.
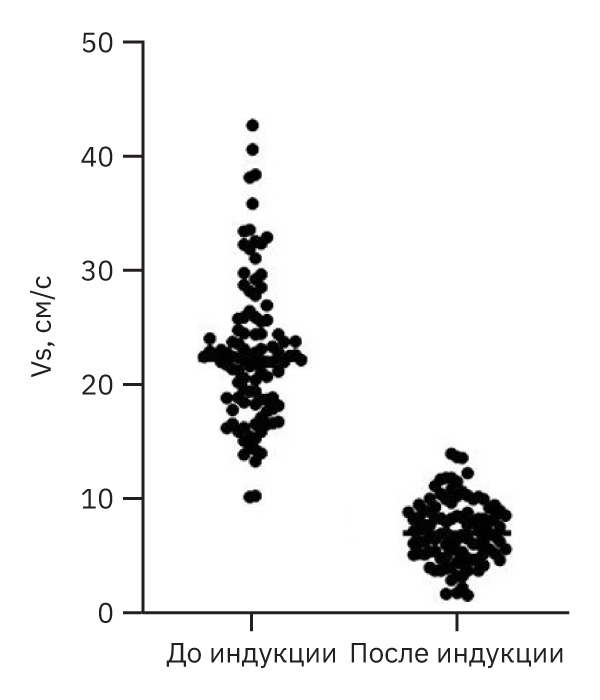
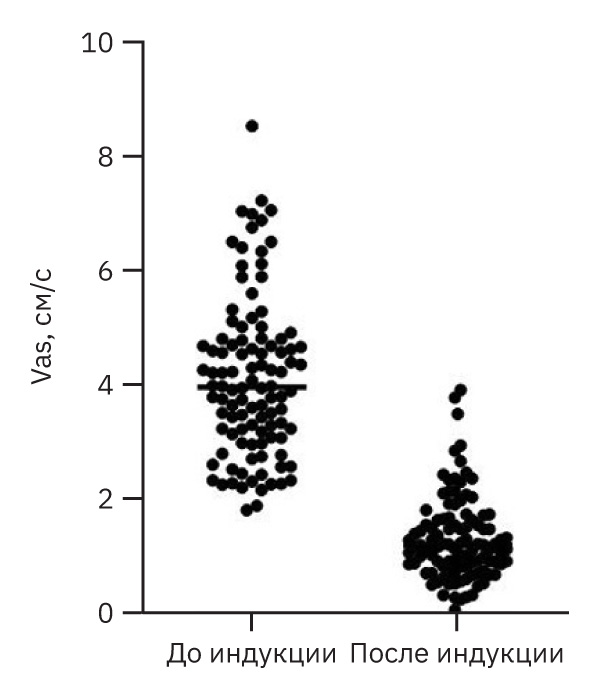
Показатель Vs находился в диапазоне от 10 до 42,7 см/с, а Vas – в диапазоне от 1,8 до 8,5 см/с. После индукции патологии скорость снижается: Vs 1,4–13,9 см/с (6,6–51,0% от исходных значений), а Vas 0,1–3,9 см/с (3,0–70,6% от исходных значений).
В табл. 1 представлены средние значения показателей в абсолютных величинах до индукции патологии и в абсолютных значениях и процентах от исходных значений после индукции патологии.

По результатам применения методики были получены данные исследования 104 животных (фоновые показатели и их изменение после лигирования сосуда), что является достаточным для построения референтных интервалов (РИ) [17].
РИ – статистический показатель, двумя пределами ограничивающий центральный 95% диапазон референтных значений [17]. Этот показатель определяют на выборке условно здоровых людей или животных, для того чтобы установить статистические нормы по какому-либо показателю, который характеризует данную популяцию [18].
Согласно рекомендациям Института клинических и лабораторных стандартов (CLSI), в каждом исследовательском центре рекомендуется создавать собственные РИ [18].
Существует два основных метода для расчета пределов РИ: параметрический и непараметрический. При использовании непараметрического метода расчета РИ рекомендуется использовать не менее 120 показателей [18], однако в некоторых случаях допустимо использовать данный метод при выборке, равной 80. К плюсам этого метода также можно отнести то, что он не требователен к распределению данных и это делает его предпочтительным при создании РИ биологических показателей, которые зачастую имеют ненормальное распределение [14].
Далее, согласно руководству CLSI для показателей скорости мозгового кровотока, проводили расчет промежутка 2,5–97,5 процентиля, диапазон между которыми и служил РИ для этой модели в условиях нашей лаборатории [17] (табл. 2).
После индукции патологии, как правило, наблюдается восстановление показателей (рис. 8). Наиболее вероятно это связано с анатомическими особенностями крыс, а именно: у крыс замкнут виллизиев круг и достаточно развито кровоснабжение через позвоночные артерии. В результате этого односторонняя перевязка сонной артерии приводит к резкому снижению скорости мозгового кровотока в бассейне среднемозговой артерии (сторона, с которой накладывалась лигатура), затем происходит перераспределение крови по виллизиевому кругу и частичное восстановление кровотока. Степень данного восстановления в значительной мере зависит от развития коллатерального кровообращения у животных [16].
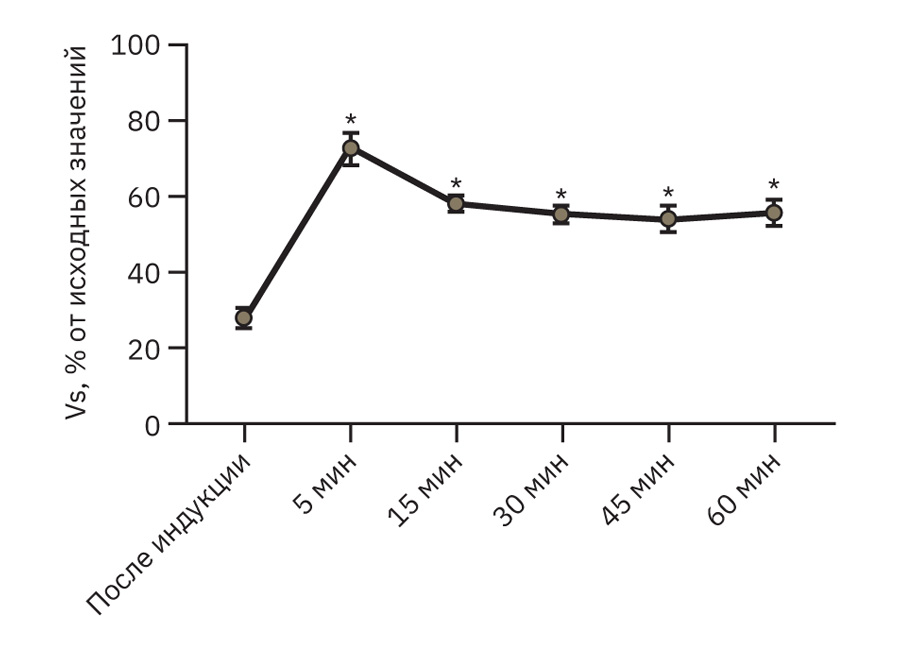
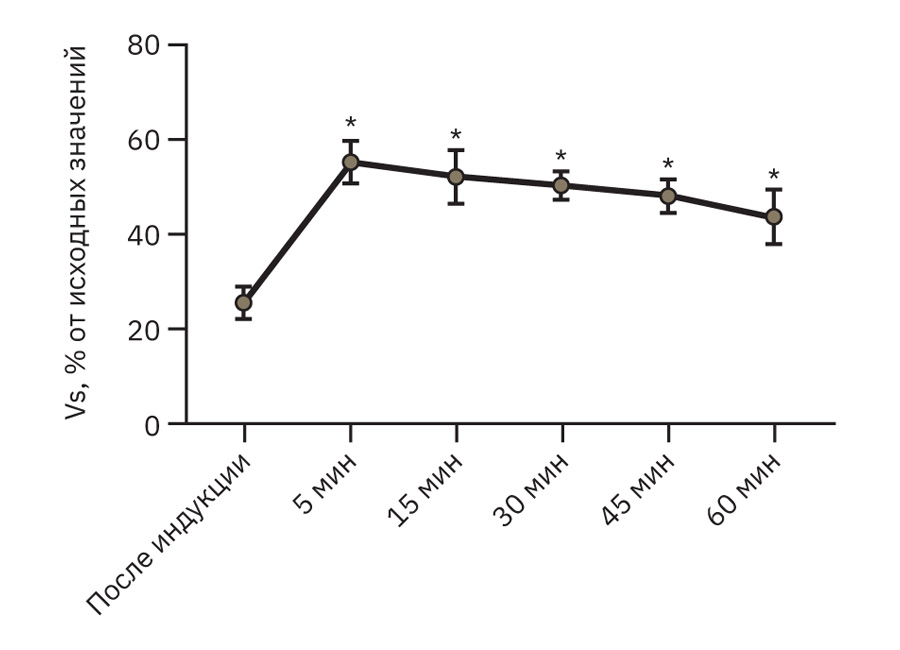
На рис. 9 и 10 представлена скорость мозгового кровотока в динамике по показателям Vs и Vas.
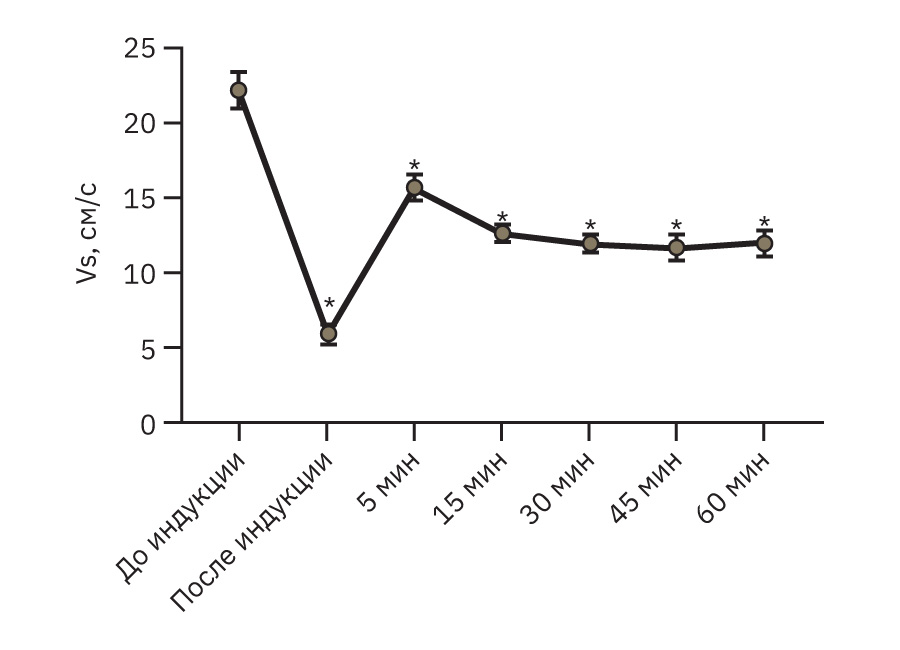
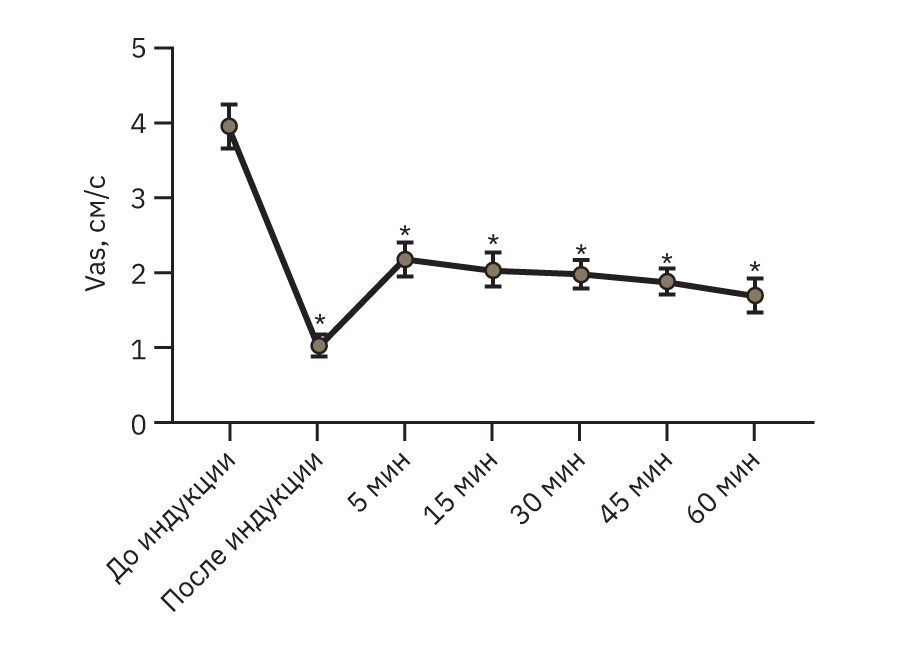
Примечание. На рис. 9 и 10: * – p<0,05, различия статистически значимы по сравнению с исходным уровнем, парный t-критерий Стьюдента, р<0,05.
После индукции патологии во всех временных точках отмечено значимое снижение относительно исходных данных показателей и Vs и Vas. На 8-й минуте после индукции патологии регистрируется выраженный пик показателей, а затем – их относительная стабилизация вплоть до 60-й минуты. Пример индивидуальной динамики показателей скорости мозгового кровотока представлен на рис. 11.
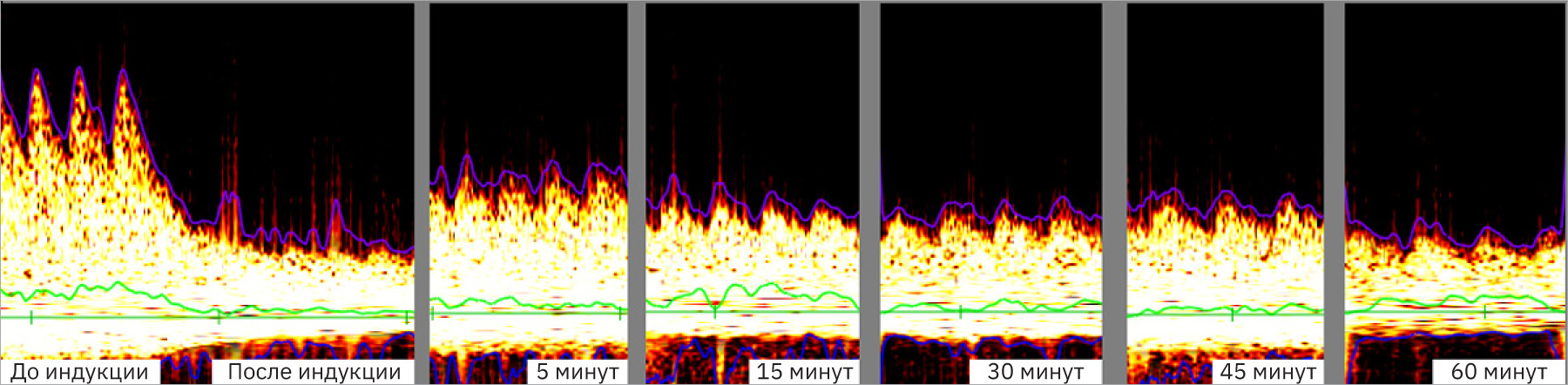
Как уже было отмечено выше, показатели скорости мозгового кровотока имеют достаточно выраженную индивидуальную вариабельность, в связи с чем целесообразно оценивать динамику их восстановления не только в абсолютных величинах, но и в процентах от исходных значений.
Во всех временных точках отмечено значимое восстановление относительно исходных данных как показателя Vs, так и Vas (рис. 12, 13).
На 5-й минуте после индукции патологии отмечался пик, который в среднем составлял около 70% по Vs и 56% по Vas от исходного уровня. Далее оба показателя стабилизировались на уровне около 50%.
Примечание. На рис. 12 и 13: * – p<0,05, различия статистически значимы по сравнению с уровнем после индукции, парный t-критерий Стьюдента, р<0,05.
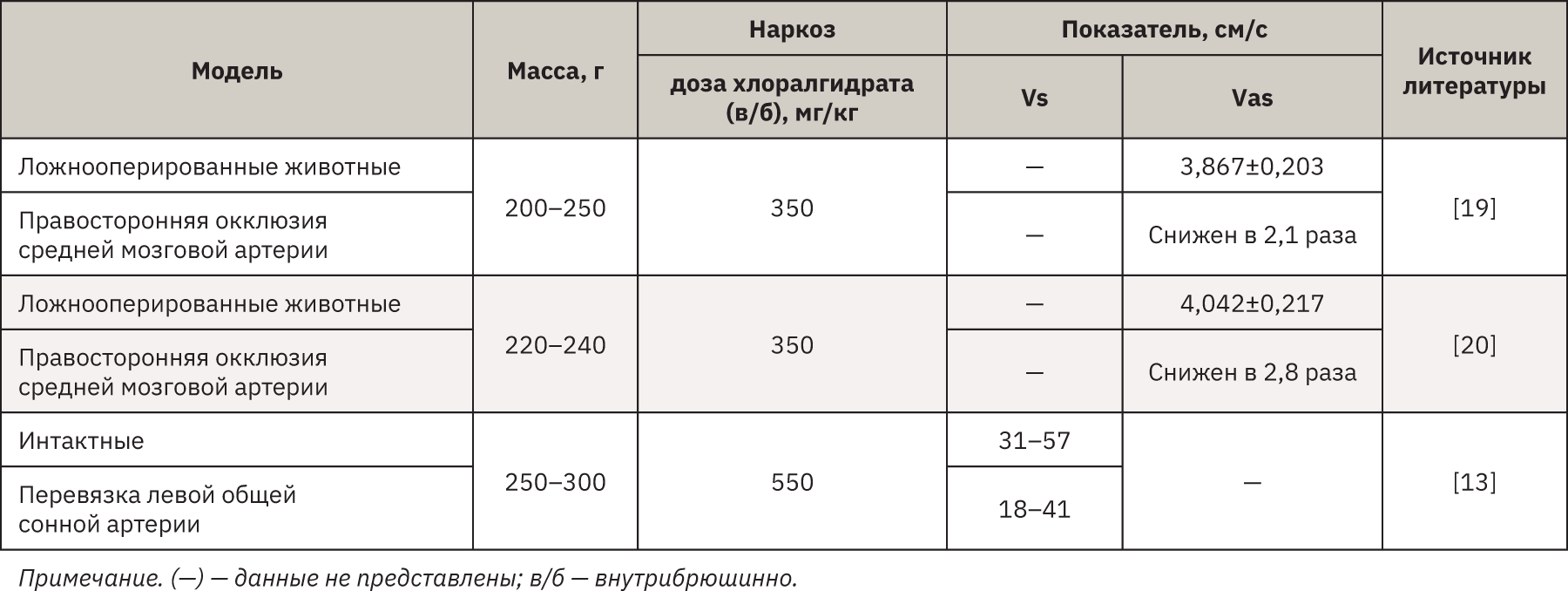
Следует отметить некоторые расхождения результатов, полученных в нашей лаборатории, с таковыми в других исследовательских учреждениях (показатели до индукции патологии несколько выше и односторонняя окклюзия не вызывает столь выраженного снижения скорости мозгового кровотока). В табл. 3 приведены данные источников литературы, касающиеся скорости мозгового кровотока крыс, полученные в различных моделях с использованием ультразвукового флуометра (бассейн среднемозговой артерии).
Это еще раз подтверждает необходимость апробации данной методики в рамках каждого исследовательского учреждения с учетом линии животных, их массы, используемого наркоза и модели индукции патологии.
Заключение
По результатам апробации метода установлено, что значения скорости мозгового кровотока имеют достаточно высокую вариабельность как до индукции патологии, так и после. В связи с этим при анализе динамики мозгового кровотока целесообразно оценивать показатели не только в абсолютных величинах, но и в процентах от исходных данных.
При испытании метода получено достаточное количество данных для построения референтных интервалов, которые рекомендуется иметь в каждой лаборатории с учетом имеющегося оборудования, популяции и пола участвующих в исследовании животных, согласно рекомендациям CLSI.
При анализе динамики показателей отмечено, что на протяжении всего эксперимента достигнуто значимое снижение скорости кровотока по показателям Vs и Vas относительно исходных данных.
На 5-й минуте после индукции патологии выявлено достаточно быстрое восстановление показателей до 70% от исходных по Vs и 56% по Vas. В последующих точках скорость стабилизируется на уровне 50% от исходных значений. Данный факт необходимо учитывать при планировании дизайна экспериментов по изучению фармакологической активности препаратов, влияющих на мозговое кровообращение, так как если их введение будет проведено сразу после индукции патологии, фармакологический эффект может наслоиться на результат физиологического восстановления, что затруднит оценку влияния препарата.
Вклад авторов
Луговик И.А. – сбор и анализ данных, проведение экспериментальных манипуляций, сбор данных из литературных источников, написание текста статьи.
Симонова Е.В. – проведение экспериментальных манипуляций.
Бернацкая Е.А. – проведение экспериментальных манипуляций
Благодарности
Работа выполнена без спонсорской поддержки.
Сведения о конфликте интересов
Авторы заявляют об отсутствии конфликта интересов.
Список источников
- Информационная бюллетень ВОЗ «10 ведущих причин смерти» URL: https://www.who.int/ru/news-room/fact-sheets/detail/the-top-10-causes-of-death (дата обращения: 01.2022).
- Durukan A., Tatlisumak T. Acute ischemic stroke: overview of major experimental rodent models, pathophysiology, and therapy of focal cerebral ischemia //Pharmacol. Biochem. Behav. – 2007 – Vol. 87(1). – Р. 179–197. DOI 10.1016/j.pbb.2007.04.015.
- Staicu C. E., Jipa F., Axente E., Radu M., Radu B.M., Sima F. Lab-on-a-Chip Platforms as Tools for Drug Screening in Neuropathologies Associated with Blood–Brain Barrier Alterations //Biomolecules. – 2021. – Т. 11. – Vol. 6. – P. 916. DOI 10.3390/biom11060916.
- Wang-Fischer Y. Manual of Stroke Models in Rats. N.-Y.: Taylor & Francis Group., 2009.
- Мазукина Е. В., Шекунова Е.В, Кашкин В.А., Фаустова Н.М., Макаров В.Г., Макарова М.Н.. Влияние умеренной гипогликемии на уровень белка S100b в крови и гиппокампе крыс //Лабораторные животные для научных исследований. – 2019. – 1 http://labanimalsjournal.ru/ru/2618723x-2019-01-07. DOI 10.29296/2618723X-2019-01-07 [Mazukina E. V., Shekunova E.V, Kashkin V.A., Faustova N.M., Makarov V.G., Makarova M.N.. Vlijanie umerennoj gipoglikemii na uroven' belka S100b v krovi i gippokampe krys //Laboratornye zhivotnye dlja nauchnyh issledovanij. (In Russ.)].
- Кашкин В. А., Арутюнян С. С. Развитие периферической сенсорной гиперсенситизации после глобальной ишемии головного мозга у крыс (краткое сообщение) DOI 10/29926/2618723X-2019-04-11//Лабораторные животные для научных исследований. – 2019. – 4. http://labanimalsjournal.ru/ru/2618723x-2019-04-11. [Kashkin V. A., Arutyunyan S. S. Razvitie perifericheskoi sensornoi gipersensitizatsii posle global'noi ishemii golovnogo mozga u krys (kratkoe soobshchenie)// Laboratory Animals for Science. (In Russ.)].
- Вавилова В.А., Гущин Я.А. Моделирование глобальной церебральной ишемии у монгольских песчанок //Лабораторные животные для научных исследований. – 2019. – №. 2. http://labanimalsjournal.ru/ru/2618723x-2019-02-03 DOI: 10.29296/2618723X-2019-02-03 [Vavilova V. A., Gushchin Ya. A. Modelirovanie global'noi tserebral'noi ishemii u mongol'skikh peschanok //Laboratornye zhivotnye dlya nauchnykh issledovanii. // Laboratory Animals for Science. (In Russ.)].
- Тюренков И. Н., Воронков А.В., Слиецанс А.А., Доркина Е.Г. Изучение влияния гесперидина на эндотелиальную функцию животных с экспериментально вызванным сахарным диабетом // Волгоградский научно-медицинский журнал. – 2009. – №. 1. – C. 19-21. [Tjurenkov I. N., Voronkov A.V., Sliecans A.A., Dorkina E.G. Izuchenie vlijanija gesperidina na jendotelial'nuju funkciju zhivotnyh s jeksperimental'no vyzvannym saharnym diabetom // Volgogradskij nauchno-medicinskij zhurnal. (In Russ.)]
- Мирзоян Р. С., Ганьшина, Т. С., Ким, Г. А., Курдюмов, И. Н., Масленников, Д.В., Курза, Е.В., Горбунов, А.А. Различие в цереброваскулярных эффектах 5-гидроксиадамантан-2-она, нимодипина и S-амлодипина никотината при геморрагическом и ишемическом поражениях мозга // Экспериментальная и клиническая фармакология. – 2018. – Т. 81, №. 5. – С. 3-6. [Mirzojan R.S., Gan'shina, T.S., Kim, G.A., Kurdjumov, I.N., Maslennikov, D.V., Kurza, E.V., Gorbunov, A.A. Razlichie v cerebrovaskuljarnyh jeffektah 5-gidroksiadamantan-2-ona, nimodipina i S-amlodipina nikotinata pri gemorragicheskom i ishemicheskom porazhenijah mozga // Jeksperimental'naja i klinicheskaja farmakologija. – (In Russ.)]
- Воронков А.В., Поздняков Д.И., Мамлеев А.В. Изучение вазодилатирующей и антитромботической функций эндотелия сосудов головного мозга крыс на различных моделях его ишемического повреждения // Современные проблемы науки и образования. – 2015. – №. 5. – С. 264-264. [Voronkov A.V., Pozdnyakov D.I., Mamleev A.V. Izuchenie vazodilatiruyushchei i antitromboticheskoi funktsii endoteliya sosudov golovnogo mozga krys na razlichnykh modelyakh ego ishemicheskogo povrezhdeniya // Sovremennye problemy nauki i obrazovaniya. (In Russ.)]
- Шмонин А. А., Дайнеко А. С., Просвирнина М. С., Колпакова М. Э., Шумеева А. Г., Мельникова Е. В., Власов Т. Д. Контроль качества эксперимента при моделировании фокальной транзиторной ишемии головного мозга у крыс по методике Koidzumi // Регионарное кровообращение и микроциркуляция. – 2014. – Т. 13, №. 3. – С. 74-79. [Shmonin A.A., Dajneko A. S., Prosvirnina M. S., Kolpakova M. Je., Shumeeva A. G., Mel'nikova E. V., Vlasov T. D. Kontrol' kachestva jeksperimenta pri modelirovanii fokal'noj tranzitornoj ishemii golovnogo mozga u krys po metodike Koidzumi // Regionarnoe krovoobrashhenie i mikrocirkuljacija. (In Russ.)]
- Рыбалко А.Е., Поздняков Д.И. Изучение влияния соединения RA-95 на уровень церебрального кровотока в условиях ишемии головного мозга // Новая наука: От идеи к результату. – 2016. – №. 2-3. – С. 93-96. [Rybalko A. E., Pozdnyakov D. I. Izuchenie vliyaniya soedineniya RA-95 na uroven' tserebral'nogo krovotoka v usloviyakh ishemii golovnogo mozga // Novaya nauka: Ot idei k rezul'tatu. (In Russ.)]
- Шмонин А.А. Перевязка средней мозговой артерии крысы: сравнение модификаций моделей фокальной ишемии мозга у крысы // Регионарное кровообращение и микроциркуляция. – 2011. – Т. 10, №. 3. – С. 68-76. [Shmonin A. A. Perevyazka srednei mozgovoi arterii krysy: sravnenie modifikatsii modelei fokal'noi ishemii mozga u krysy // Regionarnoe krovoobrashchenie i mikrotsirkulyatsiya. (In Russ.)]
-
Холин А. В., Бондарева Е. В. Допплерография и дуплексное сканирование сосудов головного мозга. – 2009. –93 с. [Holin A. V., Bondareva E. V. Dopplerografija i dupleksnoe skanirovanie sosudov golovnogo mozga. (In Russ.)]
- Ноздрачев А. Д., Поляков Е. Л. Анатомия крысы –СПб.: « //Лань», 2001.–464 с. [Nozdrachev A. D., Poljakov E. L. Anatomija krysy. (In Russ.)]
- Бонь Е. И., Максимович Н. Е. Способы моделирования и морфофункциональные маркеры ишемии головного мозга //Биомедицина. – 2018. – №. 2. [Bon' E. I., Maksimovich N. E. Sposoby modelirovanija i morfofunkcional'nye markery ishemii golovnogo mozga (In Russ.)]
- Евгина С.А., Савельев Л.И. Современные теория и практика референтных интервалов //Лабораторная служба. – 2019. – Т. 8. – №. 2. – С. 36-44. DOI 10.17116/labs2019802136 [Evgina S.A., Savel'ev L.I. Sovremennye teoriya i praktika referentnykh intervalov // Laboratornaya sluzhba (In Russ.)]
- CLSI Document C28-A3c. Defining, establishing, and verifying reference intervals in the clinical laboratory; approved guideline – third edition. Wayne, Pa., USA: CLSI; 2010.
- Воронков А. В., Поздняков Д. И. Сравнительная оценка влияния мексидола, тикотовой кислоты и соединения ATACL (4-гидрокси-3, 5-дитретбутил коричная кислота) на вазодилатирующую функцию эндотелия сосудов головного мозга крыс на фоне его ишемического повреждения //Экспериментальная и клиническая фармакология. – 2018. – Т. 81. – №. 2. – С. 21-24. [Voronkov A. V., Pozdnjakov D. I. Sravnitel'naja ocenka vlijanija meksidola, tikotovoj kisloty i soedinenija ATACL (4-gidroksi-3, 5-ditretbutil korichnaja kislota) na vazodilatirujushhuju funkciju jendotelija sosudov golovnogo mozga krys na fone ego ishemicheskogo povrezhdenija //Jeksperimental'naja i klinicheskaja farmakologija (In Russ.)]
- Воронков А. В., Оганесян Э. Т., Поздняков Д. И., Абаев В. Т. Изучение дозозависимого эндотелиотропного влияния соединения ATACL в условиях ишемического повреждения головного мозга у крыс в эксперименте //Вестник Волгоградского государственного медицинского университета. – 2017. – №. 1 (61). С. 54-58. [Voronkov A. V., Oganesjan Je. T., Pozdnjakov D. I., Abaev V. T. Izuchenie dozozavisimogo jendoteliotropnogo vlijanija soedinenija ATACL v uslovijah ishemicheskogo povrezhdenija golovnogo mozga u krys v jeksperimente //Vestnik Volgogradskogo gosudarstvennogo medicinskogo universiteta. (In Russ.)]




