Превентивные лечебные мероприятия в доклинических исследованиях (противопаразитарная обработка)
Акимов Д.Ю., Зиятдинова А.Р., Снижко Е.А. , Ильинская М.А., Васильев А.В. Превентивные лечебные мероприятия в доклинических исследованиях (противопаразитарная обработка). Лабораторные животные для научных исследований. 2020; 4. https://doi.org/10.29296/2618723X-2020-04-05
Резюме
Миссия клинической и сельскохозяйственной ветеринарной медицины в аспекте проведения противопаразитарных профилактических мероприятий – предоставление длительной защиты животным от инвазионных агентов. Фармакокинетика и фармакодинамика противопаразитарных препаратов рассматриваются под призмой безопасности сырья и готовой продукции для применения или употребления человеком. Однако при всей изученности данного вопроса имеющихся данных в свободном доступе недостаточно для составления плана лечебно-профилактических мероприятий у лабораторных животных.
В настоящей работе раскрывается тема необходимости проведения мониторинга здоровья животных касательно паразитических агентов, который должен включать в себя диагностику заболеваемости лабораторных животных арахноэнтомозами, гельминтозами и протозоонозами. При обнаружении инвазионного агента важна его идентификация до рода, а в некоторых случаях и вида возбудителя. Данный фактор является ключевым при оценке вирулентности патогена. Идентификация до вида дает возможность прогнозировать потенциальное распространение внутри питомника среди других видов лабораторных животных и иметь суждения о восприимчивости человека. Понимая, какой паразитарный агент выявлен, можно проследить весь его жизненный цикл, понять, могут ли другие виды лабораторных животных быть дефинитивными, промежуточными, дополнительными или резервуарными хозяевами. Проведение мониторинга по паразитарным агентам позволяет подобрать оптимальные схемы профилактики, а при необходимости и способы лечения, разрабатывать и совершенствовать санитарно-гигиенические мероприятия. На основании мониторинга здоровья животных можно судить об эффективности проведенных противопаразитарных мероприятий, проводить планирование лечебных действий при выявлении инвазий и контролировать их эффективность. В статье рассматриваются отдельные классы паразитарных организмов и их дефинитивные хозяева среди лабораторных животных.
Рассмотрены подходы к выбору препаратов для проведения профилактических противопаразитарных мероприятий лабораторным животным в зависимости от их вида, будь то лабораторные грызуны (мыши, песчанки, хомяки, крысы, дегу, морские свинки), кролики, хищные млекопитающие (хорьки, кошки, собаки) или карликовые свиньи (мини-пиги). Приведен обзор литературы по фармакокинетике основных препаратов для проведения профилактических мероприятий в зависимости от вида животных, пути введения и дозировки. Даны рекомендации по борьбе с гельминтозами, арахноэнтомозами и протозоонозами исходя из потребности в качественных тест-системах и периода полувыведения препаратов.
Введение
Согласно современным тенденциям доклинической практики, в отношении лабораторных животных вне эксперимента должны быть применимы принципы пяти свобод животных [1]. Одна из которых – свобода от боли, травм или болезни путем проведения превентивных мероприятий или ранней диагностики и лечения. Оказание превентивных мероприятий в рамках контроля и обеспечения здоровья и благополучия лабораторных животных является одним из основных аспектов в подготовке качественной тест-системы для доклинических исследований [1, 2].
Жизненные формы на земле постоянно подвергаются воздействию паразитов, заражение происходит в режиме цепной реакции [2]. Паразитарные заболевания наносят значительный социально-экономический ущерб обществу, в том числе и питомникам, занимающимся разведением лабораторных животных [3]. По данным Всемирной организации здравоохранения (ВОЗ), более 3 млрд человек во всем мире страдают от одного или нескольких паразитарных заболеваний, которые широко распространены и являются основной причиной заболеваемости и смертности среди населения [4–6]. Ввиду растущей тенденции к распространению паразитозов по всему миру данный вопрос актуализируется в геометрической прогрессии [4, 5]. Осуществление подбора, контроль выполнения и эффективности профилактических мероприятий в отношении животных гарантирует безопасность персонала и за счет качества тест-системы повышает достоверность доклинических исследований.
Перед разработкой лечебно-профилактических мероприятий в первую очередь необходимо оценить эпизоотологическую ситуацию. Также надо учитывать, что в практике лабораторного разведения векторами инвазии могут служить не только подстилочный материал, среда для обогащения, корм, летающие насекомые, но и обслуживающий персонал [7-15].
Осуществление подбора, контроль выполнения и эффективности профилактических мероприятий животных гарантируют безопасность персонала и качество тест-систем для доклинических исследований [16-21].
Исходя из данных факторов, цель исследования – осуществить подбор оптимальных химиопрепаратов для проведения противопаразитарных обработок лабораторных грызунов, кроликов, лабораторных хищных млекопитающих и карликовых свиней. Были поставлены следующие задачи:
- определить ключевых паразитов лабораторных животных в зависимости от вида лабораторных животных;
- дать рекомендации по применению химиопрепаратов у лабораторных животных;
- оценить необходимость тестирования противопаразитарных препаратов на их переносимость;
- установить взаимосвязь мониторинга здоровья животного и лечебно-профилактических мероприятий.
Материал и методы
Исследование проведено на базе акционерного общества «Научно-производственное объединение «Дом Фармации» и закрытого акционерного общества «Санкт-Петербургский институт фармации» в 2020 г. Предлагаемые противопаразитарные химиопрепараты были применены для профилактики инвазивных заболеваний и при лечении лабораторных животных из питомника акционерного общества «Научно-производственное объединение «Дом фармации»
Результаты и обсуждение
Лечением гельминтозов стали заниматься с тех пор, как были установлены заболевания, вызываемые гельминтами. В 1963 г. F. Hawking описал историю создания противопаразитарных препаратов и дал оценку эволюции химиотерапии паразитарных болезней и методов применения отдельно против разных классов паразитов.
Инвазивные заболевания лабораторных животных подразделяются на гельминтозы, акарозы, энтомозы и протозоонозы [1, 5, 22–30]. Ряд паразитарных заболеваний могут поражать животных как прямым контактным путем, так и трансмиссивно, когда в качестве вектора инвазии выступают членистоногие. Некоторые виды паразитов лабораторных животных представлены в табл. 1.
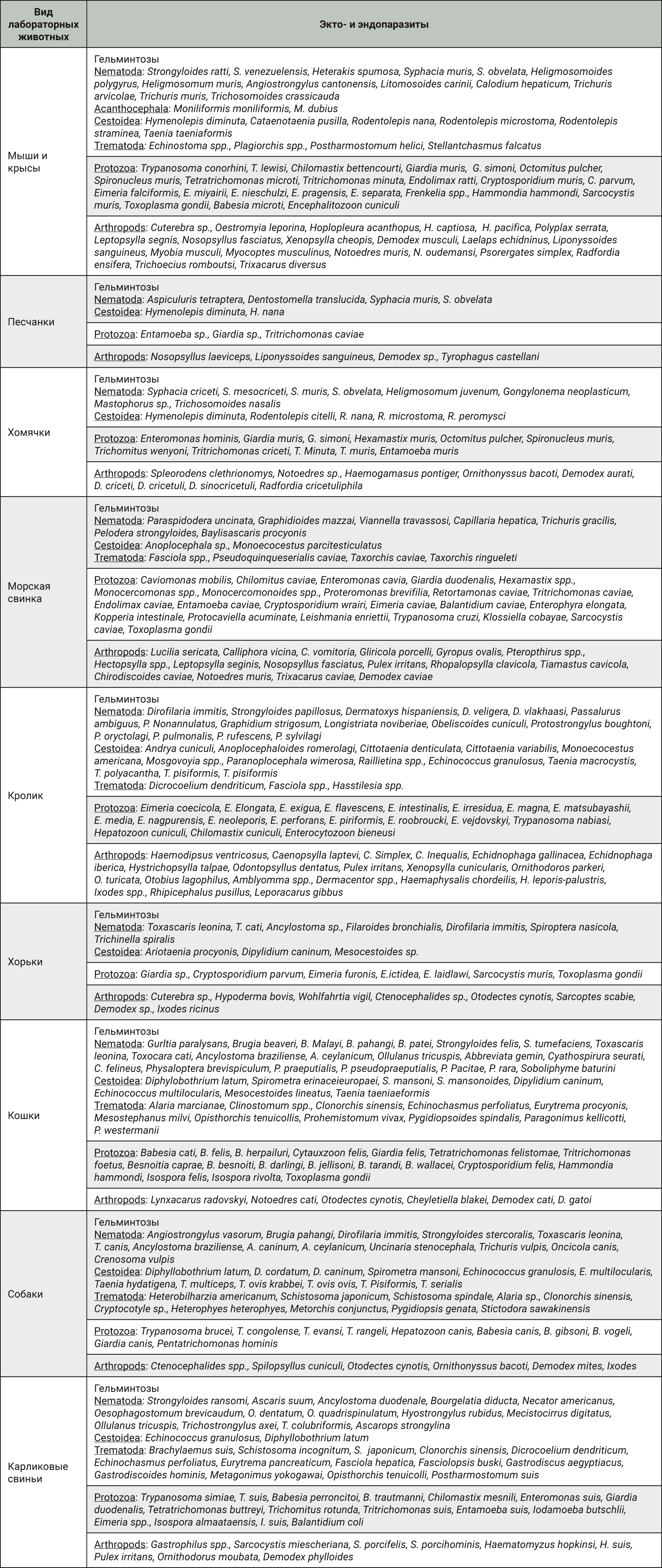
По данным отечественных авторов, огромный вклад в профиль инвазивных заболеваний лабораторных животных вносят гельминты, которые поражают от 50 до 100% лабораторных и синантропных грызунов [9–15, 31]. При этом экстенсивность инвазии может достигать 90%, а интенсивность – от 5 до 10 экземпляров [9, 28, 32]. Данные факты актуализируют необходимость в разработке наиболее эффективных методов дегельминтизации в условиях питомников доклинических центров [12, 33]. На этапе подбора химиопрепаратов для дегельминтизации важно оценить систематическое положение гельминтов, которые подразделяются на 3 класса: трематоды (Trematoda), цестоды (Cestoda) и нематоды (Nematoda). Установление поражения лабораторных животных тем или иным видом гельминтозов напрямую влияет на стратегию применения и выбор препарата [11, 34–37].
Широкое распространение на современном ветеринарном противопаразитарном рынке получили препараты, содержащие фенбендазол, паразиквантел, ивермектин [38–40].
При выборе препаратов для дегельминтизации стоит учитывать и их негативные свойства. Так, например, альбендазол оказывает эмбриотоксическое и тератогенное действие на крыс и кроликов и, следовательно, запрещен к применению во время беременности [13, 41].
Вторая по значимости проблема паразитозов животных – арахноэнтомозы, которые сами по себе вызывают заболевания, а также ряд паразитиформных клещей и членистоногих насекомых, являющихся векторами передачи трансмиссивных заболеваний, вызываемых вирусами, бактериями, грибами, риккетсиозами или протозоонозами. К препаратам действие которых направлено исключительно на арахноэнтомозы, относятся в том числе и фипронил, и S-метопрен [14–16, 42].
Проблема протозоозов сохраняет свою актуальность, что обусловлено их широким распространением как в мире, так и Российской Федерации, а также степенью значимости вызываемой ими патологии. Протозойные инфекции – это паразитарные инфекции, возбудителями являются одноклеточные микроорганизмы, относящиеся к классу простейших. В борьбе с возбудителями кишечных протозойных инфекций в ветеринарной медицине чаще всего используется два действующего вещества метронидазол и толтразурил ввиду их высокой эффективности [13, 43].
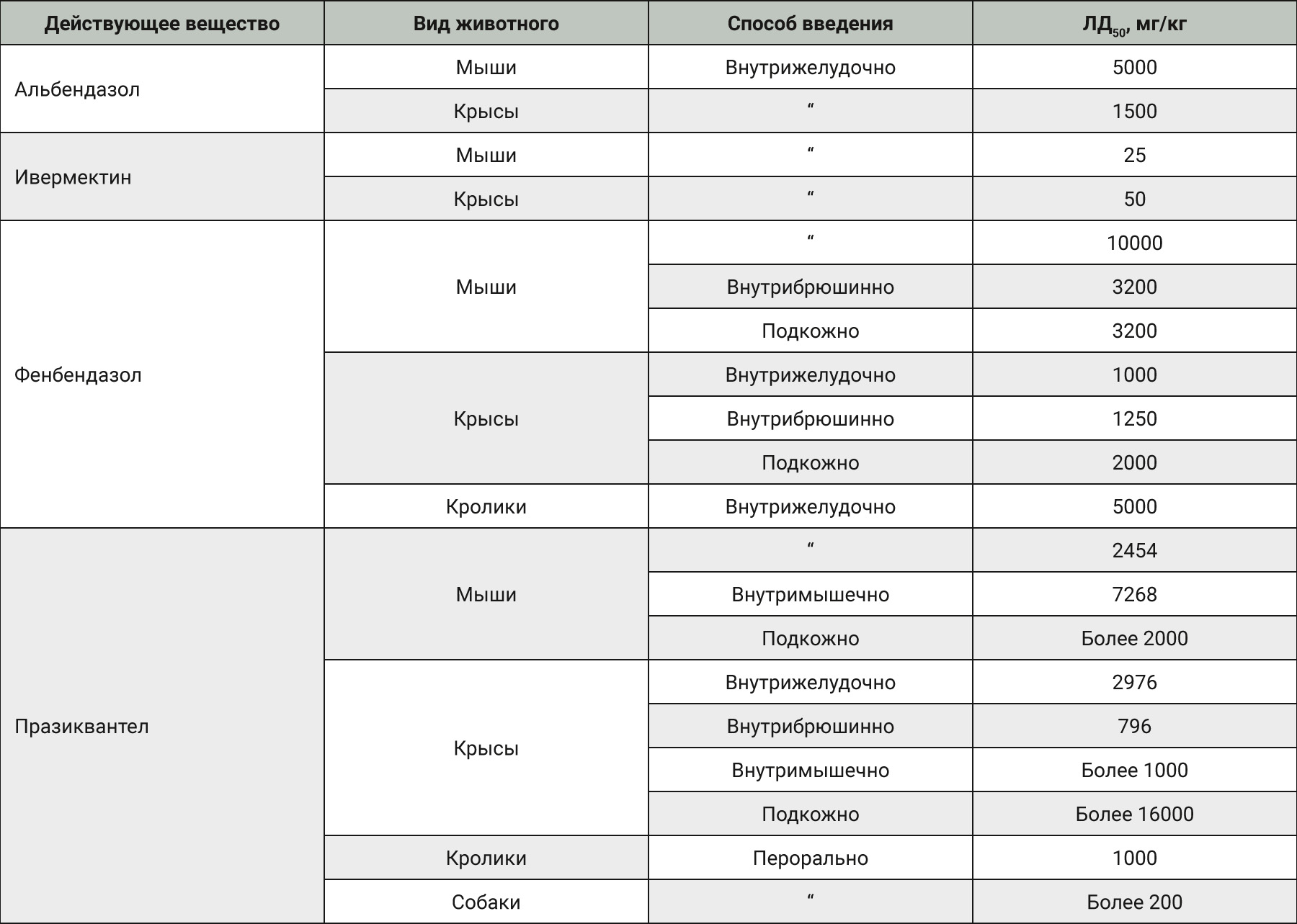
Сдерживающими факторами при выборе препаратов превентивного ряда для борьбы с паразитозами является их токсичность для макроорганизма. J.F. Rossignol (1983), установил, что летальная доза (ЛД50) альбендазола для мышей составляет 5000 мг/кг, для крыс – 1500 мг/кг. Изучением фармако-токсикологических свойств ивермектина занимались ученые компании MSD – C.R. Lankas и L.R. Gordon (1989). В это же период H. Frohberg изучал токсичность празиквантела у белых крыс. Результаты по установлению ЛД50 для разных видов лабораторных животных представлены в табл. 2.
Рекомендации к проведению лечебно-профилактических мероприятий
При разработке комплекса лечебно-профилактических мероприятий особое внимание стоит уделить литературному обоснованию применения того или иного химиопрепарата. На данном этапе можно определить ряд сдерживающих факторов, влияющих на использование лекарственных препаратов, например неприемлемость из-за недопустимых объемов введения, сомнительной или низкой эффективности, длительного влияния на организм лабораторного животного ввиду линейных/породных или видовых особенностей и длительности периода выведения.
Вводя в схему профилактики и/или лечения новый препарат, в клинической и сельскохозяйственной ветеринарии принято первоначально опробовать препарат на небольшой группе животных обоих полов с целью установления его переносимости. Для подготовки животных к доклиническим исследованиям этого недостаточно.
Руководствуясь принципами надлежащей лабораторной практики, можно рекомендовать перед введением в комплекс лечебно-профилактических мероприятий, проводимых в питомниках лабораторных животных, осуществлять собственные исследования, включающие определение не только эффективности, острой и субхронической токсичности, но и элементы репродуктивной токсичности с периодом отсроченного наблюдения.
Рациональное использование противопаразитарных средств в доклинической практике во многом основывается на знании фармакокинетических параметров, что помогает избежать влияния препарата при проведении терапии на эксперимент.
Остатки лекарственных средств в крови, органах лабораторных животных могут повлиять на обеспечение достоверности результатов исследований. Фармакокинетика варьирует в зависимости от пути введения, состава, вида животных, состояния тела, возраста и физиологического статуса, данные показатели вносят свой вклад в фармакодинамические различия одного и того же лекарственного средства.
Рассматривая ивермектин, следует учитывать, что он слабо метаболизируется, большая часть дозы эвакуируется в неизмененном виде в составе желчи с фекалиями у всех видов независимо от пути введения, а экскреция с фекалиями составляет 90% поступившей дозы, при этом менее 2% дозы экскретируется с мочой (La Оnt и соавт., 2002). Ивермектин также выводится с молоком у молочных коров, овец и коз; этот способ связан с его высокой липофильностью. После внутривенного вливания период полувыведения из плазмы у жвачных животных оказывается больше, чем у животных с однокамерным желудком [29–33, 44, 46].
Бензимидазольные противоглистные средства (альбендазол, фенбендазол) оказывают широкий спектр действия и в настоящее время используются у многих видов животных против самых разных паразитов-гельминтов. Как правило, фармацевтические препараты, абсорбируемые в организме, превращаются в метаболиты и выводятся с мочой и калом. Альбендазол и фенбендазол превращаются в сульфоксидную форму и, наконец, метаболизируются в сульфоны. Таким образом, сульфоксидирование считается основным путем метаболизма бензимидазольных средств.
После приема внутрь празиквантел практически полностью абсорбируется из желудочно-кишечного тракта. Максимальные концентрации в сыворотке достигаются через 30 мин – 1 ч. У крыс наблюдается всасывание препарата уже из желудка. Неметаболизированный празиквантел показывает очень низкие максимальные концентрации в сыворотке из-за интенсивного эффекта первого прохождения через печень. Почки являются основным путем выведения празиквантела. Определение связывания с белками показало, что 4/5 празиквантела обратимо связывается с белками сыворотки.
Комбинированные препараты, как правило, обладают более длительным периодом полувыведения по сравнению со своими моноаналогами, так, например, комбинация празиквантела и ивермектина удлиняет фармакокинетику более чем в 10 раз. У комплексного химиопрепарата, в состав которого входит фипронил, метопрен, эприномектин, празиквантел, период полувыведения увеличивается до 284 ч. Применение препаратов с длительным периодом выведения нежелательно, и, несмотря на инновационную форму и эффективность, такие средства не станут препаратами выбора в доклинических центрах, занимающихся разведением лабораторных кошек и собак.
Фармакокинетические особенности ряда химиопрепаратов, применяемых для профилактики паразитозов, изучены. Структурированные данные по фармакокинетике в зависимости от вида лабораторного животного, дозы, пути введения представлены в табл. 3.
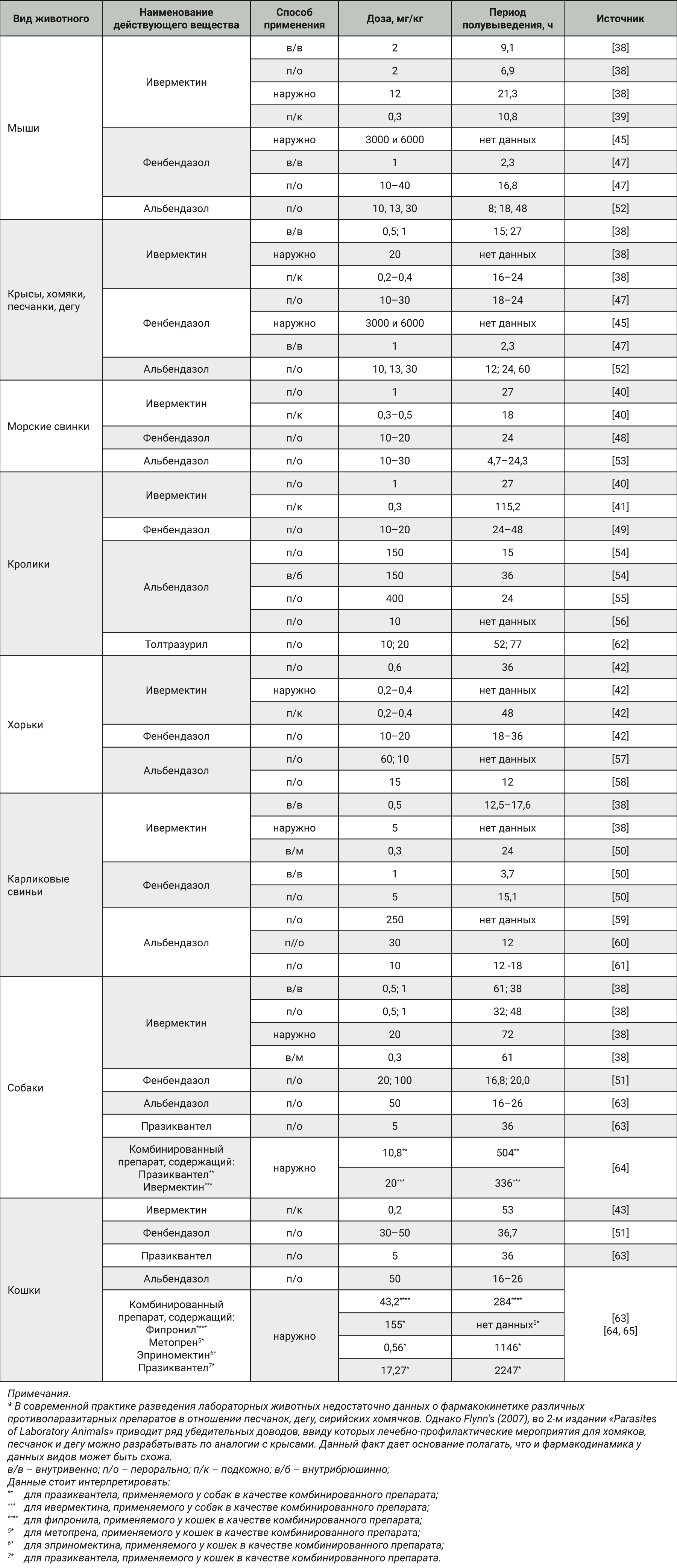
Как видно из табл. 3, можно предложить несколько схем. Для мышей, крыс, песчанок, дегу, сирийских хомячков морских свинок, хорьков, карликовых свиней препаратами выбора будут фенбендазол/альбендазол, содержащие ивермектин. Для кроликов важно включать в классическую противопаразитарную схему и противоэймериозные препараты, например толтразурил. Для собак и кошек также рекомендуем монопрепараты, так как комбинированные имеют длительный период полувыведения, что недопустимо в процессе подготовки животных к исследованию.
Так, если в качестве акарицидного и противонематодного средства использовать у собак ивермектин внутримышечно и спустя 61 ч перорально ввести альбендазол, то суммарный период полувыведения составит 79 ч, тогда как для микст-препарата празиквантел + ивермектин это время составит более 500 ч, что более чем в 6 раз превысит период при последовательном применении монопрепаратов [38, 51, 63, 64].
Аналогичная ситуация и у кошек. Для комбинированного химиопрепарата, в состав которого входят фипронил + фетопрен + эприномектин + празиквантел период полувыведения составляет более 283 ч, тогда как применение ивермектина и альбендазола для монотерапии обеспечит их более быстрое выведение [43, 51, 63–65].
Обеспечение долгосрочной защиты животных-компаньонов – основная цель фармакологических компаний, занимающихся разработкой и изготовлением противопаразитарных средств для домашних животных. Следовательно, чем дольше препарат находится в тканях животного, тем это безопаснее для животного и окружающей среды. В этом и есть существенное различие оказания помощи в клинической ветеринарной практике от превентивных мероприятий, используемых для лабораторных животных.
Эффективность лечебно-профилактических мероприятий при паразитозах зависит не только от препарата выбора, но во многом и от вспомогательных мероприятий, таких как ранняя диагностика, проведение дезинвазии помещений и др.
Взаимосвязь мониторинга здоровья животных, окружающей среды и лечебно-профилактических мероприятий
Для недопущения вспышек энзоотий следует тщательно подходить к вопросу не только разработки и проведения превентивных мероприятий, но и уделять внимание схемам контроля, мониторинга и обеспечения биологической безопасности от патогенных агентов при работе с лабораторными животными.
Оценив имеющиеся виды лабораторных животных и их возможных паразитов, разрабатываются лечебно-профилактические мероприятия (ЛПМ) После разработки ЛПМ приступают к их проведению вначале на небольшой группе животных. Ветеринарный врач оценивает состояние животных и при удовлетворительном результате назначает ЛПМ на весь цикл содержания. Ветеринарный врач контролирует проведение ЛПМ и осуществляет ежедневный клинический осмотр лабораторных животных, во время которого наблюдает за их состоянием. При необходимости назначает проведение гематологических, копрологических, патоморфологических и иных исследований [32–34]. Рекомендуемая схема контроля эффективности и планирования ЛПМ представлена на рисунке.
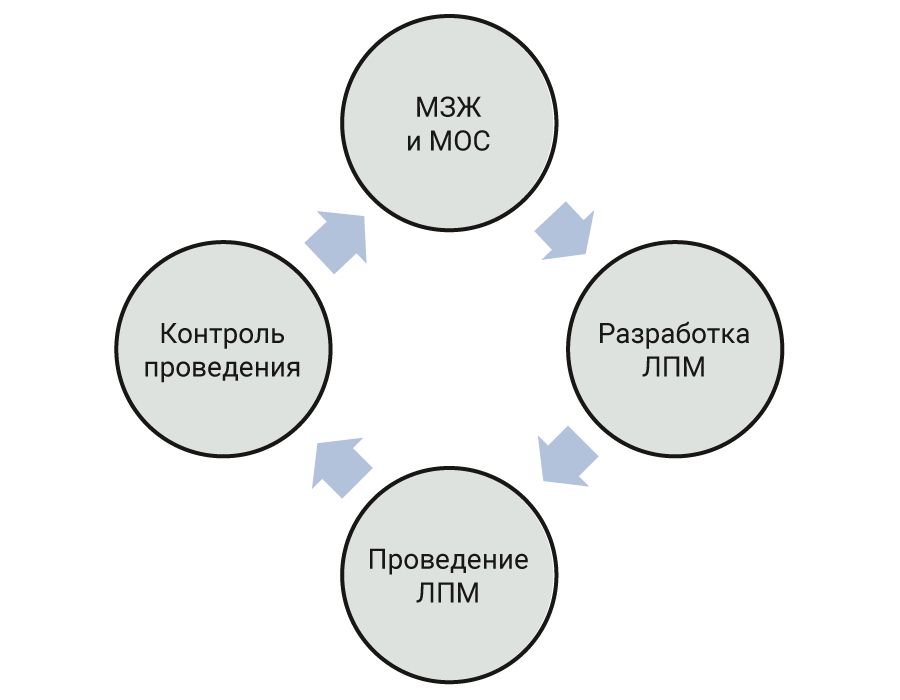
МЗЖ – мониторинг здоровья животных, МОС – мониторинг окружающей среды
С целью контроля эффективности ЛПМ проводится мониторинг здоровья животных, во время которого лабораторных животных исследуют на наличие патогенных агентов бактериальной, паразитарной и иной этиологии. Важно контролировать наличие патогенов не только внутри организма, но и вне его, а, следовательно, следует проводить мониторинг окружающей среды, которая включает мероприятия по контролю качества дезинфекции помещений, инвентаря, клеток и боксов содержания лабораторных животных. По результатам мониторинга здоровья животных и окружающей среды ЛПМ должны быть пересмотрены.
Заключение
Превентивные лечебно-профилактические мероприятия в питомниках/вивариях доклинических центров остаются актуальной проблемой. Успехи в борьбе с паразитическими заболеваниями и их профилактика у лабораторных животных могут быть достигнуты только комплексным путем. В лечебно-профилактические мероприятия входят внедрение высокоэффективных и научно обоснованных лекарственных средств, использование барьерных систем, карантинизация вновь поступивших животных, выделение на обслуживание карантинных животных отдельных сотрудников, которые только после переодевания могут быть допущены к другим животным, тщательная дезинфекция и дезинвазия помещений при условии постоянного мониторинга как здоровья животных, так и окружающей среды.
Важным фактором является индикация и идентификация патогенного агента, так как в зависимости от приуроченности паразита к тому или иному классу могут меняться как схема лечения и доза, так и лечебно-профилактические мероприятия на территории всей организации.
При плановой апробации или замене противопаразитарных препаратов стоит уделять внимание не только обзору литературы по интересующему вопросу, но и исследованию самого препарата. Полезно получить собственные данные по субхронической и репродуктивной токсичности с периодом отсроченного наблюдения.
При разработке лечебно-профилактических мероприятий и передаче животных в эксперимент важно учитывать период полувыведения химиопрепаратов, используемых для профилактики паразитозов на территории предприятия. Следует иметь в виду, чем короче период выведения, тем быстрее можно передать животных в исследование.
Вклад авторов:
Д.Ю. Акимов – идея, концепция, сбор и систематизация материала, написание, редактирование текста статьи.
А.Р. Зиятдинова – концепция, сбор и систематизация материала, написание, редактирование текста статьи.
Е.А. Снижко – сбор и систематизация материала.
М.А. Ильинская – сбор данных и редактирование текста стать.
А.В. Васильев – редактирование текста статьи.
Список источников
- Webster J., Animal Welfare: Freedoms, Dominions and "A Life Worth Living" // Animals (Basel). – 2016. – V.6(6). - №35. Р. 42-50. DOI: 10.3390/ani6060035
- Макаров В.Г., Макарова М.Н. Новое в науке и практике доклинических исследований. Сообщение 2. Лабораторные животные для научных исследований. 2020; 3. https://doi.org/10.29296/2618723X-2020-03-01 [Makarova M., Makarov V. New in the science and practice of preclinical research. Report 2. Laboratory Animals for Science. 2020; 03: с 3–6. https://doi.org/10/29926/2618723X-2020-03-01. (In Russ.)]
- Le Bailly M., Araújo A., Past Intestinal Parasites // Microbiol Spectr. - 2016 – V. 4(4). P. 226-230/ DOI: 10.1128/microbiolspec.PoH-0013-2015.
- Архипов, И. А. Антигельминтики: фармакология и применение/ И.А. Архипов.- М., - 2009. - 406 с. [Arkhipov, I. A. Antigel'mintiki: farmakologiya i primenenie/ I.A. Arkhipov.- M., - 2009. - 406 s. (In Russ.)].
- Шемяков С.А., Шемяков Д.Н. Паразитарные болезни лабораторных грызунов- URL.: –https://veterinarka.ru/vetconf/parazitarnye-bolezni-laboratornyh-gryzunov.html (дата обращения:07.2020). [Shemyakov S.A., Shemyakov D.N. Parazitarnye bolezni laboratornykh gryzunov- URL.: –https://veterinarka.ru/vetconf/parazitarnye-bolezni-laboratornyh-gryzunov.html (data obrashcheniya:07.2020) (In Russ.)].
- World Health Organization. Sustaining the Drive to Overcome the Global Impact of Neglected Diseases: Second WHO Report on Neglected Diseases.Geneva, Switzerland: World Health Organization; 2013.
- Nolan T.J, Hawdon J.M., Longhofer S.L. // Vet. Parasitol. - 1992. - V. 41. – P. 121-125. DOI: 10.1016 / 0304-4017 (92) 90015-2
- Baker D.G. Flynn's Parasites of Laboratory Animals, Second Edition // Blackwell Publishing. - 2007. рр. 813. DOI: 10.1002 / 9780470344552
- Бекиров Р.Э. Новые антгельминтики против цестодозов плотоядных // Гельминтозы и паразитарные болезни с.-х. животных в Узбекистане. – 1984. - С. 13-16 [Bekirov R.E. Novye antgel'mintiki protiv tsestodozov plotoyadnykh // Gel'mintozy i parazitarnye bolezni s.-kh. zhivotnykh v Uzbekistane. – 1984. - S. 13-16. (In Russ.)].
- Harms C.A. Treatments for parasitic diseases of aquarium and ornamental fish. Semin // Avian Exotic Pet Med. – 1996. – V. 5(2). – Р. 54-63. DOI: 10.1111/j.1749-7345.2010.00425
- Huerkamp M.J., Ivermectin eradication of inw worms from rats kept in ventilated cages // Lab. Anim. - 1993. – V. 43. – Р. 86-90.
- Kim Y.A., Yoon Y.S., Kim H.S., Jeon S.J., Cole E., Lee J., Cho Y. H. Distribution of fipronil in humans, and adverse health outcomes of in utero fipronil sulfone exposure in newborns // International journal of hygiene and environmental health. – 2019. — V. 222(3). – Р. 524-532.
- Daugschies A, Imarom S, Ganter M, Bollwahn W. Prevalence of Eimeria spp. in sows at piglet-producing farms in Germany // J Vet Med B Infect Dis Vet Public Health. – 2004. — V. 51(3). – Р. 135-139. DOI: 10.1111/j.1439-0450.2004.00734.x
- Wijayaratne L.K.W., Arthur F.H., Whyard S. Methoprene and control of stored-product insects // Journal of Stored Products Research. – 2018. — V. 76. – Р. 161-169.
- Самойловская Н.А. Условия применения солевых брикетов с ивермектином диким животным при паразитозах // Ветеринария. – 2019. № 6. С. 34-37. DOI:10.30896/0042-4846.2019.22.6.34-37 [Samoilovskaya N.A. Usloviya primeneniya solevykh briketov s ivermektinom dikim zhivotnym pri parazitozakh // Veterinariya. – 2019. № 6. S. 34-37. DOI:10.30896/0042-4846.2019.22.6.34-37 (In Russ.)]
- Kraft M.Ya.; Kochergin P.M.; Tsyganova A.M.; Shlikhunova V.S. Synthesis of metronidazole from ethylenediamine // Pharmaceutical Chemistry Journal. — 1989. — V. 23, № 10. DOI:10.1007 / bf00764821
- Haberkorn A., Friis C.W., Schulz H.P. Control of an outbreak of mouse coccidiosis in a closed colony // Lab. Anim. – 1983. — V. 17. – Р. 59-64. DOI:10.1258 / 002367783781070803
- Mundt H.C., Daugschies A. Current experience with Isospora suis infections. In: Bayer HealthCare Animal Health // 18th Congress of the International Veterinary Society, “The appropriate management of preweaning diarrhoea, a crucial point in maintaining pig health”. – 2004. – Р. 1–14.
- Peeters J.E., Geeroms R. Efficacy of toltrazuril against intestinal and hepatic coccidiosis in rabbits // Vet. Parasitol. – 1986. – V. 22. – Р. 388-394. DOI: 10.1016/0304-4017(89)90111-8
- Findon G., Miller T.E. Treatment of Trichosomoides crassicauda in laboratory rats using ivermectin // Lab. Anim. Sci. – 1997. – V. 37(4). – Р. 496-499. DOI:10.1.1.394.495
- Summa M.E.L., Ebisui L., Osaka J.T., de Tolosa E.M.C. Efficacy of oral ivermectin against Trichosomoides crassicauda in naturally infected laboratory rats // Lab. Anim. Sci. – 1992. - V. 42. - Р. 620-622.
- McKellar, Q.A. Clinical relevance of the pharmacological properties of fluoroquinolones. Suppl. Compend. Contin. Educ. Pract. Vet.18(2):14-21,1996
- Coghh, L.G., Lee D.R., Psencik B., Weiss D. Practical and effective eradication of pinworms (Syphacia muris) in rats by use of fenbendazole // Lab. Anim. – 1993. - V. 43. – Р. 481-487. DOI: 10.5958 / 2277-940X.2015.00055.8
- McKellar Q.A. Drug dosages for small mammals // In Practice. – 1989. – Р. 57-61. DOI: 10.1258/002367792780745706
- Васильевич Ф.И., Малахова Н.А. Поиск эффективных средств и способов лечения оксиуратозов лабораторных животных // Вестник Орловского государственного аграрного университета. - 2011. - Т. 28. - С. 34-35. [Vasil'evich F.I., Malakhova N.A. Poisk effektivnykh sredstv i sposobov lecheniya oksiuratozov laboratornykh zhivotnykh // Vestnik Orlovskogo gosudarstvennogo agrarnogo universiteta. - 2011. - T. 28. - S. 34-35. (In Russ.)]
- Haberkorn A., Friis C.W., Schulz H.P. Control of an outbreak of mouse coccidiosis in a closed colony // Lab. Anim. -1983. - V. 17. - Р. 59-64. DOI: 10.1258/002367783781070803
- Battles A.N., Adams S.W., Courtney C.H.. Efficacy of ivermectin against natural infection of Syphacia muris in rats // Lab.Anim. - 1987. – V. 37(6). - Р. 791-792. DOI: 10.1177/0023677214562850
- Климова Е.С., Бабинцева Т.В. Паразитофауна лабораторных грызунов // Ученые записки Казанской государственной академии ветеринарной медицины им. Н.Э. Баумана. - 2019. - Т. 240. № 4. - С. 105-108 [Klimova E.S., Babintseva T.V. Parazitofauna laboratornykh gryzunov // Uchenye zapiski Kazanskoi gosudarstvennoi akademii veterinarnoi meditsiny im. N.E. Baumana. - 2019. - T. 240. № 4. - S. 105-108 (In Russ.)]
- Priotti J., Baglioni M. V., García A., Rico M. J., Leonardi D., Lamas M. C., Márquez M. M. Repositioning of anti-parasitic drugs in cyclodextrin inclusion complexes for treatment of triple-negative breast cancer // AAPS PharmSciTech. - 2018. – V. 19(8), – Р. 3734-3741
- Макарова М.Н., Ильинская М.А. Зоотехнические особенности воспроизводства мышей линии BALB/C. Лабораторные животные для научных исследований. 2020; 1: 29–41. https://doi.org/10.29296/2618723X-2020-01-04 [Makarova M., Ilyinskaya M. Facilities of the Breeding Performance of BALB/с mice. Laboratory Animals for Science. 2020; 1: 29–41. https://doi.org/10.29296/2618723X-2020-01-04(In Russ.)]
- Jimoh M.A., Idris O.A., Jimoh M.O. Cytotoxicity, phytochemical, antiparasitic screening, and antioxidant activities of Mucuna pruriens (Fabaceae) // Plants. – 2020. – V. 9. – Р. 1249.
- Juarez M., Schcolnik-Cabrera A., Dueñas-Gonzalez A. The multitargeted drug ivermectin: from an antiparasitic agent to a repositioned cancer drug // American journal of cancer research. – 2018. – V. 8. – №. 2. – Р. 317.
- Krieg R., Jortzik E., Goetz A.A., Blandin S., Wittlin S., Elhabiri M. Arylmethylamino steroids as antiparasitic agents // Nature communications. . – 2017. – V. 8(1). – Р. 1-12.
- Авдеева О.И., Макарова М.Н., Кательникова А.Е., Симановская М.С. Оценка токсического действия некоторых носителей, используемых в доклинических исследованиях // Международный вестник ветеринарии. - 2016. - № 4. - С. 90-96. [Avdeeva O.I., Makarova M.N., Katel'nikova A.E., Simanovskaya M.S. Otsenka toksicheskogo deistviya nekotorykh nositelei, ispol'zuemykh v doklinicheskikh issledovaniyakh // Mezhdunarodnyi vestnik veterinarii. - 2016. - № 4. - Р. 90-96. (In Russ.)]
- Крышень К.Л., Кательникова А.Е., Росина Е.В., Акулова Е.Г., Макарова/ М.Н., Лютов А.Г., Макаров В.Г. Экспериментальная оценка эффективности препарата габриглобин-igm (обогащенный иммуноглобулинами класса m) на модели ЛПС-индуцированного септического шока у мышей // Биофармацевтический журнал. - 2016. - Т. 8. - С. 44-49. [Kryshen' K.L., Katel'nikova A.E., Rosina E.V., Akulova E.G., Makarova/ M.N., Lyutov A.G., Makarov V.G. Eksperimental'naya otsenka effektivnosti preparata gabriglobin-igm (obogashchennyi immunoglobulinami klassa m) na modeli LPS-indutsirovannogo septicheskogo shoka u myshei // Biofarmatsevticheskii zhurnal. - 2016. - V. 8. - Р. 44-49. (In Russ.)]
-
Ковалева М.А., Гущин Я.А., Макарова М.Н., Макаров В.Г. Сравнительное
исследование использования высококалорийных диет, обогащенных разным количеством липидов, для моделирования метаболического синдрома. Лабораторные животные для научных исследований. 2019; 1. DOI. 10/29926/2618723X-2019-01-04 [Kovaleva M., Gushchin Ya., Makarova М., Makarov V. A comparative study of the use of highcalorie diets enriched by different number of lipids for modeling metabolic syndrome. Laboratory Animals for Science. 2019; 1. https://doi.org/10.29296/2618723X-2019-01-04 (In Russ.)] - Бондарева Е.Д., Макарова М.Н., Ковалева М.А., Ходько С.В., Макаров В.Г. Нормативно-правовое регулирование деятельности питомников и экспериментально-биологических клиник (вивариев). Лабораторные животные для научных исследований. 2018; 4. https://DOI.org/10.29926/2618723X-2018-04-08 [Bondareva E., Makarova M., Kovaleva M., Khodko S., Makarov V. Regulatory framework experimental biological clinics (vivaries) and nursery for laboratory animals. Laboratory Animals for Science. 2018; 4. https://doi.org/10.29296/2618723X-2018-04-08. (In Russ.)]
-
Campbell W. History of avermectin and ivermectin, with notes on the history of other macrocyclic lactone antiparasitic agents // Current pharmaceutical biotechnology. – 2012. – V. 13. – Р. 853-865. DOI: 10.2174 / 138920112800399095
- Khan Sharun T.S., Aneesha V.A., Dhama K., Pawde A.M., Pal A. Current therapeutic applications and pharmacokinetic modulations of ivermectin // Veterinary world. – 2019. – V. 12. – №. 8. – Р. 1204. DOI: 10.14202 / vetworld.2019.1204-1211
- McKellar Q. A. Clinical and pharmacological properties of ivermectin in rabbits and guinea pigs // The Veterinary Record. – 1992. – V. 130. – №. 4. – Р. 71-73. DOI: 10.1136 / vr.130.4.71
- Gokbulut C. Plasma dispositions of ivermectin, doramectin and moxidectin following subcutaneous administration in rabbits // Laboratory animals. – 2010. – V. 44. – Р. 138-142. DOI: 10.1258 / la.2009.009053
- Williams B. H. Therapeutics in ferrets // Veterinary Clinics of North America: Exotic Animal Practice. – 2000. – V. 3. – №. 1. – Р. 131-153. DOI: 10.1016 / s1094-9194 (17) 30098-1
- Сhittrakarn S., Janchawee B., Ruangrut P., Kansenalak S., Chethanond U., Kobasa T., Thammapalo S. Pharmacokinetics of ivermectin in cats receiving a single subcutaneous dose // Research in veterinary science. – 2009. – V. 86. – №. 3. – Р. 503-507. DOI: 10.1016 / j.rvsc.2008.08.005
- Tennant B. BSAVA small animal formulary. – British Small Animal Veterinary Association, - 2005. – V. 5. – Р. 28-36.
-
Варламова А.И. Острая и накожная токсичность комплексного препарата "ВИГИСОКС" // Теория и практика борьбы с паразитарными болезнями. -- 2012. - № 13. - С. 89. [Ivanyuk V.P. Sovremennye preparaty dlya bor'by s assotsiirovannymi gel'mintozami svinei // Vestnik Bryanskoi gosudarstvennoi sel'skokhozyaistvennoi akademii. – 2017. – №. 3 (61). – Р. 30-34 (In Russ.)]
- Bazelle M.J., Bedford M.P., Bell M.A., Bower M.J., Chandler M.E., Corkhill M.R., Elliott M.R. British Small Animal Veterinary Association Annual General Meeting // Journal of Small Animal Practice. – 2016. – V. 57. – Р. 60-64. DOI: 10.1111 / jsap.2_12431
- Villar D., Cray C., Zaias J., Altman N.H. Biologic effects of fenbendazole in rats and mice: a review // Journal of the American Association for Laboratory Animal Science. – 2007. – V. 46. – №. 6. – P. 8-15.
- d’Ovidio D., Noviello E., Ianniello D., Cringoli G., Rinaldi L. Survey of endoparasites in pet guinea pigs in Italy // Parasitology research. – 2015. – V. 114. – №. 3. – P. 1213-1216. DOI: 10.1007 / s00436-014-4289-7
- Short C.R., Barker S.A., Hsieh L.C., McDowell T. Disposition of fenbendazole in the rabbit // Research in veterinary science. – 1988. – V. 44(2), - Р. 215-219. DOI: 10.1016/S0034-5288(18)30842-7
- Petersen M. B., Friis C. Pharmacokinetics of fenbendazole following intravenous and oral administration to pigs // American journal of veterinary research. – 2000. – V. 61. – №. 5. – Р. 573-576. DOI.org/10.2460/ajvr.2000.61.573
- McKellar Q.A., Harrison P., Galbraith E.A., Inglis, H. Pharmacokinetics of fenbendazole in dogs // Journal of veterinary pharmacology and therapeutics. – 1990. – V. 13. – №. 4. – Р. 386-392. DOI: 10.1111/j.1365-2885.1990.tb00793.x
- Abulaihaiti M., Wu X.W., Qiao L., Lv H.L., Zhang H.W., Aduwayi N.. Efficacy of albendazole-chitosan microsphere-based treatment for alveolar echinococcosis in mice //PLoS Negl Trop Dis. – 2015. – V. 9. – №. 9. – Р. 44-62. e0003950. DOI:10.1371/journal.pntd.0003950
- Dziekońska-Rynko J., Rokicki J., Jabłonowski Z. Effects of ivermectin and albendazole against Anisakis simplex in vitro and in guinea pigs // Journal of Parasitology. – 2002. – V. 88. – №. 2. – Р. 395-398. DOI: 10.1645 / 0022-3395 (2002) 088 [0395: EOIAAA] 2.0.CO; 2
- Cai Z.Y., Galettis P., Lu Y., Morris D.L., Pourgholami M.H Pharmacokinetics of albendazole in New Zealand white rabbits: oral versus intraperitoneal administration // Anticancer research. – 2007. – V. 27. – №. 1A. – Р. 417-422.
- Barwari W.O., Al-Mukhtar A.M. Effectiveness of albendazole against viability of entamoeba histolytica in mice and rabbits // Annals of the College of Medicine Mosul. – 2008. – V. 34. – №. 1. – Р. 64-68 DOI 10.33899 / ммед.2008.8947
- Capece B.S., Virkel G.L., Lanusse C.E. Enantiomeric behaviour of albendazole and fenbendazole sulfoxides in domestic animals: pharmacological implications // The Veterinary Journal. – 2009. – V. 181. – №. 3. – Р. 241-250.
- Eberhard, M.L., Brandt, F.H., Ruiz-Tiben, E., Hightower A. Chemoprophylactic drug trials for treatment of dracunculiasis using the Dracunculus insignis-ferret model // Journal of helminthology. – 1990. – V. 64. – №. 2. – Р. 79-86 DOI: 10.1017 / s0022149x00011962
- Hamidu, B.B., Tettevi, E.J., Larbi, J.A., The efficacy of albendazole and levamisole drug combination in individuals with reduced efficacy for single‐dose albendazole treatment against hookworm infections // American Journal of Tropical Medicine and Hygiene. – 2014. – Р. 152. DOI: 10.1023 / a: 1014214122167
- Ayoade G.O., Adejinmi J.O., Abiola J.O., Lucas F. Efficacy of some anthelmintics used in porcine practice in Ibadan, Nigeria // African Journal of Biomedical Research. – 2003. – V. 6. – №. 2. – Р. 109-110. DOI: 10.4314 / ajbr.v6i2.54035
- Štukelj M., Valenčak Z., Rataj A.V Posedi Effective treatment of giardiosis in pigs ey ale endazole // Slov Vet Res. – 2011. – V. 48 (2). – Р. 51-56.
- Иванюк В.П. Современные препараты для борьбы с ассоциированными гельминтозами свиней // Вестник Брянской государственной сельскохозяйственной академии. – 2017. – №. 3 (61). – С. 30-34 [Ivanyuk V.P. Sovremennye preparaty dlya bor'by s assotsiirovannymi gel'mintozami svinei // Vestnik Bryanskoi gosudarstvennoi sel'skokhozyaistvennoi akademii. – 2017. – №. 3 (61). – Р. 30-34 (In Russ.)]]
- Kim M.S., Lim J.H., Hwang Y.H., Park B.K., Song I.B., Yun H.I. Plasma disposition of toltrazuril and its metabolites, toltrazuril sulfoxide and toltrazuril sulfone, in rabbits after oral administration // Veterinary parasitology. – 2010. – V. 169. – №. 1-2. – Р. 51-56. DOI: 10.1016 / j.vetpar.2009.12.011
- Дьяченко Ю.В. Стратегия выбора антигельминтиков для проведения дегельминтизации служебных собак // Диагностика, лечение и профилактика заболеваний сельскохозяйственных животных. – 2007. – С. 18-21. [D'yachenko, Yu.V. Strategiya vybora antigel'mintikov dlya provedeniya degel'mintizatsii sluzhebnykh sobak // Diagnostika, lechenie i profilaktika zabolevanii sel'skokhozyaistvennykh zhivotnykh. – 2007. – Р. 18-21. (In Russ.)]
- Arisov M.V., Indyuhova E.N., Arisova G.B. Pharmacokinetics of combination antiparasitic drug preparation for dogs and cats in the form of spot-on solution // Journal of Advanced Veterinary and Animal Research. – 2019. – V. 6. – №. 1. – P. 25. doi.org/10.5455/javar.2019.f308
- Kvaternick V., Kellermann M., Knaus M., Rehbein S., Rosentel J. Pharmacokinetics and metabolism of eprinomectin in cats when administered in a novel topical combination of fipronil,(S)-methoprene, eprinomectin and praziquantel // Veterinary Parasitology. – 2014. – V. 202. – №. 1-2. – Р. 2-9. DOI: 10.1016/j.vetpar.2014.02.031




