Эндотрахеальный способ введения лекарственных средств лабораторным животным
Трофимец Е.И., Макарова М.Н., Кательникова А.Е., Крышень К.Л. Эндотрахеальный способ введения лекарственных средств лабораторным животным . Лабораторные животные для научных исследований. 2020; 2. https://doi.org/10.29296/2618723X-2020-02-08
Резюме
Практически любой эксперимент по доклиническому исследованию лекарственных средств не обходится без введения исследуемых объектов лабораторным животным. Выбор способа введения зависит прежде всего от планируемого метода применения лекарственного средства в клинической практике и в свою очередь является важным и необходимым этапом для дальнейшей оценки влияния исследуемых объектов на органы-мишени и организм в целом. В связи с разработкой новых лекарственных препаратов и лекарственных форм с целевой доставкой к органам и системам организма все больший интерес вызывают и соответствующие способы введения. Одним из таких способов является эндотрахеальное введение, представляющее собой аналог ингаляционного способа введения препаратов в клинической практике. Доставка лекарственных веществ непосредственно в легкие позволяет быстро достичь необходимых терапевтических концентраций препарата в органе-мишени, снизить его системное воздействие и выраженность побочных эффектов, позволяет избежать эффекта «первого прохождения через печень» и разрушения препарата в желудочно-кишечном тракте.
В лабораторной практике данный метод введения интересен не только с точки зрения исследования фармакологической активности и безопасности лекарственных средств, но и возможности применения такого способа для индукции патологий дыхательной системы. В статье представлен обзор по эндотрахеальному способу введения лабораторным животным, а также рассматриваются выбор наиболее подходящих препаратов для анестезиологического обеспечения, процедура введения с техникой выполнения, контроль качества манипуляции, устройства для проведения, выбор носителя и объемы введения, а также межвидовые различия физиологических параметров дыхательной системы (объем легких, длина и диаметр трахеи), которые необходимо учитывать при планировании эксперимента с данным типом введения. При разработке протокола исследования на лабораторных животных с эндотрахеальным способом введения необходимо учитывать два важных фактора, которые влияют на качество выполнения манипуляции, это объем введения и использование анестезии при проведении процедуры. От них будет зависеть распределение действующего вещества в легочной ткани, развитие нежелательных эффектов в виде потери дозирования и травматизации. Мы не обнаружили в доступной литературе сведений о рекомендованных и максимально допустимых объемах для эндотрахеального введения разным видам животных. В результате анализа данных литературы и собственного исследования предложены рекомендованные и максимальные объемы при эндотрахеальном введении для различных видов лабораторных животных.
Введение
Практически любой эксперимент по доклиническому исследованию лекарственных средств не обходится без введения исследуемых объектов лабораторным животным. Выбор метода введения зависит прежде всего от планируемого способа применения лекарственного средства в клинической практике и в свою очередь является важным и необходимым этапом для дальнейшей оценки влияния исследуемых объектов на органы-мишени и организм в целом.
В связи с разработкой новых лекарственных препаратов и лекарственных форм с целевой доставкой к органам и системам организма все больший интерес вызывают целевые способы введения. Одним из таких способов является эндотрахеальное введение, представляющее собой аналог ингаляционного метода введения препаратов в клинической практике [1].
Создание новых аэрозольных форм биологически активных веществ является одной из современных тенденций развития фармацевтики. В настоящее время аэрозольная терапия широко используется для лечения различных бронхолегочных заболеваний среди взрослых и детей [2]. Доставка лекарственных веществ непосредственно в легкие позволяет быстро достичь необходимых терапевтических концентраций препарата в органе-мишени, снизить его системное воздействие и выраженность побочных действий, помогает избежать эффекта «первого прохождения через печень» и разрушения препарата в желудочно-кишечном тракте.
Первое сообщение об эндотрахеальном введении лабораторным животным было опубликовано в 1923 г. [3], в котором T. Kimura описал введение каменноугольной смолы кроликам и морским свинкам с помощью различных неингаляционных способов (в том числе и эндотрахеального) в попытке индукции опухолевого процесса. Позднее, упоминания об эндотрахеальном введении встречаются в работах С.G. Henry (1981), W. Ho, A. Furst (1973), R.E. Kouri (1976, 1980) и P. Nettesheim, A.S. Hammons (1971) на мышах. Эндотрахеальное введение крысам применяли в своих исследованиях W.H. Blair (1974), J.D. Brain (1976), R.F. Henderson (1979). Сообщения об использовании данного способа введения хомякам отмечены в работах J.D. Brain (1976), A.R. Kennedy, J.B. Little (1975), U. Saffiotti (1968). Процедура введения для всех перечисленных видов лабораторных животных схожа. Главное отличие заключается в объеме поставляемого тестируемого объекта.
В лабораторной практике данный способ введения интересен не только с точки зрения исследования фармакологической активности и безопасности лекарственных средств, но и возможности применения данного метода для индукции патологии дыхательной системы, например моделирования инфекций дыхательных путей [4, 5] или морфологических патологических процессов (легочного фиброза) [6].
На сегодняшний день, ориентируясь на гуманные принципы обращения с животными, используются такие понятия, как рекомендованный и максимальный объем для введения препаратов животным [7–10]. Рекомендованный объем для однократного введения — это объем вводимого лекарственного средства, который не вызывает у животного дискомфорт, болевые ощущения и не влияет на его поведение. Максимальный объем вводимого лекарственного средства для однократного введения — это объем, являющийся физиологически возможным, но способный вызвать кратковременный дискомфорт у животного и потребовать дополнительной подготовки перед проведением манипуляции (депривация кормом, анестезия и др.). Информационная доступность и использование сведений о рекомендованных и максимальных объемах для введения лекарственных средств позволит более рационально подходить к вопросу разработки плана исследования, сводя к минимуму страдания животного.
Мы не обнаружили в доступной литературе сведений о рекомендованных и максимально допустимых объемах для эндотрахеального введения разным видам животных.
Данная статья является обзором по эндотрахеальному способу введения в практике доклинических исследований, в котором рассматриваются выбор наиболее подходящих препаратов для анестезиологического обеспечения, процедура введения с техникой выполнения, контроль качества манипуляции, выбор носителя и объемы введения.
Анестезиологическое обеспечение
Практически во всех анализированных источниках литературы эндотрахеальное введение проводится с применением общей анестезии.
Выбор адекватного анестезиологического сопровождения может гарантировать успешное введение исследуемых объектов. В отношении лабораторных грызунов применимы ингаляционные анестетики короткого действия. Их преимущество: подавление рефлексов на минимальный период времени и быстрое восстановление животного. В качестве таких ингаляционных анестетиков чаще всего применяют галотан, метафан, энфлуран и изофлуран. Барбитураты могут использоваться в отдельных случаях (например, у собак), но их применение иногда приводит к подавлению активности центральной нервной системы.
Диэтиловый эфир может применяться у морских свинок, так как данный вид лабораторных животных обладает видовой предрасположенностью к остановке сердечной деятельности вследствие использования галогеновых анестетиков. Эфир практически не угнетает гемодинамику и функцию паренхиматозных органов, дает выраженный анальгезирующий эффект и хорошую мышечную релаксацию. Однако препарат имеет и ряд недостатков: раздражающее действие на слизистые оболочки с последующим усилением секретообразования, длительный период возбуждения и посленаркозного пробуждения [11].
В лабораторных исследованиях на крысах зачастую отдают предпочтение золетил-ксилазиновому наркозу, обладающему рядом преимуществ: необходимая глубина и длительность анестезии, широкий терапевтический диапазон, нет необходимости в применении специального оборудования, удобный путь введения, минимальное влияние на течение экспериментальной патологии [12].
Процедура введения
Эндотрахеальное введение не является рутинной манипуляцией и требует от исполнителя определенных навыков и сноровки. Необходимо учитывать, что на качество выполнения данной манипуляции существенно влияют такие факторы, как методика интубации, специфический транспорт каждого конкретного исследуемого объекта, объем введения, доза вводимого исследуемого объекта, метод анестезии. Однако, несмотря на все это, самым основным, оказывающим решающее действие на успешность процедуры моментом является квалификация специалиста, проводящего ее.
Исследуемые объекты мелким лабораторным грызунам вводят эндотрахеально при помощи катетеров или специального эндотрахеального зонда, как правило, имеющего шариковый наконечник для предупреждения травматизации. Применение специальных эндотрахеальных зондов дает возможность более точно дозировать исследуемые вещества и вводить их в количестве, не приводящем к механической обструкции дыхательных путей.
В табл. 1 представлен обзор эндотрахеальных зондов для лабораторных животных (фирма Penn-Century Inc., СШA).
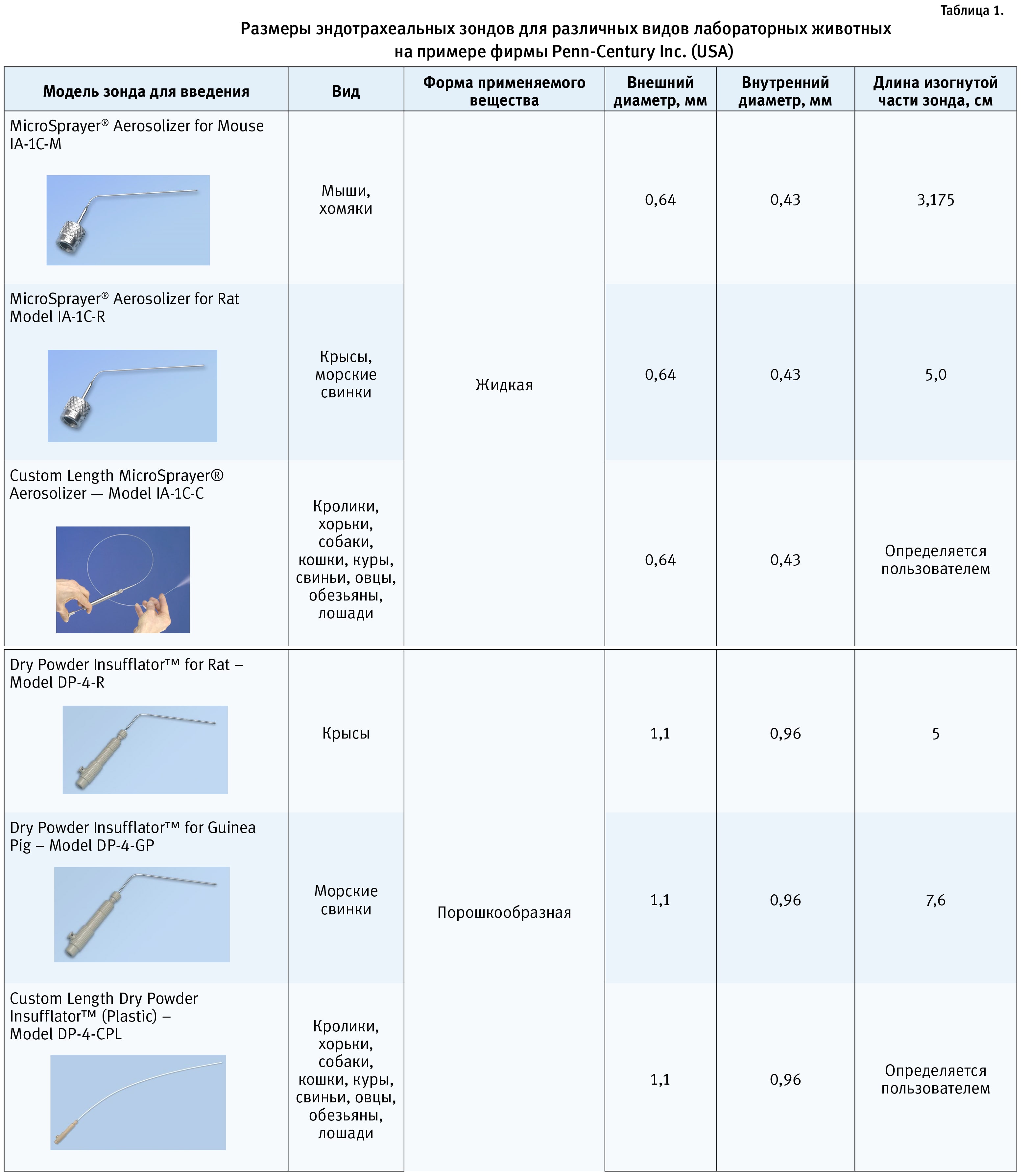
Также для проведения эндотрахеального введения могут применяться атравматические зонды для внутрижелудочного введения с параметрами, аналогичными эндотрахеальным зондам, представленным в табл. 1.
Самое главное условие успешного выполнения манипуляции заключается в том, чтобы при введении инструмента (катетер, зонд) не травмировать окружающие ткани. Правильное выполнение эндотрахеального введения представлено на рис. 1.
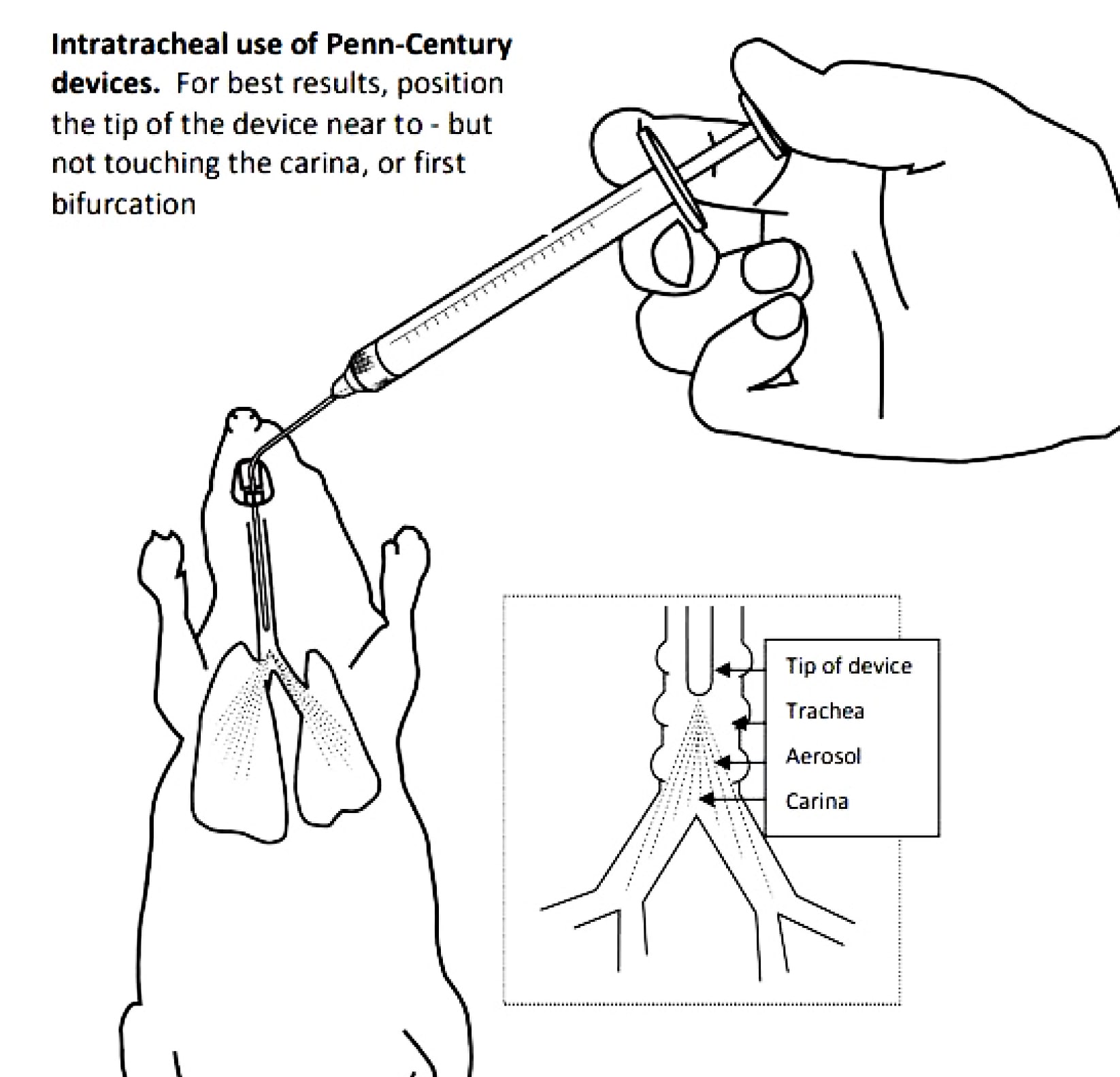
Как видно на рис. 1 при введении зонд не касается стенок трахеи и не упирается в ее бифуркацию. При таком расположении зонда происходит равномерное распределение исследуемого объекта.
У крупных видов лабораторных животных исследуемые объекты можно вводить непосредственно в долю легкого, однако данный способ весьма травматичен. Иной подход к доставке исследуемого объекта в легочную ткань — создание доступа посредством хирургического вмешательства. Во время выполнения данной методики часть трахеи хирургически выводится на вентральную сторону шеи и при помощи установки катетера через стенку трахеи создается доступ в ее просвет. Данный метод также не пользуется популярностью в силу высокой вероятности травматизации, хотя и позволяет получить постоянный доступ в просвет трахеи.
Самым простым и наименее инвазивным методом для доставки исследуемых объектов в легочную ткань мелких лабораторных животных является введение эндотрахеального зонда через ротоглотку. Эндотрахеальное введение, как правило, проводится под общей анестезией, однако при достаточном опыте процедуру можно выполнять без наркотизации животного. В таком случае необходимо использовать местные анестетики для предупреждения причинения животному болевых ощущений.
После наркотизации животное фиксируют в положении на спине, эндотрахеальный зонд вводят в ротовую полость (рис. 2), располагая между голосовыми связками. Через небольшое надавливание на надгортанный хрящ проводят инструмент в просвет трахеи до уровня ее бифуркации и осуществляют распыление исследуемого объекта. При введении крысам и морским свинкам для контроля попадания можно ориентироваться на тактильные ощущения зонда в проекции трахеи. Другой способ правильного расположения инструмента в респираторном, а не в желудочно-кишечном тракте — аккуратное введение воздуха шприцем в эндотрахеальный зонд. Если инструмент находится в респираторном тракте, наблюдают подъем грудной клетки, подтверждающий наполнение воздухом легких.
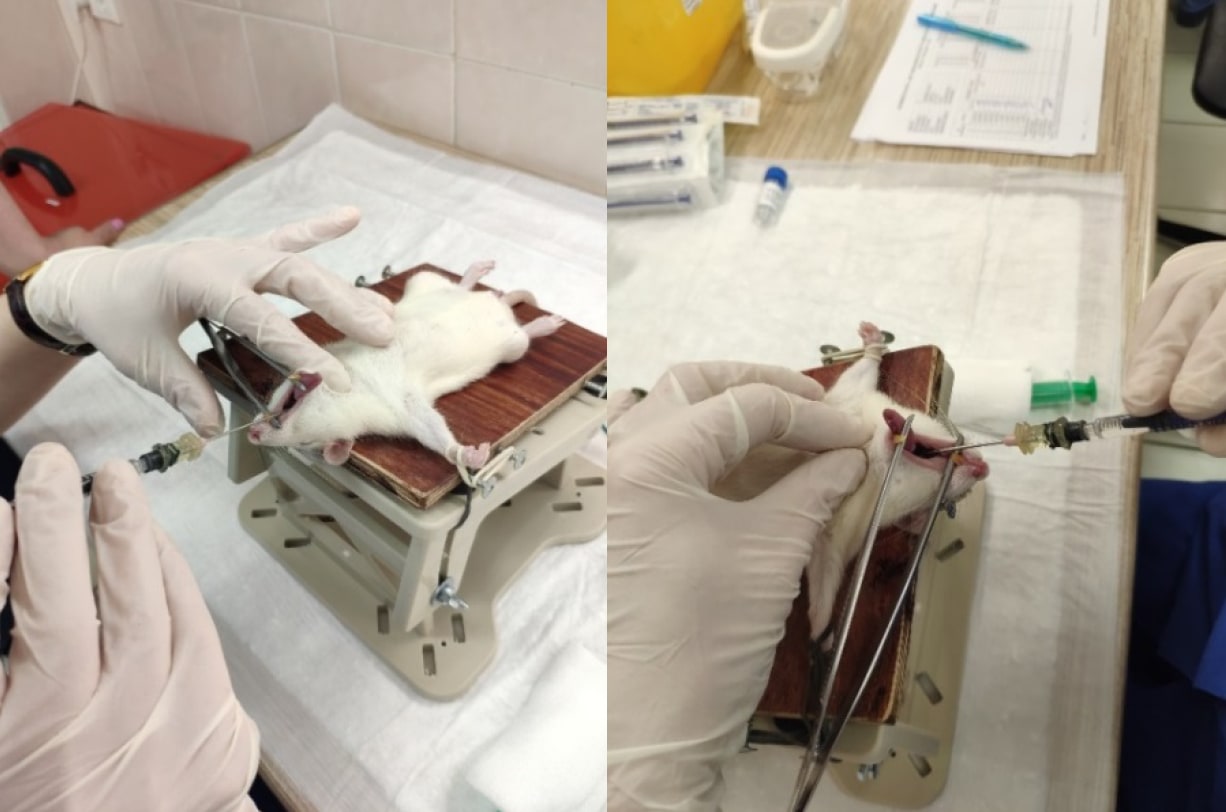
При введении мышам и хомякам необходима визуальная фиксация попадания, для чего животное обязательно наркотизируют, фиксируют на специальном столике, мощным направленным источником света подсвечивают кожу шеи в проекции гортани.
Для лучшей визуализации надгортанника у различных видов лабораторных животных с успехом применяют волокнисто-оптический ларингоскоп (рис. 3-4).
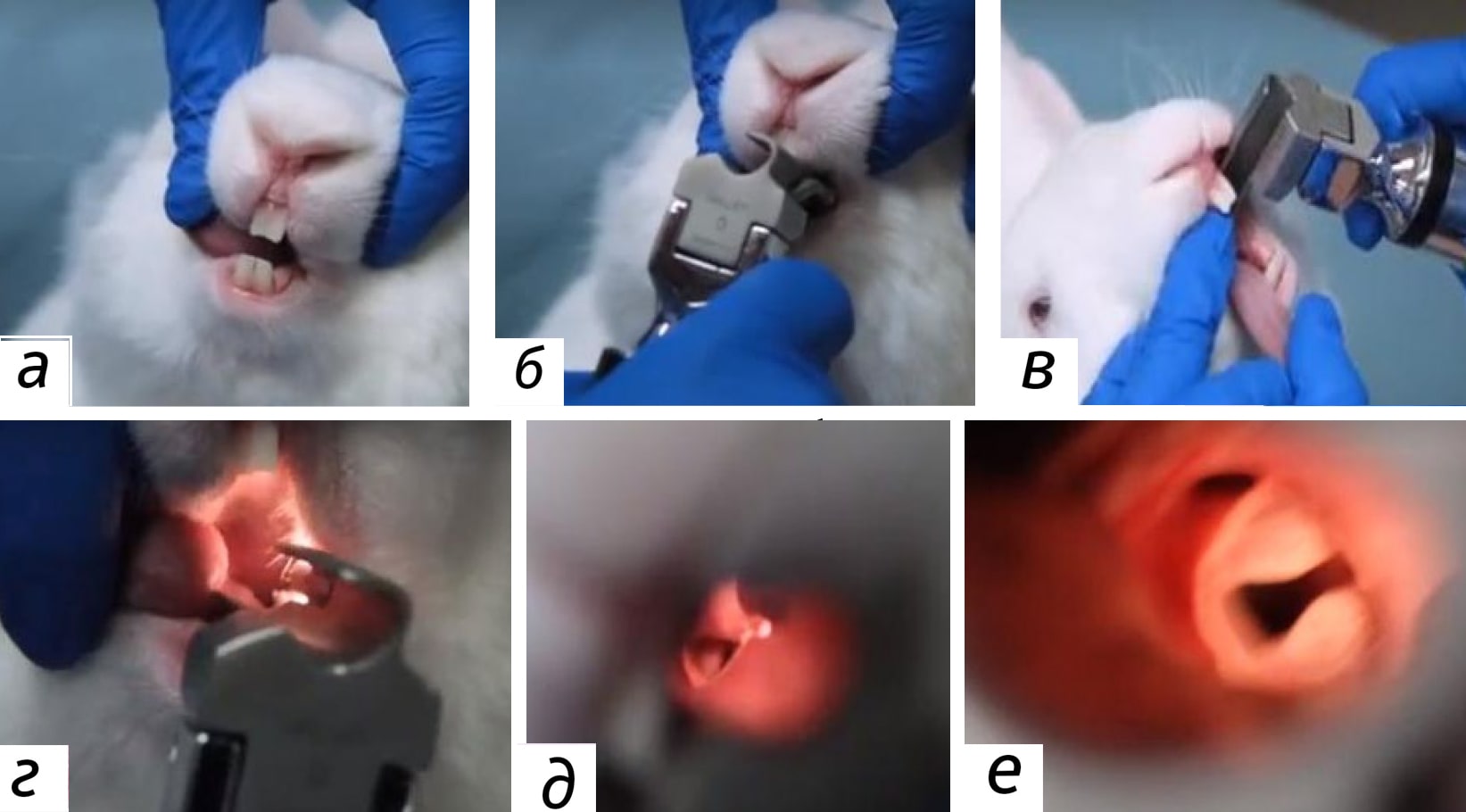

У хомяков благодаря их широким защечным мешкам ротовая полость может быть достаточно широко открыта для прямой визуализации надгортанника. В связи с данной физиологической особенностью зачастую именно хомяки являются предпочтительным видом лабораторных животных для проведения эндотрахеального введения. Также эту процедуру значительно облегчает использование роторасширителей для удержания ротовой полости в открытом состоянии [13].
Проведение контроля качества введения
В ряде исследований были подняты вопросы, касающиеся качества эндотрахеального введения. При правильном выполнении процедуры удается достичь равномерного распределения вводимого вещества и необходимого количества его доставки по долям легких [14]. Однако качество доставки вводимого вещества напрямую зависит от опыта человека, выполняющего процедуру, и требует соответствующей подготовки. Даже при должном обучении следует понимать, что результаты могут варьировать в разных учреждениях, что затрудняет их сравнение между лабораториями [13].
В настоящее время отслеживают эффективность введения, проверяя распределение исследуемого вещества в легочной ткани. Тушь или флюоресцентные латексные шарики являются хорошими маркерами для визуального исследования распределения некоторых типов частиц. После введения легкие наполняются воздухом, их извлекают из тела животного с последующим замораживанием и лиофилизацией. Затем изучают распределение введенного вещества. Также применяют гомогенизирование долей легких и экстрагирование для количественного определения флюоресценции или окраски. Обнаружение вводимого вещества в легочной ткани дает достаточное доказательство того, что процедура введения выполнена корректно, но данный анализ проводят после процедуры и это оставляет вопрос контроля качества в ходе эксперимента открытым.
При выполнении эндотрахеального введения существует вероятность того, что часть вещества может быть выведена при откашливании у тех видов животных, которые обладают кашлевым рефлексом. Особенно часто это происходит при интенсивном восстановлении после анестезии или при введении слишком большого объема исследуемого вещества.
В двух исследованиях проводили изучение удержания частиц в легочной ткани после введения. В одном исследовании у мышей сохранялось 70% введенного радиомеченого альбумина в легких через 2 ч после процедуры, в то время как голова и туловище (в основном желудок) содержали оставшиеся 30% [15]; в другом использовались меченые углеродные частицы (суспендированные в 0,1% твине-80), в легких крыс, мышей и морских свинок сохранялось более 90% вводимой дозы сразу же после манипуляции, тогда как у хомяков сохранялось около 83% [14].
Выбор носителя
Очень важным условием для проведения качественной доставки исследуемого объекта является выбор носителя. Учитывая физико-химические свойства изучаемых веществ, может потребоваться применение специфического носителя. Несмотря на то, что физиологический раствор — это наиболее часто применяемый носитель, его попадание в легкие может вызвать нежелательные реакции, например, развитие воспалительного процесса. Поверхностно-активные вещества (например, твин-80) иногда добавляются в физиологический раствор для удержания взвешенных частиц от агломерации и осаждения. Некоторые поверхностно-активные вещества могут разрушать поверхностное натяжение, обеспечиваемое сурфактантом и сами по себе вызывать неблагоприятное воздействие [13].
Объемы введения
Объем введения вещества является важным фактором, влияющим на оценку его токсического действия на легкие. Исследуемые вещества распределяются менее равномерно при использовании небольших объемов, чем больших, но в то же время введение избытка жидкости в легкие нежелательно. Выбор объема введения может напрямую зависеть от цели эксперимента [13].
В табл. 2 представлены данные литературы и результаты собственного исследования по изучению объема легких, диаметра и длины трахеи у различных видов лабораторных животных, наиболее часто применяемых для эндотрахеального введения.
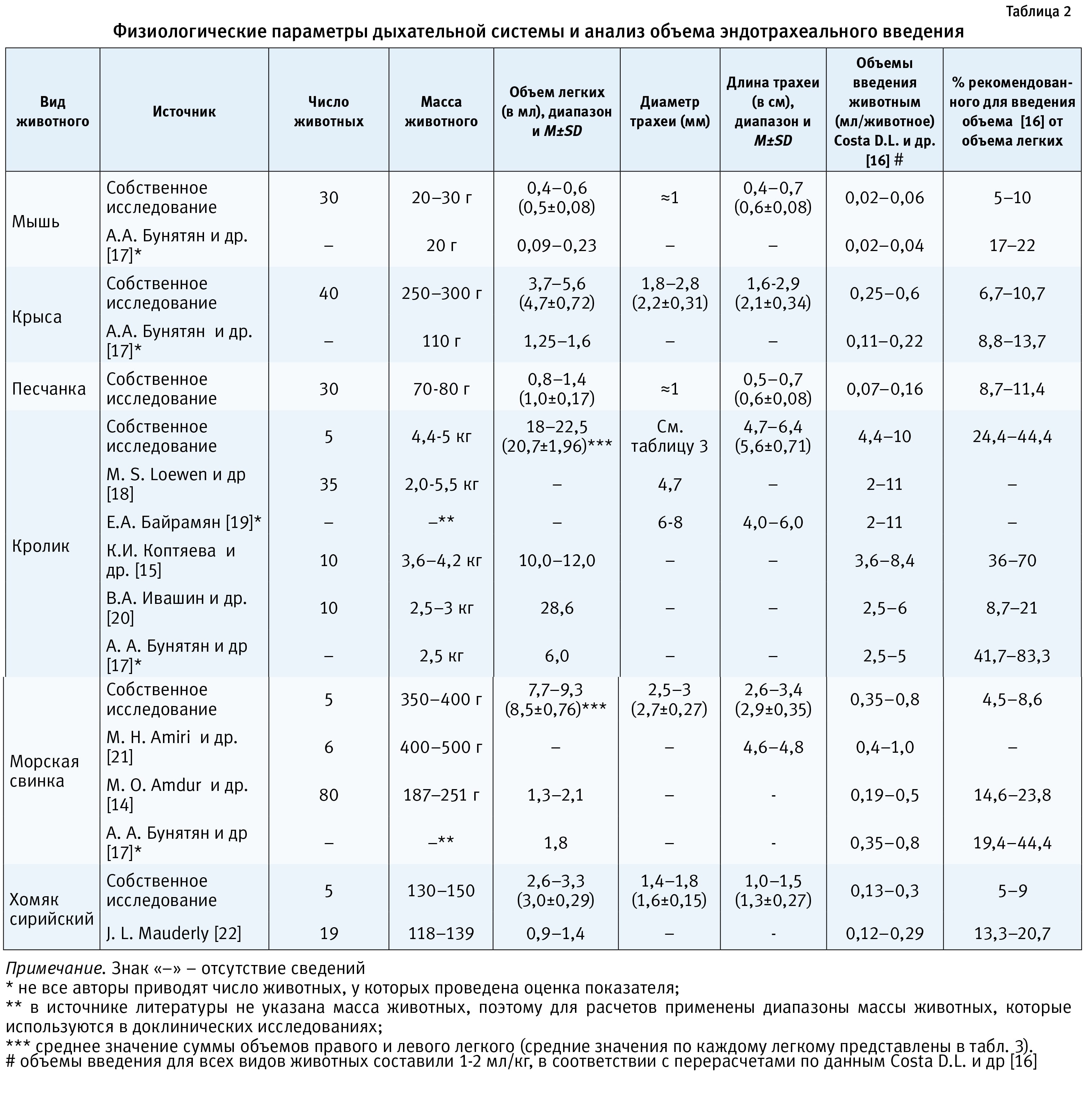
В собственном исследовании данные показатели были изучены у мышей, крыс, песчанок, хомяков (сирийских), морских свинок и кроликов. Животные были подобраны примерно одинаковой массы тела, не отклоняющейся от среднего более чем на 20%. У животных, подвергнутых эвтаназии, извлекали легкие с трахеей и оценивали объем легких онкометрическим методом. У крупных видов (кролики, морские свинки) измеряли объемы отдельно правого и левого легкого.
Диаметр трахеи измеряли с помощью линейки. Стоит отметить, что у мелких видов лабораторных животных (мыши, песчанки) измерить точный диаметр трахеи не представилось возможным ввиду слишком малых размеров (≈1 мм).
Как видно из табл. 2, объем легких, диаметр и длина трахеи отличаются между видами. Установлено, что показатели зависели от массы тела, делая ее корректным фактором при выборе объема введения.
Как видно из представленных в табл. 2 данных, при попытке сопоставить объемы введения исходя из объема легких, наблюдается очень выраженный разброс показателей, причем наиболее выраженный в отношении кроликов (от 8,7 до 83,3%). Мы предположили, что это может быть связано с некоторыми анатомическими особенностями кроликов, и провели патолого-анатомическое исследование, которое показало (см. табл. 3), что объемы правого и левого легкого у кроликов имеют существенные различия.

При измерении диаметра трахеи у кроликов обнаружили различия в размерах на различных участках трахеи. На рис. 5 представлены участки трахеи кролика, на которых обнаружена разница в диаметре.
Перечисленные анатомические особенности могли привести к таким существенным отличиям при определении объемов введения этому виду животных.
Далее мы предприняли попытку выразить рекомендованные величины в миллилитрах на 1 кг массы тела. Обращаем внимание, что при таком пересчете для всех животных, кроме кроликов, объемы для введения составили 1-2 мл/кг массы тела, т.е. около 5-10% от объема легких животных. Вероятно, эту величину (% объема введения от объема легких) можно принять за оптимальный (рекомендованный) объем для эндотрахеального введения, в том числе и для кроликов, поскольку введение более 10% от объема легких может стать фатальным, или привести к потере точности дозирования. В этом случае для кроликов объем введения (5-10% от объема легких) составит 0,2-0,4 мл/кг.
На основании анализа опубликованных и собственных данных можно предложить оптимальные объемы вводимых препаратов при проведении доклинических исследований. В табл. 4 представлены рекомендованные и максимальные объемы введения лекарственных средств при эндотрахеальном пути введения лабораторным животным, которые можно использовать как соответствующие принципам «3Rs».

По мнению авторов, введения больших объемов (больше 2 мл/кг) следует избегать, так как существует вероятность развития кашлевого рефлекса у животных, обладающих данным физиологическим защитным механизмом, и механической обструкции вследствие избытка вводимых объектов [13].
Заключение
Эндотрахеальное введение является высокотехнологичным и современным способом доставки исследуемых объектов в легочную ткань. Основным преимуществом данного способа введения является способность доставлять точно дозированное количество исследуемого объекта. При правильной технике выполнения исследуемые объекты равномерно распределяются в легких. Однако существует ряд вопросов, которые необходимо учитывать и четко прорабатывать при выборе эндотрахеального введения для оценки легочной токсичности.
Такими вопросами являются рациональность способа введения, подбор необходимого носителя, объем вводимого материала, доза и выбор анестезирующего средства. Чаще всего эндотрахеальное введение проводят с применением анестетиков короткого действия, вводя эндотрахеальный зонд через ротовую полость. Носителем зачастую является физиологический раствор. Основным критерием выбора объема для эндотрахеального введения должен быть вид лабораторных животных с учетом анатомических отличий объемов легких, как правило, не зависящих от массы тела. Процедура эндотрахеального введения не рутинная, она требует определенных технических навыков и опыта, которые должны подтверждаться соответствующей подготовкой персонала и проверкой качества выполнения процедуры.
По результатам обработки данных литературы и собственного исследования предложены рекомендованные и максимальные объемы эндотрахеального введения.
Вклад авторов
Е.И. Трофимец – сбор данных литературных источников, сбор и анализ данных, написание и редактирование текста статьи
М.Н. Макарова – концепция и дизайн исследования, редактирование текста статьи, научное консультирование и утверждение окончательного варианта статьи для публикации
А.Е. Кательникова – научное консультирование
К.Л. Крышень – научное консультирование
Благодарности. Работа выполнена при финансовой поддержке НПО «ДОМ ФАРМАЦИИ». Авторы выражают благодарность Гущину А.Я. за проведение патоморфологического исследования.
Сведения о конфликте интересов
Авторы заявляют об отсутствии конфликта интересов.
Список источников
- Kobayashi N. et al. Biological response and morphological assessment of individually dispersed multi-wall carbon nanotubes in the lung after intratracheal instillation in rats //Toxicology. – 2010. – Т. 276. – №. 3. – P. 143-153. DOI: 10.1016/j.tox.2010.07.021
- Локшина Э.Э., Зайцева О.В., Зайцева С.В. Ингаляционная терапия респираторных заболеваний у детей //Практическая пульмонология. – 2012. – №. 4 – C. 41-45 [Lokshina E. E., Zaitseva O. V., Zaitseva S. V. Ingalyatsionnaya terapiya respiratornykh zabolevanii u detei //Prakticheskaya pul'monologiya. – 2012. – №. 4 - P. 41-45 (In Russ.)].
- Kimura T. Artificial production of a cancer in the lungs following intrabronchial insufflation of coal-tar // Gann. – 1923. – Т. 7. – P. 15-21.
- Moazed T. C. et al. Experimental rabbit models of Chlamydia pneumoniae infection // The American journal of pathology. – 1996. – Т. 148. – №. 2. – P. 667.
- Azoulay-Dupuis E. et al. Comparative activity of fluorinated quinolones in acute and subacute Streptococcus pneumoniae pneumonia models: efficacy of temafloxacin // Journal of Antimicrobial Chemotherapy. – 1991. – Т. 28. – №. suppl_C. – P. 45-53. DOI: 10.1093/jac/28.suppl_c.45
- Robbe A. et al. Intratracheal bleomycin aerosolization: the best route of administration for a scalable and homogeneous pulmonary fibrosis rat model? // BioMed research international. – 2015. – Т. 2015. – P. 1-10. DOI: 10.1155/2015/198418
- Hau J, Schapiro SJ. Handbook of laboratory animal science. 3rd ed. New York: CRC Press; 2011. 760 p.
- Suckow MA, Stevens KA, Wilson RP. The laboratory rabbit, guinea pig, hamster, and other rodents. New York: Academic Press; 2012. 1288 p.
- Кибл Э, Мередит А, ред. Грызуны и хорьки. Болезни и лечение. М.: Аквариум-Принт; 2013. 392 c. [Kibl E, Meredit A, red. Gryzuny i khor'ki. Bolezni i lechenie. M.: Akvarium-Print; 2013. 392 p. (In Russ.)]
- Turner PV, Brabb T, Pekow C. Administration of substances to laboratory animals: routes of administration and factors to consider //Journal of the American Association for Laboratory Animal Science. – 2011. – Т. 50. – №. 5. – P. 600-613.
- Фокин Ю. В., Сахаров Д. С. Сравнительная характеристика и возможность использования наркотизирующих препаратов Золетил 100 и диэтиловый эфир при проведении операций по вживлению ЭЭГ-электродов на крысах //Биомедицина. – 2011. – №. 1. – C. 84-89 [Fokin Yu. V., Sakharov D. S. Sravnitel'naya kharakteristika i vozmozhnost' ispol'zovaniya narkotiziruyushchikh preparatov Zoletil 100 i dietilovyi efir pri provedenii operatsii po vzhivleniyu EEG-elektrodov na krysakh //Biomeditsina. – 2011. – №. 1. – P. 84-89 (In Russ.)].
- Кадомцев Д.В., Пасечникова Е.А., Голубев В.Г. Золетил-ксилазиновый наркоз в экспериментах у крыс //Международный журнал прикладных и фундаментальных исследований. – 2015. – №. 5-1. – С. 56-57 [Kadomtsev D. V., Pasechnikova E. A., Golubev V. G. Zoletil-ksilazinovyi narkoz v eksperimentakh u krys //Mezhdunarodnyi zhurnal prikladnykh i fundamental'nykh issledovanii. – 2015. – №. 5-1. – P. 56-57 (In Russ.)].
- Driscoll K.E. et al. Intratracheal instillation as an exposure technique for the evaluation of respiratory tract toxicity: uses and limitations //Toxicological Sciences. – 2000. – Т. 55. – №. 1. – P. 24-35. DOI: 10.1093/toxsci/55.1.24
- Amdur M. O., Mead J. Mechanics of respiration in unanesthetized guinea pigs //American Journal of Physiology-Legacy Content. – 1958. – Т. 192. – №. 2. – P. 364-368. DOI: 10.1152/ajplegacy.1958.192.2.364
- Коптяева К.И., Мужикян А.А., Гущин Я.А., Беляева Е.В., Макарова М.Н., Макаров В.Г. Некоторые особенности фиксации органов и тканей лабораторных животных для повышения качества гистологического анализа // Лабораторные животные для научных целей. – 2018. – №2. – С. 60-70. [Koptyaeva K.I., Muzhikyan A.A., Gushchin Ya.A., Belyaeva E.V., Makarova M.N., Makarov V.G. Nekotorye osobennosti fiksatsii organov i tkanei laboratornykh zhivotnykh dlya povysheniya kachestva gistologicheskogo analiza // Laboratornye zhivotnye dlya nauchnykh tselei. – 2018. – №2. – P. 60-70. DOI: 10.29296/2618723X-2018-02-07 (In Russ.)].
- Costa D. L. et al. Transoral tracheal intubation of rodents using a fiberoptic laryngoscope //Laboratory animal science. – 1986. – Т. 36. – №. 3. – P. 256-261.
- Бунятян А. А., Мизиков В. М. Анестезиология: национальное руководство //М.: ГЭоТАр-Медиа. – 2011. – 1104 с. [Bunyatyan A. A., Mizikov V. M. Anesteziologiya: natsional'noe rukovodstvo //M.: GEoTAr-Media. – 2011. – 1104 p. (In Russ.)].
- Loewen M. S., Walner D. L. Dimensions of rabbit subglottis and trachea //Laboratory animals. – 2001. – Т. 35. – №. 3. – P. 253-256. DOI: 10.1258/0023677011911714
- Байрамян Е. А. К анатомии скелета трахеи некоторых млекопитающих и человека //Էքսպերիմենտալ և կլինիկական բժշկության հանդես. – 1969. – Т. 9. – №. 5. – С. 34-40. [Bairamyan E. A. K anatomii skeleta trakhei nekotorykh mlekopitayushchikh i cheloveka //Էքսպերիմենտալ և կլինիկական բժշկության հանդես. – 1969. – T. 9. – №. 5. – P. 34-40. (In Russ.)].
- Ивашин В.А., Кезик В.И., Соловьев В.П. Модифицированная методика оценки состояния легких у экспериментальных животных при экстремальных воздействиях //Саратовский научно-медицинский журнал. – 2017. – Т. 13. – №. 4. – С. 907-912 [Ivashin V. A., Kezik V. I., Solov'ev V. P. Modifitsirovannaya metodika otsenki sostoyaniya legkikh u eksperimental'nykh zhivotnykh pri ekstremal'nykh vozdeistviyakh //Saratovskii nauchno-meditsinskii zhurnal. – 2017. – T. 13. – №. 4. – P. 907-912 (In Russ.)].
- Amiri M. H., Gabella G. Structure of the guinea-pig trachea at rest and in contraction //Anatomy and embryology. – 1988. – Т. 178. – №. 5. – P. 389-397. DOI: 10.1007/BF00306045
- Mauderly J. L. Ventilation, lung volumes and lung mechanics of young adult and old Syrian hamsters //Experimental aging research. – 1979. – Т. 5. – №. 6. – P. 497-508. DOI: 10.1080/03610737908257224




