Разработка модели иммуносупрессии у кроликов, вызванной внутривенным введением циклофосфамида
Гайдай Д.С., Кательникова А.Е., Крышень К.Л., Гайдай Е.А., Гущин Я.А., Макарова М.Н. Разработка модели иммуносупрессии у кроликов, вызванной внутривенным введением циклофосфамида. Лабораторные животные для научных исследований. 2019; 2. https://doi.org/10.29296/2618723X-2019-02-02
Резюме
На сегодняшний день популярная модель вторичного иммунодефицита у животных – угнетение иммунитета путем введения циклофосфамида. Циклофосфамид обладает выраженным иммуносупрессивным действием с угнетением в малых дозах Т-субпопуляции лимфоцитов, в больших дозах – преимущественно В-субпопуляции лимфоцитов. Характерной реакцией у млекопитающих на введение циклофосфамида является атрофия тимуса вследствие апоптоза тимоцитов. Наиболее часто эта модель иммуносупрессии используется на грызунах, однако иногда возникает необходимость введения лекарственного препарата без разрушения готовой лекарственной формы. В этом случае следует необходимость использования более крупных животных на этой модели иммуносупрессии. Предпринята попытка разработки модели иммуносупрессии при ежедневном многократном внутривенном введении циклофосфамида самцам кроликов при введении через день. В качестве критериев эффективности модели выбраны: снижение лейкоцитов в крови животных и клеточности тимуса на 40–50%, повышение отношения площади коркового вещества к площади мозгового вещества тимуса на 30–40%, сохранение гистоархитектоники тимуса.
По результатам проведенного эксперимента установлено, что:
• введение циклофосфамида через день в дозе 40 мг/кг вызывало признаки иммуносупрессии только на 21-й день эксперимента после 10 введений; установлено снижение количества лейкоцитов (≈40%), относительно интактных животных; обнаружено статистически значимое снижение клеточности тимуса, которое достигало ≈60%, и статистически значимое повышение отношения площади коркового вещества тимуса относительно мозгового на 30% по сравнению с данными интактной группы с сохранением гистоархитектоники органа.
• ежедневное внутривенное ведение циклофосфамида вызывало снижение количества лейкоцитов у животных, получавших циклофосфамид в течение 10 дней в дозе 40 мг/кг до 44% по сравнению с интактной группой, в дозе 60 мг/кг – 66%; установлена атрофия тимуса с сохранением гистоархитектоники, проявляющаяся снижением клеточности тимуса на 40% и повышением отношения коркового вещества тимуса относительно мозгового на 40% у животных, получавших циклофосфамид в дозе 40 мг/кг, относительно интактных животных. Таким образом, для оценки эффективности лекарственных препаратов на модели вторичного иммунодефицита на кроликах могут быть использованы 2 возможные схемы: 1-я – ежедневное внутривенное введение циклофосфамида в дозе 40 мг/кг на протяжении 20 дней с оценкой показателей на 10-й и 20-й дни эксперимента, где в период с 11-го по 20-й дни исследования будет оцениваться выживаемость животных; 2-я схема – ежедневное внутривенное введение циклофосфамида в дозе 40 мг/кг на протяжении 10 дней с оценкой показателей на 10-й и 20-й дни эксперимента, где в период с 11-го по 20-й дни исследования будет оцениваться обратимость вызванных циклофосфамидом эффектов.
Введение
С конца XX века по настоящее время в странах с развитой промышленностью отмечен рост заболеваний, связанных с нарушениями иммунной системы, в частности различных аутоиммунных, аллергических, онкологических и близких к ним заболеваний [5]. Нарушение функционирования органов иммунной системы обусловлено влиянием на организм неблагоприятных факторов окружающей среды, инфекциями разного генеза, а также последствиями лечения онкологических заболеваний с помощью лучевой и химической терапии [6]. Одну из основных ролей в обеспечении адаптивных реакций организма на повреждающие факторы выполняет тимус, поскольку он участвует в формировании иммунной системы в целом и Т-системы в частности.
Для изучения препаратов, используемых при иммунодефицитных состояниях, – инфекционных гнойных и септических процессах, стойких нарушениях функции тимуса, острых и хронических вирусных и бактериальных инфекциях, нарушении регенеративных процессов, угнетении иммунитета и кроветворения после химиотерапии или лучевой терапии – широко применяют модель иммуносупрессии на крысах с введением циклофосфамида [3, 4]. Однако моделирование иммуносупрессии на грызунах не всегда позволяет получить требуемые результаты, так как нередко приходится разрушать готовую лекарственную форму для осуществления введения. Среди множества видов лабораторных животных только кроликам могут быть введены перорально или внутрижелудочно таблетки и капсулы без разрушения лекарственной формы [7]. Также без разрушения лекарственной формы препарат можно ввести и более крупным животным – карликовым свиньям, собакам и обезьянам, но использование в качестве тест-системы карликовых свиней затратно, а собак и обезьян – приводит к этическим проблемам.
По данным литературы кролики пригодны для моделирования иммуносупрессии, но только в краткосрочных экспериментах с однократным введением индуктора патологии [4, 8]. Сведений о модели иммунодефицита на кроликах при длительном введении иммунодепрессанта в открытом доступе не найдено.
На сегодняшний день популярной моделью вторичного иммунодефицита у животных является угнетение иммунитета путем введения циклофосфамида [1–4]. Циклофосфамид оказывает выраженное иммуносупрессивное действие с угнетением в малых дозах Т-субпопуляции лимфоцитов, в больших дозах –преимущественно В-субпопуляции лимфоцитов [8]. Характерная реакция на введение циклофосфамида – атрофия тимуса вследствие апоптоза тимоцитов [2].
Цель данной работы – разработка модели вторичного иммунодефицита у кроликов при многократном внутривенном введении циклофосфамида.
В качестве критериев эффективности модели выбраны: снижение лейкоцитов в крови животных и клеточности тимуса на 40–50%, повышение отношения площади коркового вещества к площади мозгового вещества тимуса на 30–40%, сохранение гистоархитектоники тимуса.
Материал и методы
Исследование проводили на 48 самцах кроликов возрастом 13–15 недель и средней массой тела 3 кг. Животные были распределены на 4 группы по 6 животных в каждой выбранной схеме введения циклофосфамида (рис. 1): 1-я группа – интактная; 2-я группа – циклофосфамид в дозе 1; 3-я группа – циклофосфамид в дозе 2; 4-я группа – циклофосфамид в дозе 3.
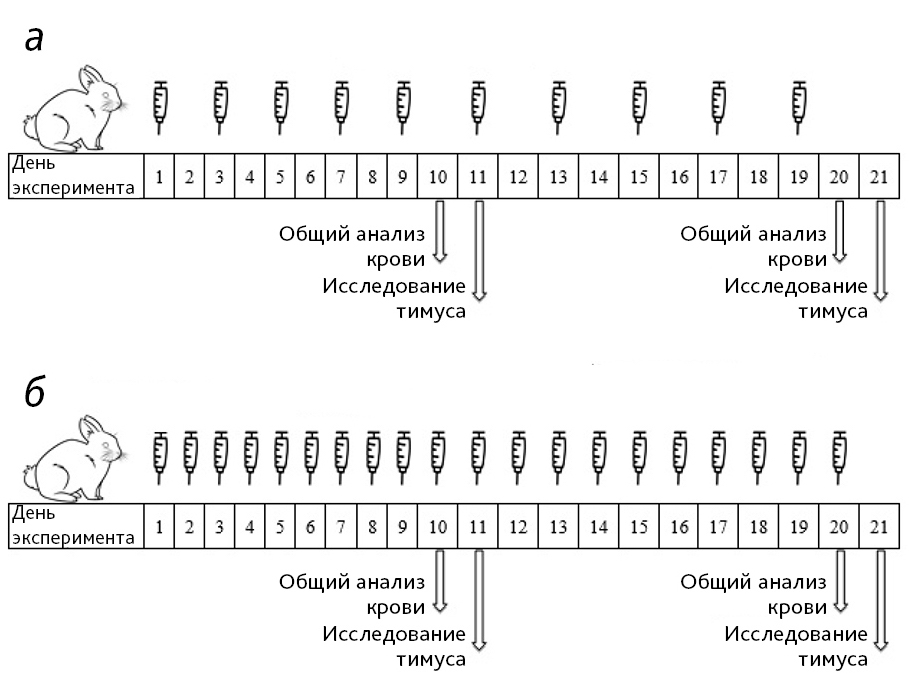
Животных содержали в стандартных условиях в соответствии с Директивой 2010/63/EU Европейского Парламента и Советом Европейского Союза от 22.09.2010 по охране животных.
В доступной литературе не обнаружено описания модели иммунодефицита на кроликах при длительном введении. Поэтому модель разрабатывали по отдельным материалам, посвященным моделированию вторичного иммунодефицита у кроликов при однократном введении, однократном и многократном введении циклофосфамида крысам и мышам [1–3].
По данным литературы при однократном введении кроликам циклофосфамида в дозе 40 мг/кг у животных развивается лейкопения и иммунодепрессия продолжительностью 5–7 дней [1]. Поскольку лейкопения характерна для вторичного иммунодефицита и является одним из критериев оценки, в качестве высшей тестируемой дозы циклофосфамида была выбрана доза 40 мг/кг. Следующие дозы были выбраны кратные двум – 10 и 20 мг/кг.
Так в статье по изучению изменений в тимусе крыс на фоне курсового внутрибрюшинного введения циклофосфамида использовали интервал между введениями 48 ч [2], в 1-й схеме (см. рис. 1, а) исследования индуктор вводили кроликам через день.
Однако результаты эксперимента при внутривенном введении циклофосфамида через день не отвечали выбранным критериям (снижение лейкоцитов в крови животных и клеточности тимуса на 40–50%, повышение отношения площади коркового вещества к площади мозгового вещества тимуса на 30–40%, сохранение гистоархитектоники тимуса) для моделирования иммунодефицита на кроликах, то была разработана 2-я схема (см. рис. 1, б) с ежедневным введением индуктора патологии в дозах 40, 60 и 80 мг/кг.
Гематологические показатели определяли в цельной крови с антикоагулянтом на гематологическом анализаторе ABACUS juniorvet (Австрия) за день до эвтаназии животных. Кроликов эвтаназировали путем передозировки комбинацией анестетиков Золетил + Ксилазин, 50% животных из каждой группы были эвтаназированы на 11-й день эксперимента, остальные животные – на 21-й день (см. рис. 1). У животных забирали тимус. Половину тимуса экспериментальных животных подвергали гомогенизации для определения клеточности органа. Общее количество жизнеспособных ядросодержащих клеток подсчитывали в камере Горяева [9]. Оставшаяся половина тимуса была взята на гистологическое исследование. Морфометрическое измерение коркового и мозгового вещества тимуса выполняли путем фотографирования на срезе как минимум 3 полей зрения при увеличении ×40, включающих оба слоя тимуса. Была измерена толщина слоев и подсчитано соотношение мозгового вещества к корковому.
Полученные данные обрабатывали с помощью лицензионной программы StatSoft Statistica 10.0 (США), достоверность различий между показателями экспериментальных и контрольной групп определяли по критерию Тьюки (р<0,05), попарное сравнение экспериментальных групп проводили с помощью t-критерия Стьюдента.
Результаты и обсуждение
Внутривенное введение циклофосфамида через день в дозах 10, 20 и 40 мг/кг не вызывало гибели экспериментальных животных на протяжении всего эксперимента. После 5 введений индуктора патологии в течение 10 дней клинически значимого влияния на исследуемые показатели не установлено (данные не приведены).
После 10 введений в течение 20 дней циклофосфамид не оказал статистически значимого влияния на уровень лейкоцитов в крови животных, но изменял соотношение в лейкоформуле (табл. 1).
Установлено статистически значимое снижение на 18% содержания лимфоцитов у животных, получавших циклофосфамид в дозах 20 и 40 мг/кг, повышение на 15% содержания моноцитов в дозе 40 мг/кг и гранулоцитов на 46% в дозе 20 мг/кг относительно интактной группы (≈40%) (см. табл. 1).
Таблица 1
Результаты общего анализа крови кроликов на 20-й день эксперимента при внутривенном введении циклофосфамида (10 введений), M±m, n=3
|
Исследуемый показатель |
Характеристика экспериментальной группы |
|||
|
1-я группа |
2-я группа |
3-я группа |
4-я группа |
|
|
Интактная |
Циклофосфамид |
|||
|
– |
10 мг/кг |
20 мг/кг |
40 мг/кг |
|
|
WBC Лейкоциты, 109/л |
7,1±1,19 |
4,7±0,22 |
4,5±0,37 |
4,1±0,15 |
|
LYM Лимфоциты, % |
68±2,6 |
61±2,5 |
56±0,8* |
56±3,6* |
|
MID Моноциты/эозинофилы, % |
3,3±0,15 |
3,1±0,15 |
3,3±0,23 |
4,8±0,30* |
|
GRA Гранулоциты, % |
28±2,6 |
36±2,4 |
41±0,6* |
40±3,7 |
|
RBC Эритроциты, 1012/л |
6,8±0,52 |
6,1±0,86 |
4,4±0,22 |
5,7±1,96 |
|
HGB Гемоглобин, г/л |
141±11,2 |
143±20,4 |
101±5,2 |
121±38,0 |
Примечание. * – p<0,05, различия статистически значимы по сравнению с интактными животными, критерий Тьюки.
Введение циклофосфамида приводит не только к изменению содержания лейкоцитов, и других форменных элементов крови, наблюдаемое в эксперименте снижение гемоглобина соответствует с данным литературы, где указано снижение уровней эритроцитов и гемоглобина после 1-й недели введения [10]. Данное действие обусловлено прямым ингибирующим влиянием циклофосфамида на гемопоэз [11].
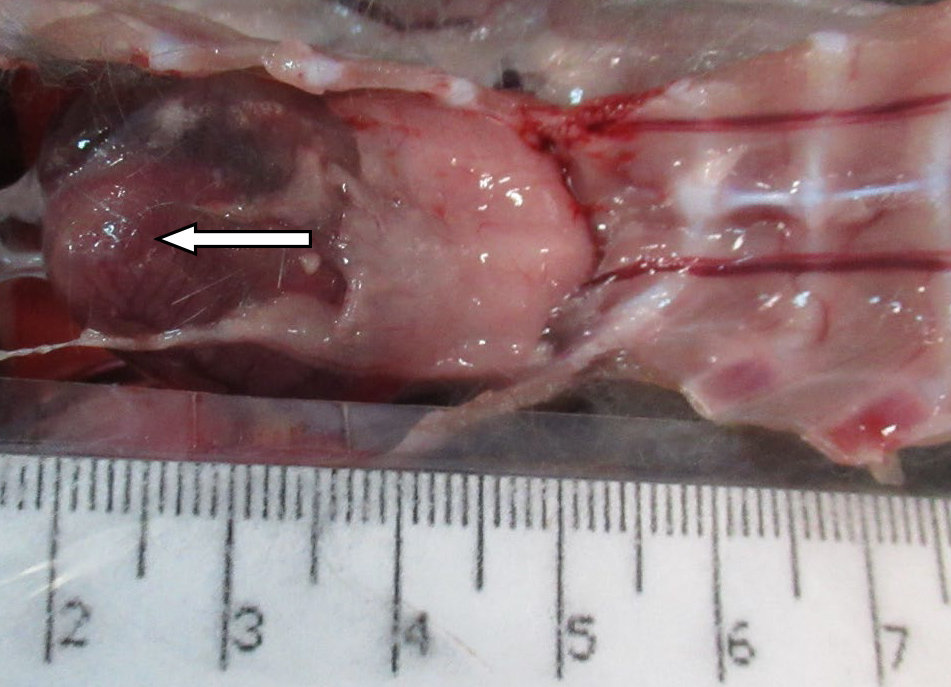
Основным показателем состоятельности модели иммуносупрессии, индуцированной введением циклофосфамида, кроме клинического анализа крови, является морфологическое исследование тимуса животных. Среди показателей, характеризующих атрофию вилочковой железы, следует выделить подсчет его клеточности и расчет отношения площади коркового вещества к площади мозгового вещества тимуса. Данные показатели позволяют подробно оценить иммуносупрессивное действие индуктора патологии, поскольку тимус особенно чувствителен к воздействию токсикантов иммунной системы и часто наблюдается четкое, связанное с дозой, уменьшение размера вилочковой железы, вызванное апоптозом корковых лимфоцитов.
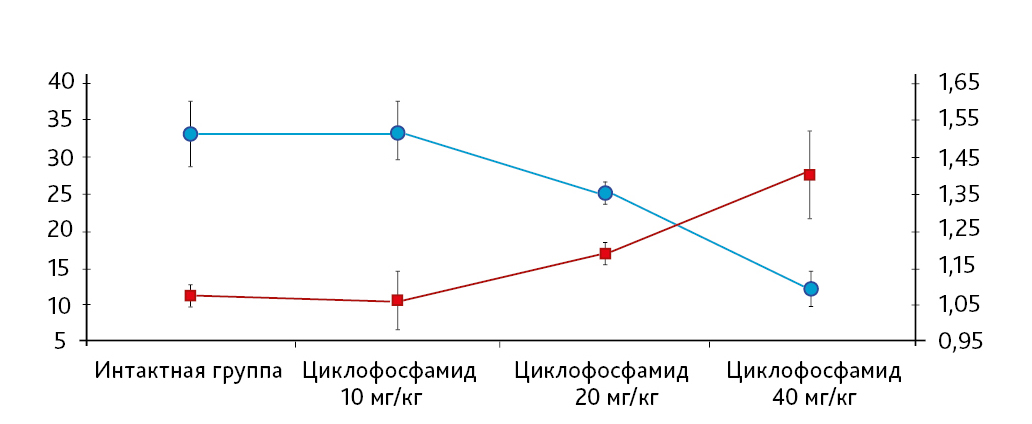
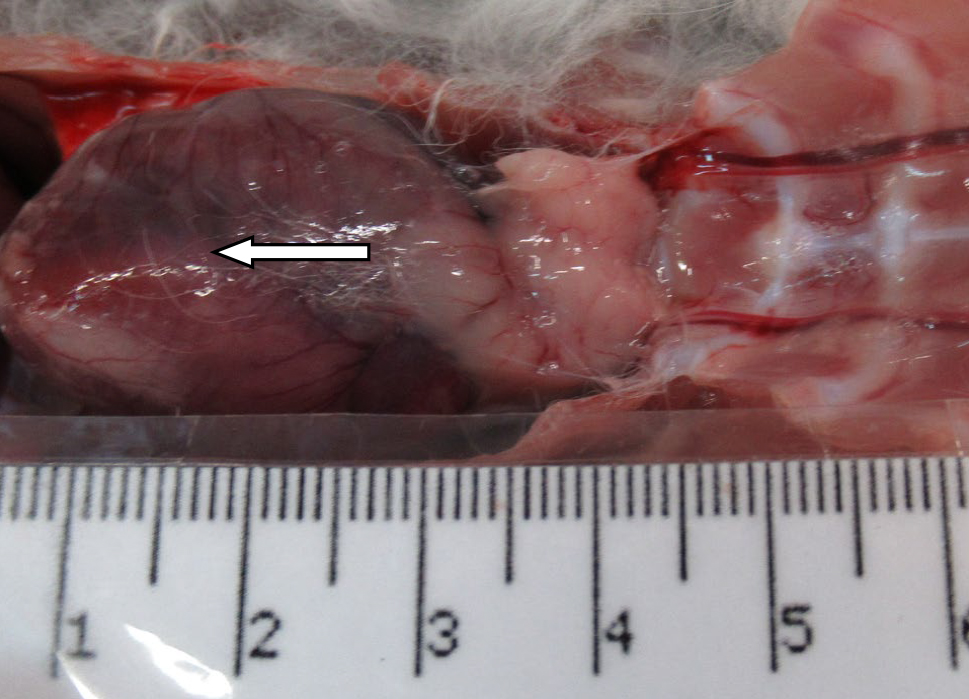
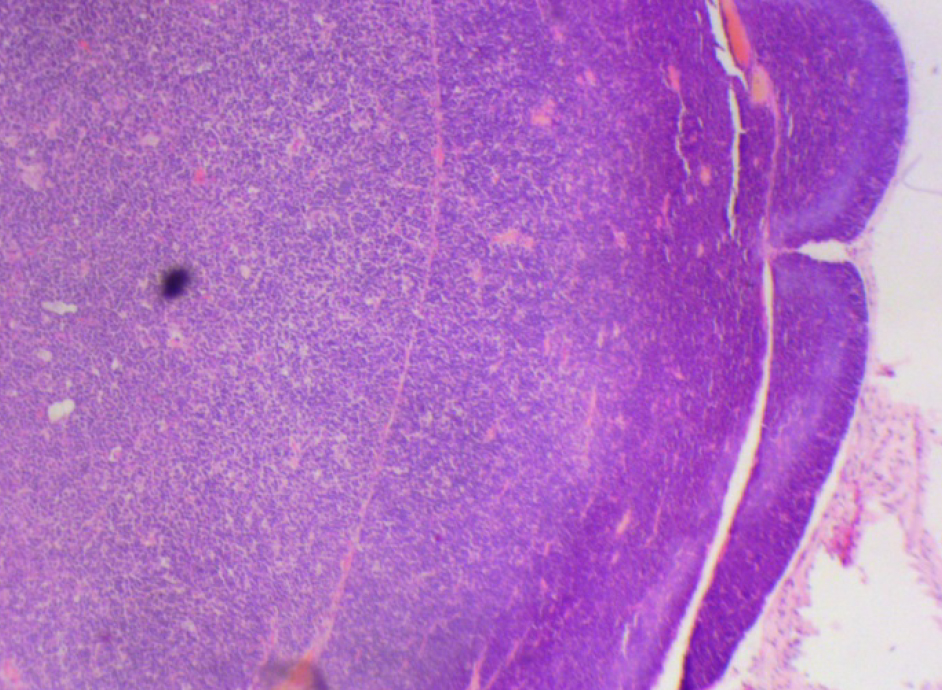
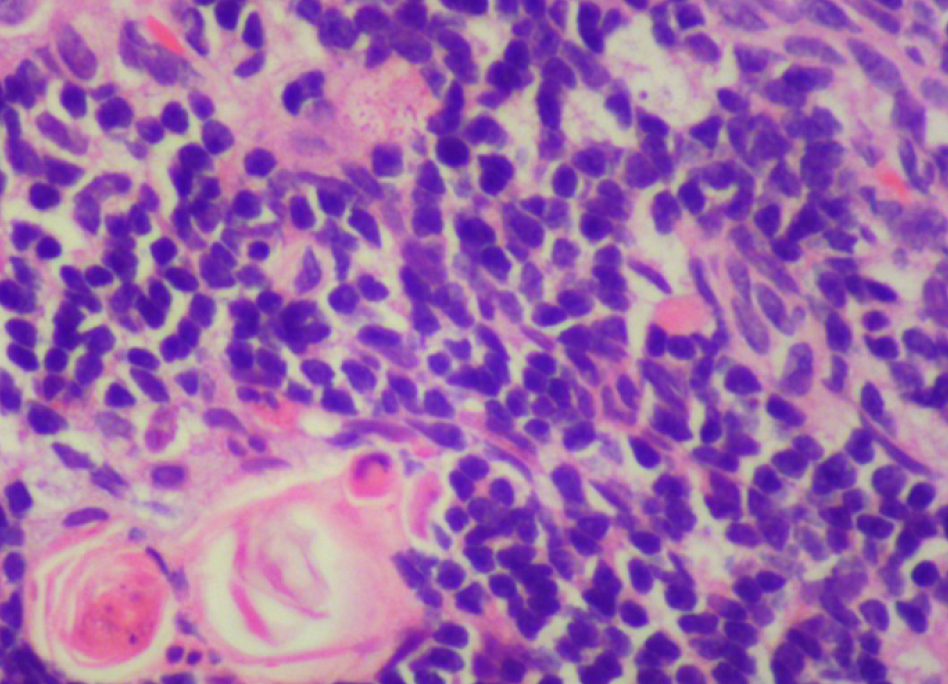
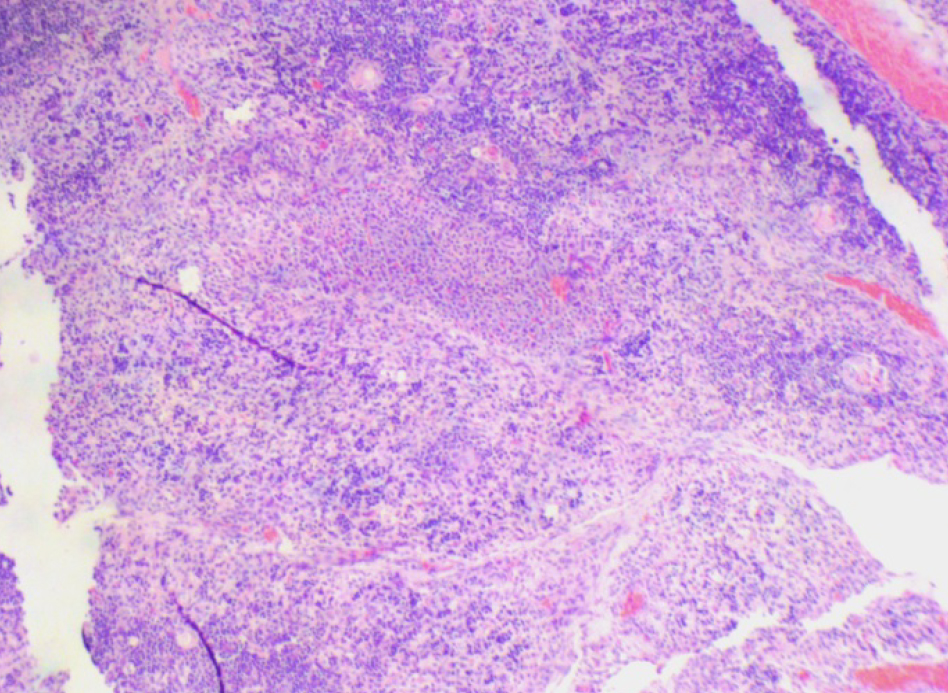
На 21-й день исследования у кроликов, получавших через день циклофосфамид в дозе 40 мг/кг, регистрировали статистически значимое снижение количества клеток тимуса, которое достигало ≈60%, и значимое повышение отношения площади коркового вещества тимуса относительно мозгового на 30% по сравнению с данными интактной группы (рис. 2). По результатам гистологического исследования строения тимуса показано, что структура органа была сохранена, признаков атрофии, апоптоза и склероза стромы не обнаружено (рис. 3–6).
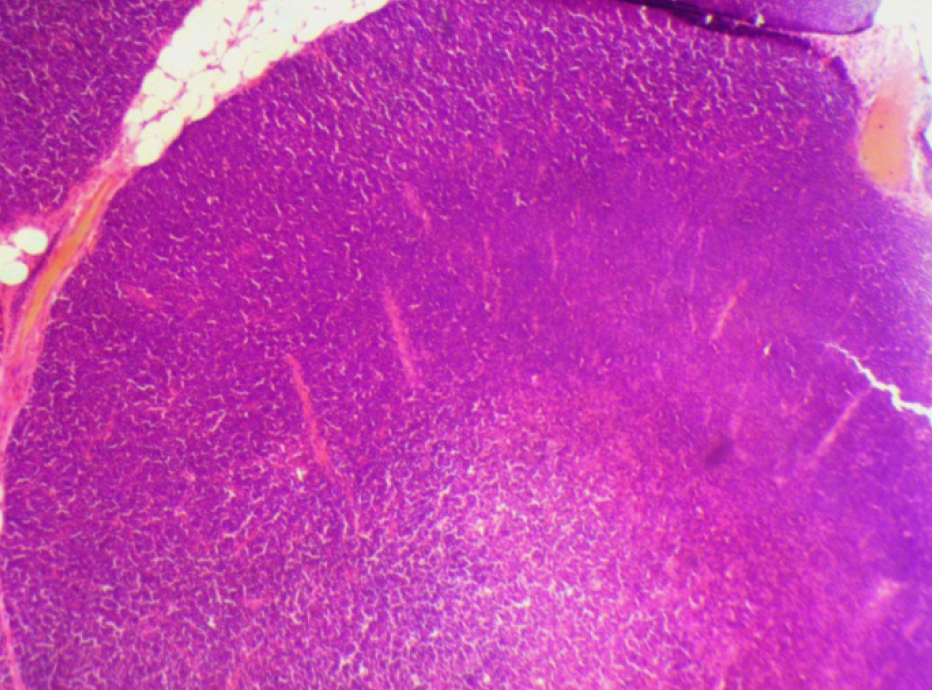
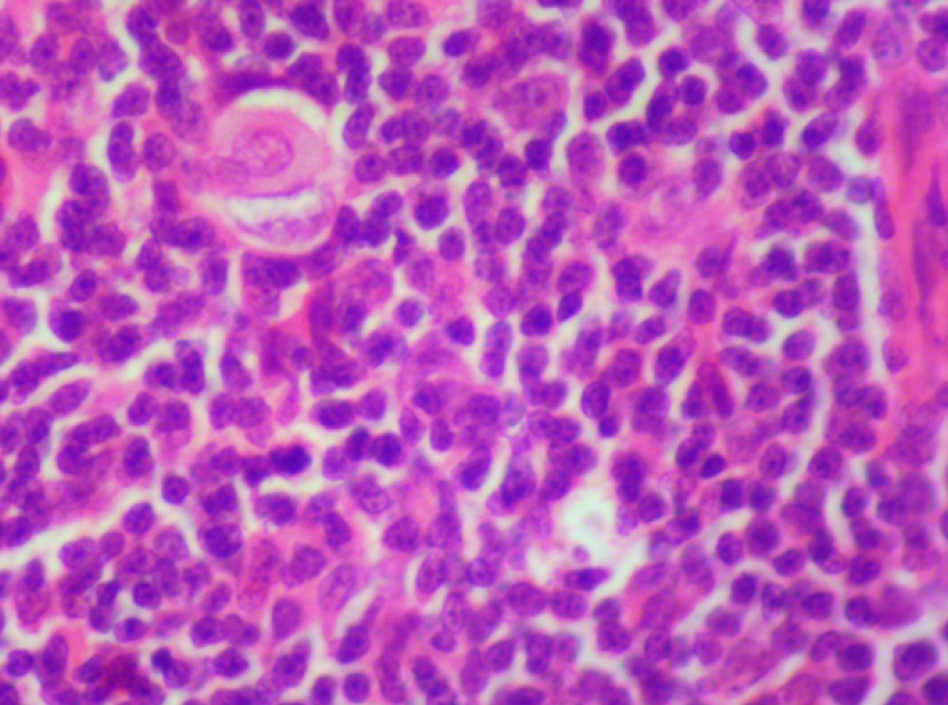
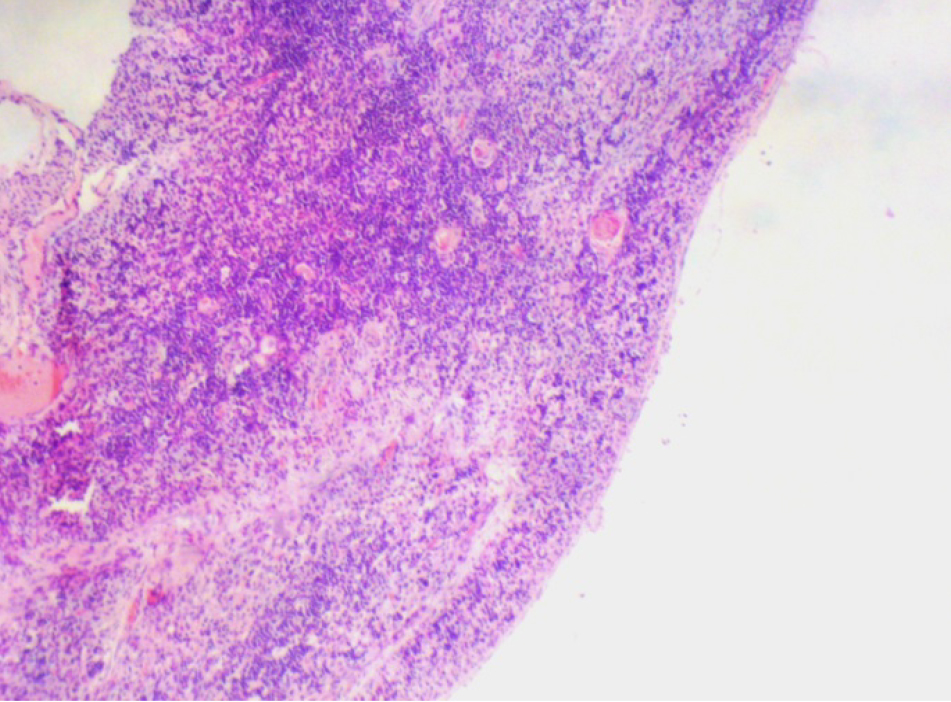
Однако результаты исследования, проведенного по схеме 1, не удовлетворяли выбранным для данной модельной патологии критериям (снижение лейкоцитов в крови животных и клеточности тимуса на 40–50%, повышение отношения площади коркового вещества к площади мозгового вещества тимуса на 30–40% и сохранение гистоархитектоники тимуса). Поэтому был проведен 2-й эксперимент в соответствии со схемой 2 (см. рис. 1, б).
При ежедневном введении циклофосфамида были зарегистрированы летальные исходы. Гибель животных наблюдали, начиная с 6-го дня эксперимента, в группах, получавших циклофосфамид в дозах 60 и 80 мг/кг, на 16-й и 18-й дни введения отмечена гибель 2 кроликов, получавших индуктор патологии в дозе 40 мг/кг.
При ежедневном внутривенном введении циклофосфамида в дозах 40 и 60 мг/кг у животных регистрировали развитие признаков лейкопении уже на 10-й день введения. Снижение уровня лейкоцитов у животных, получавших циклофосфамид в течение 10 дней в дозе 40 мг/кг, достигало 44% по сравнению с таковой в интактной группе, в дозе 60 мг/кг – 66% (табл. 2).
Таблица 2
Результаты общего анализа крови кроликов на 10-й день эксперимента при ежедневном внутривенном введении циклофосфамида, M±m
|
Исследуемый показатель |
Характеристика экспериментальной группы |
|||
|
1-я группа |
2-я группа |
3-я группа |
4-я группа |
|
|
n=3 |
n=3 |
n=4 |
n=2● |
|
|
Интактная |
Циклофосфамид |
|||
|
— |
40 мг/кг |
60 мг/кг |
80 мг/кг |
|
|
WBC Лейкоциты, 109/л |
3,9±0,30 |
2,6±0,38* |
1,6±0,20* |
0,4/0,4 |
|
LYM Лимфоциты, % |
60±3,2 |
55±2,5 |
61±1,9 |
— |
|
MID Моноциты/эозинофилы, % |
5,0±0,74 |
6,1±0,06 |
5,5±0,55 |
— |
|
GRA Гранулоциты, % |
35±2,5 |
39±2,6 |
34±1,7 |
— |
|
RBC Эритроциты, 1012/л |
5,4±0,41 |
4,7±0,01 |
4,2±0,19* |
4,6/6,6 |
|
HGB Гемоглобин, г/л |
119±8,7 |
109±1,3 |
97±2,6* |
92/135 |
Примечания. * – p<0,05, различия статистически значимы по сравнению с интактными животными, критерий Тьюки; ● – исследуемые показатели экспериментальной группы исключены из статистической обработки в виду недостаточного количества данных (< 3). Приведены индивидуальные значения для каждого выжившего животного.
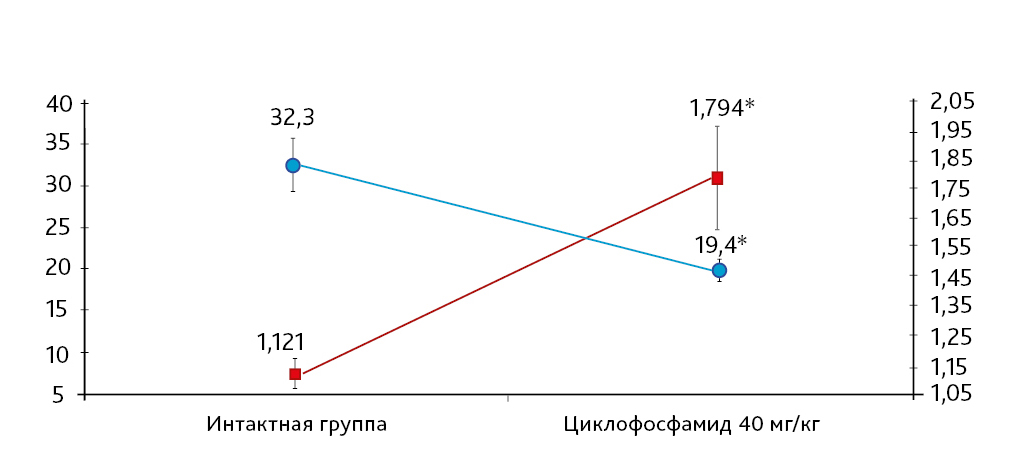
Клеточность тимуса кроликов экспериментальных групп после ежедневного введения циклофосфамида претерпела выраженные изменения. В дозе индуктора патологии 40 мг/кг у животных на 11-й день эксперимента зарегистрировано статистически значимое снижение (на 40%) клеточности тимуса по сравнению с результатами в интактной группе (рис. 2). Статистическая обработка результатов клеточности тимуса после 20-дневного введения циклофосфамида была невозможна.
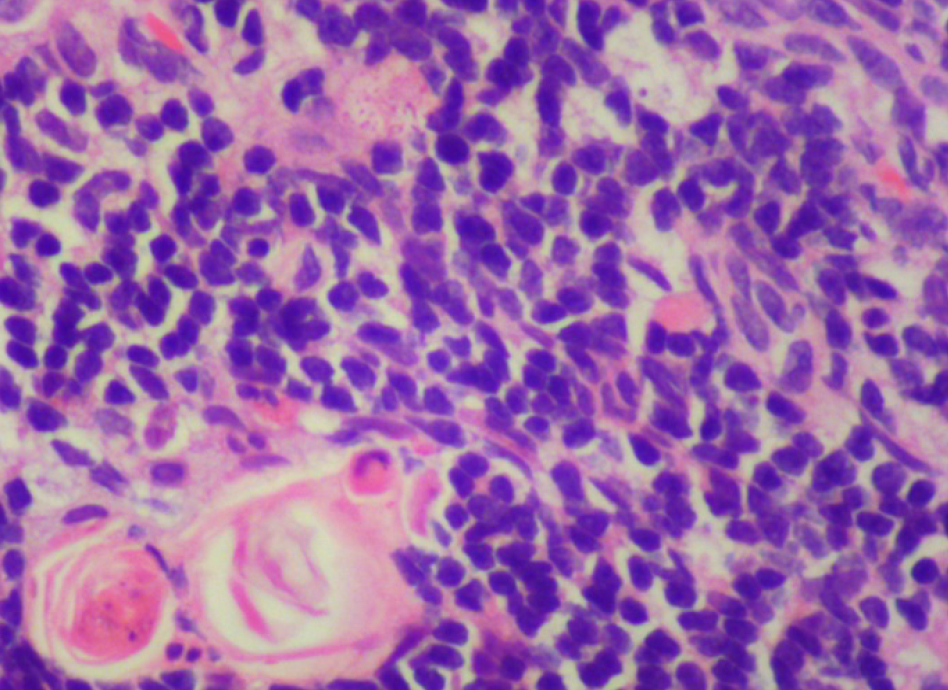
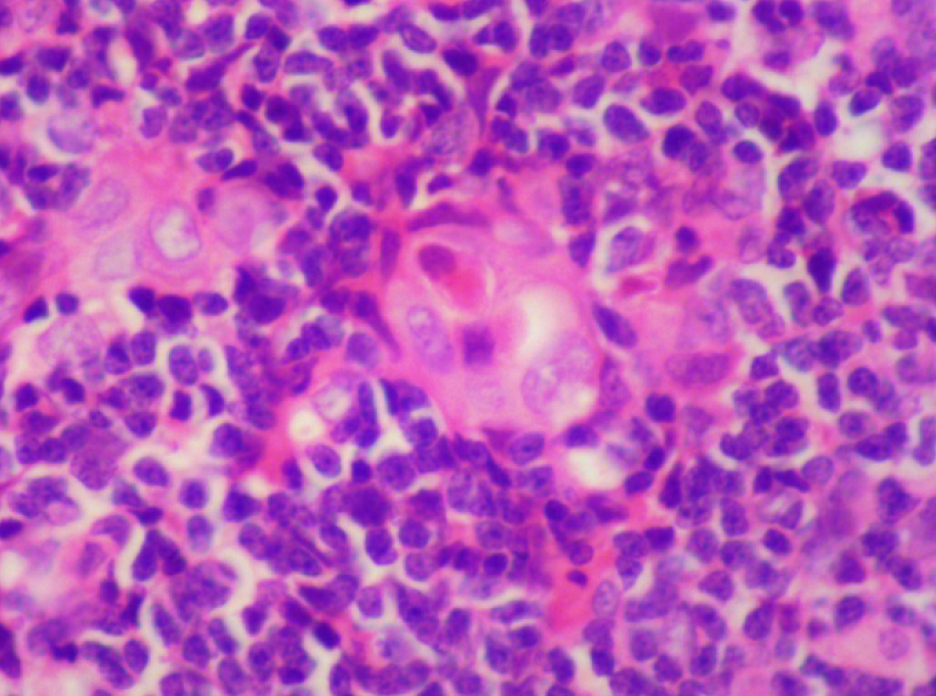
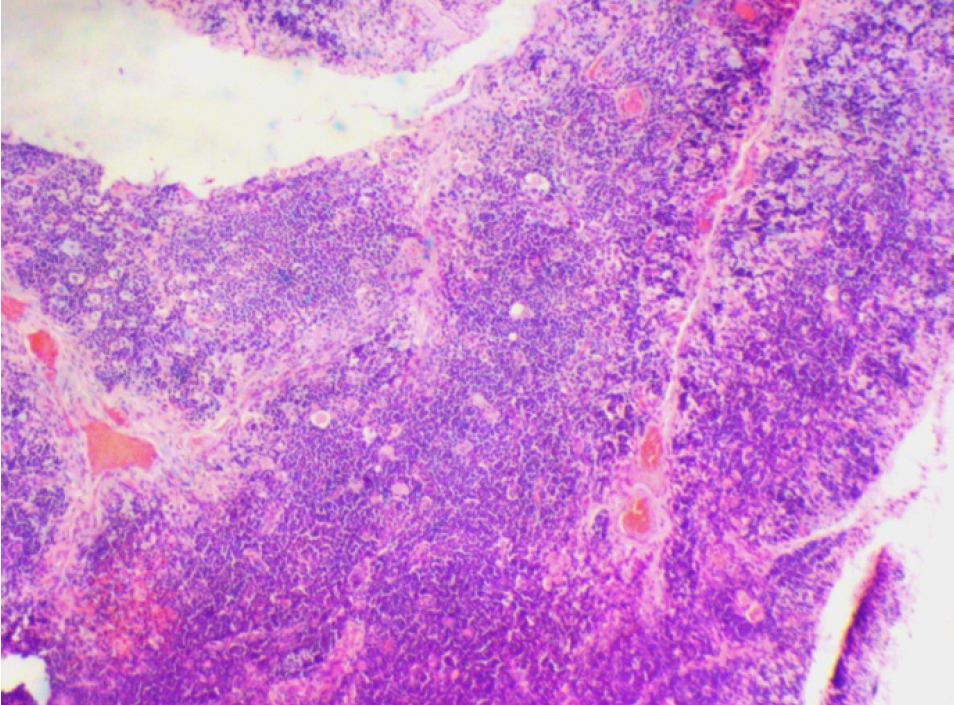
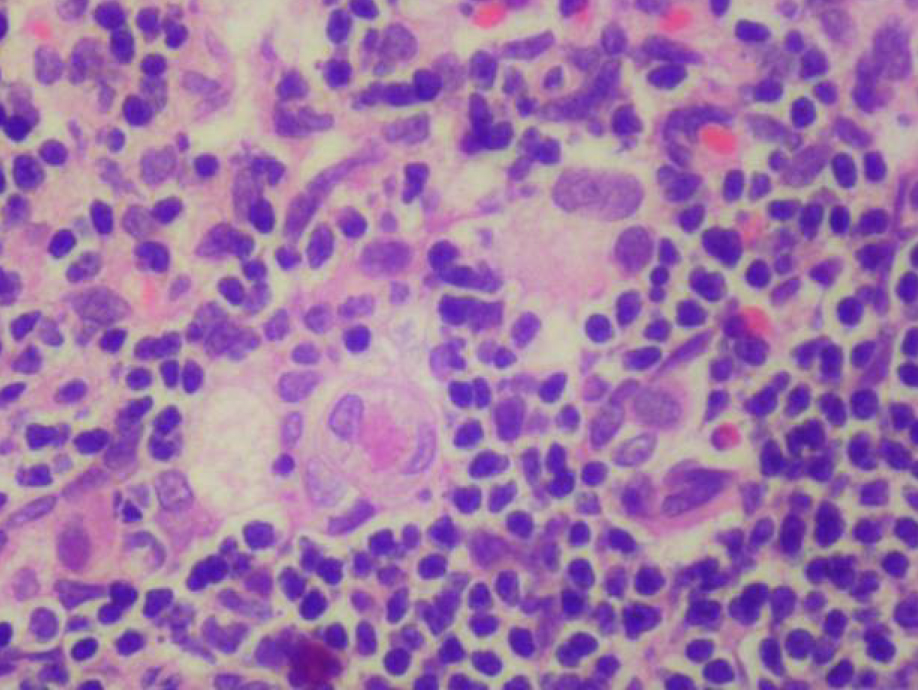
По результатам морфометрии ежедневное введение циклофосфамида в дозе 40 мг/кг приводило к статистически значимому повышению показателя «отношение площади коркового вещества к мозговому» тимуса кроликов на 11-й день эксперимента, на ≈40% относительно интактных животных (см. рис. 7). В группах, получавших циклофосфамид ежедневно в дозах 60 и 80 мг/кг соответственно, на 11-й день эксперимента была выявлена выраженная атрофия тимуса со стиранием границ между слоями, гиперплазия эпителиоретикулярных клеток, а также апоптоз и склероз стромы (рис. 8–13). Также атрофию тимуса наблюдали на 21-й день эксперимента у выжившего кролика (из 3 оставленных), получавшего циклофосфамид в дозе 40 м/кг. В связи со стиранием границ между слоями (нарушением гистоархитектоники) тимуса оценить толщину коркового и мозгового слоев было невозможно (рис. 14–15).
Таким образом, при оценке 2 схем моделирования иммуносупрессии при внутривенном введении кроликам были получены следующие результаты (табл. 3).
Таблица 3
Изменение изучаемых в эксперименте показателей, % от интактной группы
|
Схема 1 Циклофосфамид, 40 мг/кг, введение через день (20–21-й дни эксперимента) |
Схема 2 Циклофосфамид, 40 мг/кг, введение каждый день (10–11-й дни эксперимента) |
Критерии |
|
Количество лейкоцитов в крови |
||
|
↓ 43%* |
↓ 44% |
↓ 40-50% |
|
Клеточность тимуса |
||
|
↓ 63 % |
↓ 40 % |
↓ 40-50% |
|
Соотношение коркового вещества к мозговому веществу тимуса |
||
|
↑ 30 %* |
↑ 40 % |
↑ 40-50% |
|
Сохранение структуры тимуса |
||
|
Сохранена |
Сохранена |
Сохранена |
Примечание. Представлены данные 2 схем введения циклофосфамида в дозе 40 мг/кг, поскольку введение других доз не отвечало критериям эффективности модели; ↓ – снижение исследуемого показателя относительно; ↑ – повышение исследуемого показателя относительно; * – статистическая значимость отсутствуют.
Планируемые изменения исследуемых показателей клинически и статистически значимые были получены при ежедневном введении циклофосфамида в дозе 40 мг/кг. Данная доза рекомендована для моделирования иммуносупрессии у кроликов.
Заключение
Введение циклофосфамида через день в дозе 40 мг/кг вызывало признаки иммуносупрессии только на 21-й день эксперимента после 10 введений. Установлено снижение уровня лейкоцитов (≈40%), относительно интактных животных. Также обнаружено статистически значимое снижение клеточности тимуса, которое достигало ≈60%, и статистически значимое повышение отношения площади коркового вещества тимуса относительно мозгового на 30% по сравнению с данными интактной группы, с сохранением гистоархитектоники органа.
Ежедневное внутривенное ведение циклофосфамида вызывало снижение уровня лейкоцитов в крови животных, получавших циклофосфамид в течение 10 дней в дозе 40 мг/кг до 44% по сравнению с таковыми в интактной группе, в дозе 60 мг/кг – 66%. Установлена атрофия тимуса с сохранением гистоархитектоники, проявляющаяся снижением клеточности тимуса на 40% и повышением отношения коркового вещества тимуса относительно мозгового на 40% у животных, получавших циклофосфамид в дозе 40 мг/кг, относительно интактных животных.
Для оценки эффективности лекарственных препаратов на модели вторичного иммунодефицита на кроликах могут быть использованы 2 возможные схемы: 1-я – ежедневное внутривенное введение циклофосфамида в дозе 40 мг/кг на протяжении 20-ти дней с оценкой показателей на 10-й и 20-й дни эксперимента, где в период с 11-го по 20-й дни исследования будет оцениваться выживаемость животных; 2-я схема – ежедневное внутривенное введение циклофосфамида в дозе 40 мг/кг на протяжении 10 дней с оценкой показателей на 10-й и 20-й дни эксперимента, где в период с 11-го по 20-й дни исследования будет оцениваться обратимость вызванных циклофосфамидом эффектов.
* Исследование было одобрено биоэтической комиссией НПО «ДОМ ФАРМАЦИИ» № 1.60/18 от 24 сентября 2018.
Список источников
- Бобрышева И.В. Изменения ультраструктуры тимуса белых крыс после введения циклофосфамида. Вестник Витебского государственного медицинского университета. 2013; Т. 12; 4.
- Павлюковец А.Ю., Шейбак В.М., Жмакин А.И. Иммуносупрессия и метаболизм аминокислот в тимусе после курсового введения циклофосфамида. 90 лет в авангарде микробиологической науки Беларуси, 2015: 84–7.
- Chen X. et al. A polysaccharide from Sargassum fusiforme protects against immunosuppression in cyclophosphamide-treated mice. Carbohydrate polymers. 2012. Т. 90; 2: 1114–9.
- Popov B. et al. Enhancement of anti-KLH IgG antibody production in rabbits after treatment with Haberlea rhodopensis extract. Trakia Journal of Sciences, 2010. Т. 8;. 2: 92–7.
- Любошенко Т.М. Вторичные иммунодефицитные состояния у жителей крупного промышленного города Западной Сибири. Современные проблемы науки и образования. 2014; 4.; URL: http://www.science-education.ru/ru/article/view?id=13946
- Pearse G. Histopathology of the thymus. Toxicologic pathology. 2006. Т. 34; 5: 515–47.
- Рыбакова А.В., Макарова М.Н., Макаров В.Г. Использование кроликов в доклинических исследованиях. Международный вестник ветеринарии. 2016; 4: 102–6.
- Суфияров И.Ф. и др. Влияние иммуносупрессии индуцированной циклофосфамидом на развитие послеоперационных брюшинных спаек // Медицинский вестник Башкортостана. 2009. Т. 4; 4: 64–7.
- Руководство по проведению доклинических исследований лекарственных средств. Часть первая. М.: Гриф и К, 2012: 944.
- Psenak O., Sefc L., Sykora V., Chang K.T., Necas E. Cytokine gene expression in regenerating haematopoietic tissues of mice after cyclophosphamide treatment. Acta Haematol. 2003. Vol. 109, 2: 68–75.
- Гершанович М.Л. Осложнения при химио- и гормонотерапии злокачественных опухолей. М.: Медицина. 1982. Т. 221.




