Влияние изменений водно-солевого баланса на ионо- и осморегулирующую функции почек у озерной лягушки
Работа выполнена в рамках государственного задания № 075-00967-23-00. Исследования методом конфокальной микроскопии проведены на базе Центра коллективного пользования ИЭФБ РАН.
Пруцкова Н.П., Селивёрстова Е.В., Кутина А.В. Влияние изменений водно-солевого баланса на ионо- и осморегулирующую функции почек у озерной лягушки. Лабораторные животные для научных исследований. 2023; 3. https://doi.org/10.57034/2618723X-2023-03-03
Резюме
У озерной лягушки (Pelophylax ridibundus) анализировали изменения водно-солевого баланса и экскреции ионов почками при обезвоживании и инъекциях гипертонического и изотонического растворов NaCl. Введение 0,75 М NaCl и обезвоживание в течение 1 ч увеличивали осмоляльность сыворотки крови и концентрацию Na+ и Cl–, инъекции изотонического раствора не влияли на эти показатели. Примененные воздействия повышали содержание в моче Na+ и Cl– , а также усиливали экскрецию этих ионов. Наибольшие изменения, включая рост уровня натрия в крови, увеличение диуреза и скорости клубочковой фильтрации, установлены при введении 0,75 М NaCl. В проксимальных канальцах почек обнаружены изменения паттерна хлоридного канала ClC-5, предположительно вовлеченного в процесс эндоцитоза белка. С помощью иммуногистохимии и конфокальной микроскопии установлено увеличение числа ClC-5-иммунопозитивных профилей канальцев и интенсивности флуоресцентного сигнала в апикальной цитоплазме эпителиоцитов. Полученные результаты физиологических и иммуногистохимических исследований открывают перспективы моделирования состояний гипернатриемии, гиперволемии и обезвоживания у лягушек для изучения роли молекулярных детерминант эпителиального транспорта ионов и белков в почечных канальцах in vivo.
Введение
Интерес к физиологии амфибий в значительной мере связан с ключевой позицией этих животных в эволюции наземных позвоночных, разнообразием видов и мест обитания, а также с наличием широкого спектра морфологических и физиологических приспособлений, обеспечивающих выживание земноводных в изменяющихся или экстремальных условиях окружающей среды. В то же время механизмы гомеостатической регуляции водно-солевого и кислотно-щелочного баланса внутренней среды, а также транспорта воды и ионов в специализированных эпителиях осморегуляторных органов во многом аналогичны таковым у млекопитающих. Амфибии являются одними из наиболее удобных и успешно используемых экспериментальных моделей для изучения деятельности различных органов и физиологических систем позвоночных, включая экологические, молекулярно-биологические и биомедицинские исследования, а также вопросы эволюции почек позвоночных и механизмов эпителиального канальцевого транспорта [1–3].
Почка амфибий является важнейшим органом, обеспечивающим поддержание водно-солевого баланса, 20–30% профильтровавшегося Na+ и Cl– реабсорбируется в проксимальных канальцах и более 50% — в дистальных [2]. В перемещении основных осмотически активных ионов (Na+, Cl–) участвуют различные транспортные белки, включая натриевые и хлоридные каналы, котранспортеры, ионные насосы и обменники [4–8]. Физиологическое значение многих из них в почках амфибий остается неясным. Электрогенный механизм транспорта Na+ имеется в дистальных отделах нефрона и собирательных трубках, что показано в экспериментах in vitro для жабы-аги (Bufo marinus) [9], хвостатых амфибий амфиум (Amphiuma) [10] и амбистом (Ambystoma) [11]. С помощью иммуногистохимического метода установлены распределение и локализация эпителиального натриевого канала (ENaC) в эпителиальных клетках связующего канальца и главных клетках собирательных трубок у B. marinus, в том числе при гиперосмотическом стрессе [9].
Важная роль в реализации эпителиального транспорта веществ принадлежит белкам семейства хлоридных каналов (ClC). Они представляют собой потенциалзависимые хлоридные каналы плазматической мембраны и внутриклеточные Cl–/H+-обменники, вовлеченные, в частности, в трансэпителиальный транспорт и эндоцитоз [12]. В проксимальном канальце в отличие от других частей нефрона одновременно с реабсорбцией воды и ионов происходит всасывание низкомолекулярных белков с помощью рецепторов эндоцитоза мегалина и кубилина, что показано у млекопитающих [13], рыб [14] и амфибий [15–17]. Внутриклеточные хлоридные каналы, ClC-3 и ClC-5 участвуют в установлении рН различных внутриклеточных компартментов в процессе эндоцитоза, от их вовлечения в ацидофикацию эндоцитозных везикул зависит эффективность гидролиза белка в лизосомах [4, 12, 18]. В почках млекопитающих ClC-5 можно обнаружить в мембране щеточной каемки эпителиоцитов проксимального канальца, однако основная его часть локализуется в апикальных эндосомах [18, 19] наряду с ClC-3 [20]. Дефицит ClC-5 при болезни Дента и у нокаутных мышей ингибировал эндоцитоз профильтровавшихся белков в клетках проксимальных канальцев [21], однако нокаут ClC-3 не приводил к нарушению эндоцитоза в почках [22]. Некоторые гомологи хлоридных каналов амфибий клонированы (см. [5]). Два из них, xClC-3 и xClC-5, идентифицированы у лягушек рода Xenopus как ортологи CLC-3 и CLC-5 млекопитающих и человека с идентичностью последовательностей от 78 до 90%, при этом показана функциональная экспрессия различных ортологов ClC-5 в ооцитах Xenopus или в клеточных линиях млекопитающих.
Изменения осмотического баланса у амфибий в большинстве работ изучались в условиях длительной адаптации животных к повышенной солености среды или обезвоживанию в течение нескольких часов, дней или недель. Хорошо известно, что в почках амфибий нет петель Генле, и эти животные не способны продуцировать мочу, гиперосмотическую по отношению к плазме крови, а в условиях гидратации выделяют значительное количество сильно разбавленной мочи. Однако при интенсивном обезвоживании амфибии могут вырабатывать почти изотоническую мочу и быстро реагировать на резкие изменения окружающей среды (высыхание, повышение солености), тем самым обеспечивая кардинальное изменение в крови концентраций Na+, Cl– и мочевины [7]. Показано, что содержание электролитов в крови и моче, а также осмоляльность увеличивались пропорционально длительности адаптации к солености наружной среды и концентрации в ней Na+, продолжительности дегидратации, снижению содержания воды в организме в процессе ее испарения с поверхности тела [23–27].
Значительно меньше сведений об изменениях параметров крови и мочи у амфибий в ответ на быстрые изменения водно-солевого баланса, вызванные парентеральным введением гипертонических и изотонических растворов. У лопатонога (Scaphiopus couchi) инъекции гипертонического раствора NaCl не приводили к существенному повышению осмоляльности плазмы крови [28] при наличии реакции поиска воды и ее всасывания через кожу брюшка. Внутривенные инъекции озерным лягушкам 0,3 мл раствора Рингера, содержащего NaCl (концентрация 6%), или 1 мл изотонического раствора Рингера приводили к сходному увеличению осмоляльности мочи (до 60–80 мОсм/кг H2O) [26]. Инфузия 5% раствора соли постепенно увеличивала осмоляльность плазмы крови (до 240 мОсм/кг H2O) у лягушки-быка (Rana catesbeiana) [29]. Подкожное введение изотонического раствора лесным лягушкам (Rana silvatica) повышало осмоляльность мочи при значительной вариабельности осмоляльности плазмы крови и содержания в ней Na+ и Cl– [27].
Цель работы — сравнительный анализ воздействия однократных инъекций гипертонических и гипотонических растворов, а также обезвоживания на водно-солевой гомеостаз и экскрецию ионов почками у озерных лягушек.
Задачи исследования: 1) определить осмоляльность и содержание отдельных ионов в моче и крови после примененных воздействий с последующей оценкой функциональных показателей деятельности почек клиренсовыми методами; 2) выявить с помощью иммуногистохимии и конфокальной микроскопии наличие ClC-5 в проксимальных канальцах нефронов и возможные изменения паттерна этого канала при наиболее эффективных воздействиях на ионорегулирующую функцию почек.
Материал и методы
Животные. В опытах использовали озерных лягушек, Pelophylax ridibundus (Pallas, 1771), прежнее название Rana ridibunda, отловленных в Астраханской области, со средней массой тела 102±3 г (n=66), преимущественно самцов (n=50). До экспериментов, проводимых с ноября по 1‑ю половину апреля 2022 г., зимующих лягушек содержали в холодильной камере вивария института при температуре 4 °С в пластиковых контейнерах с фильтрованной водопроводной водой, сменяемой через день, без кормления, поскольку в периоде гибернации лягушки не питаются. Исследование выполнено с соблюдением принципов Европейской конвенции о защите позвоночных животных, используемых для экспериментов и других научных целей (Страсбург, 1986), содержание животных и методы исследования одобрены комиссией по биоэтике ИЭФБ РАН (протокол № 11–1/2022 от 24.11.22).
Экспериментальные процедуры. Животных, адаптированных к комнатной температуре в течение 1 ч, помещали в индивидуальные контейнеры, заполненные водопроводной водой (23 °C) до уровня 1–2 см. В начале опыта у гидратированных лягушек добивались опорожнения мочевого пузыря путем мягкого надавливания на переднюю брюшную стенку. После этого животное взвешивали на электронных лабораторных весах ВЛТЭ-210/510 (Госметр, Россия) для расчета доз вводимых веществ и функциональных показателей работы почек. Все инъекции осуществляли подкожно в спинной лимфатический мешок, используя шприц с иглой 27G. Для моделирования изменений водно-солевого баланса проводили следующие серии экспериментов: 1) инъекции 0,75 М NaCl в дозе 100 мкл на 30 г массы тела, контрольным животным вводили такое же количество изотонического 0,01 М фосфатно-солевого буфера (PBS); 2) гиперволемия, создаваемая введением изотонического PBS в объеме 0,9 мл на 30 г массы тела (3% от массы тела), в контроле использовали PBS, 100 мкл на 30 г массы; 3) дегидратация путем помещения животного в сухой контейнер в сравнении с оптимальной гидратацией в контроле. Для сбора мочи контрольным и опытным животным накладывали кисетный шов на кожу промежности вокруг анального отверстия и перевязывали клоаку. Лигатуру снимали через 1 ч и собирали мочу при произвольном мочеиспускании, регистрировали объем пробы. После сбора мочи лягушкам вводили зеленый флуоресцентный белок (GFP) (Институт белка, РАН, Пущино-на-Оке, Россия) для тестирования канальцевой реабсорбции. Через 20 мин лягушек обездвиживали с целью обезболивания, разрушая спинной мозг с помощью препаровальной иглы, затем собирали кровь из сердца, быстро извлекали почки и проводили эвтаназию путем декапитации. У части животных (по 3–4 лягушки из каждой серии) перевязку клоаки и сбор проб мочи и крови не проводили, а через 1 ч после воздействий и в контроле вводили лизоцим (Sigma Aldrich Inc., США). Через 20 мин лягушек обездвиживали, извлекали почки и проводили эвтаназию. Вводимые вещества (NaCl, а также белки в дозе 18 мкг/100 мкл на 30 г массы тела) растворяли на PBS, осмоляльность 200 мОсм/кг H2O, pH 7,4.
Измерения и расчеты. Осмоляльность мочи и сыворотки крови определяли криоскопическим методом (в мОсм/кг H2O) на микроосмометре Osmo 1 (Advanced Instruments, США). Концентрацию натрия и калия в пробах мочи измеряли на пламенном фотометре Sherwood-420 (Sherwood Scientific, Великобритания), а в сыворотке крови — с помощью ионоселективного блока на автоматическом биохимическом анализаторе Erba XL-200 (Lachema, Чехия). На этом же анализаторе в пробах мочи и сыворотки крови определяли концентрацию Cl– (ионоселективным методом), креатинина (кинетическим методом по реакции Яффе) с использованием готовых реактивов и сывороток фирмы Erba (Чехия). Были рассчитаны функциональные показатели, характеризующие работу почек, в том числе диурез (V, мл/мин) и экскреция отдельных ионов [концентрация каждого из ионов в моче (UNa, etc.), умноженная на V]. Для оценки скорости клубочковой фильтрации (СКФ) использовали клиренс креатинина (CCr), определяемый как отношение содержания креатинина в моче и сыворотке крови (UCr/PCr), умноженное на V. Все показатели (в соответствующих единицах) подсчитывали на 100 г массы тела.
Морфологические исследования. Образцы ткани почек фиксировали в 4% растворе параформальдегида с последующим отмыванием, криопротекцией и замораживанием в жидком азоте согласно применявшемуся ранее протоколу [16]. Срезы (толщиной 5–7 мкм) из разных частей почки готовили в криостате CM 1510 (Leica Microsystems, Германия). В иммуногистохимических исследованиях применяли поликлональные кроличьи антитела к ClC-5 (Sigma-Aldrich, США) в разведении 1:100, моноклональные мышиные антитела к мегалину/LRP2 (MyBioSourse, США; Acris, Origene Technologies, США) в разведении 1:1000, а также флуоресцентные конъюгаты козьих антикроличьих и антимышиных иммуноглобулинов (IgGs) с Alexa Fluor 488 и 568 (Invitrogen, Molucular Probes, США) по описанной ранее процедуре [16]. Срезы монтировали на предметные стекла, заключали в мовиол и изучали в конфокальном микроскопе DMI 6000 с лазерной приставкой Leica SP II (Leica Microsystems, Германия), используя объектив с увеличением в 40 раз. В режиме лазерного сканирования использовали спектры возбуждения с длиной волны 488 и 568 нм, регистрируя свечение в зеленой (500–520 нм) и красной (590–650 нм) частях спектра соответственно. Изображения, полученные при идентичных и постоянных параметрах работы микроскопа, анализировали, пользуясь программой Image J. На изображениях надгломерулярной зоны подсчитывали относительное число профилей иммунопозитивных проксимальных канальцев (в процентах к общему числу визуализированных проксимальных канальцев). В эпителиальном слое иммунопозитивных канальцев определяли интенсивность флуоресцентного сигнала (оптическая плотность, усл. ед.) в апикальной области эпителиоцитов.
Статистика. Для количественной оценки результатов применяли методы параметрической и непараметрической статистики. В случае соответствия показателей закону нормального распределения по результатам теста Шапиро–Уилка данные представляли в виде средней арифметической и ее стандартной ошибки (M±SEM), сравнения проводили с использованием непарного t-теста Стьюдента. Другие данные представляли как медиану с верхним и нижним квартилями [Me (Q1; Q3)], для сравнения независимых групп использовали U- или T-критерий Манна–Уитни. Различия считали статистически значимыми при p<0,05. Для расчетов и статистической обработки данных пользовались программой Microsoft Office Excel 2010 и онлайн-калькуляторами.
Результаты и обсуждение
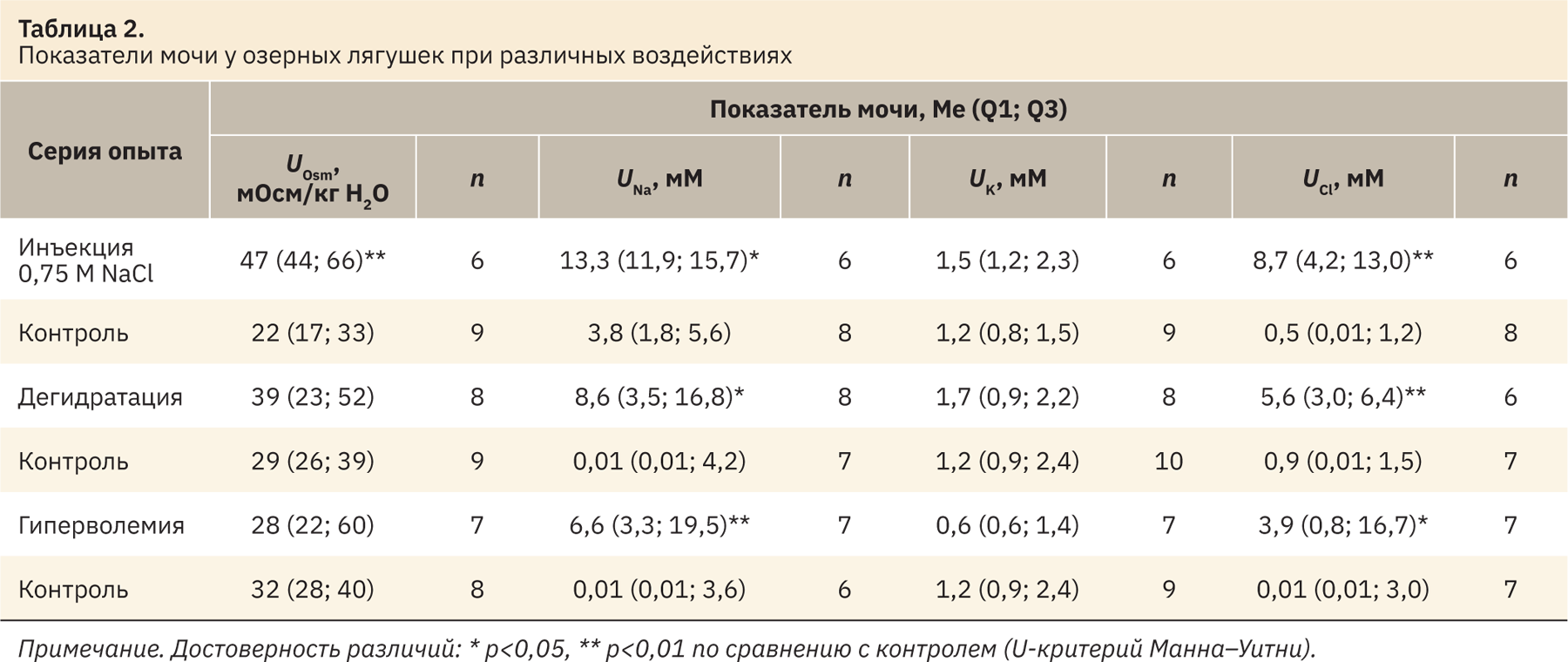
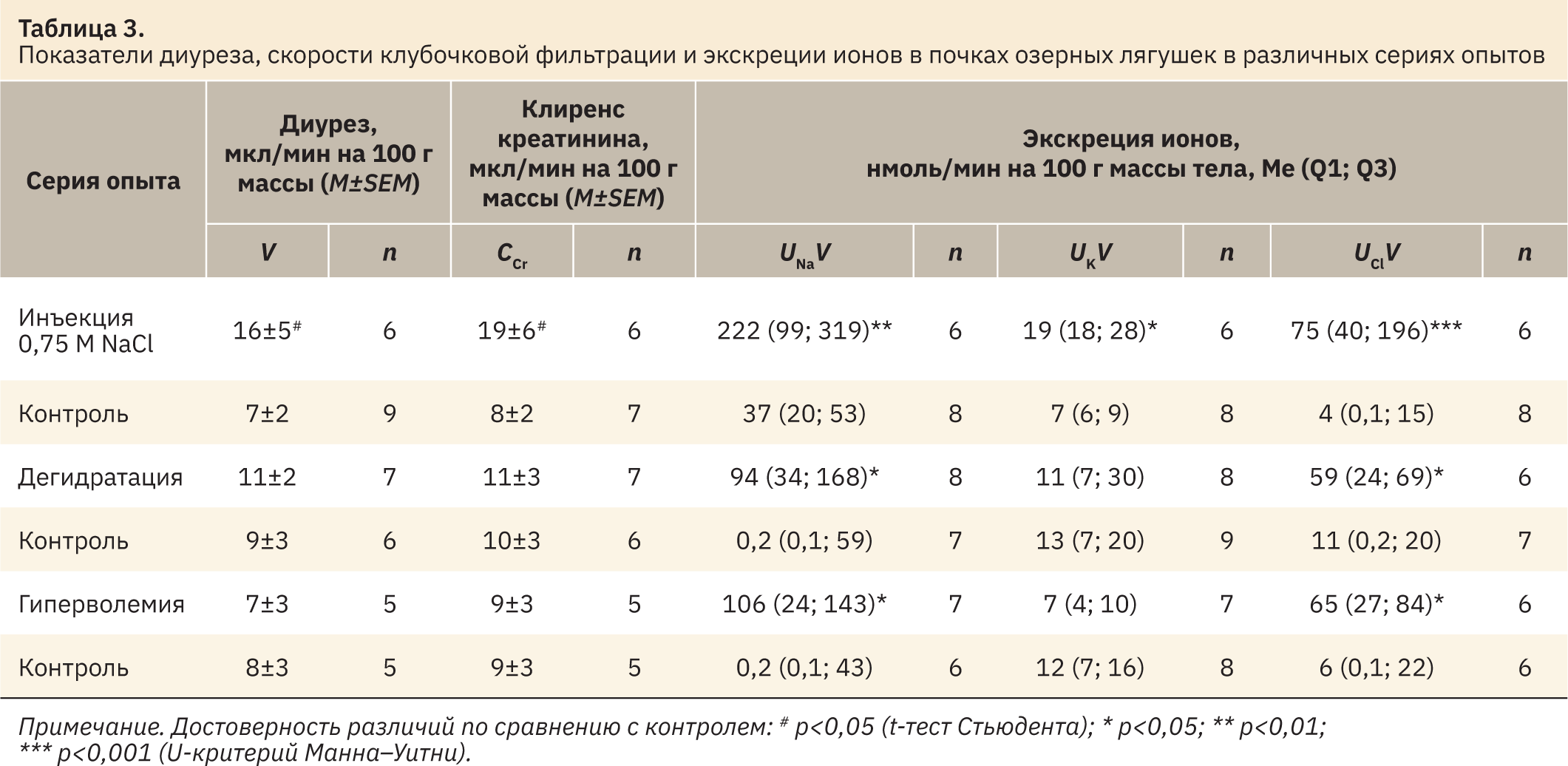
Измеренные у озерных лягушек показатели крови в контрольных сериях опытов были весьма стабильными, а существенные изменения установлены после инъекции гипертонического раствора или обезвоживания (табл. 1). Инъекция 0,75 М NaCl привела к достоверному увеличению концентрации Na+ и Cl– в крови и некоторому росту осмоляльности. При дегидратации увеличилась осмоляльность и концентрация Na+ и K+ крови, а после инъекций изотонического раствора все измеренные показатели не отличались от контроля. Концентрация измеренных ионов и осмоляльность мочи в контрольных условиях были низкими, что типично для полностью гидратированных амфибий. Наибольшая реакция почек была выявлена в ответ на инъекции NaCl, выражавшаяся в существенном повышении осмоляльности и концентрации Na+ и Cl– в моче (табл. 2). При этом установлено статистически значимое повышение минутного диуреза и клиренса креатинина (табл. 3). В условиях дегидратации и гиперволемии увеличилось только содержание в моче Na+ и Cl– при неизменной величине диуреза и СКФ. В то же время при анализе ионорегулирующей функции почек установлено усиление экскреции Na+ и Cl– в результате всех примененных воздействий (см. табл. 3).
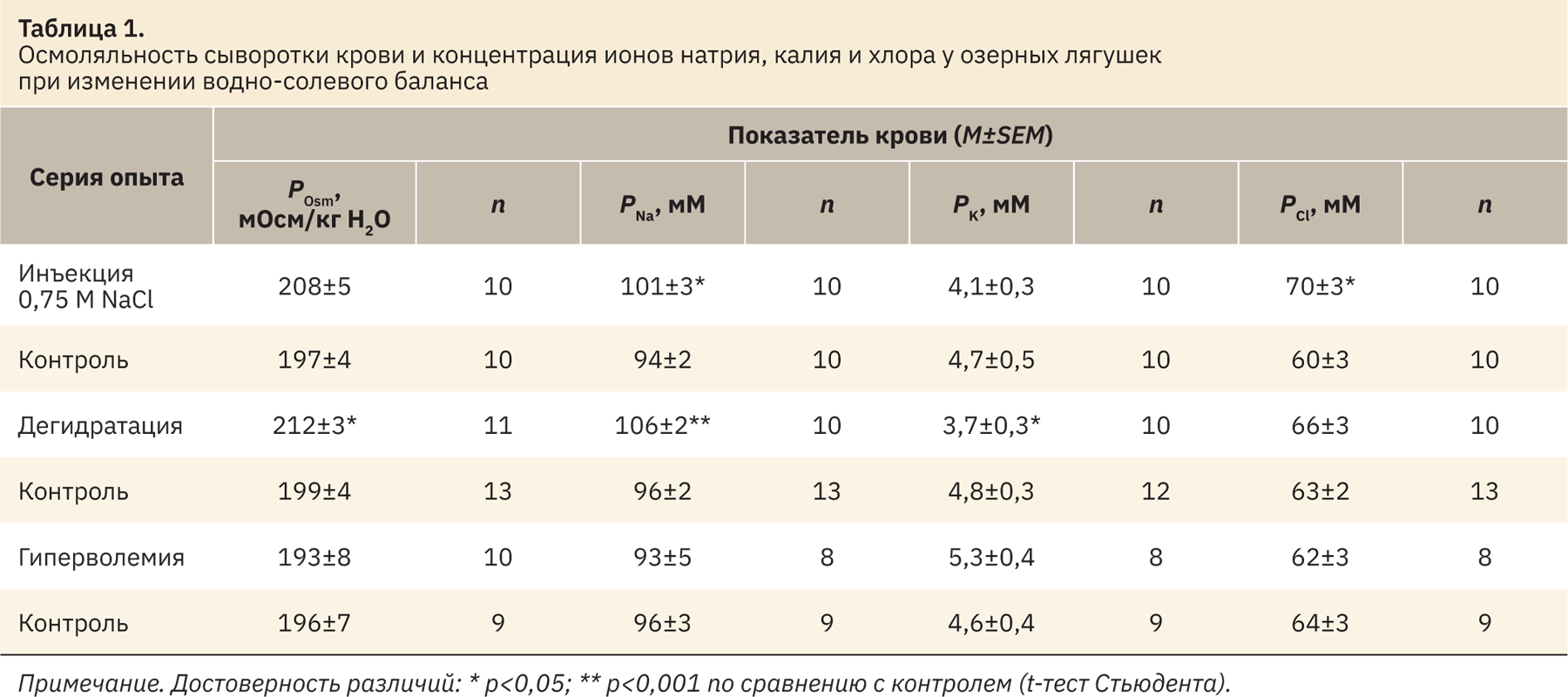
Показатели, измеренные в наших контрольных опытах у гидратированных озерных лягушек, были в пределах или ниже установленных ранее в сыворотке или плазме крови у отдельных видов бесхвостых амфибий. Так, у разных лягушек и жаб (Rana ridibunda, Rana temporaria, Bufo bufo, B. marinus) средние значения осмоляльности крови находились в диапазоне 180–240 мОсм/кг H2O [23, 25, 30, 31]. Более высокие значения (247–275 мОсм/кг H2O) приводятся для некоторых видов из южных мест обитания. К ним относятся R. ridibunda из Турции [32] и северного Израиля [33], R. silvatica из южного Огайо (США) [27], а также S. couchi, пустынная жаба из национального заповедника в Буэнос-Айресе [34]. Измеренная концентрация Na+ в крови у P. ridibundus оказалась сходной с таковой у B. marinus [30], съедобной лягушки Rana esculenta [24] и R. temporaria [31] — около 100 мМ. Это несколько ниже, чем у B. bufo [23], R. ridibunda [33], R. catesbeiana [35] и леопардовой лягушки Rana pipiens [24] — 117, 115, 116–121 и 133 мМ соответственно. Концентрация Cl– в крови у P. ridibundus была такой же, как у R. silvatica [27]. Более высокие значения (78–116 мМ) приводятся для R. catesbeiana [35], B. bufo [23] и зеленой жабы B. viridis [26].
Осмоляльность крови является строго регулируемым параметром ввиду направленности механизмов гомеостатической регуляции на стабилизацию объема клеток при изменении осмоляльности окружающей среды [3]. У разных видов амфибий различия в осмоляльности крови и содержании в ней натрия как основного иона могут быть обусловлены множеством факторов, а спектр адаптаций амфибий к повышенной солености среды, согласно недавнему обзору, значительно шире, чем полагали ранее [36]. В среде с повышенной соленостью у амфибий повышается концентрация Na+ и Cl– в плазме крови, снижаются выработка мочи и транспорт Na+ в коже [37]. Отмечена связь между осмоляльностью плазмы крови в норме и способностью амфибий выдерживать осмотический стресс, что происходит за счет увеличения в крови концентрации мочевины [26]. Так, некоторые наземные и полуводные виды амфибий могли адаптироваться к высокой солености среды (400 мМ NaCl) или длительному обезвоживанию (крабоядная лягушка R. cancrivora, а также жабы B. viridus и S. couchi). В контроле они имели более высокую осмоляльность плазмы крови (270–305 мОсм/кг H2O) и концентрацию мочевины по сравнению с плохо адаптирующимися видами, выживающими только в среде с умеренной соленостью (130–200 мМ NaCl). К последним относится большинство бесхвостых амфибий, включая озерных лягушек, у которых, согласно нашим опытам, осмоляльность крови в норме в среднем не превышала 200 мОсм/кг H2O.
Было продемонстрировано, что организм зимующих озерных лягушек способен реагировать на рост уровня натрия в крови, вызванный инъекцией 0,75 М NaCl, повышением осмоляльности мочи, усилением диуреза и экскреции Na+ и Cl– почками. У летних озерных лягушек при внутривенном введении раствора Рингера, содержащего NaCl в концентрации 6%, отмечены аналогичные изменения осмоляльности мочи [25]. Внутрибрюшинное введение 0,5–1,0 M NaCl лопатоногам незначительно повышало осмоляльность крови [28] как при введении 0,75 M NaCl в наших опытах. При длительной дегидратации (23 дня), приводившей к уменьшению содержания воды в организме R. silvatica на 10% относительно влажной массы тела, осмоляльность и концентрация Na+ и Cl– в плазме возрастали в 1,5 раза [27]. В наших опытах показано, что даже кратковременное обезвоживание (1 ч) у озерной лягушки приводило к достоверному увеличению осмоляльности и концентрации Na+ в сыворотке крови, хотя у лягушки-быка для повышения осмоляльности плазмы требовалось не менее 1,5–2,5 ч обезвоживания [29]. При дегидратации в отличие от инъекций NaCl также отмечено снижение концентрации K+ крови, по‑видимому, за счет поступления этого иона в клетки, поскольку его экскреция с мочой не увеличивалась. При гиперволемии показатели крови не изменялись, однако повышалась экскреция с мочой Na+ и Cl–. Гиперволемия у R. silvatica приводила к значительной вариабельности осмоляльности плазмы крови и содержания в ней этих ионов, но повышала осмоляльность мочи [27]. Величина СКФ во всех контрольных опытах оказалась весьма стабильной (порядка 8–10 мкл/мин на 100 г массы тела) и увеличивалась только после инъекций 0,75 M NaCl (см. табл. 3). В контроле и после инъекций NaCl у всех лягушек имела место реабсорбция GFP в значительном числе проксимальных канальцев. При маркировании проксимальных канальцев по мегалину хорошо видно, что GFP присутствует в большинстве мегалин-позитивных профилей канальцев (рис. 1, а, б).
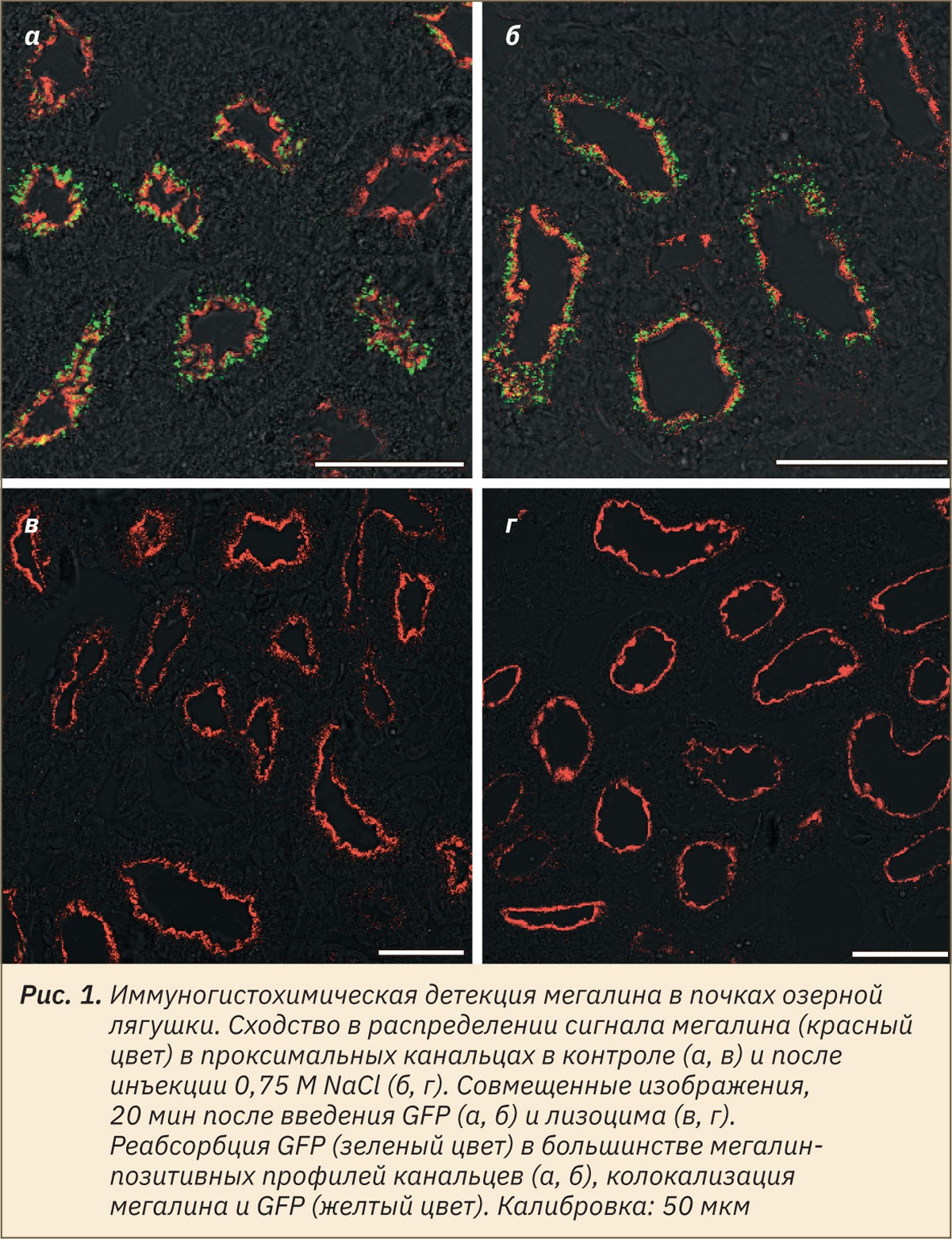
В целом статистически значимое увеличение уровня Na+ в крови у озерной лягушки после инъекции 0,75 M NaCl и обезвоживания (101±3 и 106±2 мМ против 96±3 мМ в контроле) находилось в пределах нормальных физиологических значений этого показателя у других видов амфибий, но было достаточным для усиления ионорегулирующей функции почек. Это побудило нас к сопоставлению паттерна ClC-5 в нефронах в контроле и после введения 0,75 М NaCl, то есть при усиленном поступлении в почечные канальцы осмотически активных веществ. Распределение ClC-5 анализировали в образцах, полученных в опытах с введением лизоцима, который в течение 20 мин после инъекции хорошо всасывается в эпителии проксимальных канальцев, что было показано ранее [16]. Присутствие в клетках мегалина как основного рецептора эндоцитоза служило важным показателем способности эпителиоцитов к захвату лизоцима, являющегося известным лигандом этого рецептора. После инъекций NaCl не наблюдалось изменений как паттерна мегалина по сравнению с контролем (рис. 1, в, г), так и величины сигнала, которая составила 32,7 (30,4; 36,1) и 31,0 (29,5; 32,7) усл. ед. соответственно (p>0,05; n=4 в каждой группе).
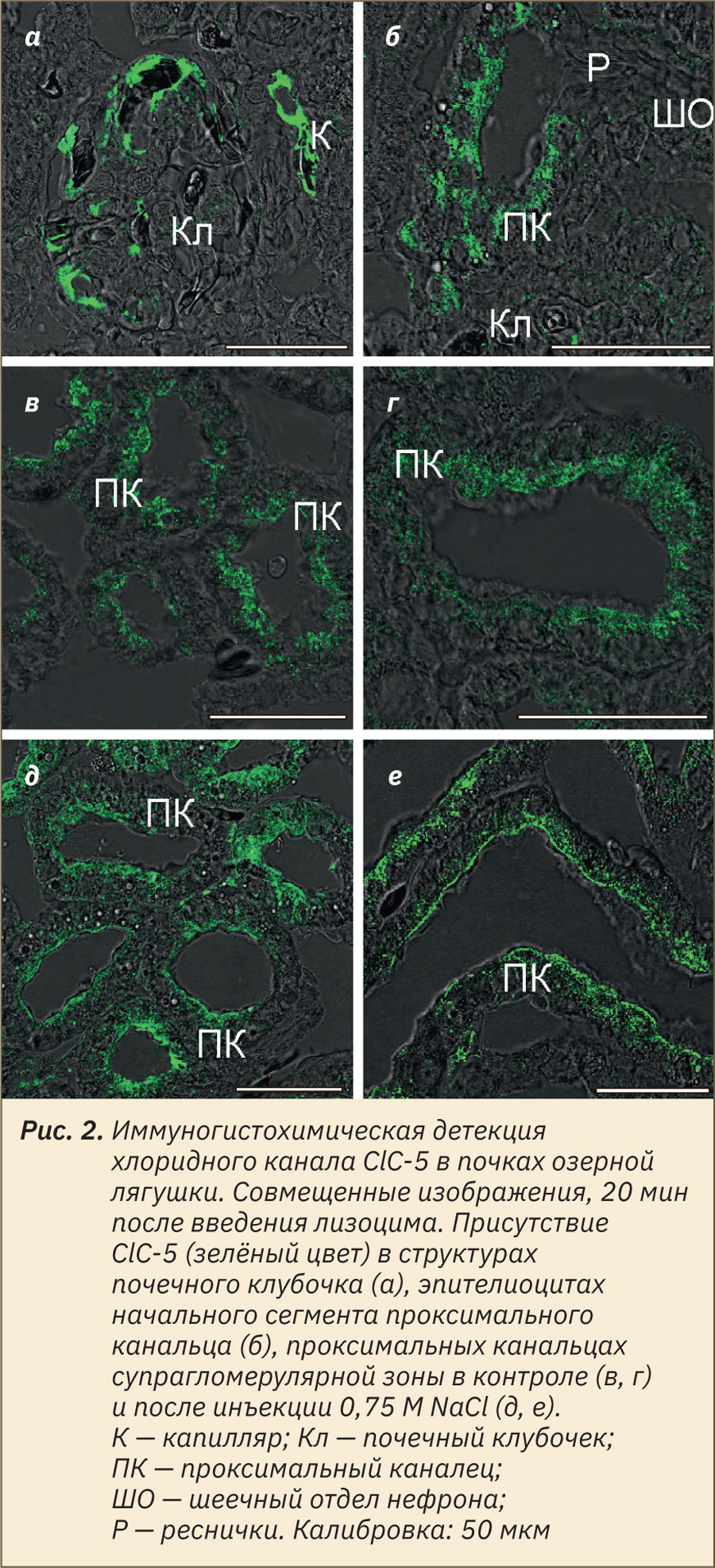
Метка к ClC-5 присутствовала в структурах почечных клубочков и эпителии проксимальных канальцев. Флуоресцентный сигнал был наиболее интенсивным в сосудистой сети клубочка и околоканальцевых капиллярах (рис. 2, а). Основываясь на свидетельствах участия ClC-5 в процессе эндоцитоза белка, распределение ClC-5 анализировали главным образом в эпителии проксимальных канальцев. По ходу проксимальных канальцев иммунофлуоресценция ClC-5 выявлялась, начиная с начальных сегментов, сразу после шеечного отдела, характеризующегося наличием реснитчатого эпителия (рис. 2, б). В эпителиоцитах контрольных образцов метка распределялась преимущественно в апикальной цитоплазме (рис. 2, в), а также в субапикальной и перинуклеарной зонах (рис. 2, б, г). При визуальной оценке сигнала после инъекций NaCl отмечено усиление свечения в апикальной зоне клеток (рис. 2, д), что в отдельных канальцах имело вид яркой узкой полосы непосредственно под щеточной каемкой (рис. 2, г).
Для количественной оценки иммунофлуоресценции ClC-5 в образцах ткани почек лягушек в контроле (n=4) и опыте (n=4) было идентифицировано по 480 проксимальных канальцев. Отмечена тенденция к увеличению (в процентах) иммунопозитивных профилей проксимальных канальцев после инъекций NaCl — 57 (51; 63) по сравнению с 47 (42; 54) в контроле (p>0,05, T-критерий Манна–Уитни). При дальнейшем анализе просмотрено 65 и 50 изображений и визуализировано 230 и 227 иммунопозитивных канальцев соответственно. Установлено увеличение интенсивности сигнала ClC-5 (в усл. ед.) в апикальной зоне эпителиальных клеток от 17,7 (15,4; 19,4) в контроле до 26,9 (23,6; 31,4) после инъекций NaCl (p<0,05), а также повышение максимума свечения от 154 (123; 178) до 211 (197; 225); p=0,057. Таким образом, при увеличении СКФ и усиленном поступлении в почечные канальцы осмотически активных веществ увеличивается количество ClC-5 в эпителии проксимальных канальцев. Это согласуется с наличием тесной связи между поступлением различных веществ с током жидкости в просвет почечных канальцев и последующей их реабсорбцией и транспортом в эпителиальных клетках. Ранее показано [38], что у мышей с мозаичной экспрессией ClC-5 в проксимальных канальцах происходит снижение аквапорина 1 в апикальной цитоплазме ClC-5‑негативных клеток и угнетение эндоцитоза белка. Исходя из установленных изменений паттерна ClC-5 в проксимальных канальцах после инъекции 0,75 M NaCl, для дальнейших исследований представляет интерес детальное изучение в этих условиях захвата и везикулярного транспорта экзогенных белков.
Заключение
В ходе проведенного сравнительного анализа эффектов однократных инъекций гипертонических и гипотонических растворов, а также обезвоживания на водно-солевой гомеостаз и экскрецию ионов почками у озерных лягушек показано, что инъекции 0,75 M NaCl озерным лягушкам оказались наиболее эффективными из примененных воздействий в отношении ионо- и осморегулирующей функций почек. Повышение концентрации Na+ и Cl– в крови сопровождалось усилением экскреции этих ионов с мочой и повышением экспрессии ClC-5 в проксимальных канальцах почек. Можно полагать, что дальнейшие опыты на лягушках в представленных физиологических моделях могут внести вклад в понимание функционирования молекулярных детерминант эпителиального канальцевого транспорта и эндоцитоза белка в почках при изменении водно-солевого гомеостаза.
Сведения о конфликте интересов
Авторы заявляют об отсутствии конфликта интересов.
Вклад авторов
Н.П. Пруцкова — концепция, дизайн и проведение экспериментов, конфокальная микроскопия, работа с изображениями, расчеты и статистический анализ данных, подготовка иллюстраций и текста публикации.
Е.В. Селивёрстова — дизайн экспериментов, сбор первичных данных, морфологические и иммуногистохимические исследования, конфокальная микроскопия, редактирование текста рукописи.
А.В. Кутина — измерения физиологических показателей, работа с табличным материалом, критический анализ полученных результатов, редактирование рукописи.
Список источников
-
Braun E.D., Dantzler W.H. Vertebrate renal system / In: Dantzler W.H. (ed.) Handbook of Physiology, Section 13. Comparative Physiology. Vol. I. New York: Oxford University Press, 1997. P. 481–576.
-
Burggren W.W., Warburton S. Amphibians as animal models for laboratory research in physiology // Ilar. J. 2007. Vol. 48. N. 3. P. 260–269. DOI: 10.1093/ilar.48.3.260.
-
Natochin Yu.V. Principles of evolution of the excretory organs and the system of homeostasis // J. Evol. Biochem. Phys. 2019. Vol. 55. N. 5. P. 398–410. DOI: 10.1134/S0022093019050077.
-
Schwake M., Friedrich T., Jentsch T.J. An internalization signal in ClC-5, an endosomal Cl-channel mutated in Dent’s disease // J. Biol. Chem. 2001. Vol. 276. N. 15. P. 12049–12054. DOI: 10.1074/jbc.M010642200.
-
Schmieder S., Lindenthal S., Ehrenfeld J. Cloning and characterisation of amphibian ClC-3 and ClC-5 chloride channels // Biochim. Biophys. Acta. 2002. Vol. 1566. N. 1–2. P. 55–66. DOI: 10.1016/s0005-2736(02)00594-1.
-
McCormick S.D., Bradshaw D. Hormonal control of salt and water balance in vertebrates // Gen. Comp. Endocrinol. 2006. Vol. 147. N. 1. P. 3–8. DOI: 10.1016/j.ygcen.2005.12.009.
-
Uchiyama M., Konno N. Hormonal regulation of ion and water transport in anuran amphibians // Gen. Comp. Endocrinol. 2006. Vol. 147. N. 1. P. 54–61. DOI: 10.1016/j.ygcen.2005.12.018.
-
Møbjerg N., Larsen E.H., Novak I. Ion transport mechanisms in the mesonephric collecting duct system of the toad Bufo bufo: microelectrode recordings from isolated and perfused tubules // Comp. Biochem. Physiol. A. Mol. Integr. Physiol. 2004. Vol. 137. N. 3. P. 585–595. DOI: 10.1016/j.cbpb.2003.11.015.
-
Konno N., Hyodo S., Yamada T. et al. Immunolocalization and mRNA expression of the epithelial Na+ channel α-subunit in the kidney and urinary bladder of the marine toad, Bufo marinus, under hyperosmotic conditions // Cell Tissue Res. 2007. Vol. 328. N. 3. P. 583–594. DOI: 10.1007/s00441‑007‑0383‑9.
-
Hünter M., Horisberger J.D., Stanton B., Giebisch G. The collecting tubule of Amphiuma. I. Electrophysiological characterization // Am. J. Physiol. Renal Physiol. 1987. Vol. 253. N. 6. P. F1263–F1272. DOI: 10.1152/ajprenal.1987.253.6.F1263.
-
Stoner L.C., Engbretson B.G., Viggiano S.C. et al. Amiloride-sensitive apical membrane sodium channels of everted Ambystoma collecting tubule // J. Membr. Biol. 1995. Vol. 144. N. 2. P. 147–156. DOI: 10.1007/BF00232800.
-
Jentsch T.J. Discovery of CLC transport proteins: cloning, structure, function, and pathophysiology // J. Physiol. 2015. Vol. 593. N. 18. P. 4091–4109. DOI: 10.1113/JP270043.
-
Christensen E.I., Birn H., Storm T. et al. Endocytic receptors in the renal proximal tubule // Physiology (Bethesda). 2012. Vol. 27. N. 4. P. 223–236. DOI: 10.1152/physiol.00022.2012.
-
Anzenberger U., Bit-Avragim N., Rohr S. et al. Elucidation of megalin/LRP2‑dependent endocytic transport processes in the larval zebrafish pronephros // J. Cell Sci. 2006. Vol. 119. Pt. 10. P. 2127–2137. DOI: 10.1242/jcs.02954.
-
Christensen E., Raciti D., Reggiani L. et al. Gene expression analysis defines the proximal tubule as the compartment for endocytic receptor-mediated uptake in the Xenopus pronephric kidney // Pflügers Arch. 2008. Vol. 456. N. 6. P. 1163–1176. DOI: 10.1007/s00424‑008‑0488‑3.
-
Seliverstova E.V., Prutskova N.P. Receptor-mediated endocytosis of lysozyme in renal proximal tubules of the frog Rana temporaria // Eur. J. Histochem. 2015. Vol. 59. N. 2. P. 2482. DOI: 10.4081/ejh.2015.2482.
-
Seliverstova E.V., Romanova I.V., Prutskova N.P. Molecular determinants of protein reabsorption in the amphibian kidneys // Acta Histochem. 2021. Vol. 123. N. 6. P. 151760. DOI: 10.1016/j.acthis.2021.151760.
-
Günther W., Lüchow A., Cluzeaud F. et al. ClC-5, the chloride channel mutated in Dent’s disease, colocalizes with the proton pump in endocytotically active kidney cells // Proc. Natl. Acad.Sci. U.S.A. 1998. Vol. 95. N. 14. P. 8075–8080. DOI: 10.1073/pnas.95.14.8075.
-
Wartosch L., Fuhrmann J.C., Schweizer M. et al. Lysosomal degradation of endocytosed proteins depends on the chloride transport protein ClC-7 // FASEB J. 2009. Vol. 23. N. 12. P. 4056–4068. DOI: 10.1096/fj.09-130880.
-
Hara-Chikuma M., Yang B., Sonawane N. D. et al. ClC-3 chloride channels facilitate endosomal acidification and chloride accumulation // J. Biol. Chem. 2005. Vol. 280. N. 2. P. 1241–1247. DOI: 10.1074/jbc.M407030200.
-
Christensen E.I., Devuyst O., Dom G. et al. Loss of chloride channel ClC-5 impairs endocytosis by defective trafficking of megalin and cubilin in kidney proximal tubules // Proc. Natl. Acad. Sci. U.S.A. 2003. Vol. 100. N. 14. P. 8472–8477. DOI: 10.1073/pnas.1432873100.
-
Rickheit G., Wartosch L., Schaffer S. et al. Role of ClC-5 in renal endocytosis is unique among CLC exchangers and does not require PY-motif-dependent ubiquitylation // J. Biol. Chem. 2010. Vol. 285. N. 23. P. 17595–17603. DOI: 10.1074/jbc.M110.115600.
-
Ferreira H.G., Jesus C.H. Salt adaptation in Bufo bufo // J. Physiol. 1973. Vol. 228. N. 3. P. 583–600. DOI: 10.1113/jphysiol.1973.sp010101.
-
Scheer B.T., Mumbach M.W. Fluxes of sodium ion in frogs (Rana esculenta) acclimated to solutions of NaCl in lake water and effects of hypophysectomy // Comp. Biochem. Physiol. 1982. Vol. 72A. N. 3. P. 549–558. DOI: 10.1016/0300-9629(82)90121-9.
-
Nouwen E.J., Kühn E.R. Volumetric control of arginine vasotocin and mesotocin release in the frog (Rana ridibunda) // J. Endocrinol. 1985. Vol. 105. N. 3. P. 371–377. DOI: 10.1677/joe.0.1050371.
-
Katz U. Strategies of adaptation to osmotic stress in anuran amphibian under salt and burrowing conditions // Comp. Biochem. Physiol. 1989. Vol. 93A. N. 3. P. 499–503.
-
Muir T.J., Costanzo J.P., Lee R.E. Jr. Osmotic and metabolic responses to dehydration and urea-loading in a dormant, terrestrially hibernating frog // J. Comp. Physiol. B. 2007. Vol. 177. N. 8. P. 917–926. DOI: 10.1007/s00360‑007‑0190‑3.
-
Mayer L.P., Propper C.R. Intra- and extracellular dehydration has no effect on plasma levels of angiotensin II in an amphibian // J. Exp. Zool. 2000. Vol. 286. N. 4. P. 343–349. DOI: 10.1002/(sici)1097-010x(20000301)286:4<343::aid-jez2>3.0.co;2‑z.
-
Pang P.K.T. Osmoregulatory functions of neurohypophysial hormones in fishes and amphibians // Amer. Zoologist. 1977. Vol. 17. P. 739–749.
-
Konno N., Hyodo S., Matsuda K., Uchiyama M. Effect of osmotic stress on expression of a putative facilitative urea transporter in the kidney and urinary bladder of a marine toad, Bufo marinus // J. Exp. Biol. 2006. Vol. 209. Pt. 7. P. 1207–1216. DOI: 10.1242/jeb.02123.
-
Kutina A.V., Marina A.S., Natochin Yu.V. Effects of exenatide on glycemia and renal water and ion excretion differ in frogs and rats // J. Evol. Biochem. Physiol. 2016. Vol. 52. N. 3. P. 228–237.
-
Voituron Y., Eugene M., Barré H. Survial and metabolic re4sponses to freezing by the water frog (Rana ridibunda) // J. Exp. Zool. 2003. Vol. 299. N. 2. P. 118–126. DOI: 10.1002/jez.a.10285.
-
Katz U. NaCl adaptation in Rana ridibunda and a comparison with the euryhaline toad Bufo viridis // J. Exp. Biol. 1975. Vol. 63. N. 3. P. 763–773. DOI: 10.1242/jeb.63.3.763.
-
Johnson W.E., Propper C.R. Effects of dehydration on plasma osmolality, thirst-related behavior, and plasma and brain angiotensin concentrations in Couch’s spadefoot toad, Scaphiopus couchii // J. Exp. Zool. 2000. Vol. 286. N. 6. P. 572–584. DOI: 10.1002/(sici)1097-010x(20000501)286:6<572::aid-jez4>3.0.co;2‑b.
-
Coppo J.A., Mussart N.B., Fioranelli S.A. Blood and urine physiological values in farm-cultured Rana catesbeiana (Anura: Ranidae) in Argentina // Rev. Biol. Trop. 2005. Vol. 53. N. 3–4. P. 545–559. DOI: 10.15517/rbt.v53i3-4.14669.
-
Hopkins G.R., Brodie E.D.Jr. Occurrence of amphibians in saline habitats: A review and evolutionary perspective // Herpetological Monographs. 2015. Vol. 29. P. 1–27. DOI: 10.1655/HERPMONOGRAPHS-D-14-00006.
-
Balinsky J.B. Adaptation of nitrogen metabolism to hyperosmotic environment in Amphibia // J.Exp. Zool. 1981. Vol. 215. N. 3. P. 335–350. DOI: 10.1002/jez.1402150311.
- Pohl M., Shan Q., Petsch T. et al. Short-term functional adaptation of aquaporin-1 surface expression in the proximal tubule, a component of glomerulotubular balance // J. Am. Soc. Nephrol. 2015. Vol. 26. P. 1269–1278. DOI: 10.1681/ASN.2014020148.




