Вариабельность биохимических показателей крови и установление референтных интервалов в доклинических исследованиях. Сообщение 9: кошки
Работа выполнена без спонсорской поддержки.
Мирошников М.В., Султанова К.Т., Ковалева М.А., Макарова М.Н. Вариабельность биохимических показателей крови и установление референтных интервалов в доклинических исследованиях. Сообщение 9: кошки. Лабораторные животные для научных исследований. 2023; 1. https://doi.org/10.57034/2618723X-2023-01-03
Резюме
Этиопатогенез многих заболеваний и патологических состояний кошек и человека в значительной степени схож между собой. К их числу можно отнести лейкемию, болезнь Альцгеймера, сердечно-сосудистые заболевания, инфекции, иммунодефицитные состояния, ожирение, сахарный диабет и патологию сетчатки. Ввиду этого кошка может быть моделью выбора в доклинических исследованиях для изучения данных заболеваний, разработке новых методов хирургической коррекции, а также в тестировании новых фармакологических субстанций. В связи с широким привлечением кошек в доклинические исследования возникает проблема мониторинга нормального состояния организма и регистрации протекания жизненно важных процессов. Биохимический анализ сыворотки крови лабораторных животных является рутинной частью доклинических центров, который является неотъемлемой частью оценки состояния организма. Как правило, полученные значения интерпретируются путем сравнения с референтным интервалом. Референтный интервал, или диапазон нормы, в доклинических исследованиях — это не только интервал значений, который считается физиологической нормой, но и основа, точка отсчета для исследователя при интерпретации полученного набора результатов и дальнейшего определения наличия или отсутствия патологического процесса у лабораторных животных. Цель данной работы — установление основных биохимических показателей в сыворотке крови кошек породы русская голубая. Данные, используемые для формирования референтных интервалов, были получены от интактных животных за временной период май–ноябрь 2022 г. в АО «НПО «ДОМ ФАРМАЦИИ». В исследование были включены кошки: 30 самцов и 28 самок (небеременные и нерожавшие, без учета фазы менструального цикла). Возраст животных соответствовал диапазону 6–12 мес. В сыворотке крови животных регистрировали такие показатели, как креатинин, мочевина, аланинаминотрансфераза, аспартатаминотрансфераза, щелочная фосфатаза, холестерин, триглицериды, общий белок, альбумин, глюкоза, креатинкиназа, лактатдегидрогеназа и общий билирубин. При сравнении полученных интервалов с референтными значениями из источников литературы показано, что в целом диапазоны рассматриваемых показателей схожи. При сопоставлении референтных интервалов биохимических показателей крови кошек с таковыми у человека сделан вывод, что верхняя граница таких показателей, как креатинин, мочевина, аспартатаминотрансфераза, аланинаминотрансфераза, глобулины, креатинкиназа, глюкоза (самки) и лактатдегидрогеназа, выше у лабораторных животных. Верхняя граница показателей уровня холестерина, триглицеридов, альбумина, соотношения альбуминов и глобулинов и общего билирубина ниже у кошек, чем у человека. Установленные в исследовании референтные интервалы биохимических показателей крови кошек породы русская голубая являются полезным инструментом в области доклинических исследований и могут быть применены для мониторинга здоровья животных, поддержания адекватности сформированной патологической модели и изучения токсикологических свойств новых химических веществ.
Введение
В настоящее время кошки в качестве лабораторных животных используются не более чем в 2% экспериментов. Однако они вносят уникальный вклад в науку. Особые биологические характеристики делают их незаменимыми в области экспериментальной неврологии, офтальмологии, исследовании ретровирусов, наследственных и иммунодефицитных заболеваний [1].
Домашняя кошка (Felis cattus) является одним из немногих млекопитающих, для которых была собрана обширная информация о геноме. Этот необычный акцент обусловлен значительным числом естественных наследственных заболеваний, которые полезны в качестве моделей их аналога у человека, например, восприимчивость к вирусу лейкемии и вирусу иммунодефицита кошек [2].
У рассматриваемого вида животных самая высокая частота естественных лимфоидных злокачественных новообразований среди всех неродственных млекопитающих. Вирус кошачьей лейкемии (FeLV) представляет собой онковирус, который вызывает лимфосаркому, лейкемию и апластическую анемию у кошек. Создание данной патологии у рассматриваемых животных считается важной моделью для нескольких характеристик ретровирусно-индуцированных заболеваний, особенно гематопоэтических опухолей, таких как острый лимфобластный лейкоз и лимфома. Вирус также вызывает иммунодефицит и миелосупрессию у животных. После заражения у кошек сохраняется виремия, и вирус выделяется, в частности, со слюной и выделениями из носа [3].
Заболевание кошек, вызываемое вирусом иммунодефицита кошек (FIV), считается одним из наиболее актуальных естественных моделей синдрома приобретенного иммунодефицита. Преимущества модели кошачьей болезни включают сходство не только с вирусом иммунодефицита человека (лентивирусом человека), но также имеют похожие патогенез и клинические признаки, легкость экспериментального заражения и предсказуемое прогрессирование заболевания. Характерные изменения в иммунной системе — это лимфаденопатия, нейтропения, снижение пролиферативного ответа лимфоцитов и повышенная восприимчивость к оппортунистическим инфекциям [4].
Еще одним примером схожего протекания патологического процесса у человека и кошки является модель инфицирования Helicobacter. Helicobacter pylori — этиологический агент, ответственный за последовательность дегенеративных изменений в слизистой оболочке желудка человека, начиная с гастрита, прогрессирующего до пептической язвы, и заканчивая раком желудка. Helicobacter felis может точно воспроизводить все повреждения, обнаруженные при заболевании человека (кроме язв), особенно те, которые связаны с хронической инфекцией [5].
Другими примерами вовлеченности кошек в доклинические исследования являются модели неинфекционных заболеваний, например, сердечно-сосудистые. Описаны три основных типа спонтанной кардиомиопатии у кошек: гипертрофическая, застойная (дилатационная) и рестриктивная. Гипертрофическая кардиомиопатия в настоящее время является наиболее распространенным спонтанным заболеванием сердца у кошек, поражающим 10–15% популяции, и схожа с симптоматикой и течением этого заболевания у человека [6, 7].
Кошки также используются в доклинических исследованиях, направленных на изучение патобиохимических и фармакологических аспектов ожирения и сахарного диабета [8, 9]. Кошки с ожирением имеют повышенное количество внутри- и внемиоцеллюлярного жира [10], что у людей обычно связано с потерей чувствительности к инсулину [11]. Повышенное количество жира в мышцах связано с изменением экспрессии и активности липопротеинлипазы. Этот фермент приобретает более высокую активность в мышечной ткани, что приводит к распределению жирных кислот в мышцах [10]. Было показано, что как глюконеогенный, так и гликогенолитический вклад в производство глюкозы в печени кошек (худых и страдающих ожирением) аналогичен тому, который был зарегистрирован у людей [12]. У рассматриваемых животных повышенная масса тела и инсулинорезистентность также сопровождаются нарушениями в соотношении липопротеинов, аналогичными тем, которые наблюдаются у людей. У кошек с ожирением отмечается увеличение уровня свободных неэтерифицированных жирных кислот, липопротеинов очень низкой плотности и триглицеридов в крови [13].
Другим примером использования кошек как модели in vivo в доклинических исследованиях является изучение противовоспалительной активности новых фармакологических агентов. Была разработана эффективная модель подкожного введения каолина кошке, а также показано, что данная инъекция в лапу животного вызывает четко выраженный, воспроизводимый и обратимый воспалительный ответ [14].
Еще одним примером использования кошек в доклинических исследованиях являются офтальмологические исследования. Популяции собак и кошек имеют большой потенциал для использования в качестве крупных экспериментальных животных ввиду сходства заболеваний сетчатки с таковыми у человека [15].
Кошки и собаки подвержены широкому перечню различных онкологических заболеваний [16, 17]. Поскольку у грызунов значительно реже развиваются онкологические заболевания и протекают иным образом, чем у человека, крупные животные являются незаменимыми моделями для изучения этиопатогенеза, фармакологической и хирургической коррекции данных заболеваний. К числу наиболее часто моделируемых онкологических патологий относят неходжкинскую лимфому [18], рак молочной железы [19], рак легких [20] и опухоли головы и шеи [21].
Известно, что функциональная активность семейства CYP1 кошек схожа с человеческим аналогом, но протекает интенсивнее, чем у человека, а подсемейства CYP2A и CYP2Е кошек осуществляют каталитическую активность медленнее, чем человеческие аналоги. Ортологи CYP2В и CYP2C у кошек либо совсем не экспрессируются в печени животного, либо в очень незначительных количествах, тем самым они не играют значительной роли в метаболизме лекарственных веществ, который связан в основном с данными подсемействами. Подсемейство CYP2D у кошек аналогично таковому человека, а активность подсемейства CYP3А значительно ниже, чем у человека. Таким образом, метаболизм фармакологического агента у кошек протекает аналогично таковому у человека, если в основном он связан с семейством CYP1 или подсемействами CYP2A, CYP2Е, CYP2D [22, 23].
Ввиду широкой вовлеченности кошек в доклинические исследования возникает проблема контроля нормального состояния организма и регистрации протекания жизненно важных биохимических процессов.
Цель данной статьи — установление референтных интервалов основных биохимических показателей в сыворотке крови кошек. Данная информация необходима в доклинических исследованиях для контроля мониторинга здоровья животных, моделирования патологического процесса и тестирования новых фармакологических агентов.
Материал и методы
Данные, используемые для формирования референтных интервалов, были получены от интактных животных за временной период май–ноябрь 2022 г. в АО «НПО «ДОМ ФАРМАЦИИ». Проведенные манипуляции и эксперименты были одобрены биоэтической комиссией. В исследование включены кошки породы русская голубая: 30 самцов и 28 самок (небеременные и нерожавшие, без учета фазы менструального цикла). Возраст животных соответствовал диапазону 6–12 мес, масса тела самцов и самок была в пределах 3–5 кг. Животных содержали в одинаковых стандартных условиях вивария: температура воздуха 22–26 °С, относительная влажность 40–75%, 12‑часовой световой день. Кормление животных проводили в соответствии с Директивой 2010/63/EU Европейского парламента и Совета Европейского союза от 22 сентября 2010 г. по охране животных, используемых в научных целях. Исследование выполнено с соблюдением принципов Европейской конвенции о защите позвоночных животных, используемых для экспериментов и других научных целей (Страсбург, 1986), и в соответствии с правилами надлежащей лабораторной практики. Определение интересующих биохимических показателей проводили в одинаковых условиях с использованием общепринятых преаналитических и аналитических методов. Забор крови у кошек производился из передней подкожной вены предплечья. Для фиксации животного использовали елизаветинский (ветеринарный) воротник. Забор крови происходил в несколько этапов. Первым этапом была подготовка — удаление шерсти вдоль расположения вены и дезинфекция кожи, затем кожа непосредственно перед проколом должна была высохнуть. После этого накладывали жгут, чтобы визуализировать вены. Далее осуществляли прокол и постепенное продвижение иглы вдоль сосуда, забор крови в пробирку и перемешивание с антикоагулянтом. После данных манипуляций жгут снимали и накладывали давящую повязку на 10–15 мин для предотвращения образования гематомы. Кровь собирали натощак без седации и анестезии в вакуумные пластиковые пробирки с активатором свертывания и гелем (ООО «КОРВЕЙ», Россия). Затем, для получения сыворотки, кровь центрифугировали в течение 15 мин при 3000 об/мин на центрифуге ОПн-3.04 «Дастан» (Киргизия). Полученную сыворотку переносили в стерильные пробирки, в которых определяли биохимические показатели. В сыворотке крови животных на автоматическом биохимическом анализаторе Rendom Access A-25 (BioSystems, Испания) с использованием соответствующих наборов регистрировали следующие показатели: креатинин, мочевина, аланинаминотрансфераза (АЛТ), аспартатаминотрансфераза (АСТ), щелочная фосфатаза, холестерин, триглицериды, общий белок, альбумин, глюкоза, креатинкиназа, лактатдегидрогеназа и общий билирубин. Концентрацию общего билирубина определяли с помощью набора реактивов («Вектор-Бест», Россия), уровень остальных аналитов рассчитывали, применяя биохимические наборы (BioSystems, Испания). Все статистические расчеты проводили с использованием программы GraphPad Prism 9.0 (США), статистические выбросы оценивали с помощью метода Тьюки, который был описан ранее [24–26], вид распределения определяли, используя критерий Шапиро–Уилка, парные сравнения между животными разного пола проводили с применением U-критерия Манна–Уитни и t-критерия Стьюдента.
Результаты и обсуждение
Из анализа были исключены значения, называемые «жесткие» и «мягкие» выбросы, то есть данные, лежащие за пределами интервала Q3 и Q1 (1‑го и 3‑го квартилей). Верхний и нижний пределы рассчитывали следующим образом:
Q1–1,5IQR и Q3+1,5IQR.
Данные о доле статистических выбросов по каждому показателю и выходящие за пределы референтных интервалов представлены в табл. 1.
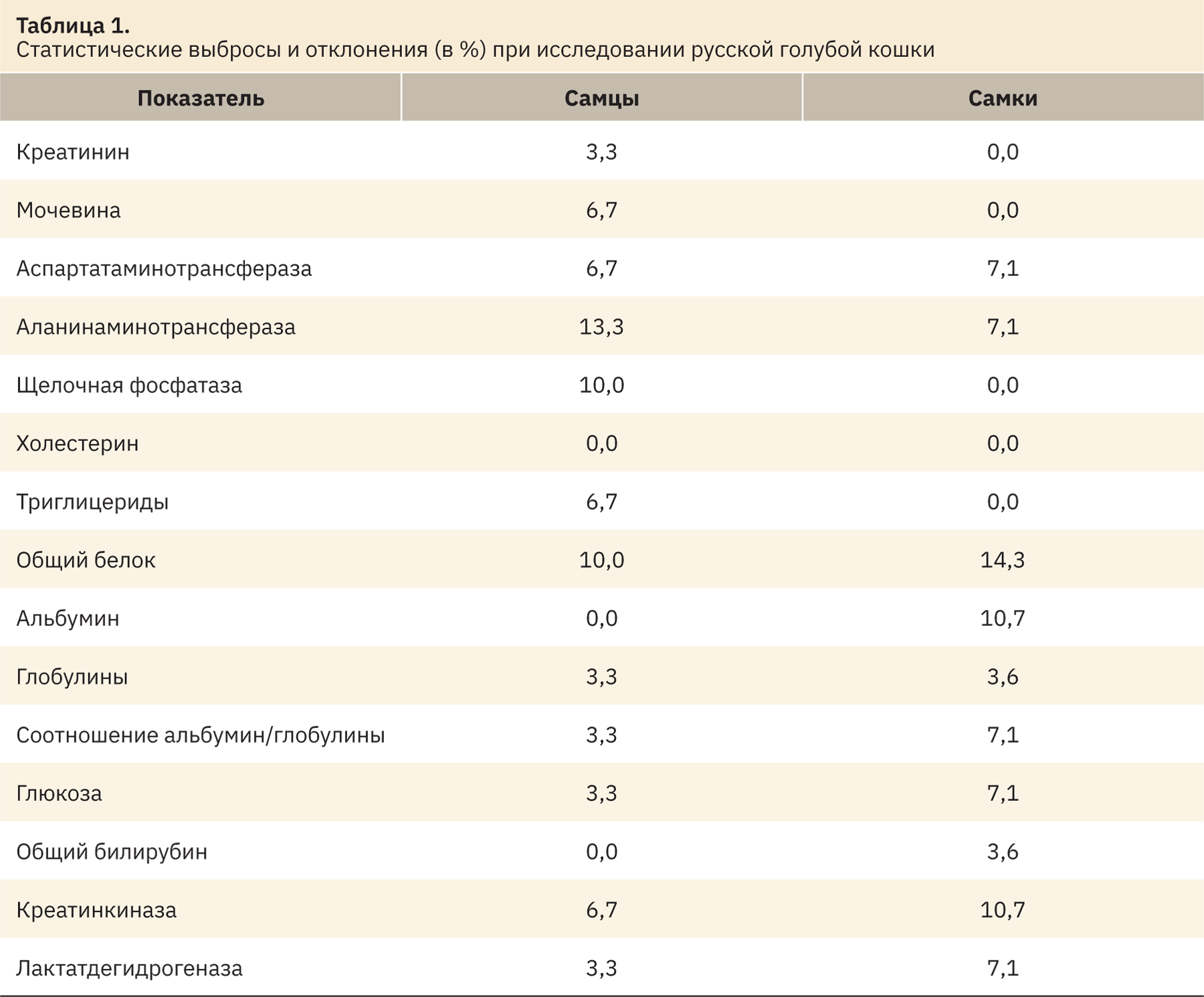
Наибольшие статистические выбросы и отклонения среди биохимических показателей крови самцов зарегистрированы в отношении АЛТ — 13,3%, щелочной фосфатазы и общего белка — 10% (см. табл. 1). Также были зарегистрированы статистические отклонения менее 10% по таким показателям, как мочевина, АСТ, триглицериды и креатинкиназа — 6,7%, а также креатинин, глобулины, соотношение альбумин/глобулины, глюкоза и лактатдегидрогеназа — 3,3%. По показателям холестерина, альбуминов и общего билирубина статистических выбросов замечено не было. У самок наибольшие статистические отклонения зарегистрированы в отношении общего белка — 14,3%, альбумина и креатинкиназы — 10,7%. Среди таких показателей, как АСТ, АЛТ, соотношение альбумин/глобулины, глюкоза и лактатдегидрогеназа, статистические выбросы составили 7,1%, отклонения глобулинов и общего билирубина — 3,6%. Среди таких показателей, как креатинин, мочевина, щелочная фосфатаза, холестерин и триглицериды, статистических выбросов не зарегистрировано.
Вид распределения полученных значений определяли по критерию Шапиро–Уилка. В зависимости от вида распределения референтные интервалы рассчитывали следующим образом:
Хср±1,96SD — для нормального распределения;
2,5–97,5‰ — для ненормального распределения (табл. 2).
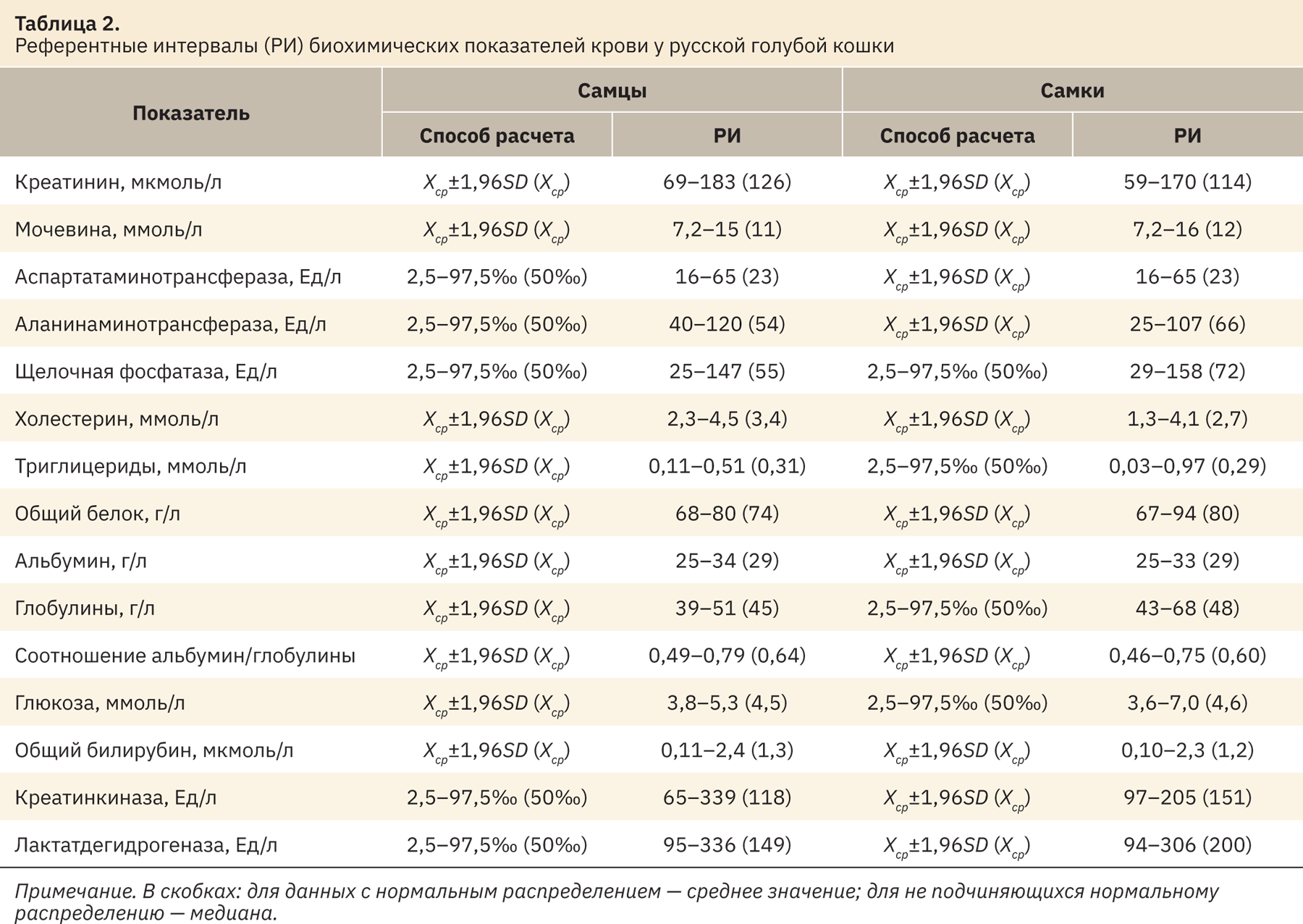
В табл. 2 представлены результаты референтных интервалов биохимических показателей крови кошек.
Полученные диапазоны значений самцов и самок кошек породы русская голубая сопоставимы между собой по всем рассматриваемым показателям, статистической разницы не выявлено (см. табл. 2).
При сравнении полученных интервалов с референтными значениями из источников литературы (табл. 3) показано, что в целом диапазоны рассматриваемых показателей схожи, но присутствуют и различия. Так, по ряду источников ширина рассчитанных референтных диапазонов креатинина, щелочной фосфатазы, холестерина, альбумина, глобулинов, соотношение альбумин/глобулины, глюкозы, общего билирубина, креатинкиназы и лактатдегидрогеназы оказалась меньше, а мочевины, наоборот, больше. Данные различия могут быть связаны с преаналитическими и аналитическими особенностями проведения анализа, породы животных и условий их содержания. Именно поэтому лучшим решением для всех доклинических центров является установление своих собственных референтных интервалов лабораторных животных. Нормальные диапазоны АСТ, АЛТ и общего белка оказались схожи с аналогичными из данных литературы.
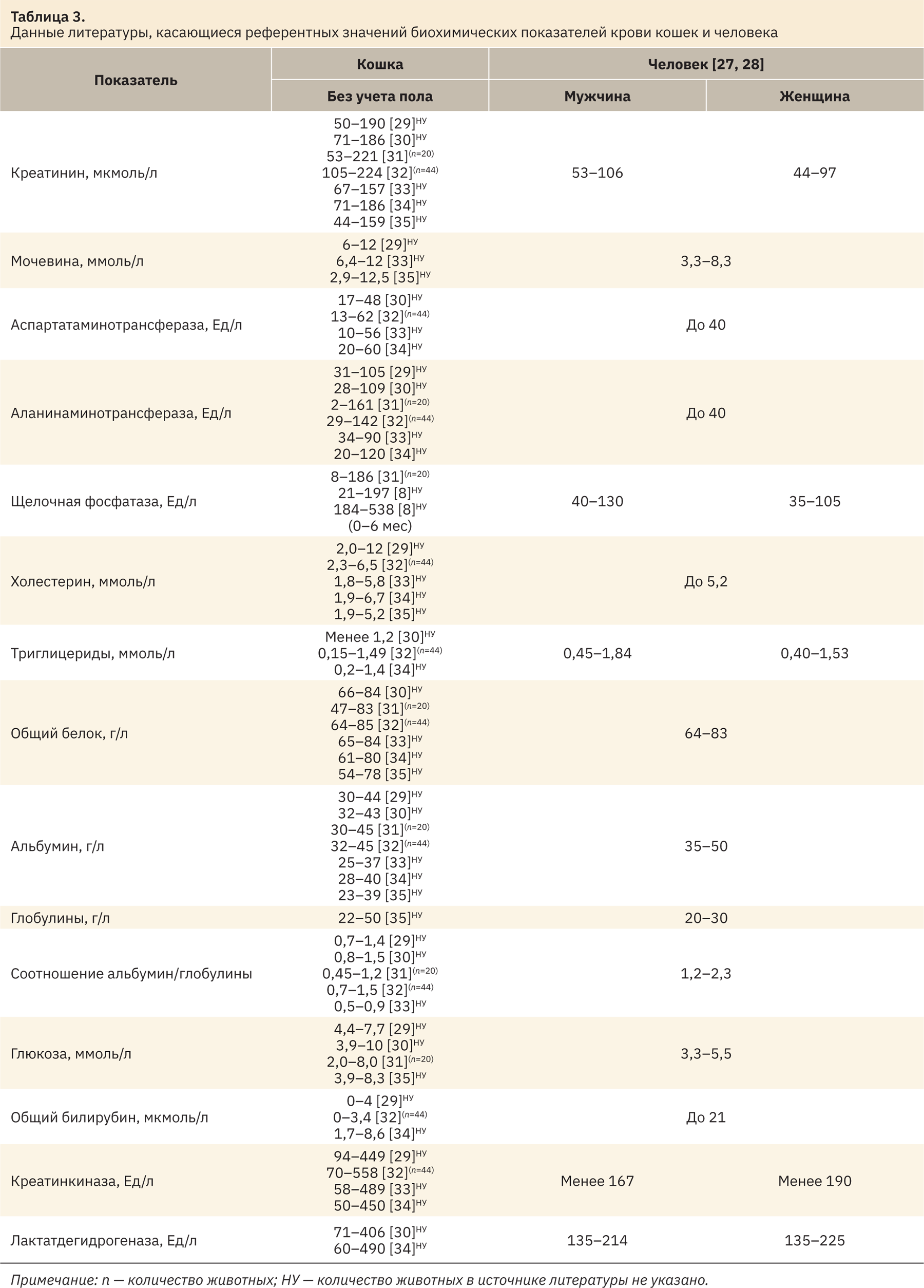
Сопоставляя полученные референтные интервалы биохимических показателей крови кошек породы русская голубая и соответствующие референтные интервалы человека (см. табл. 3), можно сделать вывод, что верхняя граница диапазона показателей креатинина, мочевины, АСТ, АЛТ, глобулинов, креатинкиназы, глюкозы (самки) и лактатдегидрогеназы выше у лабораторных животных. Верхняя граница интервалов холестерина, триглицеридов, альбумина, соотношения альбумин/глобулины и общего билирубина ниже у кошек, чем у человека. Рассчитанные интервалы общего белка и глюкозы (самцы) соответствуют таковым двух видов.
Биохимическое исследование крови позволяет выявить субклинические и клинические заболевания кошки, определить работу ферментативной системы организма и дать информацию о поражении того или иного органа лабораторного животного. Ниже указана характеристика представленных в статье биохимических показателей крови данного вида животных, а также рассмотрены наиболее распространенные патологические и физиологические состояния, при которых происходят изменения этих показателей у человека и кошек (табл. 4).

Уровень глюкозы иногда может быть повышен у рассматриваемых животных с сахарным диабетом. Самая распространенная причина повышенного уровня глюкозы у животных — стресс в момент взятия крови в результате секреции катехоламинов и стимуляции глюконеогенеза. Быстро определить, является ли повышение уровня глюкозы временным или постоянным, можно проведя общий анализ мочи. При хронически повышенном уровне глюкозы он также будет увеличен и в моче. У кошек сахарный диабет часто возникает вследствие сочетанного нарушения секреции инсулина и дефекта инсулиновых рецепторов, а также гипергликемия может развиться на фоне действия гормонов, таких как глюкагон, тироксин, гестагены и эстрогены. Низкий уровень сахара в крови встречается реже и бывает признаком рака поджелудочной железы или обширной инфекции, например, сепсиса. Низкий уровень сахара в крови может вызвать депрессию у животного или судороги [1, 36, 37].
Общий белок в крови отражает состояние аминокислотного обмена в организме, включает альбумин и более крупные белки, называемые глобулинами. Белки в организме животного принимают участие практически во всех жизненных процессах, важно как их повышенное, так и пониженное количество. Уровень общего белка может быть увеличен, если кошка обезвожена, или иммунная система животного стимулирует выработку большого количества антител. Общий белок снижается, если у животного нарушена работа иммунной системы, в результате чего не вырабатываются антитела, а также ввиду неправильного питания, истощения организма, заболевания печени и почек, осложнения сахарного диабета, анемии, последствий кровотечения, прогрессирования онкологических заболеваний, ВИЧ [38, 39].
Альбумин представляет собой белок, вырабатываемый печенью. В организме кошки он выполняет большое количество функций (перенос питательных веществ, сохранение резервных запасов аминокислот для организма, поддержание осмотического давления крови и др.). Ацетилсалициловая кислота в повышенных дозах снижает уровень альбумина. Тестостерон, эстроген и гормон роста могут вызвать легкое увеличение концентрации альбумина в крови. Высокие дозы глюкокортикоидов способны привести к незначительному увеличению уровня альбумина. Противосудорожные и противоопухолевые препараты у кошек не вызывают гипоальбуминемию сами по себе, без соответствующих причин, лежащих в основе снижения уровня альбумина (например, цирроз печени). Содержание альбумина снижается в случае повреждения печени, кишечника или почек [38, 39]. Глобулины делятся на α/β/γ. Количество α-глобулинов повышается при острых и подострых поражениях печени, процессах тканевого распада, клеточной инфильтрации, злокачественных новообразованиях и нефротическом синдроме, снижение наблюдается при сахарном диабете и токсических гепатитах. Количество β-глобулинов повышается при заболеваниях печени, нефротическом синдроме, кровоточащей язве желудка, гипотиреозе. Уровень γ-глобулинов повышается при хронических заболеваниях, циррозе печени, хроническом лимфолейкозе, эндотелиомах, остеосаркомах, кандидомикозе. Снижение наблюдается при истощении иммунной системы [38, 39].
Холестерин — структурный компонент, обеспечивающий прочность клеточных структур, принимает участие в синтезе многих жизненно важных гормонов. У кошек редко бывает повышенный уровень холестерина. При некоторых заболеваниях (гипотиреоз, болезнь Кушинга, диабет и болезни почек), вызывающих повышенный уровень холестерина, происходит потеря белка с мочой. Высокий уровень холестерина не приводит у кошек к развитию патологий сердца и сосудов, как у людей [38, 40].
Измерение уровня общего билирубина в сыворотке крови кошек проводится при выявлении желтухи, билирубинурии или при подозрении на заболевания печени. При повышении в крови конъюгированного билирубина (например, при патологии гепатобилиарной системы или обструкции желчных протоков) последний связывается с сывороточными альбуминами ковалентной и нековалентной связью. Ковалентно связанный с альбумином билирубин (дельта-билирубин, или билипротеин) выводится из организма медленнее других форм билирубина, период его полувыведения примерно равен скорости полувыведения альбумина (8–20 дней), при этом у кошек стойкая гипербилирубинемия и желтуха сохраняются дольше. У кошек не вызванная гемолизом желтуха, как правило, указывает на первичное заболевание печени. Некоторые бактериальные эндотоксины и медиаторы ответа острой фазы подавляют мембранный механизм секреции билирубина в желчные канальцы и вызывают сепсис-ассоциированный холестаз [41].
АЛТ и АСТ — ферменты, вырабатываемые клетками печени, сердца, эритроцитами и скелетной мускулатурой. Пропорция АСТ/АЛТ>1 свидетельствует о патологии сердца или мышечной ткани; АСТ/АЛТ<1 — о патологии печени. У кошек самые высокие концентрации АЛТ отмечаются в гепатоцитах. Также этот фермент присутствует, но в меньших концентрациях в почках, поджелудочной железе, кишечнике, скелетной и сердечной мышечных тканях и эритроцитах. У кошек АЛТ превалирует в печеночной ткани, ее сывороточная активность является более специфичным индикатором повреждения печени, чем АСТ. Уровень сывороточной активности АЛТ пропорционален количеству поврежденных клеток, но не всегда связан с тяжестью повреждения тканей. Холестаз и обструкция желчных путей могут увеличить сывороточную активность АЛТ вследствие токсических эффектов солей желчных кислот на гепатоциты. Одновременное исследование уровня щелочной фосфатазы и гамма-глютамилтранспептидазы в сыворотке крови помогает выявить возможный холестатический компонент при печеночной патологии. При увеличении активности АЛТ исследование желчных кислот или уровня аммиака в плазме крови дает возможность оценить функцию печени. Увеличение активности АЛТ также отмечается вследствие острых кишечных энтеропатий, внутрисосудистого гемолиза (особенно у кошек), при гипоксии, в результате токсического воздействия на гепатоциты и в ряде других случаев. Период полураспада АЛТ в сыворотке крови кошек составляет 3,5 ч. После тяжелого острого гепатоцеллюлярного поражения печени (например, воздействие токсичных веществ) уровень фермента значительно увеличивается через 12 ч и достигает пика в течение 1–2 дней. При прекращении воздействия повреждающих факторов скорость нормализации сывороточной активности АЛТ не всегда соответствует ожидаемой, принимая во внимание период полураспада фермента в сыворотке крови, и составляет 1–3 нед. Такое медленное снижение можно объяснить повышением активности АЛТ в ходе регенерации печеночной ткани. У кошек период полувыведения АСТ короче, чем АЛТ, и составляет около часа. Таким образом, АСТ может быть более чувствительным маркером при значительных повреждениях печени у кошек. Сывороточная АСТ имеет более длительный период полувыведения, чем креатинкиназа, что повышает диагностическую чувствительность во время восстановления от повреждения миоцитов или гепатоцитов. Повышение уровня АСТ может наблюдаться после отравления цинком или употребления ацетаминофена [38–41].
Лактатдегидрогеназа (ЛДГ) — фермент, участвующий в конечном этапе расщепления глюкозы. Мышцы, печень и разрушающиеся эритроциты, как правило, являются источниками высокой активности ЛДГ в сыворотке. После повреждения тканей сывороточная активность ЛДГ достигает пика через 24–48 ч и возвращается к норме в течение 7–10 дней. В случае если образец крови слишком долго отстаивается перед центрифугированием, уровень ЛДГ может быть ложно повышен в результате разрушения эритроцитов, также такое повышение ЛДГ может быть связано с неправильным забором крови. Уровни ЛДГ могут повышаться и после тяжелых физических нагрузок, при наличии некоторых злокачественных опухолей и острого панкреатита [38, 42].
Период полувыведения кишечной, почечной и плацентарной изоформы щелочной фосфатазы у кошек составляет примерно 2 мин. Таким образом, они вряд ли могут вызвать увеличение активности фермента в сыворотке крови. Увеличение секреции щелочной фосфатазы и повышение ее активности в сыворотке крови обычно происходит при холестазе, повышении активности остеобластов, в результате действия некоторых лекарственных препаратов, а также при некоторых хронических заболеваниях. Период полувыведения фермента в результате холестаза составляет приблизительно 6 ч у кошек. Различные эндокринные заболевания могут быть также связаны с повышенной активностью щелочной фосфатазы в сыворотке крови животных [43, 44].
У кошек и собак удаление азота из организма происходит посредством экскреции мочевины. Величина реабсорбции мочевины в канальцах зависит от скорости тока мочи по канальцам, уровень мочевины в сыворотке крови используется для оценки скорости клубочковой фильтрации. С ее снижением увеличивается интенсивность реабсорбции мочевины, и возрастает ее уровень в крови. Однако, поскольку уровень мочевины и креатинина в сыворотке крови не увеличиваются вплоть до поражения около 70% нефронов, определение концентрации этих показателей не является информативным в ранней диагностике почечной недостаточности. К наиболее распространенным причинам увеличения уровня мочевины в сыворотке крови относятся гиповолемия и желудочно-кишечные кровотечения. К другим причинам увеличения уровня мочевины в крови можно отнести усиление катаболизма белка (например, при употреблении высокобелковой пищи), но при этом, как и при усиленном мышечном катаболизме, азотемии у здоровых животных не возникает. Длительное применение кортикостероидных препаратов также может быть причиной повышения концентрации мочевины в крови [38, 39].
Креатинин — побочный мышечный продукт, выводимый из организма почечной системой. Уровень колеблется в зависимости от состояния выделительной мочевой системы. Отношение мочевина/креатинин (0,08 и меньше) позволяет прогнозировать скорость развития почечной недостаточности. Хотя изменения уровня креатинина обычно связаны с заболеванием почек, при этом многие другие факторы могут тоже влиять на его уровень. К примеру, обезвоживание, шок, болезни сердца, мышечная атрофия или сильная потеря массы тела. Антибиотики также вызывают повышение уровня креатинина [38, 45].
Креатинфосфокиназа — фермент, который в огромном количестве содержится в скелетной группе мышц. У большинства видов животных самая высокая концентрация фермента наблюдается в мышечной ткани. По его наличию в крови можно судить о работе сердечной мышцы, а также о внутренних мышечных травмах. В скелетной мускулатуре активность креатинфосфокиназы в 2–4 раза выше, чем в сердечной мышце, хотя у кошек в этих тканях активность фермента почти одинаковая. Период полувыведения креатинфосфокиназы из крови у кошек при мышечном повреждении, как и у многих других животных, составляет в среднем 6–7 ч. У кошек значительное повышение активности креатинфосфокиназы в сыворотке крови отмечается в состоянии анорексии (в результате мышечного катаболизма), при миопатиях различного генеза и гипертиреозе. Введение кортикостероидных препаратов, стрептокиназы, амфотерицина В, пенициллинов и сульфаниламидов может увеличить значение креатинфосфокиназы [46, 47].
Уровень триглицеридов в крови характеризует работу сердечно-сосудистой системы, а также энергетический обмен и обычно анализируется в комплексе с уровнем холестерина. У некоторых кошек уровень триглицеридов повышается после длительного лечения стероидами. При этом у животных могут появиться жировые отложения на животе и глазах, боль в животе, гиперчувствительность к прикосновениям и даже судороги. Обнаружение гипертриглицеридемии в образце крови после 12‑часового периода голодания указывает на стойкую или патологическую гиперлипидемию. Патологическая гипертриглицеридемия, как правило, вторична по отношению к основному заболеванию эндокринной системы, поджелудочной железы, печени или почек. Первичная гиперлипидемия встречаются редко и, как правило, вызвана генетическими отклонениями [1, 13, 38, 39].
В конце исследования были рассчитаны коэффициенты вариации рассмотренных биохимических показателей крови кошек, что в грубом приближении соответствует межиндивидуальной вариабельности этих показателей в человеческой популяции. В широком смысле под этим определением подразумевается изменчивость качественных и/или количественных особенностей структуры и/или функций, присущих двум и более отдельным (индивидуальным) животным. Сравнительные данные приведены в табл. 5.
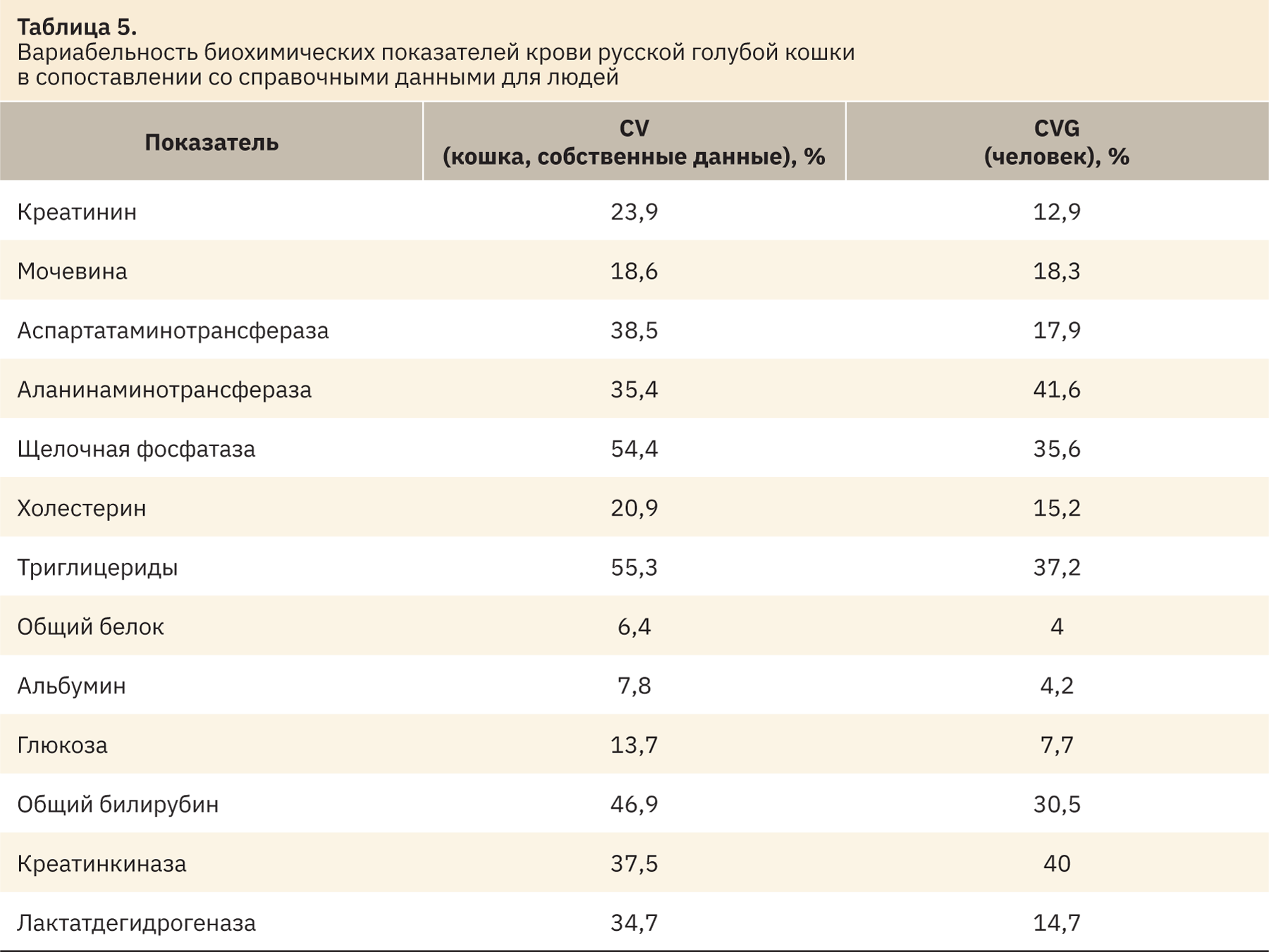
Схожая вариабельность отмечена по таким показателям, как мочевина, АЛТ, общий белок и креатинкиназа. Различия присутствуют среди показателей аспартатаминотрансферазы АСТ, щелочной фосфатазы, холестерина, триглицеридов, альбумина, глюкозы, общего билирубина и лактатдегидрогеназы. Рассматриваемые показатели имеют более широкую вариабельность у кошек в отличие от человека. Данная информация может быть полезной при интерпретации полученных значений в доклинических исследованиях.
Заключение
Кошка является важной моделью in vivo в доклинических исследованиях ввиду своей схожести с человеком по некоторым биологическим характеристикам. Рассматриваемый вид животных используется в разработке новых хирургических методов лечения в офтальмологии, неврологии, кардиологии, исследовании этиопатогенеза ретровирусов, наследственных и иммунодефицитных заболеваний, тестировании новых фармакологических агентов. В результате проведенного исследования установлены референтные интервалы биохимических показателей крови кошек породы русская голубая. Данные показатели являются полезным инструментом в области доклинических исследований и могут быть применены для мониторинга здоровья животных, адекватности сформированной патологической модели и изучения токсикологических свойств новых химических веществ.
Сведения о конфликте интересов
М.Н. Макарова является членом редакционной коллегии журнала «Лабораторные животные для научных исследований». Остальные авторы заявляют об отсутствии конфликта интересов, требующего раскрытия в данной статье.
Вклад авторов
М.В. Мирошников — анализ научной и методической литературы, написание, редактирование и доработка текста рукописи, ответственность за все аспекты работы, связанные с достоверностью данных.
К.Т. Султанова — написание и редактирование текста рукописи, обобщение результатов исследования, работа с табличным материалом.
М.А. Ковалева — анализ научной и методической литературы, научное редактирование текста рукописи.
М.Н. Макарова — идея разработки темы и обоснование актуальности работы, критический пересмотр содержания.
Список источников
-
Макарова М.Н. Кошки в лабораторных исследованиях. Обзор литературы // Лабораторные животные для научных исследований. 2021. № 1. С. 86–104. [Makarova M.N. Koshki v laboratornyh issledovaniyah. Obzor literatury // Laboratornye zhivotnye dlya nauchnyh issledovanij. 2021. N. 1. P. 86–104. (In Russ.)].
-
Griffin B., Baker H.J. Domestic cats as laboratory animals // Laboratory animal medicine. 2002. P. 459.
-
Miyazawa T. Infections of feline leukemia virus and feline immunodeficiency virus // Frontiers in Bioscience-Landmark. 2002. Vol. 7. N. 4. P. 504–518.
-
Azadian A., Gunn Moore D.A. Age related cognitive impairments in domestic cats naturally infected with feline immunodeficiency virus // Veterinary Record. 2022. P. e1683.
-
Esteves M.I., Schrenzel M.D., Marini R.P. et al. Helicobacter pylori gastritis in cats with long-term natural infection as a model of human disease // The American journal of pathology. 2000. Vol. 156. N. 2. P. 709–721.
-
Freeman L.M., Rush J.E., Stern J.A. et al. Feline hypertrophic cardiomyopathy: a spontaneous large animal model of human HCM // Cardiology research. 2017. Vol. 8. N. 4. P. 139.
-
Liu S.K., Tilley L.P. Animal models of primary myocardial diseases // The Yale Journal of Biology and Medicine. 1980. Vol. 53. N. 3. P. 191.
-
Hoenig M. The cat as a model for human nutrition and disease // Current Opinion in Clinical Nutrition & Metabolic Care. 2006. Vol. 9. N. 5. P. 584–588.
-
Henson M.S., O’Brien T.D. Feline models of type 2 diabetes mellitus // ILAR journal. 2006. Vol. 47. N. 3. P. 234–242.
-
Hoenig M., Thomaseth K., Brandao J., et al. Assessment and mathematical modeling of glucose turnover and insulin sensitivity in lean and obese cats // Domest Anim Endocrinol. 2006. Vol. 31. N. 4. P. 373–389.
-
Schrauwen-Hinderling V.B., Hesselink M.K., Schrauwen P. et al. Intramyocellular lipid content in human skeletal muscle // Obesity (Silver Spring). 2006. Vol. 14. N. 3. P. 357–367. DOI: 10.1038/oby.2006.47.
-
Schermerhorn T. Normal glucose metabolism in carnivores overlaps with diabetes pathology in non-carnivores // Frontiers in endocrinology. 2013. Vol. 4. P. 188.
-
Jordan E., Kley S., Le N. A. et al. Dyslipidemia in obese cats // Domestic animal endocrinology. 2008. Vol. 35. N. 3. P. 290–299.
-
Giraudel J.M., Diquelou A., Lees P. et al. Development and validation of a new model of inflammation in the cat and selection of surrogate endpoints for testing anti-inflammatory drugs // Journal of Veterinary Pharmacology and Therapeutics. 2005. Vol. 28. N. 3. P. 275–285.
-
Narfström K., Holland Deckman K., Menotti-Raymond M. The domestic cat as a large animal model for characterization of disease and therapeutic intervention in hereditary retinal blindness // Journal of ophthalmology. 2011. Vol. 2011.
-
Cannon C.M. Cats, cancer and comparative oncology // Veterinary sciences. 2015. Vol. 2. N. 3. P. 111–126.
-
Hansen K., Khanna C. Spontaneous and genetically engineered animal models: use in preclinical cancer drug development // European Journal of Cancer. 2004. Vol. 40. N. 6. P. 858–880.
-
Walton R.M., Hendrick M.J. Feline Hodgkin’s-like lymphoma: 20 Cases (1992–1999) // Veterinary pathology. 2001. Vol. 38. N. 5. P. 504–511.
-
Nascimento C., Ferreira F. Tumor microenvironment of human breast cancer, and feline mammary carcinoma as a potential study model // Biochimica et Biophysica Acta (BBA) — Reviews on Cancer. 2021. Vol. 1876. N. 1. P. 188587.
-
D’Costa S., Yoon B.I., Kim D.Y. et al. Morphologic and molecular analysis of 39 spontaneous feline pulmonary carcinomas // Veterinary Pathology. 2012. Vol. 49. N. 6. P. 971–978.
-
Marconato L., Buchholz J., Keller M. et al. Multimodal therapeutic approach and interdisciplinary challenge for the treatment of unresectable head and neck squamous cell carcinoma in six cats: a pilot study // Veterinary and comparative oncology. 2013. Vol. 11. N. 2. P. 101–112.
-
Okamatsu G., Kawakami K., Komatsu T. et al. Functional expression and comparative characterization of four feline P450 cytochromes using fluorescent substrates // Xenobiotica. 2017. Vol. 47. N. 11. P. 951–961.
-
Okamatsu G., Komatsu T., Ono Y. et al. Characterization of feline cytochrome P450 2B6 // Xenobiotica. 2017. Vol. 47. N. 2. P. 93–102.
-
Мирошников М.В., Макарова М.Н. Вариабельность биохимических показателей крови и установление референсных интервалов в доклинических исследованиях. Сообщение 4: мыши // Лабораторные животные для научных исследований. 2021. № 3. С. 64–70. [Miroshnikov M.V., Makarova M.N. Variabel’nost’ biohimicheskih pokazatelej krovi i ustanovlenie referensnyh intervalov v doklinicheskih issledovaniyah. Soobshchenie 4: myshi //Laboratornye zhivotnye dlya nauchnyh issledovanij. 2021. N. 3. P. 64–70. (In Russ.)].
-
Мирошников М.В., Султанова К.Т., Ковалева М.А. и др. Вариабельность биохимических показателей крови и установление референсных интервалов в доклинических исследованиях. Сообщение 5: хорьки // Лабораторные животные для научных исследований. 2021. № 4. С. 29–39. [Miroshnikov M.V., Sultanova K.T., Kovaleva M.A. i dr. Variabel’nost’ biohimicheskih pokazatelej krovi i ustanovlenie referensnyh intervalov v doklinicheskih issledovaniyah. Soobshchenie 5: hor’ki // Laboratornye zhivotnye dlya nauchnyh issledovanij. 2021. N. 4. P. 29–39. (In Russ.)].
-
Мирошников М.В., Султанова К.Т., Ковалева М.А. и др. Вариабельность биохимических показателей крови и установление референтных интервалов в доклинических исследованиях. Сообщение 6: яванские макаки // Лабораторные животные для научных исследований. 2022. № 2. С. 14–25. [Miroshnikov M.V., Sultanova K.T., Kovaleva M.A. i dr. Variabel’nost’ biohimicheskih pokazatelej krovi i ustanovlenie referentnyh intervalov v doklinicheskih issledovaniyah. Soobshchenie 6: yavanskie makaki // Laboratornye zhivotnye dlya nauchnyh issledovanij. 2022. N. 2. P. 14–25. (In Russ.)].
-
Лившиц В.М., Сидельникова В.И. Биохимические анализы в клинике: справ.-3‑е изд. 2011. [Livshits V.M., Sidel’nikova V.I. Biokhimicheskie analizy v klinike: sprav.-3‑e izd. 2011. (In Russ.)].
-
Ингерлейб М.Б. Медицинские анализы. Самый полный современный справочник / М.Б. Ингерлейб. Москва: Изд-во АСТ, 2015. 416 с. [Ingerleib M.B. Meditsinskie analizy. Samyi polnyi sovremennyi spravochnik / M.B. Ingerleib. Moskva: Izd-vo AST, 2015. 416 p. (In Russ.)].
-
Biochemistry reference intervals. https://www.uoguelph.ca/ahl/biochemistry-reference-intervals (дата обращения: 10.2022 г.).
-
Reference Intervals. https://www.vet.cornell.edu/animal-health-diagnostic-center/laboratories/clinical-pathology/reference-intervals/chemistry (дата обращения: 10.2022 г.).
-
Paltrinieri S., Ibba F., Rossi G. Haematological and biochemical reference intervals of four feline breeds // Journal of feline medicine and surgery. 2014. Vol. 16. N. 2. P. 125–136.
-
Lin T.L., Chung S.H., Sung C.H. et al. Establishment of feline in-house reference intervals for hematologic and biochemical parameters and potential age-related differences // Polish journal of veterinary sciences. 2019: 599‑608‑599‑608.
-
https://diagnosticservices.avc.upei.ca/reference-guide/reference-intervals (дата обращения: 10.2021 г.).
-
https://vetmed.iastate.edu/vpath/services/diagnostic-services/clinical-pathology/testing-and-fees/reference-intervals?field_p_type_tid=288 (дата обращения: 10.2022 г.).
-
https://en.wikivet.net/Feline_Biochemistry (дата обращения: 10.2022 г.).
-
Rand J.S., Kinnaird E., Baglioni A. et al. Acute stress hyperglycemia in cats is associated with struggling and increased concentrations of lactate and norepinephrine // Journal of veterinary internal medicine. 2002. Vol. 16. N. 2. P. 123–132.
-
Kettelhut I.C., Foss M.C., Migliorini R.H. Glucose homeostasis in a carnivorous animal (cat) and in rats fed a high-protein diet // American Journal of Physiology-Regulatory, Integrative and Comparative Physiology. 1980. Vol. 239. N. 5. P. R437–R444.
-
Thrall M.A., Weiser G., Allison R.W. et al. (ed.). Veterinary hematology and clinical chemistry. John Wiley & Sons, 2012.
-
Sodikoff C.H., Charles H. Laboratory profiles of small animal diseases: a guide to laboratory diagnosis. Mosby Inc., 2001. Ed. 3.
-
Watson T.D.G. Lipoprotein metabolism in dogs and cats // Comparative Haematology International. 1996. Vol. 6. N. 1. P. 17–23.
-
Sherlock S., Dooley J. Diseases of the liver and biliary system. John Wiley & Sons, 2008.
-
Terragni R., Morselli-Labate A.M., Vignoli M. et al. Is serum total LDH evaluation able to differentiate between alimentary lymphoma and inflammatory bowel disease in a real world clinical setting? // PLoS One. 2016. Vol. 11. N. 3. P. e0151641.
-
Hoffman W.E., Renegar W.E., Dorner J.L. Alkaline phosphatase and alkaline phosphatase isoenzymes in the cat // Veterinary Clinical Pathology. 1977. Vol. 6. N. 3. P. 21–24.
-
Everett R.M., Duncan J.R., Prasse K.W. Alkaline phosphatases in tissues and sera of cats // American Journal of Veterinary Research. 1977. Vol. 38. N. 10. P. 1533–1538.
-
Kongtasai T., Paepe D., Meyer E. et al. Renal biomarkers in cats: A review of the current status in chronic kidney disease // Journal of Veterinary Internal Medicine. 2022. Vol. 36. N. 2. P. 379–396.
-
Aroch I., Keidar I., Himelstein A. et al. Diagnostic and prognostic value of serum creatine-kinase activity in ill cats: a retrospective study of 601 cases // Journal of feline medicine and surgery. 2010. Vol. 12. N. 6. P. 466–475.
- Neumann S. Serum creatine kinase activity in dogs and cats with metabolic diseases // DTW. Deutsche Tierarztliche Wochenschrift. 2005. Vol. 112. N. 9. P. 343–347.




