Вариабельность биохимических показателей крови и установление референтных интервалов в доклинических исследованиях. Сообщение 7: морские свинки
Работа выполнена без спонсорской поддержки.
Мирошников М.В., Султанова К.Т., Ковалева М.А., Макарова М.Н. Вариабельность биохимических показателей крови и установление референтных интервалов в доклинических исследованиях. Сообщение 7: морские свинки. Лабораторные животные для научных исследований. 2022; 3. https://doi.org/10.57034/2618723X-2022-03-01
Резюме
Морская свинка является значимой моделью в доклинических исследованиях из‑за оптимального размера тела и широкой коммерческой доступности, при этом их анатомические, иммунологические и биохимические особенности схожи с таковыми у человека. Рассматриваемые животные широко используются для исследований в области аллергологии и иммунологии, инфекционных и сердечно-сосудистых заболеваний, атеросклероза, артрита. Кроме того, метаболизм липидов, холестерина и глюкозы у морских свинок и человека тоже похожи. Ввиду высокой вовлеченности данных животных в доклинические исследования и возможности моделирования большого количества патологических состояний важными моментами являются контроль здоровья животных, оценка состояния внутренних органов и информация о метаболизме — обмене липидов, белков и углеводов. Цель данного исследования — установить референтные интервалы некоторых биохимических показателей сыворотки крови морских свинок. Данные показатели необходимы в доклинических исследованиях при мониторинге здоровья животных, определении наличия/отсутствия дрейфа изучаемых показателей, сравнении полученных значений с подобными у человека и оценке модельной патологии. Для формирования референтных интервалов использовали данные, полученные от интактных здоровых животных в декабре 2021 г. — апреле 2022 г. в АО НПО «ДОМ ФАРМАЦИИ». Все проведенные эксперименты были одобрены биоэтической комиссией. В сыворотке крови животных на автоматическом биохимическом анализаторе Rendom Access A-25 с использованием соответствующих наборов определяли следующие показатели: креатинин, мочевина, аланинаминотрансфераза, аспартатаминотрансфераза, щелочная фосфатаза, общий холестерин, липопротеины высокой плотности, α-амилаза, триглицериды, общий белок, альбумин, глюкоза, креатинкиназа, лактатдегидрогеназа и общий билирубин. Исходя из содержания общего белка каждого животного, было определено количество глобулинов и рассчитано соотношение альбумин/глобулинов морских свинок. При сопоставлении полученных и литературных данных было показано, что рассчитанные в АО НПО «ДОМ ФАРМАЦИИ» референтные значения биохимических показателей животных в целом соотносятся с таковыми других научных центров и лабораторий, что подтверждает их репрезентативность. Сравнение полученных значений биохимических показателей крови морских свинок с данными человека показало, что некоторые результаты схожи между собой (уровень креатинина, содержание лактатдегидрогеназы, глобулинов). Показатели щелочной фосфатазы, холестерина, липопротеинов высокой плотности, α-амилазы, триглицеридов, общего билирубина, глюкозы отличаются по величине референтного диапазона. Содержание мочевины, аланинаминотрансферазы и аспартатаминотрансферазы оказалось выше у животных по сравнению с данными человека. Такие различия необходимо учитывать в дальнейших доклинических исследованиях для более точного анализа полученных результатов.
Введение
Морская свинка (Cavia porcellus) является значимой моделью в доклинических исследованиях из‑за нескольких факторов. К числу первых можно отнести оптимальный размер тела, позволяющий проводить большое количество хирургических манипуляций с данным видом, широкую коммерческую доступность и неагрессивный характер животных [1]. К другим наиболее важным факторам относится схожесть некоторых анатомических, иммунологических, биохимических особенностей морских свинок с таковыми у человека [2]. Так, например, у рассматриваемых животных, как и людей, есть потребность в пищевом витамине С (отсутствует синтез фермента L-гулонолактоноксидазы) [3]. Иммунная система морской свинки имеет много общего с человеческой. Так, человек и морские свинки имеют сходные паттерны генетической экспрессии IFNγ и индуцибельной синтазы оксида азота, цитокины IL-8 и IL-12, систему комплемента и гликопротеины CD1 и CD8. В связи с этим данные животные являются перспективными при разработке новых вакцин [4].
Морские свинки — перспективная модель при исследовании бронхиальной астмы с развитием хорошо охарактеризованной ранней и поздней астматической реакции на аллерген. Анатомические особенности дыхательной системы этих животных также позволяют изучать другие респираторные заболевания, такие как хроническая обструктивная болезнь легких и гиперчувствительность дыхательных путей [4].
Одним из самых больших преимуществ морских свинок является возможность воспроизведения схожего патогенеза, наблюдаемого при некоторых вирусных и бактериальных заболеваниях человека [4, 6]. Морские свинки восприимчивы к нескольким аренавирусам — Мачупо, Хунин, Ласса и филовирусам — Эбола, Марбург. Ввиду этого данные животные используются для изучения патогенеза и лечения геморрагических лихорадок, которые вызывают данные патогены [5, 8, 9]. К тому же морские свинки восприимчивы к респираторно-синцитиальному вирусу и вирусу гриппа, что также нашло применение в доклинических исследованиях [9]. Рассматриваемые животные иcпользуются в изучении ряда бактериальных заболеваний человека: стафилококковой инфекции; инфекций, передающихся половым путем, — сифилиса, хламидиоза; желудочно-кишечных — хронического гастрита и язвы, ассоциированных с Helicobacter pylori [10, 11]. Данные животные обладают высокой восприимчивостью к Mycobacterium tuberculosis, положительно реагируют на стандартные пероральные препараты (изониазид, рифампицин, этамбутол), вакцины, причем в отличие от мышиных моделей у морских свинок развивается казеозный некроз при туберкулезных поражениях, что является одним из отличительных признаков заболевания у людей [12].
Морские свинки широко используются для исследований сердечно-сосудистых заболеваний, атеросклероза, артрита [13, 14]. Кроме того, морская свинка в большей степени, чем любой другой грызун, имеет общие черты с метаболизмом липидов человека, включая метаболизм и транспорт холестерина. Ключевой момент сходства обмена липидов заключается в том, что большая часть циркулирующего холестерина транспортируется в виде липопротеинов низкой плотности (ЛПНП) [15]. Отличительной чертой морских свинок от других грызунов является то, что у них имеется белок-переносчик эфиров холестерина (CETP), критический компонент для обратного транспорта холестерина у человека (у крыс он отсутствует), а также ферментов лецитинхолестеринацилтрансферазы (LCAT) и липопротеинлипазы (LPL), которые регулируют уровень липидов в крови и вовлечены в патогенез атеросклероза [16]. Было показано, что морские свинки являются релевантными моделями для изучения механизмов, с помощью которых статины, холестирамин, ингибиторы апикального транспорта натрия и желчных кислот (ASBT) снижают уровень холестерина и ЛПНП в плазме [17, 18]. Также разработаны модели сахарного диабета 2‑го типа у данных животных, основанные на использовании корма с высоким содержанием жиров и углеводов, которые демонстрируют нарушение толерантности к глюкозе и компенсаторную гиперинсулинемию [19].
Ввиду высокой вовлеченности морских свинок в доклинические исследования, возможности моделирования большого количества патологических состояний важными моментами являются контроль здоровья животных, оценка работы внутренних органов и информация о метаболизме — обмене липидов, белков и углеводов.
Цель данного исследования — установить референтные интервалы некоторых биохимических показателей сыворотки крови морских свинок. Данные показатели могут быть полезны в доклинических исследованиях при мониторинге здоровья животных, оценке наличия/отсутствия дрейфа изучаемых показателей, сравнении полученных значений с таковыми у человека и при оценке успешности моделирования патологии.
Материал и методы
Для формирования референтных интервалов использовали данные, полученные от интактных здоровых животных в декабре 2021 г. — апреле 2022 г. в АО НПО «ДОМ ФАРМАЦИИ». Все проведенные эксперименты одобрены биоэтической комиссией. Ретроспективные данные биохимии сыворотки получены от 45 самцов и 64 самок морских свинок. Самки были небеременными и нерожавшими. Возраст животных составлял 5–9 мес. Масса морских свинок была 700–1000 г. Содержание и уход за животными осуществляли в соответствии с Директивой 2010/63/EU Европейского парламента и Совета Европейского союза от 22 сентября 2010 г. по охране животных, используемых в научных целях. Животным был предоставлен доступ к еде и воде ad libitum. В помещениях для животных поддерживали цикл день/ночь (12 ч : 12 ч), температуру 20–26 °C и влажность 30–70%. Исследование выполнено с соблюдением принципов Европейской конвенции о защите позвоночных животных, используемых для экспериментов и других научных целей (Страсбург, 1986), и в соответствии с правилами надлежащей лабораторной практики. Определение биохимических показателей для всех животных проводили в одинаковых условиях с помощью общепринятых аналитических методов. Для исследования использовали кровь, которую отбирали из бедренной вены морских свинок натощак (депривация по еде 8 ч) без седации и анестезии в вакуумные пластиковые пробирки (OÜ InterVacTechnology, Эстония, вакуумные пробирки с активатором свертывания и гелем LIND-VAC, 1 мл, 13×75 мм). Для получения сыворотки кровь центрифугировали в течение 15 мин при 3000 об/мин на центрифуге ОПн-3.04 Дастан (Киргизия). Полученную сыворотку переносили в стерильные пробирки, в которых определяли биохимические показатели. В сыворотке крови животных на автоматическом биохимическом анализаторе Rendom Access A-25 (BioSystems, Испания) с использованием соответствующих наборов регистрировали следующие показатели: уровень креатинина, мочевины, аланинаминотрансферазы (АЛТ), аспартатаминотрансферазы (АСТ), щелочной фосфатазы (ЩФ), общего холестерина (ХС), липопротеинов высокой плотности (ЛПВП), панкреатической α-амилазы, триглицеридов (ТГ), общего белка, альбумина, глюкозы, креатинкиназы (КК), лактатдегидрогеназы (ЛДГ), общего билирубина (ОБ). Концентрацию ОБ измеряли с помощью набора реактивов (Вектор-Бест, Россия), для определения содержания остальных аналитов использовали биохимические наборы (BioSystems, Испания). Исходя из количества общего белка каждого животного, регистрировали количество глобулинов, а также рассчитывали соотношение альбумин/глобулинов у морских свинок. Статистическую обработку осуществляли с использованием пакета программ GraphPad Prism 9.0 (США), статистические выбросы оценивали с помощью метода Тьюки, вид распределения — критерия Шапиро–Уилка, парные сравнения между животными разного пола проводили, используя U-критерий Манна–Уитни и t-критерий Стьюдента.
Результаты и обсуждение
Референтный интервал считается репрезентативным или контрольным для здоровья животных. При отсутствии данных интервалов полученные лабораторные значения не имеют смысла, так как нельзя с уверенностью говорить об отсутствии, наличии или развитии патологического процесса. Текущие рекомендации по установлению референтных интервалов в идеале требуют от 20 до 120 здоровых особей [20]. При составлении внутрилабораторных референтных интервалов необходимо опираться на массив данных литературы, но не всегда полученные значения будут коррелировать с результатами других источников. Преаналитическая изменчивость у мелких млекопитающих возникает вследствие различий в местах отбора проб (подкожная головная вена, вены Сафена, наружная яремная вена) анестезии, стресса, диеты, возраста, беременности, пола, состояния натощак или без него, а также сезонных колебаний. Информация об этих переменных полезна при интерпретации данных. Чем больше общих характеристик будет в выборке животных, использованных с целью получения данных для референтного интервала и выборки из другого эксперимента, тем более точной будет интерпретация.
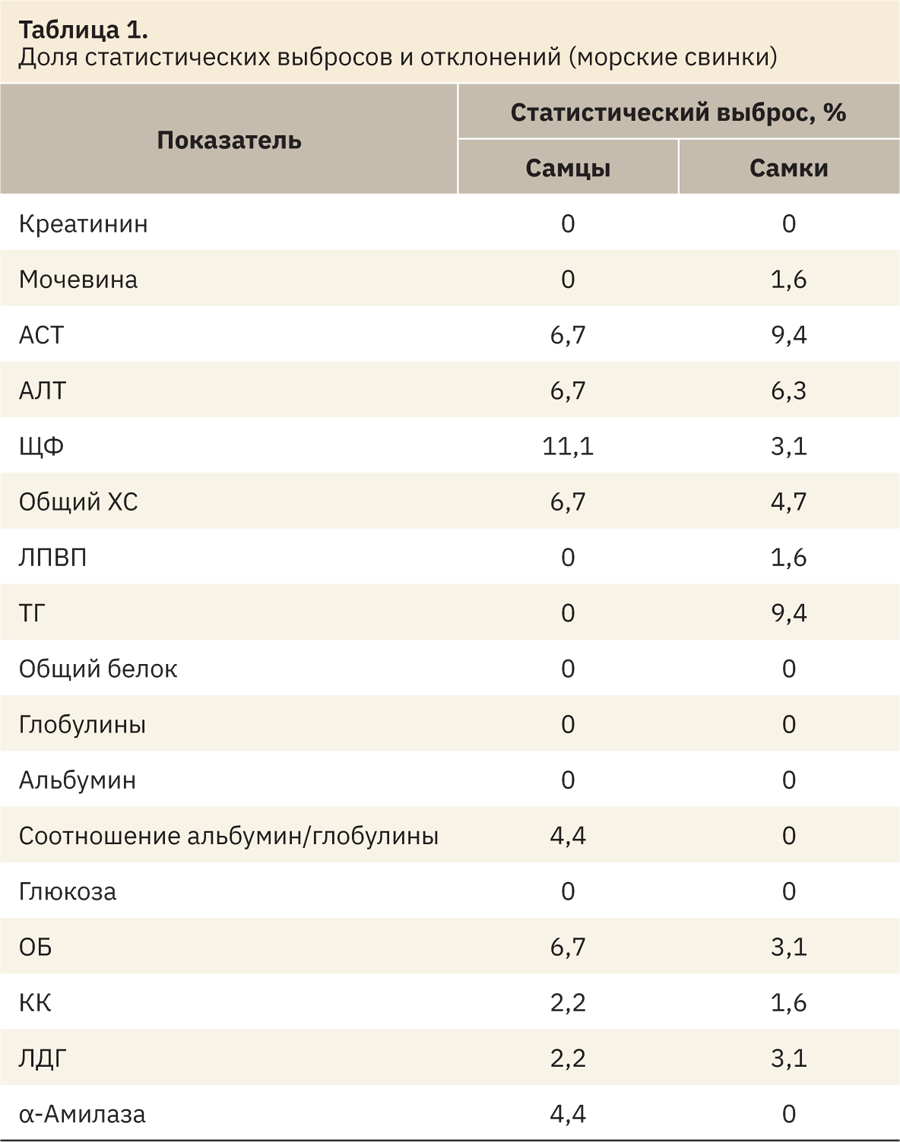
На первом этапе из выборки были устранены статистические выбросы, которые определяли отдельно для каждого показателя и пола животных по методу Тьюки. Были исключены данные, лежащие за пределами интервала Q3 и Q1 (1‑го и 3‑го квартилей). Межквартильный интервал IQR вычисляли как Q3–Q1. Верхний и нижний пределы рассчитывали следующим образом [21]:
Q1–1,5IQR и Q3+1,5IQR
Данные о доле статистических выбросов по каждому показателю представлены в табл. 1.
Наибольшие статистические выбросы при анализе сыворотки крови морских свинок отмечались в отношении ЩФ — 11,1% у самцов, а у самок в отношении АСТ и триглицеридов ТГ — 9,4%.
Референтные интервалы (РИ) для полученных результатов в зависимости от вида их распределения рассчитывали как:
Хср±1,96SD — для параметрического распределения (далее Хср±1,96SD);
2,5–97,5 процентили (‰) — для непараметрического распределения.
Вид распределения определяли с помощью критерия Шапиро–Уилка. Дополнительно проводили сравнение между животными разного пола — U-критерий Манна–Уитни (непараметрическое распределение) или t-критерий Стьюдента (параметрическое распределение).
Полученная биохимическая панель исследуемых показателей у морских свинок представлена в табл. 2.
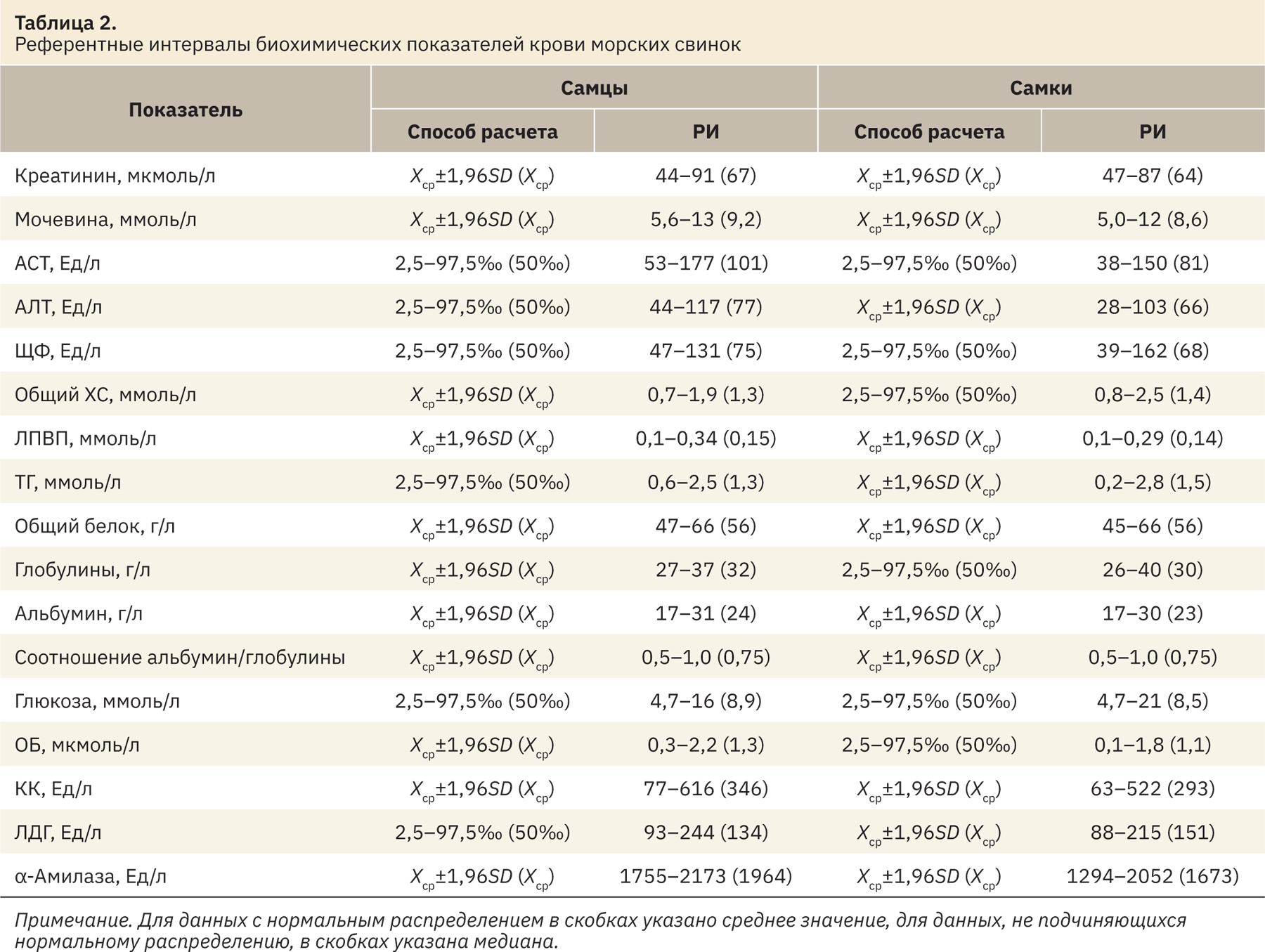
При анализе полученных данных показано, что значения КК, мочевины, ЛПВП, общего белка, глобулинов, альбуминов и соотношения альбумин/глобулинов сопоставимы между самцами и самками морских свинок. Референтные интервалы АСТ, АЛТ, α-амилазы, ОБ, КК и ЛДГ у самцов имеют более высокие показатели, чем у самок. Интервалы ЩФ, общего ХС, ТГ и глюкозы относительно схожи между самцами и самками, но диапазоны рассматриваемых показателей оказались шире у самок. Все эти различия могут быть связаны с половыми особенностями, эмоциональным стрессом, состоянием физической активности животных.
У морских свинок, как и у других лабораторных животных, есть свои определенные биохимические особенности, на которые необходимо обращать внимание при проведении исследований.
Известно, что различия в уровне глюкозы в сыворотке у морских свинок могут быть связаны с применением анестетиков (кетамин/ксилазин/пентобарбитал). Есть предположение, что эти различия связаны с ингибированием некоторыми анестетиками секреции инсулина бета-клетками поджелудочной железы морских свинок. На количество глюкозы влияют преаналитические факторы (стресс), а также гормоны — инсулин, глюкагон, глюкокортикоиды, адреналин и тироксин. Гипогликемия может быть связана с голоданием, печеночной недостаточностью и опухолями (инсулинома, лейомиосаркома), гипергликемия — с сахарным диабетом, со стрессом, с местом сбора крови, анестетиками и некоторыми новообразованиями (функциональные опухоли коры надпочечников и феохромоцитома). Метаболизм инсулина и уровень глюкозы в крови морских свинок могут меняться в зависимости от сезона [22, 23].
Было обнаружено, что уровни ТГ постепенно увеличиваются с возрастом у самцов и самок морских свинок. Липопротеиновая фракция животных содержит в основном ЛПНП с небольшим количеством ЛПВП, если только в рационе не присутствует холестерин. Кишечник является основным местом синтеза холестерина. Морская свинка служит релевантной тест-системой для моделирования гиперхолестеринемии в доклинических исследованиях. Высокий уровень холестерина в рационе этих животных вызывает гемолитическую анемию, увеличение селезенки, гиперплазию костного мозга, образование атерогенных бляшек, жировой инфильтрации печени и других тканей. Патологическая гиперлипидемия чаще всего связана с эндокринными нарушениями (сахарный диабет, гипотиреоз), диетой, холестазом и нефротическим синдромом. В ответ на физические нагрузки у рассматриваемых животных снижается уровень ТГ и повышается уровень холестерина ЛПВП в плазме [13–15, 23].
Активность ЩФ резко снижается после рождения морских свинок, а затем постепенно выравнивается к 5–6‑му месяцу. Диета с дефицитом цинка вызывает повышение активности фермента, тогда как голодание и дефицит аскорбиновой кислоты способствуют снижению уровня ЩФ у животных. Концентрация ЩФ в сыворотке может кратковременно повышаться после приема пищи. У всех молодых растущих животных концентрация ЩФ выше, что, вероятно, связано с ростом костей. Патологическое повышение ЩФ чаще всего связано с заболеванием гепатобилиарной системы или повреждением костей. У большинства видов увеличенный уровень ЩФ предшествует повышению ОБ при заболевании гепатобилиарной системы. Гиперадренокортицизм, зарегистрированный у морских свинок, характеризуется повышенным уровнем ЩФ и кортизола наряду с клиническими признаками симметричной алопеции, полиурии и полидипсии [23, 24].
Концентрация АЛТ значима при оценке поражения печени у хорьков, однако у кроликов, морских свиней и шиншиллы не играет большой роли, так как фермент имеет более низкую активность у травоядных. Повышенные значения АСТ следует интерпретировать вместе с показателями КК, чтобы исключить повреждение мышц у животного. Данные о пониженной концентрации аналитов, синтезируемых в печени, таких как глюкоза, альбумин, азот мочевины, холестерин и билирубин малозначимы для выявления печеночной дисфункции, при этом многие из них также неспецифичны [24].
Было показано, что метод анестезии влияет на уровень КК у морских свинок. Животные, которым вводили пентобарбитал внутрибрюшинно, имели более высокие уровни КК, чем морские свинки, которым вводили внутримышечно кетамин и ксилазин. Повышенное содержание фермента можно наблюдать у морских свинок с миопатией, связанной с дефицитом витамина Е, селена и др. Это важный тест для подтверждения повреждения печени, если значения АЛТ и АСТ повышены без увеличения КК [25].
Показатели ЛДГ у морских свинок могут увеличиваться при вирусной и бактериальной инфекции, сердечной патологии и физических нагрузках. У грызунов ЛДГ, КК и АСТ чаще всего используют для оценки повреждения скелетных мышц и сердца [26].
Уровни сывороточного белка могут увеличиваться при обезвоживании, инфекции, опухолях и снижаться при голодании, заболеваниях печени, энтеропатии с потерей белка, нефропатии, гельминтозах, гипоальбуминемии (которая связана с заболеванием клубочков, потерей или снижением всасывания в желудочно-кишечном тракте или уменьшением продукции из‑за печеночной недостаточности). Существуют данные, подтверждающие, что значения общего белка у морских свинок резко возрастают и стабилизируются в возрасте 5–7 мес [25, 26].
Концентрации ОБ могут быть повышены в результате задержки желчи вследствие нарушения внутрипеченочного или внепеченочного оттока желчи, гемолитической анемии или при снижении печеночной или желчной секреции, или изменении метаболизма билирубина. Образцы крови, подвергшиеся воздействию солнечного света, демонстрируют снижение концентрации билирубина до 50% за 1 ч. Замораживание образцов сыворотки также может вызвать искусственное понижение. Печеночный билирубин связан с увеличением значений АСТ, АЛТ и ЩФ. Надпеченочный билирубин связан со снижением гематокрита, концентрации гемоглобина и числа эритроцитов, а также с ретикулоцитозом (если костный мозг уже успел отреагировать на анемию) [24, 25].
Было обнаружено, что уровни мочевины постепенно увеличиваются с возрастом у морских свинок. По некоторым источникам литературы, концентрация мочевины выше у морских свинок, которым вводили пентобарбитал внутрибрюшинно по сравнению с кетамином и ксилазином. Считалось, что это различие связано с подавлением пентобарбиталом сердечного выброса, почечного кровотока и скорости клубочковой фильтрации. Заболевание почек является распространенной хронической патологией у возрастных морских свинок, в то время как острое заболевание почек может возникать у более молодых животных, например, острая почечная недостаточность с повышенным уровнем мочевины после употребления в пищу растений, содержащих оксалаты (сушеные абрикосы, инжир, сливы, щавель, ботва свеклы, миндаль, кешью). Концентрация мочевины и креатинина у рассматриваемых животных увеличивается при снижении клубочковой фильтрации. Преренальными причинами повышенного уровня азота мочевины являются диета с высоким содержанием белка, катаболизм белка, обезвоживание, желудочно-кишечное кровотечение и лихорадка [22, 27].
Креатинин является более специфическим биомаркером, чем мочевина, и его уровень не изменяется при катаболизме белка или желудочно-кишечном кровотечении, но увеличивается при обезвоживании. При интерпретации значений креатинина следует учитывать состояние организма. Уровень креатинина может быть менее показательным в качестве маркера сниженной клубочковой фильтрации у животных со слабой мускулатурой или выраженным истощением мышц. Было обнаружено, что значения креатинина постепенно увеличиваются с возрастом у самцов и самок морских свинок [27].
В табл. 3 представлены данные биохимических показателей крови морских свинок различных пород на основании источников литературы. Перерасчет показателей, представленных в традиционных единицах, в единицы системы СИ был произведен с помощью коэффициентов [28]. Также в табл. 3 представлены референтные интервалы мужчин и женщин.
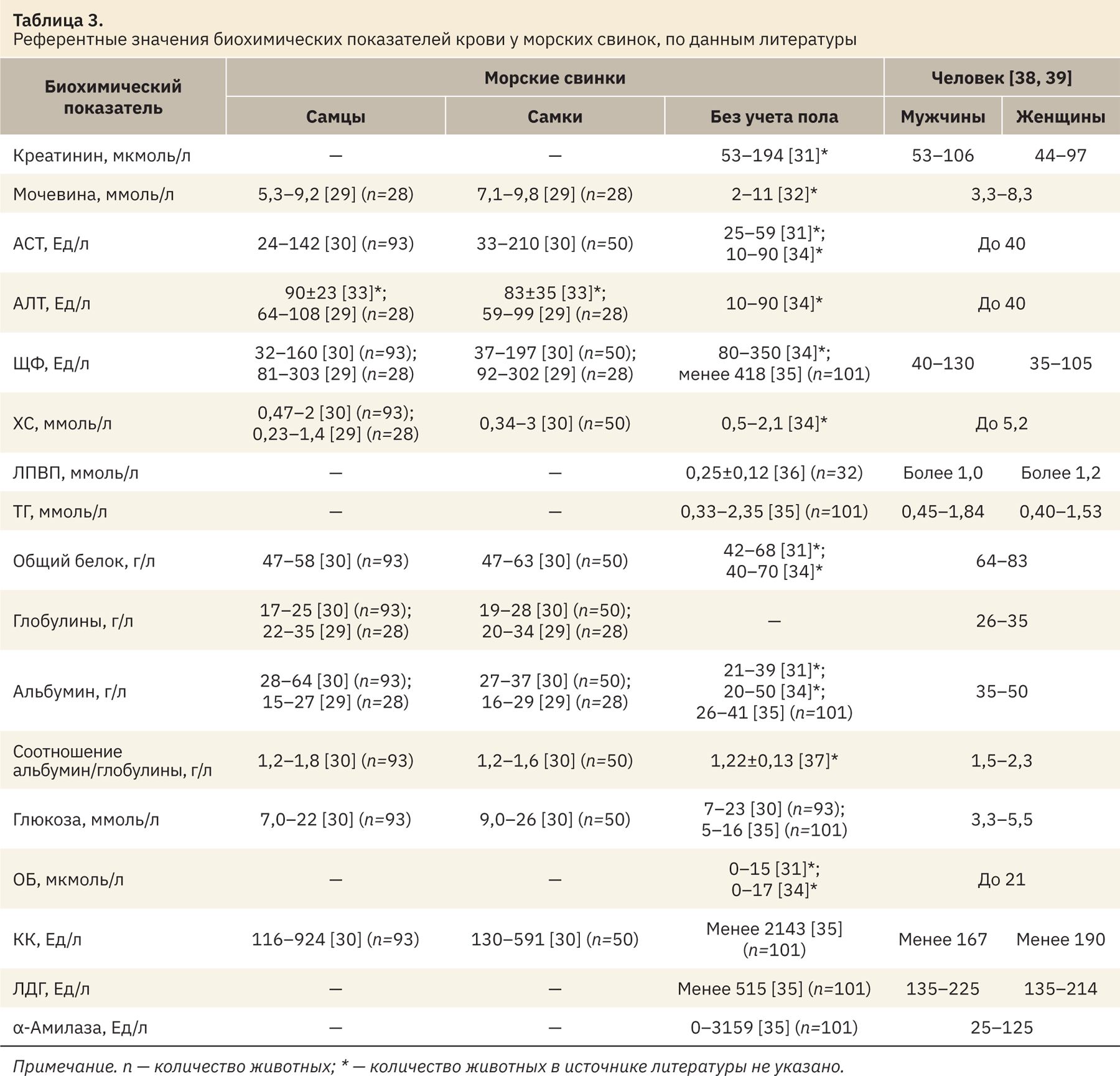
При сопоставлении полученных и литературных данных (см. табл. 3) было показано, что рассчитанные в АО НПО «ДОМ ФАРМАЦИИ» референтные значения биохимических показателей морских свинок в целом соотносятся с таковыми в других научных центрах и лабораториях, что подтверждает достоверность полученных сведений. Значения креатинина (44–91 мкмоль/л — самцы; 47–87 мкмоль/л — самки) оказались несколько ниже представленных в источниках литературы (53–194 мкмоль/л — оба пола). Референтный диапазон мочевины (5,6–13 ммоль/л — самцы; 5,0–12 ммоль/л — самки) относительно одних данных литературы (5,3–9,2 ммоль/л — самцы; 7,1–9,8 ммоль/л — самки) оказался шире, а относительно других его верхняя граница оказалась выше (2–11 ммоль/л — оба пола), что может быть связано, например, с содержанием белка в рационе питания животных. Референтные интервалы АСТ, ТГ, АЛТ, ЩФ, холестерина, ЛПВП, общего белка, глобулинов, альбумина и глюкозы соответствуют таковым, указанным в литературе. Нормальные диапазоны ОБ, КК, ЛДГ и α-амилазы, рассчитанные в АО НПО «ДОМ ФАРМАЦИИ», были уже значений, представленных в литературе. Установленные различия можно объяснить, опираясь на генетические и физиологические факторы, условия внешней среды, преаналитические причины.
При сопоставлении полученных в АО НПО «ДОМ ФАРМАЦИИ» данных биохимических показателей крови морских свинок со значениями человека было показано (см. табл. 3), что диапазоны креатинина как животных (44–91 мкмоль/л — самцы; 47–87 мкмоль/л — самки), так и человека (53–106 ммоль/л — мужчины; 44–97 ммоль/л — женщины) соотносятся между собой, аналогичная картина наблюдается при рассмотрении полученных значений ЛДГ животных (93–244 Ед/л — самцы; 88–215 Ед/л — самки) и человека (135–225 Ед/л — мужчины; 135–214 Ед/л — женщины). Референтные показатели мочевины (5,6–13 ммоль/л — самцы; 5,0–12 ммоль/л — самки), АСТ (53–177 Ед/л — самцы; 38–150 Ед/л — самки) и АЛТ (44–117 Ед/л — самцы; 28–103 Ед/л — самки) у животных выше, чем у человека (мочевина 3,3–8,3 ммоль/л — оба пола; АСТ и АЛТ до 40 Ед/л — оба пола). Значения ЩФ у самцов морских свинок (47–131 Ед/л) соответствуют таковым у мужчин (40–130 Ед/л), но диапазон самок (39–162 Ед/л) оказался шире, чем у женщин (35–105 Ед/л). Диапазоны ОХ (0,7–1,9 ммоль/л — самцы; 0,8–2,5 ммоль/л — самки), ЛПВП (0,1–0,34 ммоль/л — самцы; 0,1–0,29 ммоль/л — самки) морских свинок оказались уже, чем у человека в 2 и 3 раза соответственно. Показатели α-амилазы исследуемых животных (1755–2173 Ед/л — самцы; 1294–2052 Ед/л — самки) были значительно выше, чем норма у человека (25–125 Ед/л — оба пола). Диапазон ТГ животных (0,6–2,5 ммоль/л — самцы; 0,2–2,8 ммоль/л — самки) также оказался выше, чем у мужчин (0,45–1,84 ммоль/л) и женщин (0,40–1,53 ммоль/л). Референтные интервалы общего белка (47–66 г/л — оба пола) и альбумина (17–30 г/л) морских свинок оказались ниже, чем у человека (общий белок 64–83 г/л — оба пола; альбумин 35–50 г/л — оба пола), хотя уровни глобулинов были схожими. Исходя из различий общего количества белков плазмы крови животных и человека, соотношение альбумин/глобулины у морских свинок меньше в 2 раза, чем у мужчин и женщин. Референтные интервалы глюкозы животных (4,7–16 ммоль/л — самцы; 4,7–21 ммоль/л — самки) значительно отличаются от таковых у человека (3,3–5,5 ммоль/л — оба пола) — в 3 раза шире. В свою очередь, показатель ОБ у людей (до 21 мкмоль/л — оба пола) оказался в 10 раз больше, чем значения морских свинок, полученные в ходе исследования (0,3–2,2 мкмоль/л — самцы; 0,1–1,8 мкмоль/л — самки), хотя уровень билирубина у морских свинок, по данным литературы, был выше (0–17 мкмоль/л — оба пола). Уровень КК у животных (77–616 Ед/л — самцы; 63–522 Ед/л — самки) оказался в 5 раз значительнее, чем у мужчин (до 167 Ед/л) и женщин (до 190 Ед/л). Полученную в ходе работы информацию необходимо учитывать при проведении доклинических исследований для интерпретации данных.
В табл. 4 представлены краткие данные литературы с указанием некоторых схожих патологических состояний морских свинок и человека, сопровождающиеся повышенным или пониженным содержанием некоторых биохимических показателей. Данная таблица может помочь в понимании развития, наличия или отсутствия какого‑либо патологического процесса у лабораторных морских свинок и, как следствие, разобраться в интерпретации полученной информации при сравнении ее с таковой у человека.

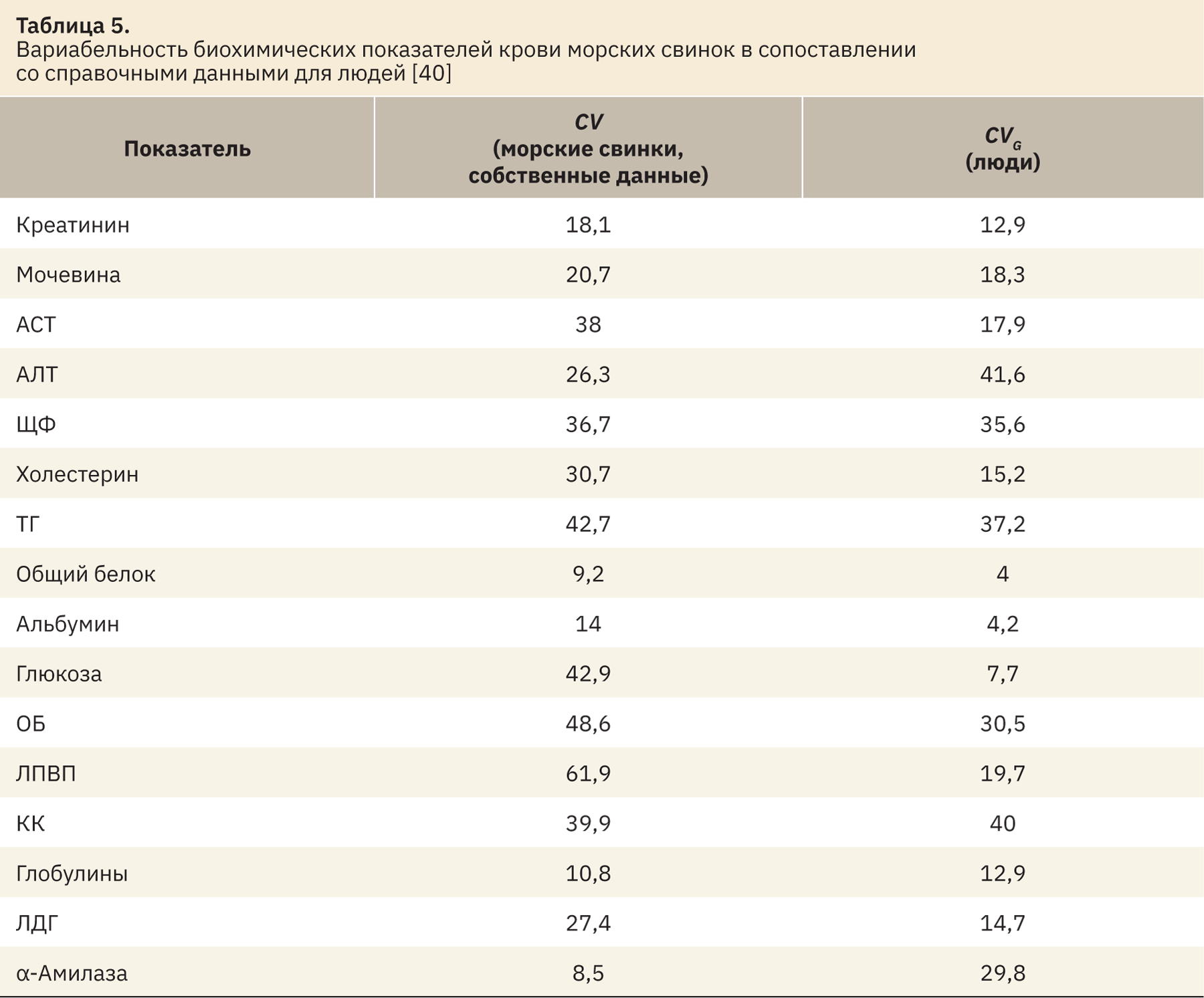
На последнем этапе для каждого показателя были рассчитаны коэффициенты вариации (CV=SD/Хср×100%), что в грубом приближении соответствует межиндивидуальной вариабельности этих показателей. Стоит напомнить, что под межиндивидуальной вариабельностью понимают изменчивость качественных или количественных особенностей структуры или функций, присущих двум и более отдельным (индивидуальным) животным или людям. Следует отличать межиндивидуальную вариабельность от индивидуальной вариабельности, присущей одному отдельному объекту.
Сравнительные данные приведены в табл. 5. Можно отметить сходную у морской свинки с человеком вариабельность по таким показателям, как креатинин, мочевина, ЩФ, ТГ, КК, глобулины, общий белок и ОБ. В то же время значения АСТ, АЛТ, холестерина, глюкозы, ЛПВП и α-амилазы морских свинок и человека имеют большие различия, что может быть обусловлено видовыми особенностями. Полученную информацию необходимо учитывать при интерпретации полученных данных в доклинических исследованиях.
Заключение
Трактовка полученных результатов доклинических исследований представляет собой процесс сравнения, ценность этого процесса зависит главным образом от принятой системы отсчета или референтных интервалов. Процесс установления этих контрольных интервалов сложен и определяется множеством биологических и технических факторов, связанных с различиями в популяциях и лабораторном оборудовании. Данные интервалы важны и их наличие в каждом доклиническом центре необходимо для полного и объемного понимания развития или отсутствия определенной патологии животных и возможности интерпретации полученной информации. Морская свинка представляет собой ценную и подтвержденную экспериментальную доклиническую модель из‑за некоторого биологического сходства с людьми. В работе были установлены референтные интервалы биохимических показателей крови данных животных. При сопоставлении полученных и литературных данных было показано, что рассчитанные в АО НПО «ДОМ ФАРМАЦИИ» референтные значения биохимических показателей животных в целом соотносятся с таковыми в других научных центрах и лабораториях, что подтверждает их репрезентативность. При сравнении биохимических показателей крови (креатинин, лактатдегидрогеназа, глобулины) морских свинок с данными человека показано, что некоторые значения схожи между собой; другие отличаются по величине референтного диапазона — щелочная фосфатаза, холестерин, липопротеины высокой плотности, триглицериды, общий билирубин, глюкоза; показатели α-амилазы, мочевины, аланинаминотрансферазы и аспартатаминотрансферазы оказались выше у животных. Сравнительный анализ межиндивидуальной вариабельности биохимических показателей крови морских свинок и человека также демонстрирует наличие некоторых видовых различий, которые необходимо учитывать при рассмотрении результатов доклинических исследований.
Сведения о конфликте интересов
Авторы заявляют об отсутствии конфликта интересов.
Вклад авторов
М.В. Мирошников — анализ научной и методической литературы, написание, редактирование и доработка текста рукописи, ответственность за все аспекты работы, связанные с достоверностью данных.
К.Т. Султанова — написание и редактирование текста рукописи, обобщение результатов исследования, работа с табличным материалом.
М.А. Ковалева — анализ научной и методической литературы, редактирование текста рукописи.
М.Н. Макарова — идея, критический пересмотр содержания, редактирование текста рукописи.
Список источников
- Акимова М.А., Акимов Д.Ю. Морские свинки в доклинических исследованиях, оптимальные характеристики тест-системы // Лабораторные животные для научных исследований. 2021. № 1. [Akimova M.A., Akimov D.Yu. Morskie svinki v doklinicheskikh issledovaniyakh, optimal’nye kharakteristiki test-sistemy // Laboratornye zhivotnye dlya nauchnykh issledovaniy. 2021. №. 1. (In Russ.)]. doi: 10.29296/2618723X-2021-01-08.
-
Taylor D.K., Lee V.K. Guinea pigs as experimental models // The Laboratory Rabbit, Guinea Pig, Hamster, and Other Rodents. Academic Press, 2012. P. 705–744. doi: 10.1016/B978-0-12-380920-9.00025-0.
-
Lykkesfeldt J., Tveden-Nyborg P. The pharmacokinetics of vitamin C // Nutrients. 2019. Vol. 11. N. 10. Р. 2412. doi: 10.3390/nu11102412.
-
Padilla-Carlin D.J., McMurray D.N., Hickey A.J. The guinea pig as a model of infectious diseases // Comparative medicine. 2008. Vol. 58. N. 4. Р. 324–340.
- Adner M. Canning B.J., Meurs H. et al. Back to the future: re-establishing guinea pig in vivo asthma models // Clinical Science. 2020. Vol. 134. N. 11. P. 1219–1242. doi: 10.1042/CS20200394.
- Bouvier N.M., Lowen A.C. Animal models for influenza virus pathogenesis and transmission // Viruses. 2010. Vol. 2. N. 8. P. 1530–1563. doi: 10.3390/v20801530.
- Bell T.M., Shaia C.I., Bearss J.J. et al. Temporal progression of lesions in guinea pigs infected with Lassa virus // Veterinary pathology. 2017. Vol. 54. N. 3. P. 549–562. doi: 10.1177/0300985816677153.
- Gowen B.B., Juelich T.L., Sefing E.J. et al. Favipiravir (T-705) inhibits Junin virus infection and reduces mortality in a guinea pig model of Argentine hemorrhagic fever // PLoS neglected tropical diseases. 2013. Vol. 7. N. 12. P. e2614. doi: 10.1371/journal.pntd.0002614.
-
Bente D., Gren J., Strong J., Feldmann H. Disease modeling for Ebola and Marburg viruses // Disease models & mechanisms. 2009. Vol. 2. N. 1–2. P. 12–17.
-
Yoon J.J., Toots M., Lee S. et al. Orally efficacious broad-spectrum ribonucleoside analog inhibitor of influenza and respiratory syncytial viruses // Antimicrobial agents and chemotherapy. 2018. Vol. 62. N. 8. P. e00766–18. doi: 10.1128/AAC.00766-18.
- Gonciarz W., Walencka M., Moran A.P. et al. Upregulation of MUC5AC production and deposition of Lewis determinants by Helicobacter pylori facilitate gastric tissue colonization and the maintenance of infection // Journal of Biomedical Science. 2019. Vol. 26. N. 1. P. 1–12. doi: 10.1186/s12929-019-0515-z.
-
Hunter R.L., Actor J.K., Hwang S.A. et al. Pathogenesis and animal models of post-primary (bronchogenic) tuberculosis, a review // Pathogens. 2018. Vol. 7. N. 1. P. 19. doi: 10.3390/pathogens7010019.
-
Zhao Y., Qu H., Wang Y. et al. Small rodent models of atherosclerosis // Biomedicine & Pharmacotherapy. 2020. Vol. 129. P. 110426. doi: 10.1016/j.biopha.2020.110426.
-
Radakovich L.B., Marolf A.J., Culver L.A. et al. Calorie restriction with regular chow, but not a high-fat diet, delays onset of spontaneous osteoarthritis in the Hartley guinea pig model // Arthritis research & therapy. 2019. Vol. 21. N. 1. P. 1–14. doi: 10.1186/s13075-019-1925-8.
-
Fernandez M.L., Volek J.S. Guinea pigs: a suitable animal model to study lipoprotein metabolism, atherosclerosis and inflammation // Nutrition & metabolism. 2006. Vol. 3. N. 1. P. 1–6. doi: 10.1186/1743-7075-3-17.
-
Priyadharsini R.P. Animal models to evaluate anti-atherosclerotic drugs // Fundamental & Clinical Pharmacology. 2015. Vol. 29. N. 4. P. 329–340.
-
Witztum J.L., Young S.G., Elam R.L. et al. Cholestyramine-induced changes in low density lipoprotein composition and metabolism. I. Studies in the guinea pig // Journal of Lipid Research. 1985. Vol. 26.1. P. 92–103.
-
Turley S.D., West C.E. Effect of cholesterol and cholestyramine feeding and of fasting on sterol synthesis in the liver, ileum, and lung of the guinea pig // Lipids. 1976. Vol. 11.7. P. 571–577. doi: 10.1007/BF02532904.
-
Podell B.K., Ackart D.F., Richardson M.A. et al. A model of type 2 diabetes in the guinea pig using sequential diet-induced glucose intolerance and streptozotocin treatment // Disease models & mechanisms. 2017. Vol. 10 (2). P. 151–162. doi: 10.1242/dmm.025593.
-
Friedrichs K.R., Harr K.E., Freeman K.P. et al. ASVCP reference interval guidelines: determination of de novo reference intervals in veterinary species and other related topics // Veterinary clinical pathology. 2012. Vol. 41. N. 4. P. 441–453. doi: 10.1111/vcp.12006.
-
Horn P. S., Pesce A.J. Reference intervals: an update // Clinica Chimica Acta. 2003. Vol. 334 (1–2). Р. 5–23. doi: 10.1016/s0009-8981(03)00133-5.
-
Dang V., Bao S., Ault A., Murray C. et al. Efficacy and safety of five injectable anesthetic regimens for chronic blood collection from the anterior vena cava of Guinea pigs // Journal of the American Association for Laboratory Animal Science. 2008. Vol. 47 (6). P. 56–60.
-
Suckow M.A., Stevens K.A., Wilson R.P. (ed.). The laboratory rabbit, guinea pig, hamster, and other rodents. Academic Press, 2012.
-
Siegel A., Walton R.M. Hematology and Biochemistry of small mammals // Ferrets, Rabbits, and Rodents. 2020. P. 569.
-
McClure D.E. Clinical pathology and sample collection in the laboratory rodent // Veterinary Clinics of North America: Exotic Animal Practice. 1999. Vol. 2. N. 3. P. 565–590. doi: 10.1016/s1094-9194(17)30111-1.
-
Baldrey V., Ashpole I. Interpreting blood profiles in non-domestic small mammals. 2012.
-
Kitagaki M., Yamaguchi M., Nakamura M. et al. Age-related changes in haematology and serum chemistry of Weiser — Maples guineapigs (Cavia porcellus) // Laboratory animals. 2005. Vol. 39 (3). P. 321–330. doi: 10.1258/0023677054307042.
-
Конвертор единиц измерения используемых в лабораторной и медицинской практике в единицы международной системы СИ. URL.: http://unitslab.com/ru (дата обращения: 01.2022 г.).
-
https://agmv.ro/wp-content/uploads/2021/06 (дата обращения: 01.2022 г.).
-
Spittler A.P., Afzali M.F., Bork S.B. et al. Age-and sex-associated differences in hematology and biochemistry parameters of Dunkin Hartley guinea pigs (Cavia porcellus) // Plos one. 2021. Vol. 16. N. 7. P. e0253794. doi: 10.1371/journal.pone.0253794.
-
https://en.wikivet.net/Guinea_Pig_Biochemistry (дата обращения: 01.2022 г.).
-
Rabe H. Reference ranges for biochemical parameters in guinea pigs for the Vettest® 8008 blood analyzer // Tierarztliche Praxis. Ausgabe K., Kleintiere/heimtiere. 2011. Vol. 39. N. 3. P. 170–175.
-
David M. Kurtz, Gregory S. Travlos. The Clinical Chemistry of Laboratory Animals. 3rd Edition. CRC Press, 2017. 1162 p.
-
Washington I.M., Van Hoosier G. Clinical biochemistry and hematology // The laboratory rabbit, guinea pig, hamster, and other rodents. Academic Press, 2012. P. 57–116.
-
Hein J., Hartmann K. Labordiagnostische Referenzbereiche bei Meerschweinchen // Tierarztl Prax Ausg K Kleintiere Heimtiere. 2003. Vol. 31. N. 06. P. 383–389. doi: 10.1055/s-0037-1622380.
-
Rice B.H., Kraft J., Destaillats F. et al. Ruminant-produced trans-fatty acids raise plasma HDL particle concentrations in intact and ovariectomized female Hartley guinea pigs // The Journal of nutrition. 2012. Vol. 1; 142 (9). P. 679–683. doi: 10.3945/jn.112.160077.
-
Azab A.E., Albasha M.O. Simultaneous administration of aqueous extract of Rosmarinus officinal with nicotine resulted in prevention of induced hepatorenal toxicity in guinea pigs // American Journal of Bioscience and Bioengineering. 2015. Vol. 3. N. 5. P. 80–86.
-
Лившиц В.М., Сидельникова В.И. Биохимические анализы в клинике: справ.-3-е изд. 2011. [Livshits V.M., Sidel’nikova V.I. Biokhimicheskie analizy v klinike: sprav.-3-e izd. 2011 (In Russ.)].
-
Ингерлейб М.Б. Медицинские анализы. Самый полный современный справочник [Текст] / М.Б. Ингерлейб. М.: Изд-во АСТ, 2015. 416 с. [Ingerleib M.B. Meditsinskie analizy. Samyi polnyi sovremennyi spravochnik [Tekst] / M.B. Ingerleib. M.: Izd-vo AST, 2015. 416 p. (In Russ.)].
- ГОСТ Р 53022.2–2008 Технологии лабораторные клинические. Требования к качеству клинических лабораторных исследований. Часть 2. Оценка аналитической надежности методов исследования (точность, чувствительность, специфичность) М., 2008. [GOST R 53022.2–2008 Tekhnologii laboratornye klinicheskie. Trebovaniya k kachestvu klinicheskih laboratornyh issledovanij. CHast’ 2. Ocenka analiticheskoj nadezhnosti metodov issledovaniya (tochnost’, chuvstvitel’nost’, specifi chnost’) M., 2008. (In Russ.)].




