Сравнительная анатомия сердца человека и экспериментальных животных
Гущин Я.А. Сравнительная анатомия сердца человека и экспериментальных животных. Лабораторные животные для научных исследований. 2021; 1. https://doi.org/10.29296/2618723X-2021-01-06
Резюме
Проблема лечения и профилактики заболеваний сердечно-сосудистой системы является актуальной, при этом немаловажную роль играет фармакотерапия, а следовательно, разработка новых лекарственных веществ. Один из неизменных этапов поиска – доклинические исследования на лабораторных животных, в ходе которых определяется не только эффективность, но и безопасность новых препаратов. Кроме того, оценка сердечно-сосудистой системы важна и в исследованиях фармакологической безопасности и токсичности новых лекарственных средств. В настоящей статье мы попробовали собрать воедино основные элементы строения сердца человека и лабораторных животных, а также сравнить морфологию органа, чтобы определить сходство и различия в анатомии и гистологии разных видов животных и человека.
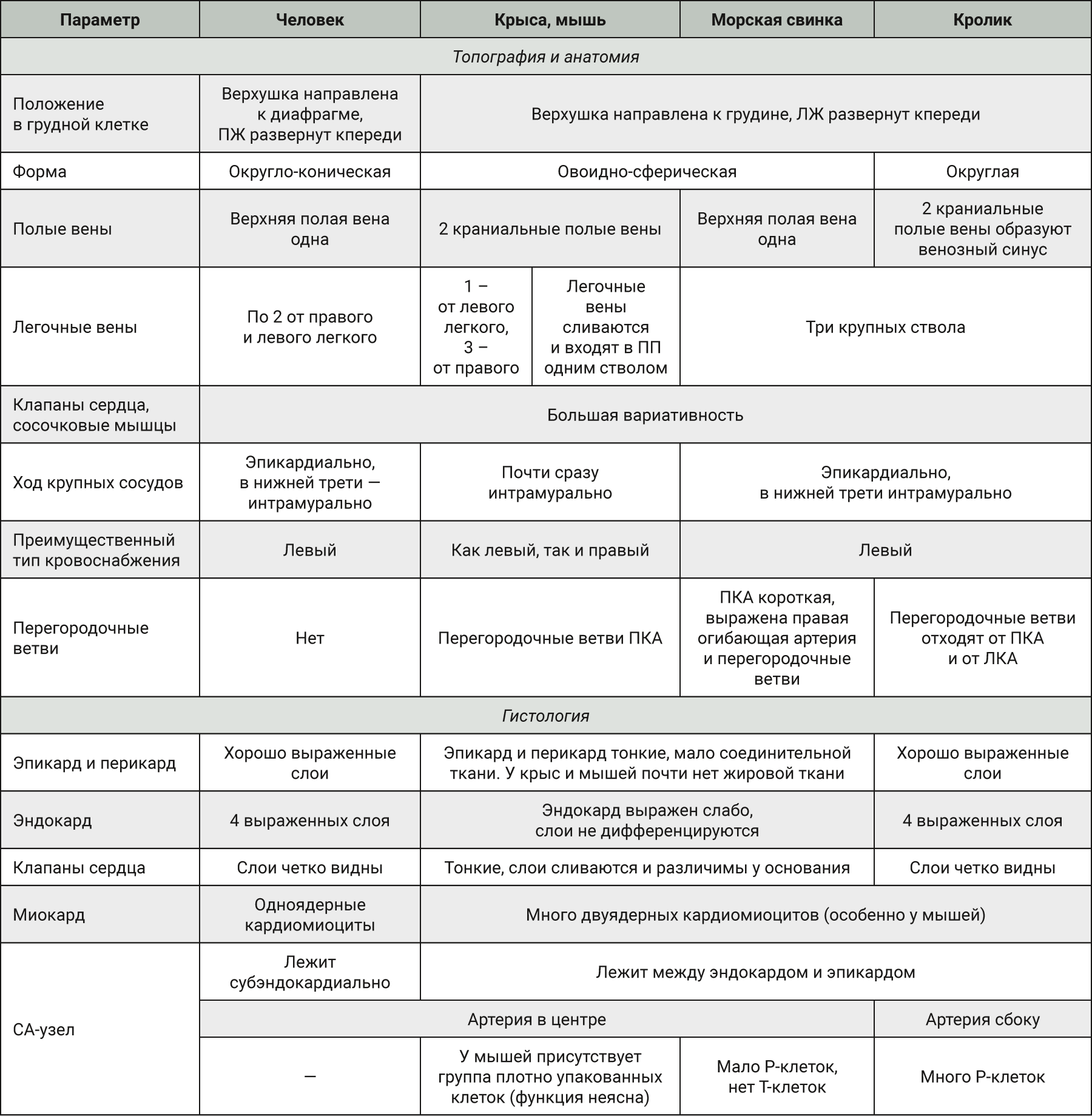
Анатомия сердца у млекопитающих имеет одинаковый план организации, схожее топографическое расположение органа и его анатомическое и гистологическое строение. Однако присутствуют и некоторые яркие видовые особенности. Расположение сердца опосредовано пространственным положением тела. У всех четвероногих оно отклонено к грудине и развернуто левым желудочком к передней грудной клетке, у человека, наоборот, верхушка сердца прилежит к диафрагме, а правая половина повернута кпереди.
Сравнивая между собой анатомическое строение сердца как человека, так и лабораторных животных, можно отметить разное количество ряда анатомических структур, таких как створки клапанов, хорды и сосочковые мышцы, но такое разнообразие прослеживается и внутри видов.
Выраженные особенности имеет количество и расположение полых и легочных вен. Ход коронарных артерий и их вклад в кровоснабжение отделов миокарда также имеют свою видоспецифичность, в результате чего различен и тип кровоснабжения миокарда. Преимущественно доминирует левая коронарная артерия, но у крыс и мышей правая и левая коронарные артерии равномерно кровоснабжают миокард. Кроме того, у животных присутствуют отдельные перегородочные ветви правой коронарной артерии, которых нет у человека. Также у грызунов венечные артерии почти сразу после отхождения от аорты уходят в толщу миокарда, у человека они длительное время идут эпикардиально.
Гистологическое строение сердца одинаково у всех видов. Есть небольшие различия, скорее связанные с размерами животных.
Проводящая система сердца у всех млекопитающих имеет единый план строения, а видовая специфичность проявляется в вариативности расположения узлов и их клеточного состава.
В данном обзоре рассмотрено только морфологическое строение структур и не обсуждались их физиологические параметры, поскольку эта тема требует отдельного обзора.
Введение
В настоящее время заболевания сердечно-сосудистой системы занимают лидирующее место в структуре смертности. Поэтому до сих пор актуальной является проблема не только их лечения, но и профилактики возникновения. Немаловажную роль в снижении уровня заболеваемости, помимо первичной профилактики, направленной на общее оздоровление населения, вносит профилактика вторичная, направленная на поддержание здоровья и работоспособности лиц, уже имеющих патологию сердечно-сосудистой системы. Именно при вторичной профилактике, не говоря уже о лечении, большое значение имеет фармакотерапия. В результате чего огромные силы и средства вкладываются в разработку лекарственных веществ, воздействующих на сердце и сосуды, а одним из неизменных этапов поиска являются доклинические исследования на лабораторных животных. Кроме того, оценка сердечно-сосудистой системы важна и в исследованиях фармакологической безопасности и токсичности новых лекарственных средств. На данном этапе определяется не только эффективность, но и безопасность новых веществ. Таким образом, исследователю необходимо иметь четкое понимание механизма действия, точку приложения и прогнозировать результат воздействия препаратов. Кроме того, в дальнейшем необходимо перенести полученные данные с животных на человека, для чего необходимо знать нормальное строение и функционирование исследуемых органов не только у человека, но и у животных.
В настоящей статье мы попытались собрать воедино основные элементы строения сердца человека и лабораторных животных, а также сравнить морфологию органа, чтобы определить сходство и различия в анатомии и гистологии различных видов животных и человека.
Данный сравнительный обзор будет полезен исследователям, работающим в области доклинических исследований лекарственных веществ, а также иным специалистам, изучающим гистологию, физиологию и патологию сердечно-сосудистой системы.
Топография
Сердце располагается в грудной полости (рис. 1) в переднем (у кроликов в среднем [1]) средостении, в перикарде, между листками медиастинальной плевры [2].
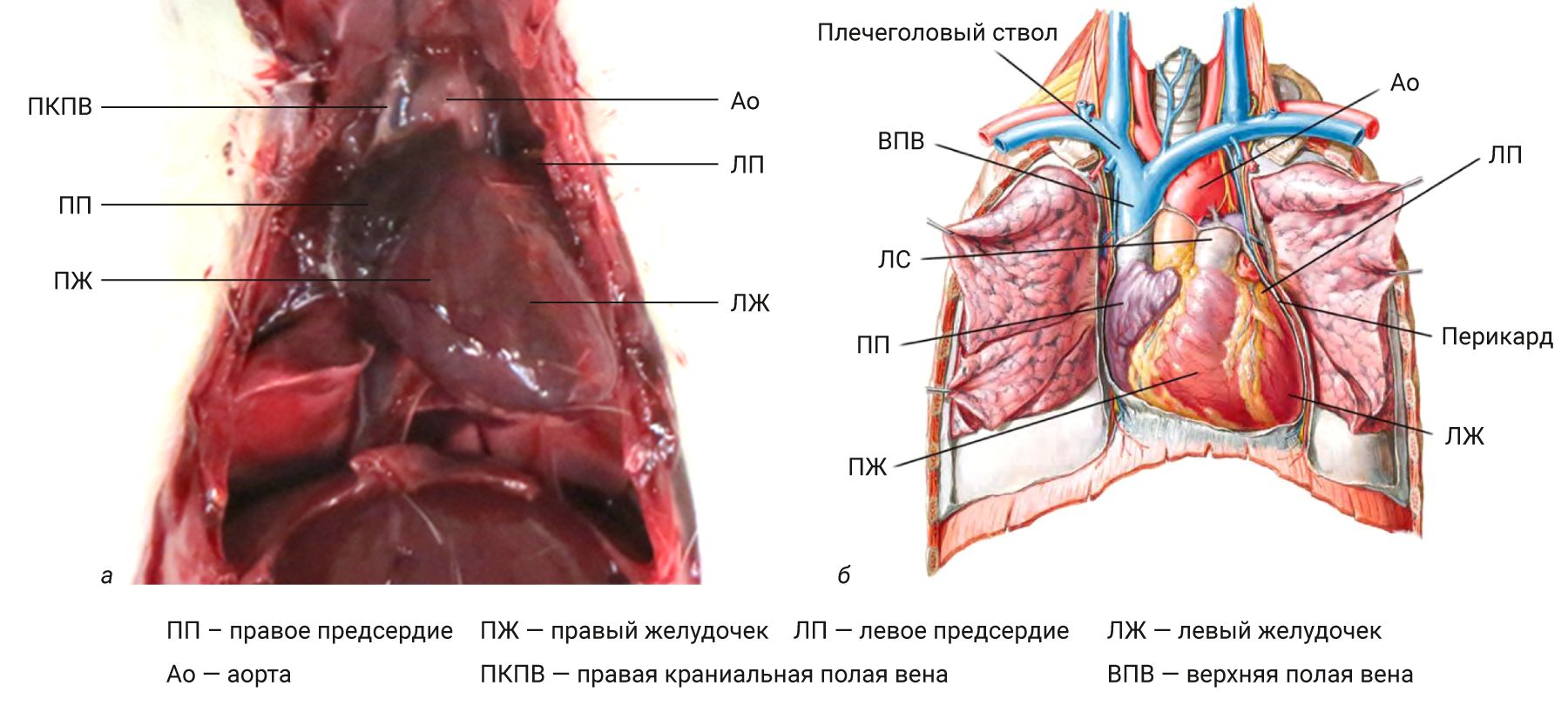
Различают основание (basis cordis) и верхушку (apex cordis) сердца, а также следующие поверхности сердца: переднюю (грудино-реберную; facies sternocostalis), прилежащую к грудине, ребрам и межреберным мышцам; нижнюю (диафрагмальную; facies diaphragmatica) и латеральные (легочные; facies pulmonales), примыкающие к корням легких и окруженные медиастинальной плеврой. У грызунов и кроликов, как и у всех четвероногих млекопитающих, верхушка сердца больше направлена к грудине в отличие от человека. Также сердце животных сильно развернуто левым желудочком к передней стенке грудной клетки, в то время как у человека правая половина сердца развернута кпереди [2, 3].
Форма сердца разнообразна, преимущественно округло-коническая. Она несколько различается в зависимости от телосложения человека и сильно отличается у разных видов животных: у кроликов более округлая со скругленной верхушкой, а у грызунов – овоидно-сферическая.
На поверхности сердца как у человека, так и животных хорошо визуализируется поперечно расположенная венечная борозда (sulcus coronarius) и продольная передняя межжелудочковая борозда (sulcus interventricularis ant) [2]. У человека хорошо выражена задняя межжелудочковая борозда (sulcus interventricularis post), которая у кроликов обозначена слабо, при этом у них на поверхности левого желудочка также наблюдается третья нечеткая и непостоянная промежуточная борозда [1, 2].
Как и у всех млекопитающих, сердце человека и рассматриваемых животных разделено на 4 камеры: 2 желудочка (ventriculus dex. et sin.) и 2 предсердия (рис. 2). Их границей служит фиброзное кольцо (annulus fibrosus), которое является своеобразным «скелетом» сердца, образуя опору для клапанов сердца и тем самым обеспечивая их динамическую функцию на протяжении всей жизни.
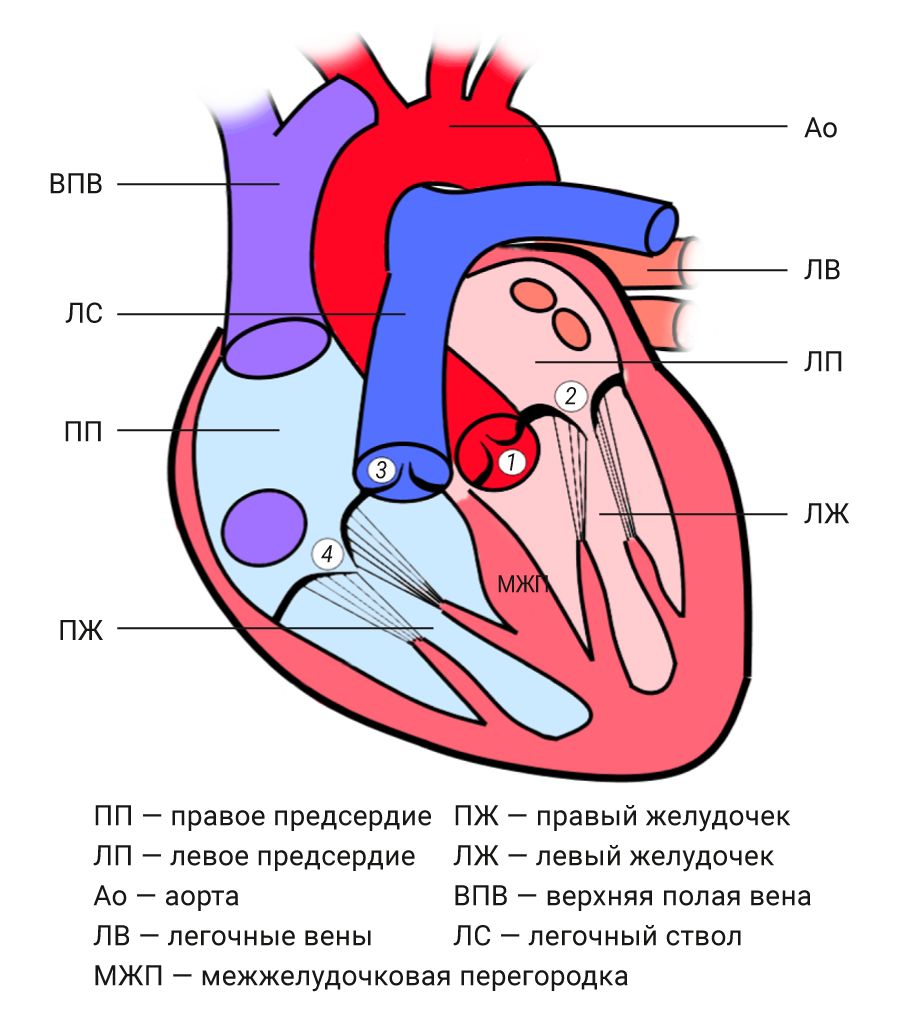
Правое предсердие имеет шарообразную или кубическую форму, кпереди продолжается полым отростком – ушком (auriculf dext.), книзу сообщается с правым желудочком правым атриовентрикулярным отверстием с трехстворчатым клапаном. Внутренняя поверхность неровная за счет гребенчатых мышц (mm. pectinati). На латеральной стенке предсердия гребенчатые мышцы, оканчиваясь, образуют возвышение – пограничный гребень (crista terminalis). Тонкая межпредсердная перегородка, представляющая собой два листка эндокарда, в центре имеет овальную ямку (fossa ovalis), оставшуюся после закрытия овального отверстия. В правое предсердие впадают нижняя и верхняя полая вены, пространство между ними называется синусом полых вен (sinus venarum cavarum). Устье нижней полой вены ограничено заслонкой (valvula venae cavae inf.). В отличие от человека, у которого одна верхняя полая вена образована слиянием правой и левой плечеголовных вен, у мышей и крыс имеется 2 краниальные полые вены – правая и левая, которые образуются слиянием соответствующих яремных и подключичных вен, впадающих в правое предсердие по отдельности [2, 4–6]. У кроликов также 2 краниальных вены, но есть и особенность – венозный синус не полностью объединен с предсердием и представляет собой 2 невыраженные области – передневерхнюю и заднюю, которая продолжается межпредсердной перегородкой, и именно на ней расположена овальная ямка [1, 4].
Левое предсердие шарообразной формы, также имеет слепое выпячивание – левое ушко (auricula sin.). Внутренняя поверхность гладкая, только в ушке имеются неровности за счет гребенчатых мышц. В предсердие впадают легочные вены. У человека их 4 – по 2 ствола из каждого легкого. У крыс 4 легочные вены, но 1 идет от левого легкого и 3 – от правого [4], у мышей вены сливаются вместе и в правое предсердие входят одним общим стволом [6]. У кроликов и морских свинок 3 крупных ствола [1, 7]. Книзу открывается левое атриовентрикулярное отверстие в левый желудочек.
Правый желудочек (ventriculus dext.) имеет конусообразную форму, у грызунов в поперечном сечении он серповидный за счет мощной межжелудочковой перегородки [5]. Стенки желудочка заметно тоньше, чем у левого. В желудочке выделяют 2 области – собственно желудочек и артериальный конус, который продолжается легочным стволом. В желудочке имеется два отверстия, прикрытых клапанами: правое атриовентрикулярное (ostium atrio-ventriculare dext.) с трехстворчатым клапаном и отверстие легочного ствола (ostium trunci pulmonalis) с клапаном легочного ствола. Трехстворчатый клапан (правый предсердно-желудочковый, valva atrioventricularis dext., valva tricuspidalis) препятствует току крови из желудочка в предсердие, состоит из фиброзного кольца, створок, от свободного края которых сухожильные хорды тянутся к сосочковым мышцам (mm. papillares). И у человека, и у животных в большинстве случаев 3 створки и 3 мышцы, но их может быть и больше. Клапан легочного ствола представлен 3 полулунными заслонками, между ними и стенкой легочного ствола формируются луночки, которые наполняются кровью при диастоле, тем самым смыкая заслонки друг с другом.
Левый желудочек (ventriculus sin.) конической формы с мощными стенками, внутренняя поверхность неровная за счет множества трабекул, рядом с отверстием аорты располагается артериальный конус. Имеет два отверстия – левое атриовентрикулярное (ostium atrio-ventriculare sin.) и отверстие аорты (ostium aortae), в которых так же, как и в правом, располагаются клапаны. Атриовентрикулярное отверстие прикрыто двустворчатым клапаном (valva atrioventricularis sin., valva mitralis), от него к 2 сосочковым мышцам отходят сухожильные хорды. Аортальный клапан образован тремя полулунными заслонками, которые совместно со стенкой аорты образуют синусы (sinus aortae), от них начинаются коронарные артерии. Присутствует значительная вариабельность количества структур обоих клапанов. Межжелудочковая перегородка состоит преимущественно из мышечной ткани, но в верхней части имеется небольшой участок фиброзной ткани, покрытый эндокардом. Таким образом, в ней выделяют мышечную часть (pars muscularis) и перепончатую часть (pars membranacea) [2].
Сосуды
Кровоснабжение сердца (рис. 3) осуществляется обычно 2 коронарными артериями – левой и правой (аа. coronariae sin. et dext.), которые начинаются в пределах луковицы аорты. Возможны редкие варианты количества коронарных артерий (1 или 3–4) [2].
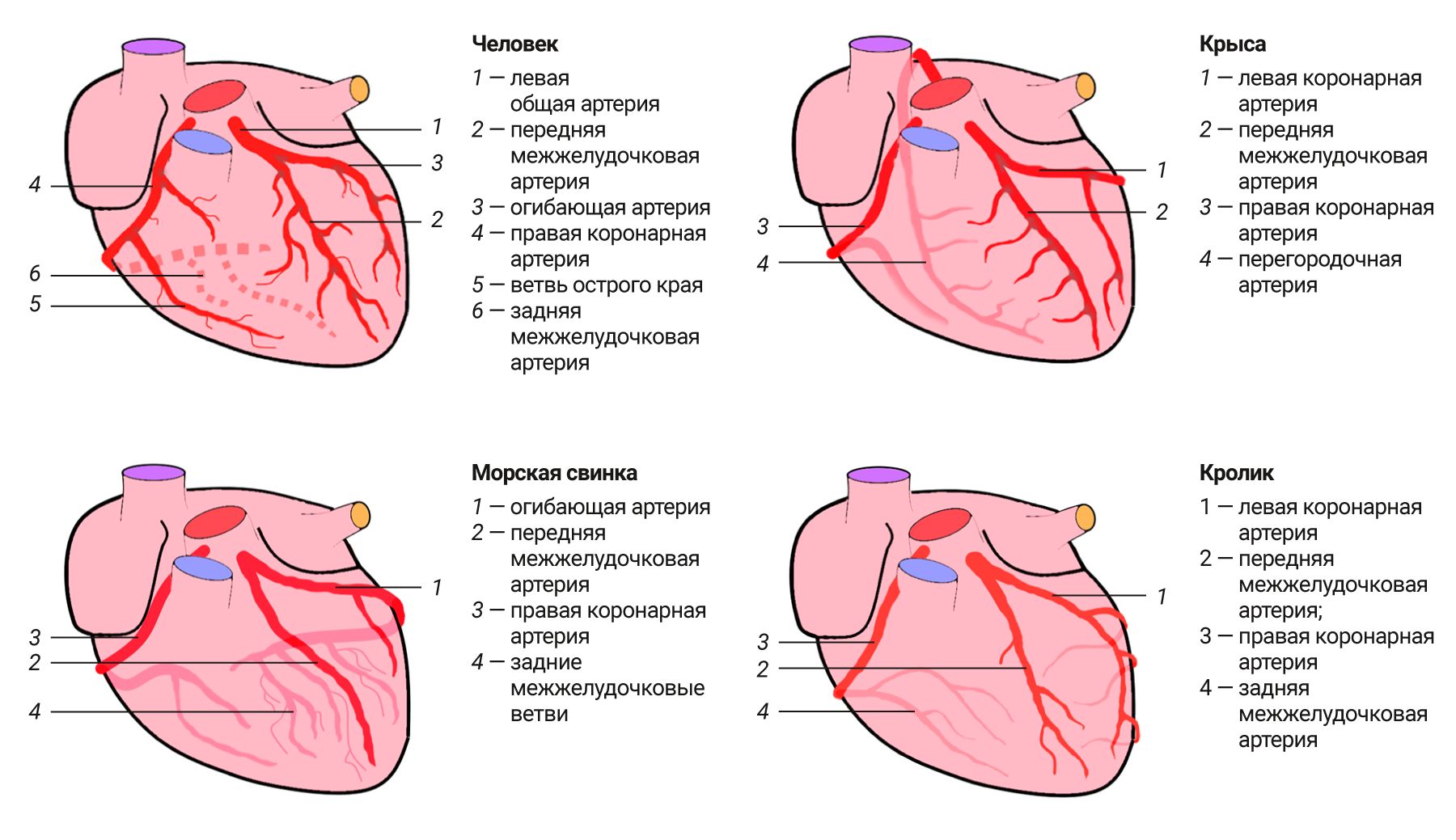
Левая коронарная артерия отходит от аорты, проходит по венечной борозде и разделяется на две ветви – огибающую (r. circumflexus) и переднюю межжелудочковую (r. Interventricularis ant.) (у животных она называется околоконусной – r. Interventricularis paracanalis), которая в области верхушки анастомозирует с задней межжелудочковой артерией. Таким образом, левая коронарная артерия питает левое предсердие, большую часть левого желудочка, часть правого желудочка и межпредсердную перегородку. Правая коронарная артерия ложится в венечную борозду и далее продолжается, образуя) заднюю межжелудочковую ветвью (r. Interventricularis post.) (у животных подсинусная – r. Interventricularis subsinuosus), спускающуюся к верхушке сердца и отдающую ветви межпредсердной и межжелудочковой перегородкам. Часто она разветвляется, составляя огибающую и заднюю межжелудочковую ветви, анастомозирующие с системой левой коронарной артерии. Кровоснабжение сердца животных в целом схоже с анатомией коронарных сосудов человека. У мышей и крыс отдельно выделяют перегородочные ветви (rr. septales) правой коронарной артерии, которые участвуют в кровоснабжении межжелудочковой перегородки [5, 8]. У мышей перегородочные ветви также могут начинаться как непосредственно от аорты, так и из системы левой коронарной артерии [6, 9]. У кроликов тоже присутствуют перегородочные ветви, которые отходят как от правой, так и от левой коронарной артерий [10]. У крыс левая огибающая артерия не выражена, присутствует ветвь, отходящая от околоконусной межжелудочковой ветви левой коронарной артерии и идущая параллельно межжелудочковой перегородке [6], в результате чего кровоснабжение межжелудочковой перегородки индивидуально у каждого животного и у 50% животных может осуществляться правой коронарной артерией, а у 50% – левой [11, 12]. У кроликов околоконусная межжелудочковая ветвь в области верхушки сердца сильно разветвляется, но из-за короткой подсинусной межжелудочковой ветви образует очень мало анастомозов [10, 13]. У морских свинок правая коронарная артерия короткая и не кровоснабжает заднюю стенку правого желудочка, но при этом значительно выражены правая огибающая ветвь и перегородочные ветви, которые имеют обширные коллатерали с левой коронарной артерией [12, 13].
Примечательно, что у крыс и мышей крупные коронарные артерии почти сразу располагаются интрамурально, в то время как у человека они на значительном протяжении идут эпикардиально и только дистальная часть уходит в толщу миокарда [6].
Артерии разветвляются на более мелкие и далее – на артериолы, которые распространяются во всех слоях стенки и в свою очередь распадаются на интрамуральное капиллярное сплетение. Капилляры в большинстве своем ориентированы параллельно миокардиоцитам и образуют обширные анастомозы между собой. У человека соотношение капилляры: кардиомиоциты составляют примерно 1:1 [14]. Примерно такое же соотношение наблюдается у крыс, мышей и кроликов [15–17]. Хотя этот показатель разнится в зависимости от исследуемого участка (правый/левый желудочек или предсердие). Затем капилляры формируют венозные синусы, из которых кровь собирается в наименьшие вены сердца (vv. cordis minimae). Они впадают в более крупные вены, которые густо оплетают сердце и формируют основные его вены. Большая часть крупных вен собирается в венечный синус: большая вена сердца (v. cordis magna), задняя вена левого желудочка (v. post, ventriculi sin.), косая вена левого предсердия (v. obliqua atrii sin.), средняя вена сердца (v. cordis media) и малая вена (v. cordis parva). В меньшей степени кровь через передние вены (vv. cordis ant.) и наименьшие вены сразу поступает в правое предсердие. У крыс и мышей ветвление коронарных вен очень изменчиво и вариабельно, кроме того, нет единой терминологии в их наименовании. Однако можно выделить следующее: в большинстве случаев венозная система представлена левой веной, большой каудальной веной, правой и левой конической венами, также существуют варианты с наличием выраженной краниальной вены, каудальных вен, левой предсердной вены [4, 8]. Анатомия венозной системы сердца кролика сходна с таковой у человека, за исключением, как упоминалось ранее, выраженного венечного синуса [18].
Лимфатическая система сердца состоит из концевых капилляров, капиллярных сплетений, которые осуществляют отток лимфы из субэпикардиальных, миокардиальных и субэпикардиальных областей в собирательные (дренирующие) сосуды. Капилляры располагаются между мышечными пучками и сопровождают кровеносные сосуды. Лимфатические сплетения распределены относительно равномерно в оболочках сердца. Однако у мышей и кроликов субэндокардиальное сплетение менее развито по сравнению с субэпикардиальным и миокардиальным [19, 20]. Очень важной является связь лимфатического дренажа с проводящей системой сердца. Узлы и проводящие пути густо оплетены лимфатической сетью, поэтому при нарушениях лимфооттока, а также при повышении уровня калия в ней возможно развитие частичной или даже полной блокады проводимости [21]. Капилляры сливаются в более крупные сосуды и проходят в субэпикардиальном пространстве параллельно кровеносным сосудам. Сливаясь, они образуют преколлекторы, а затем коллекторы, которые вливаются в лимфатические узлы. У мышей и крыс в отличие от других видов животных и человека преколлекторы и коллекторы сопровождают вены сердца [22]. Лимфатические пути образуют два ствола – левый и правый. Левый, или главный, ствол собирает лимфу с левой и частично – правой половины сердца. Правый менее выражен и образован из лимфатических сосудов, идущих преимущественно от правого желудочка. Далее лимфа достигает регионарных лимфатических узлов – левый ствол чаще идет к лимфатическим узлам бифуркации трахеи, правый – к передним мезентериальным узлам [2, 23]. После чего лимфатические пути разделяются на правый и левый медиастинальные лимфатические стволы, которые впадают в венозные углы [21, 23]. Есть данные, что у человека оба ствола соединяются в единый, идущий к корню аорты [22]. Интересно, что у мышей правый ствол вбирает в себя лимфу от левого желудочка [22].
Гистология
Сердце состоит из трех следующих оболочек (рис. 4): внутренняя – эндокард (endocardium), средняя – миокард (myocardium), составляет основную массу сердца и наружная – эпикард (epicardium), является висцеральным листком перикарда.
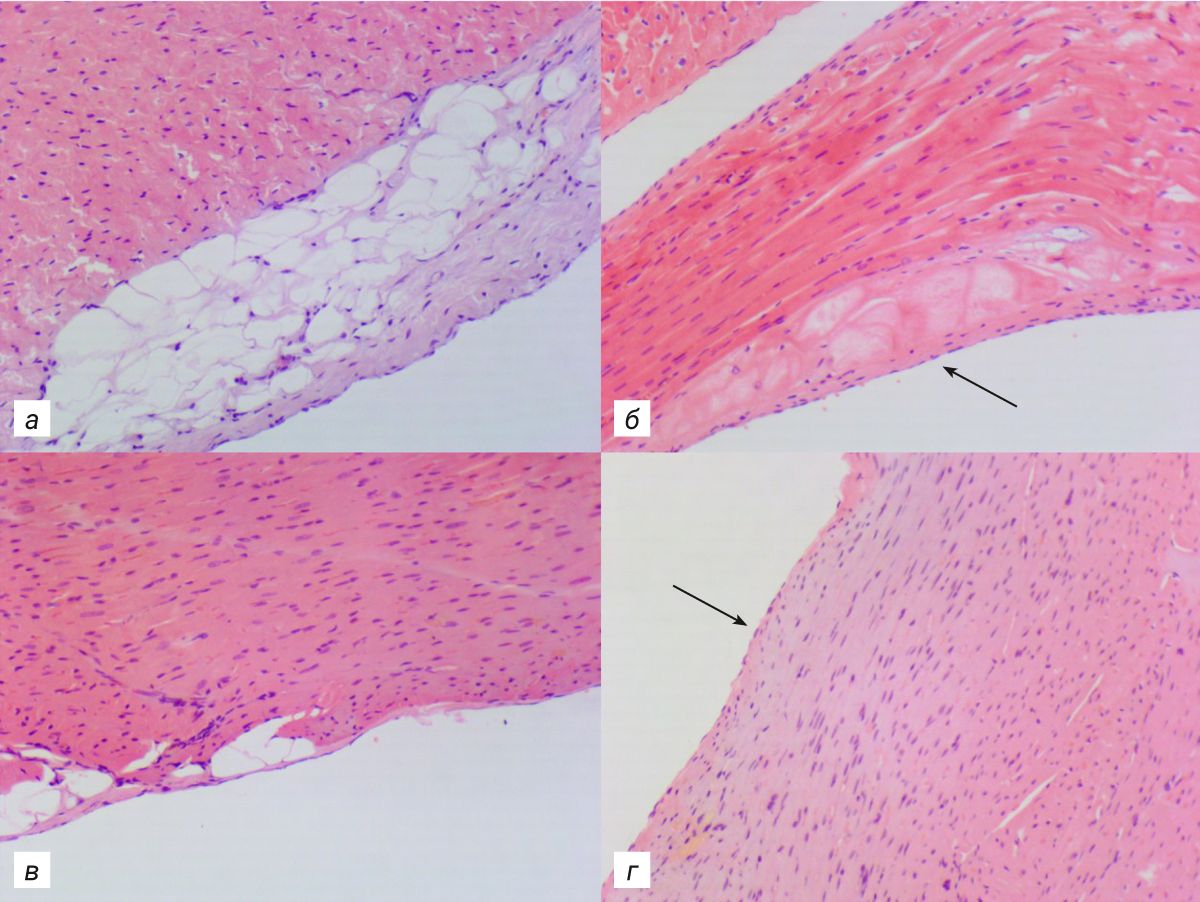
Эпикард и перикард являются дубликатурами серозной оболочки и образованы фиброэластической соединительной тканью, покрытой однослойным эпителием (мезотелием). В них выделяют несколько слоев: мезотелий, базальную мембрану, поверхностный слой коллагеновых волокон, поверхностный коллагеново-эластический слой, слой эластических волокон и глубокий слой коллагеново-эластических волокон. Эпикард плотно срощен с эндомизием миокарда. В толще оболочек, кроме соединительной ткани, располагается и жировая ткань, многочисленные кровеносные и лимфатические сосуды, а также нервные волокна [24]. В отличие от людей и кроликов у грызунов эпикард и перикард имеют меньше соединительнотканных слоев и гораздо тоньше (относительно размеров тела). Также в эпикарде крыс и мышей почти отсутствует жировая ткань, сгруппированная в основном в области межжелудочковой и межпредсердной борозд, хотя у человека она может охватывать все сердце [6, 11].
Эндокард – это внутренняя оболочка сердца, покрывающая всю поверхность желудочков и предсердий, а также все структуры, выступающие в их просвет – клапаны, трабекулы, сосочковые мышцы. Его толщина неоднородна и зависит от толщины сердечной мышцы: в желудочках значительно толще, чем в предсердиях. Состоит эндокард из четырех слоев: эндотелий, субэндотелиальный слой, образованный рыхлой соединительной тканью, затем мышечно-эластический слой, и самый глубокий слой представлен соединительной тканью с толстыми коллагеновыми и ретикулярными волокнами, здесь могут находиться жировые клетки, проходить кровеносные сосуды и нервные волокна, а также в отдельных участках – ветви проводящей системы сердца [24]. У грызунов эндокард не выражен, он настолько тонкий, что слои практически не различимы. При световой микроскопии удается различить только эндотелий и небольшое количество соединительной ткани [6].
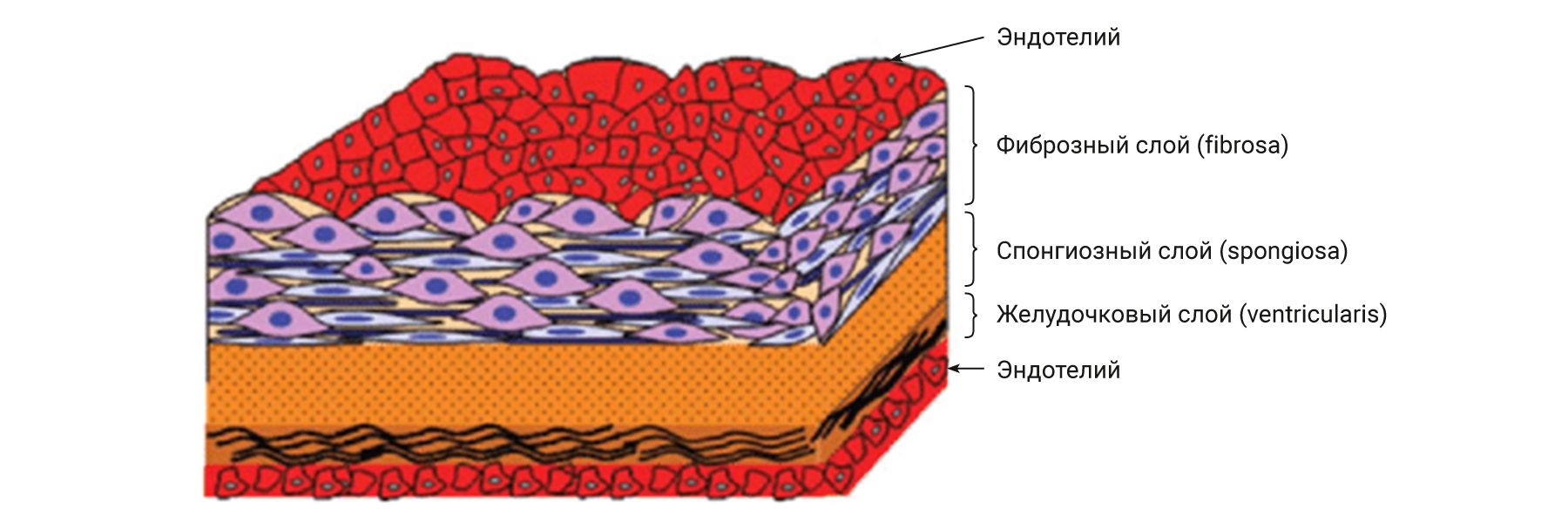
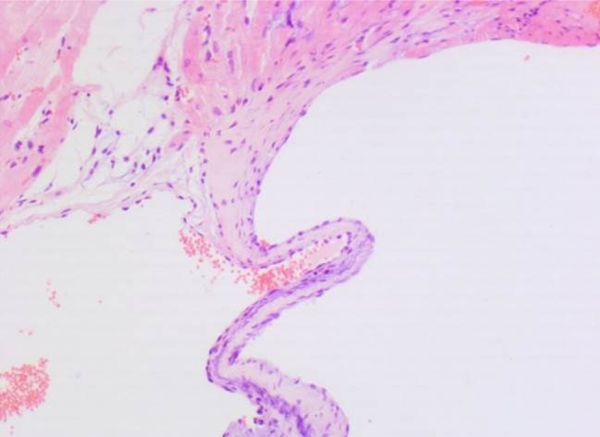
Клапаны сердца представляют собой складку эндокарда с прослойкой соединительной ткани, в которой выделяют несколько слоев (рис. 5). Каркасом служит спонгиозный слой (spongiosa), состоящий из гликозаногликанов и рыхлого коллагена, сверху он покрыт желудочковым слоем (ventricularis), состоящим из эластических волокон, а книзу от него расположен фиброзный слой (fibrosa), содержащий преимущественно коллагеновые волокна [25]. У основания клапанов имеются скопления гладкомышечных клеток, сокращение которых обеспечивает расправление клапанов. Как указывалось ранее, клапаны прикреплены к фиброзному скелету сердца. Несмотря на их схожесть, каждый из них является отдельной анатомической и функциональной структурой, подвергающейся разным динамическим нагрузкам и способной работать в индивидуальных условиях [26]. Поэтому соотношение соединительнотканных волокон, а также их направление в клапанах различно. Строение клапанов у человека и лабораторных животных схожее, только у грызунов границы слоев нечеткие, спонгиозный слой очень тонкий и зачастую различим только у основания клапанов (рис. 6) [6].
Миокард
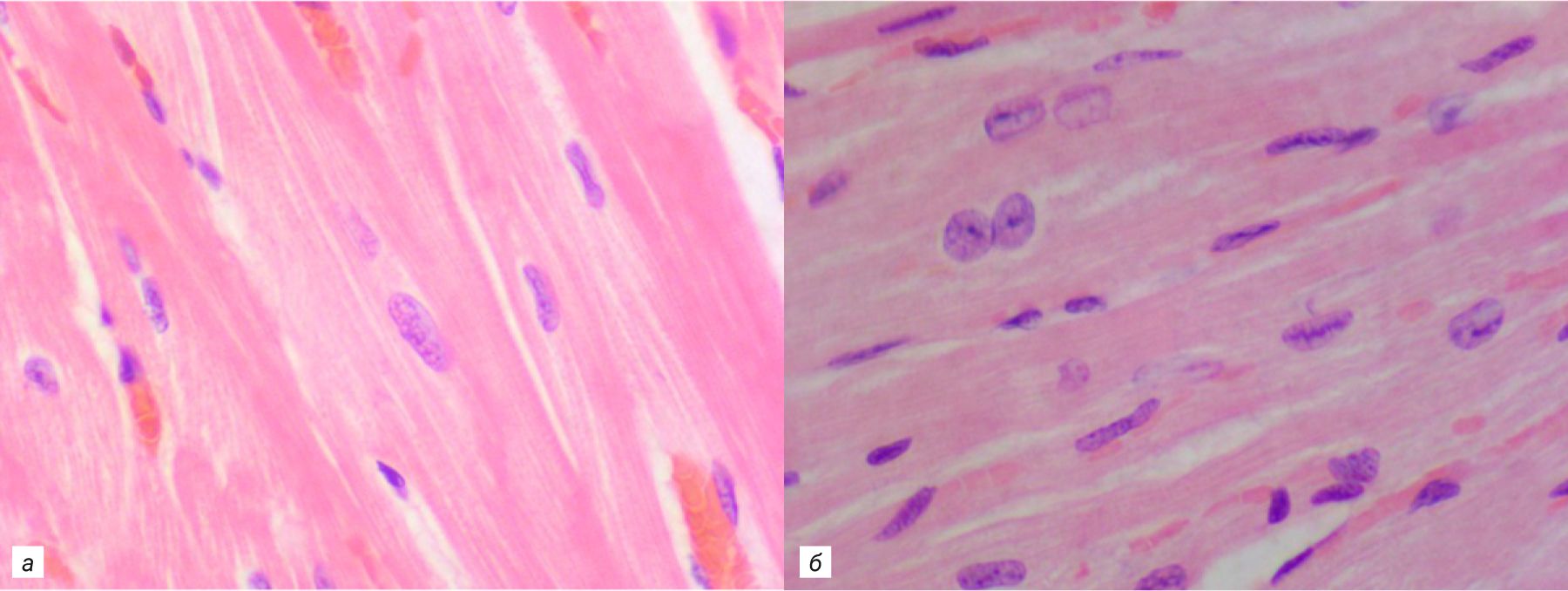
Основная масса сердца приходится на среднюю мышечную оболочку (рис. 7). Она состоит из кардиомиоцитов, которые можно разделить на 3 группы: рабочие, или сократительные, проводящие и секреторные. Рабочие кардиомиоциты составляют основной объем миокарда. Они схожи с миоцитами скелетных мышц, но в отличие от них сильно ветвятся, образуя между собой анастомозы, при этом они тоньше и короче. Характерная черта кардиомиоцитов – вставочный диск по краям клетки, который выполняет опорную функцию для сократительных элементов клетки (миофиламенты) и обеспечивает единое сокращение миокарда, тем самым создавая функциональный синцитий. Ядра занимают центральную часть клеток. У кроликов и грызунов, особенно у мышей, большинство кардиомиоцитов двуядерные, а у человека, наоборот, двуядерные клетки редки, и увеличение плоидности ядер является негативным признаком [6, 27]. Между кардиомиоцитами располагается щелевидное пространство, заполненное обильно васкуляризированной соединительной тканью.
Немногочисленные секреторные, или миоэндокринные, клетки миокарда располагаются преимущественно в правом предсердии, имеют отростчатую форму и содержат осмиофильные гранулы. Они вырабатывают предсердный натрийуретический пептид, участвующий в регуляции кровяного давления и водно-электролитного равновесия.
Проводящие кардиомиоциты являются специализированными мышечными волокнами, обладающими способностью к генерации и передаче нервного импульса, и образуют узлы, пучки проводящей системы сердца. Они характеризуются слабым развитием сократительного аппарата, отсутствием Т-трубочек и поперечной исчерченности, поскольку миофибриллы расположены неупорядоченно. Из них выделяют три вида клеток: пейсмекеры, или Р-клетки, расположенные в синоатриальном узле (СА-узел), переходные, или Т-клетки, и третьим типом являются клетки пучка Гиса и волокон Пуркинье. Р-клетки обладают собственным автоматизмом, их потенциал действия постепенно уменьшается, что называется медленной диастолической деполяризацией. В результате чего возбудимость клетки постоянно нарастает и при достижении критического уровня в клетке возникает потенциал действия [28]. По периферии синоатриального узла располагаются Т-клетки, они проводят полученный импульс к другим клеткам предсердия, а также формируют атриовентрикулярный узел (АВ-узел). Эти клетки тоже обладают функцией автоматизма, но из-за подчинения синоатриальному узлу в нормальных условиях выполняют проводящую функцию. Клетки Пуркинье представляют рабочие клетки миокарда, но миофибрилл у них меньше, расположены они по периферии клеток и содержат мало гликогена [24].
Проводящая система
Это комплекс анатомических образований (узлы, пучки и волокна), который способен генерировать импульс, распространяющийся по всем отделам сердца, вызывающий координированное сокращение кардиомиоцитов (рис. 8).
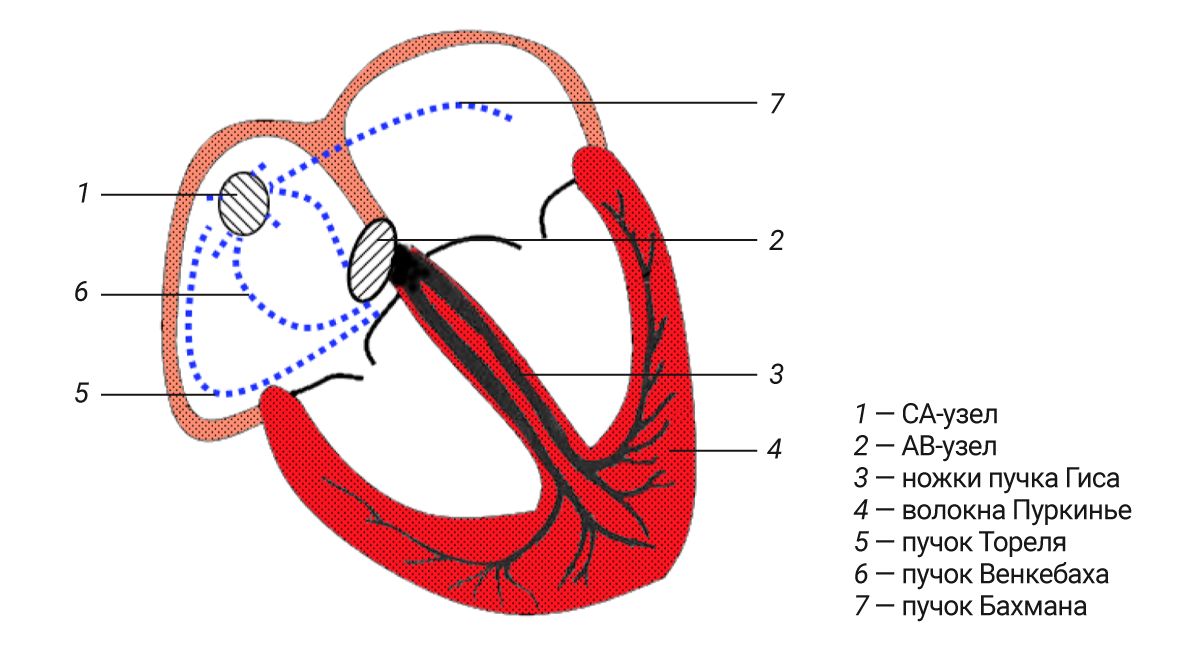
Анатомически различают два взаимосвязанных отдела проводящей системы: синусно-предсердный и атрио-вентрикулярный.
Синусно-предсердный отдел представлен синусно-предсердным узлом (синоатриальный узел; узел Киса–Фляка; node Keith–Flack; nodus sinuatrialis) и отходящими от него пучками. Атриовентрикулярная часть состоит из атриовентрикулярного узла (nodus atrioventricularis) и проводящих путей: пучка Гиса (атриовентрикулярный пучок; предсердно-желудочковый пучок; fasciculus atrioventricularis) с его левой и правой ножками и периферическими разветвлениями (проводящие волокна Пуркинье; myofibrae conducentes purkinjienses).
СА-узел является основным водителем ритма, он отвечает за инициацию и регуляцию сердечного ритма. Узел вытянутой формы, расположен субэпикардиально в правом предсердии, в области устья верхней (краниальной) полой вены, у пограничного гребня [28]. Он тесно оплетен кровеносными сосудами и нервными волокнами как симпатической, так и парасимпатической нервной системы. По периферии он отделен от рабочего миокарда тонкой прослойкой соединительной ткани, выполняющей роль изолятора (ту же роль выполняет фиброзное кольцо сердца, отделяя предсердия от желудочков). От СА-узла импульс быстро распространяется по проводящим пучкам Бахмана, Венкебаха и Торела по предсердиям, вызывая их одновременное сокращение, и достигает атриовентрикулярного узла [2, 28]. В АВ-узле импульс задерживается, тем самым обеспечивая сокращение желудочков только после предсердий. Сам узел округлой формы, расположен в межпредсердной перегородке у трехстворчатого клапана. Он имеет трехслойное строение. Первый слой состоит из Т-клеток и коллагеновых волокон, что и определяет замедление импульса. Затем идет собственно АВ-узел, в состав которого входят преимущественно Т-клетки, но присутствуют и Р-клетки. Третий слой продолжается общим стволом пучка Гиса [28, 29]. Такое строение АВ-узла формирует два пути проведения – медленный (α) и быстрый (β), что, учитывая возможность антеградного проведения импульса в узле, при определенных условиях создает предпосылки возникновения реципрокных аритмий [28].
От АВ-узла отходит общий ствол (truncus) пучка Гиса, который проникает в перепончатую часть межжелудочковой перегородки и вскоре разделяется на 2 ножки – левую и правую (crus sin. et dext.). В области верхушки сердца ножки расходится – левая, более толстая, направлена к миокарду левого желудочка, правая – к миокарду правого желудочка, вскоре они разветвляются на многочисленные ветви (rr. cruris), заканчивающиеся среди рабочего миокарда проводящими волокнами Пуркинье. Также существуют добавочные проводящие тракты – пучки Кента, Джеймса, волокна Махейма.
У человека и лабораторных животных общий план строения проводящей системы сердца похож. Есть различия относительных размеров и формы узлов, а также ветвления путей, хотя их ход в миокарде вариабелен также и внутри вида. Однако стоит отметить и ряд особенностей. У человека СА-узел расположен под эндокардом, а у животных (например, кроликов, морских свинок) часть узла находится в межполостной области и может занимать все пространство между эндокардом и эпикардом [30]. У кроликов в СА-узле много Р-клеток, сам узел относительно большой и расположен с края от артерии (у человека и других видов артерия лежит в центре узла), что, вероятно, объясняет нестабильность ритма при операциях или без анестезии. АВ-узел небольшой и хотя его строение такое же, но есть мнение о его «незрелости» из-за недоразвитого венозного синуса. Исходя из поперечных размеров проводящих путей, основной путь проходит через передний интернодальный путь, а путь межпредсердной проводимости – через пучок Бахмана [31]. У морских свинок, наоборот, СА-узел относительно небольшой, Р-клеток меньше, чем у кроликов, при этом отсутствуют Т-клетки у границы перегородки [13, 30]. У мышей в СА-узле присутствует компактная группа плотноупакованных клеток с небольшим количеством соединительной ткани, отделенная от мышц предсердия соединительнотканной прослойкой, при этом другие участки узла имеют диффузное расположение клеток. Данная структура уникальна для мышей и не встречается у других животных и человека, но значение такого плотного расположения клеток пока неясно [32, 33].
Заключение
Строение сердца у человека и лабораторных животных имеет одинаковый план организации: похоже, топографическое расположение органа, его анатомическое и гистологическое строение. Однако присутствуют и видовые особенности, которые необходимо принимать во внимание при проведении исследований и интерпретации их результатов (основные отличительные черты представлены в таблице). Прежде всего, хочется отметить несоответствие номенклатуры, используемой в анатомии человека и животных. Это объясняется различным расположением тела – человек прямоходящий и, например, при описании его анатомических структур, используются термины «верх/низ», в то время как у животных принято обозначение «краниальный/каудальный», что вносит некоторое непонимание. Кроме того, анатомическая номенклатура животных не до конца сформирована и разнится в зависимости от приверженности к той или иной «анатомической школе».
Расположение сердца у животных в грудной клетке опосредовано их пространственным положением тела. У всех четвероногих оно отклонено к грудине и развернуто левым желудочком к передней грудной клетке, у человека, наоборот, верхушка сердца прилежит к диафрагме, а правая половина повернута кпереди.
Форма сердца так же имеет видоспецифичность: вытянутая у человека и округлая у кроликов.
Строение предсердий и желудочков различается не сильно, можно отметить только разное количество таких структур, как створки клапанов, хорды и сосочковые мышцы, но такое разнообразие прослеживается и внутри видов.
Выраженные особенности имеет количество и расположение полых вен. У человека их 2 – верхняя и нижняя, в то же время у животных две краниальные вены впадают в правое предсердие, причем у кроликов венозный синус не полностью сформирован и является своеобразной отдельной от сердца структурой. В левом предсердии анатомия легочных вен так же разнится: по 2 вены от каждого легкого у человека, у мышей они сливаются в единый ствол, у кроликов и морских свинок – 3 вены, а у крыс – 4, но 1 идет от левого легкого и 3 – от правого.
Ход коронарных артерий и их вклад в кровоснабжение отделов миокарда так же имеет свою видоспецифичность, в результате чего различен и тип кровоснабжения миокарда. Преимущественно доминирует левая коронарная артерия, но у крыс и мышей правая и левая коронарные артерии равномерно кровоснабжают миокард. Примечательно, что у животных присутствуют отдельные перегородочные ветви правой коронарной артерии, которых нет у человека. Так же у грызунов венечные артерии почти сразу после отхождения от аорты уходят в толщу миокарда, у человека они длительное время идут эпикардиально.
Гистологическое строение сердца одинаково у всех видов. Есть небольшие различия, скорее связанные с размерами животных: у грызунов эпикард и перикард тонкий и его слои не прослеживаются, так же почти не различим и эндокард, а клапаны сердца имеют смазанную слоистую структуру в отличие от более крупных видов. Рабочие кардиомиоциты у мышей и крыс в отличие от человека, ди- и полиплоидны, что у других видов можно рассматривать как проявление патологии.
Проводящая система сердца у всех млекопитающих имеет единый план строения. Можно отметить некоторую вариативность расположения узлов и их клеточный состав.
В данном обзоре рассмотрено только морфологическое строение структур и не обсуждались их физиологические параметры, поскольку данная тема требует отдельного обзора.
Список источников
- Жеденов В. Н. Анатомия кролика. М.: Сов. Наука. 1957. С. 312 [Zhedenov V. N. Anatomy of the rabbit. M.: Sov. Nauka, 1957. 312 p. (In Russ.)].
- Привес М. Г. Лысенков Н. К., Бушкович В. И. Анатомия человека: учебник. 12 издание. СПб.: Гиппократ, 2008. С. 704 [Prives M. G. Lysenkov N. K.. Bushkovich V. I. Human Anatomy: A Textbook. 12rd ed.// SPb. : Gippokrat, 2008. 704 p. (In Russ.)].
- Shively M.J., Stump J.E. The systemic arterial pattern of the guinea pig: the abdomen. Anat Rec. 1975 Jul;182(3):355-66. doi: 10.1002/ar.1091820309.
- Krešáková L, Purzyc H, Schusterová I, Fulton B, Maloveská M, Vdoviaková K, Kravcová Z, Boldižár M. Variability in the cardiac venous system of Wistar rats. J Am Assoc Lab Anim Sci. 2015 Jan;54(1):10-6.
- Ноздрачев А. Д., Поляков Е. Л. Анатомия крысы. СПб.: Издательство «Лань», 2001.С. 464 [Nozdrachev A. D.. Polyakov E. L. Anatomy of the rat. SPb.: Izdatelstvo «Lan,. 2001. 464 p. (In Russ.)].
- Treuting P. M., Dintzis S.M., Kathleen S. Montine. Comparative Anatomy and Histology: A Mouse, rat and Human Atlas. Elsevier. Academic Press 2018: 570
- Wagner J.E., Manning P. J. The Biology of the Guinea Pig. American College of Laboratory. Animal Medicine Academic Press, 1976. 317 p.
- Ciszek B., Skubiszewska D., Ratajska A. The anatomy of the cardiac veins in mice. J Anat. 2007;211(1):53-63. doi:10.1111/j.1469-7580.2007.00753.x
- Yoldas A., Ozmen E., Ozdemir V. Macroscopic description of the coronary arteries in Swiss albino mice (Mus musculus). J S Afr Vet Assoc. 2010 Dec;81(4):247-52. doi: 10.4102/jsava.v81i4.156. PMID: 21526741.
- Bahar S., Ozdemir V., Eken E., Tipirdamaz S. The distribution of the coronary arteries in the Angora rabbit. Anat Histol Embryol. 2007 Oct;36(5):321-7. doi: 10.1111/j.1439-0264.2007.00770.x. PMID: 17845219.
- Robert Lewis Maynard, Noel Downes. Anatomy and Histology of the Laboratory Rat in Toxicology and Biomedical Research. Academic Press. 2019: 378
- Ahmed S.H., Rakhawy M.T., Abdalla A., Assaad E.I. The comparative anatomy of the blood supply of cardiac ventricles in the albino rat and guinea-pig. J Anat. 1978 May;126(Pt 1):51-7.
- Flores N.A., Davies R.L., Penny W.J., Sheridan D.J. Coronary microangiography in the guinea pig, rabbit and ferret. Int J Cardiol. 1984 Oct;6(4):459-71. doi: 10.1016/0167-5273(84)90326-7.
- Rakusan K., Flanagan M.F., Geva T., Southern J., Van Praagh R. Morphometry of human coronary capillaries during normal growth and the effect of age in left ventricular pressure-overload hypertrophy. Circulation. 1992 Jul;86(1):38-46. doi: 10.1161/01.cir.86.1.38.
- Iemitsu M., Maeda S., Jesmin S., Otsuki T., Miyauchi T. Exercise training improves aging-induced downregulation of VEGF angiogenic signaling cascade in hearts. Am J Physiol Heart Circ Physiol. 2006 Sep;291(3):H1290-8. doi: 10.1152/ajpheart.00820.2005.
- Al-Samir S., Wang Y., Meissner J.D., Gros G., Endeward V. Cardiac Morphology and Function, and Blood Gas Transport in Aquaporin-1 Knockout Mice. Front Physiol. 2016 May 24;7:181. doi: 10.3389/fphys.2016.00181.
- Goo S., Joshi P., Sands G., Gerneke D., Taberner A., Dollie Q., LeGrice I., Loiselle D. Trabeculae carneae as models of the ventricular walls: implications for the delivery of oxygen. J Gen Physiol. 2009 Oct;134(4):339-50. doi: 10.1085/jgp.200910276.
- Yoldaş, A., Nur I.H. The distribution of the cardiac veins in the New Zealand White rabbits (Oryctolagus cuniculus). Iranian Journal of Veterinary Research. 2012. 13(3), 227-233. doi: 10.22099/ijvr.2012.362
- Flaht-Zabost A., Gula G., Ciszek B., Czarnowska E., Jankowska-Steifer E., Madej M., Niderla-Bielińska J., Radomska-Leśniewska D., Ratajska A. Cardiac mouse lymphatics: developmental and anatomical update. Anat Rec (Hoboken). 2014 Jun;297(6):1115-30. doi: 10.1002/ar.22912.
- Marchetti C., Poggi P., Calligaro A., Casasco A. Lymph vessels of the rabbit heart: distribution and fine structure in ventricles. Lymphology. 1985 Jun;18(2):90-5.
- Karunamuni Ganga. The cardiac lymphatic system: An overview. Springer-Verlag New York. 2014: 184. doi: 10.1007/978-1-4614-6774-8.
- Ratajska A, Gula G, Flaht-Zabost A, Czarnowska E, Ciszek B, Jankowska-Steifer E, Niderla-Bielinska J, Radomska-Lesniewska D. Comparative and developmental anatomy of cardiac lymphatics. ScientificWorldJournal. 2014. doi: 10.1155/2014/183170.
- Бородин Ю.И. Лимфатический дренаж сердца. Морфофункциональный аспект. // Вестник лимфологии. 2013. N4. с.4-10 [Borodin Yu.I. Limfaticheskii drenazh serdtsa. Morfofunktsional'nyi aspekt. // Vestnik limfologii. 2013.N4. s.4-10. (In Russ.)].
- Хэм А., Кормак Д. Гистология. В пяти томах. М.: Мир, 1983. Т-4. С. 245 [Khem A.. Kormak D. Histology. In five volumes. M.: Mir, 1983. V 4. 245 p. (In Russ.)].
- Sacks Michael, Liao Jun. Advances in Heart Valve Biomechanics Valvular Physiology, Mechanobiology, and Bioengineering. Springer. 2018: 487. doi: 10.1007/978-3-030-01993-8.
- Misfeld M., Sievers H.H. Heart valve macro- and microstructure. Philos Trans R Soc Lond B Biol Sci. 2007;362(1484):1421-1436. doi:10.1098/rstb.2007.2125.
- Bensley J.G., De Matteo R., Harding R., Black M.J. Three-dimensional direct measurement of cardiomyocyte volume, nuclearity, and ploidy in thick histological sections. Sci Rep. 2016;6:23756. doi:10.1038/srep23756.
- Paul A. Iaizzo. Handbook of Cardiac Anatomy, Physiology, and Devices. Humana Press. 2009: 659
- Monfredi O., Dobrzynski H., Mondal T., Boyett M.R., Morris G.M. The anatomy and physiology of the sinoatrial node-a contemporary review. Pacing Clin Electrophysiol. 2010 Nov;33(11):1392-406. doi: 10.1111/j.1540-8159.2010.02838.x.
- Д. В. Комягин, Е. С. Белкина. Кровоснабжение проводящей системы сердца (обзор литературы)// Весенние анатомические чтения: сборник статей научно‐практической конференции, посвященной памяти доцента В. М. Левченко. Гродно. 2019. C. 57-62 [D. V. Komyagin, E. S. Belkina. Krovosnabzhenie provodyashchei sistemy serdtsa (obzor literatury)// Vesennie anatomicheskie chteniya : sbornik statei nauchnO‐prakticheskoi konferentsii, posvyashchennoi pamyati dotsenta V. M. Levchenko. Grodno. 2019. C. 57-62. (In Russ.)].
- Boyett M.R., Honjo H., Kodama I. The sinoatrial node, a heterogeneous pacemaker structure. Cardiovascular Research. Vol. 47. 2000: 658–687. doi.org/10.1016/S0008-6363(00)00135.
- James T.N. Anatomy of the cardiac conduction system in the rabbit. Circ Res. 1967 Jun;20(6):638-48. doi: 10.1161/01.res.20.6.638.
- Liu J., Dobrzynski H., Yanni J., Boyett M.R., Lei M. Organisation of the mouse sinoatrial node: structure and expression of HCN channels. Cardiovasc Res. 2007 Mar 1;73(4):729-38. doi: 10.1016/j.cardiores.2006.11.016.




