Особенности дыхательной системы животных, используемых в доклинических исследованиях, которые необходимо учитывать при моделировании патологий легких
Каргопольцева Д.Р., Кательникова А.Е., Крышень К.Л., Гущин Я.А. Особенности дыхательной системы животных, используемых в доклинических исследованиях, которые необходимо учитывать при моделировании патологий легких. Лабораторные животные для научных исследований. 2020; 4. https://doi.org/10.29296/2618723X-2020-04-08
Резюме
Дыхательная система является одной из важнейших систем организма, обеспечивающей поступление кислорода из атмосферного воздуха в дыхательные пути, осуществляющие газообмен и выведение углекислого газа обратно в окружающую среду. Заболевания дыхательной системы влияют на жизнь большого числа людей в мире. При планировании исследований по изучению фармакологической активности и токсичности лекарственных препаратов при эндотрахеальном и ингаляционном путях введения следует принимать во внимание видовые особенности анатомии, микроструктуры и патофизиологических процессов у различных видов животных, в том числе и в сравнении с человеком.
В настоящем обзоре рассмотрены анатомические и гистологические особенности дыхательной системы мышей, крыс, морских свинок, кроликов, свиней и собак, которые используются в биомедицинских исследованиях, и их сравнительная характеристика относительно устройства дыхательной системы у человека. Так, при изучении данных литературы обнаружено, что наибольшее сходство с дыхательной системой человека как по макроскопическим данным, так и на микроскопическом уровне, выявлено у морских свинок и карликовых свиней. Поиск статей, опубликованных на английском языке, осуществляли по базам данных Google Scholar и PubMed (1970–2020), на русском языке – по базе данных научной электронной библиотеки eLIBRARY.RU. Помимо рассмотрения анатомических и гистологических особенностей строения дыхательной системы лабораторных животных, в данный обзор также были включены модели патологий легких, воспроизводимых на перечисленных животных. Так, на мышах и крысах воспроизводят хроническую обструктивную болезнь легких (ХОБЛ), фиброз, воспаление, эмфизему. Мыши определенных линий, как и морские свинки, используются для моделирования бронхиальной астмы. Лабораторных животных также применяют при воспроизведении бактериальных и вирусных болезней дыхательной системы. Таким образом, требуется очень тщательный подход к подбору тест-системы при моделировании заболеваний дыхательной системы. Это необходимо для получения более схожих клинических симптомов и патофизиологических процессов с человеком при тех или иных патологиях легких, что в дальнейшем позволит лучше прогнозировать фармакодинамические и токсические эффекты лекарственных препаратов в клинической практике.
Введение
Дыхание в организме человека и животных представляет собой процесс использования кислорода клетками тканей в биологическом окислении с образованием энергии и конечного продукта дыхания – углекислого газа.
Дыхательная система обеспечивает газообмен между атмосферным воздухом и легкими, в результате кислород из легких поступает в кровь, которая переносит его к тканям организма, а углекислый газ транспортируется от тканей в противоположном направлении [1]. У млекопитающих газообмен происходит в легких, находящихся в грудной клетке, путем сокращения мышц-вдыхателей и выдыхателей, которые поочередно расширяют и сужают грудную клетку, а вместе с ней и легкие. Это обеспечивает всасывание воздуха через воздухопроводящие пути в легкие (вдох) и его обратное выталкивание (выдох). Дыхательная система включает в себя верхние и нижние дыхательные пути. Верхние дыхательные пути – это нос и носовая полость, придаточные носовые полости и гортань (иногда гортань относят к нижним дыхательным путям). Нижняя дыхательная система может быть разделена на две структурные и функциональные части – проводящую и дыхательную. Проводящая часть, которая транспортирует газы в легкие и обратно, включает трахею, бронхи и простирается до терминальных бронхиол. Дыхательная часть состоит из бронхиол, альвеолярных ходов, альвеолярных мешочков и альвеол.
Для проведения доклинических исследований лекарственных средств с целью изучения токсичности при эндотрахеальном и ингаляционном введении и оценки фармакологической активности на соответствующих модельных патологиях используют различные виды животных, которые, в свою очередь, имеют различия в строении дыхательной системы, как анатомические, так и гистологические, которые необходимо учитывать, в том числе в сравнении с таковыми у человека.
Статья представляет собой анализ данных литературных источников (1970–2020), входящих в базы данных Google Scholar и PubMed (статьи, опубликованные на английском языке) и научной электронной библиотеки eLIBRARY.RU (статьи, опубликованные на русском языке). Поиск проводили по следующим семантическим полям: анатомия дыхательной системы, животные, мыши, крысы, морские свинки, карликовые свиньи, собаки, патологии легких. В анализ включались публикации, посвященные сравнительной физиологии, анатомии и гистологии верхних и нижних дыхательных путей человека и лабораторных животных, а также моделированию патологий легких у различных видов животных.
Из анализа исключались неопубликованные статьи и результаты клинических исследований.
Мыши
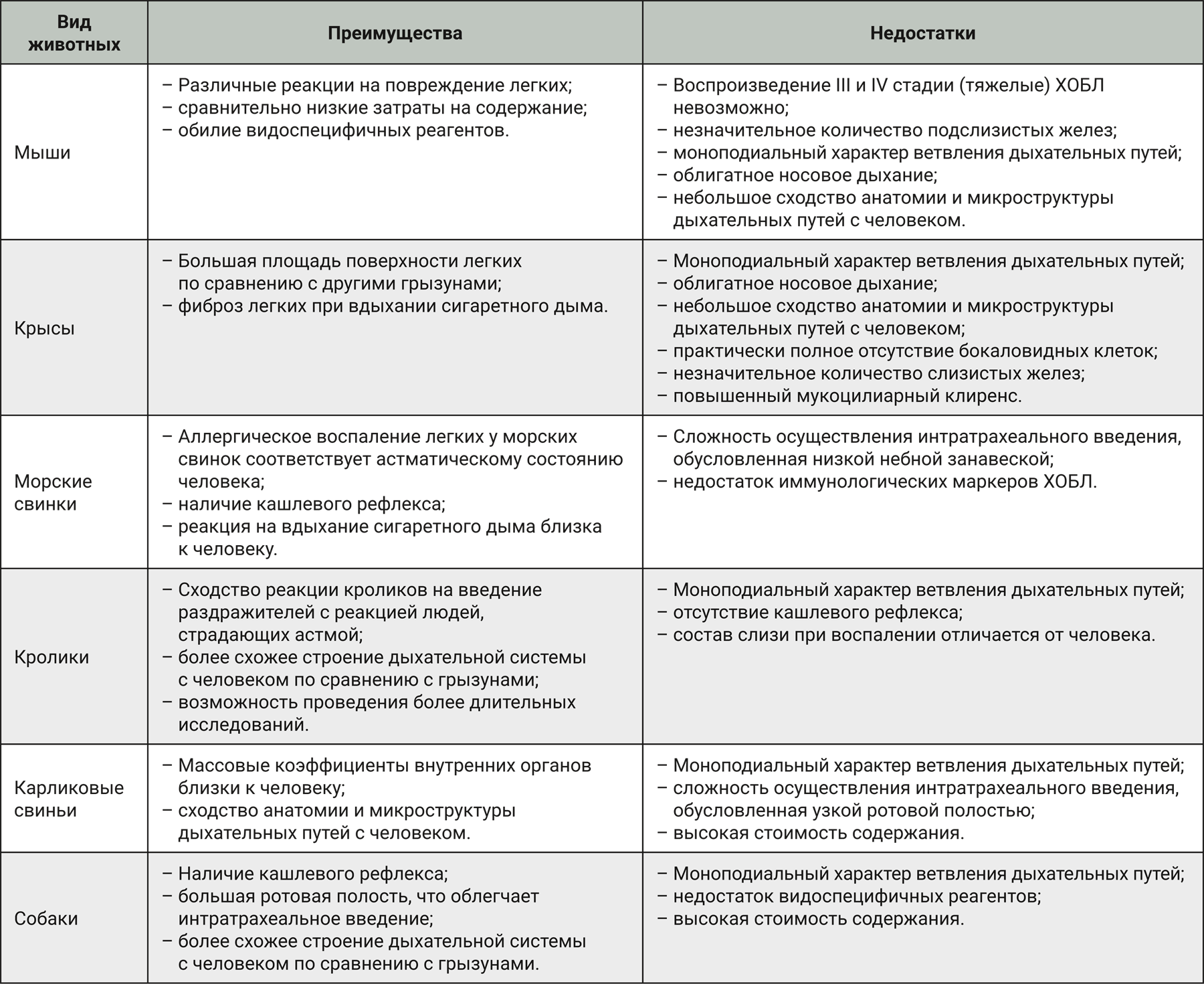
Мыши широко используются в исследованиях патологий легких, например при моделировании повреждения легких с применением солевого раствора, олеиновой кислоты, липополисахарида (LPS), а также на модели повреждения при вдыхании сигаретного дыма [2].
Отмечается, что существуют значительные отличия легочных реакций в ответ на вдыхание токсичных химических веществ у различных линий мышей. Так, например, мыши линии C57BL/6 менее чувствительны к острому повреждению легких по сравнению с другими инбредными линиями мышей [2–4]. Поскольку мышиная модель повреждения легких довольно хорошо изучена, данный вид животных может выступать в качестве оптимальной модели для оценки и разработки стратегии лечения повреждения легких.
Особенности дыхательных путей у мышей
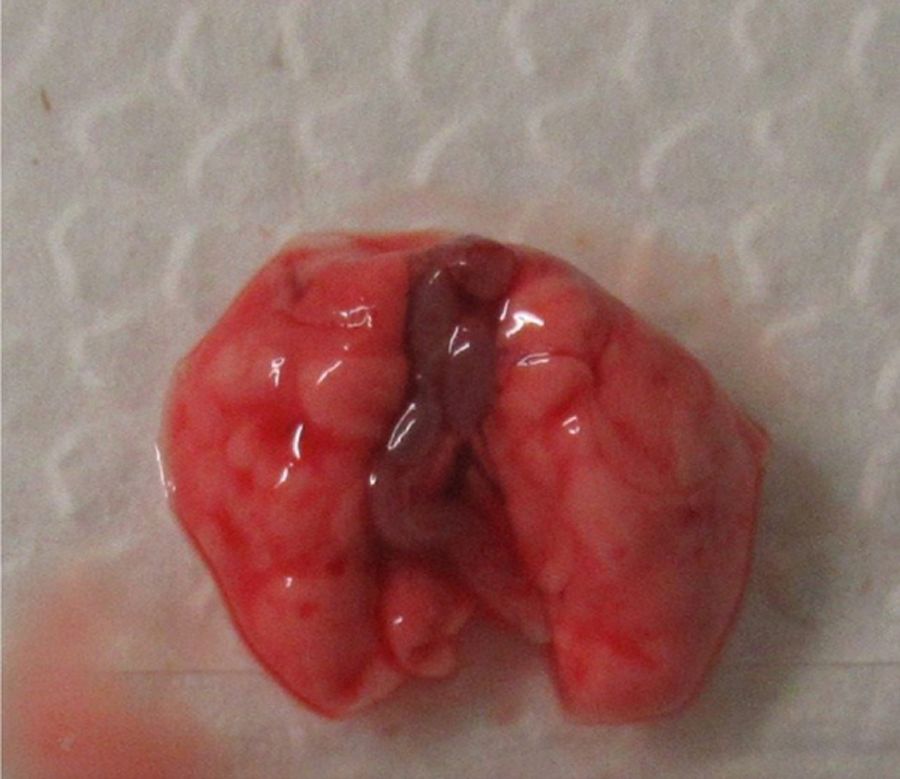
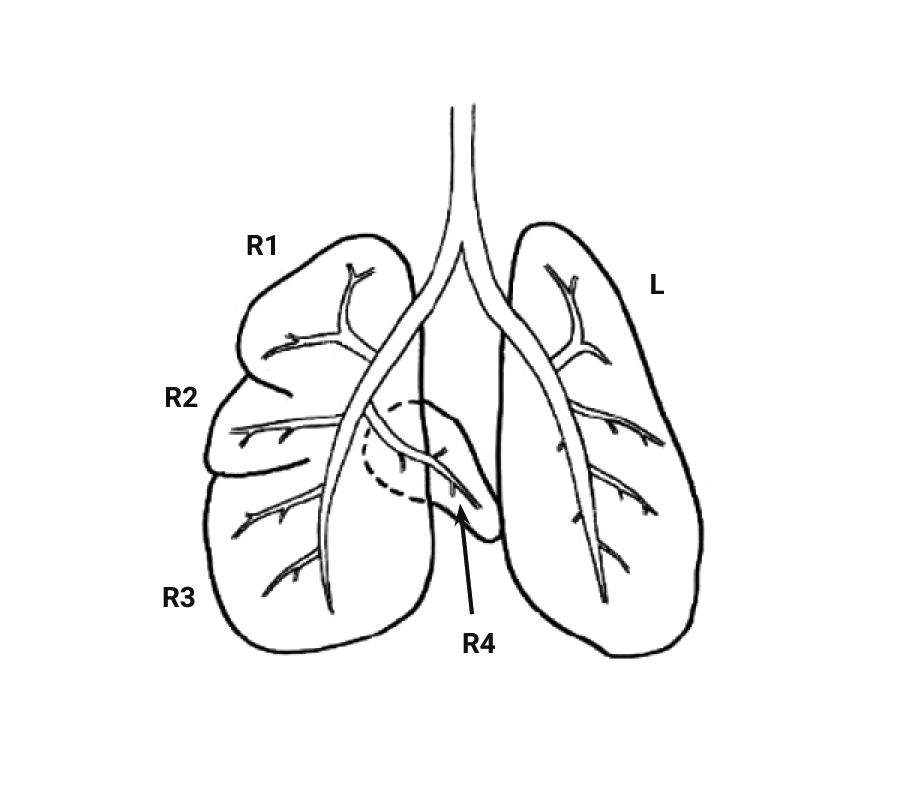
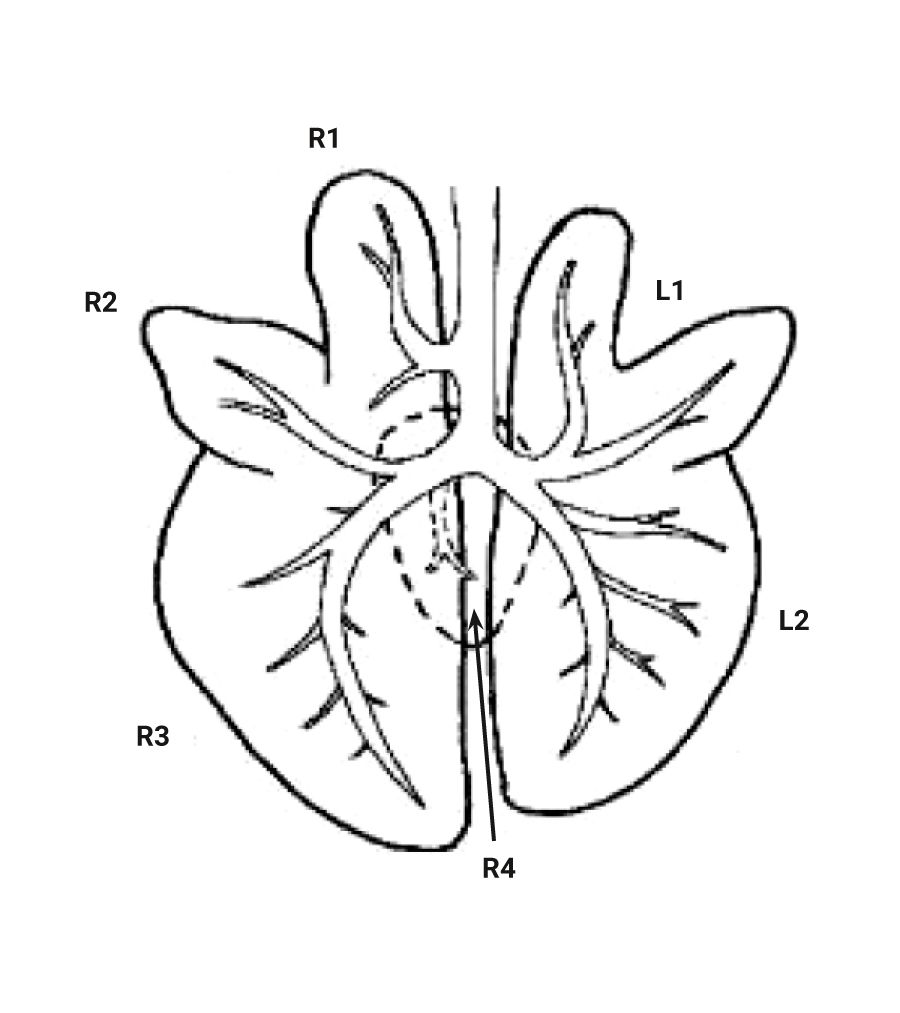
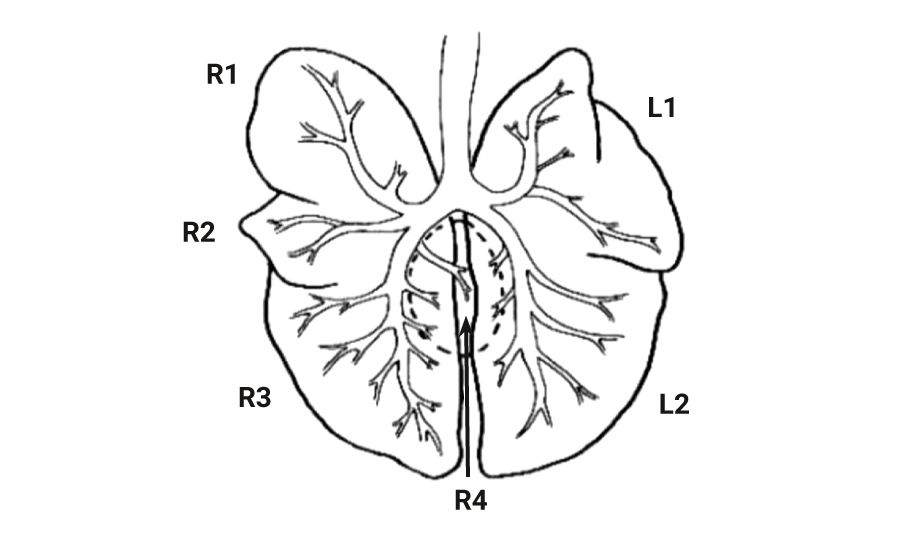
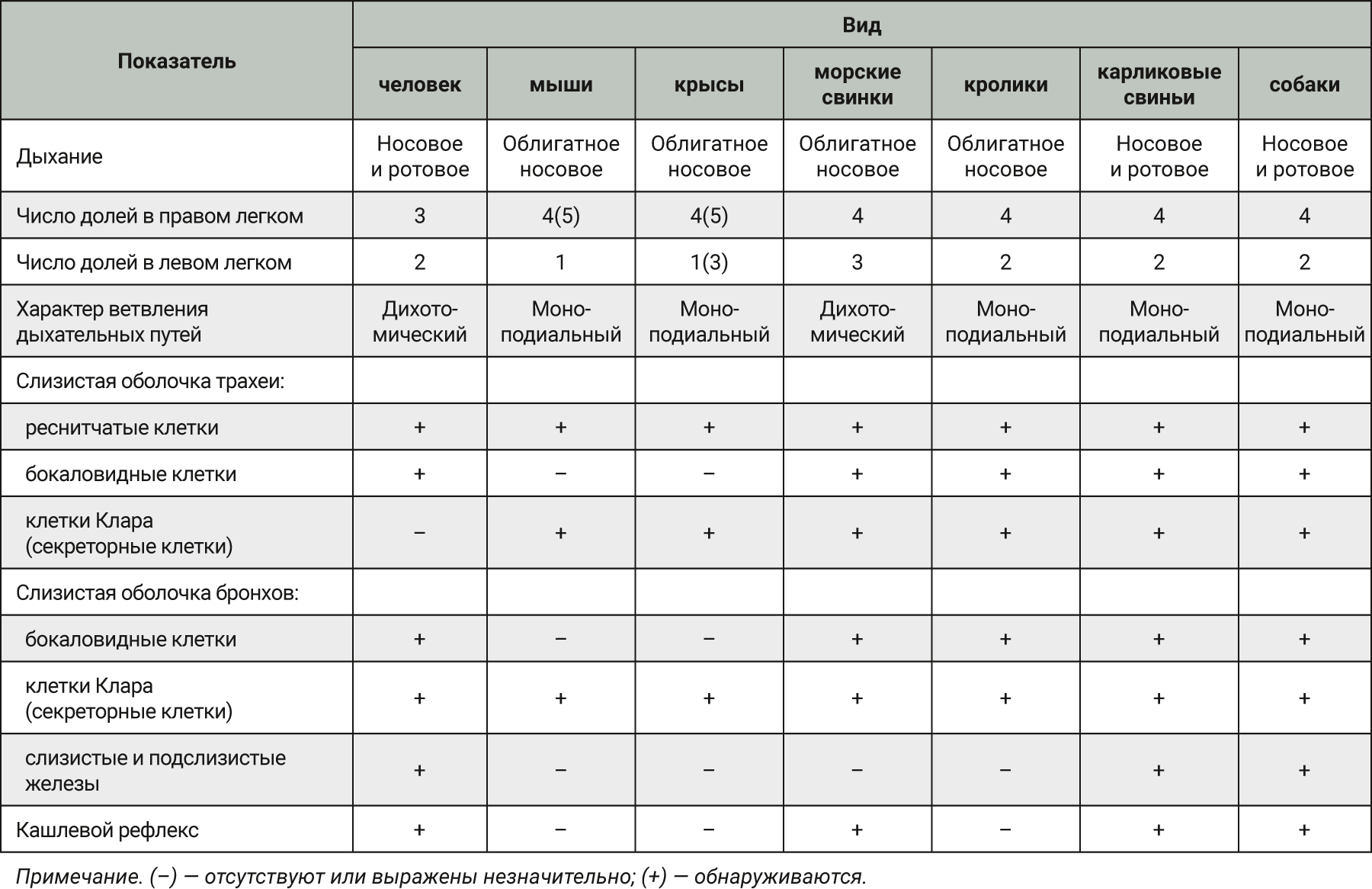
При изучении дыхательной системы мышей и планировании исследований при моделировании патологий легких следует отметить несколько различий между структурами дыхательных путей человека и мыши (табл. 1) [2, 5]. Мыши в отличие от человека имеют облигатное носовое дыхание и неэффективную фильтрацию дымсодержащего аэрозоля [6]. В легких мыши насчитывается 5 долей: 1 доля в левом легком и 4 в правом (краниальная, медиальная, каудальная и добавочная доли) (рис. 1 и 2) [2, 7]. Однако в некоторых номенклатурах описывается наличие 5 долей в правом легком (добавочная подразделяется на промежуточную и диафрагмальную) [8]. У человека правое легкое разделено на 3 доли – проксимальную, медиальную и дистальную, левое легкое имеет проксимальную и дистальную доли.
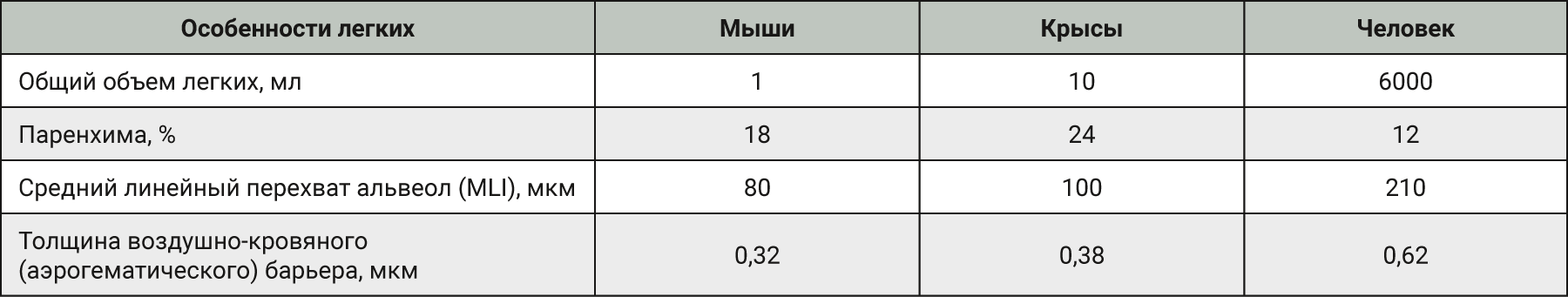
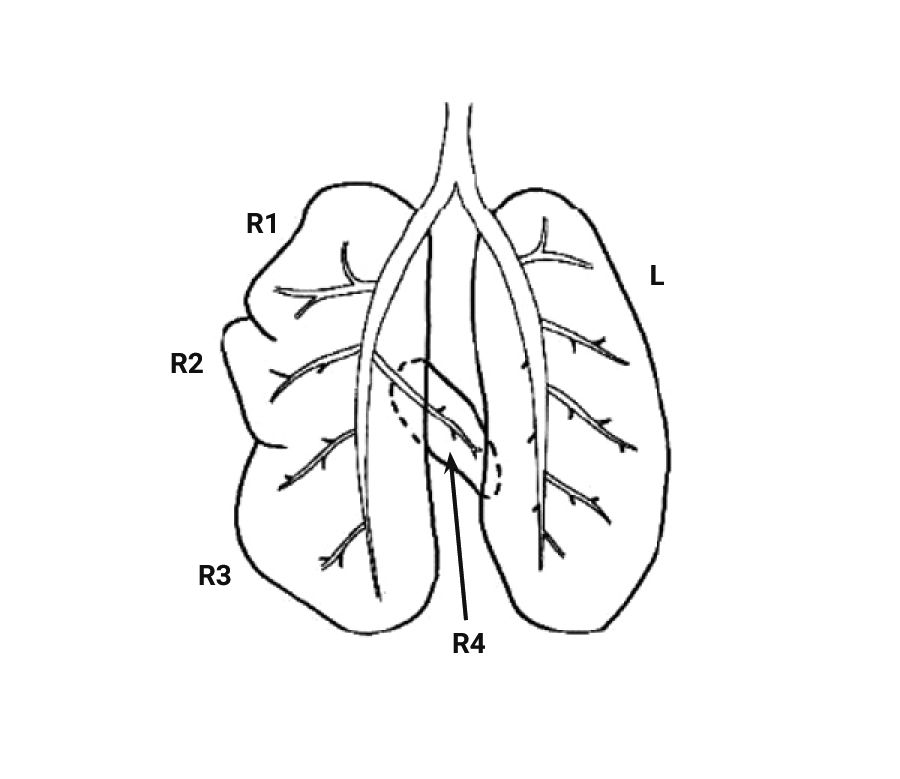
Легкие мышей имеют сильно моноподиальный характер ветвления дыхательных путей в отличие от легких человека, у которых относительно дихотомический характер ветвления. Терминальные ветви дыхательного дерева ведут непосредственно к альвеолярным ходам [2, 8]. У мышей отсутствуют прекапиллярные бронхолегочные анастомозы. Альвеолы мышей очень малы по сравнению с альвеолами человека – средний линейный перехват альвеолы у мышей составляет 80 мкм, в то время как у человека – 210 мкм. Также имеются отличия в толщине воздушно-кровяного (аэрогематического барьера): 0,32 мкм у мышей и 0,62 мкм у людей [9].
Трахея мышей и человека выстлана многорядным столбчатым эпителием. Эпителий трахеи у мышей тоньше, чем у людей. У людей среди популяции клеток, выстилающих трахею, выделяют преимущественно реснитчатые, бокаловидные и базальные клетки, тогда как трахея мышей в основном выстлана нереснитчатыми клетками, к которым также относятся секреторные клетки или клетки Клара. Эти клетки выполняют несколько функций, среди которых секреция антимикробных белков для защиты дыхательных путей. У мышей в отличие от человека эпителий проксимальных дыхательных путей поддерживается скудной сетью базальных клеток. У человека собственная пластинка слизистой оболочки включает в себя большое количество лимфатических фолликулов, которые являются частью лимфоидной ткани. У мышей со статусом SPF очень мало лимфатических фолликулов в собственной пластинке слизистой оболочки. Подслизистые железы мышей располагаются в основном в проксимальной части трахеи (ближе к гортани) в пределах первых восьми хрящевых колец. У человека подслизистая оболочка содержит многочисленные слизисто-белковые железы, которые продуцируют слизь.
В главных бронхах мышей в отличие от человека отсутствуют подслизистые железы, а также насчитывается менее 1% бокаловидных клеток в эпителии. Таким образом, количество клеток, продуцирующих слизь, значительно различается между человеком и мышами [2, 7, 10]. Паренхима легких у мышей состоит только из бронхиол, в то время как у человека она включает как бронхи, так и бронхиолы (рис. 3) [2, 8].
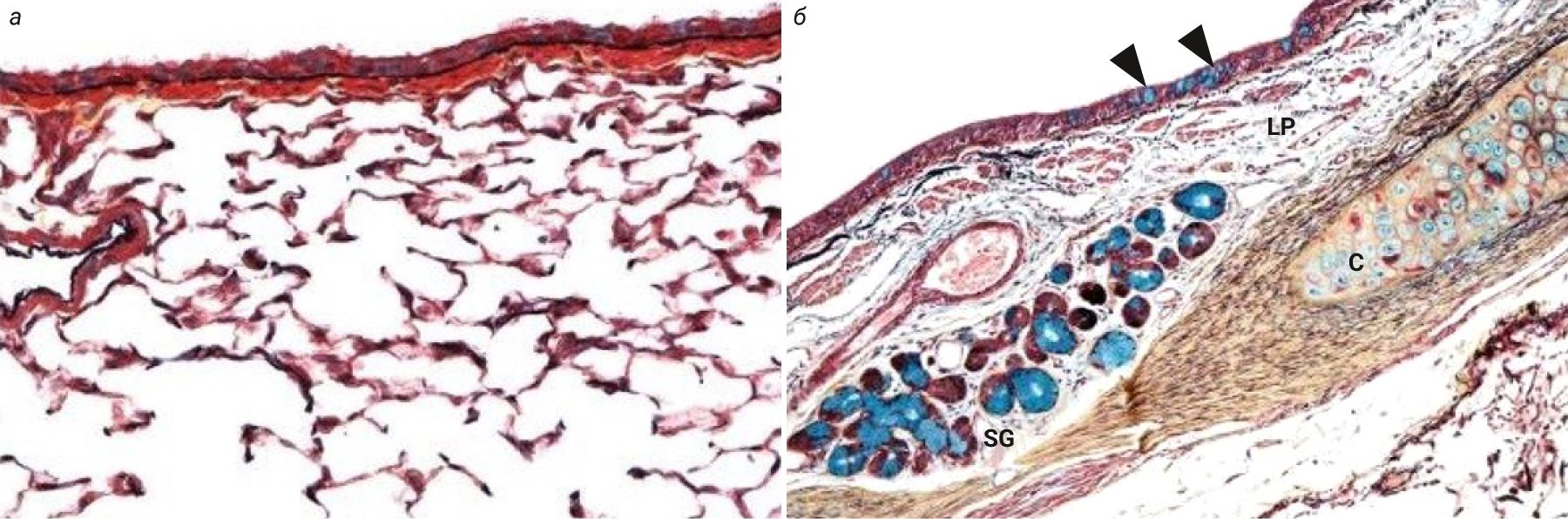
Также у мышей нет хорошо развитых респираторных бронхиол (или они вовсе отсутствуют), поэтому дыхательная зона легких у них состоит лишь из альвеолярных ходов и альвеол, в то время как у человека еще имеются респираторные бронхиолы.
Несмотря на описанные различия, на описанные различия, мыши могут выступать в качестве тест-системы для моделирования ХОБЛ I или II стадии (классификация, описанная Global initiative for Obstructive Lung Disease — GOLD) и демонстрировать симптомы, характерные для человека, страдающего ХОБЛ: воспаление легких с накоплением макрофагов, нейтрофилов и лейкоцитов, медиаторов воспаления легких (цитокины, хемокины и протеазы), нарушение функции легких, эмфизема, гиперсекреция слизи, утолщение и ремоделирование дыхательных путей за счет накопления воспалительных клеток и метаплазии бокаловидных клеток с сужением, деформацией и закупоркой слизью дыхательных путей, ремоделирование сосудов легких, легочная гипертензия [11]. Однако для моделирования хронического бронхита или III и IV стадии ХОБЛ мыши не подходят, поскольку либо выздоравливают, либо погибают до того, когда можно оценить интересующие параметры [12, 13]. Также мыши могут быть использованы в качестве тест-системы при моделировании астмы, но стоит иметь в виду, что отсутствие обширного легочного кровообращения может оказывать влияние на адгезию и миграцию лейкоцитов и как следствие – на воспаление [14–17]. На мышах можно воспроизвести фиброз легких, которому в большей степени подвержены определенные линии мышей (например, C57BL/6, тогда как линия мышей Balb/c относительно устойчива к развитию данной патологии) [18, 19].
Крысы
Существуют многочисленные модели на крысах, которые имитируют болезни человека. В том числе крыс используют в качестве модели повреждения легких при вдыхании дыма [2]. Однако для моделирования повреждения легких крыс применяют реже, чем мышей, так как они обладают резистентностью к развитию симптомов ХОБЛ.
Особенности дыхательных путей у крыс
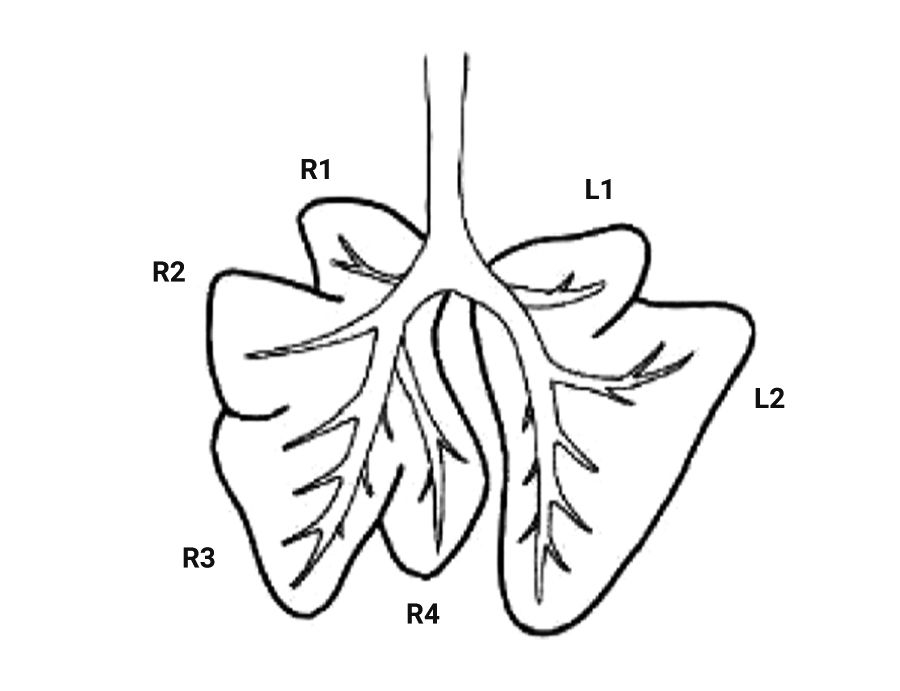
Легкие крысы имеют значительные отличия от дыхательных путей человека, что следует учитывать при проведении исследований с моделированием повреждения легких. Крысы, как и мыши, имеют облигатное носовое дыхание [20, 21]. Строение легких крыс сходно со строением легких мышей. Правое легкое крысы включает 4 доли (краниальная, медиальная, каудальная и добавочная), а левое представляет собой 1 большую долю (рис. 4, 5) [2, 8]. Однако в статье В.М. Петренко описывается наличие трех «скрытых» долей в левом легком (краниальная, каудальная и добавочная (околоворотная)), которые срослись под давлением правого легкого и сердца [22, 23]. Также, согласно данным статьям, в легком крысы насчитывается не 4, а 5 долей: краниальная, медиальная, каудальная и две добавочные (в составе каудальной).
Легкие крысы, как и мыши, имеют сильно моноподиальный характер ветвления дыхательных путей. У крыс самая толстая легочная вена и самая тонкая легочная артерия из всех видов грызунов [2, 8].
Конечные бронхиолы в легких крыс имеют диаметр 0,2 мм и длину 0,35 мм, тогда как у человека их ширина 0,6 мм и длина 1,68 мм. Осаждение вдыхаемых частиц размером менее 0,5 мкм очень незначительное как у людей, так и крыс. У крыс осаждение частиц максимально при их размере 1 мкм, а у человека – при размере 2–4 мкм. Процент частиц, вдыхаемых человеком и крысами, также различен. Так, для человека поглощение при вдыхании через рот составляет около 50%, а при носовом дыхании – около 25%, в то время как у крыс – около 5%. У крыс гораздо быстрее очищаются слизистые оболочки, чем у людей;10–50% частиц размером 0,1–7 мкм осаждаются в бронхиальном дереве человека и могут быть обнаружены даже через 24 ч, а у крыс легкие свободны от частиц уже через 6–8 ч. Возможно, это обусловлено локализацией вдыхаемых частиц в легких: у крыс частицы осаждаются в центральной части легких, а у человека в основном – в периферических частях легкого. Средний линейный перехват альвеолы у крыс составляет 100 мкм, в то время как у человека данный показатель 210 мкм. Также имеются отличия в толщине воздушно-кровяного (аэрогематического) барьера: 0,38 мкм у крыс и 0,62 мкм у людей (см. табл. 1) [2, 9].
У крыс трахея выстлана однорядным столбчатым эпителием. В отличие от мышей у крыс подслизистые железы обнаруживаются в трахее вплоть до бифуркации легких [2, 8, 9]. Отличием эпителиального слоя слизистой оболочки трахеи крыс от человека является практически полное отсутствие бокаловидных клеток, отвечающих за выработку слизистого секрета, а также у них отмечается меньшее количество слизистых желез, которые сконцентрированы в основном в проксимальной части трахеи. У крыс отмечают повышенный мукоцилиарный клиренс, ответственный за местную защиту органов дыхания от внешних воздействий [9]. Дыхательные бронхиолы у крыс появляются через несколько недель после рождения, в то время как у мышей они отсутствуют (рис. 6).
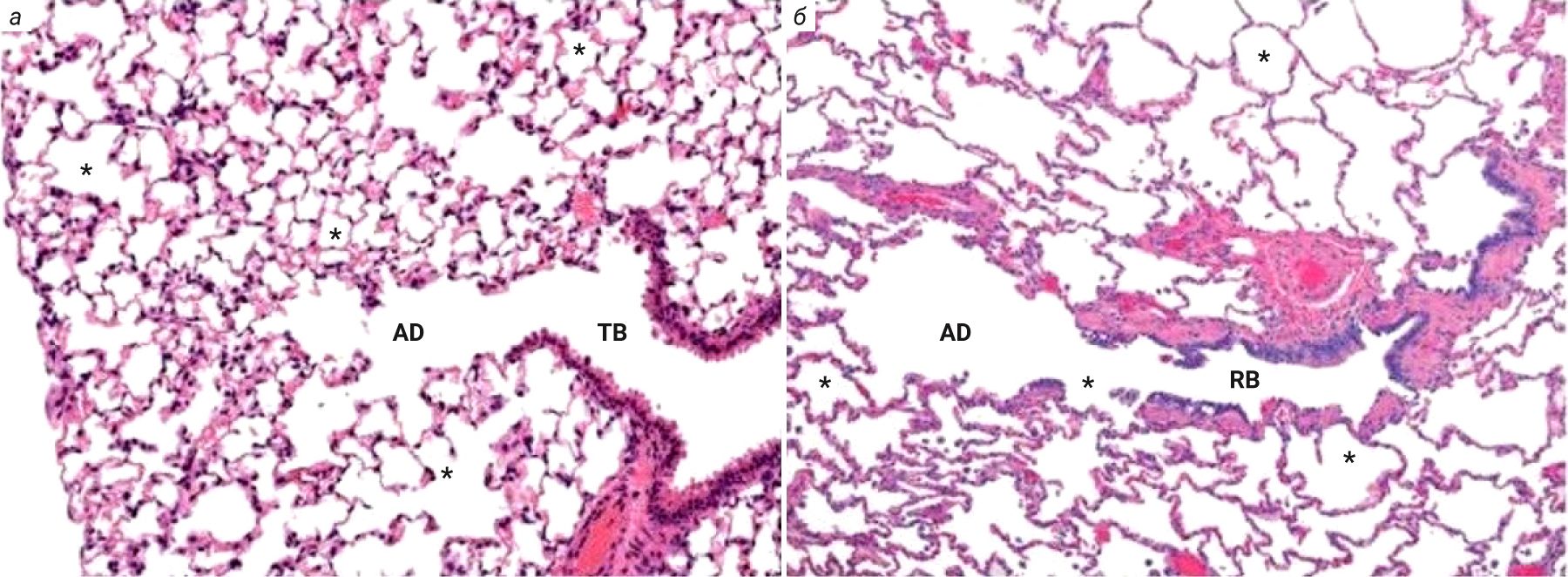
Количество слизистых желез у крыс и других мелких лабораторных животных заметно меньше, чем у более крупных млекопитающих [24]. Несмотря на это, крысы выступают как наиболее часто используемая тест-система при моделировании ХОБЛ, повреждение легких при этом достигается при воздействии сигаретного дыма, липополисахарида [25–28]. Наряду с ХОБЛ у животных развиваются эмфизема и воспаление [29–31]. Также у крыс регистрируют развитие фиброза легких при вдыхании сигаретного дыма, который характерен для курильщиков [32].
Морские свинки
Роберт Кох был первым, кто использовал морских свинок в качестве тест-системы для индукции бактериальных инфекций в 1882 г. [33, 34]. С тех пор они используются в качестве лабораторных животных, хотя и не так широко, как крысы и мыши. Дыхательные пути морских свинок, как и у людей, очень чувствительны к аллергенам, в связи с чем они широко применяются в исследованиях аллергических реакций, астмы и экстремального анафилактического шока [2].
Особенности дыхательных путей у морских свинок
Морские свинки обладают довольно большим сердцем, за счет чего у них сравнительно небольшие легкие в отличие от крыс и мышей. Легкие морских свинок разделены на 7 долей. Правое легкое состоит из краниальной, медиальной, каудальной и добавочной долей, левое – из краниальной, медиальной и каудальной долей (рис. 7, 8). Легкие морских свинок имеют дихотомический характер ветвления дыхательных путей, похожий на таковой у человека [2, 22, 35, 36]. Морские свинки имеют облигатное носовое дыхание [37].
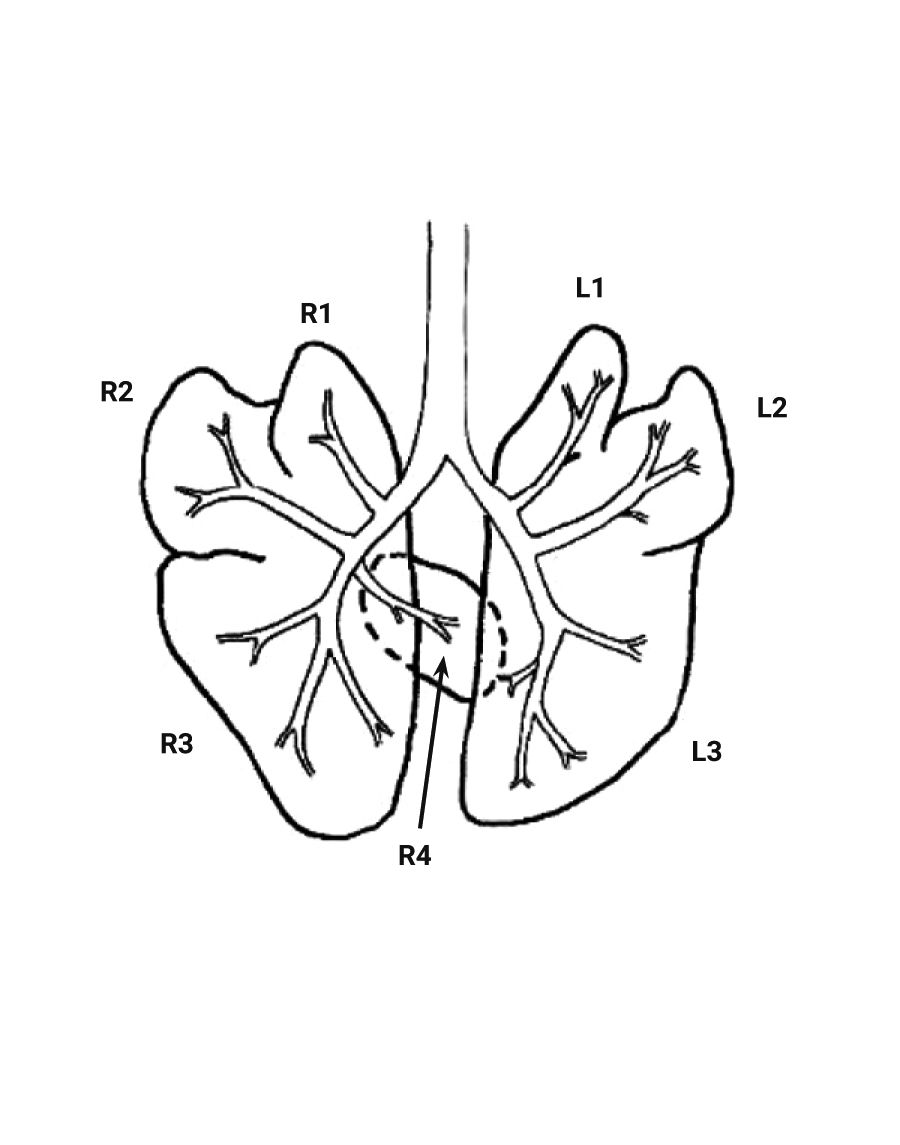
Эпителий трахеи, главных и крупных бронхов у морских свинок выстлан многорядным мерцательным эпителием, который менее развит у мышей и крыс. В верхних дыхательных путях обнаруживаются бокаловидные клетки, клетки Клара и слизистые железы [10, 22]. Сосудистые сплетения в собственной пластинке хорошо выражены, как и у человека. Однако у морских свинок в отличие от мышей, крыс и человека нет слизисто-белковых желез в собственной пластинке слизистой оболочки. У человека имеются хорошо развитые бронхиальные железы, в время как у морских свинок они состоят лишь из нескольких ацинусов (рис. 9) [10, 38, 39].
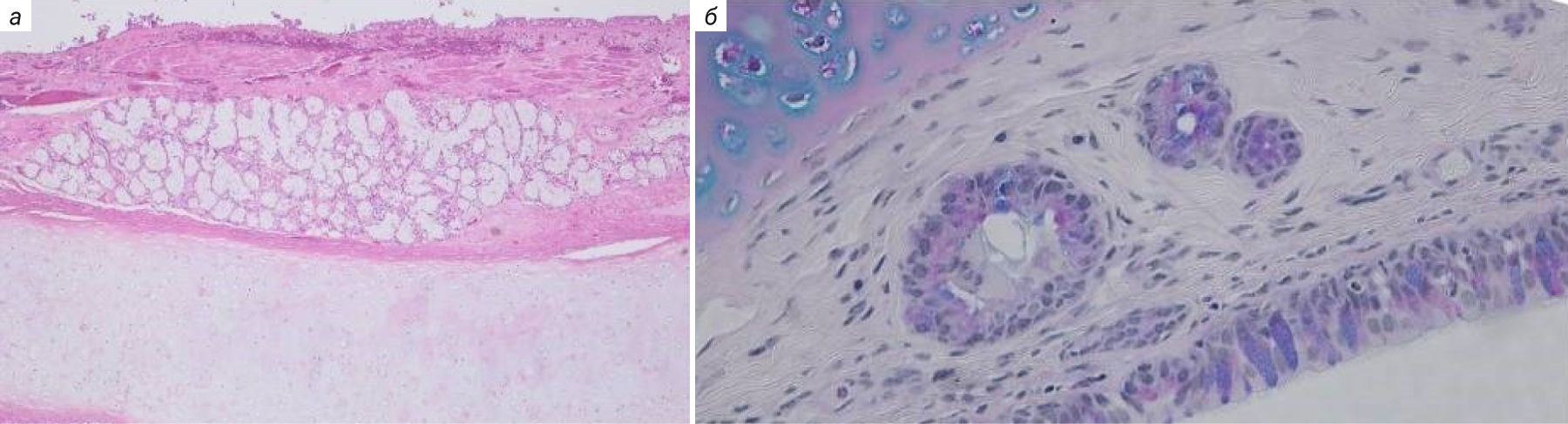
Нейроэндокринные клетки и нейроэпителиальные тела (нейроэндокринные клетки, организованные в кластеры) у морских свинок расположены по всему эпителию верхних и нижних дыхательных путей, что также характерно для человека [39–41].
И у человека, и у морской свинки спазм гладких мышц дыхательных путей при аллергическом воспалении происходит на фоне выделяемых аутокоидов. У людей и морских свинок гиперчувствительность на аллерген в значительной степени обусловлена активацией гистаминовых H1 и лейкотриеновых cysLT1-рецепторов. Также аллергическое воспаление легких у морских свинок соответствует астматическому состоянию человека. Поэтому морские свинки подходят в качестве тест-системы в исследованиях аллергической реакции и астмы [39, 42, 43]. При воспроизведении ХОБЛ симптомы у морских свинок и человека схожи и включают острую нейтрофилию, накопление моноцитов, повышенную сосудистую проницаемость, секрецию слизи, разрушение альвеол, легочную гипертензию. При заражении морских свинок вирусными инфекциями у животных отмечают схожесть патогенеза с людьми [2, 44]. Также преимуществом морских свинок является наличие кашлевого рефлекса [39, 44, 45]. Таким образом, за счет сходства анатомии и физиологии дыхательной системы с человеком морские свинки часто используются в доклинических исследованиях, связанных с астмой, исследованием аллергических реакций и при воспроизведении ХОБЛ.
Кролики
Филогенетически кролики ближе к людям, нежели грызуны, что отображается анатомическим, физиологическим, генетическим и биохимическим сходством.
Особенности дыхательных путей у кроликов
Кролики имеют облигатное носовое дыхание [46]. Грудная полость кролика относительно размера тела довольно мала. Легкие кролика окружены тонкой плеврой. В легких отсутствует или присутствует плохо развитая междольчатая соединительная ткань. Правое легкое у кроликов разделено на 4 доли (краниальная, медиальная, каудальная и добавочная), левое легкое меньшего размера и разделено на 2 доли (краниальная и каудальная) (рис. 10, 11) [2, 47]. У кроликов относительно узкая трахея делится на 2 главных бронха, которые в свою очередь – на бронхиолы, при этом формируется моноподиальное дыхательное дерево [2, 48].
Эпителий трахеи и главных бронхов кроликов на 50% представлен реснитчатыми, а также бокаловидными клетками (менее распространены, чем в эпителии трахеи человека), клетками Клара и базальными клетками (рис. 12) [2, 49].
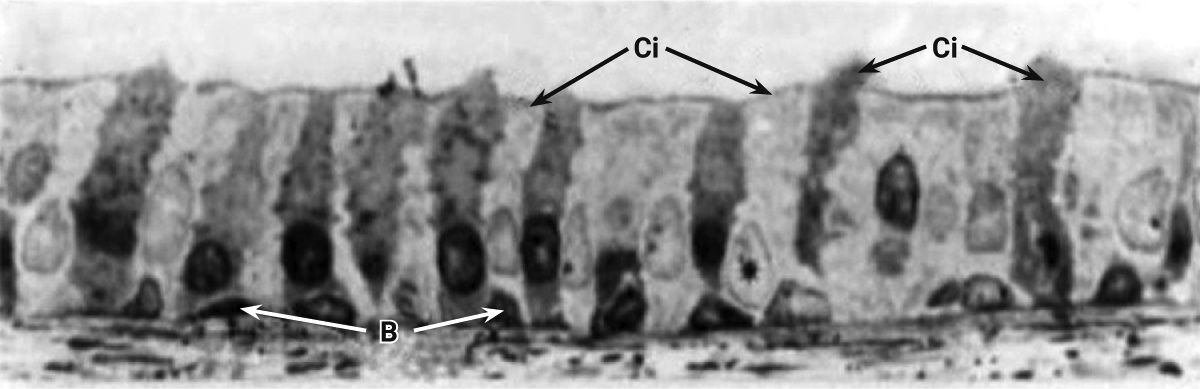
Хорошо развитые подслизистые железы у людей располагаются между хрящевыми кольцами трахеи, у кроликов, напротив, подслизистые железы отсутствуют. У кроликов насчитывается 32 порядка бронхов, а у человека – 25. К бронхам 5-го порядка бокаловидные клетки постепенно замещаются клетками Клара. Респираторные бронхиолы у кроликов отсутствуют, в то время как у человека они есть [50, 51]. Эпителий терминальных бронхиол на 50% состоит из реснитчатых клеток и на 50% из клеток Клара. По сравнению с людьми кролики обладают меньшим количеством секреторных клеток в дыхательных путях [2].
Исследования, направленные на изучение реакции дыхательных путей на различные раздражители (гистамин, монофосфат аденозина), показали сходство реакции кроликов с реакцией людей, страдающих астмой. Также на модели аллергии у кроликов получены данные по чувствительности к противоастматическим препаратам (бета-адреномиметики, кортикостероиды, ингибиторы фосфодиэстеразы и теофиллин) [48, 52]. Кроме того, у кроликов наблюдаются схожие с человеком повреждения дыхательных путей, особенно верхних дыхательных путей, при вдыхании дыма. К ним относятся слущивание некротизированных эпителиальных клеток, воспалительная реакция, обструкция дыхательных путей, отек. Однако при выборе кролика в качестве тест-системы для моделирования повреждения легких сигаретным дымом стоит учитывать, что у них отсутствует кашлевой рефлекс [2, 53]. Таким образом, кролики подходят для моделирования ряда легочных заболеваний.
Карликовые свиньи
Все больше и больше заболеваний легких изучается и моделируется на свиньях, что связано со сходством строения их дыхательной системы с человеческой [54]. Cвиньи довольно часто используются в качестве тест-системы для моделирования респираторных заболеваний, вызванных Bordetella pertussis [55], вирусом гриппа, Mycobacterium tuberculosis [56], Pseudomonas aeruginosa [57] и Staphylococcus aureus [58].
Особенности дыхательных путей у карликовых свиней
Верхние дыхательные пути свиней и человека анатомически схожи. Так, по своему анатомическому строению лимфатическое глоточное кольцо (кольцо Вальдейера) у человека наиболее близко с таковому у карликовых свиней. Также у свиней есть миндалины в отличие от мелких грызунов [54, 59]. Свиньи могут осуществлять как носовое, так и ротовое дыхание, а мыши, крысы, морские свинки и кролики нет [60].
Правое легкое свиньи разделено на 4 доли (краниальная, медиальная, каудальная и добавочная), а левое – на 2 (краниальная и каудальная) (рис. 13, 14). Краниальнее бифуркации отделяется трахейный бронх для правой краниальной доли легкого. Дыхательное дерево легких свиньи имеет моноподиальный характер ветвления в отличие от человека [2, 61, 62]. Легкие свиней окружены толстой плеврой с хорошо развитой междольчатой соединительной тканью. Терминальные бронхиолы у свиней относительно длинные и делятся на 2 или 3 короткие бронхиолы, за которыми следуют альвеолы [63].
Микроструктура эпителия легких у свиней похожа на таковую человека. Верхние дыхательные пути выстланы многорядным мерцательным эпителием. Эпителий трахеи представлен реснитчатыми, базальными и секреторными клетками с распределенными между ними бокаловидными клетками. Как и у людей, у свиней наблюдаются хорошо развитые подслизистые железы, что является важным критерием при моделировании муковисцидоза и воспалительных процессов в легких. По направлению к дистальным участкам бронхиального дерева многорядный мерцательный эпителий замещается на нереснитчатый призматический. Большая часть дыхательных путей (от носовой полости до начала дыхательных бронхиол) покрыта слизью, продуцируемой бокаловидными и секреторными клетками. Начиная с терминальных бронхиол к альвеолярной части бокаловидные клетки замещаются на клетки Клара [2, 62, 64].
Наиболее широко карликовые свиньи используются в качестве тест-системы при моделировании кистозного фиброза, который подобен проявлениям муковисцидоза у людей [65–68].
Собаки
Особенности дыхательных путей у собак
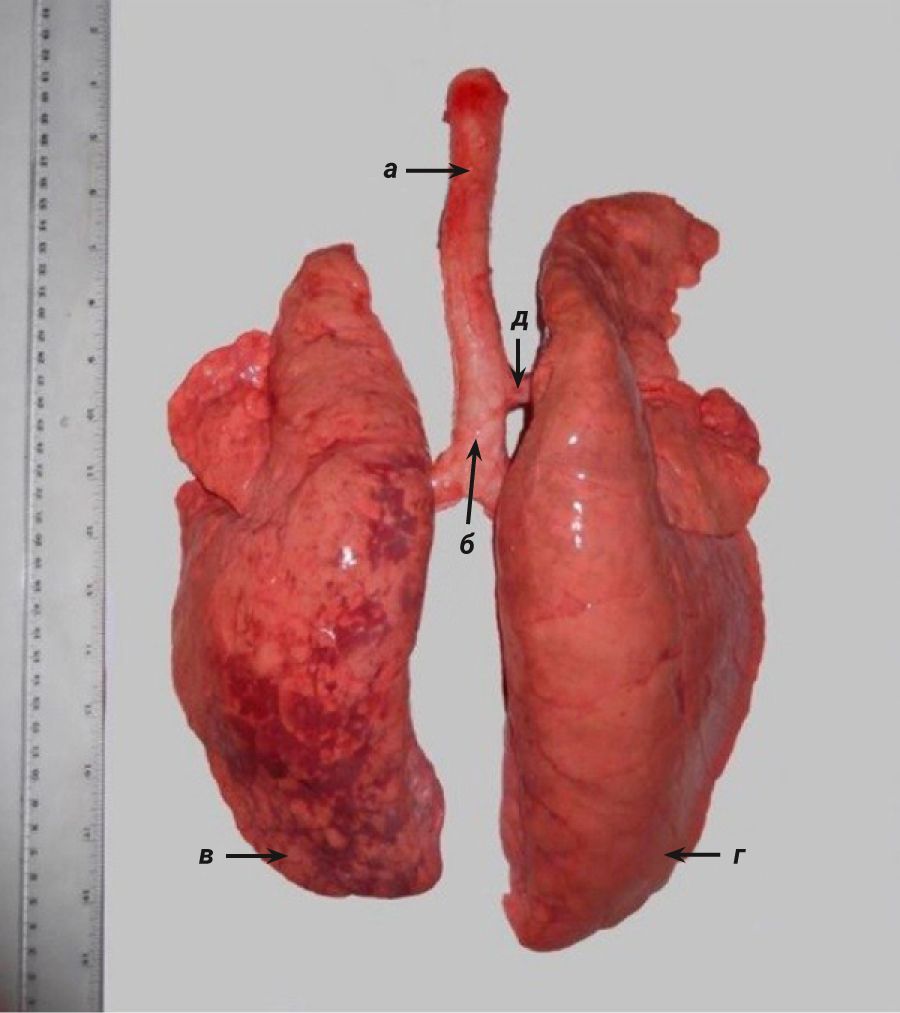
Анатомическое строение легких у собаки схоже с таковым у кроликов. Правое легкое состоит из краниальной, медиальной, каудальной и добавочной долей, а левое – из краниальной и каудальной (рис. 15) [2, 69, 70].
Собаки, как и люди, могут осуществлять дыхание через носовую и ротовую полости [71]. Легкие собак окружены тонкой плеврой, имеющей множество лимфатических сосудов [2]. Трахея собак раздваивается на 2 бронха, которые далее моноподиально разветвляются на более мелкие бронхиолы [2, 70]. После нескольких бифуркаций бронхиолы переходят в дыхательные бронхиолы, а затем в альвеолярные мешочки.
Эпителий, выстилающий поверхность трахеи и бронхов, у собак больше похож на человеческий, нежели у кроликов и грызунов (рис. 16). У собак хорошо развиты секреторные клетки и железы. Терминальные и дыхательные бронхиолы состоят из клеток Клара и небольшого количества реснитчатых клеток (<5%) [2, 72]. По всей слизистой оболочке нижних дыхательных путей у собак обнаруживаются бронхиальные слизистые железы [73]. Свойства слизи и механизмы очистки легких ближе к таковым у людей, чем у более мелких животных. Данное сходство важно при моделировании повреждения легких при вдыхании дыма.
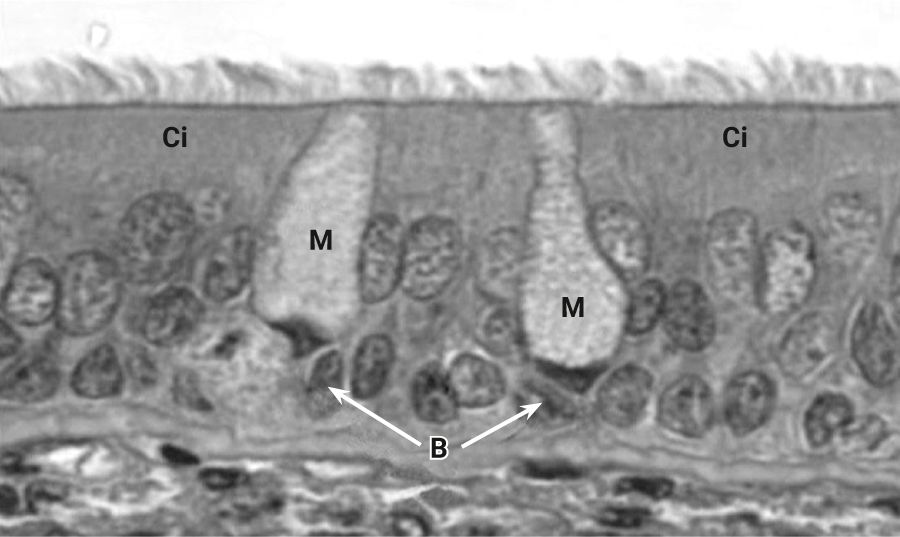
При моделировании патологии легких при вдыхании дыма в течение месяца у собак наблюдаются пролиферация бокаловидных клеток в нижних дыхательных путях, воспалительная инфильтрация, гиперсекреция слизи и повышенное отложение коллагена в паренхиме легких, что характерно для хронического бронхита у человека. Также еще одним преимуществом собак является наличие кашлевого рефлекса, который является одним из основных клинических признаков ХОБЛ. Помимо этого, при более длительном вдыхании сигаретного дыма (годы) у собак происходят патологические изменения, напоминающие эмфизему человека [2, 74, 75].
Заключение
Таким образом, требуется очень тщательный подход к подбору тест-систем при моделировании заболеваний дыхательной системы. Это необходимо для получения более схожих клинических симптомов и патофизиологических процессов при тех или иных патологиях легких, которые наблюдаются у человека, что в дальнейшем позволит лучше прогнозировать фармакодинамические и токсические эффекты лекарственных препаратов в клинической практике. В табл. 2 и 3 обобщены основные отличительные особенности дыхательной системы, преимущества и недостатки различных тест-систем при моделировании патологий легких.
Вклад авторов
Д.Р. Каргопольцева – идея исследования, поиск литературы, написание текста статьи;
А.Е. Кательникова – поиск литературы, редактирование текста статьи
К.Л. Крышень – поиск литературы, редактирование текста статьи
Я.А. Гущин – поиск литературы, редактирование текста статьи
Список источников
- Ткаченко Б.И. Нормальная физиология человека // М.: Медицина. – 2005. – 879 с. [Tkachenko B.I. Normal'naya fiziologiya cheloveka // M.: Medicina. – 2005. – 879 s. (In Russ.)]
- Reczyńska K., Tharkar P., Kim S.Y., Wang Y., Pamuła E., Chan H.K., Chrzanowski, W. Animal models of smoke inhalation injury and related acute and chronic lung diseases // Advanced drug delivery reviews. – 2018. – Vol. 123. – P. 107-134. DOI: 10.1016/j.addr.2017.10.005.
- Jacob S., Deyo D.J., Cox R.A., Traber D.L., Hawkins H.K. Assessment of lung inflammation in a mouse model of smoke inhalation and burn injury: strain-specific differences // Toxicology Mechanisms and Methods. – 2008. – Vol. 18, No 7. – P. 551-559. DOI: 10.1080/15376510802251993.
- Котельников В.Н., Слабенко Э.В., Заяц Ю.В., Гельцер Б.И. Экспериментальные модели хронической обструктивной болезни легких: методические подходы и обоснование выбора // Российский физиологический журнал им. ИМ Сеченова. – 2018. – Т. 104. – №. 4. – С. 396—411. [Kotel'nikov V.N., Slabenko E.V., Zayac YU.V., Gel'cer B.I. Eksperimental'nye modeli hronicheskoj obstruktivnoj bolezni legkih: metodicheskie podhody i obosnovanie vybora // Rossijskij fiziologicheskij zhurnal im. IM Sechenova. – 2018. – T. 104. – №. 4. – S. 396—411. (In Russ.)]
- Irvin C.G., Bates J.H.T. Measuring the lung function in the mouse: the challenge of size // Respiratory research. – 2003. – Vol. 4, No 1. – P. 1. DOI: 10.1186/rr199.
- Bruun C.S., Jensen L.K., Leifsson P.S., Nielsen J., Cirera S., Jørgensen C.B., Fredholm M. Functional characterization of a porcine emphysema model // Lung. – 2013. – Vol. 191, No 6. – P. 669-675. DOI: 10.1007/s00408-013-9504-2.
- Hyde D.M., Hamid Q., Irvin C.G. Anatomy, pathology, and physiology of the tracheobronchial tree: emphasis on the distal airways // Journal of Allergy and Clinical Immunology. – 2009. – Vol. 124, No 6. – P. 72-77. DOI: 10.1016/j.jaci.2009.08.048.
- Treuting P.M., Dintzis S.M., Liggitt D., Frevert C.W. Comparative anatomy and histology: a mouse and human atlas. – Academic Press, 2011. – 552 p.
- Fröhlich E., Salar-Behzadi S. Toxicological assessment of inhaled nanoparticles: role of in vivo, ex vivo, in vitro, and in silico studies // International journal of molecular sciences. – 2014. – Vol. 15, No 3. – P. 4795-4822. DOI: 10.3390/ijms15034795.
- Wright J.L., Cosio M., Churg A. Animal models of chronic obstructive pulmonary disease // American journal of physiology-lung cellular and molecular physiology. – 2008. – Vol. 295, No 1. – P. 1-15. DOI: 10.1152/ajplung.90200.2008.
- Vlahos R., Bozinovski S. Preclinical murine models of chronic obstructive pulmonary disease // European journal of pharmacology. – 2015. – Vol. 759. – P. 265-271. DOI: 10.1016/j.ejphar.2015.03.029.
- Vlahos R., Bozinovski S. Recent advances in pre-clinical mouse models of COPD // Clinical science. – 2014. – Vol. 126, No 4. – P. 253-265. DOI: 10.1042/CS20130182.
- Ghorani, V., Boskabady, M. H., Khazdair, M. R., & Kianmeher, M. Experimental animal models for COPD: a methodological review // Tobacco induced diseases. – 2017. – Vol. 15, No 1. – P. 1-13. DOI: 10.1186/s12971-017-0130-2.
- Bischoff S.C. Role of mast cells in allergic and non-allergic immune responses: comparison of human and murine data // Nat Rev Immunol. – 2007. – Vol. 7, No 2. – P. 93–104. DOI: 10.1038/nri2018.
- Schmit D., Le D.D., Heck S., Bischoff M., Tschernig T., Herr C., Bals R. Allergic airway inflammation induces migration of mast cell populations into the mouse airway // Cell Tissue Res. – 2017. – Vol. 369, No 2. – P. 331–340. DOI: 10.1007/s00441-017-2597-9.
- Andersson C.K, Mori M., Bjermer L., Lofdahl C.G., Erjefalt J.S. Novel site-specific mast cell subpopulations in the human lung // Thorax. – 2009. – Vol. 64, No 4. – P. 297–305. DOI: 10.1136/thx.2008.101683.
- Mullane K., Williams M. Animal models of asthma: reprise or reboot? // Biochemical pharmacology. – 2014. – Vol. 87, No 1. – P. 131-139. DOI: 10.1016/j.bcp.2013.06.026.
- Walkin, L., Herrick, S. E., Summers, A., Brenchley, P. E., Hoff, C. M., Korstanje, R., & Margetts, P. J. The role of mouse strain differences in the susceptibility to fibrosis: a systematic review // Fibrogenesis & tissue repair. – 2013. – Vol. 6, No 1. – P. 18. DOI: 10.1186/1755-1536-6-18.
- Rydell-Törmänen K., Johnson J. R. The applicability of mouse models to the study of human disease // Mouse Cell Culture. – 2019. – P. 3-22. DOI: 10.1007/978-1-4939-9086-3_1.
- Петренко В. М. Анатомия легких у белой крысы // Международный журнал прикладных и фундаментальных исследований. – 2013. – №. 10-3. – С. 414-417. [Petrenko V. M. Anatomiya legkih u beloj krysy // Mezhdunarodnyj zhurnal prikladnyh i fundamental'nyh issledovanij. – 2013. – №. 10-3. – S. 414-417. (In Russ.)]
- Matute-Bello G., Frevert C.W., Martin T.R. Animal models of acute lung injury //American Journal of Physiology-Lung Cellular and Molecular Physiology. – 2008. – Vol. 295, No 3. – P. L379-L399. DOI: 10.1152/ajplung.00010.2008.
- Tanner L., Single A.B. Animal models reflecting chronic obstructive pulmonary disease and related respiratory disorders: translating pre-clinical data into clinical relevance // Journal of innate immunity. – 2020. – Vol. 12, No 3. – P. 203-225. DOI: 10.1159/000502489.
- Петренко В.М. Строение и топография непарной вены и грудного протока у человека и белой крысы с позиций эмбриогенеза // Фундамент. исследов-я. – 2009. – № 10. – С. 46–47. [Petrenko V.M. Stroenie i topografiya neparnoj veny i grudnogo protoka u cheloveka i beloj krysy s pozicij embriogeneza // Fundament. issledov-ya. – 2009. – № 10. – S. 46–47. (In Russ.)]
- Chen X., Liu Q., Wang D., Feng S., Zhao Y., Shi Y., Liu Q. Protective effects of hydrogen-rich saline on rats with smoke inhalation injury // Oxidative medicine and cellular longevity. – 2015. – Vol. 2015. DOI: 10.1155/2015/106836.
- Kozma R.D.L.H., Alves E.M., Barbosa-de-Oliveira V.A., Lopes F.D.T.Q.D.S., Guardia R.C., Buzo H. V., Ribeiro-Paes M.J.D.O. A new experimental model of cigarette smoke-induced emphysema in Wistar rats // Jornal Brasileiro de Pneumologia. – 2014. – Vol. 40, No 1. – P. 46-54. DOI: 10.1590/S1806-37132014000100007.
- Su J., Li J., Lu Y., Li N., Li P., Wang Z., Liu X. The rat model of COPD skeletal muscle dysfunction induced by progressive cigarette smoke exposure: a pilot study // BMC Pulmonary Medicine. – 2020. – Vol. 20. – P. 1-13. DOI: 10.3325/cmj.2016.57.363
- Van Helden H.P.M. Kuijpers W.C., Steenvoorden D., Go C., Bruijnzeel P.L.B., Van Eijk M., Haagsman H.P. Intratracheal aerosolization of endotoxin (LPS) in the rat: a comprehensive animal model to study adult (acute) respiratory distress syndrome // Experimental lung research. – 1997. – Vol. 23, No 4. – P. 297-316. DOI: 10.3109/01902149709039228.
- Кательникова А.Е., Крышень К.Л., Макарова М.Н., Макаров В.Г. Экспериментальные модели острого бронхита на животных // Лабораторные животные для научных исследований. – 2019. – №. 1. – С. 127-151. [Katel'nikova A.E., Kryshen' K.L., Makarova M.N., Makarov V.G. Eksperimental'nye modeli ostrogo bronhita na zhivotnyh // Laboratornye zhivotnye dlya nauchnyh issledovanij. – 2019. – №. 1. – S. 127-151. (In Russ.)] DOI: 10.29296/2618723X-2019-01-10.
- Wright J.L., Churg A. Animal models of cigarette smoke-induced chronic obstructive pulmonary disease // Expert review of respiratory medicine. – 2010. – Vol. 4, No 6. – P. 723-734. DOI: 10.1586/ers.10.68
- Nikota J. K., Stämpfli M. R. Cigarette smoke-induced inflammation and respiratory host defense: Insights from animal models // Pulmonary pharmacology & therapeutics. – 2012. – Vol. 25, No 4. – P. 257-262. DOI: 10.1016/j.pupt.2012.05.005.
- Mercer P.F., Abbott-Banner K., Adcock I.M., Knowles R. G. Translational models of lung disease // Clinical Science. – 2015. – Vol. 128, No 4. – P. 235-256. DOI: 10.1042/CS20140373.
- Zhu F., Qiu X., Wang J., Jin Y., Sun Y., Lv T., Xia Z. A rat model of smoke inhalation injury // Inhalation toxicology. – 2012. – Vol. 24, No 6. – P. 356-364. DOI: 10.3109/08958378.2012.673179.
- Cambau E., Drancourt M. Steps towards the discovery of Mycobacterium tuberculosis by Robert Koch, 1882 // Clinical Microbiology and Infection. – 2014. – Vol. 20, No 3. – P. 196-201. DOI: 10.1111/1469-0691.12555.
- Padilla-Carlin D.J., McMurray D.N., Hickey A.J. The guinea pig as a model of infectious diseases // Comparative medicine. – 2008. – Vol. 58, No 4. – P. 324-340.
- Schreider J. P., Hutchens J. O. Morphology of the guinea pig respiratory tract // The Anatomical Record. – 1980. – Vol. 196, No 3. – P. 313-321. DOI: 10.1002/ar.1091960307.
- Yarto-Jaramillo E. Respiratory system anatomy, physiology, and disease: guinea pigs and chinchillas // Veterinary Clinics: Exotic Animal Practice. – 2011. – Vol. 14, No 2. – P. 339-355. DOI: 10.1016/j.cvex.2011.03.008.
- Shomer N. H., Holcombe H., Harkness J. E. Biology and diseases of guinea pigs // Laboratory Animal Medicine. – Academic Press, 2015. – P. 247-283. DOI: 10.1016/B978-0-12-409527-4.00006-7.
- Choi H.K., Finkbeiner W.E., Widdicombe J.H. A comparative study of mammalian tracheal mucous glands // Journal of anatomy. – 2000. – Vol. 197, No 3. – P. 361-372. DOI: 10.1046/j.1469-7580.2000.19730361.x.
- Canning B. J., Chou Y. Using guinea pigs in studies relevant to asthma and COPD // Pulmonary pharmacology & therapeutics. – 2008. – Vol. 21, No 5. – P. 702-720. DOI: 10.1016/j.pupt.2008.01.004.
- Adriaensen D., Brouns I., Pintelon I., De Proost I., & Timmermans, J. P. Evidence for a role of neuroepithelial bodies as complex airway sensors: comparison with smooth muscle-associated airway receptors // Journal of Applied Physiology. – 2006. – Vol. 101, No 3. – P. 960-970. DOI: 10.1152/japplphysiol.00267.2006.
- Weichselbaum M., Sparrow M.P., Hamilton E.J., Thompson P.J., Knight D.A. A confocal microscopic study of solitary pulmonary neuroendocrine cells in human airway epithelium // Respiratory Research. – 2005. – Vol. 6, No 1. – P. 115. DOI: 10.1186/1465-9921-6-115.
- Крышень К.Л., Кательникова А.Е., Мужикян А.А., Макарова М.Н., Макаров В.Г. Регуляторные и методические аспекты изучения аллергизирующих свойств новых лекарственных средств на этапе доклинических исследований // Ведомости Научного центра экспертизы средств медицинского применения. – 2018. – Т. 8. – №. 1. [Kryshen' K.L., Katel'nikova A.E., Muzhikyan A.A., Makarova M.N., Makarov V.G. Regulyatornye i metodicheskie aspekty izucheniya allergiziruyushchih svojstv novyh lekarstvennyh sredstv na etape doklinicheskih issledovanij // Vedomosti Nauchnogo centra ekspertizy sredstv medicinskogo primeneniya. – 2018. – T. 8. – №. 1. (In Russ.)]
- Ellis J.L., Undem B.J. Role of peptidoleukotrienes in capsaicin‐sensitive sensory fibre‐mediated responses in guinea‐pig airways // The Journal of Physiology. – 1991. – Vol. 436, No 1. – P. 469-484. DOI: 10.1113/jphysiol.1991.sp018561.
- Canning B.J., Mori N., Mazzone S.B. Vagal afferent nerves regulating the cough reflex // Respiratory physiology & neurobiology. – 2006. – Vol. 152, No 3. – P. 223-242. DOI: 10.1016/j.resp.2006.03.001.
- Ito K., Sawada Y., Kamei J., Misawa M., Iga T. Toxicodynamic analysis of cough and inflammatory reactions by angiotensin-converting enzyme inhibitors in guinea pig // Journal of Pharmacology and Experimental Therapeutics. – 1995. – Vol. 275, No 2. – P. 920-925.
- Johnson-Delaney C. A., Orosz S. E. Rabbit respiratory system: clinical anatomy, physiology and disease // Veterinary Clinics: Exotic Animal Practice. – 2011. – Vol. 14, No 2. – P. 257-266. DOI: 10.1016/j.cvex.2011.03.002.
- Kozma C., Macklin W., Cummins L.M., Mauer R. Anatomy, physiology and biochemistry of the rabbit // The biology of the laboratory rabbit. – 1974. – Vol. 12, No 1. – P. 55-58.
- Kamaruzaman N.A., Kardia E., Kamaldin N.A., Latahir A.Z., Yahaya B.H. The rabbit as a model for studying lung disease and stem cell therapy // BioMed research international. – 2013. – Vol. 2013. DOI: 10.1155/2013/691830.
- Hilding D.A., Hilding A.C. Electron microscopic observations of nasal epithelium after experimental alteration of airflow // Annals of Otology, Rhinology & Laryngology. – 1970. – Vol. 79, No 3. – P. 451-460. DOI: 10.1177/000348947007900304.
- Ramchandani R., Bates J.H.T., Shen X., Suki,B., Tepper R.S. Airway branching morphology of mature and immature rabbit lungs // Journal of Applied Physiology. – 2001. – Vol. 90, No 4. – P. 1584-1592. DOI: 10.1152/jappl.2001.90.4.1584.
- Hislop A., Muir D. C.F., Jacobsen M., Simon G., Reid L. Postnatal growth and function of the pre-acinar airways // Thorax. – 1972. – Vol. 27, No 3. – P. 265-274.
- Keir S., Page C. The rabbit as a model to study asthma and other lung diseases // Pulmonary pharmacology & therapeutics. – 2008. – Vol. 21, No 5. – P. 721-730. DOI: 10.1016/j.pupt.2008.01.005.
- Thorning D.R., Howard M.L., Hudson L.D., & Schumacher R.L. Pulmonary responses to smoke inhalation: Morphologic changes in rabbits exposed to pine wood smoke // Human pathology. – 1982. – Vol. 13, No 4. – P. 355-364. DOI: 10.1016/s0046-8177(82)80225-6.
- Meurens F., Summerfield A., Nauwynck H., Saif L., Gerdts V. The pig: a model for human infectious diseases // Trends in microbiology. – 2012. – Vol. 20, No 1. – P. 50-57. DOI: 10.1016/j.tim.2011.11.002.
- Elahi S., Holmstrom J., Gerdts V. The benefits of using diverse animal models for studying pertussis // Trends in microbiology. – 2007. – Vol. 15, No 10. – P. 462-468. DOI: 10.1016/j.tim.2007.09.003.
- Khatri M., Dwivedi V., Krakowka S., Manickam C., Ali A., Wang L., Lee C.W. Swine influenza H1N1 virus induces acute inflammatory immune responses in pig lungs: a potential animal model for human H1N1 influenza virus // Journal of virology. – 2010. – Vol. 84, No 21. – P. 11210-11218. DOI: 10.1128/JVI.01211-10.
- Gil O., Díaz I., Vilaplana C., Tapia G., Díaz J., Fort M., Domingo M. Granuloma encapsulation is a key factor for containing tuberculosis infection in minipigs // PloS one. – 2010. – Vol. 5, No 4. – P. e10030. DOI: 10.1371/journal.pone.0010030.
- Luna C.M., Sibila O., Agusti C., Torres, A. Animal models of ventilator-associated pneumonia // European Respiratory Journal. – 2009. – Vol. 33, No 1. – P. 182-188. DOI: 10.1183/09031936.00046308.
- Identification and Prevention of the Sick or Compromised Nursery Pig // Pork information Gateway. 2014. – URL: https://porkgateway.org/wp-content/uploads/2015/07/identification-of-the-sick-or-compromised-pig1.pdf (дата обращения 10.2020).
- Horter D. C., Yoon K. J., Zimmerman J. J. A review of porcine tonsils in immunity and disease //Animal health research reviews. – 2003. – Т. 4. – №. 2. – С. 143-155. DOI: 10.1079/ahr200358.
- Nakakuki S. Bronchial tree, lobular division and blood vessels of the pig lung // Journal of Veterinary Medical Science. – 1994. – Vol. 56, No 4. – P. 685-689. DOI: 10.1292/jvms.56.685.
- Judge E.P., Hughes J.L., Egan J.J., Maguire M., Molloy E.L., O’Dea S. Anatomy and bronchoscopy of the porcine lung. A model for translational respiratory medicine //American journal of respiratory cell and molecular biology. – 2014. – Vol. 51, No 3. – P. 334-343. DOI: 10.1165/rcmb.2017-0096ST.
- Kurmi O.P., Semple S., Simkhada P., Smith W.C.S., Ayres J.G. COPD and chronic bronchitis risk of indoor air pollution from solid fuel: a systematic review and meta-analysis // Thorax. – 2010. – Vol. 65, No 3. – P. 221-228. DOI: 10.1136/thx.2009.124644.
- Choi W.I., Syrkina O., Kwon K., Quinn D.A., Hales C.A. JNK activation is responsible for mucus overproduction in smoke inhalation injury // Respiratory research. – 2010. – Vol. 11, No 1. – P. 1-8. DOI: 10.1186/1465-9921-11-172.
- Meyerholz D. K. Lessons learned from the cystic fibrosis pig // Theriogenology. – 2016. – Vol. 86, No 1. – P. 427-432. DOI: 10.1016/j.theriogenology.2016.04.057.
- Olivier A.K., Gibson-Corley K.N., Meyerholz D.K. Animal models of gastrointestinal and liver diseases. Animal models of cystic fibrosis: gastrointestinal, pancreatic, and hepatobiliary disease and pathophysiology // American Journal of Physiology-Gastrointestinal and Liver Physiology. – 2015. – Vol. 308, No 6. – P. G459-G471. DOI: 10.1152/ajpgi.00146.2014.
- Rogers C.S., Stoltz D.A., Meyerholz D.K., Ostedgaard L.S., Rokhlina T., Taft P.J., Kabel A. C. Disruption of the CFTR gene produces a model of cystic fibrosis in newborn pigs // Science. – 2008. – Vol. 321, No 5897. – P. 1837-1841. DOI: 10.1126/science.1163600.
- Stoltz D.A., Meyerholz D.K., Pezzulo A.A., Ramachandran S., Rogan M.P., Davis G.J., Nelson G.A. Cystic fibrosis pigs develop lung disease and exhibit defective bacterial eradication at birth // Science translational medicine. – 2010. – Vol. 2, No 29. – P. 29ra31-29ra31. DOI: 10.1126/scitranslmed.3000928.
- Kimmel E.C., Still K.R. Acute lung injury, acute respiratory distress syndrome and inhalation injury: an overview // Drug and chemical toxicology. – 1999. – Vol. 22, No 1. – P. 91-128. DOI: 10.3109/01480549909029726
- Choi W.I., Syrkina O., Kwon K., Quinn D.A., Hales C.A. JNK activation is responsible for mucus overproduction in smoke inhalation injury // Respiratory research. – 2010. – Vol. 11, No 1. – P. 1-8. DOI: 10.1186/1465-9921-11-172
- Hecht S.S. Carcinogenicity studies of inhaled cigarette smoke in laboratory animals: old and new // Carcinogenesis. – 2005. – Vol. 26, No 9. – P. 1488-1492. DOI: 10.1093/carcin/bgi148.
- Zwicker G.M., Filipy R.E., Park J.F., Loscutoff S.M., Ragan H.A., Stevens D.L. Clinical and pathological effects of cigarette smoke exposure in beagle dogs // Archives of pathology & laboratory medicine. – 1978. – Vol. 102, No 12. – P. 623
- Takenaka S., Heini A., Ritter B., Heyder, J. Morphometric evaluation of bronchial glands of beagle dogs // Toxicology letters. – 1996. – Vol. 88, No 1-3. – P. 279-285. DOI: 10.1016/0378-4274(96)03750-2.
- Liang G.B., He Z.H. Animal models of emphysema //Chinese Medical Journal. – 2019. – Vol. 132, No 20. – P. 2465. DOI: 10.1097/CM9.0000000000000469.
- Radostits O.M., Mayhew, I.G., Houston D.M. Veterinary clinical examination and diagnosis. – WB Saunders, 2000. – 800 p.




