Исследование биосовместимости композиционных материалов на основе гидроксиапатита и сополимера лактид-гликолида на лабораторных мышах
Смирнов С.С., Карпов А.А., Гуцалова А.А., Курзина И.А., Лыткина Д.Н., Щепкина Е.А., Плиско Г.А., Карев В.Е., Ивкина А.С. Исследование биосовместимости композиционных материалов на основе гидроксиапатита и сополимера лактид-гликолида на лабораторных мышах. Лабораторные животные для научных исследований. 2020; 3. https://doi.org/10.29296/2618723X-2020-03-06
Резюме
В данном исследовании на мышах изучалась биосовместимость композиционных материалов на основе гидроксиапатита и сополимера лактида и гликолида с различным соотношением компонентов: композиционный материал №1 – 95:5 мас.%, композиционный материал №2 – 93:7 мас.%. В ходе экспериментов были использованы 30 беспородных мышей самцов массой 30–40 г, которые до операции случайным образом были разделены на 5 групп в зависимости от того, какой материал был имплантирован в организм: гидроксиапатит, сополимер лактид-гликолид, композиционный материал №1, композиционный материал №2; в группе ложнооперированных животных выполняли доступ до большой грудной мышцы без помещения материала. Были проведены операции по внедрению испытуемых материалов за большую грудную мышцу. Длительность эксперимента составила 22 сут. На 21-е сутки после операции из ретроорбитального синуса забирали кровь, в которой определяли уровень лейкоцитов, после этого выполняли эвтаназию животных в CO2-боксе. После эвтаназии проводили макроскопическое и гистологическое исследования большой грудной мышцы. Окрашивание гистологических препаратов выполняли, используя гематоксилин и эозин и окраску по ван Гизону. При этом оценивали следующие параметры: воспаление, фиброз и васкуляризацию. Было показано, что изолированное применение гидроксиапатита сопровождается умеренным фиброзом и местным воспалением. В ответ на имплантацию чистого сополимера лактида и гликолида не наблюдалось никакой реакции со стороны организма. Среди композитных материалов с точки зрения биосовместимости оптимальным для имплантации был композиционный материал с соотношением гидроксиапатита к сополимеру лактида и гликолида, равным 93:7 мас.% (композиционный материал №2), применение которого характеризуется меньшей выраженностью воспаления и фиброза в зоне имплантации по сравнению с гидроксиапатитом. Большая биосовместимость композиционного материала №2 по сравнению с гидроксиапатитом и композиционным материалом №1, вероятно, может быть связана с увеличением содержания сополимера лактида и гликолида в его составе.
Введение
Восполнение дефектов костной ткани длинных костей конечностей – одна из актуальных проблем ортопедии. Высокоэнергетическая травма, резекция опухоли, пороки развития и инфекция могут привести к значительной потере костной массы и большим дефектам с низким внутренним потенциалом заживления [1]. При этом развитие высокоэнергетических видов транспорта сопровождается увеличением не только частоты повреждений опорно-двигательного аппарата до 52% , но соответственно и частоты возникновения посттравматических укорочений нижних конечностей (до 7,4–13,1%) [2]. Во всем мире ежегодно проводится >2 млн хирургических вмешательств по пересадке кости, что является вторым по частоте трансплантации ткани сразу после переливания крови [3].
Наличие дефекта требует имплантации материала, который будет выполнять роль матрицы для растущей кости. Традиционное применение аутотрансплантата дает хорошие результаты [4]. Однако данная методика имеет ряд сложностей, которые затрудняют ее распространение в клинической практике [5]. Так, не у всех больных можно использовать аутотрансплантацию в силу общего состояния больного и состояния кости-реципиента, кроме того, размер аутотрансплантата имеет верхний порог объема, поэтому крупные зоны дефекта заполнить не удается. Более того, аутотрансплантация не всегда ведет к повышению качества жизни, что вызвано болевым синдромом в месте резекции костного блока, который сохраняется длительное время. Применение донорской декальцинированной кости также имеет недостатки, которые заключаются в трудностях ее заготовки и консервации [6], а также в ее повышенной резорбции [7–9]. Именно поэтому наиболее перспективными становятся исследования искусственных заменителей костной ткани и работа по их внедрению в практическую медицину.
Гидроксиапатит (ГА) – наиболее распространенный заменитель костной ткани [10–13], который является основным минеральным компонентом кальцинированных тканей. Однако это соединение обладает рядом недостатков, таких как недостаточная механическая прочность и высокая цитотоксичность, что ограничивает его применение в клинической практике [14]. Композиционные материалы на основе ГА и сополимера лактида и гликолида (СЛГ) в условиях in vitro показали лучшие механохимические свойства по сравнению с ГА [15], что создает хорошие предпосылки к дальнейшему изучению этого направления.
Цель исследования – изучение биосовместимости композиционных материалов на основе гидроксиапатита и сополимера лактида и гликолида в различных соотношениях в экспериментах на мышах.
Материал и методы
Синтез ГА осуществляли жидкофазным методом с использованием СВЧ-излучения при рН~11,0 по методике, детально описанной ранее [16]. СЛГ получали методом ионной полимеризации [17]. Кроме того, получены 2 композиционных материала на основе ГА и СЛГ с различным соотношением компонентов: композиционный материал №1 (К1) – 95:5 мас.%, композиционный материал №2 (К2) (n = 6) – 93:7 мас.%
В ходе экспериментов использованы 30 беспородных мышей самцов массой 30–40 г (питомник «Рапполово», Ленинградская область), содержащихся в условиях 12/12-часового светотемнового режима и получавших стандартный гранулированный корм «Полнорационный экструдированный комбикорм ПК-120 для лабораторных животных (крыс, мышей)» производства ООО «ЛАБОРАТОРМКОРМ» (Россия) и питьевую воду ad libitum. Все эксперименты проведены в соответствии с правилами, принятыми Европейской конвенцией по защите позвоночных животных, используемых для экспериментальных и иных целей [18], с требованиями ГОСТа Р ИСО 10993-2-2009 и «Руководства по уходу и использованием лабораторных животных» (публикация Национального института здоровья США, №85-23). Эксперименты одобрены локальным этическим комитетом СПХФУ (Протокол БЭК №Mice-1/03-19). Эвтаназию животных проводили в соответствии с внутренним стандартизированным операционным протоколом путем усыпления углекислым газом в CO2-боксе модели THF3481-V01 (BIOSCAPE (EHRET), Германия).
Все животные до операции случайным образом были разделены на (по 6 мышей в каждой) с дальнейшим введением различного материала:
- гидроксиапатит (ГА);
- сополимер лактид-гликолид (СЛГ);
- композиционный материал №1 (К1);
- композиционный материал №2 (К2);
- ложнооперированные (ЛО) – выполняли доступ до большой грудной мышцы без помещения материала.
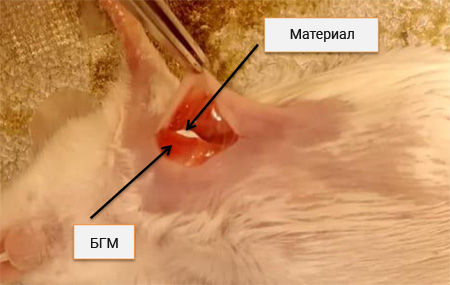
Животных наркотизировали с помощью хлоралгидрата в дозе 450 мг/кг, вводимого интраперитонеально, помещали на термостатируемый столик (TCAT-2LV controller (Physitemp Instruments Inc., США), им удаляли шерсть и обрабатывали подготовленный участок кожи хлоргексидином (ЭКОЛАБ, Россия). Доступ до грудных мышц осуществляли помощью L-образного разреза кожи от верхнего края тела грудины до мечевидного отростка по средней линии и далее по ходу VII ребра до средней аксиллярной линии. Образцы исследуемых материалов помещали за большую грудную мышцу, рану послойно ушивали (рис. 1). После операции животные находились на подогреваемом коврике до окончания действия анестезии.
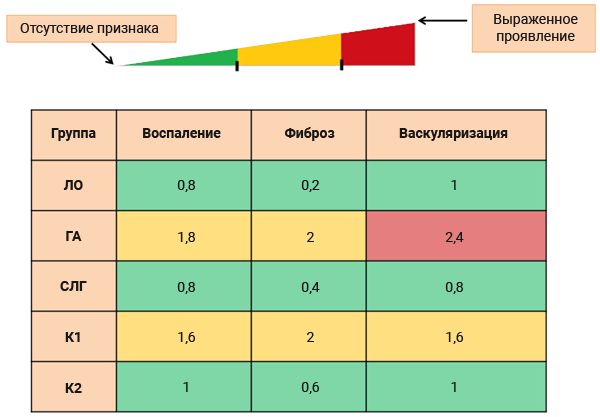
На 21-е сутки после операции с помощью пункции ретроорбитального сплетения производили забор крови и определяли уровень лейкоцитов в периферической крови, после этого выполняли эвтаназию. После эвтаназии осуществляли макроскопическое и гистологическое исследования большой грудной мышцы. Окрашивание гистологических препаратов выполняли, используя гематоксилин и эозин и окраску по ван Гизону. При этом проводили оценку следующих параметров: воспаление, фиброз и васкуляризация. Каждый из параметров был оценен независимым экспертом по шкале степени выраженности проявления признака: 0 – полное отсутствие; 1 – незначительное; 2 – умеренное; 3 – выраженное проявление признака.
Анализ данных проводили с помощью статистического пакета Statistica 7.0 (StatSoft; США). Первичный анализ различий данных в опытных группах осуществляли с помощью многомерного непараметрического критерия Краскела–Уоллиса (Nonparametric One-way ANOVA), различия считали достоверными при р<0,05. Последующий анализ различий в парах выполняли с помощью метода множественных сравнений по критерию Краскела–Уоллиса для показателей со статистически значимой разницей по данным многомерного анализа.
Результаты
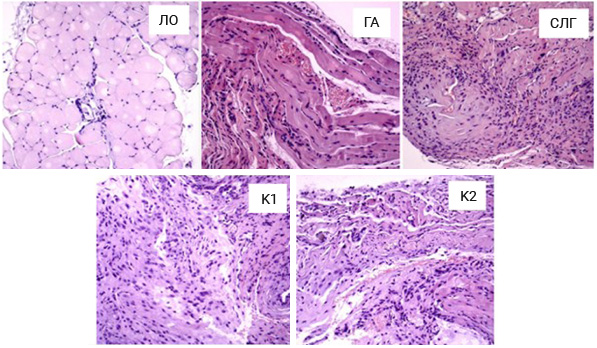
Примечание: здесь и на рис. 3: ЛО – ложнооперированные; ГА – гидроксиапатит; СЛГ – сополимер лактид-гликолид; К1 – композиционный материал №1; К2 – композиционный материал №2. Окраска гематоксилином и эозином.
В течение всего срока наблюдения гибели животных не было. По результатам визуальной оценки ни у одной особи не наблюдалось абсцессов и других местных признаков воспаления.
По данным гистологического исследования отмечалась значимо большая выраженность воспаления, фиброза и васкуляризации в группах ГА и К1 по сравнению с ЛО (p<0,05) (см. таблицу). Подобных изменений не выявлено в группе СЛГ. В группе К2 определена статистическая тенденция к увеличению выраженности фиброза по сравнению ЛО (p = 0,68) (рис. 2).
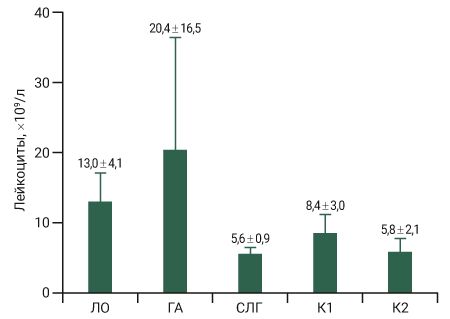
По данным анализа крови, выполненного через 21 сут после имплантации исследуемых материалов, значимых различий в уровне (109/л) лейкоцитов (маркера системного воспаления) не выявлено: ЛО 13,0 ± 4,1; К1 8,4 ± 3,0 ; К2 11,6 ± 4,2 ; СЛГ 11,2 ± 1,8 ; ГА 20,4 ± 16,1 (рис. 3).
Заключение
В ходе проведенного исследования продемонстрировано, что изолированное применение гидроксиапатита сопровождается умеренным фиброзом и местным воспалением. В ответ на имплантацию чистого сополимера лактида и гликолида не наблюдалось никакой реакции со стороны организма. Это может быть объяснено способностью сополимера лактида и гликолида биодеградировать в организме до молочной и гликолевой кислот, которые являются естественными метаболитами. С точки зрения биосовместимости оптимальным материалом для имплантации среди исследованных был композиционный материал с соотношением гидроксиапатита к сополимеру лактида и гликолида, равным 93:7 мас.% (композиционный материал №2), применение которого характеризуется меньшей выраженностью воспаления и фиброза в зоне имплантации по сравнению с гидроксиапатитом. Складывается представление, что большая биосовместимость композиционного материала №2 по сравнению с гидроксиапатитом и композиционным материалом №1 может быть связана с увеличением содержания сополимера лактида и гликолида в его составе. Принимая во внимание также хорошие механические свойства [15], этот материал может быть в дальнейшем использован для доклинического тестирования с целью замещения дефектов костной ткани.
Благодарности
Работа выполнена без спонсорской поддержки.
Вклад авторов
Смирнов С.С. – идея, планирование, выполнение экспериментальной работы на лабораторных животных;
Карпов А.А. – планирование, выполнение экспериментальной работы на лабораторных животных, редактирование текста публикации;
Гуцалова А.А. – идея, синтез гидроксиапатита, сополимера лактида и гликолида и композиционных материалов;
Щепкина Е.А. – планирование, редактирование текста публикации;
Плиско Г.А. – уход за животными, забор биоматериала;
Карев В.Е. – выполнение гистологического исследования, анализ результатов;
Ивкина А.С. – анализ и интерпретация результатов, написание, редактирование текста.
Список источников
- Pneumaticos S.G., Triantafyllopoulos G.K., Basdra E.K., Papavassiliou A.G. Segmental bone defects: from cellular and molecular pathways to the development of novel biological treatments // J. Cell. Mol. Med.. 2010. №14. P. 2561-2569. DOI: 10.1111/j.1582-4934.2010.01062.x.
- Шаповалов В.М., Хоминец В.В., Михайлов С.В., Шакун Д.А., Капилевич Б.Я. Комбинированный способ восстановления длины бедра и голени при лечении больных с последствиями травм и дефектами развития // Гений Ортопедии. 2010. №1. С. 116-121. [Shapovalov V.M., Khominets V.V., Mikhailov S.V., Shakun D.A., Kapilevich B.Ya. Combined method of restoring the length of the hip and hunger in diseases with the consequences of trauma and developmental defects // Genius of Orthopedics. 2010. No. 1. S. 116-121.(In Russ.)]
- Campana V., Milano G., Pagano E., et al. Bone substitutes in orthopaedic surgery: from basic science to clinical practice // J Mater Sci: Mater Med. 2014. №25. P. 2445-2461. DOI: 10.1007/s10856-014-5240-2.
- Базаров Н.И., Нарзулоев В.А., Усмонов Х.С., Курбанов Д.М. Некоторые аспекты костной аутотрансплантации при костных новообразованиях и опухолеподобных процессах // Вестник Авиценны. 2009. №4. С. 34-40 [Bazarov N.I., Narzuloev V.A., Usmonov Kh.S., Kurbanov D.M. Nekotorye aspekty kostnoi autotransplantatsii pri kostnykh novoobrazovaniyakh i opukholepodobnykh protsessakh // Vestnik Avitsenny. 2009. №4. P. 34-40. (In Russ.)]
- Buyuksungur S., Tanir T.E., Buyuksungur A. et al. 3D Printed Poly(ε-caprolactone) Scaffolds Modified with Hydroxyapatite and Poly(propylene fumarate) and Effects on Healing of Rabbit Femur Defects // Biomaterials Science. 2017. №5. P. 2144-2158. DOI: 10.1039/c7bm00514h
- Булатов А.А., Калинин А.В., Савельев В.И. Современные способы изготовления, стерилизации и консервации деминерализованных костных трансплантатов // Травматология и ортопедия России. 2005. №1. С. 55-59.[ Bulatov A.A., Kalinin A.V., Savel'ev V.I. Sovremennye sposoby izgotovleniya, sterilizatsii i konservatsii demineralizovannykh kostnykh transplantatov // Travmatologiya i ortopediya Rossii. 2005. №1. S. 55-59. (In Russ)]
- Gordh M., Alberius P. Some basic factors essential to autogeneic nonvascularized onlay bone grafting to he craniofacial skeleton // Scand J Plast Reconstr Surg Hand Surg. 1999. №33. С. 129-146. DOI: 10.1080/02844319950159370.
- Nyström E., Ahlqvist J., Legrell P.E., Kahnberg. K.E. Bone graft remodelling and implant success rate in the treatment of the severely resorbed maxilla: A 5-year longitudinal study // Int J Oral Maxillofac Surg. 2002. №31. P. 158-164. DOI: 10.1054/ijom.2001.0197.
- Dasmah A., Thor A., Ekestubbe A. et al. Particulate vs. block bone grafts: Three-dimensional changes in graft volume after reconstruction of the atrophic maxilla, a 2-year radiographic follow-up // J Craniomaxillofac Surg. 2012. №40. P. 654–659. DOI: 10.1016/j.jcms.2011.10.032.
- Landes C.A., Ballon A., Tran A. et al. Segmental stability in orthognathic surgery: hydroxyapatite/Poly-l-lactide osteoconductive composite versus titanium miniplate osteosyntheses // J Craniomaxillofac Surg. 2014. №42. P. 930-942. DOI: 10.1016/j.jcms.2014.01.013.
- Landes C., Ballon A., Ghanaati S. et al. Treatment of malar and midfacial fractures with osteoconductive forged unsintered hydroxyapatite and poly-L-lactide composite internal fixation devices // J Oral Maxillofac Surg. 2014. №72. P. 1328-1338. DOI: 10.1016/j.joms.2014.02.027.
- Takada N., Otsuka T., Suzuki H., Yamada K. Pediatric displaced fractures of the lateral condyle of the humerus treated using high strength, bioactive, bioresorbable F-u-HA/PLLA pins: a case report of 8 patients with at least 3 years of follow-up // J Orthop Trauma. 2013. №27. С. 281-284. DOI: 10.1097/BOT.0b013e318269ba8e.
- Tsunekawa T., Usui A., Oshima H. et al. A bioresorbable osteosynthesis device can induce an earlier sternal fusion after median sternotomy // Interactive CardioVascular and Thoracic Surgery. 2012. №15. P. 377-381. DOI: 10.1093/icvts/ivs151.
- Березовская А.А., Лыткина Д.Н., Курзина И.А. Исследование биоактивных свойств композиционных материалов на основе гидроксиапатита и сополи(лактид-гликолид)а и оценка их цитотоксичности с индикатором Alamar Blue // Сборник трудов 6-ой Международной научной конференции «Новые оперативные технологии». Томск: Издательство Томского государственного университета, 2017. С. 16-17. [Berezovskaya A.A., Lytkina D.N., Kurzina I.A. Issledovanie bioaktivnykh svoistv kompozitsionnykh materialov na osnove gidroksiapatita i sopoli(laktid-glikolid)a i otsenka ikh tsitotoksichnosti s indikatorom Alamar Blue // Sbornik trudov 6-oi Mezhdunarodnoi nauchnoi konferentsii «Novye operativnye tekhnologii». Tomsk: Izdatel'stvo Tomskogo gosudarstvennogo universiteta, 2017. S. 16-17. (In Russ)]
- Гуцалова А.А., Лыткина Д.Н., Курзина И.А. Получение и исследование прочности биосовместимых композитов на основе гидроксиапатита и биоразлагаемых полимеров // Сборник материалов V Всероссийской студенческой конференции с международным участием, посвященной Международному году Периодической таблицы химических элементов. СПб: Издательство РГПУ им. А. И. Герцена, 2019. С. 103-104. [Gutsalova A.A., Lytkina D.N., Kurzina I.A. Poluchenie i issledovanie prochnosti biosovmestimykh kompozitov na osnove gidroksiapatita i biorazlagaemykh polimerov // Sbornik materialov V Vserossiiskoi studencheskoi konferentsii s mezhdunarodnym uchastiem, posvyashchennoi Mezhdunarodnomu godu Periodicheskoi tablitsy khimicheskikh elementov. SPb.: Izdatel'stvo RGPU im. A. I. Gertsena, 2019. S. 103-104. (In Russ)]
- Способ получения кремниймодифицированного гидроксиапатита с использованием свч-излучения // Патент России № 2507151. 2014. Бюл. № 5. / Коротченко Н.М., Рассказова Л.А. [Sposob polucheniya kremniimodifitsirovannogo gidroksiapatita s ispol'zovaniem svch-izlucheniya // Patent Rossii № 2507151. 2014. Byul. № 5. / Korotchenko N.M., Rasskazova L.A. (In Russ)]
- Kurzina I.A., Botvin V.V., Davydova D. V. et al. New materials based on polylactide modified with silver and carbon ions // AIP Conference Proceedings. 2015. Vol. 1688. P. 030033-1-030033-7. DOI: doi.org/10.1063/1.4936028.
- Council Directive 86/609/EEC of 24 November 1986 on the approximation of laws, regulations and administrative provisions of the Member States regarding the protection of animals used for experimental and other scientific purposes Official Journal L 358 , 18/12/1986 P. 0001 – 0028




