Сравнительный анализ эффективности обзора по доклиническим и клиническим исследованиям и собственных исследований как инструмента для регистрации генерика
Семивеличенко Е.Д., Эриванова Л.В., Ивкин Д.Ю., Ивкина А.С., Плиско Г.А., Елецкая Е.И., Дзюба А.С. Сравнительный анализ эффективности обзора по доклиническим и клиническим исследованиям и собственных исследований как инструмента для регистрации генерика. Лабораторные животные для научных исследований. 2019; 1. https://doi.org/10.29296/2618723X-2019-01-03
Резюме
На сегодняшний день существует 2 способа регистрации воспроизведенного препарата (генерика) на фармацевтическом рынке в части, касающейся доклинических исследований: представление обзоров по доклиническим и клиническим исследованиям оригинального препарата или отчетов по проведенным доклиническим исследованиям (острая и подострая токсичность генерика в сравнении с оригинальным препаратом). Достоинством 1-го способа является относительная простота, скорость и экономичность. Однако только 2-й способ позволяет в полной мере оценить безопасность воспроизведенного препарата. Поэтому некоторые фармацевтические фирмы используют одновременно оба способа. Приводится анализ статей, посвященных результатам доклинических и клинических исследований селективного нестероидного противовоспалительного препарата Эторикоксиб, а также результаты собственных доклинических исследований подострой (субхронической) токсичности оригинального лекарственного препарата Аркоксиа® (МНН: эторикоксиб) в лекарственной форме – таблетки, покрытые оболочкой 120 мг. Согласно полученным данным, препарат Эторикоксиб малотоксичен и безопасен при многократном (ежедневно в течение 14 дней) внутрижелудочном введении экспериментальным животным (крысы) в дозах 10,1 и 101,0 мг/кг (терапевтическая и 10-кратно превышающая терапевтическую дозы). На основании данного исследования показана сопоставимость результатов, полученных отечественными и зарубежными исследователями в рамках оценки токсикологических показателей эторикоксиба, с токсикологическим профилем препарата, оцененным авторами в ходе оценки субхронической токсичности на белых беспородных крысах обоего пола. Сопоставимые показатели получены также за счет использования в качестве испытуемого объекта исследования оригинального препарата. В случае воспроизведенных препаратов, написание обзоров по доклиническим и клиническим исследованиям референтного лекарственного средства представляется авторам недостаточным, т.к. существуют объективно высокие риски выведения на фармацевтический рынок препарата с неэквивалентной оригинатору безопасностью (например, за счет иного качества фармацевтической субстанции или иного качества и/или состава вспомогательных веществ).
Введение
Эторикоксиб – 5-хлоро-3-(4-метансульфонилфенил)-6-метил-[2,3']-бипиридинил] – представляет собой производное дипиридинила, содержащее (4-метилсульфонил) фенильную группу, связанную с центральным кольцом и обеспечивающую взаимодействие с ЦОГ2 [13]. Занимая боковой гидрофильный канал ЦОГ2, эторикоксиб образует с ним прочный комплекс, блокируя взаимодействие арахидоновой кислоты с расположенным здесь активным центром фермента. Это приводит к снижению выработки продуктов, опосредующих развитие воспалительных изменений. Взаимодействие препарата с соответствующей структурой ЦОГ1 является гораздо более слабым и носит обратимый характер, что обеспечивает сохранение активности фермента [22]. Эторикоксиб оказывает на ЦОГ2 примерно в 106 раз более мощное действие, чем на ЦОГ1, и имеет более выраженную ЦОГ2-селективность, чем целекоксиб [26].
В исследованиях С.С. Chan и соавт. [6] эторикоксиб показал себя мощным ингибитором продукции простогландина ПГЕ2 в клетках яичников китайских хомячков (CHO), экспрессирующих ЦОГ2 человека (доза, ингибирующая фермент в 50% случаев (IC50) = 79 ± 12 нМ) с высокой селективностью по сравнению с его воздействием на ЦОГ1 (IC50 > 50 мМ в клетках CHO).
IC50 селективность (ЦОГ1/ЦОГ2) для эторикоксиба, рофекоксиба, вальдекоксиба, целекоксиба и нимесулида составила 106, 35, 30, 7,6 и 7,3 соответственно. Более низкие (в 2–3 раза) отношения селективности наблюдались для диклофенака, этодолака и мелоксикама.
Цель данного исследования – определение токсических эффектов оригинального лекарственного препарата Аркоксиа® (МНН: эторикоксиб) производства Мерк Шарп и Доум Б.В., Нидерланды, серия М003942; лекарственная форма – таблетки, покрытые оболочкой, 120 мг, в дозах 10,1 мг/кг (терапевтическая доза – ТД) и 101,0 мг/кг (10 ТД) при 14-дневном внутрижелудочном введении 1 раз/день аутбредным крысам обоего пола.
Материал и методы
Животные были получены из питомника ПЛЖ «Рапполово». Количество животных для исследования было достаточным для получения статистически достоверных результатов, но при этом – минимальным по биоэтическим принципам. Возраст животных к началу эксперимента – 10–12 нед, вес 180–250 г, 30 самок и 30 самцов (по 10 в группе). Группы животных формировали случайным образом, отклонение массы тела животных среднего значения в группах одного пола допускалось не более чем на 10%. Контрольным животным аналогичным образом вводили воду, очищенную в таком же объеме, как и растворы исследуемого препарата.
Животные содержались в контролируемых условиях окружающей среды при температуре 20–26°C и относительной влажности воздуха 30–70%. В комнатах содержания животных поддерживался 12-часовой цикл освещения и 10-кратная смена объема воздуха комнаты в час. Температура и влажность контролировались с помощью термогигрометров Testo 608-1H.
Часть подопытных животных (50%) подвергалась эвтаназии на 15-й день после первого введения препарата, а оставшаяся часть – на 29-й день путем усыпления углекислым газом в CO2-боксе модели THF3481-V01 (производитель BIOSCAPE – EHRET, Германия).
Гематологический анализ был выполнен на ветеринарном автоматическом геманализаторе Abacus junior Vet (DIATRON, Австрия), биохимический анализ – на биохимическом анализаторе StatFax 1904 + (AwarenessTechnology, США) или автоматическом анализаторе Эрба Лахема (Польша), показатели гемостаза были определены в пробах на гемокоагулометре HumaClot Duo Plus (Human GmbH, Германия).
Выбор доз был обусловлен задачами исследования, в которые входило выявление дозозависимости токсических эффектов анализируемого препарата при многократном введении. Расчет дозировок препаратов для введения животным проводили при помощи коэффициентов пересчета доз для крысы и человека в зависимости от массы тела по E.J. Freireich (1966) [32].
Процедуры с животными были рассмотрены и утверждены биоэтической комиссией Санкт-Петербургского химико-фармацевтического университета Минздрава России.
Количественные данные рассчитывались по методам описательной статистики: подсчитывались средние значения (М) и стандартные отклонения (SD).
Межгрупповые различия анализировали непараметрическими методами для множественного сравнения – критерий
Крускала–Уоллиса, с последующим применением критерия Данна, в случае необходимости. Различия определяли при
0,05 уровне значимости. Использовалось программное обеспечение
Statistica 6.1.
Доклинические исследования безопасности и эффективности препарата Эторикоксиб
Эффективность эторикоксиба оценивали на различных моделях у крыс и приматов, включая каррагинан-индуцированный отек лапы, гипералгезию лапы, индуцированную каррагенаном, и модель повышения температуры тела при индуцировании эндотоксином [7].
Эффективность эторикоксиба при хронических воспалительных состояниях оценивали в индуцированном адъювантом артрите у крыс [11].
Было установлено, что эторикоксиб в дозах 0,3–0,9 мг/кг эффективен в моделях каррагинан-индуцированной гипералгезии и отеке лапы, а также индуцированного эндотоксином пиреза с эффективностью, сравнимой с эффективностью рофекоксиба и индометацина (табл. 1).
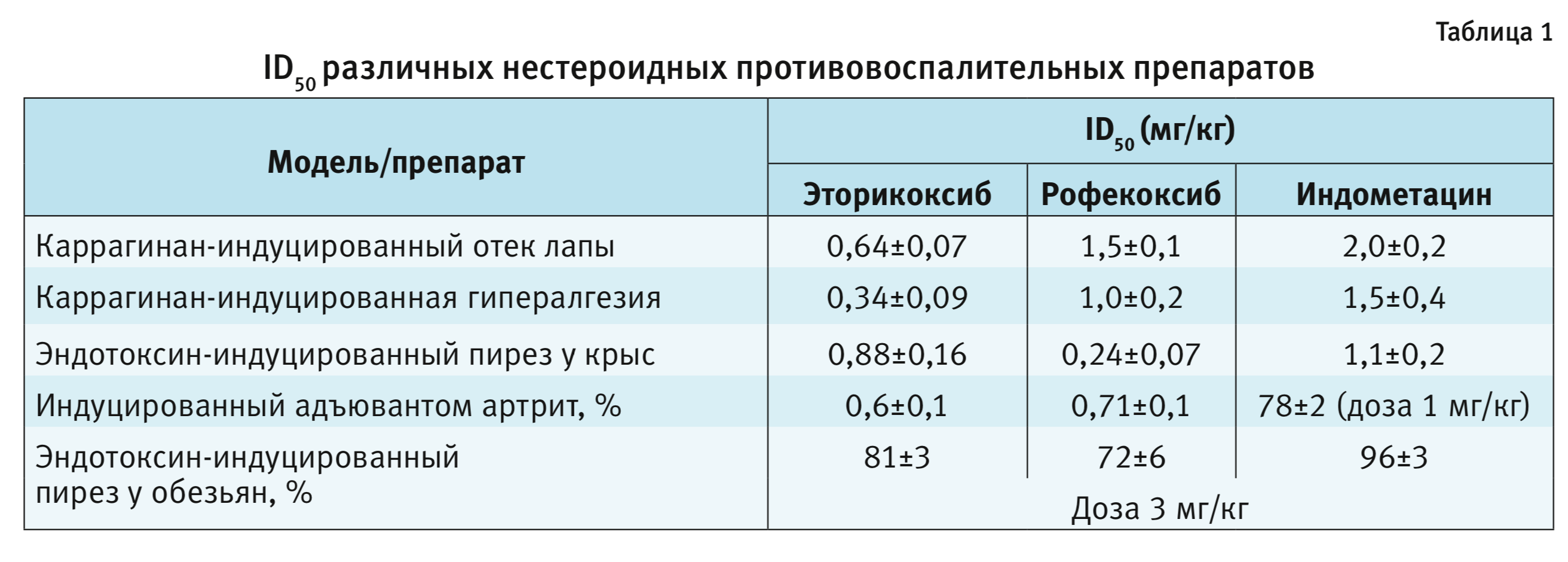
Безопасность эторикоксиба оценивали после его введения в дозах 10 и
30 мг/кг/день в течение 60 дней крысам
Wistar. В начале экспериментального периода статистически значимого межгруппового различия в систолическом
артериальном давлении (САД) среди животных 3 исследованных групп не наблюдалось (в день 0, р=0,2411). Начиная с
28-го дня введения эторикоксиба значение САД значительно увеличивалось по сравнению с таковой в контрольной группе
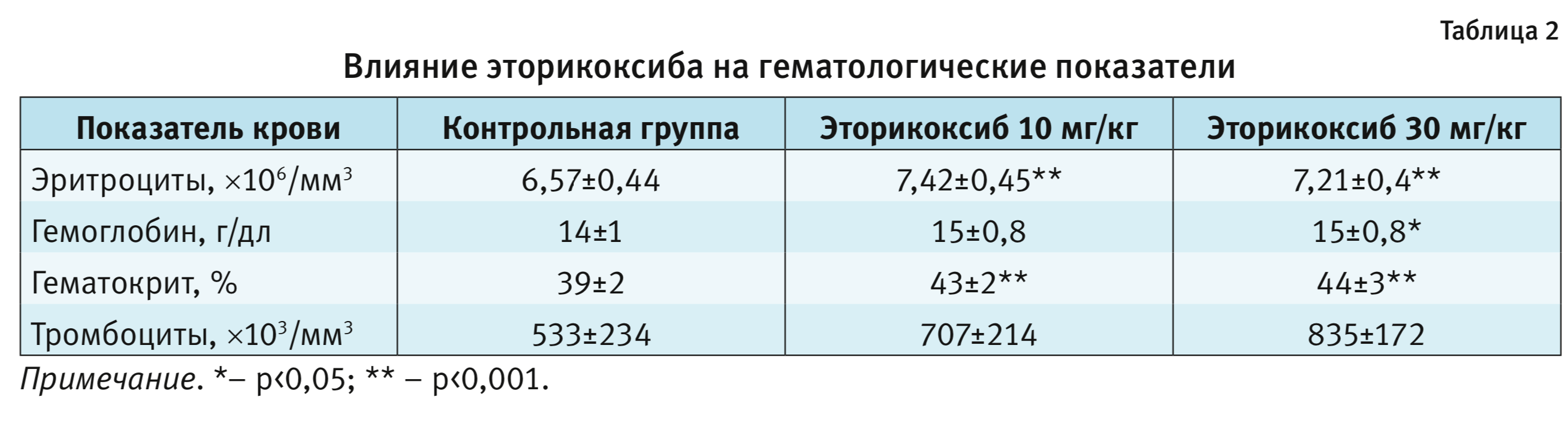
(эторикоксиб 10 мг/кг/день – р=0,0102 и эторикоксиб 30 мг/кг/день – р=0,0036). Кроме того, хроническое
применение эторикоксиба дало статистически достоверное увеличение уровней эритроцитов, гематокрита и тромбоцитов по
сравнению с показателями в контрольной группе (табл. 2), но не вызывало значительных изменений в других изученных
гематологических параметрах по сравнению с контрольной группой (р > 0,05) [21].
Гистологический анализ коры головного мозга, субэндокардиальных мышц, аорты, проксимальных канальцев и печеночных долек не выявил отклонений в 3 изученных группах. Таким образом, по данным C.V.B. Nilo [21], длительное применение эторикоксиба приводило к росту значения САД без существенных изменений морфологии органов-мишеней по сравнению с таковой в контрольной группе.
По результатам других токсикологических исследований М. Fornai и соавт. [12] применение эторикоксиба не приводило к значительному увеличению поражений слизистой желудка по сравнению с контрольными животными (F = 20,26, p>0,05).
Следующий эксперимент тех же авторов проводили на 40-недельных самцах крыс Wistar массой 500–600 г. Группа 1-я
– контрольная, получала метоцел 1%; группа 2-я – индометацин 3 мг/кг в день; группа 3-я –
индометацин 3 мг/кг в день и омепразол 0,7 мг/кг в день; группа 4-я – диклофенак 8 мг/кг в день; группа 5-я
– диклофенак 8 мг/кг в день и омепразол 0,7 мг/кг в день; группа 6-я – эторикоксиб
5 мг/кг в день; группа 7-я – целекоксиб 4 мг/кг в день.
Согласно результатам, представленным в табл. 3, смертность в группе эторикоксиба не отличалась от таковой в контрольной группе. У контрольных животных наблюдалось увеличение массы тела на 7-й и 14-й день. Введение индометацина, индометацина и омепразола, диклофенака или диклофенака и омепразола в течение 7 или 14 дней было связано со значительным снижением массы тела. У животных, получавших эторикоксиб, наблюдалось значительное снижение массы тела после 14 дней лечения, тогда как введение целекоксиба ассоциировалось с уменьшением массы тела на 7-й и 14-й день, что, однако, не достигало статистической значимости по сравнению с контролем.
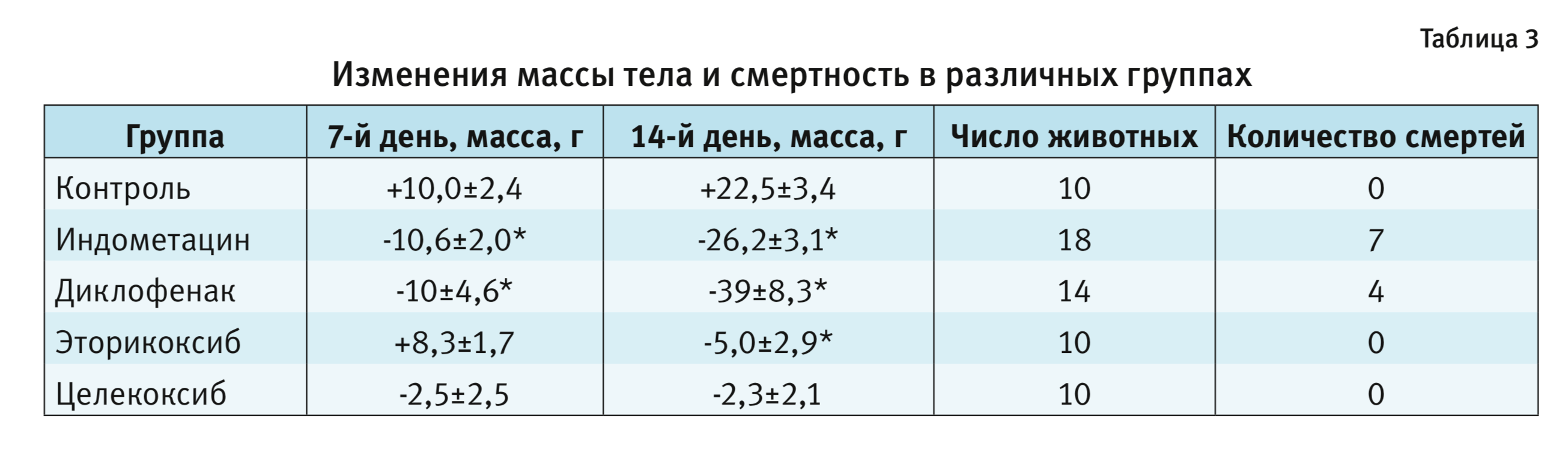
Макроскопические исследования тонкой кишки выявили диафрагмальные стриктуры и множественные язвенные повреждения у животных, получавших индометацин или диклофенак независимо от отсутствия или присутствия омепразола. Напротив, заметных макроскопических изменений в тканях кишечника у крыс, получавших эторикоксиб или целекоксиб, не обнаружено [12].
Исходя из приведенного представляют интерес данные клинических исследований эторикоксиба и корреляция их результатов с доклиническими испытаниями.
Клинические исследования эффективности и безопасности применения эторикоксиба
Высокий анальгетический потенциал эторикоксиба был подтвержден при купировании зубной боли – классической модели, используемой для оценки эффективности НПВП при ургентной патологии [16]. В рандомизированном клиническом исследовании (РКИ) G. Rasmussen и соавт. [25] изучали эффективность обезболивания у 228 больных, перенесших эндопротезирование коленного или тазобедренного сустава и получавших эторикоксиб в дозе 120 мг (1 раз в сутки), напроксен (1100 мг/сут) или плацебо. По результатам работы, число пациентов, у которых была достигнута первая «конечная» точка – полное купирование боли через 8 ч, на фоне приема эторикоксиба и напроксена было в 2 раза больше, чем среди тех, кто получал плацебо. Хороший или превосходный ответ на терапию наблюдался у 53, 60 и 26% больных, соответственно. Кроме того, в отличие от группы плацебо у пациентов, получавших эторикоксиб, отмечалось достоверное (на 35%) снижение потребности в наркотических анальгетиках.
Недавно были опубликованы результаты РКИ A. Siddiqui и соавт. [29], которые определяли анальгетический потенциал эторикоксиба 120 мг (в сравнении с плацебо) у 200 пациентов с острыми травмами, нуждающихся в операции. Использование эторикоксиба существенно снизило потребность в опиоидных анальгетиках.
Одним из наиболее ярких доказательств высокого терапевтического потенциала эторикоксиба является опыт лечения подагры этим препаратом. Так, H. Schumacher и соавт. [28] лечили 150 пациентов с этой патологией эторикоксибом в дозе 120 мг 1 раз в сутки или индометацином по 50 мг 3 раза в сутки. Снижение интенсивности боли определялось в баллах от 0 до 4 (исходно ее уровень составил в среднем 2,88 и 2,99 балла соответственно). На 3-й день терапии отмечалось выраженное улучшение), причем эффект от приема эторикоксиба и индометацина не отличался: интенсивность боли снизилась на 1,66 и 1,76 балла соответственно. К 8-му дню наблюдения у 89 и 90% пациентов имело место купирование основных клинических проявлений артрита. При этом серьезные побочные эффекты – язва желудка и кровотечение – отсутствовали у больных, принимавших эторикоксиб, но развились у 3 пациентов, получавших индометацин. Этот результат был подтвержден в ходе более позднего исследования, проведенного B. Rubin и соавт. (n=189) [27]. Число побочных эффектов на фоне приема эторикоксиба оказалось в 2 раза меньше – суммарно 16,5 и 37,2%.
Терапевтический потенциал эторикоксиба при длительной симптоматической терапии хронических ревматических заболеваний (РЗ) доказан серией хорошо организованных, масштабных и длительных РКИ, охватывающих наиболее распространенные нозологические формы – ревматоидный артрит (РА), остеоартроз (ОА), анкилозирующий спондилит (АС), синдром боли в нижней части спины (БНЧС). Эторикоксиб демонстрировал высокую эффективность, обеспечивая стойкое уменьшение боли, воспалительной активности и улучшение самочувствие больных. В целом его эффективность при данной патологии не уступает или несколько превышает лечебное действие нНПВП и других селективных НПВП (сНПВП) [4, 18].
Таким образом, с точки зрения доказательной медицины эторикоксиб эффективен в качестве анальгетика после хирургических операций и острых травм (А), не уступает нНПВП (А), его эффект превосходит «мягкие» опиоидные препараты и парацетамол (А), эффективен при остром подагрическом артрите (А), не уступает максимальной дозе индометацина (А), эффективен для длительной терапии хронической боли при ОА (А), РА (А) и АС (А); не уступает таким нНПВП, как ибупрофен, диклофенак и напроксен в максимальных дозах (А), эффективен для лечения хронической БНЧС (А), не уступает нНПВП (диклофенак).
При выборе того или иного препарата необходимо учитывать не только его эффективность, но и безопасность. Практически для всего класса НПВП характерны побочные эффекты, напрямую связанные с подавлением ЦОГ1-зависимого синтеза простагландинов: поражение слизистой практически всех отделов ЖКТ (от пищевода до кишечника), нарушение функции почек, агрегации тромбоцитов, системы кровообращения. Риск нежелательных эффектов возрастает у лиц старшей возрастной группы, у пациентов, принимающих кортикостероиды, высокие дозы НПВП [1, 2, 3].
Имеется несколько основных параметров оценки гастроинтестинальной безопасности НПВП. Важнейший из них – определение риска развития угрожающих жизни осложнений (кровотечения, перфорации, клинически выраженные язвы). Другой критерий безопасности НПВП – выявление язв желудка и/или двенадцатиперстной кишки (ДПК). Еще одним параметром оценки безопасности НПВП служит НПВП-ассоциированная диспепсия – комплекс неприятных ощущений со стороны верхних отделов ЖКТ, не связанных с повреждением слизистой оболочки. Все перечисленные параметры безопасности ЖКТ при приеме эторикоксиба были предметом тщательного изучения.
Подтверждением относительно низкого риска развития опасных гастроинтестинальных осложнений на фоне приема
эторикоксиба является метаанализ данных серии длительных рандомизированных клинических исследований (РКИ),
законченных к 2003 г. (n=5441). Согласно полученным результатам, у больных, принимавших эторикоксиб
в дозе 60–120 мг, суммарная частота кровотечений ЖКТ, перфораций и клинически выраженных язв
составила 1,24%, что было в 2 раза меньше, чем у пациентов, получавших диклофенак, напроксен или
ибупрофен – суммарно
2,48% (p<0,001) [24].
Для изучения влияния эторикоксиба на развитие эндоскопических язв были проведены 2 масштабных РКИ. В них были включены 1422 пациента с ревматоидным артритом (РА) и остеоартритом/остеоартрозом (ОА), принимавших эторикоксиб 120 мг, ибупрофен 2400 мг, напроксен 1000 мг или плацебо и прошедших эндоскопическое исследование до и после окончания 12-недельного курса терапии. Суммарная частота язв желудка и ДПК на фоне приема эторикоксиба оказалась как минимум в 2 раза меньше и составила 8,1 и 7,4% (17 и 25,3% – в контрольных группах; p<0,001). При этом на фоне приема эторикоксиба не повышалось выделение крови с калом. В то же время у пациентов, получавших ибупрофен, кровопотеря с калом увеличивалась более чем в 3 раза (3,26, p<0,001) [14].
Не вызывает сомнения и меньшая частота развития диспепсии на фоне приема эторикоксиба. Доказательством этого могут служить результаты метаанализа 9 РКИ, в которых изучались эффективность и переносимость эторикоксиба у больных с РА, ОА и болью в нижней части спины (БНЧС). При использовании этого препарата частота отмен терапии из-за развития диспепсии составила 1,5 на 100 пациенто-лет – в 2 раза меньше по сравнению с неселективными НПВП (нНПВП) (2,7 на 100 пациенто-лет; p=0,007). Потребность в гастропротективных средствах для купирования неприятных ощущений со стороны ЖКТ у больных, получавших эторикоксиб, также оказалась достоверно меньше, чем у принимавших нНПВП [31].
Эторикоксиб – наиболее селективный среди всех НПВП. Существует ли опасность развития осложнений со стороны сердечно-сосудистой системы у больных, получающих этот препарат? Этот вопрос привлекает пристальное внимание исследователей. Однако результаты серии предрегистрационных исследований (фаза IIb–III), в которых оценивались сравнительная эффективность и безопасность эторикоксиба у больных РА, ОА, АС и БНЧС, а контролем являлись плацебо и нНПВП, не показали существенного повышения риска возникновения подобных осложнений. Суммарно приблизительно у 6500 пациентов, включенных в эти исследования, было выявлено 64 эпизода инфаркта миокарда и ишемического инсульта. Достоверного отличия между эторикоксибом и плацебо в отношении риска развития этой патологии не выявлено [относительный риск (ОР) – 1,11; 0,32–3,81]. При этом применение эторикоксиба ассоциировалось с меньшей частотой возникновения кардиоваскулярных осложнений по сравнению с ибупрофеном и диклофенаком (ОР – 0,83; 0,26–2,64), хотя он несколько уступал напроксену (ОР – 1,70; 0,91–3,18) [9]. Эти данные представляются вполне убедительными. Тем не менее для получения максимально полной информации сравнительной безопасности эторикоксиба как в отношении ЖКТ, так и сердечно-сосудистой системы была выполнена исследовательская программа MEDAL (Multinational Etoricoxib and Diclofenac Arthritis Long-term). На сегодняшний день это наиболее масштабное и длительное исследование безопасности НПВП в мировой практике. Программа MEDAL включала 34 701 пациента с ОА и РА, которые в течение 1,5 года непрерывно принимали эторикоксиб в дозе 60 или 90 мг или диклофенак 150 мг/сут. При этом в ходе MEDAL предлагалось моделировать реальную клиническую практику: так, у больных с серьезными факторами риска развития НПВП-гастропатии допускалось назначение гастропротекторов (ингибиторы протонной помпы – ИПП), а при наличии кардиоваскулярных факторов риска – низких доз аспирина [5; 15].
Программа MEDAL стала дополнительным доказательством терапевтического потенциала эторикоксиба, поскольку по эффективности он не уступал диклофенаку. Так, число эпизодов прерывания терапии из-за неэффективности составило 9,0 и 9,8% соответственно. Однако наибольшую ценность представляют данные о сравнительной безопасности эторикоксиба. Суммарная частота развития осложнений со стороны ЖКТ на фоне приема этого препарата оказалась существенно меньше по сравнению с диклофенаком – соответственно 1,0 и 1,4% (р<0,001). В то же время число эпизодов кровотечений ЖКТ и перфораций оказалось очень близким – 0,3 и 0,32 на 100 пациенто-лет, что, несомненно, является следствием применения ИПП более чем у половины больных. К тому же на фоне приема эторикоксиба терапия прерывалась из-за осложнений ЖКТ значительно реже – суммарно около 8,6% случаев, в то время как в контрольной группе аналогичный показатель составил 11,2% (р<0,001) [15]. Особое внимание исследователей было уделено патологии сердечно-сосудистой системы. Необходимо отметить, что исследуемая группа включала очень большое число лиц с серьезно повышенным риском развития кардиоваскулярных осложнений. Так, около 41% пациентов каждой группы составляли лица старше 65 лет и по 38% – имели 2 и более стандартных факторов риска возникновения сердечно-сосудистых осложнений. Около 47% больных в обеих подгруппах имели диагностированную артериальную гипертензию (АГ). В ходе исследования было показано достоверное повышение риска дестабилизации АГ у пациентов, получавших эторикоксиб. Однако частота развития кардиоваскулярных осложнений на фоне приема этого препарата и диклофенака оказалась фактически одинаковой – всего 320 и 323 эпизода (1,24 и 1,3 на 100 пациенто-лет). Одинаковым было и число летальных исходов, связанных с кардиоваскулярными осложнениями, – по 43 (0,26%) [5, 8].
Таким образом, в ходе программы MEDAL еще раз была подтверждена эффективность и хорошая гастроинтестинальная переносимость эторикоксиба. Важно, что длительный прием этого препарата у больных, многие из которых имели коморбидную патологию сердечно-сосудистой системы, не привел к нарастанию частоты развития опасных кардиоваскулярных осложнений по сравнению с традиционным НПВП. Следует отметить, что по сравнению с диклофенаком частота возникновения гепатотоксических реакций при использовании эторикоксиба оказалась почти в 10 раз меньше.
Необходимо обратить внимание на низкую частоту реакций гиперчувствительности при приеме эторикоксиба. Есть данные, свидетельствующие о возможности использования этого препарата у больных, у которых ранее на фоне приема нНПВП возникали аллергические реакции. Также показана возможность безопасного применения эторикоксиба у лиц, страдающих аспирин-индуцированным респираторным заболеванием [10, 23, 30].
Эторикоксиб способен вызывать класс-специфические осложнения со стороны сердечно-сосудистой системы, в частности требуется осторожность при его назначении больным АГ. Однако существенного (выделяющего его среди других НПВП) повышения риска развития таких кардиоваскулярных катастроф, как инфаркт миокарда или ишемический инсульт, а также связанной с ними летальности, для эторикоксиба не доказано. При этом эторикоксиб безопаснее, чем традиционные НПВП, в отношении развития патологии ЖКТ, поражения печени, кожных и респираторных реакций, что определяет целесообразность его применения при наличии соответствующих факторов риска.
Таким образом, с точки зрения доказательной медицины эторикоксиб:
- достоверно реже вызывает кровотечения ЖКТ, перфорации язв и клинически выраженные язвы по сравнению с нНПВП (А);
- достоверно реже (более чем в 2 раза) по сравнению с нНПВП вызывает развитие эндоскопических язв желудка и/или ДПК (А);
- достоверно реже по сравнению с нНПВП вызывает диспепсию (А);
- не увеличивает риск развития кардиоваскулярных катастроф (инфаркт миокарда); они возникают не чаще, чем при использовании диклофенака (А);
- достоверно реже по сравнению с диклофенаком вызывает гепатотоксические осложнения (А), а по сравнению с нНПВП – развитие реакций гиперчувствительности (В).
Фармакокинетика препаратов эторикоксиба
Эторикоксиб обладает высокой биодоступностью (около 100%), обеспечивающей достижение пиковой концентрации в крови уже через 1–3 ч после перорального приема (табл. 4). Следовательно, по скорости наступления анальгетического эффекта он не уступает любым НПВП, используемым для ургентного обезболивания. Период полувыведения эторикоксиба составляет 22 ч (биотрансформация препарата происходит в печени, 70% метаболитов выделяется почками, 20% – через кишечник), и на протяжении всего этого времени сохраняется эффективное подавление активности ЦОГ2. Таким образом, в течение суток после однократного приема эторикоксиба сохраняется стабильный обезболивающий и противовоспалительный эффект [4, 17, 18, 22].
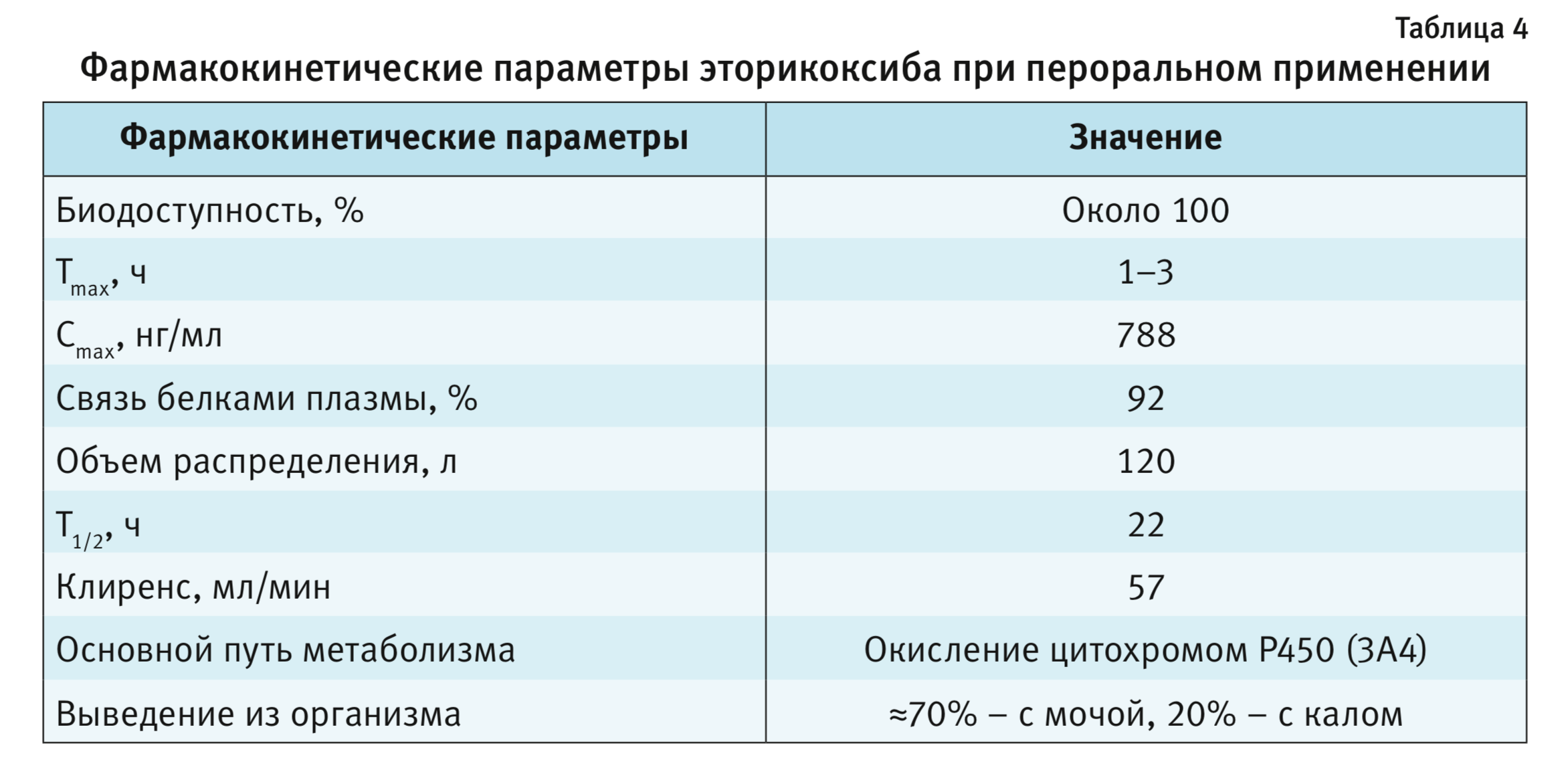
Гендерных или этнических различий в фармакокинетике эторикоксиба не выявлено [19].
Согласно результатам исследования, современный отечественный безопасный и эффективный препарат Эторикоксиб во всем иногообразии доз (60, 90 и 120 мг) будет чрезвычайно востребован на российском фармацевтическом рынке и эффективен для лечения целого ряда патологических состояний у пациентов самых разных групп.
Результаты и обсуждение
На испытанных дозах клинические симптомы отравления у животных отсутствовали. Многократное введение растворов исследуемого препарата все животные перенесли хорошо: процедура введения не сопровождалась какими-либо признаками недовольства, болезненности. В период наблюдения гибели животных не было, общее состояние животных опытных и контрольных групп не различалось.
Визуально отличий в величинах показателей потребления корма и воды между группами подопытных животных установлено не было.
Оценка динамики массы тела крыс самцов и самок показала, что многократное введение в течение 14 дней (1 раз в день) животным исследуемого препарата в дозах 10,1 и 101,0 мг/кг внутрижелудочно не оказывает влияния на данный показатель.
Изменений, свидетельствующих о гематотоксическом действии исследуемого препарата, выявлено не было; значения всех тестируемых показателей находились в пределах физиологической нормы для используемого вида животных.
Значимых межгрупповых отличий, свидетельствующих о негативном влиянии исследуемого препарата на показатели биохимии сыворотки крови и гемостаз подопытных животных, выявлено не было.
По данным вскрытия и макроскопического исследования изучаемых органов различий между опытными группами, получавшими исследуемый препарат, и контрольными группами животных не установлено.
При анализе гистологических препаратов серьезных патологических изменений в строении внутренних органов у животных из исследуемых групп не выявлено. Наблюдалась воспалительная реакция в двенадцатиперстной кишке у животных, получавших препарат Аркоксиа® в высокой дозе. У животных, получавших Аркоксиа®, после периода восстановления (14 дней) показатели гистологического анализа максимально приблизились к таковым у животных, получавших контрольное вещество (вода очищенная).
Половых различий в течение наблюдения в опытных и контрольных группах не отмечалось. Статистически значимых различий исследуемых показателей не выявлено (критерий Стьюдента, р < 0,05).
Результаты исследования свидетельствуют о том, что препарат Аркоксиа® малотоксичен и безопасен при 14-кратном внутрижелудочном введении экспериментальным животным в дозах 10,1 и 101,0 мг/кг, и его токсикологический профиль сравним с профилем, описанным в литературе.
Заключение
В ходе данного исследования показана сопоставимость результатов, полученных отечественными и зарубежными исследователями при оценке токсикологических показателей эторикоксиба, с токсикологическим профилем препарата, оцененным авторами статьи в ходе оценки субхронической токсичности на белых беспородных крысах обоего пола.
Сопоставимость показателей получена благодаря тому, что авторы в качестве испытуемого объекта исследования анализировали достоинства и недостатки оригинального препарата. В случае воспроизведенных препаратов, написание обзоров по доклиническим и клиническим исследованиям референтного ЛС явно недостаточно, так как существуют объективно высокие риски выведения на фармацевтический рынок препарата с неэквивалентной оригинатору безопасностью (например, за счет иного качества фармацевтической субстанции или иного качества и/или состава вспомогательных веществ). Так, одним из исследуемых авторами препаратов, являлся генерик антиагреганта клопидогрела, оригинальный препарат которого представляет собой S-изомер рацемического вещества PCR 4099. Однако поставщик активной фармацевтической субстанции поставил R-форму энантиомера, что вызвало массовую гибель животных в эксперименте, тогда как крысы, получавшие референсный препарат, хорошо переносили его введение. В то же время несложно представить ситуацию, когда данный генерик появляется на фармацевтическом рынке лишь на основании написанных обзоров. Последствия подобного вывода препарата на рынок могут оказаться весьма плачевными, как для пациентов, так и для фирмы-изготовителя.
Список источников
- Каратеев А.Е., Яхно Н.Н., Лазебник Л.Б. и др. Применение нестероидных противовоспалительных препаратов. М.: ИМА-ПРЕСС, 2009.
- Насонов Е.Л. Нестероидные противовоспалительные препараты (Перспективы применения в медицине). М.: Анко, 2000.
- Шварц Г.Я. Современные нестероидные противовоспалительные препараты. М., Реафарм, 2004.
- Brooks P., Kubler P. Etoricoxib for arthritis and pain management. Ther Clin Risk Manag 2006; 2 (1): 45–57.
- Cannon C., Curtis S., FitzGerald G. et al. Cardiovascular outcomes with etoricoxib and diclofenac in patients with osteoarthritis and rheumatoid arthritis in the Multinational Etoricoxib and Diclofenac Arthritis Longterm (MEDAL) programme: a randomised comparison. Lancet 2006; 18: 368 (9549): 1771–81.
- Chan C.C., Boyce S., Brideau C., Charleson S., Cromlish W., Ethier D., Evans J., Ford-Hutchinson A.W., Forrest M.J., Gauthier J.Y., et al. Rofecoxib (Vioxx, MK-0966; 4-(49-methylsulfonylphenyl)-3-phenyl-2-(5H)-furanone): A potent and orally active cyclooxygenase-2inhibitor. Pharmacological and biochemical profiles. .J Pharmacol. Exp. Ther. 1995. 290:551–60.
- Chan C.C, Boyce S., Brideau C., Ford-Hutchinson A.W, Gordon R., Guay D., Hill R.G., Li C.S., Mancini J., Penneton M., et al. Pharmacology of a selective cyclooxygenase-2 inhibitor, L-745,337: A novel nonsteroidal anti-inflammatory agent with an ulcerogenic sparing effect in rat and nonhuman primate stomach. J. Pharmacol. Exp. Ther. 1995. 274:1531–1537.
- Coxib and traditional NSAID Trialists’ (CNT) Collaboration. Vascular and upper gastrointestinal effects of non-steroidal anti-inflammatory drugs: meta-analyses of individual participant data from randomised trials. Lancet. 2013. Vol. 382: 769–79.
- Curtis S., Ko A., Bolognese J. et al. Pooled analysis of thrombotic cardiovascular events in clinical trials of the COX-2 selective Inhibitor etoricoxib. Сurr. Med. Res. Opin. 2006; 22 (12): 2365–74.
- El Miedany Y., Youssef S., Ahmed I., El Gaafary M. Safety of etoricoxib, a specific cyclooxygenase-2 inhibitor, in asthmatic patients with aspirin-exacerbated respiratory disease. Ann Allergy Asthma Immunol. 2006.– Vol. 97 (1): 105–9.
- Fletcher D.S., Widmer W.R., Luell S. et al. Therapeutic administration of a selective inhibitor of nitric oxide synthase does not ameliorate the chronic inflammation and tissue damage associated with adjuvant-induced arthritis in rats. J. Pharmacol. Exp. Ther. 1998. 284: 714–21.
- Fornai M., Antonioli L., Colucci R. et al. NSAID-Induced Enteropathy: Are the Currently Available Selective COX-2 Inhibitors All the Same? / J. Pharmacol. Exp. Ther. 2014. Vol. 348: 86–95.
- Friesen R.W., Brideau C., Chan C.C. et al. 2-Pyridinyl-3-(4-methylsulfonyl)phenylpyridines: selective and orally active cyclooxygenase-2 inhibitors. Bioorg. Med. Chem. Lett. 1998. Oct. 6; 8 (19): 2777–82.
- Hunt R., Harper S., Callegari P. et al. Complementary studies of the gastrointestinal safety of the cyclo-oxygenase-2-selective inhibitor etoricoxib. Aliment Pharmacol. Ther. 2003;.17:.201–10.
- Laine L., Curtis S.P., Cryer B. et al. Assessment of upper gastrointestinal safety of etoricoxib and diclofenac in patients with osteoarthritis and rheumatoid arthritis in the Multinational Etoricoxib and Diclofenac Arthritis Long-term (MEDAL) programme: a randomised comparison. Lancet. 2007; 369: 465–73.
- Malmstrom K., Sapre A., Couglin H. et al. Etoricoxib in acute pain associated withdental surgery: a randomized, double-blind, placebo- and active comparator-controlled dose-ranging study. Clin.Ther. 2004; 26 (5): 667–79.
- Martina S., Vesta K., Ripley T. Etoricoxib: a highly selective COX-2 inhibitor. Ann Pharmacother. 2005; 39 (5): 854–62.
- Matsumoto A., Cavanaugh P. Etoricoxib. Drugs Today 2004; 40 (5): 395–414., Brooks P., Kubler P. Etoricoxib for arthritis and pain management. Ther. Clin. Risk. Manag. 2006; 2 (1): 45–57.
- Merck & Co, Inc. Arcoxia (etoricoxib) [prescribing information; online]. Available from URL: http://www.arcoxia.ae/secure/resources/pi/pi.html;
- Moore R., Derry S., McQuay H. Discontinuation rates in clinical trials in musculoskeletal pain: meta-analysis from etoricoxib clinical trial reports. Arthrit. Res. Ther. 2008; 10 (3): 53.
- Nilo Cеsar do Vale Baracho, Guilherme Pedrosa Guizelli, Beatriz Leone Carmello et al. Cardiovascular and hematologic effects produced by chronic treatment with etoricoxib in normotensive rats. Acta Cirúrgica Brasileira. 2009. Vol. 24 (3): 206–10.
- Patrignani P., Capone M.L., Tacconelli S. Clinical pharmacology of etoricoxib: a novel selective COX2 inhibitor. Expert Opin Pharmacother. 2003. Feb; 4 (2): 265–84.
- Quercia O., Emiliani F., Foschi F., Stefanini G. Safety of etoricoxib in patients with reactions to NSAIDs. J. Investig. Allergol. Clin. Immunol. 2008; 18 (3): 163–67.
- Ramey D., Watson D., Yu C. et al. The incidence of upper gastrointestinal adverse events in clinical trials of etoricoxib vs. nonselective NSAIDs: an updated combined analysis. Curr. Med. Res. Opin. 2005;.21.(5):.715–22.
- Rasmussen G., Malmstrom K., Bourne M. et al. Etoricoxib provides analgesic efficacy to patients after knee or hip replacement surgery: a randomized, double-blind, placebo-controlled study. Anesth. Analg. 2005. Vol. 101 (4): 1104–11.
- Riendeau D., Percival M.D., Brideau C. Et al. Etoricoxib (MK-0663): preclinical profile and comparison with other agents that selectively inhibit cyclooxygenase-2. J. Pharmacol. Exp. Ther. 2001. Feb; 296 (2): 558–566.
- Rubin B., Burton R., Navarra S. et al. Efficacy and safety profile of treatment with etoricoxib 120 mg once daily compared with indomethacin 50 mg three times daily in acute gout: a randomized controlled trial. Arthrit Rheum 2004; 50 (2): 598–606.
- Schumacher H., Boice J., Dahikh D. et al. Randomised double blind trial of etoricoxib and indomethacin in treatment of acute gouty arthritis. BMJ. 2002; 324: 1488–92.
- Siddiqui A., Sadat-Ali M., Al-Ghamdi A. et al. The effect of etoricoxib premedication on postoperative analgesia requirement in orthopedic and trauma patients. Saudi Med. J. 2008; 29 (7): 966–70.
- Viola M., Quaratino D., Gaeta F. et al. Etoricoxib tolerability in patients with hypersensitivity to nonsteroidal anti-inflammatory drugs. Int Arch Allergy Immunol. 2007;.143.(2):.103–8.
- Watson D., Bolognese J., Yu C. et al. Use of gastroprotective agents and discontinuations due to dyspepsia with the selective cyclooxygenase-2 inhibitor etoricoxib compared with non-selective NSAIDs. Curr. Med. Res. Opin. 2004; 20 (12): 1899–908.
- Freireich E.J., Gehan E.A., Rail D.P. et al // Cancer Chemother. Rep. 1966. Vol. 50 (4): 219–44.




