Селектированные линии крыс с высоким и низким порогом возбудимости: модель для изучения дезадаптивных состояний, зависимых от уровня возбудимости нервной системы
Вайдо А.И., Ширяева Н.В., Павлова М.Б., Левина А.С., Хлебаева Д.А.-А., Любашина О.А., Дюжикова Н.А. Селектированные линии крыс с высоким и низким порогом возбудимости: модель для изучения дезадаптивных состояний, зависимых от уровня возбудимости нервной системы. Лабораторные животные для научных исследований. 2018; 3. https://doi.org/10.29296/2618723X-2018-03-02
Резюме
Обобщены сведения об основных характеристиках, связанных с генетически-детерминированным уровнем возбудимости нервной системы, а также вызванные длительным эмоционально-болевым стрессорным воздействием, долгосрочные устойчивые изменения в поведении, морфологические, генетические и эпигенетические модификации в клетках различных структур головного мозга крыс линий, селектированных по порогу возбудимости нервной системы к электрическому току: линия с высоким порогом (ВП) возбудимости (низковозбудимая), линия с низким порогом (НП) возбудимости (высоковозбудимая). В ходе многолетних исследований у крыс этих линий выявлены различия как по возбудимости большеберцового нерва, так и по порогам возбудимости других отделов нервной системы, как периферических, так и центральных. Обнаружена зависимость между возбудимостью нервной системы и проявлением безусловно- и условно-рефлекторных характеристик поведения, выявлены различия в стратегии поведения, изменения разных звеньев систем гормональной регуляции, метаболизма медиаторов, структурно-функциональных особенностей мембран нервных клеток. Линии имеют различную чувствительность к нейротоксикантам и мутагенам, а также стресс-реактивность в тестах лишения парадоксальной фазы сна, действии короткого и длительного эмоционально-болевого стресса (по схеме К. Гехта). После длительного эмоционально-болевого стрессорного воздействия на крысах ВП и НП продемонстрированы долгосрочные патологические изменения поведения, сохраняющиеся на протяжении 6 мес. Нарушения высшей нервной деятельности имеют специфические особенности у каждой из линий, что позволило использовать эти линии в качестве модельных вариантов для исследования постстрессорных патологических состояний тревожного спектра (посттравматического стрессового и компульсивного расстройств человека). В основе долгосрочных эффектов стресса лежат морфологические изменения нейронов в разных структурах мозга, дифференциальные постстрессорные модификации хроматина в нейронах и клетках периферических органов, связанные с определенными эпигенетическими изменениями ДНК и гистоновых белков. Обсуждается возможность использования этих линий в качестве оригинальной модели для изучения механизмов, вызванных экстремальными воздействиями (включая стрессорные) дезадаптивных состояний, зависимых от уровня возбудимости нервной системы.
Введение
Важная роль в процессах нейропластичности и формировании нейропатологии принадлежит функциональному состоянию нервной системы. И.П. Павлов первым обратил внимание на важность индивидуальных, генотип-зависимых признаков, а именно – возбудимости в реализации различных типов высшей нервной деятельности. Развитие этих представлений привело к созданию генетических моделей с четкими различиями по особенностям функционирования нервной системы, в том числе и с применением селекционного метода. При этом отбор по переменным с ясной физиологической основой более предпочтителен по сравнению с прямым отбором по поведенческим признакам, поскольку позволяет изучать механизмы наследственной изменчивости адаптивных и патологических процессов на основе целенаправленной стратегии.
Для исследования генетически детерминированных связей между функциональным состоянием нервной системы (возбудимостью), функционированием мозга и широким спектром поведенческих признаков в 70-е годы прошлого века в лаборатории генетики высшей нервной деятельности Института физиологии им. И.П. Павлова была начата селекционная программа, направленная на создание линий крыс с различиями в уровне возбудимости нервной системы. Исходным материалом служили крысы популяции Вистар (Столбовая, Московская область). Отбор вели по величине порога нервно-мышечной возбудимости при раздражении электрическим током большеберцового нерва – n. tibialis (прямоугольные электрические импульсы длительностью 2 мс). В первых 2 поколениях скрещивались полные сибсы. Начиная с 3-го поколения, внутрилинейные скрещивания осуществлялись в случайном порядке. С 10-го поколения селекция вышла на плато. При этом 4-кратные различия между линиями значительно превосходили внутрилинейную изменчивость. Первые результаты были опубликованы в журнале «Генетика» в 1979 г. [1].
Характеристики линий крыс с высоким и низким порогом возбудимости, связанные с наследственно-обусловленной возбудимостью нервной системы
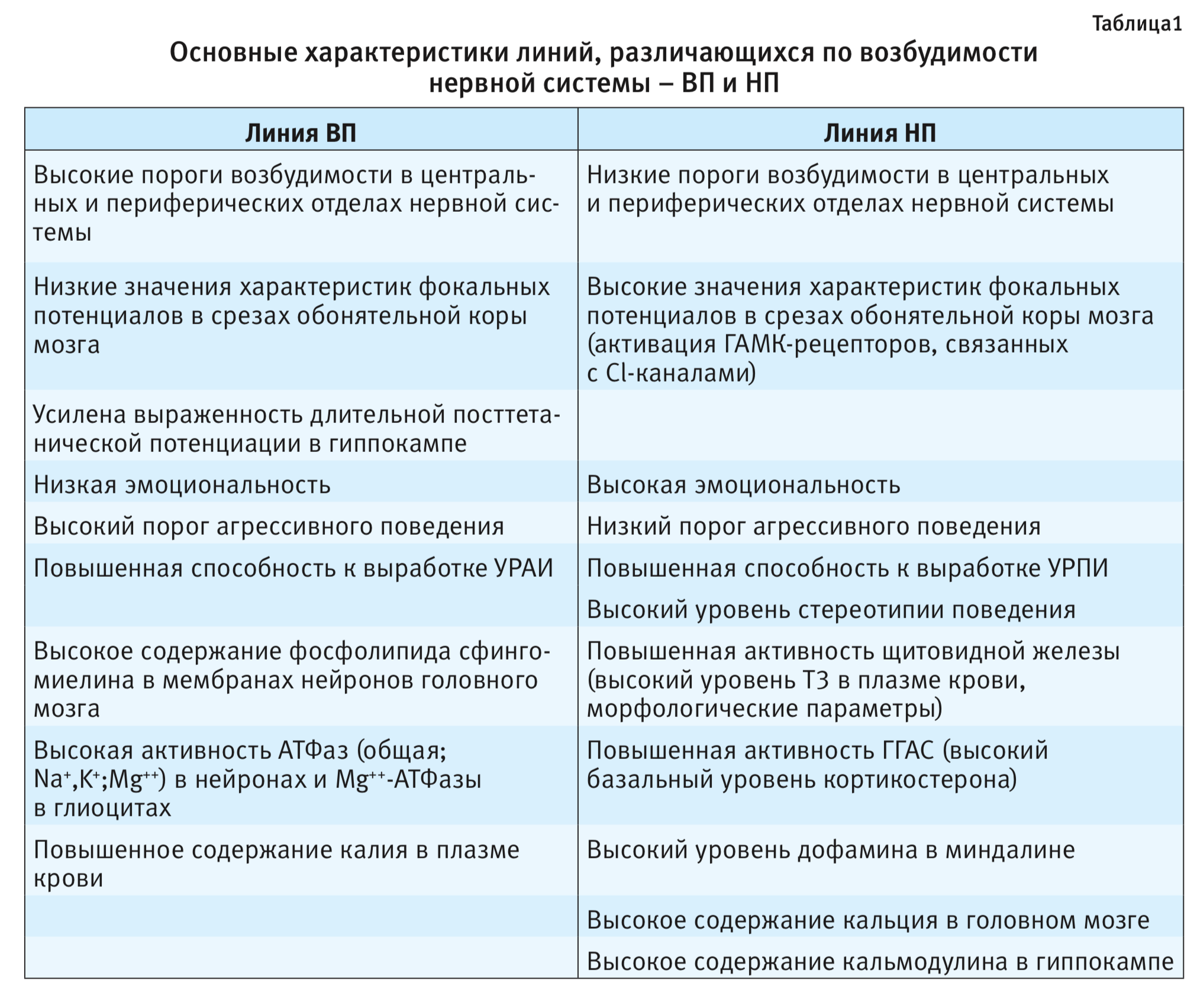
Были выведены 4 линии крыс с разной градацией порогов возбудимости – линия с высоким порогом (ВП) возбудимости (низковозбудимая), линия с низким порогом (НП) возбудимости (высоковозбудимая): ВП1, НП1, ВП2, НП2 (высокий и низкий пороги, соответственно 1, 2 – номера селекционных программ) [1]. В настоящее время поддерживаются 2 линии – ВП1(ВП) и НП2(НП), с наиболее контрастными величинами порогов возбудимости, прошедшие более 70 поколений селекции. ВП – низковозбудимая линия крыс с высоким порогом нервной возбудимости, НП – высоковозбудимая линия с низким порогом нервной возбудимости.
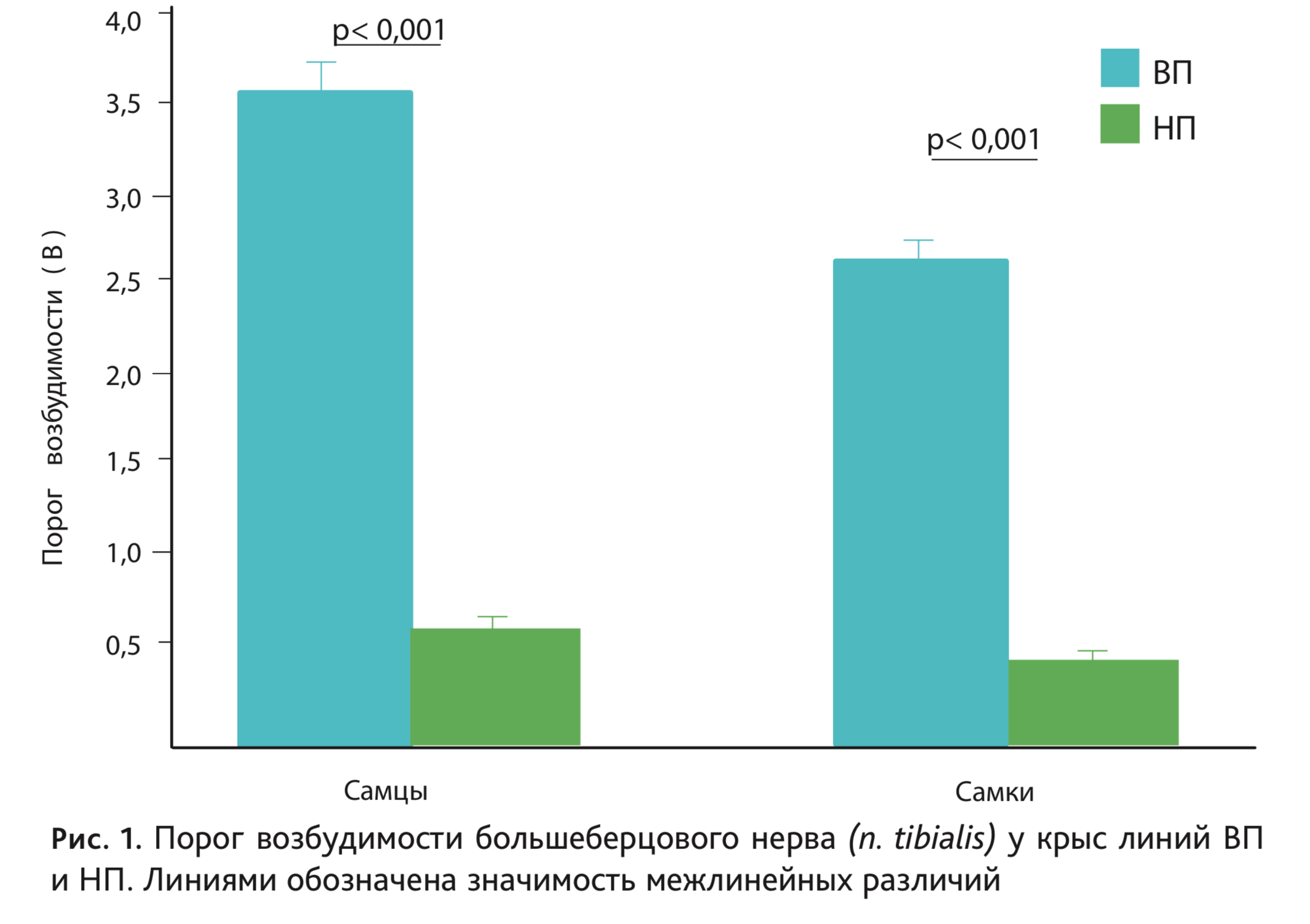
На рис. 1 представлены средние значения порогов возбудимости большеберцового нерва (n. tibialis) у самцов и самок крыс линий ВП и НП последних поколений, демонстрирующие 4-х кратные различия между линиями. Аналогичным образом линии различались по порогу возбудимости других отделов нервной системы, как периферических (n. caudalis) [2], так и центральных, в частности по порогу реакции активации электроэнцефалограммы (ЭЭГ) в ретикулярной формации среднего мозга (отведение от сенсомоторной зоны коры) [3]. Следует отметить, что ретикулярная формация среднего мозга оказывает активирующее влияние на другие отделы центральной нервной системы, и от уровня ее функциональной активности во многом зависит тонус головного мозга в целом. Выявлены также межлинейные различия по длительной потенциации гиппокампа [4].
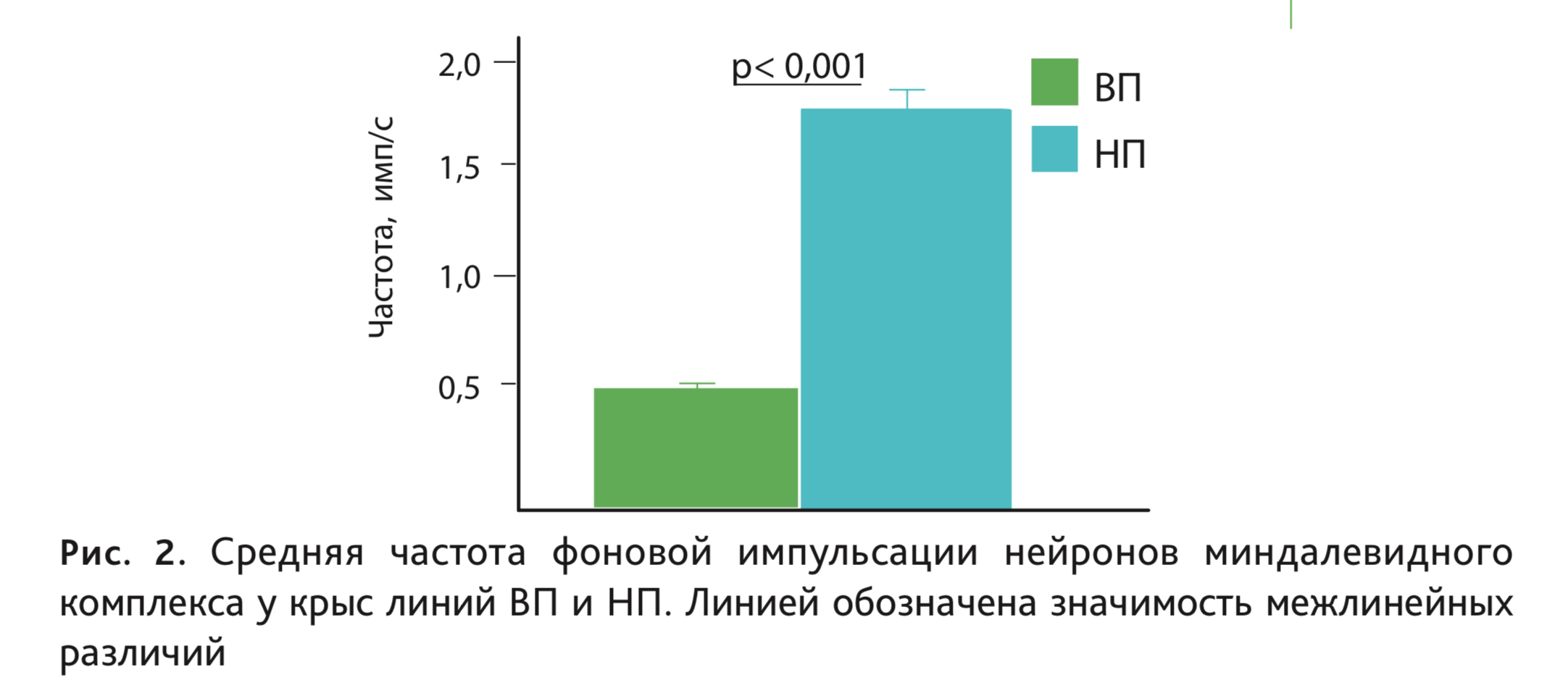
Согласно данным последних экспериментов, частота фоновой импульсной активности нейронов базолатеральной амигдалы также существенно различается у исследуемых линий, более высокие значения у высоковозбудимых крыс линии НП по сравнению с низковозбудимыми крысами линии ВП (рис. 2).
Селекционный процесс привел к накоплению у высоковозбудимой и низковозбудимой линий изменений в системах гормональной регуляции [5], метаболизма нейромедиаторов [6], структурно-функциональных особенностей мембран нервных клеток [7], нейроанатомических признаков [8].
Молекулярно-генетические исследования показали существенное снижение копийности гена rpl13α у низковозбудимых крыс ВП [9]. Продукт гена 60S рибосомального белка 13α выполняет, помимо канонической рибосомальной функции, роль в ингибировании провоспалительных генов и связан с липидным обменом.
Обнаружена связь между генетически детерминированной возбудимостью нервной системы и комплексом безусловно- и условно-рефлекторных характеристик поведения. Более высокая двигательная активность и агрессивность, вызванная раздражительностью, характерна для высоковозбудимых крыс линии НП по сравнению с ВП [10, 11]. Для линии НП характерна стереотипность поведения при регистрации активности моторных подсистем и демонстрация выраженной реакции страха при действии экстремальных раздражителей [11].
Способность к обучению у крыс линий ВП и НП отличается в различных тестах. Так, формирование
условного рефлекса активного избегания (УРАИ) более эффективно у крыс линии ВП [12, 13], тогда как крысы линия
НП демонстрируют лучшие результаты при выработке условного рефлекса пассивного избегания (УРПИ) и большую
длительность сохранения памятного следа [13, 14]. Показатели, характеризующие пространственное обучение
в водном лабиринте Морриса, не различаются у крыс обеих линий [15]. Однако в этом тесте были выявлены
особенности латерального моторного предпочтения и ярко выраженное проявление спонтанного поведения ныряния
у высоковозбудимых крыс линии НП [15]. В целом связь возбудимости с обучением при разном подкреплении
и в разных методических условиях неодинакова, что связано, по-видимому, с различиями
в оптимальном уровне функциональ-
ного состояния нервной системы, необходимом для каждого вида
обучения.
На основании данных испытания животных в тестах «открытое поле» и «водный лабиринт Морриса» можно сделать заключение о различной стратегии поведения высоковозбудимых и низковозбудимых крыс [15, 16]. Крысы линии НП строят свое поведение высоковероятностными стереотипами, тогда как линии ВП – более пластично и разнообразно.
Обобщенные, связанные с наследственно обусловленной возбудимостью нервной системы, характеристики линий ВП и НП приведены в табл. 1.
Чувствительность линий крыс ВП и НП к нейротоксикантам и мутагенам
Обнаружена дифференциальная чувствительность к каинату у крыс линий ВП и НП по нейродегенеративным
изменениям в гиппокампе, выявляемым с помощью окрашивания срезов мозга FluoroJadeB [17]. У крыс линии
ВП нейродегенеративным изменениям подвержено поле СА3 гиппокампа, тогда как у линии
НП–СА1, что
может быть связано с различиями в количестве и свойствах каинатных рецепторов [17].
Более высокая чувствительность к действию тиопентала натрия проявляется у высоковозбудимых крыс линии НП по сравнению с низковозбудимыми крысами линии ВП [14].
Чувствительность клеток костного мозга к мутагену циклофосфамиду (мутаген непрямого действия, требующий трансформации микросомальными оксигеназами печени), определяемая по уровню хромосомных аберраций, значительно выше также у высоковозбудимых крыс линии НП по сравнению с ВП [18].
Таким образом, использование экспериментальных животных с различным генетически-детерминированным функциональным состоянием нервной системы при исследовании механизмов действия нейротоксикантов и мутагенов может помочь в понимании причин индивидуальной изменчивости проявления патогенетических процессов как в центральной нервной системе (ЦНС), так и в периферийных органах при интоксикации и определении путей их коррекции, что является необходимым звеном доказательной медицины.
Постстрессорные морфологические, генетические и эпигенетические изменения у линий крыс ВП и НП
Линии ВП и НП имеют различную стресс-реактивность в тестах лишения парадоксальной фазы сна, иммобилизации, короткого эмоционально-болевого стресса [13]. Однако, остановимся более подробно на последствиях длительного эмоционально-болевого стрессорного воздействия (ДЭБС), осуществляемого по стохастической схеме К. Гехта [19].
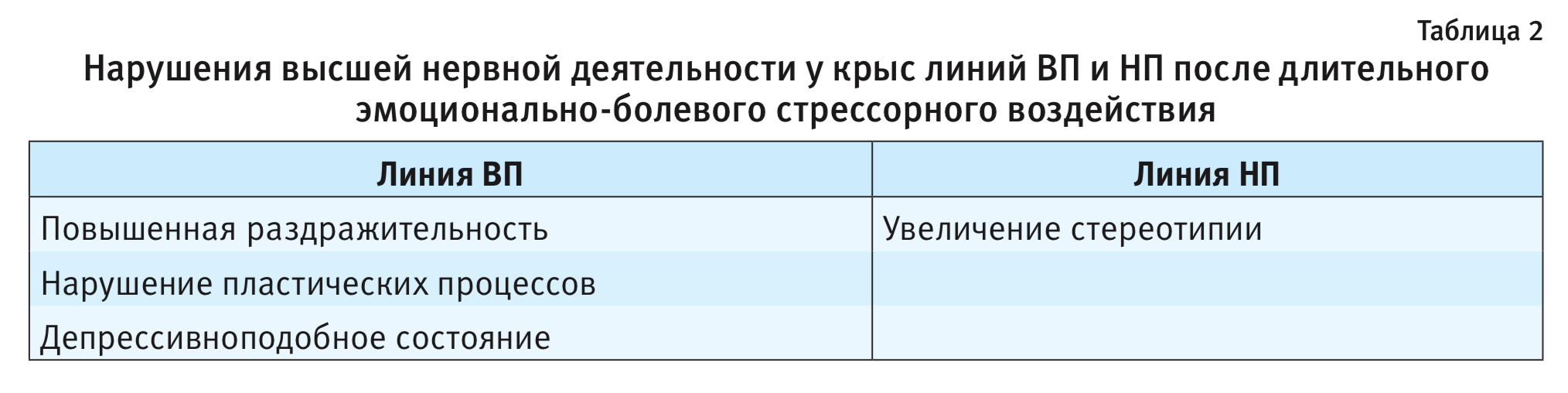
При действии ДЭБС на крысах ВП и НП продемонстрированы долгосрочные постстрессорные изменения поведения, сохраняющиеся на протяжении 6 мес [19]. Нарушения высшей нервной деятельности имеют специфические особенности у каждой из линий: у низковозбудимой линии ВП – формирование депрессивно-подобного состояния, рост возбудимости, агрессивности, нарушение пластических процессов [13], у высоковозбудимой НП – появление и сохранение компульсивных движений [13]. Это позволило использовать эти линии в качестве модельных вариантов для исследования постстрессорных патологических состояний тревожного спектра, в частности посттравматического стрессового расстройства (ПТСР) и компульсивного расстройства (КР) человека [20] (табл. 2).
Механизмы, лежащие в основе длительных постстрессорных патологических состояний, связанных с возбудимостью нервной системы:
- изменения морфологических характеристик мозга;
- устойчивые генетические и эпигенетические модификации нейронов разных районов мозга [13, 20, 21].
После действия ДЭБС (через 24 ч) было выявлено снижение численной плотности нейронов СА3 поля гиппокампа, сохраняющееся до 2 мес после воздействия у низковозбудимых крыс линии ВП, тогда как у крыс линии НП изменения происходили с латентным периодом 2 мес [20]. Как показали дальнейшие исследования, это не было напрямую связано ни с клеточной гибелью, ни со специфическими изменениями в морфологии клеток гиппокампа.
В основе долгосрочных эффектов ДЭБС лежат также дифференциальные постстрессорные модификации хроматина в нейронах разных структур мозга, связанные с определенными эпигенетическими изменениями ДНК и гистоновых белков [21].
Только у низковозбудимых крыс линии ВП после ДЭБС происходило устойчивое, сохраняющееся до 2 мес после воздействия, снижение площади районов сверхконденсированного хроматина (гетерохроматина) в ядрах нейронов поля СА3 гиппокампа, что сопровождалось увеличением уровня общей РНК [20].
Как известно, маркером активной транскрипции является ацетилирование гистонов, в частности ацетилирование Н3 гистона по лизинам в положении 9 и 14 (ацН3К9/14). Деацетилирование, напротив, ведет к репрессии транскрипции.
У крыс ВП и НП исследовали влияние ДЭБС на степень ацН3К9/14 иммуногистохимическим методом на срезах мозга в сенсомоторной зоне коры, ретикулярной формации среднего мозга, районах мозга, непосредственно связанных с детерминацией уровня наследственно обусловленной возбудимости нервной системы, а также в медиальной префронтальной коре, гиппокампе и базолатеральной области амигдалы, входящих в патологический нервный контур посттравматического стрессового расстройства. Значительную активацию ацН3К9/14 во всех исследуемых районах мозга относительно контроля наблюдали у крыс линии ВП (рис. 3), наибольшее усиление в ретикулярной формации среднего мозга и СА3 поле гиппокампа, именно тех районах, где ранее были выявлены электрофизиологические и нейроанатомические особенности, связанные с низким уровнем возбудимости нервной системы. У высоковозбудимых крыс НП – менее выраженные разнонаправленные изменения.
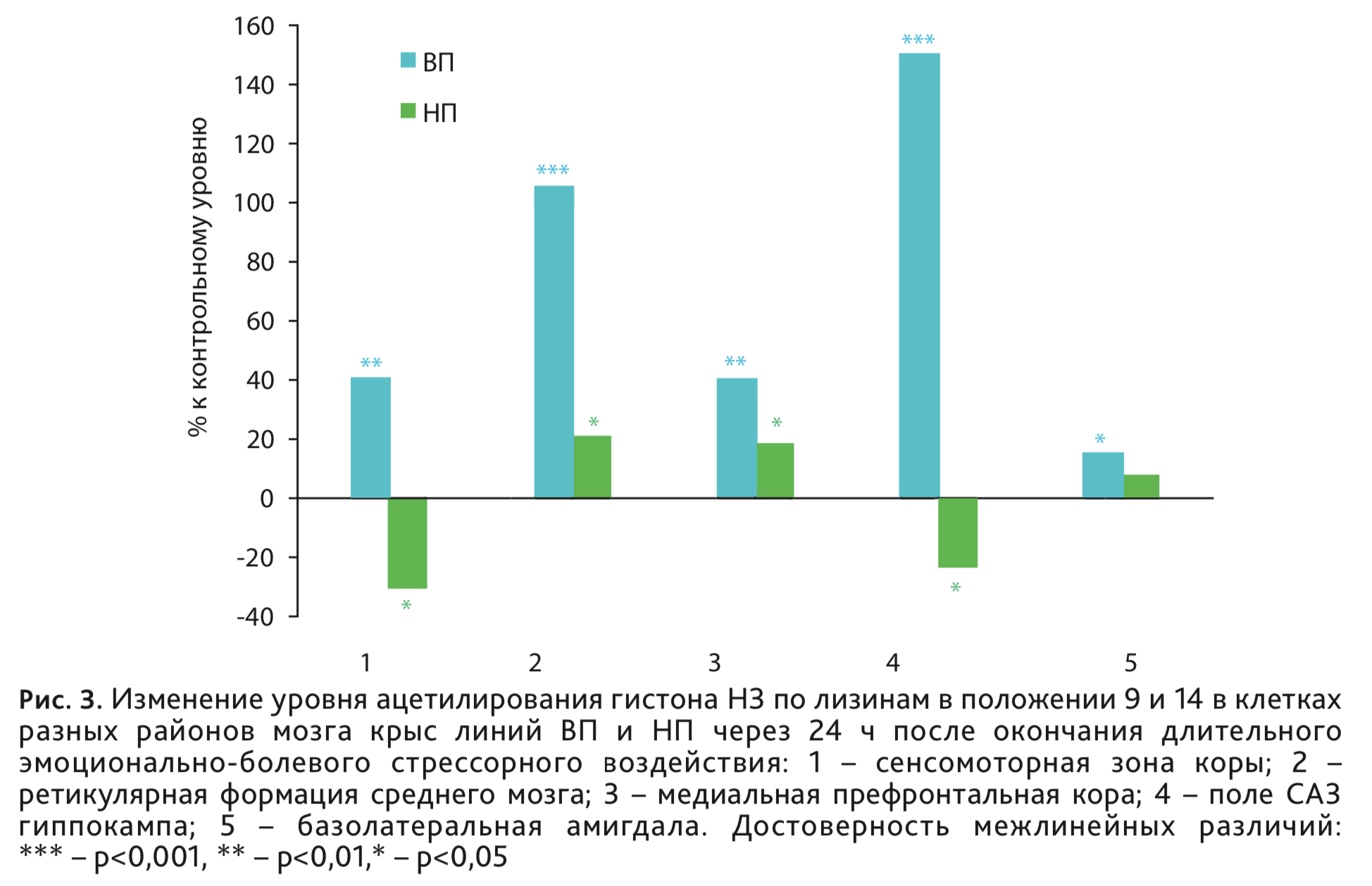
Таким образом, характер изменения транскрипционной активности в разных структурах мозга в ответ на ДЭБС зависит от базового, наследственно-обусловленного уровня возбудимости нервной системы. Обнаруженные изменения могут отражать известную адаптивную роль процесса усиления ацетилирования гистонов в механизмах развития депрессии и стрессорной реакции, как механизма противодействующего развитию депрессии [21]. В то же время устойчивое усиление ацетилирования гистона Н3, сохраняющееся до 2 мес после ДЭБС в клетках сенсомоторной и медиальной префронтальной коры у крыс линии ВП может быть связано и с долговременными постстрессорными нарушениями высшей нервной деятельности, которые зависят от низкого уровня возбудимости нервной системы.
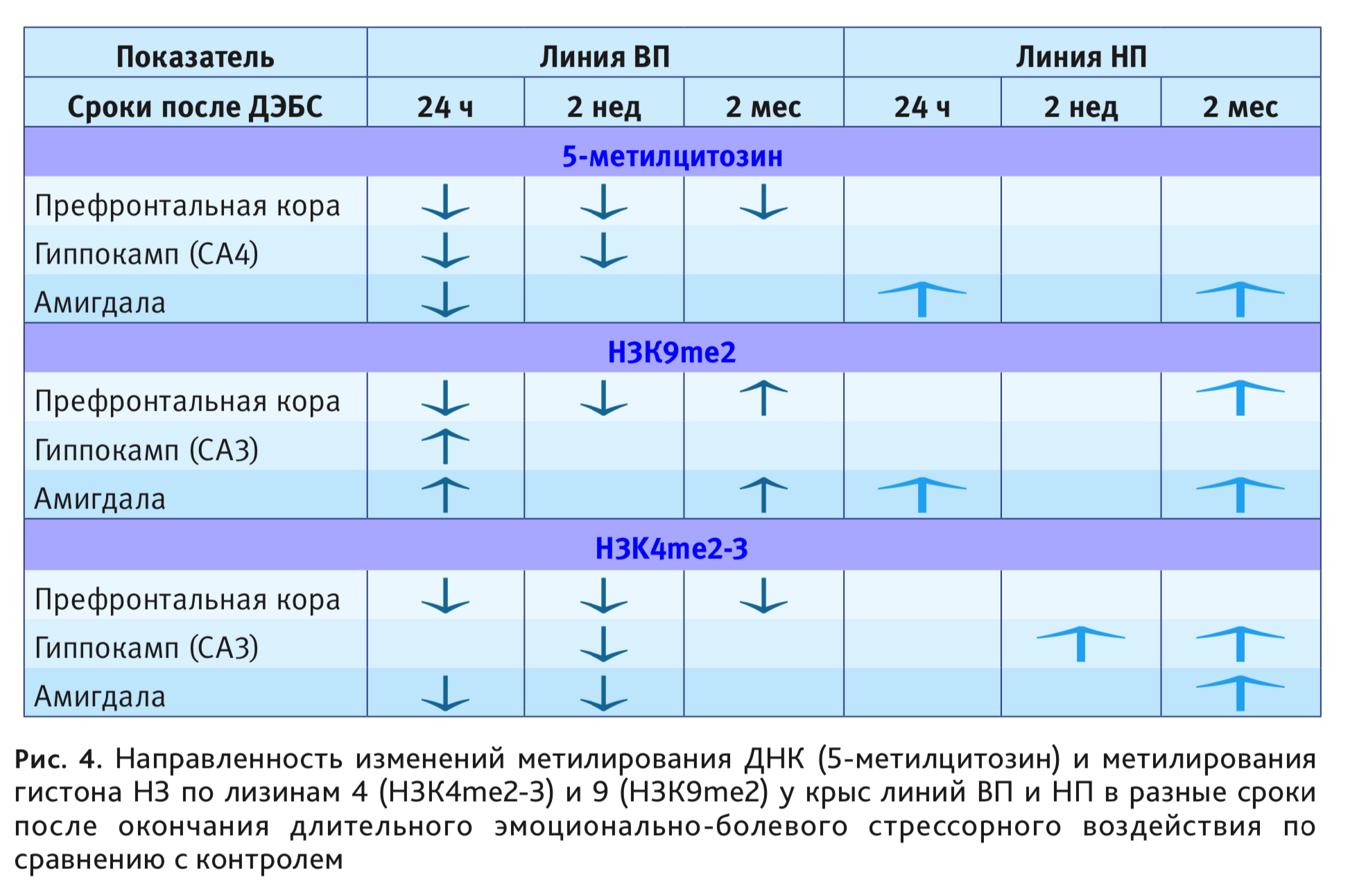
Исследование, наряду с ацетилированием, метилированием ДНК и гистона Н3 по лизинам 4 и 9 с противоположным характером влияния на транскрипционные процессы, в динамике изменений до 2 мес после ДЭБС, в медиальной префронтальной коре, гиппокампе и базолатеральной амигдале, позволило построить матрицу долговременных эпигенетических изменений в этих структурах мозга, связанных с уровнем возбудимости нервной системы (рис. 4). У животных низковозбудимой линии ВП большинство изменений возникают через 1 сут после воздействия и длительно сохраняеюся, у линии НП наблюдаются отсроченные изменения, иного спектра и направленности.
ДЭБС приводило также к дестабилизации генома в клетках костного мозга у крыс обеих исследуемых линий, более выраженное возрастание уровня хромосомных аберраций происходило у низковозбудимых животных линии ВП [22].
ПЦР-скрининг для идентификации инсерций ретротранспозона LINE1 в ген grin1 ключевой NR1 субъединицы NMDA рецептора после эмоционально-болевого стрессорного воздействия позволил выявить множественные внедрения в клетках зубчатой извилины гиппокампа. Паттерн этих изменений различен у крыс ВП и НП [23].
Также необходимо оценить влияние ДЭБС на степень генетических изменений непосредственно в нейронах различных структур мозга и длительность их сохранения с помощью современных генетических технологий.
В целом, основываясь на обобщенных в обзоре базовых характеристиках линий ВП и НП и анализе изменений, вызванных стрессом, целесообразно их использовать в качестве модельных объектов для исследования механизмов стресс-индуцированных дезадаптивных состояний на основе персонифицированного подхода с учетом характеристик возбудимости нервной системы, что важно как для выявления генетически-детерминированных факторов риска, связанных с различиями в функциональном состоянии нервной системы, так и для изучения особенностей проявления и длительного течения стресс-зависимой патологии.
***
Работа поддержана программами фундаментальных научных исследований государственных академий на 2013–2020 гг. (ГП-14, раздел 65) и Президиума РАН (0134-2017-0001).
Список источников
- Вайдо А.И., Ситдиков М.Х. Селекция линий крыс по долгосрочному порогу возбудимости нервно-мышечного аппарата. Генетика. 1979; ХV(1): 144–8.
- Вайдо А.И., Енин Л.Д., Ширяева Н.В. Скорость проведения потенциалов действия по хвостовому и большеберцовому нервам у линий крыс, селектированных по возбудимости нервно-мышечного аппарата. Генетика. 1985; 21(2): 262–4.
- Александрова Н.П., Ширяева Н.В., Кратин Ю.Г., Лопатина Н.Г. Порог активации мозга у крыс, селектированных по возбудимости нервно-мышечного аппарата. ДАН СССР. 1981; 259: 1233–5.
- Вайдо А.И., Ширяева Н.В., Хиченко В.И., Любославская П.Н., Старостина М.В. Развитие длительной посттетанической потенциации и изменение содержания белка S-100 в срезах гиппокампа крыс с различным функциональным состоянием нервной системы. Бюлл. эксперим. биологии и медицины. 1992; 113 (6): 645–-8.
- Ордян Н.Э., Вайдо А.И., Ракицкая В.В., Ширяева Н.В., Проймина Ф.И., Лопатина Н.Г., Шаляпина В.Г. Функционирование гипофизарно-адренокортикальной системы у крыс, селектированных по порогу чувствительности к электрическому току. Бюлл.экспер.биологии и медицины.1998; 4: 443–5.
- Алехина Т.А., Шульга В.А., Лопатина Н.Г., Ширяева Н.В., Вайдо А.И. Нейрогормональные характеристики крыс, селектированных по длительности пассивно-оборонительной реакции и порогу нервно-мышечной возбудимости.Журн. высшей нервной деятельн. 1994; 44 (4-5): 837–41.
- Герасимова И.А., Флеров М.А., Вайдо А.И., Ширяева Н.В. Фосфолипидный состав синаптосом коры головного мозга крыс, различающихся по порогу возбудимости нервной ткани. Нейрохимия.2001;18 (4): 273–8.
- Дмитриева Н.И., Гоццо С. Структурные особенности головного мозга крыс, селектированных по порогу возбудимости. Арх. анат.1985; 88 (2): 5–10.
- Kalendar R., Belyaev A., Zachepilo T., Vaido A., Maidanyuk D., Schulman A., Dyuzhikova N. Copy-number variation of housekeeping gene rpl13a in rat strains selected for nervous system excitability Molecular and Cellular Probes.2017; 33: 11–5.
- Ширяева Н.В., Вайдо А.И., Левкович Ю.И., Лопатина Н.Г. Поведение в открытом поле крыс с различным уровнем возбудимости нервной системы в разные сроки после невротизации.Журн. высш.нерв.деят. 1992; 42 (4): 754–7.
- Алехина Т.А., Вайдо А.И., Ширяева Н.В., Лопатина Н.Г. Общие характеристики поведения крыс, селектированных по длительности пассивно-оборонительной реакции и порогу нервно-мышечной возбудимости. Журн. высшей нервн. деятельн. 1994; 44 (3): 597–603.
- Лопатина Н.Г., Пономаренко В.В. Исследование генетических основ высшей нервной деятельности. В кн.: Физиология поведения. Нейробиологические закономерности Под ред. А.С. Батуева. Л.: Наука. 1987: 9–59.
- Вайдо А.И. Физиолого-генетический анализ возбудимости нервной системы и поведения лабораторной крысы. Дисс … д-ра биол. наук. СПб. 2000; 197.
- Швецов А.В., Вайдо А.И., Дюжикова Н.А., Бельская А.В., Михайлова М.В., Скоморохова Е.Б., Батоцыренова Е.Г. Влияние тиопентала натрия на сохранение условного рефлекса пассивного избегания у крыс с различной возбудимостью нервной системы. Токсикол. вестник. 2018; 1: 8–11.
- Левина А.С., Захаров Г.А., Ширяева Н.В., Вайдо А.И. Сравнительная характеристика поведения крыс двух линий, различающихся по порогу возбудимости нервной системы, в модели пространственного обучения в водном лабиринте Морриса. Журн. высшей нервной деят. 2018; 68 ( 2): 1–12.
- Ширяева Н.В., Вайдо А.И., Петров Е.С., Хофман Г.Ю., Забродин И.Ю., Макарова Т.М. Поведение в открытом поле крыс с различным уровнем возбудимости нервной системы. Журн. высш. нерв. деят.1987;37 (6):1064–9.
- Левина А.С., Савенко Ю.Н., Дюжикова Н.А., Вайдо А.И. Каинатные рецепторы в гиппокампе крыс линий, различающихся по уровню возбудимости нервной системы.Морфология. 2011;139 (3): 25–9.
- Быковская Н.В., Дюжикова Н.А., Вайдо А.И., Лопатина Н.Г., Шварцман П.Я. Частота хромосомных аберраций, индуцированных стрессорным воздействием и циклофосфаном в клетках костного мозга крыс, селектированных по порогу возбудимости нервной системы. Генетика.1994;30 (9):1224–8.
- Ширяева Н.В., Вайдо А.И., Лопатина Н.Г. Влияние невротизации спустя длительные сроки после ее окончания на поведение крыс, различающихся по возбудимости нервной системы. Журн. высш. нервн. деят.1996;46 (1):157–62.
- Вайдо А.И., Дюжикова Н.А., Ширяева Н.В., Савенко Ю.Н., Соколова Н.Е., Вшивцева В.В. Системный контроль молекулярно-клеточных и эпигенетических механизмов долгосрочных последствий стресса. Генетика. 2009; 45(3): 342–8.
- Дюжикова Н.А., Скоморохова Е.Б., Вайдо А.И. Эпигенетические механизмы формирования постстрессорных состояний. Успехи физиологических наук. 2017; 45 (1): 47–74.
- Дюжикова Н.А., Даев Е.В., Павлова М.Б., Ширяева Н.В., Левина А.С., Вайдо А.И. Изменение транскрипционной активности и дестабилизация генома под влиянием психоэмоционального стресса у крыс с контрастной возбудимостью нервной системы. Труды Х1V Международного междисциплинарного конгресса: Нейронаука для мед. и психол. Россия. Судак. Крым. 2018: 191–2.
- Zachepilo T.G., Kalendar R., Schulman A.H., Vaido A.I., Dyuzhikova N.A. Emotionally painful stress causes changes in L1 insertion pattern in the hippocampus in rats with different nervous system excitability/27th ECNP Congress, Berlin, Germany. Eur. Neuropsychopharmac. 2014; 24 (2): 163.




