Анализ роли нейтрофилов в развитии воспаления в монокроталининдуцированной легочной артериальной гипертензии
Работа выполнена при поддержке Белорусского Республиканского фонда фундаментальных исследований (грант № М17-113).
Семенкова Г.Н., Адзерихо И.Э., Амаэгбери Н.В., Владимирская Т.Э., Яцевич О.Н. Анализ роли нейтрофилов в развитии воспаления в монокроталининдуцированной легочной артериальной гипертензии. Лабораторные животные для научных исследований. 2023; 4. https://doi.org/10.57034/2618723X-2023-04-06
Резюме
Легочная артериальная гипертензия (ЛАГ) представляет собой клинический синдром с мрачным исходом. Это заболевание связано с дисфункцией или повреждением эндотелия, ремоделированием легочных сосудов, повышением сосудистого сопротивления и артериального давления в легочной артерии. Все это провоцирует правожелудочковую недостаточность и отек легких, что приводит к преждевременной смерти больных. ЛАГ сопровождается развитием воспалительного процесса, одной из основных причин которого является усиленная продукция активных форм кислорода и хлора стимулированными нейтрофилами.
Цель исследования — изучение роли этих клеток в формировании оксидативного стресса в экспериментальной модели ЛАГ.
Исследования проведены на беспородных белых крысах. Моделирование ЛАГ проводили путем подкожного введения раствора монокроталина в дозе 60 мг/кг. Контрольную группу составили 10 здоровых животных. После инъекции монокроталина животных с ЛАГ разделяли на 4 группы: 10 крыс в 2-недельной группе, 10 крыс в 4-недельной группе, 14 крыс в 6-недельной группе и 20 крыс в 8-недельной группе. После забора периферической крови и выделения нейтрофилов определяли продукцию активных форм кислорода и хлора, секреторную дегрануляцию и концентрацию несвязанных ионов кальция в цитозоле с использованием спектральных методов анализа. Результаты сравнивали с соответствующими данными, полученными для 10 здоровых животных.
Установлено, что развитие ЛАГ у крыс в течение 8 нед сопровождается праймингом нейтрофилов и формированием оксидативного стресса в результате модификации механизмов «респираторного взрыва». Выявлено изменение продукции активных форм кислорода и хлора, нарушение Ca2+-зависимой внутриклеточной сигнализации с вовлечением циклооксигеназ 1/2 и фосфатидилинозитол-3-киназы, усиление секреции миелопероксидазы из нейтрофилов.
Введение
Легочная артериальная гипертензия (ЛАГ) — клинический синдром, сочетающий в себе патологические состояния различной этиологии и патогенеза. Это заболевание сопровождается ремоделированием и неконтролируемой вазоконстрикцией легочных сосудов, в результате чего повышается давление в системе легочной артерии и увеличивается сосудистое сопротивление. В дальнейшем это провоцирует правожелудочковую недостаточность и отек легких, что приводит к преждевременной смерти больных [1]. Особенностью ЛАГ является изменение иммунитета и развитие в легких воспалительного процесса. Об этом свидетельствуют инфильтрация легочной ткани различными воспалительными клетками (макрофагами, нейтрофилами, Т- и В-лимфоцитами), увеличение уровня цитокинов и факторов роста в ремоделированных сосудах, а также циркулирующих хемокинов и цитокинов [2, 3]. Установлена связь воспалительного процесса с ремоделированием легочных сосудов при ЛАГ, которое прогрессирует в плексиформную артериопатию [2].
Одной из основных причин воспалительного патогенеза ЛАГ является оксидативный стресс, вызванный перепроизводством свободных радикалов и других оксидантов [4, 5]. Источником активных форм кислорода и хлора (АФКХ) являются фагоциты. При активации НАДФН-оксидазы эти клетки генерируют супероксидные анион-радикалы, которые превращаются в пероксид водорода (Н2О2), являющийся субстратом миелопероксидазы (МПО), катализирующей образование хлорноватистой кислоты (HOCl). Она выполняет роль основного микробицидного агента и является при этом источником свободных радикалов, что может приводить к повреждению жизненно важных молекул, нарушению клеточных функций или цитодеструкции [6, 7]. Поэтому важной составляющей медикаментозной терапии ЛАГ является снижение последствий оксидативного стресса.
Цель исследования — изучение роли нейтрофилов в формировании оксидативного стресса в экспериментальной модели ЛАГ. Выбор клеток обусловлен тем, что нейтрофилы являются основными продуцентами АФКХ благодаря высокому содержанию НАДФН-оксидазы и МПО.
Материал и методы
В работе использовали: монокроталин (МКТ), гистопак-1077, люминол (5-амино-2,3-дигидрофталазин-1,4-дион), люцигенин (N,N’-диметил-9,9’-бисакридиний нитрат), ABAH (гидразид 4-аминобензойной кислоты), LY294002, аспирин, H2O2, Triton X-100 (Sigma, США), Fura 2-AM (Thermofisher Scientific, США), компоненты для приготовления сбалансированного буферного солевого раствора Эрла (СБСРЭ) («Анализ Х», Беларусь).
Исследования проведены на 64 рандомбредных белых крысах (самцы массой 200–250 г), содержащихся в стационарных условиях вивария Белорусской медицинской академии последипломного образования (БелМАПО) на полноценном стандартном пищевом рационе согласно установленным нормам. Для эксперимента выбирали активных животных с гладким, блестящим шерстным покровом, нормальной окраской видимых слизистых оболочек, охотно поедающих корм. До исследования животные находились под карантинным наблюдением в течение 2 нед, а за 24 ч были лишены корма. В день начала эксперимента проводили дополнительное обследование и взвешивание животных. Компоновка по группам наблюдения проводилась произвольно.
Моделирование ЛАГ у 54 животных осуществляли с помощью МКТ [8, 9]. МКТ растворяли в подогретом до 30 °С 0,9% растворе NaCl; 1 мл полученного раствора вводили крысам утром натощак в дозе 60 мг/кг массы тела подкожно в область холки. После инъекции МСТ крысы с ЛАГ были случайным образом разделены на 4 группы: 2-недельную (10 крыс), 4-недельную (10 крыс), 6-недельную (14 крыс) и 8-недельную (20 крыс) группы, что обусловлено временными промежутками между началом индуцирования патологии и забором крови для анализа. Забор крови проводили утром из нижней полой вены животных под наркозом в стандартных условиях операционного блока вивария. Наркотизацию животных проводили внутримышечным введением раствора кетамина из расчета 0,2–0,3 мл на 100 г массы тела. Результаты сравнивали с соответствующими данными, полученными для контрольной группы. Контрольную группу составили 10 здоровых животных, которым вместо МКТ вводили эквивалентное количество физиологического раствора. Забор крови у этих животных производили через 2 нед после введения растворителя.
На протяжении всего эксперимента животные содержались индивидуально в стандартных условиях вивария с постоянным доступом к воде и пище. По истечении срока наблюдения животные были выведены из эксперимента с соблюдением принципов биоэтики (в соответствии со стандартами GLP) на фоне внутрибрюшинного тиопенталового наркоза из расчета 1 мл 5% тиопентала натрия на 100 г массы тела.
При проведении исследований руководствовались соблюдением требований Европейской конвенции о защите позвоночных животных, используемых для экспериментов или в иных научных целях, а также требований и рекомендаций, нормативных, научно-методических и справочных материалов по содержанию, кормлению и выводу их из эксперимента с последующей утилизацией (https://bioethics.belmapo.by/research-ethics.html). Настоящее исследование одобрено этической комиссией БелМАПО (№ 4 от 23.09.20).
Нейтрофилы выделяли из периферической крови крыс в градиенте плотности гистопака по стандартной методике [10]. Подсчет клеток проводили с помощью камеры Горяева. Выделенные клетки ресуспендировали в СБСРЭ, рН 7,4.
Генерацию АФКХ изучали методом хемилюминесценции (ХЛ) на биохемилюминометре БХЛ-1 (Минск, Беларусь). Определение АФКХ проводили с использованием 10 мкM люминола или 10 мкM люцигенина. «Респираторный взрыв» в нейтрофилах (1·105 клеток/мл) индуцировали с помощью адгезии клеток к поверхности стекла, для чего использовали в процессе измерения ХЛ дно кварцевой кюветы диаметром 40 мм. Вклад в процессы внутриклеточной сигнализации ферментов, которые участвуют в образовании АФКХ, оценивали с использованием специфических ингибиторов: 0,1 мкM ABAH — ингибитор МПО, 0,1 мкM LY294002 — ингибитор фосфатидилинозитол-3-киназы (ФИ3К), 1 мкM аспирина — ингибитор циклооксигеназы 1/2. Время прединкубации клеток с ингибиторами составляло 20 мин.
Активность секретируемой из нейтрофилов МПО оценивали по интенсивности ХЛ, измеренной в течение 10 мин в системе, содержащей 1 мл СБСРЭ (pH 5,2), 10 мкМ H2O2, 25 мкМ люминола и 200 мкл внеклеточной жидкости, полученной после центрифугирования суспензии нейтрофилов (1·106 клеток/мл), как описано в работе [11]. Перед измерением нейтрофилы стимулировали адгезией к поверхности кварцевого стекла в течение 30 мин при 37 °C. Активность секретированной МПО (∑Iсекр/∑Iобщ×100%) оценивали как отношение активности МПО (интегральная интенсивность ЛюмХЛ) во внеклеточной среде стимулированных адгезией клеток (∑Iсекр) к общей активности МПО в 200 мкл лизата клеток (∑Iобщ). Лизат нейтрофилов для оценки общей активности МПО получали добавлением 10% раствора Triton X-100.
Концентрацию свободного цитозольного Са2+ ([Ca2+]i) определяли с помощью флюоресцентного зонда Fura 2-AM (λex=340/380 нм, λem=510 нм) на флуориметре (CM 2203 «Солар», Беларусь) по методике, описанной в работе [12]. Нейтрофилы (106 клеток/мл) (рН 7,4) инкубировали с 2 мкмоль/л Fura 2-AM при 37 °C в течение 30 мин. Клетки дважды промывали СБСРЭ и выдерживали при 37 °С в течение 30 мин для завершения деэстерификации флюоресцентного красителя. После этого клеточную суспензию помещали в кварцевую кювету и регистрировали флюоресценцию в течение 10 мин.
Концентрацию свободных цитозольных ионов кальция в нейтрофилах рассчитывали по уравнению Гринкевича:
[Ca2+]i =Kd×[(R – Rmin)/Rmax – R)]×В,
где [Ca2+]i — концентрация несвязанных ионов кальция в цитоплазме (в нМ); Kd — константа связывания ионов Ca2+ с зондом Fura-2 (при 37 °C Kd составляет 225); R — отношение интенсивности флюоресценции при λ=340 нм к интенсивности флюоресценции при λ=380 нм; Rmin — отношение интенсивности флюоресценции 340/380 при минимальной концентрации Ca2+ в среде; Rmax — отношение интенсивности флюоресценции 340/380 при максимальной концентрации Ca2+ в среде; В — отношение интенсивности флюоресценции 340/380 при максимальной концентрации Ca2+ в среде к интенсивности флюоресценции 340/380 при минимальной концентрации Ca2+ в среде.
Статистическую обработку результатов проводили с помощью однофакторного дисперсионного анализа (ANOVA). Различия между контрольной и экспериментальной группой анализировали с помощью критерия Даннета. Результаты представлены как среднее значение трех или более независимых экспериментов ± стандартное отклонение. Результаты считали значимыми при p<0,05.
Результаты и обсуждение
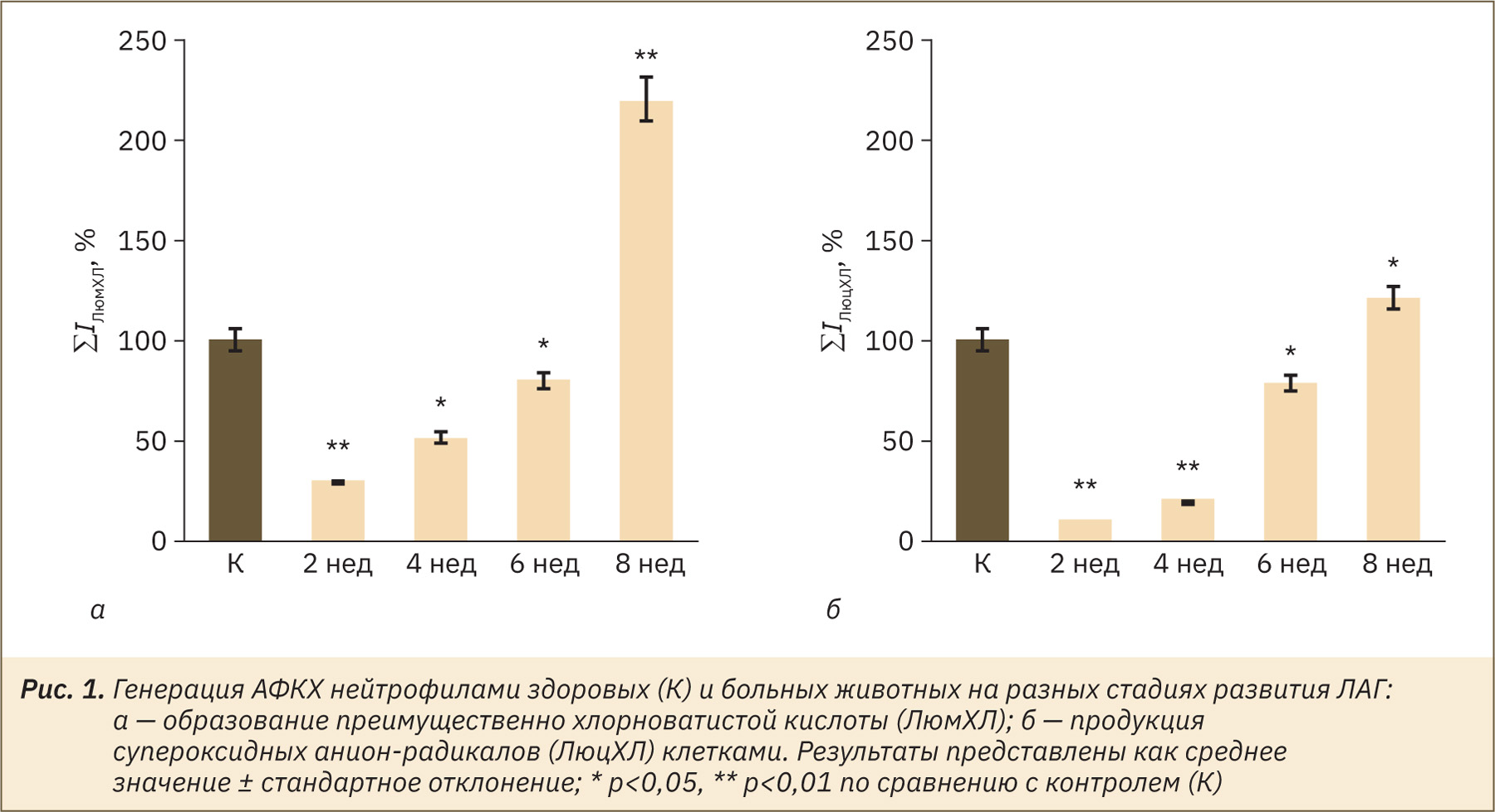
Изучена генерация АФКХ нейтрофилами крыс при прогрессировании ЛАГ. Интенсивность усиленной люминолом (ЛюмХЛ) или люцигенином ХЛ (ЛюцХЛ) отражает концентрацию различных типов АФКХ в модельных и клеточных системах. Люминол известен как ХЛ-индикатор всех типов АФКХ, однако более эффективно он окисляется хлорноватистой кислотой [13]. В то же время люцигенин окисляется преимущественно супероксидными анион-радикалами (О2–) [14]. Изменение интегральной интенсивности ЛюмХЛ (∑IЛюмХЛ) и ЛюцХЛ (∑IЛюцХЛ) нейтрофилов крыс с ЛАГ и контрольной группы показаны на рис. 1, а и б. Как видно из рис. 1, а, общий выход нейтрофильных АФКХ по сравнению с контролем был значительно снижен в 2-недельной группе и умеренно снижен в 4- и 6-недельных группах животных. К 8-й неделе прогрессирования заболевания отмечалось увеличение (в 2,3 раза) продукции АФКХ нейтрофилами. Прогрессирование ЛАГ приводило к уменьшению интенсивности ЛюцХЛ и, как следствие, продукции супероксидных анион-радикалов в нейтрофилах крыс через 2 или 4 нед после инъекции МКТ с последующим умеренным увеличением через 6 нед и значительным повышением (на 20%) через 8 нед (см. рис. 1, б).
Для выявления механизмов образования АФКХ в нейтрофилах крыс с МКТ-индуцированной ЛАГ использовали следующие специфические ингибиторы: АВАН, аспирин и LY294002. Данные, представленные в таблице 1, показывают, что после добавления АВАН к нейтрофилам здоровых животных интегральная интенсивность ЛюмХЛ снизилась до 20±10% от контрольного значения (в отсутствие ингибитора). Однако в обработанных АВАН нейтрофилах крыс, которым вводили МКТ, снижение продукции АФКХ менее выражено при прогрессировании ЛАГ: продукция АФКХ снижается до 32±7, 38±10, 42±7 и 59±6% в группах для 2, 4, 6 и 8-й недели соответственно. Таким образом, наблюдается тенденция к снижению вклада МПО в генерацию АФКХ нейтрофилами животных с ЛАГ. Ингибирование циклооксигеназы 1/2 также приводило к снижению выхода АФКХ в нейтрофилах. Как следует из анализа результатов, представленных в таблице 1, генерация АФКХ клетками, обработанными аспирином, через 2 нед после введения МКТ повышалась более чем в 2 раза, затем снижалась и была ниже контрольного уровня через 8 нед прогрессирования ЛАГ.
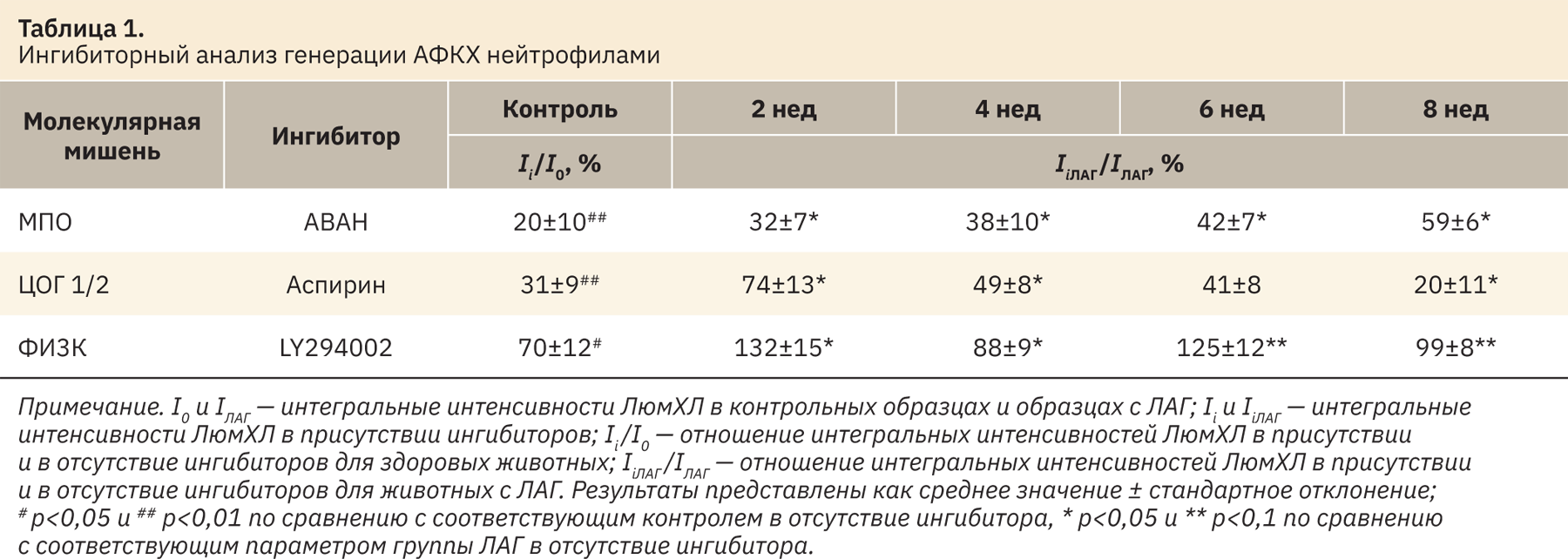
Участие PI3K в продукции свободных радикалов нейтрофилами крыс с ЛАГ имеет сложный характер. Ингибирование ФИ3К способствовало повышению продукции АФКХ во всех группах животных с ЛАГ. В контрольных образцах добавление ингибитора ФИ3К приводило к снижению выхода АФКХ до 70±12%, что свидетельствует о значительном вкладе этого фермента в образование АФКХ. В 2- и 6-недельных группах LY294002 вызывал повышение общей интенсивности ЛюмХЛ. Через 8 нед после инъекции МКТ ФИ3К, вероятно, не была вовлечена в образование АФКХ нейтрофилами. Анализ результатов, полученных с помощью ингибиторов ферментов, вовлеченных в процессы внутриклеточной сигнализации при формировании «дыхательного взрыва» нейтрофилов, свидетельствует, что прогрессирование ЛАГ со 2-й по 8-ю неделю сопровождается снижением вклада МПО, усилением роли циклооксигеназы 1/2 и модификацией передачи сигналов ФИ3К при генерации АФКХ нейтрофилами.
С интенсификацией процессов трансдукции активационного сигнала в клетках связывают повышение концентрации свободных ионов кальция в цитозоле ([Ca2+]i) [15]. Мы исследовали уровень [Ca2+]i в цитозоле нейтрофилов здоровых и больных крыс через 2 нед после индуцирования ЛАГ с помощью МКТ. Было показано, что [Ca2+]i в клетках здоровых крыс составляет 296±24 нМ. Через 2 нед после инъекции МКТ этот параметр увеличился в 2,5 раза (до 729±69 нМ), что указывает на активацию процессов кальцийзависимой внутриклеточной сигнализации.
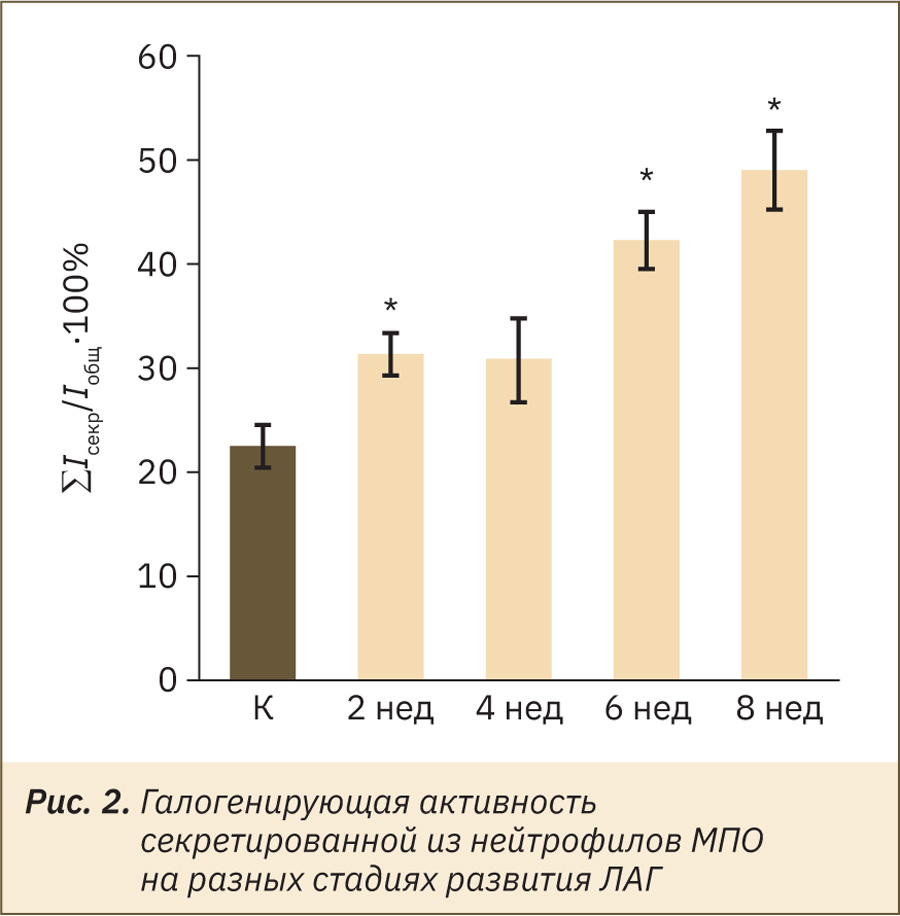
На рис. 2 приведены значения интенсивности ХЛ, отражающие уровень образования HOCl под действием МПО, секретированной из нейтрофилов во внеклеточную среду после их стимуляции адгезией в течение 30 мин. Данный параметр характеризует галогенирующую активность МПО [11]. Как видно на рис. 2, через 2 и 4 нед после инициирования ЛАГ наблюдалось небольшое увеличение продукции HOCl во внеклеточной среде. Через 6 и 8 нед уровень HOCl был повышен на 100–150%. Эти данные показывают, что прогрессирование ЛАГ сопровождается усилением процессов секреторной дегрануляции нейтрофилов, в результате чего из клеток во внеклеточную среду высвобождается больше МПО.
Заключение
Полученные данные указывают на важную роль нейтрофилов в развитии воспаления в МКТ-индуцированной ЛАГ. Изменение продукции АФКХ нейтрофилами крыс в динамике ЛАГ свидетельствует о модификации функциональной активности этих клеток, что выражается в усиливающейся предактивации (прайминге), сопряженной с нарушением кальцийзависимых процессов трансдукции активационного сигнала с участием МПО, циклооксигеназы 1/2 и ФИ3К. При этом через 2–8 нед после индуцирования ЛАГ в результате нарастающей секреторной дегрануляции наблюдается увеличение выхода из нейтрофилов важнейшего медиатора воспаления фермента МПО, который катализирует реакцию образования HOCl и, как следствие, является потенциальным индуктором оксидативного/галогенирующего стресса в организме.
Сведения о конфликте интересов
Авторы заявляют об отсутствии конфликта интересов.
Вклад авторов
Г.Н. Семенкова — концепция и дизайн исследования, написание текста статьи.
И.Э. Адзерихо — концепция и дизайн исследования.
Н.В. Амаэгбери — получение, обработка экспериментальных данных.
Т.Э. Владимирская — получение, обработка, анализ экспериментальных данных.
О.Н. Яцевич — получение, обработка экспериментальных данных.
Все авторы прочитали окончательную версию рукописи и согласились с ней.
Список источников
-
Galiè N., Hoeper M.M., Humbert M. et al. Guidelines for the diagnosis and treatment of pulmonary hypertension // Eur. Respir. J. 2009. Vol. 34. N. 6. P. 1219–1263. DOI: 10.1183/09031936.00139009.
-
El Chami H., Hassoun P.M. Immune and inflammatory mechanisms in pulmonary arterial hypertension // Prog. Cardiovasc. Dis. 2012. Vol. 55. N. 2. P. 218–228. DOI: 10.1016/j.pcad.2012.07.006.
-
Tang C., Luo Y., Li S. et al. Characteristics of inflammation process in monocrotaline-induced pulmonary arterial hypertension in rats // Biomed Pharmacother. 2021. Vol. 133. P. 111081. DOI: 10.1016/j.biopha.2020.111081.
-
Touyz R.M. Reactive oxygen species, vascular oxidative stress, and redox signaling in hypertension: what is the clinical significance? // Hypertension. 2004. Vol. 44. P. 248–252. DOI: 10.1161/01.HYP.0000138070.47616.9d.
-
Rafikova O., Al Ghouleh I., Rafikov R. Focus on early events: pathogenesis of pulmonary arterial hypertension development // Antioxid. Redox. Signal. 2019. Vol. 31. N. 13. P. 933–953. DOI: 10.1089/ars.2018.7673.
-
Arnhold J. The dual role of myeloperoxidase in immune response // Int. J. Mol. Sci. 2020. Vol. 21. P. 8057. DOI: 10.3390/ijms21218057.
-
Hawkins C.L., Pattison D.I., Davies M.J. Hypochlorite-induced oxidation of amino acids, peptides and proteins // Amino Acids. 2003. Vol. 25. N. 3–4. P. 259–274. DOI: 10.1007/s00726-003-0016-x.
-
Padrez Y., Golubewa L., Kulahava T. et al. Quantitative and qualitative analysis of pulmonary arterial hypertension fibrosis using wide-field second harmonic generation microscopy // Scientific reports. 2022. Vol. 12. N. 1. P. 7330. DOI: 10.1038/s41598-022-11473-5.
-
Wilson D.W., Segall H.J., Pan L.C. et al. Mechanisms and pathology of monocrotaline pulmonary toxicity // Crit. Rev. Toxicol. 1992. Vol. 22. P. 307–325. DOI: 10.3109/10408449209146311.
-
Bøyum A. Isolation of lymphocytes, granulocytes and macrophages // Scand. J. Immunol. 1976. Suppl. 5. P. 9–15.
-
Kavalenka A.I., Semenkova G.N., Cherenkevich S.N. Effects of hydrogen peroxide on neutrophil ability to generate reactive oxygen and chlorine species and to secrete myeloperoxidase in vitro // Cell Tissue Biol. 2007. Vol. 1. N. 6. P. 551–559.
-
Patel A., Hirst R.A., Harrison C. et al. Measurement of [Ca2+] i in whole cell suspensions using fura-2 // Methods Mol. Biol. 2013. Vol. 937. P. 37–47. DOI: 10.1007/978-1-62703-086-1_2.
-
Рощупкин Д.И., Белакина Н.С., Мурина М.А. Усиленная люминолом хемилюминесценция полиморфноядерных лейкоцитов кролика: природа оксидантов, непосредственно вызывающих окисление люминола // Биофизика. 2006. Т. 51. № 1. С. 99–107. [Roshchupkin D.I., Belakina N. S., Murina M.A. Luminol-enhanced chemiluminescence of rabbit polymorphonuclear leukocytes: the nature of oxidants directly responsible for luminol oxidation // Biophys. 2006. Vol. 51. N. 1. P. 99–107. (In Russ.)].
-
Li Y., Zhu H., Kuppusamy P. Roubaud V., Zweier J.L., Trush M.A. Validation of lucigenin (bis-N-methylacridinium) as a chemilumigenic probe for detecting superoxide anion radical production by enzymatic and cellular systems // J. Biol. Chem. 1998. Vol. 273. N. 4. P. 2015–2023. DOI: 10.1074/jbc.273.4.2015.
- Immler R., Simon S.I., Sperandio M. Calcium signalling and related ion channels in neutrophil recruitment and function // Eur. J. Clin. Invest. 2018. Vol. 48. P. e12964. DOI: 10.1111/eci.12964.




