Офтальмоскопия как метод оценки фармакологической безопасности препаратов
Работа выполнена без спонсорской поддержки.
Прудникова Е.В., Бокарев А.В., Минина А.О., Пилипец Е.А. Офтальмоскопия как метод оценки фармакологической безопасности препаратов. Лабораторные животные для научных исследований. 2023; 4. https://doi.org/10.57034/2618723X-2023-04-03
Резюме
Токсические эффекты препаратов могут затрагивать передний и задний сегменты глаза, хрусталик. Для прижизненной оценки состояния заднего сегмента глаза используется офтальмоскопия — осмотр глазного дна. При офтальмоскопии можно наблюдать характерные изменения, появляющиеся чаще всего при системном или интраокулярном использовании препаратов. Однако до интерпретации патологических офтальмоскопических признаков у лабораторных животных следует знать нормальные вариации картины глазного дна, так как среди видов животных существует значительное разнообразие строения глазного дна (наличие или отсутствие тапетума, пигментации и тип питания сетчатки). Патологические данные, полученные при офтальмоскопии, указывающие на токсический эффект препарата, могут выражаться в виде экссудативных, воспалительных, дегенеративных и атрофических процессов, расширения, извитости и кровенаполненности сосудов сетчатки, изменения цвета тапетума, отслойки сетчатки, кровоизлияний на глазном дне, сужения сосудов сетчатки и гиперрефлективности тапетума. Офтальмоскопическое обследование является важнейшим инструментом диагностики патологий заднего сегмента глаз у лабораторных животных, принимающих участие в исследовании фармакологической безопасности препаратов. Офтальмоскопия должна проводиться высококвалифицированным ветеринарным офтальмологом на всех этапах доклинического исследования препарата.
Виды и техника проведения офтальмоскопии
Офтальмоскопия (осмотр глазного дна) используется для оценки состояния заднего сегмента глаза животных как в клинической ветеринарии, так и в доклинических исследованиях с использованием лабораторных животных. Офтальмоскопия проводится при помощи прямого либо непрямого офтальмоскопов и линз различной диоптрийности (20–90 D) в зависимости от размера глазного яблока исследуемого животного. Независимо от вида используемого офтальмоскопа для полноценного осмотра глазного дна требуется расширение зрачка, которое достигается путем внесения в конъюнктивальный мешок одной капли 1% раствора тропикамида 2–3 раза с интервалом 5 мин. Мидриаз у некоторых кроликов может быть неполным из-за присутствия в крови атропинэстеразы, разрушающей мидриатики, которая была обнаружена у 30% животных [1, 2]. Офтальмоскопию проводят в затемненном помещении, чаще всего без общей анестезии или седации, так как их применение может приводить у некоторых видов животных к энофтальму, страбизму, протрузии третьего века, которые осложняют визуализацию. Животных (кошки, собаки, кролики), не проявляющих агрессию, ассистент удерживает в сидячем положении на столе, для других видов животных можно использовать станки-фиксаторы, домики. У мышей и крыс возможно сужение сосудов сетчатки при избыточной фиксации для обследования, это может дать ложное представление о состоянии глазного дна [3], в таких случаях требуются деликатный подход или седация.
При использовании прямого офтальмоскопа исследователь задействует только один свой глаз, располагается очень близко к животному (менее 5 см) и, вращая колесо фокусирующих линз офтальмоскопа, добивается четкого изображения глазного дна. Получаемое изображение прямое, очень крупное, а поле зрения мало (в разы меньше, чем при использовании непрямого офтальмоскопа), что обусловливает некоторые ограничения его использования в ветеринарии (затруднительно сравнивать разные участки глазного дна особенно при постоянном движении глазного яблока, сложнее обеспечить безопасность исследователя). Прямая офтальмоскопия не всегда подходит для мелких лабораторных животных из-за очень маленького размера глазного яблока [1, 2].
Непрямая офтальмоскопия является наиболее удобным и информативным методом осмотра глазного дна. При непрямой офтальмоскопии линзу, как правило, 20 или 30 D для собак, кошек, свиней, кроликов и линзы с большей оптической силой для животных с глазами меньшего размера помещают у глаза животного и на расстоянии вытянутой руки от глаза врача, проводящего исследование. При этом на голове у исследователя надет бинокулярный непрямой офтальмоскоп с налобным источником света, что позволяет ему использовать оба глаза и, соответственно, получить объемную картину глазного дна. Получаемое изображение перевернутое и зеркально отраженное, однако при этом можно быстро осмотреть основную часть глазного дна и сравнить различные участки глазного дна в пределах одного поля зрения [2, 4].
Также описана окулоскопия, проводимая при помощи жесткого эндоскопа с осветителем и камерой, который располагают на расстоянии 1–2 мм от поверхности роговицы. Для окулоскопии требуются общая анестезия и специализированное эндоскопическое оборудование, что является относительным ограничением, однако имеется существенное преимущество — данные могут быть сразу же записаны в видеоформате [5].
Анатомия глазного дна и видовые особенности
Глазное дно лабораторных животных состоит из нейросенсорной сетчатки с различными вариациями васкуляризации, пигментного эпителия сетчатки (может быть пигментирован или может быть беспигментным), хориоидеи с наличием или отсутствием тапетума, склеры и диска зрительного нерва с различной миелинизацией волокон. У приматов отмечают дополнительно область макулы с центральной ямкой — темное пятно в центральной части сетчатки, место концентрации колбочек.
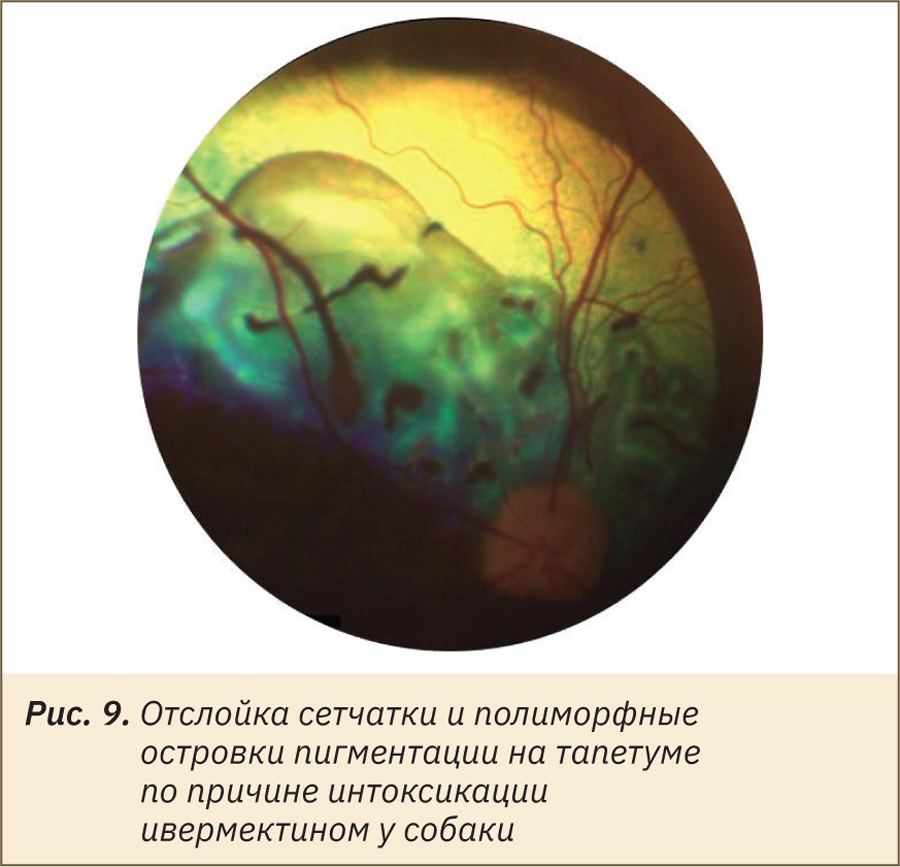
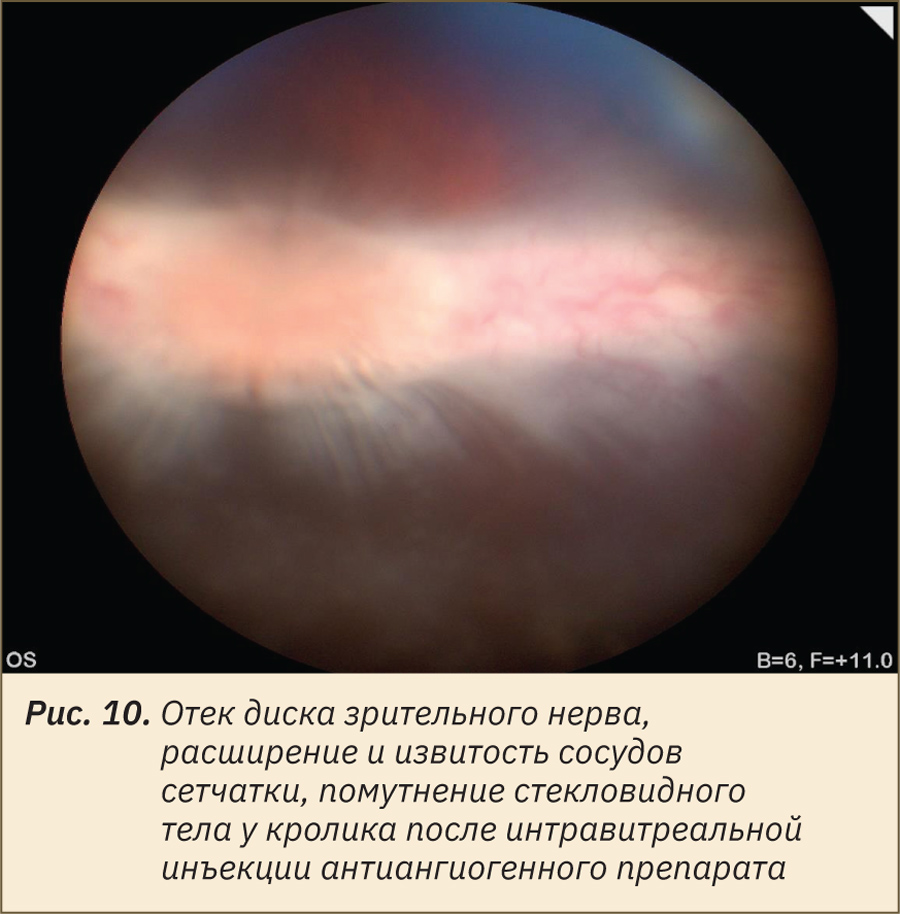
Сосудистая система сетчатки проявляет наибольшую степень изменчивости у лабораторных животных: от полного отсутствия сосудов (в этом случае сетчатка питается только за счет хориокапилляров) до системы сосудистой сети, покрывающей всю сетчатку, с капиллярами, доходящими до уровня ядер палочек и колбочек. Классификация внешнего вида глазного дна лабораторных животных на основе типа васкуляризации сетчатки выделяет холангиотическое, мерангиотическое, паурангиотическое и анангиотическое глазное дно. Холангиотическое глазное дно, при котором сетчатка получает кровоснабжение непосредственно из центральной артерии или из цилиоретинальных артерий, встречается у собак (рис. 1), кошек (рис. 2), крыс (рис. 3), свиней (рис. 4), овец и приматов. Мерангиотическое глазное дно, при котором только часть сетчатки латеральнее и медиальнее диска зрительного нерва снабжена сосудами, наблюдается у кроликов (рис. 5, 7, 8). Паурангиотическое глазное дно, в этом случае сосуды малы и простираются лишь на небольшое расстояние радиально от диска зрительного нерва, встречается у лошади и морской свинки (рис. 6). Анангиотическое глазное дно, здесь сетчатка лишена сосудов, наблюдается у птиц, рептилий и некоторых грызунов, но не у тех, которые обычно используются в лабораторных исследованиях.
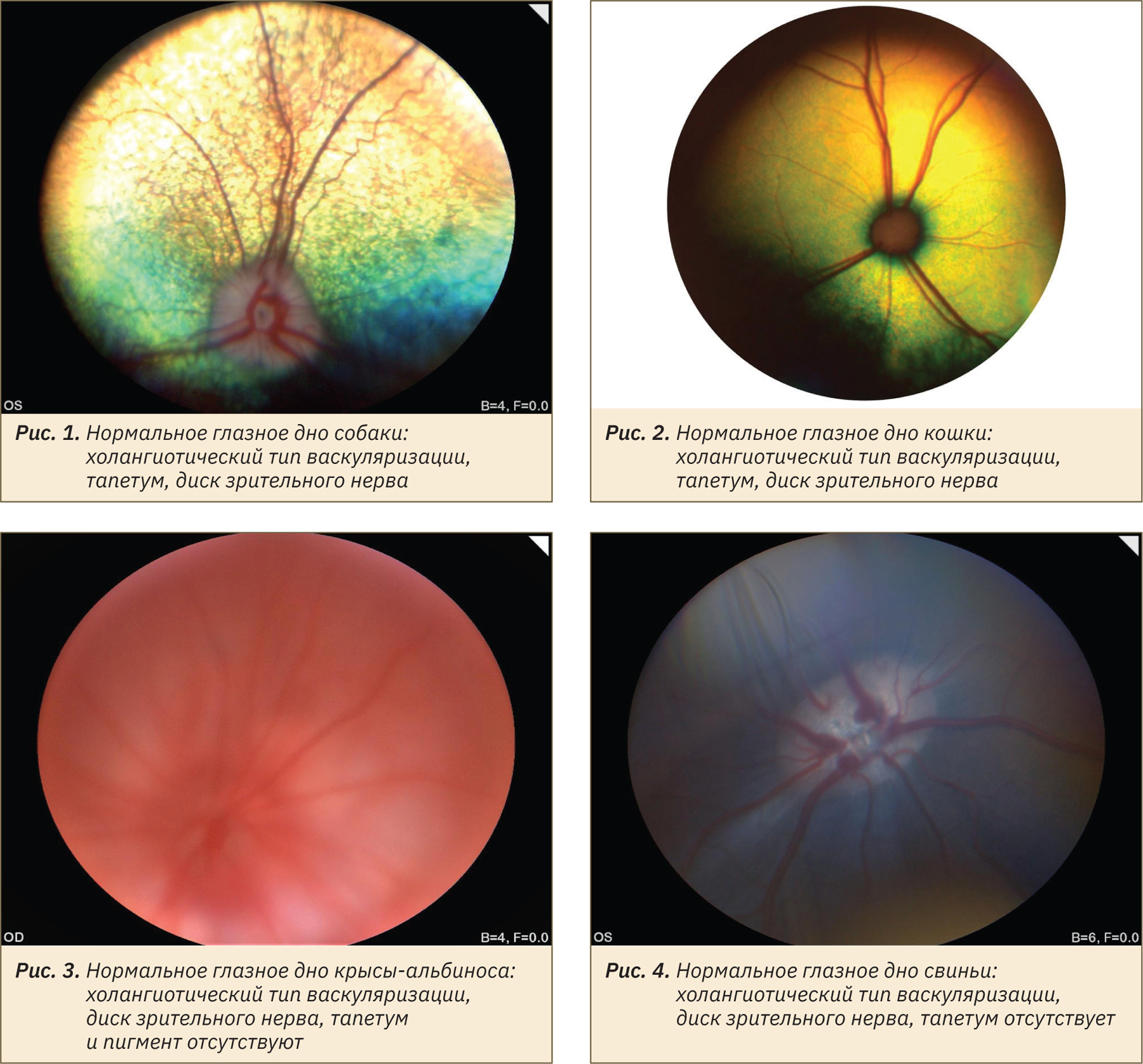
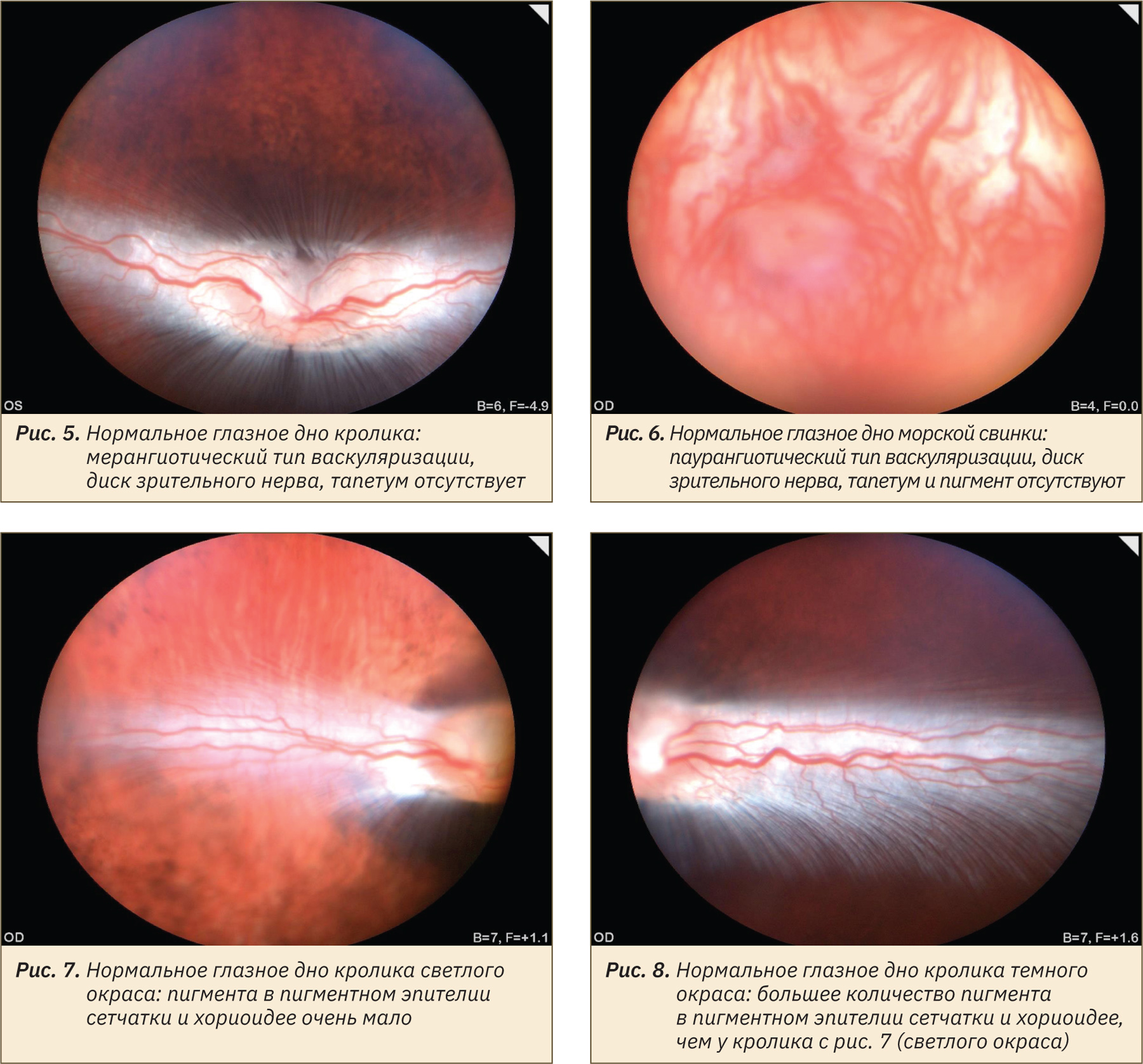
Диск зрительного нерва имеет видовые различия: у собак чаще всего он треугольно-овальный розово-белый с объемным фестончатым краем и небольшой физиологической чашечкой (см. рис. 1), у кошек круглый серовато-белый с ровным краем (см. рис. 2), у свиней горизонтально-овальный серо-белый с ровным краем (см. рис. 4), у кролика горизонтально-овальный бело-розовый с расходящимися латерально и медиально «крыльями» миелина и большой физиологической чашечкой (см. рис. 5), у приматов вертикально-овальный розово-белый с ровным краем. Изменение внешнего вида диска зрительного нерва встречается при тяжелых патологиях — аплазии и гипоплазии, колобоме, атрофии, воспалении.
Наличие или отсутствие тапетума и степень пигментации глазного дна также являются вариабельными в норме у разных видов животных и даже особей одного вида. Тапетум отсутствует у свиней (см. рис. 4), приматов, кроликов (см. рис. 5), грызунов, а у собак, кошек (см. рис. 1, 2) и хорьков он чаще всего присутствует, но может и отсутствовать или быть гипоплазирован в зависимости от окраса и породы животного. Приобретенные изменения цвета тапетума могут возникать как часть патологических реакций тканей глаза. Пигментация пигментного эпителия сетчатки может быть не выражена или полностью отсутствует у особей-альбиносов и животных светлой масти (см. рис. 3, 6, 7), что также является вариантом нормы и не должно быть ложно интерпретировано как кровоизлияние. Чаще всего встречается типичная коричнево-черная пигментация в нетапетальной части глазного дна животных с тапетумом и по всей площади глазного дна животных без тапетума (см. рис. 4, 8).
Кратность осмотров и параметры включения животных в исследования фармакологической безопасности препаратов
В большинстве общих крупных исследований офтальмоскопию следует проводить животным по крайней мере дважды: до начала и перед завершением исследования. При этом в долгосрочных работах (3 мес и более) или в тех, где эффекты тестируемого препарата считаются более вероятными (исследование системной токсичности, в области интраокулярной хирургии и интраокулярного введения препаратов), дополнительно могут быть рекомендованы промежуточные осмотры глазного дна в критических точках эксперимента либо при выявлении подозрительных признаков у животного (нарушение зрачкового рефлекса, зрения) [6, 7]. Лабораторные животные с тяжелыми врожденными патологиями глаз (колобома, катаракта, персистирующие гиалоидные сосуды), острым воспалением тканей глаза, внутриглазным кровоизлиянием, с выраженным помутнением роговицы не включаются в исследования с офтальмоскопической оценкой токсичности препаратов. Для эксперимента берут полностью здоровых лабораторных животных и с незначительными не прогрессирующими отклонениями (например, мелкие персистирующие зрачковые мембраны), а при недостатке таковых животных группу можно дополнить особями с незначительной патологией, не мешающей обследованию: эпифора, небольшой фиброз роговицы после травмы [3]. Желательно, чтобы в исследуемой группе животных были как пигментированные особи, так и альбиносы, это позволяет точнее выявлять токсические эффекты препаратов [6].
Патологические офтальмоскопические признаки, обнаруживаемые при исследованиях токсичности препаратов
Структурами-мишенями при патологических процессах, а также токсическом воздействии препаратов на глазном дне являются в основном ткани сетчатки и хориоидеи (в частности, тапетум). Как правило, токсические аберрации глазного дна можно разделить на четыре основные категории: 1) поражающие сосудистую сеть сетчатки и сосудистой оболочки; 2) экссудативные (из-за утечки жидкости из сосудов или другой природы); 3) дегенеративные/атрофические; 4) вызывающие изменения цвета тапетума [7].
Негативное влияние множества химических агентов на ткани сетчатки животных изучается уже длительное время [8–10]. D. Shiavo (1972) описал эффекты гидроксипиридинтиона, диэтилдитиокарбамата, дитизона, имидазохиназолина, и в последнем случае при офтальмоскопии были выявлены симметричные округлые зоны отслойки сетчатки и пигментация тапетальной области у биглей, причем у собак без тапетума и приматов ретинопатии не было установлено. Похожий пример воспалительного, экссудативного и изменяющего цвет тапетума процесса — интоксикация ивермектином у собак. Имеются сообщения о токсичности ивермектина для собак, особенно колли и австралийских овчарок с мутацией гена MDR1, а также об отдельных случаях подобной реакции у собак иных пород [11, 12] и животных других видов [13]. У животных наблюдаются острая слепота, мидриаз, при офтальмоскопии отмечаются отек, складки или плоские отслойки сетчатки, полиморфные очаги пигментации на тапетуме (рис. 9). Могут дополнительно присутствовать признаки поражения ЦНС. Прогноз после приема внутрь высоких доз ивермектина (более 400 мкг/кг) неблагоприятный; имеются сообщения о гибели животных, однако после приема более низких доз лечение нередко приводит к полному выздоровлению.
Воспалительные процессы с явлениями отека тканей, эссудации и неоваскуляризации встречались у кроликов при введении малеиновой кислоты интравитреально в дозе 1,5–2 мг [14]. При офтальмоскопии наблюдались извитость и кровенаполненность сосудов сетчатки, отек диска зрительного нерва, складки сетчатки. Похожие явления при офтальмосокпии авторы данной статьи наблюдали в доклинических исследованиях на кроликах при интравитреальном введении антиангиогенного препарата N (рис. 10).
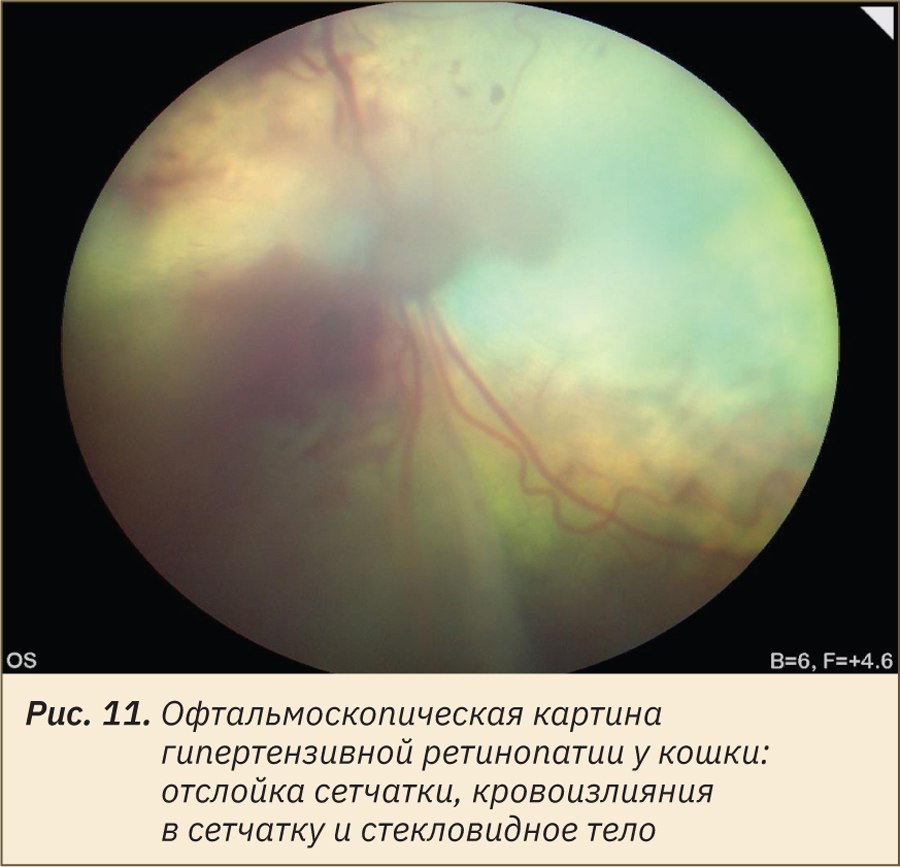
Гипертензивную васкулопатию сетчатки и наблюдаемые при офтальмоскопии признаки (кровенаполненность и извитость вен, сужение артерий сетчатки, ишемия и отек сетчатки, кровоизлияния) у крыс спровоцировали А.А. Peresypkina и соавт. (2016) [15] при использовании 12,5 мг/кг в сут N-нитро-L-аргинин метилового эфира интраперитонеально в течение 28 дней. Клиническая форма гипертензивной ретинопатии широко распространена у кошек и имеет сходные офтальмоскопические признаки (рис. 11).
Примерами фармакологически-индуцированных дегенеративных изменений глазного дна у кошек может быть дегенерация сетчатки при интоксикации энрофлоксацином и тауриндефицитная дегенерация сетчатки.
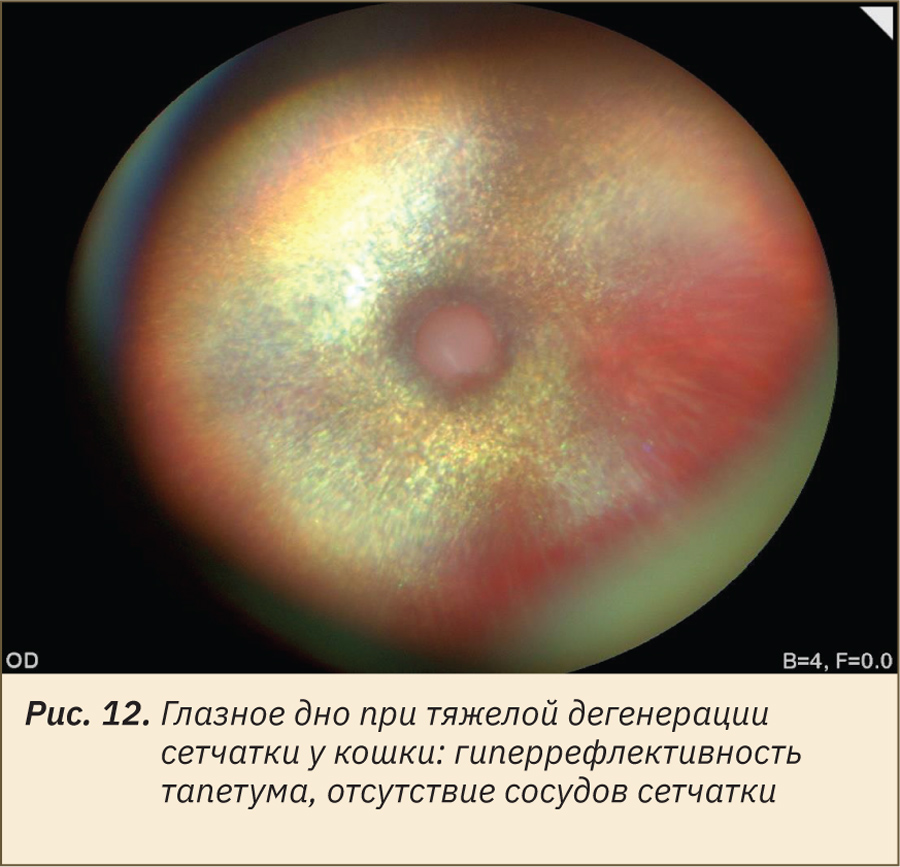
Парентеральное или пероральное введение энрофлоксацина может вызвать острую дегенерацию сетчатки у кошек. У пораженных животных наблюдается острая слепота, зрачки расширены и не реагируют на свет, а при офтальмоскопии выявляются гиперрефлективность тапетума и сужение сосудов сетчатки (рис. 12). C.J. Ramirez и соавт. (2011) [16] выяснили, что у восприимчивых кошек имеется мутация белка ABCG2, входящего в состав гематоретинального барьера, что приводит к накоплению фотореактивных фторхинолонов в сетчатке кошек. Воздействие света на сетчатку приводит к образованию активных форм кислорода, которые вызывают характерную дегенерацию сетчатки и слепоту. Для профилактики токсических явлений рекомендуется не превышать предписанную суточную дозу энрофлоксацина в 5 мг/кг в сут и даже разделять ее на несколько небольших доз, принимаемых в течение дня. Исследования безопасности показали сходную дозозависимую нежелательную реакцию на орбифлоксацин, но не на марбофлоксацин [16].
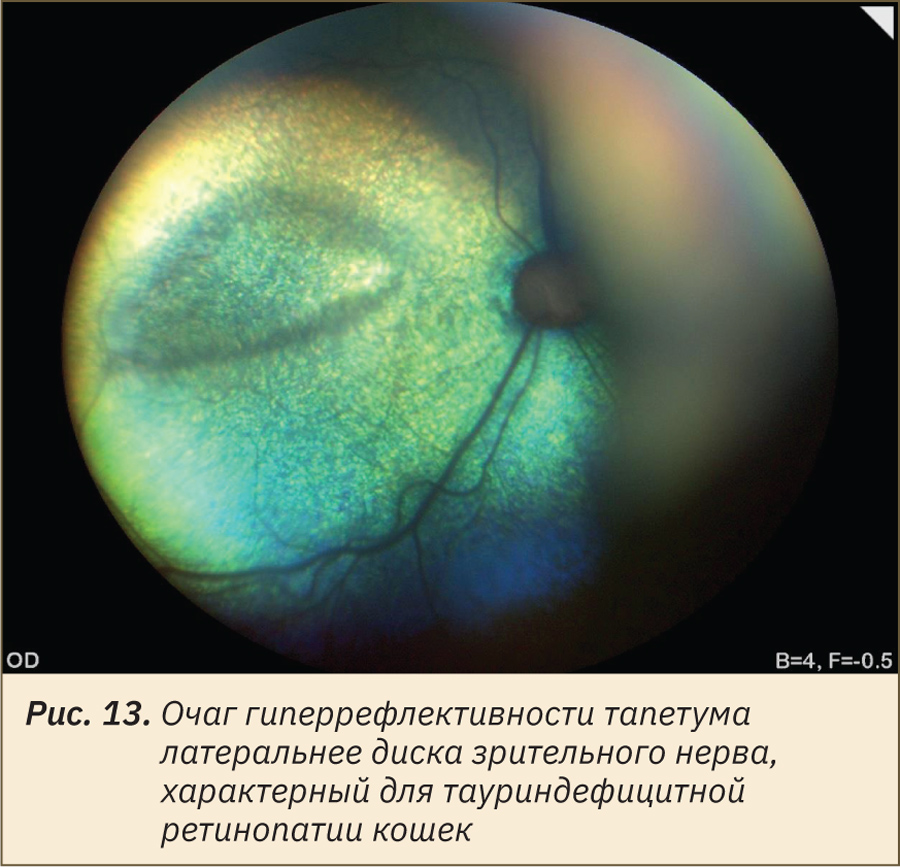
У кошачьих дефицит таурина приводит к прогрессирующей дегенерации сетчатки (а также дилатационной кардиомиопатии). Первично при офтальмоскопии обнаруживается небольшой веретеновидный участок гиперрефлективности тапетума (рис. 13) темпоральнее и немного выше диска зрительного нерва в центральной области сетчатки (зона наибольшей концентрации колбочек), хотя клинически никаких признаков выявить на этом этапе не удается. По мере прогрессирования состояния очаг поражения распространяется в виде полосы от темпоральной части глазного дна по верхней части диска зрительного нерва на назальную часть, в конечном итоге поражает всю сетчатку, что приводит к необратимой слепоте [17]. Препараты и вещества, влияющие на метаболизм таурина, могут приводить к офтальмоскопической картине, аналогичной алиментарному дефициту таурина у кошек [18].
Заключение
Офтальмоскопия — ценный инструмент в диагностике токсических эффектов препаратов при доклинических испытаниях. Учитывая разнообразие используемых в исследованиях видов животных, осмотр глазного дна должен проводиться высококвалифицированным ветеринарным специалистом, знакомым как с техникой проведения процедуры, так и с видовыми, породными и индивидуальными вариациями нормальной картины глазного дна обследуемых животных. Патологические изменения, чаще всего встречающиеся при исследовании фармакологической безопасности, включают отек сетчатки и ее отслойку, пигментацию тапетума, кровенаполненность и извитость сосудов сетчатки, гиперрефлективность тапетума и сужение сосудов сетчатки. Непрямая офтальмоскопия, как наиболее удобный вариант осмотра глазного дна, должна быть обязательной и регулярной процедурой в ходе исследований препаратов на лабораторных животных.
Сведения о конфликте интересов
Авторы заявляют об отсутствии конфликта интересов.
Вклад авторов
Е.В. Прудникова — анализ литературных данных, написание текста статьи, предоставление всех фото из личного архива.
А.О. Минина и Е.Я. Пилипец — анализ литературных данных, дополнение текста статьи.
А.В. Бокарев — критический пересмотр текста статьи, утверждение окончательного варианта статьи для публикации.
Список источников
-
Assessing ocular toxicology in laboratory animals / edited by R.J. Munger, M. Collins. NJ: Humana Totowa, 2012. P. 319.
-
Maggs D.J. Slatters’s fundamentals of veterinary ophthalmology / D.J. Maggs, P.E. Miller, R. Ofri. St.-Louis: Elsevier, 2017. 584 p.
-
Wolf E.D., Kuno H. Ophthalmic examination in preclinical safety studies // Anim. Eye Res. 1991. N. 10. P. 1–11.
-
Willams D. Rabbit and rodent ophthalmology // EJCAP. 2007. N. 3. P. 242–252.
-
Jekl V., Hauptman K., Knotek Z. Oculoscopy in rabbits // The veterinary clinics of North America. Exotic animal practice. 2015. N. 18. P. 417–430.
-
Munger R.J. Veterinary ophthalmology in laboratory animal studies // Vet Ophthalmol. 2002. N. 5. P. 167–175.
-
Schiavo D.M. The use of laboratory animals in toxicology: an ophthalmoscopic assessment // Toxicologic pathology. 1990. N. 1. P. 222–223.
-
Shibuya K., Tomohiro M., Sasaki Sh., Otake S. Characteristics of structures and lesions of the eye in laboratory animals used in toxicity studies // J. Toxicol Pathol. 2015. N. 28. P. 181–188. DOI: 10.1293/tox.2015-0037.
-
Souza Monteiro de Araújo D., Brito R., Pereira-Figueiredo D. et al. Retinal toxicity induced by chemical agents // Int. J. Mol. Sci. 2022. N. 23. P. 1–23.
-
Schiavo D.M. Retinopathy from administration of an imidazo quinazoline to beagles // Toxicol. Appl. Pharmacol. 1972. N. 23. P. 782–783.
-
Epstein S.E., Hollingsworth S.R. Ivermectin-induced blindness treated with intravenous lipid therapy in a dog // Journal of Veterinary Emergency and Critical Care. 2013. N. 23. P. 58–62. DOI: 10.1111/vec.12016.
-
Kenny P., Vernau K., Puschner B., Maggs D. Retinopathy associated with ivermectin toxicosis in two dogs // Journal of the American Veterinary Medical Association. 2008. N. 233. P. 279–284.
-
Saqib M., Abbas G., Mughal M.N. Successful management of ivermectin-induced blindness in an African lion (Panthera leo) by intravenous administration of a lipid emulsion // BMC Vet Res. 2015. N. 11. P. 287–290. DOI: 10.1186/s12917-015-0603-6.
-
Aguirre S.A., Collette W., Gukasyan H.J., Huang W. An assessment of the ocular safety of excipient maleic acid following intravitreal injection in rabbits // Toxicologic pathology. 2012. N. 40. P. 797–806. DOI: 10.1177/0192623312441400.
-
Peresypkina A.A., Gubareva V.O., Levkova E.A., Shabelnikova A.S. Correction of retinal angiopathy of hypertensive type by minoxidil, sildenafil in experiment // Research result. 2016. N. 4. P. 34–44.
-
Ramirez C.J., Minch J.D., Gay J.M. et al. Molecular genetic basis for fluoroquinolone-induced retinal degeneration in cats // Pharmacogenet Genomics. 2011. N. 2. P. 66–75. DOI: 10.1097/FPC.0b013e3283425f44.
-
Gelatt K.N., van der Woerdt A., Ketring K.L. et al. Enrofloxacin-associated retinal degeneration in cats // Vet Ophthalmol. 2001. N. 2. P. 99–106.
- Imaki H., Messing J., Sturman J.A. Extensive Taurine Depletion and Retinal Degeneration in Cats Treated with β-Alanine for 40 Weeks // Taurine 3. Advances in Experimental Medicine and Biology. 1998. N. 442. P. 224–235.




