Сравнительная оценка различных методов экспериментального моделирования нейропатического болевого синдрома у крыс
Александровская Н.В., Круглова А.А. Сравнительная оценка различных методов экспериментального моделирования нейропатического болевого синдрома у крыс . Лабораторные животные для научных исследований. 2021; 3. https://doi.org/10.29296/2618723X-2021-03-04
Резюме
Боль возникает в результате активации множества сенсорных нейронов, называемых ноцицепторами, она эволюционировала как механизм обнаружения и защиты. Однако поражение или заболевание сенсорной системы может привести к нейропатической боли, которая не имеет никакой защитной функции. Нейропатический болевой синдром (НБС) – комплекс симптомов, сопровождающий заболевания различной этиологии, что значительно ухудшает качество жизни. Причинами НБС могут быть сдавление (компрессия), воспаление, интоксикация, нарушение кровоснабжения и питания (ишемия) нервных тканей. Проявления нейропатии бывают самыми разнообразными и зависят от локализации процесса: нейропатия лицевого, локтевого, тройничного, лучевого, седалищного нервов и др.; от функции нерва – двигательной, чувствительной или вегетативной. Один из самых крупных в организме человека и животных седалищный нерв (N. ischiadicus), он является продолжением передних ветвей LIV–SIII спинномозговых нервов. Нейропатия седалищного нерва характеризуется такими симптомами, как онемение, боли в бедре и голени, парез стопы в следствии чего невозможность нормально опираться на конечность, а также выпадение функции малоберцового и большеберцового нервов (повышенная чувствительность к внешним раздражителям (гиперестезия), анестезия всей голени и стопы, утрата ахиллова рефлекса, сухость кожи или гипергидроз, нарушение координации движений и т.д.). При разработке лекарственных средств для терапии НБС различной этиологии необходима модель, максимально точно отражающая развитие и симптомы реального заболевания.
Цель данной работы – сравнительная оценка эффективности моделирования НБС, созданного различными типами воздействия на седалищный нерв. В ходе эксперимента наиболее эффективным для моделирования НБС среди исследуемых механических методов воздействий на седалищный нерв оказалось лигирование нервного ствола и наложение металлической клеммы. Перспективнее всего для моделирования НБС среди исследуемых химических методов воздействий на седалищный нерв использовать инъекцию 37% перекиси водорода.
Введение
Боль – это неприятное сенсорное и эмоциональное переживание, связанное с истинным или потенциальным повреждением ткани или описанное терминами такого повреждения (по определению Международной ассоциации по изучению боли – IASP). Боль возникает в результате активации подмножества сенсорных нейронов, называемых ноцицепторами, при этом она эволюционировала как механизм обнаружения и защиты. Однако поражение или заболевание сенсорной системы может привести к нейропатической боли, которая не выполняет никакой защитной функции [1].
Выделяют два основных типа боли: ноцицептивную и нейропатическую. Их различия обусловлены источниками. Ноцицептивная боль является следствием активации рецепторов периферической нервной системы, болевыми стимулами в результате повреждения ткани; причина нейропатической боли – повреждение или дисфункция центральной нервной системы или периферических нервов [2].
Нейропатия – обобщающее название различных дегенеративно-дистрофических изменений периферических нервов. Ее причинами могут стать компрессия, механическое повреждение, интоксикация, нарушение кровоснабжения и питания нервных тканей.
Нейропатии бывают самыми разнообразными в зависимости от локализации процесса: нейропатия тройничного нерва, лучевого, локтевого, срединного, седалищного нервов и др. [3].
Одним из самых крупных нервов в организме человека и животных является седалищный нерв (N. ischiadicus), он считается продолжением передних ветвей LIV–SIII спинномозговых нервов у человека, более ограничен по протяженности своего начала (LIV–LVI) у крыс [4]. На уровне бедра от него отходят ветви к двуглавой мышце бедра (M. biceps femoris), полуперепончатой (M. semimembranosus) и полусухожильной мышцам (M. semitendinosus), которые сгибают голень и поворачивают ее наружу или внутрь. В верхнем отделе подколенной ямки седалищный нерв разделяется на большеберцовый (N. tibialis) и общий малоберцовый (N. peroneus communis) нервы, хотя их субэпиневральное обособление осуществляется обычно еще в полости малого таза [5, 6].
Нейропатия седалищного нерва – комплекс симптомов, сопровождающий заболевание, значительно ухудшающих качество жизни больного. Характерными признаками его являются онемение, боли в бедре и голени, парез стопы вследствии чего невозможно нормально опираться на конечность, а также выпадение функции малоберцового и большеберцового нервов (повышенная чувствительность к внешним раздражителям (гиперестезия), анестезия всей голени и стопы, утрата ахиллова рефлекса, сухость кожи или гипергидроз, нарушение координации движений и т.д.).
В литературе встречается множество методических подходов к моделированию нейропатического болевого синдрома (НБС) у лабораторных животных посредством повреждения седалищного нерва. Их можно разделить на 2 типа: механический и химический. Механическое нарушение структуры нерва осуществляется посредством оперативного вмешательства, химическое происходит вследствие повреждения нервной ткани при помощи инъекции химических веществ [7–9].
Цель данной работы – сравнительная оценка эффективности моделирования НБС, созданного различными типами воздействия на седалищный нерв.
Материал и методы
Подготовка к проведению исследования
Эксперимент проводили на 50 белых беспородных крысах-самцах массой 200–300 г, полученных из питомника ФГБУН «Научный центр биомедицинских технологий» ФМБА России, филиал «Андреевка» и прошедших 14-дневный карантин. Содержание и обращение с используемыми в эксперименте животными соответствовали директиве 2010/63/EU Европейского парламента и совета Европейского Союза от 22 сентября 2010 г. по охране животных, используемых в научных целях. Исследование было выполнено с соблюдением принципов «Европейской конвенции о защите позвоночных животных, используемых для экспериментов и других научных целей» (Страсбург, 1986).
Были сформированы группы животных, в каждой по 5 голов минимум. Группа соответствовала определенному типу травмирующих воздействий на седалищный нерв. Контролем служила интактная лапа для каждого из животных.
Периферический НБС у крыс моделировали путем проведения травмирующих воздействий на левый седалищный нерв на уровне подколенной ямки выше места его бифуркации на большеберцовый (N. tibialis) и малоберцовый (N. peroneus communis) нервы [10].
Техника проведения операции по моделированию НБС
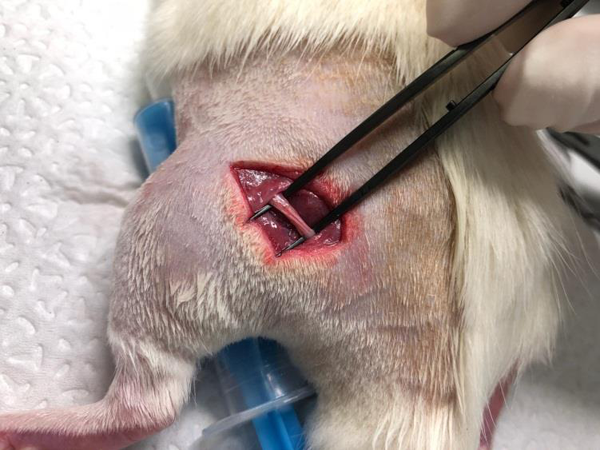
Операцию производили под общим ингаляционным наркозом с применением системы для проведения анестезии Combi-vet (Швейцария). В качестве анестетика использовали изофлуран в смеси с медицинским кислородом. Во избежание последствий анестезиологической гипотермии операцию осуществляли на подогреваемом хирургическом столике Combi-vet (Швейцария).
Первым этапом операции по моделированию НБС является обеспечение доступа к седалищному нерву: после подготовки операционного поля и обработки антисептическим средством производится разрез по проекционной линии седалищного нерва и его препарирование от окружающих тканей (рис. 1). Затем осуществляется травмирующее воздействие на седалищный нерв на уровне подколенной ямки. Заключительный этап – ушивание раны.
Способы травмирующих воздействий на седалищный нерв [11]:
I. Механический тип:
1) лигирование нерва хирургическим капроном в 1 месте;
2) лигирование нерва хирургическим капроном в 3 местах;
3) перерезка нерва с частичной эктомией нервного ствола (1–2 мм);
4) пресечение нерва с лигированием выше места надреза (краниально);
5) надсечение седалищного нерва в 3 местах;
6) наложение металлической клеммы на нервный ствол;
7) послойное сшивание пресеченного нервного ствола.
II. Химический тип:
1) инъекция 10% забуференного формалина в седалищный нерв (V=0,02 мл);
2) инъекция 37% перекиси водорода в седалищный нерв (V=0,02 мл);
3) инъекция 70% уксусной кислоты в седалищный нерв (V=0,02 мл).
Оценка нейропатического болевого синдрома
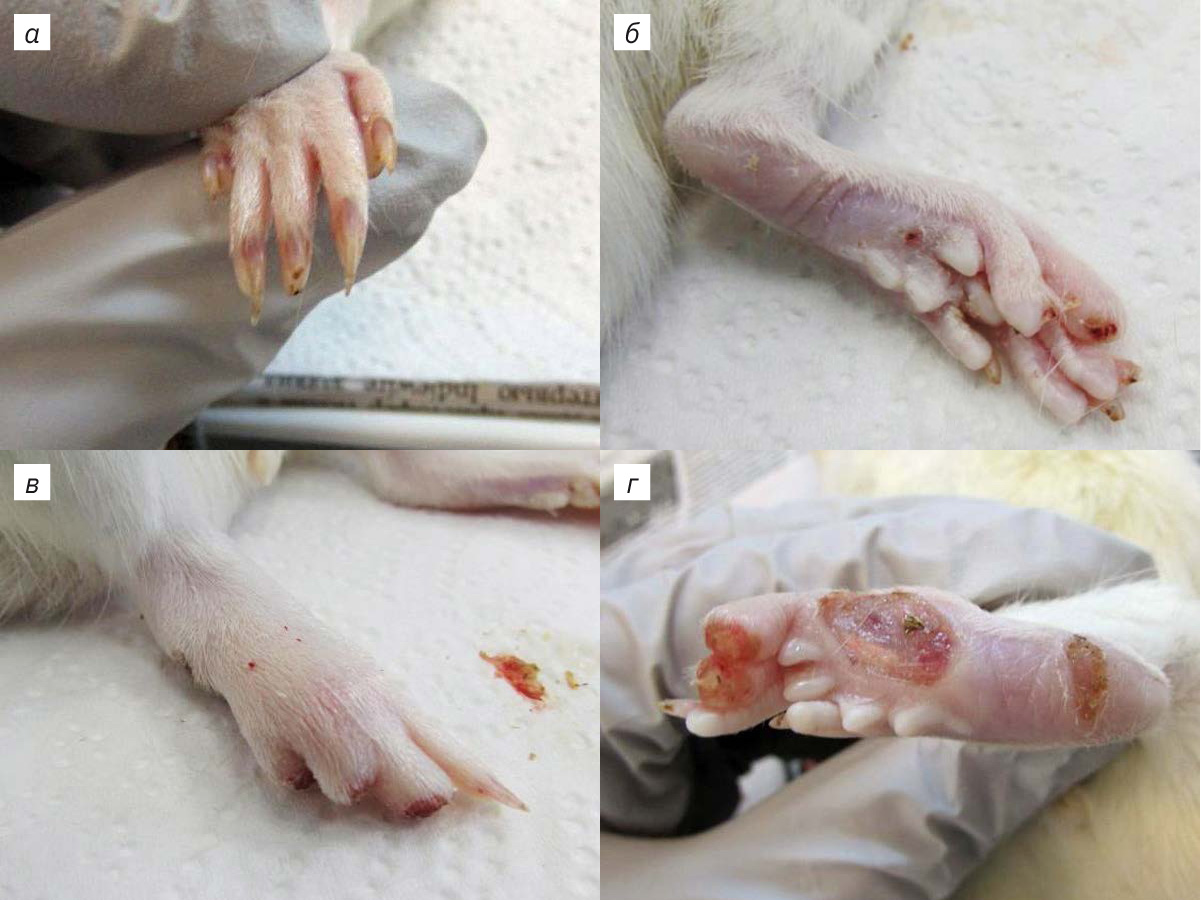
Характерными поведенческими проявлениями нейропатической боли у экспериментальных животных являются спонтанные приступы боли, аутотомия (поврежденного участка на оперированной конечности) и аллодиния. Они служат маркерами нейропатической боли и клиническим коррелятом сенситизации ноци-цептивных структур [12].

Оценка развития НБС проводилась по специфичным стимулонезависимым (аутотомия) и стимулозависимым (термическая аллодиния, механи-ческая и термическая гипералгезия) критериям.
Развитие болевого синдрома определяли по появлению признаков аутотомии на оперированной конечности (рис. 2). Интенсивность аутотомии оценивали по 11-балльной шкале: 1 балл – повреждение 1 когтя; 2, 3, 4 и 5 баллов – повреждение 2, 3, 4 и 5 когтей; 6 баллов – повреждение фаланги одного пальца; 7, 8, 9 и 10 баллов – повреждение фаланг соответственно на 2, 3, 4 и 5-м пальцах; 11 баллов – повреждение плюсневых костей. Динамику развития болевого синдрома у крыс наблюдали в течение 21 дня.

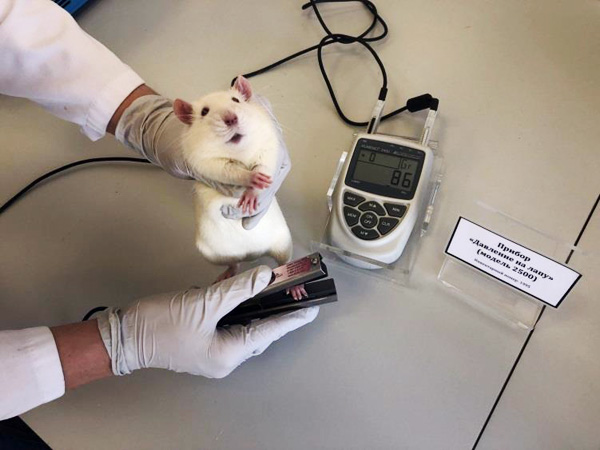
Интенсивность и динамику развития термической гипералгезии оценивали в «плантарном тесте» (на 7, 14 и 21-й дни после операции) с помощью прибора «Plantar test analgesia meter» (IITC Life Science, США), который фокусирует луч инфракрасного света на подошву лапы животного (рис. 3). Определяли термический порог реакции, вызывающий отдергивание лапы.
Интенсивность развития механической гипералгезии оценивали на 14-й день после операции с помощью аналгезиметра Digital Randall Selitto (IITC Life Science, США) (рис. 4), который обеспечивает плавное увеличение нагрузки до появления болевой реакции (оцениваемой по писку животного). Определяли болевой порог реакции, вызывающий отдергивание лапы [4].
Интенсивность и динамику развития термической аллодинии оценивали (на 7, 14 и 21-й дни после операции) с помощью теста «холодная пластина», в ходе которого животное помещали на пластину прибора Cold/hot plate analgesia meter (Columbus Instruments, США) (рис. 5), охлажденную до 0,5°С максимум на 7 мин. Измеряли число болевых реакций задней конечности со стороны повреждения седалищного нерва: облизывание и отдергивание. В случае отсутствия болевой реакции обеих лап у животного в течение времени тестирования фиксировали полную аналгезию.
Обработка данных выполнена с использованием пакетов статистических программ MO Excel (Microsoft, США), SPSS 13.0 для Windows (SPSS, США).
Результаты и обсуждение
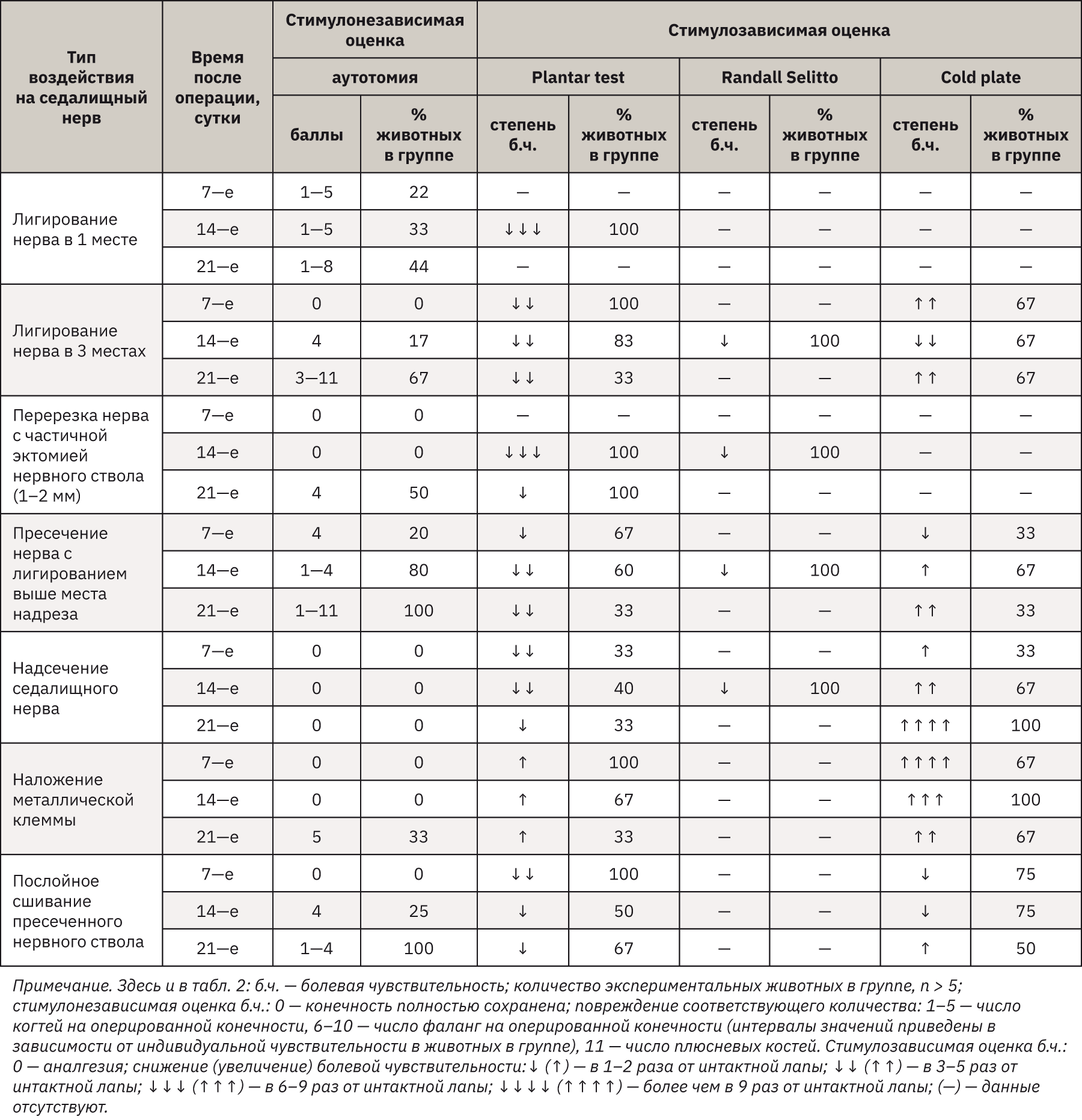
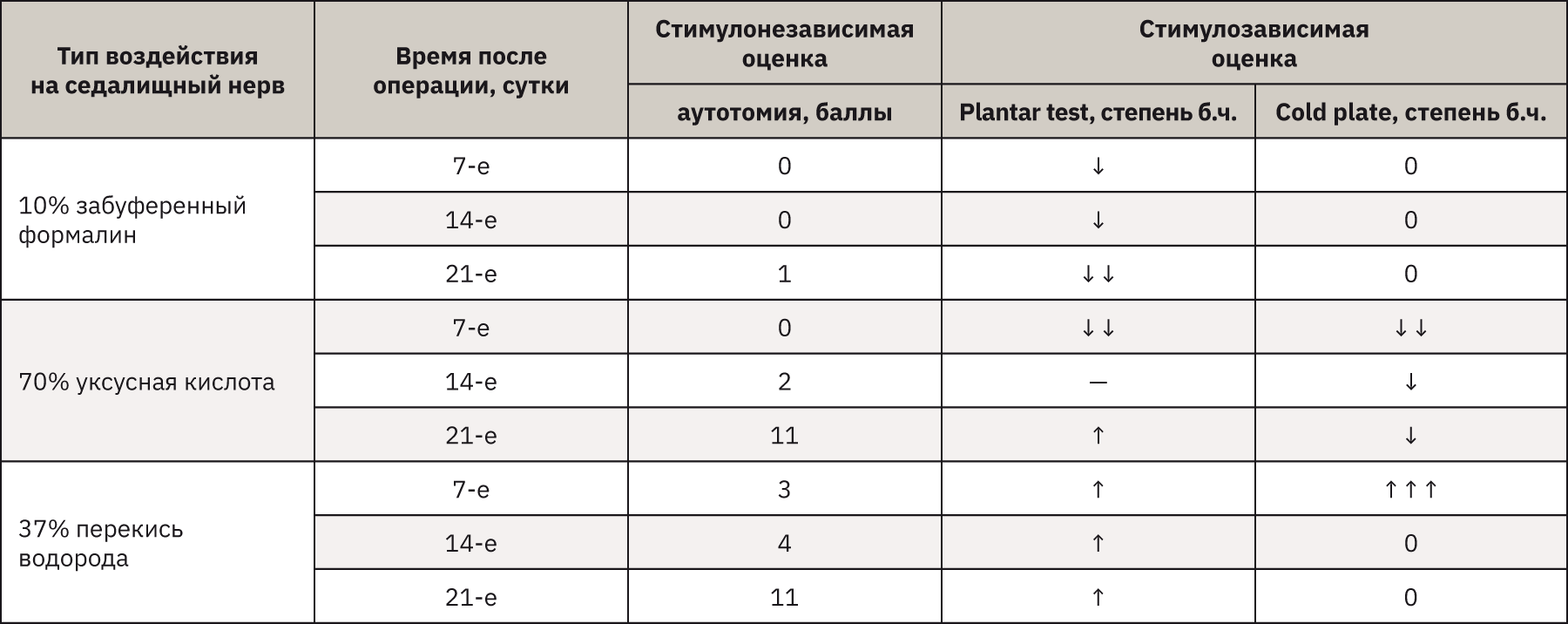
В результате проведенного исследования были получены данные, представленные в табл. 1 и 2.
Оценка НБС при механических типах воздействия на седалищный нерв
Из данных, полученных при изучении влияния механических типов воздействия на седалищный нерв, видно, что при лигировании седалищного нерва как в одном, так и в трех местах происходит интенсивное последовательное увеличение количества (% животных в группе) и степени проявления аутотомии (баллы) у исследуемых животных, что ясно свидетельствует о развитии НБС. Вместе с этим при лигировании нервного ствола в трех местах наблюдается уменьшение количества животных с гипоалгезией со 100% на 7-е сутки до 33% к 21-м. Термическая аллодиния при данном типе воздействия на нерв в равной степени выражена на 7-е и 21-е сутки эксперимента. На 14-е сутки наблюдается снижение болевой чувствительности на «холодной пластине».
При перерезке седалищного нерва с частичной эктомией нервного ствола происходит несущественное развитие НБС (аутотомия составляет 4 балла на 21-е сутки эксперимента). У животных данной группы наблюдаются признаки аналгезии, следовательно, данный тип операции не подходит для моделирования нейропатии.
В то же время при пресечении нерва с лигированием выше места надреза (ближе к тазу) наблюдалось интенсивное развитие болевого синдрома (аутотомии), достигающего максимального значения на 21-е сутки. Балльная оценка интенсивности наблюдаемой в «плантарном тесте» гипоалгезии к 14-м суткам увеличилась в 3–5 раз по сравнению с таковой интактной конечности. Термическая аллодиния начинала проявляться на 14-е сутки исследования у ⅔ животных, к 21-м суткам порог аллодинии снижался в 5 раз по сравнению с выраженностью реакции интактной лапы, но лишь у ⅓ животных.
При надсечении седалищного нерва в течение всего времени наблюдений повреждения оперированной конечности не происходит, из чего можно сделать вывод об отсутствии гиперактивации нервной системы. Наблюдаемая при данном типе воздействия на нерв гипоалгезия к 21-м суткам эксперимента снизилась в 2 раза, сохранившись только у ⅓ животных. Вместе с тем установлено равномерное увеличение степени гипералгезии в тесте «холодная пластина», достигшее максимума к 21-м суткам у всех животных данной группы. Вскрытие по окончании эксперимента показало, что иннервация нервного ствола на оперированной конечности сохранена. Надсечение седалищного нерва является достаточно спорной моделью НБС в связи с проблемой валидации техники исполнения: несистемным характером надсечения нервных стволов, глубиной надреза и сложностью оценки степени повреждения.
Травмирование седалищного нерва путем наложения металлической клеммы не дало ярко выраженного развития аутотомии, максимальное значение в группе составило 5 баллов у 1/3 животных. Однако только данный тип механического воздействия на нерв дал положительную гипералгезию у 100% животных на 7-е сутки, которая к концу исследования сохранилась у ⅓ животных. Также в течение всего времени эксперимента у 67% животных данной группы наблюдалось максимальное проявление аллодинии.
При послойном сшивании пресеченного нервного ствола в группе наблюдается последовательное увеличение числа животных с признаками аутотомии. Гипоалгезия регистрируется на протяжении всего теста с максимумом на 7-е сутки. Термическая аллодиния при данном типе воздействия на нерв выявлена лишь к 21-м суткам эксперимента у половины животных в группе.
Согласно результатам опыта, среди исследуемых механических воздействий на нерв наиболее эффективными для моделирования НБС является лигирование седалищного нерва независимо от количества накладываемых лигатур и наложение металлической клеммы, дающие последовательное увеличение симптоматики аутотомии, интенсивности аллодинии на «холодной пластине» и разнонаправленность изменений болевой чувствительности в «плантарном тесте».
Отмечена также эффективность метода перерезки седалищного нерва с лигированием выше места надреза, что можно связать с развитием процесса формирования НБС по типу лигирования.
Необходимо отметить, что данные, полученные при оценке интенсивности развития механической гипералгезии с помощью аналгезиметра Digital Randall Selitto, невозможно однозначно интерпретировать в связи с недостаточной чувствительностью метода. В дальнейшем для оценки интенсивности развития механической гипералгезии планируется использование волосков Фрея.
Оценка НБС при химических типах воздействия на седалищный нерв
При химических типах воздействия на седалищный нерв было выявлено, что инъекция 10% забуференного формалина не приводит к развитию аутотомии, однако становится причиной нарастающей гипоалгезии в «плантарном тесте» и анестезии на «холодной пластине» в течение всего времени исследования.
Инъекция 70% уксусной кислоты обеспечивает развитие аутотомии, достигающей максимума к 21-м суткам. Болевая чувствительность на «холодной пластине» в этом случае снижена. В «плантарном тесте» отмечаются разнонаправленные изменения болевой чувствительности.
При введении 37% перекиси водорода наблюдается постепенное развитие аутотомии с максимумом симптоматики на 21-е сутки. Термическая гипералгезия в «плантарном тесте» наблюдалась на уровне 1–2 баллов в течение всего исследования. Признаки аллодинии в тесте «холодная пластина» были ярко выражены лишь на 7-е сутки исследования.
Согласно полученным результатам, среди исследуемых химических воздействий на нерв наиболее эффективным для моделирования НБС является инъекция 37% перекиси водорода при проведении исследований длительностью не более 7 сут.
Все сказанное позволяет определить наиболее эффективные для моделирования НБС способы воздействия на седалищный нерв.
Заключение
По результатам изложенного сделаны следующие выводы:
- лигирование нервного ствола и наложение металлической клеммы – наиболее надежный способ среди исследуемых механических методов воздействия;
- инъекция 37% перекиси водорода – наиболее эффективный способ среди исследуемых химических методов воздействия.
Вклад авторов
Н.В. Александровская – существенный вклад в концепцию работы, написание статьи для публикации, утверждение окончательного варианта статьи для публикации, согласие нести ответственность за все аспекты работы;
А. А. Круглова – разработка дизайна метода, проведение экспериментальной работы, сбор и анализ данных, работа с литературными источниками, участие в написании статьи для публикации, подготовка фотоматериалов для статьи.
Благодарности
Работа выполнена без спонсорской поддержки.
Сведения о конфликте интересов
Авторы заявляют об отсутствии конфликта интересов.
Список источников
- Smith E.S.J. Advances in understanding nociception and neuropathic pain // J Neurol. – 2018. – Vol. 265 (2). – P. 231-238. DOI: 10.1007/s00415-017-8641-6.
- Dubin A.E., Patapoutian A. Nociceptors: the sensors of the pain pathway // J Clin Investig. – 2010. – Vol. 120. – P. 3760-3772. doi: 10.1172/JCI42843.
- Baheti D.K. Neuropathic pain-recent trends in management // Pain Management Clinic, Bombay Hospital Institute of Medical Sciences, Mumbai. PMID: 12022219
- Barbosa A.B.M., Santos P.V.D., Targino V.A., Silva N.A., Silva Y.C.M., Gomes FB, Assis TO. Sciatic nerve and its variations: is it possible to associate them with piriformis syndrome? // Arq Neuropsiquiatr. – 2019. – Vol. 23 №77(9). – P. 646-653. doi: 10.1590/0004-282X20190093. eCollection 2019.
- Нервные болезни: учебник для студентов медицинских вузов / под ред. М. М. Одинака. – СПб: СпецЛит, 2014. – 526 с. [Nervnye bolezni: uchebnik dlya studentov meditsinskikh vuzov / pod red. M. M. Odinaka. – SPb: SpeTSLit, 2014. – 526 p. (In Russ.)].
- Анатомия крысы (Лабораторные животные) / Под ред. Академика А. Д. Ноздрачева. – СПб.: Изд-во «Лань», 2001. – 464 с. [Anatomiya krysy (Laboratornye zhivotnye) / Pod red. Akademika A. D. Nozdracheva. – SPb.: Izd-vo «Lan'», 2001. – 464 p. (In Russ.)].
- Burma NE, Leduc-Pessah H, Fan CY, Trang T. Animal models of chronic pain: advances and challenges for clinical translation: animal models of chronic pain // J Neurosci Res. – 2017. – Vol. 95. – P. 1242-1256. doi: 10.1002/jnr.23768.
- Miller J.J., Aoki K., Moehring F., Murphy C.A., O'Hara C.L., Tiemeyer M., Stucky C.L., Dahms N.M. Neuropathic pain in a Fabry disease rat model // JCI Insight. – 2018. – Vol. 22 №3(6). – P. 1-19. doi: 10.1172/jci.insight.99171. PMID: 29563343
- Абдулкина Н.Г., Левицкий Е.Ф., Кочегуров B.А. Алгоритмизация физиотерапии травм периферических нервов. – Томск: Изд-во «Печатная мануфактура», 2007. – 248 с. [Abdulkina N. G., Levitskii E. F., Kochegurov B. A. Algoritmizatsiya fizioterapii travm perifericheskikh nervov. – Tomsk: Izd-vo «Pechatnaya manufakturA», 2007. – 248 p. (In Russ.)].
- Руководство по проведению доклинических исследований лекарственных средств. Часть первая / Под ред. А.Н. Миронова. – М.: Гриф и К, 2012. – 944 с. [Rukovodstvo po provedeniyu doklinicheskikh issledovanii lekarstvennykh sredstv. Chast' pervaya / Pod red. A.N. Mironova. – M.: Grif i K, 2012. – 944 s.]
- Картищенко Н. Н. Основы биомоделирования. – М.: Изд-во ВПК, 2004. – 608 с. [Kartishchenko N. N. Osnovy biomodelirovaniya. – M.: Izd-vo VPK, 2004. – 608 s. (In Russ.)].
- Крупаткин А.И. Клиническая нейроангиофизиология конечностей (периваскулярная иннервация и нервная трофика). – М.: Научный мир, 2003. – 328 с. [Krupatkin A. I. Klinicheskaya neiroangiofiziologiya konechnostei (perivaskulyarnaya innervatsiya i nervnaya trofika). – M.: Nauchnyi mir, 2003. – 328 p. (In Russ.)].




