Оценка аддиктивного потенциала препарата Кортексин® в доклинических исследованиях
Абашева Д.А. , Калатанова А.В., Карпенко М.Н., Куркин Д.В., Клименко В.М. , Бакулин Д.А., Морковин Е.И. , Ивлева И.С. , Пестерева Н.С. , Майстренко В.А. , Абросимова Е.Е. , Ковалев Н.С. , Дубровина М.А. Оценка аддиктивного потенциала препарата Кортексин® в доклинических исследованиях. Лабораторные животные для научных исследований. 2020; 4. https://doi.org/10.29296/2618723X-2020-04-03
Резюме
Исследование лекарственной зависимости – обязательный этап доклинических исследований лекарственных препаратов, проявляющих активность в отношении центральной нервной системы. Применение комплексного подхода при планировании программы оценки аддиктивного потенциала лекарственного средства позволяет не только соблюсти регуляторные требования, но и в полной мере оценить риски развития лекарственной зависимости, существующие для препаратов, проникающих через гематоэнцефалический барьер.
Цель настоящего исследования – оценка аддиктивного потенциала полипептидного препарата Кортексин®, проникающего через гематоэнцефалический барьер. В рамках первого этапа оценки аддиктивного потенциала лекарственного средства показано, что препарат не связывается с ассоциированными с привыканием опиоидными, серотониновыми и дофаминовыми рецепторами. Исследование in vivo включало 3 эксперимента: тест внутривенного самовведения на аутбредных мышах, тест предпочтения места и модель хронического абстинентного синдрома на аутбредных крысах. Кортексин® вводили животным в терапевтической (1 мг/кг/сут) и супратерапевтических дозах (3 и 30 мг/кг/сут). В качестве отрицательного контроля использовали D-маннитол или физиологический раствор, а в качестве положительного контроля – этиловый спирт. Установлено, что при курсовом введении препарата Кортексин® в дозе 1 мг/кг у животных не вырабатывалась условно-рефлекторная реакция предпочтения места и не изменялась двигательная активность. В тесте внутривенного самовведения количество инфузий было схожим с таковым в группе плацебо, а R-критерий не отличался от нуля при введении всех исследуемых доз. В результате 14-дневноговведения препарата Кортексин® у животных через 24 ч после отмены не развивался абстинентный синдром, а также не изменялась ориентировочно-исследовательская или двигательная активность в тесте «открытое поле» через 48 ч после отмены препарата. В целом в ходе доклинического исследования установлено, что исследуемый препарат Кортексин® не обладает аддиктивным потенциалом или аверсивными свойствами. Таким образом, по результатам проведения программы доклинических исследований показано, что риск развития лекарственной зависимости при клиническом применении препарата Кортексин® минимален и проведение расширенных доклинических испытаний не требуется.
Введение
Согласно Руководству по доклиническим исследованиям безопасности, утвержденному решением ЕЭК от 26 ноября 2019 г. [3], для лекарственных препаратов, проявляющих активность в отношении центральной нервной системы (ЦНС), должны быть проведены доклинические исследования, обосновывающие необходимость клинической оценки аддиктивного потенциала. Лекарственная зависимость связана с применением различных препаратов (например, опиоидов, седативных средств, психостимуляторов) и представляет собой серьезное нежелательное явление, которое необходимо учитывать при оценке рисков. В то же время аддиктивный потенциал сложен для изучения на клиническом этапе, так как требует длительного применения препарата, при этом признаки патологического пристрастия чаще развиваются после окончания курсового применения. В связи с этим доклинические исследования аддиктивного потенциала лекарственных средств особенно важны для прогнозирования нежелательных явлений при клиническом применении.
Кортексин® – ноотропный препарат, представляющий собой комплекс низкомолекулярных водорастворимых полипептидных фракций, полученных из коры головного мозга крупного рогатого скота и свиней. В составе комплексной терапии он был одобрен для применения при различных патологиях ЦНС у взрослых и детей. Кортексин® относится к модуляторам нейротрофиновой системы и дает ноотропный, нейропротекторный, антиоксидантный и тканеспецифический эффект, воздействуя на множественные терапевтические мишени [1, 2].
В исследовании методом радиоактивной метки изотопом йода 125I установлено, что Кортексин® проникает через гематоэнцефалический барьер, что создает потенциальный риск возникновения лекарственной зависимости. Для подтверждения либо опровержения данной гипотезы разработана программа оценки аддиктивного потенциала препарата Кортексин®. В рамках первого этапа оценки возможной зависимости проведено исследование лиганд-рецепторного взаимодействия, по результатам которого показано, что Кортексин® не связывается с ассоциированными с привыканием опиоидными, серотониновыми и дофаминовыми рецепторами. Значимое взаимодействие выявлено с ГАМК-рецепторами (GABAA1) и рецепторами глутамата (каинатными, AMPA-, mGluR1 и mGluR5), не связанными с развитием зависимости. Таким образом, выявленные in vitro фармакодинамические свойства препарата Кортексин® не указывали на наличие аддиктогенного риска. Для получения исчерпывающей информации об аддиктивном потенциале препарата, а также с целью соблюдения регуляторных требований в рамках второго этапа было проведено исследование in vivo.
Цель настоящего исследования – доклиническая оценка аддиктивного потенциала препарата Кортексин® in vivo у грызунов.
Материал и методы
Объектом испытания послужил Кортексин® лиофилизат для приготовления раствора для внутримышечного введения, 10 мг . Кортексин® вводили животным в терапевтической (1 мг/кг/сут) и супратерапевтических (3 и 30 мг/кг/сут) дозах. В качестве отрицательного контроля использовали D-маннитол или физиологический раствор, а в качестве положительного контроля – этиловый спирт.
Доклиническую оценку риска развития зависимости проводили на грызунах, поскольку профиль метаболитов и мишени действия препарата Кортексин® у грызунов сходны с таковыми у человека. Характеристика животных представлена в табл. 1.
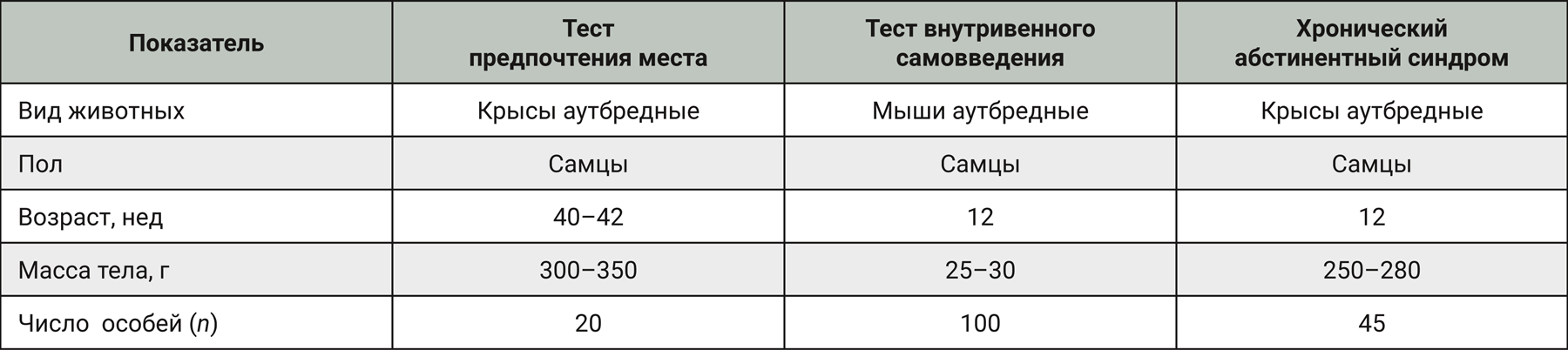
Все эксперименты выполняли в соответствии с законодательством Российской Федерации и техническими стандартами Евразийского экономического союза по надлежащей лабораторной практике (ГОСТ Р 53434-2009 [4], ГОСТ Р 51000.4-2011 [5]). Запланированные процедуры с использованием животных одобрены независимыми локальными этическими комитетами. Для ограничения боли и страданий экспериментальных животных применяли надлежащие меры согласно Директиве 2010/63/EU Европейского парламента и совета Европейского союза от 22 сентября 2012 г. по охране животных, используемых в научных целях [6].
Согласно руководству The Guide for Care and Use of Laboratory Animals [7], во всех экспериментах животных содержали при температуре 23 ± 3°C и влажности 30–70%, со сменяющимся циклом день/ночь (12/12 ч) и неограниченным доступом к стандартному корму/воде.
Экспериментальный дизайн
Тест предпочтения места. Методика эксперимента по выработке условно-рефлекторной реакции предпочтения места (УРПМ) описана подробно в работе Y. Sun и соавт. [8]. Исследование включало 3 этапа:
- адаптация животных к экспериментальной установке (2 сессии по 15 мин/сут в течение 3 дней);
- выработка условного рефлекса на помещение в одну из камер с альтернативным паттерном пола и стенок (2 сессии по 15 мин/сут в течение 6 дней);
- оценка воспроизведения условного рефлекса (3 сессии через 2, 10 и 18 дней после завершения выработки условного рефлекса).
Для изучения поведения предпочтения места использовали установку «Тест предпочтения места» c двумя боковыми и одной центральной камерой, сообщающимися между собой; на стенах боковых камер закреплены сменные панели из вспененного поливинилхлорида с нанесенными на него контрастными узорами, позволяющими животным дифференцировать камеры.
Кортексин® вводили крысам из опытной группы на втором этапе исследования (с 4-го по 9-й день исследования, после адаптации животных к экспериментальной установке) внутримышечно в дозе 1 мг/кг/сут (соответствующей крысиной «терапевтической дозе») утром или вечером, каждый день чередуя введение препарата с введением плацебо. Животным из контрольной группы и утром, и вечером вводили плацебо. Массу тела экспериментальных животных регистрировали непосредственно перед использованием препаратов для определения объемов введения.
На третьем этапе испытания оценивали воспроизведение выработанного условного рефлекса, регистрируя при помощи видеозаписи следующие показатели: длительность пребывания в каждом из отсеков установки; общую длительность двигательной активности; количество переходов между отсеками; соотношение времени, проведенного в подкрепляемом отсеке, к общему времени пребывания в альтернативных (боковых) камерах. Дополнительно рассчитывали коэффициент предпочтения, численно равный процентному отношению разности времени пребывания в ассоциированном с препаратом отсеке и альтернативном отсеке к сумме этих показателей.
Тест внутривенного самовведения. По завершении периода акклиматизации проведено исходное тестирование ориентировочно-исследовательской активности всех животных в тесте «открытое поле». Активность животных оценивали по количеству вертикальных стоек, выходов в центр арены и актов обнюхивания норок; 20 мышей с аномально высокой или низкой активностью были отбракованы, остальные животные разделены на подгруппы по уровню ориентировочно-исследовательской активности. Затем животные из каждого кластера активности распределены на 5 групп по 16 особей в каждой так, чтобы средняя масса тела животных статистически не отличалась между группами.
Введение препаратов мышам осуществляли внутривенно в хвостовую вену ежедневно 1 раз в день на протяжении 14 дней. Для определения объемов введения ежедневно измеряли массу тела животных. Во 2, 3 и 4-й группах животные получали 1, 3 и 30 мг/кг тестируемого препарата соответственно; 2 другие группы получали контрольное вещество. В качестве отрицательного контроля использовали физиологический раствор (1-я группа), в качестве положительного контроля выработки реакции внутривенного самовведения (РВС) – этиловый спирт в дозе 1,25 г/кг (5-я группа). Каждую дозу препарата вводили в 10 мкл инфузионного раствора.
Перед выработкой РВС каждое животное на протяжении 4 дней приучали к экспериментальной установке путем высаживания в экспериментальную камеру и фиксации хвоста (длительность каждой сессии 30 мин). Животных приучали выглядывать в отверстия путем предъявления через них пищи. На 11-й день эксперимента оценивали выработку РВС. Экспериментальная установка состояла из двух смежных камер, позволявших животным сохранять относительную свободу движений, в том числе свободно выглядывать в отверстие на передней стенке. Передняя стенка каждого бокса имела отверстие, снабженное датчиком для регистрации реакции выглядывания; фотодатчик на передней стенке камеры был связан с компьютером, который управлял работой инфузионного насоса с шаговыми двигателями, осуществляя кратковременную инъекцию препарата в ответ на выглядывание мыши в определенное отверстие. В задней стенке каждого бокса была прорезана вертикальная щель для вывода хвоста, который фиксировали липкой лентой [9].
Для выработки РВС использовали пары особей, одна из которых являлась активной мышью (АМ), ее выглядывания в отверстие приводили к внутривенной самоинфузии исследуемого раствора, а также к введению той же дозы в вену второй, контрольной мыши (КМ). Последняя, таким образом, получала инфузии исследуемого соединения в том же режиме, что и АМ, но это введение не зависело от собственной ориентировочно-исследовательской реакции. В результате обе особи получали одинаковое число инъекций с одинаковым распределением во времени (т.е. одинаковую дозу препарата), что позволяло при оценке эффекта и сравнении данных у АМ и КМ уравнять влияние препаратов на двигательную и исследовательскую активность.
Заключение о положительно-подкрепляющем эффекте исследуемого препарата основывали на расхождении количества выглядываний АМ и КМ. Если за период сессии количество выглядываний АМ превышало таковое у КМ, то делали заключение о положительно-подкрепляющем эффекте препарата, в противоположном случае эффект соединения расценивали как аверсивный. Для визуализации полученных данных вычисляли R-критерий (логарифм соотношения количества выглядываний АМ и КМ) и строили кривую зависимости концентрация–эффект. Кроме того, сравнивали количество инфузий, полученных животными в каждой группе, а внутри каждой группы оценивали количество выглядываний АМ в подкрепляемое и неподкрепляемое отверстия.
Исследование на модели хронического абстинентного синдрома. Все манипуляции по выработке УРПМ проводили согласно методическим рекомендациям [9]. С 11-го по 14-й день эксперимента животных помещали в экспериментальную установку для фармакологического обусловливания. На 15-й день (через 24 ч после последнего обусловливания) проводили заключительное тестирование выработки УРПМ. Для этого из камеры вынимали перегородку между отсеками и в течение 15 мин регистрировали время нахождения в отсеках и количество переходов из одного отсека в другой. Время, проводимое в подкрепляемом отсеке, сравнивали со временем нахождения в отсеке, ассоциированном с физиологическим раствором. Положительное значение разности двух величин расценивали как выработку УРПМ, а отрицательное – как условно-рефлекторную реакцию избегания места (УРИМ). На 16-й день эксперимента (на 2-й день после отмены препарата) проводили тестирование в установке «открытое поле». В эксперименте оценивали наличие абстинентного синдрома, горизонтальную и вертикальную двигательную активность животных, норковый рефлекс.
Статистическая обработка данных
Обработку данных осуществляли с использованием пакета программ Statistica 6.0/10.0 (StatSoft, США), Prism 6 (GraphPad Software Inc., США). Нормальность распределения проверяли критерием Колмогорова и Шапиро–Уилка. Для регистрируемых количественных переменных в случае нормальности распределения рассчитывали среднее значение параметра в группе и ошибку среднего, в остальных случаях вычисляли медиану и значения верхнего и нижнего квартилей. Данные контрольных и экспериментальных групп подвергали статистической оценке с использованием параметрических (дисперсионный анализ, post-hoc-метод наименьшей значимой разности Фишера и Ньюмена–Кейлса) и непараметрических (Краскела–Уоллиса, Ньюмена–Кейлса–Уилкоксона) критериев. Различия считали статистически значимыми при р <0,05.
Результаты и обсуждение
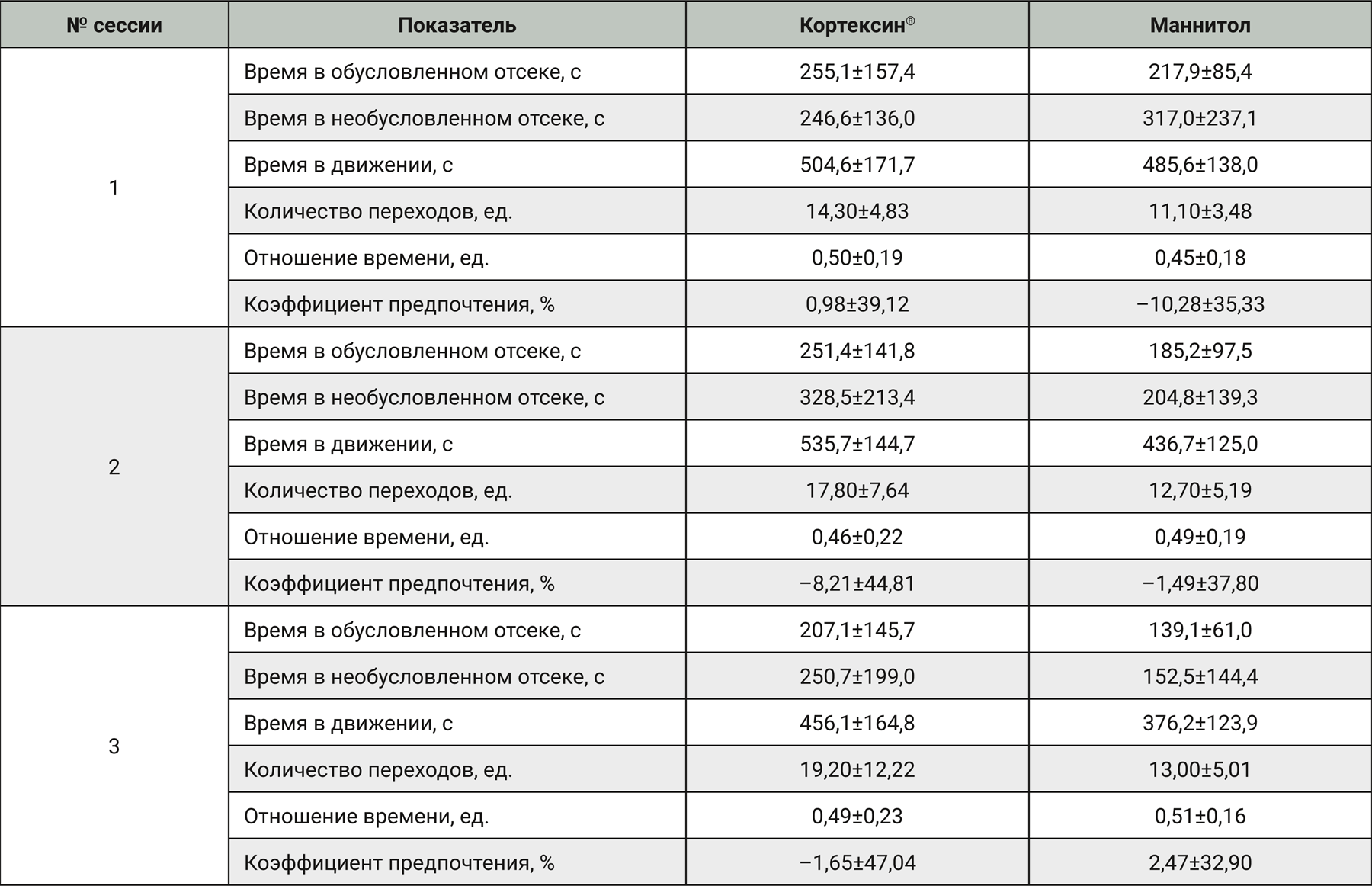
В тесте предпочтения места при сравнении крыс, получавших тестируемый препарат, с животными из группы плацебо отклонений в поведении и физическом состоянии признаков местно-раздражающего действия препарата и прочих нежелательных явлений не наблюдали. При проверке условного рефлекса у животных из обеих групп не отметили предпочтения какого-либо из альтернативных отсеков установки: ни по одному из измеряемых показателей значимых межгрупповых различий не выявили (p>0,05 в каждом из случаев). Время, проведенное в обусловленном и необусловленном отсеках установки, было сходным в группе контроля и группе тестируемого препарата. Различий в уровне двигательной активности и количестве переходов между отсеками не наблюдали. Соотношение времени, проведенного в подкрепляемом отсеке, к общему времени пребывания в парных отсеках установки у крыс из опытной группы также существенно не отличалось от показателя, зарегистрированного у животных из контрольной группы. В обеих группах это отношение было близко к 0,5, а значения коэффициента предпочтения находились в диапазоне от -50 до 50% в большинстве случаев, причем среднее значение было близко к нулю, что свидетельствует об отсутствии выраженных стимульных или аверсивных свойств у препарата.
Средние арифметические значения и стандартные отклонения измеренных показателей для группы, получавшей Кортексин®, и группы плацебо представлены в табл. 2.
В тесте внутривенного самовведения курсовое введение препарата Кортексин® во всех дозах в течение 14 дней не привело к значимому изменению массы тела животных по сравнению с группами отрицательного или положительного контроля.
Медианы количества инфузий, полученных животными за 30 мин наблюдения в тесте РВС, были сопоставимы в 1–4-й группах, отличие от этих групп наблюдалось только у животных положительного контроля (5-я группа). Данные представлены в табл. 3.

При анализе количества выглядываний АМ в подкрепляемое и неподкрепляемое отверстия значимое преобладание таковых в подкрепляемое отверстие было отмечено только в 5-й группе (p<0,02), в остальных группах таких выглядываний в оба отверстия было примерно одинаковым. Данные суммированы в табл. 4.
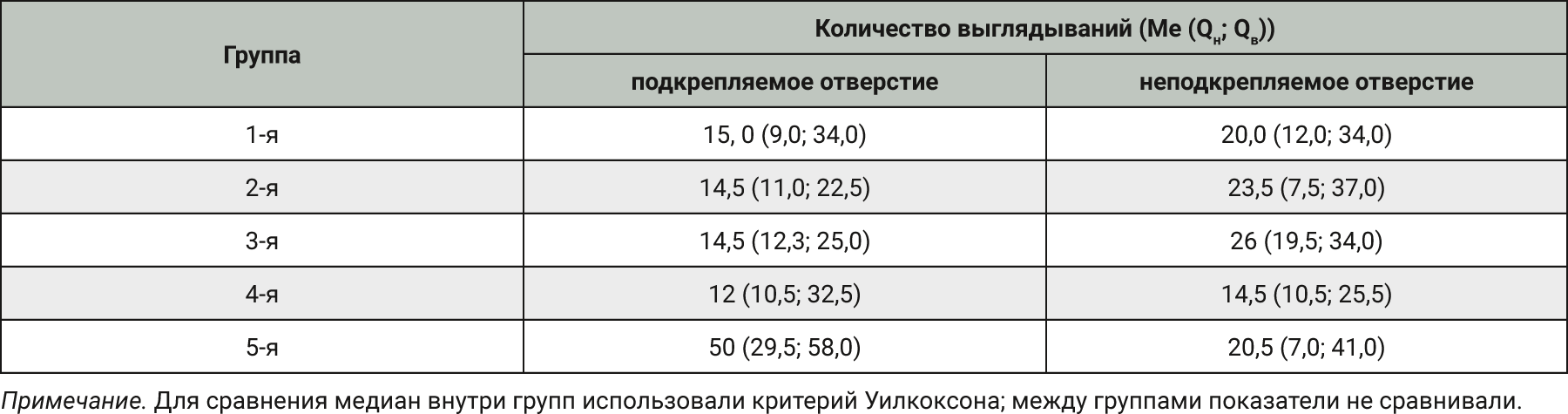
Показано, что только в группе введения этилового спирта количество выглядываний в подкрепляемое отверстие было достоверно выше по сравнению с таковым в неподкрепляемое отверстие.
Для выявления дозозависимого эффекта тестируемого препарата на выработку РВС была построена кривая зависимости концентрация–эффект. Как известно, при наличии у препарата аддиктивного потенциала кривая зависимости концентрация–эффект должна иметь куполообразную форму [9]. В данном случае в контрольной группе и во всех группах, получавших Кортексин®, значение R-критерия не отличалось от нуля (р1= 0,351; р2 = 0,780; р3= 0,063; р4= 0,880), что позволяет заключить, что тестируемый препарат не обладает аддиктивным потенциалом. Кривая зависимости концентрация–эффект показана на рисунке.
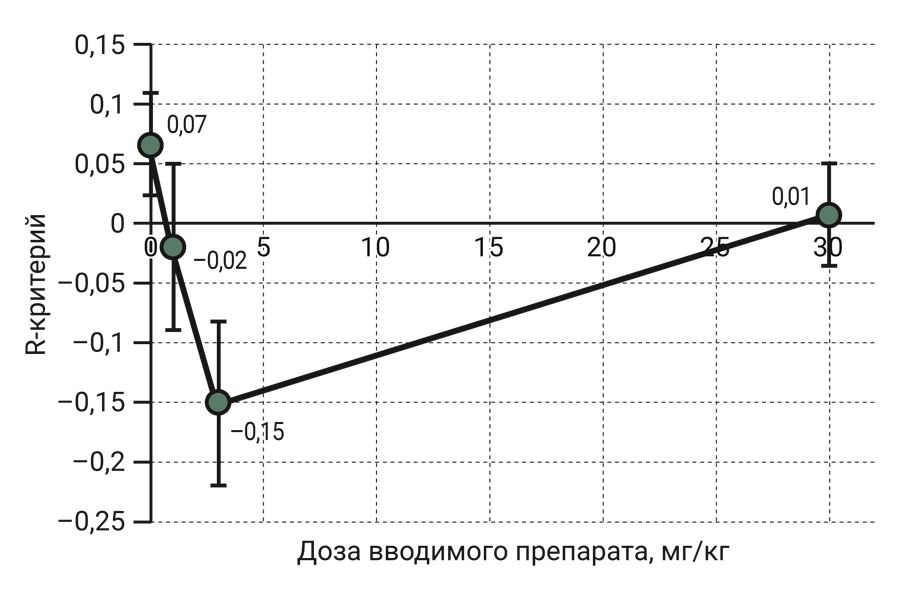
Кривая зависимости концентрация–эффект тестируемого препарата при выработке РВС (данные, рассчитанные по 4 парам животных в каждой группе, представлены как средние значения R-критерия ± ошибка среднего).
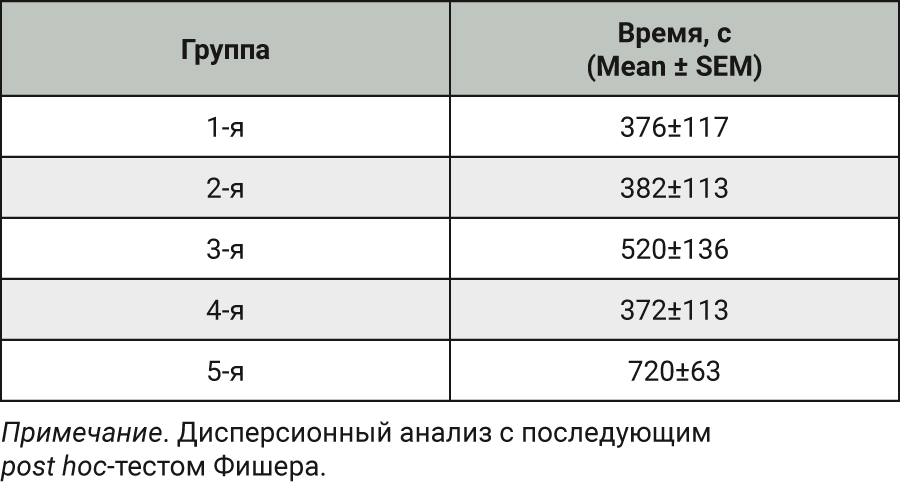
В исследовании на модели хронического абстинентного синдрома курсовое введение препарата Кортексин® во всех дозах в течение 14 дней не привело к значимому изменению массы тела животных по сравнению с группами отрицательного или положительного контроля.
При анализе времени, проведенного животными в подкрепляемом отсеке камеры для выработки УРПМ,
в 5-й группе время нахождения в такой камере было достоверно выше, чем в 1, 2 и 4-й группах (p <0,04). По данному показателю группы тестируемого препарата не отличались от группы, получавшей физиологический раствор, что указывает на отсутствие развития у животных абстинентного синдрома в ответ на отмену введения Кортексина®. Данные представлены в табл. 5.
Кроме этого, сравнивали число переходов между подкрепляемой и неподкрепляемой камерой в тесте выработки УРПМ. При этом значимых различий между группами не выявлено (данные не показаны). Схожесть числа переходов в группе, получавшей этиловый спирт, с остальными группами объясняется тем, что признаки синдрома отмены, в том числе ажитация, развиваются только при более длительных курсах введения и бóльших дозах этанола [10, 11].
При оценке ориентировочно-исследовательской и двигательной активности крыс в тесте «открытое поле» через 48 ч после отмены тестируемого препарата значимых различий между группами также не отмечалось (данные не показаны). Поскольку количество стоек с упором, норок, вертикальных стоек и обнюхиваний в 1–4-й группе было сопоставимо, следует сделать вывод, что введение тестируемого препарата во всех дозах не привело к изменению ориентировочно-исследовательской активности по сравнению с группой плацебо. Схожие показатели количества локомоций и длины пройденного пути в 1–4-й группе говорят об отсутствии изменений в двигательной активности при отмене тестируемого препарата по сравнению с группой плацебо.
Заключение
По результатам доклинического исследования в тестах предпочтения места у крыс, внутривенного самовведения у мышей и на модели хронического абстинентного синдрома был сделан следующий вывод: исследуемый препарат Кортексин® не обладает аддиктивным потенциалом или аверсивными свойствами.
Таким образом, на основании результатов исследования, а также данных исследования лиганд-рецепторного взаимодействия показано, что риск развития лекарственной зависимости при клиническом применении препарата Кортексин® минимален и проведение расширенных доклинических испытаний не требуется.
Вклад авторов
Д.А. Абашева – написание оригинального текста статьи.
А.В. Калатанова – написание оригинального текста статьи, планирование исследований, методология, обработка данных, обсуждение результатов, редактирование статьи.
М.Н. Карпенко – критический пересмотр содержания статьи, планирование исследований, методология, обработка данных, обсуждение результатов, редактирование статьи, сбор, анализ или интерпретация результатов работы.
Д.В. Куркин – критический пересмотр содержания статьи, планирование исследований, методология, обработка данных, обсуждение результатов, редактирование статьи, сбор, анализ или интерпретация результатов работы.
В.М. Клименко – критический пересмотр содержания статьи, планирование исследований, методология, обработка данных, обсуждение результатов, редактирование статьи, сбор, анализ или интерпретация результатов работы.
Д.А. Бакулин – планирование исследований, методология, обработка данных, обсуждение результатов, редактирование статьи, сбор, анализ или интерпретация результатов работы.
Е.И. Морковин – планирование исследований, методология, обработка данных, обсуждение результатов, редактирование статьи, сбор, анализ или интерпретация результатов работы.
И.С. Ивлева – сбор, анализ или интерпретация результатов работы.
Н.С. Пестерева – сбор, анализ или интерпретация результатов работы.
В.А. Майстренко – сбор, анализ или интерпретация результатов работы.
Е.Е. Абросимова – сбор, анализ или интерпретация результатов работы.
Н.С. Ковалев – сбор, анализ или интерпретация результатов работы.
М.А. Дубровина – сбор, анализ или интерпретация результатов работы.
Список источников
- Гуляева Н.В. Молекулярные механизмы действия препаратов, содержащих пептиды мозга: кортексин. Журнал неврологии и психиатрии им. С.С. Корсакова. 2018;118(10):93-96. [Gulyaeva N.V. Molekulyarnye mekhanizmy deistviya preparatov, soderzhashchikh peptidy mozga: korteksin. Zhurnal nevrologii i psikhiatrii im. S.S. Korsakova. 2018;118(10):93-96. (In Russ.)].
- Гомазков О.А. Кортексин: молекулярные механизмы и мишени нейропротективной активности. Журнал неврологии и психиатрии им. С.С. Корсакова. 2015;115(8):99-104. [Gomazkov O.A. Korteksin: molekulyarnyye mekhanizmy i misheni neyroprotektivnoy aktivnosti. Zhurnal nevrologii i psikhiatrii im. S.S. Korsakova. 2015;115(8):99-104. (In Russ.)].
- Руководство по доклиническим исследованиям безопасности в целях проведения клинических исследований и регистрации лекарственных препаратов (ЕАЭС) от 26 ноября 2019 [Интернет]. URL: https://www.alta.ru/tamdoc/19kr0202/ (дата обращения: 08.2020).
- ГОСТ Р 53434-2009 Принципы надлежащей лабораторной практики, ГОСТ Р от 02 декабря 2009 года №53434-2009 [Интернет]. URL: http://docs.cntd.ru/document/1200075972 (дата обращения: 08.2020).
- ГОСТ Р 51000.4-2011 Общие требования к аккредитации испытательных лабораторий, ГОСТ Р от 29 июня 2012 года №51000.4-2011 [Интернет]. URL: http://docs.cntd.ru/document/1200094437 (дата обращения: 08.2020).
- Директива Европейского парламента и Совета Европейского Союза 2010/63/ЕС от 22.09.2010 о защите животных, использующихся для научных целей | ГАРАНТ [Интернет]. URL: http://base.garant.ru/70350564/ (дата обращения: 08.2020).
- National Research Council (US) Committee for the Update of the Guide for the Care and Use of Laboratory Animals. Guide for the Care and Use of Laboratory Animals. 8th edition. Washington (DC): National Academies Press (US); 2011/
- Sun Y, Chen G, Zhou K, Zhu Y. A Conditioned Place Preference Protocol for Measuring Incubation of Craving in Rats. J. Vis. Exp. 2018 Nov 6;(141).
- Экспериментальное доклиническое изучение аддиктивного потенциала фармакологических средств. Методические рекомендации № 2000/112. Звартау Э.Э., Кузьмин А.В., Беспалов А.Ю. Институт фармакологии ПСПбГМУ. [Eksperimental'noye doklinicheskoye izucheniye addiktivnogo potentsiala farmakologicheskikh sredstv. Metodicheskiye rekomendatsii № 2000/112. Zvartau E.E., Kuz'min A.V., Bespalov A.YU. Institut farmakologii PSPbGMU. (In Russ.)].
- Uzbay IT, Kayaalp SO. A modified liquid diet of chronic ethanol administration: validation by ethanol withdrawal syndrome in rats. Pharmacol Res. 1995;31(1):37-42.
- Jones BC, Ben-Hamida S, de Vasconcelos AP, Kelche C, Lazarus C, Jackisch R, Cassel JCEffects of ethanol and ecstasy on conditioned place preference in the rat. J. Psychopharmacol. 2010; 24(2): 275-279.




