Апробация модели цисплатин-индуцированной острой рвоты у хорьков и выбор референтного препарата
Кательникова А.Е., Зуева А.А., Матичин А.А., Каргопольцева Д.Р., Гайдай Д.С. Апробация модели цисплатин-индуцированной острой рвоты у хорьков и выбор референтного препарата. Лабораторные животные для научных исследований. 2019; 3. https://doi.org/10.29296/2618723X-2019-03-10
Резюме
Отсутствие противорвотного средства, эффективного во всех проявлениях тошноты и рвоты, требует проведения исследований в этой области, а также выбора наиболее подходящей модели для этой цели. В начале 1980-х годов в эксперименте у хорьков развилась острая рвота на высокую дозу цисплатина. Поэтому данный вид животных был предложен в качестве альтернативной модели вместо собак, кошек и обезьян для изучения рвоты, вызванной цитотоксическими препаратами, и выявления потенциальных противорвотных средств. Модель цисплатин-индуцированной рвоты у хорька используется более 30 лет, что позволило установить и внедрить в клинику такие противорвотные препараты, как ондансетрон, гранисетрон, апрепитант, фосапрепитант.
Цель данной работы — апробация модели цисплатин-индуцированной острой рвоты у хорьков с отработкой выбора референтных препаратов.
В эксперименте было сформировано 3 группы по 4 животных в каждой. Для индукции патологии всем животным внутрибрюшинно вводили цисплатин в дозе 10 мг/кг. Препарат Ондансетрон вводили животным внутримышечно в дозе 1 мг/кг, препарат Эменд В/В вводили внутривенно в дозе 3 мг/кг. Исследовали следующие показатели: продолжительность латентного периода, акт рвоты и рвотные позывы, количество которых оценивали у животных по характерным признакам на протяжении 4 ч с момента введения цисплатина. По результатам эксперимента латентный период в среднем составлял 2 ч. Суммарное количество актов рвоты и рвотных позывов у контрольных животных составило 41±17 (M±SD). Выбранные в качестве препаратов сравнения Ондансетрон и Эменд В/В оказали выраженное противорвотное действие, которое проявлялось в статистически значимом уменьшении рвотных позывов у животных, причем ни у одного животного не было зарегистрировано акта рвоты. Введение референтных препаратов не влияло на продолжительность латентного периода. При интерпретации данных были учтены факторы, которые могли повлиять на воспроизведение модели, например путь введения индуктора патологии, использование анестезии, количество животных в группе, включая самый не очевидный — это питомник, где выращивали животных.
Введение
Тошнота (неприятное ощущение, предшествующее рвоте) и рвота (рефлекторный акт эвакуации желудочного содержимого через рот и нос) обычно встречаются или по отдельности, или одновременно как симптомы отдельных заболеваний (распространенный рак, синдром циклической рвоты, эпилепсия, функциональная диспепсия, мигрень, повышение внутричерепного давления), системных (менингит), желудочно-кишечных инфекций, отравлений токсинами, беременности, воздействия некоторых форм движения (параболические полеты) и векция (индуцированное движение) [1]. Тошнота и рвота также могут быть побочными эффектами таких процедур, как лучевая терапия, анестезия и хирургическое вмешательство (послеоперационная тошнота и рвота (ПОТР)), а также медикаментозного лечения. Очень часто тошноту и рвоту вызывает химиотерапия. Так, препараты циклофосфамид и цисплатин обладают высоким уровнем эметогенности, вызывая рвоту более чем у 90% больных. Рвота начинается в течение нескольких часов после введения (острая фаза) и может сохраняться в течение нескольких дней (отсроченная или затяжная фаза) [2, 3]. Это существенно ухудшает качество жизни больных и даже приводит к тому, что некоторые пациенты отказываются от дальнейшего лечения.
Клиническая потребность в разработке эффективных противорвотных стратегий для лечения тошноты и рвоты, связанных с химио- и лучевой терапией, явилась движущей силой для возрождения интереса к базовой и прикладной нейрофармакологии тошноты и рвоты в начале 1980-х годов. Классические исследования рвотного рефлекса в 1950-х годах проводились Борисоном, Вангом, Маккарти и Бриззи [4]. В эти годы впервые использовали цитотоксический препарат цисплатин, высокоэффективный против многих опухолей. Однако он вызывал интенсивную рвоту, которая была устойчива к противорвотным средствам, доступным в то время. У пациентов, не получавших противорвотные средства, частота возникновения рвоты при высокой дозе цисплатина составляла 98% ( в острой фазе) и между 44 и 89% (в отсроченной фазе) [3].
В начале 1980-х годов в эксперименте у хорьков (Mustela putorius furo L.) развилась острая рвота на высокую дозу цисплатина (8–10 мг/кг), и данный вид животных был предложен в качестве альтернативной модели вместо собак, кошек и обезьян для изучения рвоты, вызванной цитотоксическими препаратами, и выявления потенциальных противорвотных средств [5]. Попытки понять нейрофармакологию вызванной цисплатином рвоты с использованием модели хорька сыграли ключевую роль в идентификации селективных антагонистов рецептора 5-гидрокситриптамин3 (5-НТ3) и, возможно, антагонистов рецептора тахикинин нейрокинин1 (NK1) [6]. Несмотря на то, что антагонисты 5-НТ3 (ондансетрон, гранисетрон) и NK1 (апрепитант, фосапрепитант) рецепторов оказывают значительное противорвотное действие при химиотерапии, данные препараты эффективны не для всех пациентов, к тому же тошнота купируется хуже, чем рвота [7]. Лечение ПОТР также улучшилось, но его нельзя считать оптимальным [8]. Отсутствие противорвотного средства, которое было бы эффективным во всех клинических (синдром циклической рвоты) и других (укачивание) условиях проявления тошноты и рвоты, доказывает необходимость дальнейших исследований в этой области и поднимает вопрос о том, какие модели (на животных или иные) наиболее подходят для таких исследований.
Рвота присутствует у многих видов млекопитающих и немлекопитающих, но не у всех чувствительность сходна с рвотными раздражителями у человека. Возможности замены исследований на млекопитающих с использованием предположительно «менее чувствительных» видов ограничены различиями в механизме возникновения рвоты, связанными с отсутствием диафрагмы у рыб или замкнутой у лягушек, морфологией желудочно-кишечного тракта у птиц и рептилий [3, 9, 10]. В литературе встречаются публикации, где используют в качестве тест-системы грызунов, в частности крыс и мышей. Суррогатными маркерами тошноты у данного вида животных условно считаются неприятие вкуса/избегание пищи, пикка (потребление животным каолина) и физиологические параметры [3, 11, 12]. Однако до тех пор как анатомия, физиологические и фармакологические механизмы, лежащие в основе отсутствия рвотного рефлекса у данного вида животных, не будут поняты, к результатам исследований на грызунах в этой области следует относиться с осторожностью. Для изучения рвоты, вызванной химиотерапией, по мнению ряда ученых, целесообразно использовать хорьков [11, 13]. Кроме того, достаточно популярной тест-системой из мелких лабораторных животных (не грызуны) является мускусная землеройка (Suncus murinus) [14].
Цель данной работы – апробация модели цисплатин-индуцированной острой рвоты у хорьков с отработкой выбора референтных препаратов.
Материал и методы
В качестве референтных препаратов были выбраны Ондансетрон (МНН: ондансетрон (производитель – ООО «ГРОТЕКС», Россия, серия 030418) и Эменд В/В (МНН: Фосапрепитант, производитель – «Мерк Шарп» и Доум Б.В., Нидерланды, серия №013909).
Ондансетрон является сильнодействующим высокоселективным антагонистом 5HT3-рецепторов. При проведении лучевой терапии и приеме цитостатических лекарственных средств возможно высвобождение серотонина (5-НТ) в тонком кишечнике, вызывающего рвотный рефлекс через активацию 5-НТ3-рецепторов и возбуждение афферентных волокон блуждающего нерва. Ондансетрон блокирует инициацию этого рефлекса. Активация афферентных волокон блуждающего нерва, в свою очередь, может вызвать выброс 5-НТ в заднем поле дна 4-го желудочка (area postrema) и, следовательно, запустить рвотный рефлекс через центральный механизм. Таким образом, подавление ондансетроном химио- и радиоиндуцированной тошноты и рвоты осуществляется благодаря антагонистическому воздействию на 5-НТ3-рецепторы нейронов, расположенных как на периферии, так и в центральной нервной системе (ЦНС) [15]. При клиническом применении все антагонисты 5-НТ3-рецепторов обладают сходным профилем противорвотного действия, хотя режимы их дозирования различаются. Было показано, что антагонисты 5-HT3-рецептора заметно ингибируют острую фазу рвоты, которая возникает в течение 24 ч после введения цисплатина. Однако эти агенты малоэффективны в качестве монотерапии против замедленной фазы рвоты, которая возникает через 24 ч у людей и экспериментальных животных, в частности у хорьков [16].
К более эффективным противорвотным препаратам относят антагонисты к тахикининовым рецепторам типа NK1. Накоплено много данных, свидетельствующих о том, что антагонисты рецептора NK1 работают в ЦНС, оказывая противорвотное действие [17, 18]. Сообщается, что вещество P и рецепторы NK1 широко распространены в ЦНС, при этом значительные уровни этих соединений обнаруживаются в продолговатом мозге в ядре одиночного пути, тесно связанного с центром рвоты [19, 20]. Доклинические исследования на различных видах животных показали, что селективные антагонисты рецепторов NK1, СР-99,994, СР-122,721, MK-0869 (его пролекарство L-758,298), SCH 619734, GR203040 и GR205171, ослабляли рвотные реакции, вызываемые различными стимулами, включая химиотерапевтический агент цисплатин [17-22]. Таким образом, антагонисты рецепторов NK1 могут обеспечивать более широкую защиту от множества рвотных агентов у человека, чем антагонисты 5-НТ3-рецепторов [15]. В связи с чем в качестве второго позитивного контроля был взят препарат Эменд В/В селективный антагонист, обладающий высоким сродством к человеческим рецепторам NK1 [23].
Исследование было выполнено в соответствии с нормативными документами [24, 25]. При этом использовали хорьков возрастом 22–24 нед, полученных из питомника «Твой хорек» (Краснодар, Россия). Животных содержали в стандартных условиях в соответствии с санитарно-эпидемиологическими правилами СП 2.2.1.3218-14 и Директивой 2010/63/EU от 22 сентября 2010 г. по охране животных, используемых в научных целях. Корм включал крупы в смеси с мясом и мясными субпродуктами. Воду в стандартных поилках со стальными крышками-носиками давали ad libitum. Хорьков содержали в металлических индивидуальных клетках, в которых у каждого хорька был гамак для сна, хлопок – как материал для гнездования. Площадь пола на 1 животное составила не менее 3000 см2 (минимально допустимая площадь). Исследование было одобрено на заседании биоэтической комиссии НПО «Дом Фармации» (БЭК №1.47/18 от 03 августа 2018 г.).
Животные были разделены на 3 группы по 4 животных в каждой: 2 группы экспериментальных и 1 – контрольная (позитивный контроль).
В качестве индуктора патологии использовали препарат Цисплатин-Тева (МНН – цисплатин, производство Фармахеми Б.В., Нидерланды, серия 17Е15LA). Животным всех групп вводили цисплатин в дозе 10 мг/кг однократно внутрибрюшинно через 30 мин после введения препаратов. Доза цисплатина и путь введения были выбраны на основании данных литературы [11, 16, 26].
Препарат Ондансетрон вводили животным внутримышечно в бедренные мышцы тазовых конечностей в виде готового раствора с концентрацией 2 мг/мл в дозе 1 мг/кг с помощью шприца с иглой. Внутривенно препарат сравнения Эменд В/В вводили животным в дозе 3 мг/кг в виде предварительно приготовленного раствора с концентрацией 1 мг/мл шприцем через предварительно установленный катетер. Объемы введения для хорька массой тела 1,5 кг составляли: внутривенное – 4,5 мл и внутримышечное – 0,75 мл.
Для осуществления внутривенного введения препарата Эменд В/В в связи с высокой подвижностью хорьков их вводили в легкий наркоз. Наркотизацию животных проводили средством для ингаляционного наркоза Аэрран (МНН: Изофлюран, Бакстер Хелскэа Пуэрто-Рико, Пуэрто-Рико, США, серия 16605L53) с помощью ветеринарного наркозного аппарата Zoomed Minor Vet (ЗооМед, Россия).
Поскольку наркоз может оказывать влияние на латентный период (время от введения индуктора патологии до развития акта рвоты или рвотных позывов), то животных всех групп вводили в наркоз при введении препаратов соответствующим путем [11]. Животных контрольной группы также вводили в наркоз на время, которое было использовано для внутривенного введения препарата Эменд В/В.
Исследуемые показатели: продолжительность латентного периода, акт рвоты и рвотные позывы, количество которых оценивали у животных по характерным признакам на протяжении 4 ч с момента введения цисплатина.
Показатели фиксировали в первичных картах по следующим признакам [11]:
- Рвота – это рефлекторный акт форсированного извержения содержимого желудка через рот.
- Рвотные позывы характеризуются ритмичными синхронными движениями диафрагмы, брюшных и наружных межреберных мышц, в то время когда рот остается закрытым. Количество рвотных позывов фиксировали подсчетом каждого ритмического сокращения брюшины животного.
- Латентный период – отрезок времени от момента введения цисплатина животному до развития акта рвоты или рвотных позывов.
Для всех данных была применена описательная статистика: данные были проверены на соответствие закону нормального распределения с помощью критерия Шапиро–Уилка. Для данных, подчиняющихся закону нормального распределения, рассчитывали среднее значение (M) и стандартное отклонение (SD). Для оценки данных с признаками нормального распределения был использован однофакторный дисперсионный анализ (ANOVA), с последующим межгрупповым сравнением с помощью критерия Тьюки. Различия были определены при 0,05 уровне значимости. Статистический анализ был выполнен с применением пакета программного обеспечения Statistica 10.0 (StatSoft, США).
Результаты и обсуждение
Целью эксперимента было моделирование у животных острой рвоты с коротким латентным периодом. Согласно данным литературы, введение цисплатина в дозе 5 мг/кг сопровождается значительной задержкой в развитии первых симптомов (акт рвоты и/или рвотные позывы) по сравнению с более высокими дозами индуктора патологии в диапазоне 6–20 мг/кг (рис. 1).
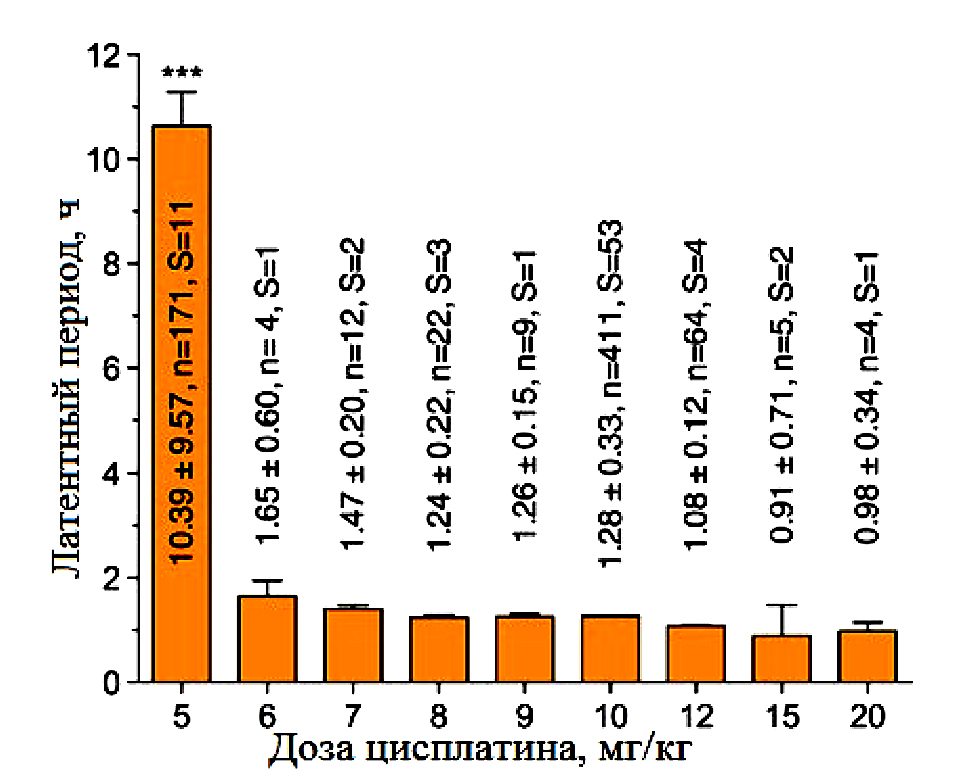
В эксперименте была выбрана доза цисплатина 10 мг/кг при внутрибрюшинном введении. Латентный период при введении дозы 10 мг/кг составляет 1,28±0,33 ч – 411 (26%) против 10,39±0,39 ч – 171 (4%) при введении в дозе 5 мг/кг (см. рис. 1). При этом в контрольной группе животных при внутрибрюшинном введении хорькам латентный период составил 1,62±0,89 ч – 4 (55%). Однако у 3 из 4 животных первые симптомы появились через 2 ч после введения, а у 1 животного – через 45 мин. Аналогичная картина была характерна и для других экспериментальных групп, у 1 животного из 4, получивших референтные препараты, регистрировали раннее проявление симптомов. При исключении животного с коротким латентным периодом в контрольной группе из статистической обработки данных время составило 2,01±0,55 ч 3 (28%), так же, как и в остальных группах (рис. 2).
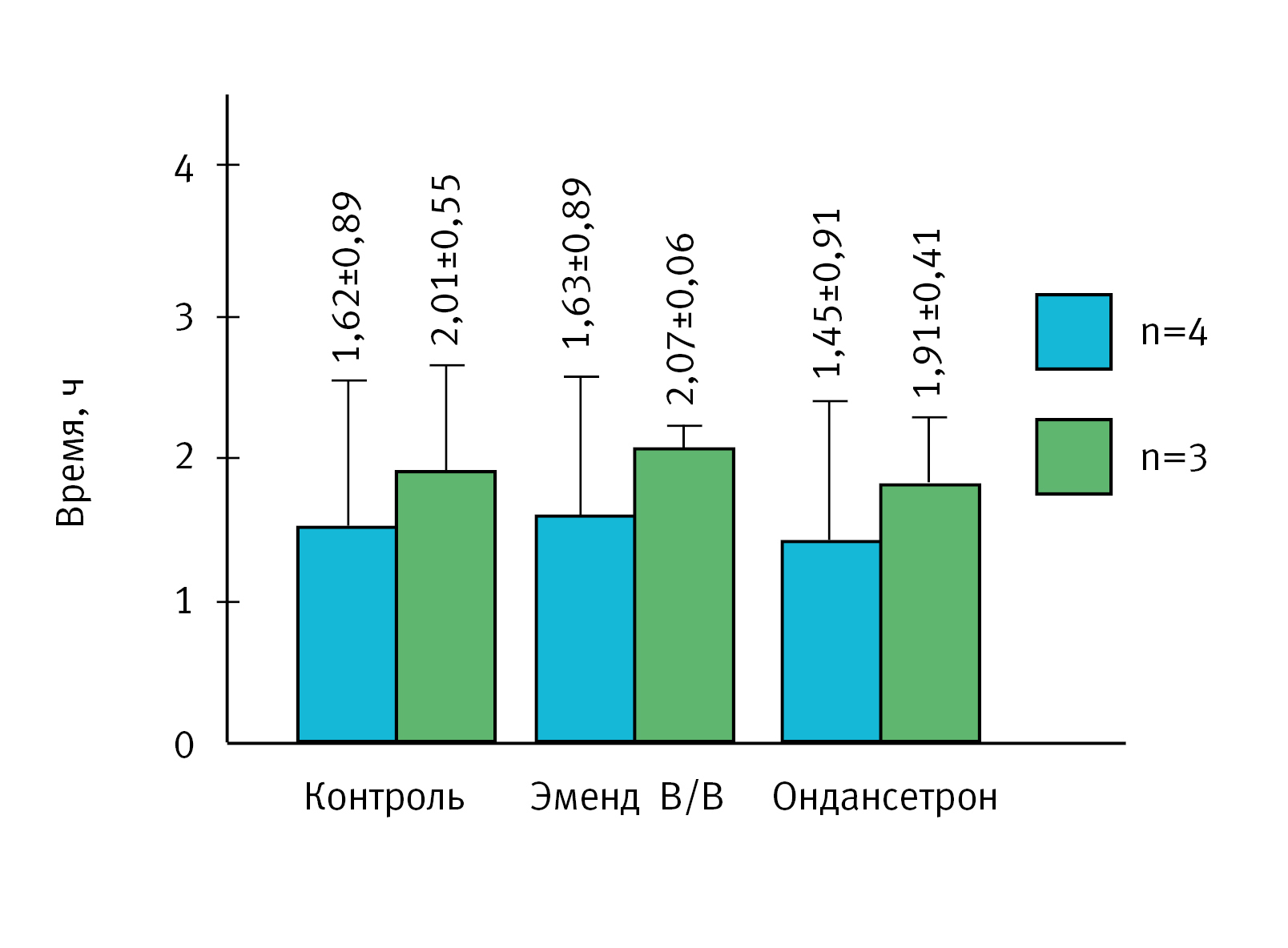
Возможно, при большей численности выборки животных результаты были бы более ровными, но использование хорьков в исследованиях ограничивается их доступностью и этическими принципами. Поэтому среднее количество хорьков в экспериментальной группе составляет 4–6 особей [10, 27, 28].
На увеличение латентного периода могли повлиять внутрибрюшинный путь введения индуктора патологии и использование наркоза. По данным литературы латентный период короче при внутривенном способе введения цисплатина в дозе 10 мг/кг (1,16±0,35 ч; n=277), чем при внутрибрюшинном в той же дозе (1,51±0,29 ч; n=134). Введение же анестетика практически не влияет на время до развития симптомов, это было продемонстрировано в длительном эксперименте, где у животных, получивших цисплатин под наркозом, латентный период составил 1,21±0,32 ч (n=93), против 1,11±0,31 ч (n = 51) без использования анестетика. Однако есть сведения, что применение инъекционного анестетика (фенобарбитал натрия в дозе 30–35 мг/кг в сутки) сокращает латентный период (0,95±0,14 ч; n=46) по сравнению с летучими анестетиками (1,21±0,39 ч; n=176) [11].
Удивительно, но на длительность латентного периода может влиять даже место расположения питомника, где выращивают хорьков. Например, у хорьков, разведенных в Новой Зеландии, задержка акта рвоты и рвотных позывов была значительно больше (1,73±0,37 ч; n=11) по сравнению с животными, полученными в Великобритании (1,25±0,44 ч; n=170) и США (1,31±0,19 ч; n=176).
В нашем эксперименте, несмотря на малую выборку животных, даже не исключая хорьков с ранним появлением симптомов, латентный период оказался больше, чем указанный в литературе, и был ближе к дозе цисплатина 6 мг/кг (см. рис. 1). Вероятно, на его продолжительность все-таки повлияло расположение питомника (Краснодар), откуда были получены животные. Опровергнуть такое предположение невозможно, поскольку подобных данных в отечественной литературе в открытом доступе не найдено.
Эффективность референтных препаратов оценивали по 3 показателям: по сумме количества актов рвоты и рвотных позывов, количеству животных с развившейся рвотой и продолжительностью латентного периода.
Показатель: сумма количества актов рвоты и рвотных позывов. По результатам статистической обработки данных препараты Ондансетрон и Эменд В/В статистически значимо снижали количество актов рвоты и рвотных позывов по сравнению с контрольной группой животных (р<0,05, рис. 3). Причем внутримышечное введение препарата Ондансетрон в дозе 1 мг/кг было в 2,2 раза эффективнее внутривенного введения препарата Эменд В/В в дозе 3 мг/кг. Так, на фоне лечения референтным препаратом Ондансетрон было зафиксировано 1,25±0,50 рвотных позывов, против 2,75±1,71 при препарате Эменд В/В.
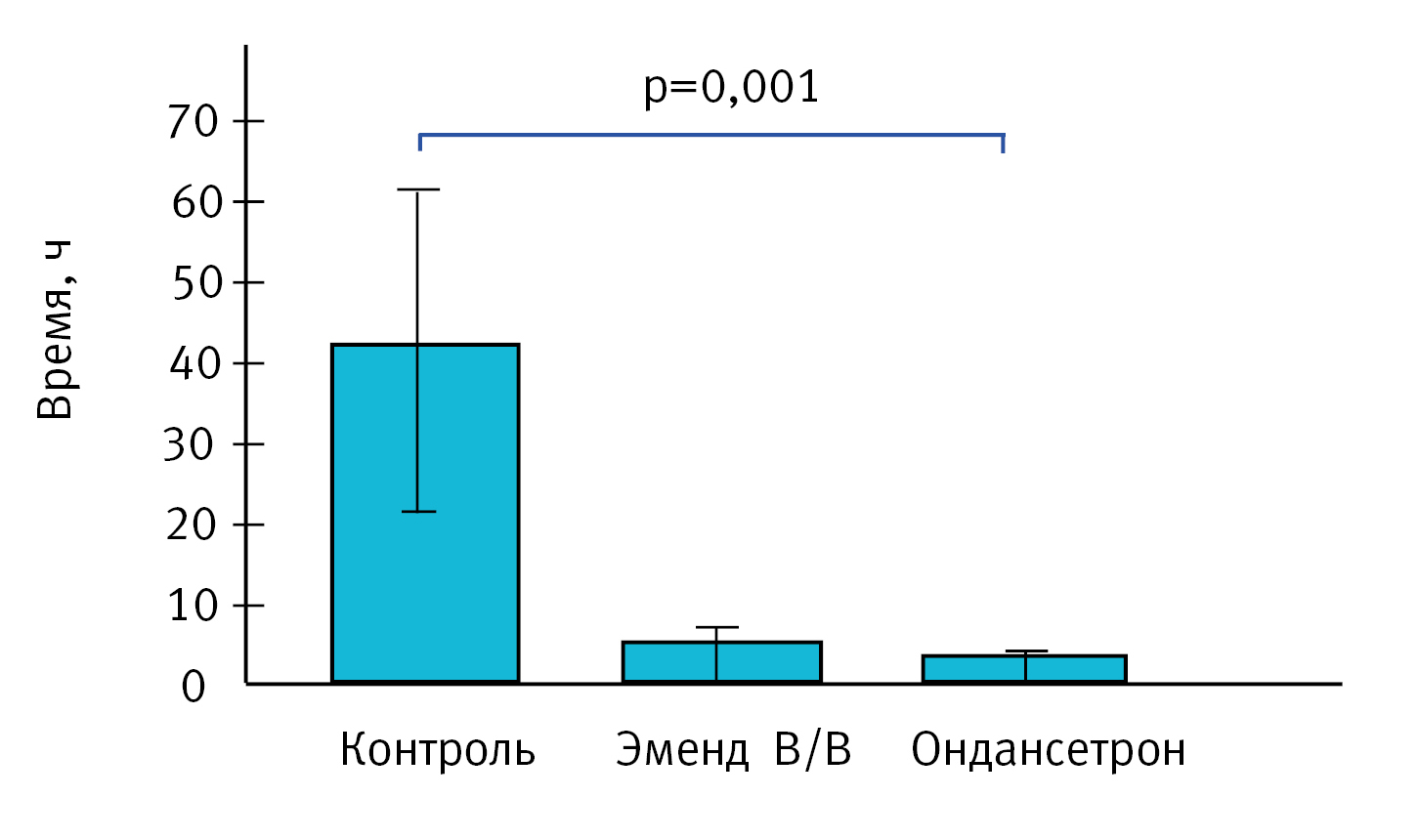
По данным литературы в течение 4 ч можно зафиксировать в контрольной группе до 12 актов рвоты и до 110 рвотных позывов [16]. Суммарно по 2 показателям (акт рвоты + рвотные позывы) возможно получить до 156±41 – 19 (26%) определений в течение 4 ч [11]. В нашем эксперименте суммарно по 2 показателям в контрольной группе было зафиксировано 41±17 – 4 (41%), что значительно меньше, чем указано в литературе.
Показатель: количество животных с развившейся рвотой. Препараты сравнения оказали выраженное противорвотное действие. Ни у одного животного не зафиксировано развития акта рвоты на фоне введения препаратов Ондансетрон и Эменд В/В. Результаты по данному показателю приведены в таблице.
Количество животных с выявленным актом рвоты
|
Обозначение группы, доза |
Количество животных с признаком/общее количество животных в группе |
|
Контроль |
3/4 |
|
Эменд В/В, 3 мг/кг |
0/4 |
|
Ондансетрон, 1 мг/кг |
0/4 |
Поскольку в контрольной группе животных у 1 хорька из 4 не зарегистрировано развития рвоты, в виду возможной индивидуальной чувствительности организма к цисплатину, то возникает вопрос об оптимальном количестве животных в группе. В некоторых публикациях с данной моделью патологии в контрольную группу включают большее количество хорьков, чем в остальные экспериментальные группы. Например, 6 или 9 хорьков – в контроле, 4 или 5 – в экспериментальных группах [16, 17, 26].
Показатель: продолжительность латентного периода. Введение референтных препаратов Ондансетрон и Эменд В/В не влияло на продолжительность латентного периода (см. рис. 2), что значительно расходится с данными приведенными в литературе, включая систематический обзор по препарату Ондансетрон [11]. По результатам мет-анализа введение Ондансетрона в дозе 1 мг/кг на фоне индукции острой рвоты цисплатином в дозе 10 мг/кг, статистически значимо задерживает развитие рвоты у животных на 200% по сравнению с животными контрольной группы.
В отношении антагонистов рецепторов NK1 сообщается, что исследованные до настоящего времени препараты не демонстрировали значительной задержки появления актов рвоты и рвотных позывов, но уменьшали совокупное число этих рвотных ответов [18, 28]. Например, в эксперименте на модели острой рвоты у хорьков, вызванной введением цисплатина в дозе 10 мг/кг, М. Tsuchiya и соавт. (2002) регистрировали, что эзлопитант (антагонист NK1) в дозе 3 мг/кг уменьшал рвотный ответ с уменьшением количества актов рвоты и рвотных позывов, но незначительно задерживал начало рвотных эпизодов (2,2±0,5 ч; M±SEM; n=5) [16]. Причем эзлопитант уменьшал количество рвотных позывов до 2,4±1,0 (M±SEM) и только у 1 хорька из 5 был зафиксирован акт рвоты, что полностью сопоставимо с данными полученными в нашем эксперименте (акт рвоты – 0/4, рвотные позывы – 2,75±1,71 (M±SD)).
Заключение
Была воспроизведена модель острой рвоты у хорьков путем внутрибрюшинного введения цисплатина в дозе 10 мг/кг. По результатам эксперимента латентный период в среднем составлял 2 ч и был ближе по значениям к дозе цисплатина 6 мг/кг, что соответствовало данным литературы [11]. Суммарное количество актов рвоты и рвотных позывов у контрольных животных составило 41±17 (M±SD; n=4), что значительно меньше чем это указано в литературе: суммарно по 2 показателям (акт рвоты + рвотные позывы) возможно получить до 156±41 – 19 (26%) определений в течение 4 ч [11]. Выбранные в качестве референтных препаратов Ондансетрон и Эменд В/В оказали выраженное противорвотное действие, которое проявлялось в статистически значимом уменьшении рвотных позывов у животных, причем ни у 1 животного не было зарегистрировано развития акта рвоты. Однако введение препаратов не влияло на продолжительность латентного периода.
Полученные экспериментальные данные в контрольной группе и результаты по препарату Ондансетрон отличаются от опубликованных в литературе, а также от данных систематического обзора по модели цисплатин-индуцированной рвоты у хорьков [11]. Однако факторов, которые могли повлиять на воспроизведение модели, достаточно, включая самый не очевидный – это питомник где выращивают животных, о чем и пишут в своей работе N.P. Du Sert и соавт. (2011) [11]. Еще один важный фактор – это малая выборка животных в группе. Основываясь на собственном опыте, учитывая индивидуальную чувствительность животных, рекомендуем включать в группу не менее 5 хорьков.
Таким образом, воспроизведена модель острой рвоты у хорьков, индуцированная внутрибрюшинным введением цисплатина в дозе 10 мг/кг. Модель подтвердила противорвотную активность препарата Ондасетрон, являющегося антагонистом 5-HT3-рецепторов, и препарата Эменд В/В – антагониста NK1 рецепторов по показателям количества актов рвоты и рвотных позывов.
Список источников
- Andrews P.L.R., Horn C.C. Signals for nausea and emesis: Implications for models of upper gastrointestinal diseases. Auton. Neurosci. 2006. Vol. 125 (1–2): 100–15. DOI:10.1016/j.autneu.2006.01.008.
- Владимирова Л.Ю., Гладков О.А., Когония Л.М., Королева И.А., Семиглазова Т.Ю. Практические рекомендации по профилактике и лечению тошноты и рвоты у онкологических больных. Злокачественные опухоли. 2017; 7 (3-S2): 466–76. [Vladimirova L.YU., Gladkov O.A., Kogoniya L.M., Koroleva I.A., Semiglazova T.YU. Prakticheskie rekomendacii po profilaktike i lecheniyu toshnoty i rvoty u onkologicheskih bol'nyh. Zlokachestvennye opuholi. 2017; 7 (3-S2): 466–76 (in Russ)].
- Holmes A.M., Rudd J.A., Tattersall F.D., Aziz Q., Andrews P.L.R. Opportunities for the replacement of animals in the study of nausea and vomiting. Br. J. Pharmacol. 2009. Vol. 157 (6): 865–80. DOI: 10.1111/j.1476-5381.2009.00176.x.
- Davis C.J. Emesis research: a concise history of the critical concepts and experiments. J. R. Nav. Med. Serv. 1997. Vol. 83 (1): 31–41.
- Florczyk A.P., Schurig J.E., Bradner W.T. Cisplatin-induced emesis in the Ferret: a new animal model. Cancer. Treat. Rep. 1982. Vol. 66 (1): 187–9.
- Christie D.A., Tansey E.M. The discovery, use and impact of platinum salts as chemotherapy agents for cancer: The transcript of a Witness Seminar held by the Wellcome Trust Centre for the History of Medicine at UCL, London, on 4 April 2006. Wellcome Trust: London. 2007: 148.
- Hesketh P.J. Chemotherapy-induced nausea and vomiting. N. Engl. J. Med. 2008. Vol. 358 (23): 2482–494. DOI: 10.1056/NEJMra0706547.
- Ho K.Y., Gan T.J. Pharmacology, pharmacogenetics, and clinical efficacy of 5-hydroxytryptamine type 3 receptor antagonists for postoperative nausea and vomiting. Curr. Opin. Anesthesiol. 2006. Vol. 19 (6): 606–11. DOI: 10.1097/01.aco.0000247340.61815.38.
- Pickering M., Jones J.F.X. The diaphragm: two physiological muscles IN one. J. Anat. 2002. Vol. 201 (4): 305–12. DOI: 10.1046/j.1469-7580.2002.00095.x.
- Alam J., Subhan F., Ullah I., Shahid M., Ali G., Sewell R.D. Synthetic and natural antioxidants attenuate cisplatin-induced vomiting. BMC Pharmacol. Toxicol. 2017. Vol. 18 (1): 4. DOI: 10.1186/s40360-016-0110-9.
- Du Sert N.P., Rudd J.A., Apfel C.C., Andrews P.L.R. Cisplatin-induced emesis: systematic review and meta-analysis of the ferret model and the effects of 5-HT 3 receptor antagonists. Cancer Chemother. Pharmacol. 2011. Vol. 67(3): 667–86. DOI: 10.1007/s00280-010-1339-4.
- Bolognini D., Rock E.M., Cluny N.L., Cascio M.G., Limebeer C.L., Duncan M., Pertwee R.G. Cannabidiolic acid prevents vomiting in S uncus murinus and nausea-induced behaviour in rats by enhancing 5-HT1A receptor activation. Br. J. Pharmacol. 2013. Vol. 168 (6): 1456–70. DOI: 10.1111/bph.12043.
- Horn C.C., Meyers K., Pak D., Nagy A., Apfel C.C., Williams B.A. Post-anesthesia vomiting: Impact of isoflurane and morphine on ferrets and musk shrews. Physiol. Behav. 2012. Vol. 106 (4): 562–8. DOI: 10.1016/j.physbeh.2012.03.031.
- Horn C.C., Henry S., Meyers K., Magnusson M.S. Behavioral patterns associated with chemotherapy-induced emesis: a potential signature for nausea in musk shrews. Front. Neurosci. 2011. Vol. 5: 88. DOI: 10.3389/fnins.2011.00088.
- Инструкция по медицинскому применению препарата Ондансетрон®. 2019. [Instrukciya po medicinskomu primeneniyu preparata Ondansetron®. 2019]. Available at: https://grls.rosminzdrav.ru/Grls_View_v2.aspx?routingGuid=47637e28-fa22-4161-953e-8f6028d9aaec&t= (accessed 18.08.2019).
- Tsuchiya M., Fujiwara Y., Kanai Y., Mizutani M., Shimada K., Suga O., Nagahisa, A. Anti-emetic activity of the novel nonpeptide tachykinin NK1 receptor antagonist ezlopitant (CJ-11,974) against acute and delayed cisplatin-induced emesis in the ferret. Pharmacol. 2002. Vol. 66 (3): 144–52. https://doi.org/10.1159/000063796.
- Tattersall F.D., Rycroft W., Francis B., Pearce D., Merchant K., MacLeod A.M., Cascieri M. Tachykinin NK1 receptor antagonists act centrally to inhibit emesis induced by the chemotherapeutic agent cisplatin in ferrets. Neuropharmacol. 1996. Vol. 35 (8): 1121–9. DOI:10.1016/s0028-3908(96)00020-2.
- Gardner C.J., Bountra C., Bunce K.T., Dale T.J., Jordan C.C., Twissell D.J., Ward P. Anti-emetic activity of neurokinin NK1 receptor antagonists is mediated centrally in the ferret. Br. J. Pharmacol. 1994. Vol. 112: 516.
- Duffy R.A., Morgan C., Naylor R., Higgins G.A., Varty G.B., Lachowicz J.E., Parker E.M. Rolapitant (SCH 619734): a potent, selective and orally active neurokinin NK1 receptor antagonist with centrally-mediated antiemetic effects in ferrets. Pharmacol. Biochem. Behav. 2012. Vol. 102 (1): 95–100. DOI: 10.1016/j.pbb.2012.03.021.
- Watson J.W., Gonsalves S.F., Fossa A.A., McLean S., Seeger T., Obach S., Andrews P.L.R. The anti-emetic effects of CP-99,994 in the ferret and the dog: role of the NK1 receptor. Br. J. Pharmacol. 1995. Vol. 115 (1): 84–94. DOI: 10.1111/j.1476-5381.1995.tb16324.x.
- Gonsalves S.F., Watson J.W., Ashton C.A. Broadspectrum antiemetic effects of CP-122,721, a tachykinin NK1 receptor antagonist, in ferrets. Eur. J. Pharmacol. 1996. Vol. 305: 181–5. DOI: 10.1016/0014-2999(96)00216-6.
- Grelot L., Dapzol J., Esteve E., Frugiere A., Bianchi A.L., Sheldrick R.L., Gardner C.J., Ward P. Potent inhibition of both the acute and delayed emetic responses to cisplatin in piglets treated with GR205171, a novel highly selective tachykinin NK1 receptor antagonist. Br. J. Pharmacol. 1998. Vol. 124: 1643–50. DOI: 10.1038/sj.bjp.0702019.
- Инструкция по медицинскому применению препарата Эменд В/В®. 2017. [Instrukciya po medicinskomu primeneniyu preparata Emend V/V®. 2017]. Available at: https://grls.rosminzdrav.ru/Grls_View_v2.aspx?routingGuid=9f0f819f-d2dd-4735-b1d4-46a485c87fb8&t= (accessed 18.08.2019).
- Приказ Министерства здравоохранения Российской Федерации № 199н от 01.04.2016 "Об утверждении Правил надлежащей лабораторной практики". [Prikaz Ministerstva zdravoohraneniya Rossijskoj Federacii ot 01.04.2016 № 199n "Ob utverzhdenii Pravil nadlezhashchej laboratornoj praktiki" (in Russ)].
- Решение Совета ЕЭК № 81 от 03.11.16 «Об утверждении Правил надлежащей лабораторной практики Евразийского экономического союза в сфере обращения лекарственных средств». [Reshenie Soveta EEK № 81 ot 03.11.16 «Ob utverzhdenii Pravil nadlezhashchej laboratornoj praktiki Evrazijskogo ekonomicheskogo soyuza v sfere obrashcheniya lekarstvennyh sredstv» (in Russ)].
- Minami M., Endo T., Kikuchi K., Ihira E., Hirafuji M., Hamaue N., Kisara K. Antiemetic effects of sendide, a peptide tachykinin NK1 receptor antagonist, in the ferret. Eur. J. Pharmacol. 1998. Vol. 363 (1): 49–55. DOI:10.1016/s0014-2999(98)00784-5.




