Модель животного для доклинического изучения артериальных имплантов
Орлинская Н.Ю., Шарабрин Е.Г., Чаткин Д.Г., Давыденко Д.В., Рассихин Н.Е., Гришин А.С., Другов А.Б., Попов М.Е., Простякова А.И. Модель животного для доклинического изучения артериальных имплантов . Лабораторные животные для научных исследований. 2019; 3. https://doi.org/10.29296/2618723X-2019-03-04
Резюме
Согласно международным рекомендациям и практике, доклинические испытания на животных — обязательный этап перед началом клинических испытаний медицинских изделий высокого класса потенциального риска и имплантируемых медицинских изделий. Наиболее распространенные изделия этого класса — артериальные имплантаты, в частности коронарные стенты (III класс риска согласно Правилам классификации медицинских изделий в зависимости от потенциального риска применения).
В настоящее время на рынке имеются десятки, если не сотни, различных моделей стентов, причем каждый год появляются новые модификации: меняются материал и дизайн стентов, лекарственные препараты, полимеры, обеспечивающие контролируемую кинетику выделения лекарства и т.п. Поскольку стенты относятся к изделиям самого высокого класса риска, каждое вновь разработанное изделие должно пройти полный цикл доклинических и клинических испытаний, подтверждающих его безопасность и эффективность. При этом, необходимо отметить, что дизайн как клинических, так и доклинических исследований напрямую зависит от области применения и типа изделия, но на данный момент в Российской Федерации отсутствуют детальные рекомендации к выбору модельных объектов, методикам и процедурам проведения доклинических испытаний коронарных стентов in vivo.
Цель исследования — разработка протокола оперативного вмешательства по установке эндоваскулярного имплантата в сосудистое русло животного для последующего проведения доклинических испытаний эндоваскулярных имплантатов (стентов).
В качестве экспериментальной модели для имплантации стентов использовали наружную подвздошную артерию кроликов-самцов породы шиншилла. Операционный доступ осуществлялся через правую общую сонную артерию. Проанализированы этапы операции, технические приемы, оценены возможные трудности и осложнения доступа.
Показано, что подвздошная артерия кролика с доступом к сосудам через сонную артерию представляет собой недорогую удобную и безопасную модель для проведения доклинических испытаний эндоваскулярных имплантатов. Методика не требует специализированного инструментария: используются стандартные медицинские изделия для проведения эндоваскулярных вмешательств. Ушивание пункционного отверстия общей сонной артерии обеспечивает надежный гемостаз и профилактику инсульта у лабораторных животных, повышает выживаемость животных после операции и существенно не увеличивает время манипуляции и наркоза. Предложенные модель и техника выполнения вмешательства показали хорошую воспроизводимость и могут быть рекомендованы для использования в доклинических испытаниях эндоваскулярных имплантатов (стентов) на территории Российской Федерации.
Введение
В настоящее время с целью совершенствования регулирования обращения медицинских изделий в Российской Федерации планируется введение обязательных клинических испытаний для медицинских изделий классов потенциального риска применения 2б, 3 и имплантируемых медицинских изделий, а также пострегистрационный контроль их клинического применения. При этом в Правилах проведения клинических и клинико-лабораторных испытаний (исследований) медицинских изделий, утвержденных решением Совета экономической комиссии №29 от 12.02.2016, установлены требования предоставления, в том числе результатов доклинических исследований и испытаний.
Однако до настоящего времени вопросам проведения доклинических исследований и испытаний медицинских изделий не уделялось должного внимания, вследствие чего в Российской Федерации нет детальных рекомендаций к методикам и процедурам проведения доклинических испытаний. Согласно международным рекомендациям и практике, доклинические испытания на животных – обязательный этап, перед началом клинических испытаний медицинских изделий высокого класса потенциального риска и имплантируемых медицинских изделий [16, 17].
Необходимо отметить, что дизайн как клинических, так и доклинических исследований напрямую зависит от области применения и типа изделия. Одними из самых распространенных имплантируемых изделий являются эндоваскулярные стенты.
В настоящее время на рынке имеются десятки, если не сотни, различных моделей стентов, причем каждый год появляются новые модификации: меняются материал и дизайн стентов, лекарственные препараты, полимеры, обеспечивающие контролируемую кинетику выделения лекарства и т.п. При этом, поскольку стенты относятся к изделиям самого высокого III класса риска (согласно Правилам классификации медицинских изделий в зависимости от потенциального риска применения), каждое вновь разработанное изделие должно пройти полный цикл доклинических и клинических испытаний, подтверждающих его безопасность и эффективность.
В настоящий момент нет «идеального» модельного объекта для тестирования эндоваскулярных имплантатов in vivo, однако 2 модели считаются наиболее удачными и используются чаще других для доклинических исследований стентов: коронарные артерии свиньи и подвздошные артерии кролика [12]. Несмотря на то, что анатомически подвздошная артерия кролика существенно отличается от коронарных артерий человека, она имеет сходную реакцию сосудистой стенки на имплантацию стента (в отличие от модели свиньи, отсутствует выраженная гранулематозная реакция, процесс эндотелизации сходен с таковым у человека). Кроме того, кролику можно имплантировать стенты в обе подвздошные артерии, что позволяет сравнить изучаемый стент с контрольным, исключив влияние индивидуальных особенностей на процесс заживления. Кроме того, модель отличается относительно низкой стоимостью, простотой применения, не требует длительного обучения, а также возможностью использования известных, имеющихся на рынке инструментов и аксессуаров. Однако, несмотря на широкое использование данной модели, нам удалось найти всего несколько публикаций, посвященных описанию техники эксперимента [1, 4–6, 13, 17]. Также в настоящий момент отсутствуют стандартные протоколы или рекомендации по проведению оперативного вмешательства на подвздошной артерии кролика. Разработке стандартного протокола операции и посвящена данная работа.
Цель исследования – разработать протокол оперативного вмешательства на лабораторных животных для последующего проведения доклинических испытаний эндоваскулярных имплантатов (стентов).
Материал и методы
Протокол планируемого исследования был одобрен на заседании Комитета по этике ФГБУ «ПФМИЦ» Минздрава России (выписка из протокола №5 от 14.04.2017). Эксперименты проводили в соответствии с требованиями Женевской конвенции «International Guiding Principles for Biomedical Research Involving Animals» (Geneva, 1990), Директивы 2010/63/EU Европейского Парламента и Совета Европейского Союза от 22 сентября 2010 г. по охране животных, используемых в научных целях.
В качестве экспериментальной модели для имплантации стентов использовали наружную подвздошную артерию кроликов-самцов породы шиншилла массой 3,8±0,5 кг (от 3,1 до 4,5 кг) от полученных из питомника лабораторных животных «Пущино» (МО, Пущино)
Предоперационная подготовка
Перед операцией животным ограничивали доступ к еде в течение 8 ч. С целью профилактики инфекционных осложнений за 30 мин перед операцией животным внутримышечно вводили антибиотик Cefazolin (25 мг/кг). Операцию проводили под общей анестезией. Препарат Ketamine 75 мг/кг водили внутримышечно [3, 8]. Глубину наркоза и его течение контролировали по реакции зрачков животного на свет, по частоте сердечных сокращений и частоте дыхания. При достижении глубокого наркоза (III уровень) проводили санитарное бритье шерстяного покрова в области сонной артерии (поле размером 10×10 см). Затем животное переносили в операционный блок, помещали на операционном столе и приступали к операции.
Ход операции
За основу была взята экспериментальная модель на животных [4, 5]. Операционное поле обрабатывали антисептическим раствором. Далее в асептических условиях выполняли продольный разрез кожи длиной 3–5 см на 0,5–1 см латеральнее средней линии шеи, по переднемедиальной поверхности шеи.
После рассечения подкожной ткани, на расстоянии 1–1,5 см латеральнее трахеи обнаруживали внутреннюю яремную вену. При этом важно не повредить внутреннюю яремную вену и не вызвать массивное кровотечение [4, 9].
Гемостаз в ране из сосудов кожи, подкожной клетчатки осуществляли мануальной компрессией. Перевязка сосудов в ране потребовалась в 4 случаях, прошивание сосуда в ране – у 2 животных.
Между внутренней яремной веной и трахеей выделяли медиальный край кивательной мышцы, обнажали и мобилизовали правую общую сонную артерию. Очень важно тщательно освободить артерию в области планируемой пункции от периваскулярных тканей, чтобы последние не помешали введению интродьюсера в артерию [4], в связи с этим в дистальном и проксимальном отделах общей сонной артерии с помощью лигатуры (шелковая нить 3/0) формировали «держалки» (у 12 животных) [4]. Данный прием позволял ассистенту хирурга зафиксировать выделенную артерию, что в дальнейшем позволяло легче проводить пункцию артерии. У 28 животных для дополнительного открытия операционного поля использовали комбинацию «держалки» на дистальном сегменте артерии и наложение сосудистого зажима типа «бульдог» (длина 46 мм, рабочая часть 8 мм) на проксимальный отдел общей сонной артерии (рис. 1).
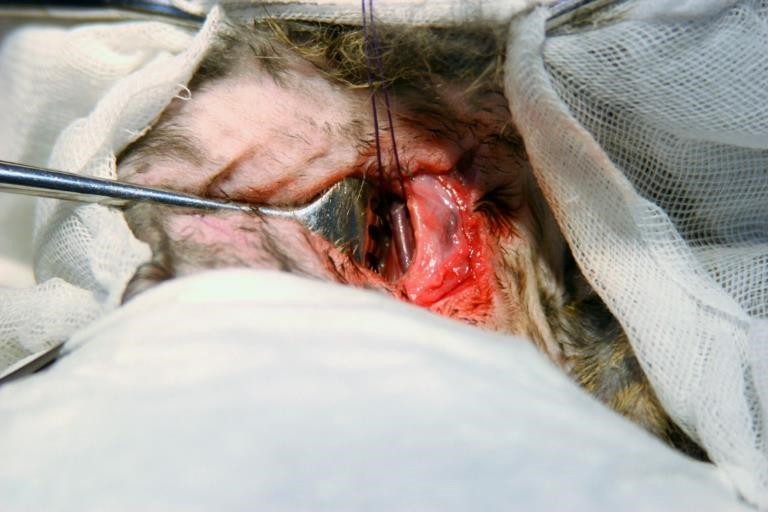
Непосредственно перед пункцией общей сонной артерии несколько натягивали дистальную «держалку» с целью наполнения артерии, увеличения ее диаметра и облечения пункции. Пункцию общей сонной артерии выполняли сосудистой иглой 22 G (рис. 2). Затем в иглу вводили коронарный проводник диаметром 0,014" и проводили в восходящую или нисходящую аорту (рис. 3). Использовали проводник Balance (Abbot, США) у 15 животных, Balance Elite (Abbot, США) – у 8, Runthrough NSTM (Terumo, Япония) – у 17. При проведении проводника не допускается применение усилий, резких рывков и толчков проводника во избежание развития диссекций аорты. В случае затруднения продвижения проводника его вращение, изменение радиуса кончика проводника, угла наклона иглы облегчает безопасное его проведение.
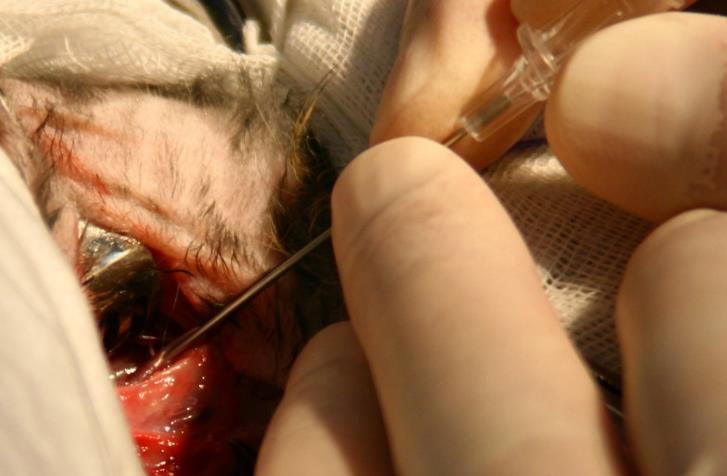
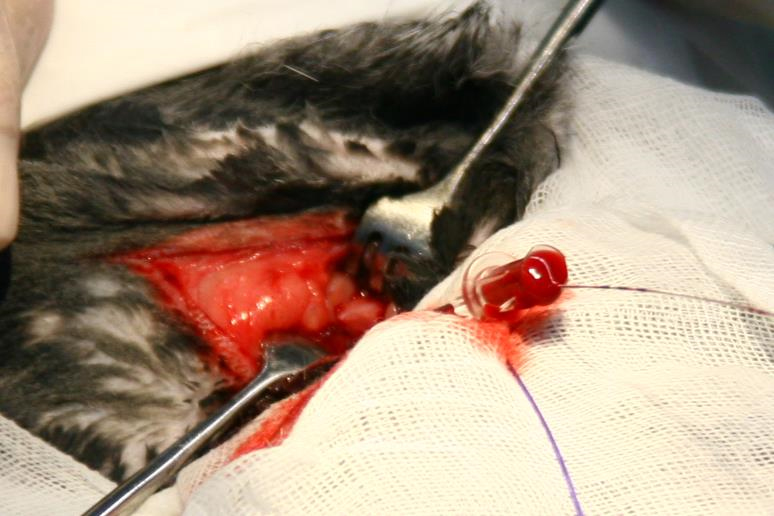
Далее по проводнику в артерию вводили интродьюсер для лучевого доступа Check-Flo Performer 4F (Cook, США) – 34 животным, интродьюсер Radiofocus II 4F (Terumo, Япония) – 6 [15, 1]. Интродьюсер устанавливали так, чтобы его кончик на 1–2 мм выходил из общей сонной артерии в аорту (рис. 4). После установки интродьюсера интраартериально вводили гепарин 100 ЕД/кг массы аналогично [4, 5, 7]. Важно отметить, что мы не применяли интродьюсеры диаметром 5F, указанные в работах [1, 7, 8], из-за риска повреждения сосуда, а использовали интродьюсеры 4F. Интродьюсер фиксировали нитями к коже для исключения его дислокации из артерии.

Для контроля положения инструмента и оценки анатомии дуги аорты выполняли ангиографию на рентгенодиагностической хирургической передвижной установке РТС-612 (ЗАО «НИПК «Электрон», Россия) в режиме ангиографии с параметрами напряжения тока 73кВ/2.5 мА. Для ангиографического исследования применяли контраст Omnipaque 350 (General Electric), разбавленный физиологическим раствором в пропорции 1:1
Затем установку переключали в флюоороскопический режим, и в дугу аорты под контролем вводили диагностический катетер BERENSTEIN 4 F длиной 65 см (Merit Medical). Носик катетера ориентировали в направлении нисходящей аорты. Кончику проводника придавали небольшой изгиб под углом 45о длиной 2–3 мм. По катетеру в дугу аорты, а затем в нисходящую аорту устанавливали проводник. Далее всю систему «катетер-проводник» подводили к терминальному отделу аорты. Проводник удаляли и выполняли аортографию терминального отдела аорты с контрастированием общих подвздошных артерий и артерий задних конечностей (рис. 5 и 6).
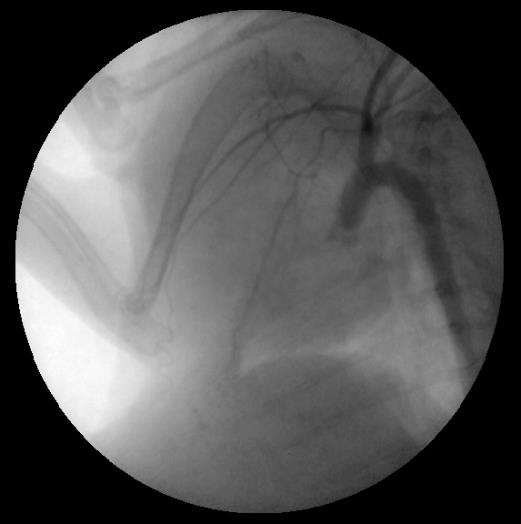
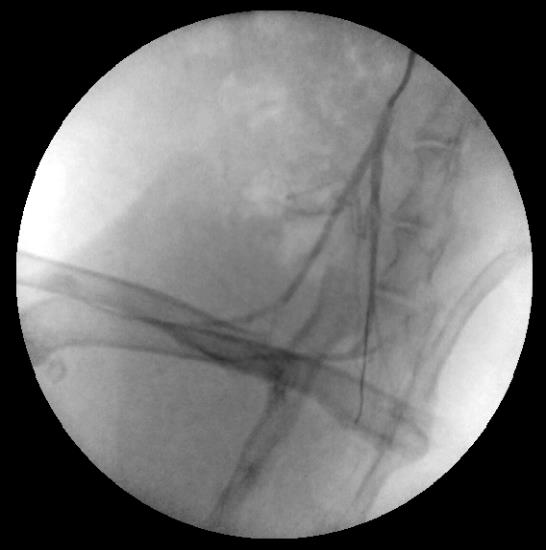
Далее проводник проводили в правую подвздошную артерию, по нему – доставляющую систему с баллон-расширяемым коронарным стентом, позиционировали стент в проксимальном сегменте правой общей подвздошной артерии. Отношение диаметра стента к диаметру артерии составило 1,2:1, что соответствовало [4, 14]. Использовали стенты диаметром 2,5 мм и длиной 8, 10, 12 мм. Стент имплантировали давлением в баллоне 7 атм, экспозиция составляла 30 с. Далее аналогичным способом имплантировали стент в левую общую подвздошную артерию (рис. 7).
После имплантации стентов по проводнику в терминальном отделе аорты вновь устанавливали диагностический катетер BERENSTEIN (Merit Medical) и выполняли контрольную аортографию с контрастированием подвздошных и артерий задних конечностей. Оценивали положение стентов, наличие кровотока по дистальным артериям, наличие спазма артерий в области имплантации стентов (рис. 8).
Затем интродьюсер удаляли из правой общей сонной артерии. Следуя методике, описанной в работе [4], сонную артерию перевязывали дистально у 3 экспериментальных животных. В последующем мы отказались от перевязки сонной артерии. Пункционное отверстие ушивали П-образными встречными швами нитью полипропилен 7/0 (выполнено у 36 животных) (рис. 9)
Далее после тщательного контроля гемостаза операционную рану ушивали послойно и накладывали асептическую повязку.
Послеоперационный уход
После операции кролики в течение 28 дней содержались в помещении вивария Приволжского исследовательского медицинского университета в соответствии с требованиями ГОСТ 33216-2014 [14] при соблюдении стандартного режима кормления и неограниченного доступа к воде. В качестве профилактики тромбоза, животные получали ежедневно перорально аспирин 2 мг/кг [4].
Результаты и обсуждение
Осложнений наркоза не отмечено. Прооперировано 40 кроликов, имплантировано 78 стентов.Так как, внутренняя яремная вена является источником массивного кровотечения и может быть причиной гибели лабораторного животного, поэтому состояние этого сосуда требует постоянного контроля при манипуляциях в ране. При первых манипуляциях выделения и пунктирования сонной артерии у 2 кроликов была повреждена правая внутренняя яремная вена в связи с близостью расположения. В 1-м случае наблюдался полный перерыв вены. Из-за массивного кровотечения и снижения видимости в ране остановить кровотечение не удалось. Животное погибло на операционном столе. Во 2-м случае указанная вена была повреждена, но не пересечена. Удалось выполнить перевязку сосуда в ране, остановить кровотечение и продолжить операцию. Кровопотеря составила 20 мл, что составило не более 10% от объема циркулирующей крови животного. Дальнейшие манипуляции проводились с учетом адаптации методики, т.е. с применением «держалок» (см. «Материал и методы»), с помощью которых ассистент хирурга мог контролировать положение сонной артерии, снижая вероятность травмирования расположенной рядом яремной вены, а также регулировать степень наполнения артерии.
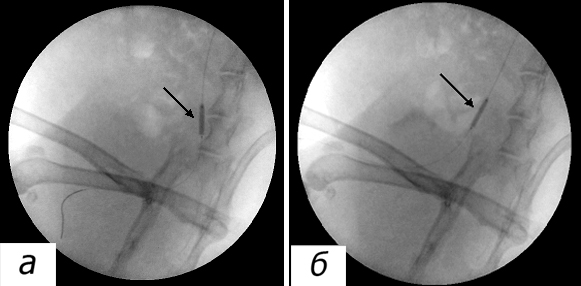
После выделения общей сонной артерии и фиксирования ее «держалками» (см. рис. 1) выполняется ее пункция. Как было указано выше, пункцию рекомендуется выполнять скосом иглы книзу для предотвращения прокола задней стенки сонной артерии [4].
Мы выполнили пункцию артерии скосом иглы кверху 10 животным, скосом иглы книзу (аналогично [4]) – 30. При прохождении иглы скосом кверху через стенку артерии возникала кратковременная ситуация, когда часть среза иглы находилась в просвете артерии, а часть – вне просвета в ране. В этот момент отмечалось массивное поступление крови в рану с ограничением видимости. При расположении иглы скосом вниз просвет иглы в ране частично прижимался к стенке артерии, что уменьшало кровотечение и сохраняло обзор в операционной ране. При дальнейшем продвижении иглы в артерию весь скос оказывался в просвете артерии и кровотечение прекращалось.
Задняя стенка пунктирована в 2 случаях, что мы объяснили небольшим диаметром артерии (при этом продольный размер скоса иглы оказался больше диаметра артерии), а также увеличением угла пункции. После введения в артерию интродьюсера последний перекрыл область пункции задней стенки. Кровотечение из прокола прекратилось и не возобновилось после удаления интродьюсера.
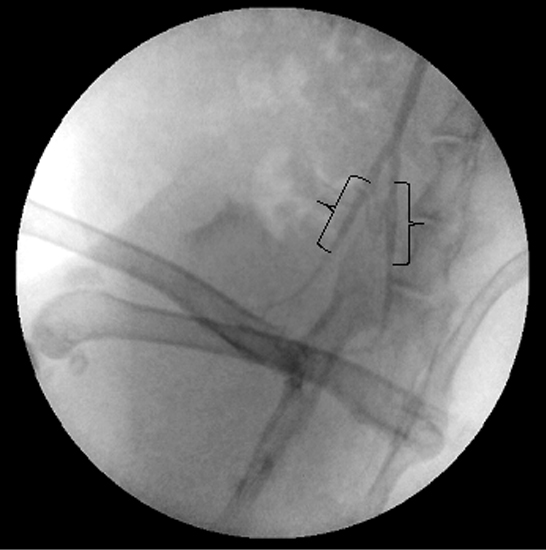
Считаем, что выполнять пункцию следует после тщательного позиционирования иглы над артерией одним плавным непрерывным движением под углом наклона до 30о: в этом случае длинник скоса иглы, как правило, будет меньше расстояния до задней стенки (см. рис. 2). При получении пульсирующей струи крови из иглы и отсутствии кровотечения непосредственно из зоны пункции следует прекратить продвижение иглы вперед и ввести в иглу проводник. Мы полагаем, что пункция иглой скосом вниз лишь предупреждает дополнительную кровопотерю, но не защищает от пункции задней стенки. Также не рекомендуется применять интродьюсеры размером 5F и более в связи с повышением опасности повреждения сонной артерии по сравнению с более тонкими интродьюсерами 4F (см. рис. 3, 4).
Большинство исследователей предпочитают заканчивать операцию перевязкой общей сонной артерии в ее дистальном отделе, считая, что это не увеличивает частоту возникновения инсультов [1, 4, 5, 9]. Лишь единичные из них рекомендуют не перевязывать, а ушивать артерию, опасаясь развития острой ишемии головного мозга [10]. Мы перевязали правую общую сонную артерию доступа 3 лабораторным животным. Инсульт развился у всех: непосредственно во время операции – у 1, к окончанию первых суток – у 2; 2 животных погибли на 2-е и 3-и сутки. Общую сонную артерию доступа ушили 36 животным. В послеоперационном периоде (28 сут) ни у одного не развился инсульт, кровотечения из области артериального шва не возникло.
Согласно результатом исследований, операцию следует завершать наложением шва на сонную артерию (рис. 9) и избегать ее перевязки, так как лигирование артерии приводит к развитию инсульта и росту летальности. Наложение шва значительно не удлиняло время операции.
Время операции от разреза до ушивания раны составило в среднем 34,3±12,4 мин (от 20 до 55 мин). Время работы рентгеновской трубки – в среднем 8,3±3,2 мин (от 5 до 14 мин). Операция была удачно завершена у 39 животных. Как было указано выше, от интраоперационного кровотечения погиб 1 кролик. Следует отметить, что операция относительно легко выполнима, производилась быстро, не пришлось осваивать новые мануальные приемы, сопровождалась низкой лучевой нагрузкой.
Заключение
Установка артериальных имплантатов в подвздошную артерию кролика с доступом к сосудам через сонную артерию представляет собой недорогую и удобную экспериментальную модель in vivo для проведения доклинических испытаний эндоваскулярных имплантатов, в частности коронарных стентов. Техники оперативного вмешательства не требует специализированного инструментария: используются стандартные медицинские изделия для проведения эндоваскулярных вмешательств (интродьюсеры, проводники, индефляторы, диагностические катетеры). Ушивание пункционного отверстия общей сонной артерии обеспечивает надежный гемостаз и профилактику инсульта у лабораторных животных, повышает выживаемость животных после операции и не удлиняет существенно манипуляцию и время наркоза.
Финансирование исследования и конфликт интересов. Исследование было проведено при поддержке компании ООО «БИОСТЭН». Авторы заявляют об отсутствии конфликта интересов.
Список источников
- Balastegui M.T., Ramos-Pl J. J., Ferrer-Puchol M.D. Anatomical Variations in the Aortic Bifurcation in New Zealand White Rabbits on Arteriography. Anat Rec., 2014; 297: 663–9. DOI: 10.1002/ar.22874
- Ding Y.H., Dai D., Layton K.F. Vascular Anatomic Variation in Rabbits. J Vasc Interv Radiol., 2006: 17: 1031–5. DOI:10.1097/01.RVI.0000220677.34695.29
- Lee, J.S., Hamilton, M.G. and Zabramski, J.M. Variations in the anatomy of the rabbit cervical carotid artery. Stroke, 1994; 25: 501–3. DOI:10.1161/01.str.25.2.501
- Lee J.M., Lee J., Jeong H. Development of a Rabbit Model for a Preclinical Comparison of Coronary Stent Types In-Vivo. Korean Circ J., 2013; 43: 713–22. DOI: 10.4070/kcj.2013.43.11.713
- Lim K.S., Jeong M. H., Bae I. H. Effect of Atorvastatin-Eluting Stents in a Rabbit Iliac Artery Restenosis Model. Chonnam Med J., 2013; 49: 118–24. DOI: 10.4068/cmj.2013.49.3.118
- Nakazawa G., Nakano M., Otsuka F., et al. Evaluation of Polymer-Based Comparator Drug-Eluting Stents Using a Rabbit Model of Iliac Artery Atherosclerosis. Circulation: Cardiovascular Interventions., 2011; 4: 38–46. DOI: 10.1161/CIRCINTERVENTIONS.110.957654
- Nakazawa G., Torii S., Ijichi T. et al Comparison of Vascular Responses Following New-Generation Biodegradable and Durable Polymer-Based Drug-Eluting Stent Implantation in an Atherosclerotic Rabbit Iliac Artery Model. J Am Heart Assoc., 2016; 5: 1–8. DOI: 10.1161/JAHA.116.003803
- Patel A. Parikh P., patil D. Comparative effects of sirolimus-eluting versus bare metal stents on neointimal hyperplasia in balloon-injured external iliac artery of rabbits. Turk J Vet Anim Sci., 2015; 39: 369–75. DOI:10.3906/vet-1307-18.
- Patil P.B., Patil D.B., Parikh P.V. Catheterization of carotid artery for iliac stenting in rabbits Indian J. Vet. Surg., 2007; 28 (2): 133–4. PMID: 10928503
- Ruiter M.S., van Tiel1 C.M., Doornbos A., et al. Stents Eluting 6-Mercaptopurine Reduce Neointima Formation and Inflammation while Enhancing Strut Coverage in Rabbits PLOS ONE., 2015; 10 (9).
- Sommer CM, Grenacher L, Stampfl U, et al. Impact of stent design on in-stent stenosis in a rabbit iliac artery model. Cardiovasc Intervent Radiol., 2010; 33: 565–75. DOI: 10.1371/journal.pone.0138459.
- Schwartz R.S., Edelman E., Virmani R., et al. Drug-eluting stents in preclinical studies: updated consensus recommendations for preclinical evaluation. Circulation. Cardiovascular interventions., 2008; 1(2): 143–53. DOI: 10.1161/CIRCINTERVENTIONS.108.789974
- Takimura C.K., Watanabe Ii-sei, Laurindo F.R. et al Assessment of Stent Strut Endothelialization in Iliac Arteries of Rabbits. Arq Bras Cardiol., 2012; 99 (6): 1123–8. DOI: 10.1590/s0066-782x2012005000103.
- ГОСТ 33216-2014 «Руководство по содержанию и уходу за лабораторными животными. Правила содержания и ухода за лабораторными грызунами и кроликами». Дата введения 2016-07-01.
- Yang W., Ge J., Liu H., Arsenic trioxide eluting stent reduces neointima formation in a rabbit iliac artery injury model. Cardiovascular Research., 2006; 72: 483–93. DOI: 10.1016/j.cardiores.2006.08.010.
- Электронный ресурс. – URL. https://www.ema.europa.eu/en/clinical-non-clinical-evaluation-during-consultation-procedure-medicinal-substances-contained-drug
- Электронный ресурс. – URL. https://www.fda.gov/MedicalDevices/ucm220760.htm




