Методы визуализации и анализа состояния микроциркуляторного русла в ветеринарной и экспериментальной практике
Васютина М.Л., Печникова Н.А., Торопова Я.Г. Методы визуализации и анализа состояния микроциркуляторного русла в ветеринарной и экспериментальной практике. Лабораторные животные для научных исследований. 2019; 2. https://doi.org/10.29296/2618723X-2019-02-07
Резюме
В ветеринарии в экспериментальных исследованиях актуальными на сегодняшний день остаются вопросы о качественных исследованиях микроциркуляции и состояния сосудов микроциркуляторного русла. Нормальное функционирование органов как таковых и организма в целом определяется состоянием регуляторных систем и отдельных звеньев микроциркуляторного русла. В настоящее время визуализация микроциркуляторного русла осуществляется инвазивными и неинвазивными методами. Однако предпочтение отдается непрямым методам диагностики состояния сосудов, основанным на анализе обменных процессов в организме.
Приводятся сведения о наиболее распространенных методах визуализации и диагностики состояния микрососудистого русла в экспериментальной и ветеринарной практиках. Обзор литературы проводился с помощью поисковой системы MEDLINE, начиная с января 2008 г. по следующим ключевым словам: microcirculation, visualization of blood vessels, аnalysis of vessels. Согласно данным литературы, в ветеринарной практике для оценки микрососудистого русла используют, как правило, неинвазивные способы. Наиболее доступные и информативные методы: спектрофотометрия, реовазография, лазерная допплеровская флоуметрия (в том числе и ультразвуковая биомикроскопия), а также СВЧ-радиотермометрия, методы рентгеноконтрастных исследований, вазография, венография и лимфографии. Кроме того, информативными методами для диагностики сосудистого русла считаются также магнитно-резонансная ангиография, пульсовая оксиметрия и компьютерная капилляроскопия.
Однако различная оптическая техника (люминесцентный, ультрафиолетовый, интерференционный, фазовоконтрастный микроскопы), оптические квантовые генераторы, электронный и телевизионный микроскопы, новые типы датчиков и усилителей имеют существенные ограничения в практическом применении (не позволяют проанализировать функциональный аспект в исследовании звеньев микроциркуляции). В результате знания в этой области до настоящего времени остаются на уровне морфологии отдельных компонентов. Наиболее привлекательным методом практической оценке состояния крови и лимфатического потока становиться интравитальная флюоресцентная цифровая микроскопия.
Введение
В ветеринарии и экспериментальных исследованиях актуальными на сегодняшний день остаются вопросы о детальном исследовании функционирования различных уровней сердечно-сосудистой системы: микроциркуляторном и системном. В таких исследованиях акцент делается на изучении жизненно важного тканевого гомеостаза в организме, состояние регуляторных систем и отдельных звеньев микроциркуляторного русла. Для исследований такого характера используются различные методы с проведением инвазивных манипуляций или отсутствием таковых. Несмотря на разнообразие методик и оборудования для диагностики микроциркуляции, все они имеют свои положительные и отрицательные стороны. В данном обзоре представлена информация о наиболее информативных способах визуализации микроциркуляторного русла и оценки состояния сосудов за последние 10 лет.
Материал и методы
Авторы выполнили поиск в системе MEDLINE, начиная с января 2008 г., по следующим ключевым словам: microcirculation, visualization of blood vessels, аnalysis of vessels. При необходимости в работу включались более ранние литературные источники.
Оценка состояния микроциркуляторного русла. Как правило, методика оценки состояния микроциркуляции проводится по определенным показателям с учетом таких дополнительных специальных параметров, как: определение процента распространенности агрегации и сладжа в микрососудах в одном поле зрения, измерение размеров и площади сосудисётого русла или сосуда, подсчет числа и процентного соотношения сосудов, имеющих вид петель или клубочков, подсчет количества в поле зрения артериоло-венулярных и венуло-венулярных анастомозов и пр.
На практике оцениваются 3 основных компонента микрососудистого русла: внесосудистый, сосудистый и внутрисосудистый. Основными критериями тяжести нарушения состояния микроциркуляции, оцениваемыми, в частности при визуальном исследовании сосудов, считаются следующие:
- наличие периваскулярных геморрагий или отека;
- изменение формы микрососудов (артериол 2-го и 1-го порядков, прекапилляров и посткапилляров, капилляров, венул 1-го и 2-го порядков) в виде возникновения саккуляций и аневризм, неравномерности калибра, повышенной извитости, появления клубочков микрососудов, образования петлевых и штопорообразных микрососудов, изменения диаметров просвета и величины артериоло-венулярного коэффициента (соотношения), плотности микрососудов на площади в 1 мм2;
- наличие внутрисосудистых изменений – сладж-феномена, агрегации, резкого замедления скорости или необратимой блокады тока крови, нарушения кровотока в капиллярах от I до III степени, характера кровотока в микрососудах (ненарушенного или гомогенного, зернистого, глыбистого);
- конъюнктивальный показатель нарушений микроциркуляции в баллах (КП баллов);
- распространенность агрегации и нарушений кровотока в микрососудах в поле зрения (%).
На этих критериях основывалась и основывается в настоящее время экстренная оценка (экспресс-диагностика) состояния микроциркуляции. Экспресс-диагностика делается, как правило, с помощью неинвазивных методов (например, допплеровской флоуметрия). В дальнейшем проводиться более качественный анализ морфометрии состояния сосудов, который включает в себя работу по фотонегативу (использование негатива позволяет более детально проанализировать микрососудистое русло):
- измеряются диаметры сосудов всех звеньев микроциркуляторного русла;
- определяется плотность сети обменных сосудов путем подсчета числа функционирующих капилляров на единицу площади;
- вычисляется артериоло-венулярный коэффициент (АВК), или соотношение, идущих параллельно сосудов: АВК = D2А/D2В, где D – диаметр, А – артериолы, В – венулы;
- определяется коэффициент извитости сосудов – отношение средней линии, проведенной через нулевые значения периодов извитого сосуда, к его реальной длине, измеренной с помощью курвиметра;
- вычисляется коэффициент поперечной деформации сосудов, который представляет собой отношение диаметра неизмененного участка сосуда к диаметру расширенной или суженной его части.
В зависимости от выбранного метода исследования микроциркуляции сосудистого русла подбирается или применяется установленный алгоритм обработки данных. Так, алгоритм оценки состояния микрогемоциркуляции при биомикроскопии сосудов различных органов, в частности брыжейки, включает [1]:
- качественную характеристику композиции микрососудов и кровотока в них, а также особенностей пассажа крови в сосудах артериолярного, капиллярного и венулярного звеньев;
- сравнение их с нормой и другими данными;
- полуколичественный учет признаков, характеризующих: гемодинамику в микрососудах, структурные изменения микрососудов, реологические сдвиги, состояние барьерной функции микрососудов;
- расчет индекса микроциркуляции, который характеризует степень отклонения оцениваемых признаков от нормы;
- определение вклада различных показателей структурно-функциональные изменения микроциркуляции;
- оценку степени нарушения микроциркуляции.
Как правило, при использовании видео и фотофайлов, экспериментатору требуется провести сбор и обработку данных. Прижизненные наблюдения проводят различной техникой (Axioskop, Leica). Так, при получении с цифровой камеры ряда изображений при наличии подходящего программного обеспечения для обработки изображений (цифровые изображения с камеры, как правило, получают с помощью захвата интересующего кадра или последовательных изображений из экспериментального видео, соответствующих точкам измерения), количественная оценка диаметра нужного сосуда и плотности проводится с помощью одного из программных пакетов Image J изображения (NIH Image), Scion Image различных версий (Scion, Фредерик, MD) с использованием AxioVision в комплексе с программным обеспечением визуализации (Carl Zeiss) [2,3].В клинической практике ветеринарного врача большую роль играет визуальная оценка полученных данных, которая при достаточном опыте позволяет качественно диагностировать патологическое состояние.
Визуализация микроциркуляторного русла
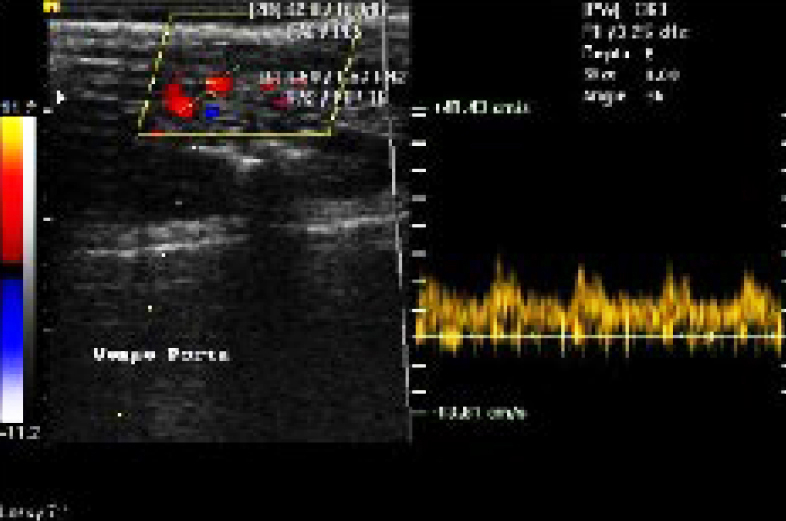
В последнее время, в связи с интенсивным развитием диагностических методов, основанных на неинвазивной медицинской спектрофотометрии, широкое применение нашли следующие методы: фотоплетизмография (ФПГ), пульсоксиметрия (SaO2), оптическая тканевая оксиметрия (ОТО), лазерная допплеровская флоуметрия (ЛДФ), реография, ангиография, ультразвуковая диагностика с использованием допплерометрии (рис. 1) [4]. При этом все более актуальным становится вопрос о возможности их применения в качестве методов оценки влияния на систему микроциркуляции бариатрических манипуляций у животных.
Растет также популярность последних достижений оптики (люминесцентный, ультрафиолетовый, интерференционный, фазовоконтрастный микроскопы), оптических квантовых генераторов, достижений электроники (электронный и телевизионный микроскопы), новых типов датчиков и усилителей. Однако существующие ограничения не позволяли развить функциональный аспект в исследовании звена микроциркуляции, поэтому знания в этой области до настоящего времени остаются на уровне морфологии [5].
Так, существующая интравитальная флюоресцентная цифровая микроскопия (ИФЦМ) [6–8] крови и лимфатического потока включает в себя: картирование кровеносных (ангиография) и лимфатических (лимфография) сосудов с использованием флюоресцентных красителей и квантовых точек (КТ); обнаружение и подсчет клеток, циркулирующих в крови и лимфе, и измерения клеток в клеточных взаимодействиях in vivo путем мечения их различными флюоресцентными маркерами (выделенные клетки могут быть животного или человеческого происхождения, или инфекционных и других патогенов, включая, например, циркулирующие опухолевые клетки); изучение физиологических процессов на клеточном уровне, на животных, с использованием специальных флюоресцентных индикаторов, чувствительных к изменениям микросреды; изучение анатомической структуры и функции кровеносных или лимфатических сосудов (например, ангиогенез); мониторинг кровеносной и лимфатической реакции на терапию, в том числе при применении фармакологических препаратов и терапевтического лазерного облучения.
Следует отметить, что существуют различные подходы, основанные на данном методе, например, измерение скорости клеток в потоке с помощью видеозаписи движения клеток, называемом «анемометрия по изображениям частиц» (АИЧ) (в англоязычной литературе – microparticle image velocimetry – μPIV). При таком подходе система автоматически отслеживает отобранные частицы в потоке жидкости с помощью цифровой обработки изображений, данная технология широко используется в струйной технике для измерения жидких и газовых скоростей потока в рамках различных приложений [9,10]. Данная технология была применена для изучения микроциркуляции крови в аорте, моделях аорты [11, 12] и мониторинга кровообращения в мелких кровеносных сосудах человека и животных.
Остановимся на следующих методах изучения сосудов. Так, одним из наиболее распространенным методом исследования микроциркуляторного звена и состояния сосудов является пульсовая оксиметрия. Она основана на использовании принципов фотоплетизмографии (ФПГ), позволяющих выделить артериальную составляющую абсорбции света для определения оксигенации артериальной крови [13]. Измерение этой составляющей позволяет использовать спектрофотометрию для неинвазивного мониторинга сатурации (насыщения) артериальной крови кислородом (SaO2) и снятия прочих показателей [14]. При этом диагностические возможности данного метода базируются на свойствах пульсограммы [14], отражающих не только ритмические колебания капиллярного кровотока, вызванные перемещением артериальной крови под воздействием мышечных сокращений левого желудочка сердца, но также и все процессы, происходящие в сердце, связанные с возникновением ритмических сокращений; процесс отображения пульсограммы соответствует интервалу времени от момента открытия аортального клапана до его закрытия и дальнейшего проталкивания крови за счет эластичности стенок аорты; на пульсограмме всегда наблюдается момент закрытия аортального клапана и хорошо виден участок, на котором проявляются свойства эластичности стенок аорты и сосудов.
Наряду с пульсовой оксиметрией широко используется реовазография (РВГ). Данный метод направлен на исследование общего и органного кровообращения, основанный на регистрации колебаний сопротивления ткани переменному току высокой частоты [13, 15] (табл. 1). Основную роль в колебании этого сопротивления играет пульсовое кровенаполнение. Метод РВГ характеризует артериальное кровенаполнение, состояние тонуса артериальных сосудов, венозный отток, коллатеральное кровообращение. Диагностические возможности РВГ значительно расширяются за счет нагрузочных тестов, которые позволяют дифференцировать органические поражения сосудов от функциональных нарушений [13]. К таким тестам относятся температурные, дыхательные, фармакологические и физическая нагрузка [13, 16].
Таблица 1
Основные показатели реовазографии
|
Показатель |
Характеристика показателя |
|
Реографический индекс |
Пульсовое кровенаполнение |
|
Время максимального систолического наполнения сосудов |
Эластические свойства сосудистой стенки |
|
Коэффициент асимметрии |
Асимметрия пульсового кровенаполнения |
|
Время медленного наполнения |
Тонус артерий мышечного типа |
|
Дикротический индекс |
Тонус артериол |
|
Венозный отток |
Тонус венозной сети |
Наиболее чувствительным методом регистрации динамики процессов микроциркуляции крови в биотканях по технологии неинвазивной медицинской спектрофотометрии является сегодня метод лазерной допплеровской флоуметрии (ЛДФ), наиболее доступный для оценки состояния микроциркуляции. Он позволяет в клинических и экспериментальных условиях получить объективную информацию о параметрах функционирования микроциркуляторного русла с любого участка поверхности тела в реальном времени и затем оперативно использовать ее для проведения и коррекции лечебного процесса.
Метод ЛДФ основан на измерении допплеровской компоненты в спектре отраженного лазерного сигнала, рассеянного на движущихся в тканях частицах. В основе метода ЛДФ лежит использование излучения монохроматического гелийнеонового лазера (I = 632,8 нм) малой мощности (2 mW), которое хорошо проникает в поверхностные слои тканей. ЛДФ позволяет одномоментно в динамике в течение неограниченного по длительности периода неинвазивным путем оценивать состояние микроциркуляции в поверхностных слоях кожи, слизистых оболочек, а также в поверхностных отделах различных органов во время оперативного вмешательства (рис. 2).
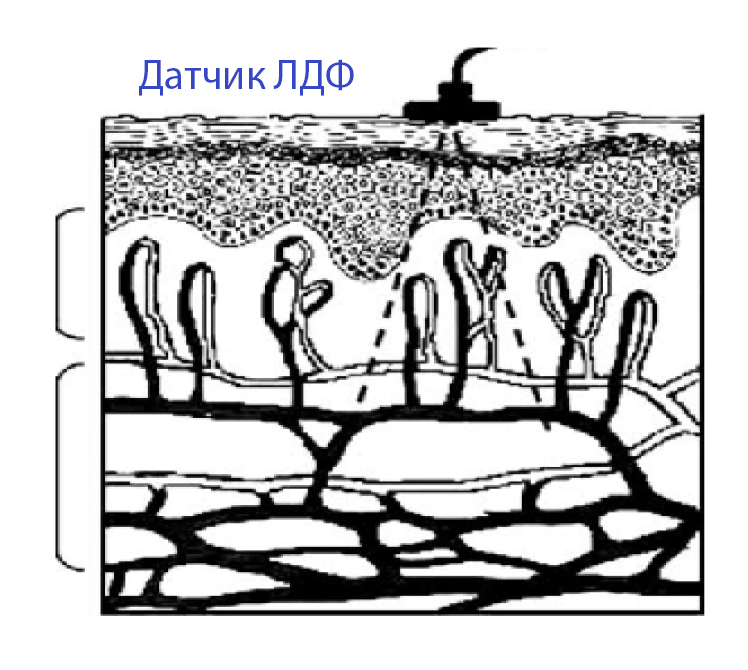
Интегральную характеристику капиллярного кровотока оценивают с помощью показателя микроциркуляции. В микроциркуляторном русле, кроме того, выделяют различные типы колебательных процессов со свойственными им частотами и амплитудами: медленные волны (активность гладкомышечных клеток в прекапиллярном звене микрососудов); быстрые волны (связанные с дыхательными экскурсиями грудной клетки); пульсовые волны (вызываемые перепадами систолического и диастолического давления) [17]. Снижение амплитуды медленных колебаний наблюдается при увеличении притока крови в систему микроциркуляции, при стазе тока крови и депрессии процессов транскапиллярного обмена [5,18].
В настоящее время получен положительный опыт, свидетельствующий об эффективности ультразвуковых методов для изучения микроциркуляции. Достижения в области клинической ультрасонографии, такие как энергетическое допплеровское картирование, нативное контрастирование и применение высокочувствительных широкополосных датчиков, увеличивает возможности в определении скорости и визуализации изображения кровотока в мелких сосудах.
В условиях клиники (в отличие от экспериментальных исследований) невозможно, используя ультразвуковые методы, исследовать кровоток в единичных сосудах микроциркуляторного русла и проводить лоцирование исходного объема ткани, в котором представлены сосуды различного калибра, с разной скоростью кровотока и разнонаправленным движением крови (микроциркуляторный срез ткани); при этом применение ультразвуковых методов регистрации кровотока в сосудах микроциркуляторного русла (диаметр менее 100 мкм) сопряжено с рядом трудностей и прежде всего с низкой линейной скоростью кровотока [17].
Одним из перспективных методов ультразвуковой допплерографии применительно к сосудам микроциркуляторного русла является ультразвуковая биомикроскопия [19]. При этом используется двухэлементный допплеровский датчик, работающий на частоте 40 МГц: 1 элемент датчика непрерывно излучает ультразвуковые колебания, а 2-й принимает отраженный сигнал, регистрирует кровоток, скорость которого колеблется от 8 до 12 мм/с, в артериолах диаметром 20 мкм – 5 мм/с (R. P. Kelly, 2002). Применяя ультразвуковую систему, работающую с частотой 50 МГц, можно измерить скорость кровотока в микрососудах уха мыши диаметром 12–15 мкм в микрососудах радужной оболочки кролика (40 мкм) [20].
При изучении микроциркуляции как дополнительный метод активно применяется также определение температурных аномалий тканей – СВЧ-радиотермометрия. Все известные методы определения температуры (тепловидение, термография, в том числе и жидкими кристаллами) косвенно отражают внутритканевую температуру, фиксируя ее на поверхностных слоях кожи, для медицинских исследований более важно измерение глубинной температуры тканей и органов, так как последняя является интегральным показателем уровня биоэнергетических процессов и может служить индикатором их морфофункционального состояния. Следует отметить, что дециметровая СВЧ-радиотермометрия, благодаря простоте исследования, неинвазивности и безвредности может быть перспективным методом в разработке новых способов диагностики и контроля состояния микроциркуляции [21].
Среди методов изучения микроциркуляции, применяемых в клинической практике, биомикроскопическая техника достаточно широко используется для мониторинга состояния микрогемоциркуляции у пациентов при различных патологических расстройствах, поскольку дает объективную и наглядную характеристику перераспределения потоков крови в тканях [1]. Биомикроскопия микрососудов позволяет проводить детальную оценку состояния всех звеньев микроциркуляторного русла – артериол, прекапиллярных артериол, капилляров, посткапиллярных венул и венул, а также особенностей кровотока в микрососудах и состояния периваскулярного пространства.
Наряду с этим, ключевое место в исследовании сосудов в медицинской и ветеринарной практике принадлежит рентгеноконтрастным исследованиям. Позитивное контрастирование протоков или сосудов позволяет визуализировать на рентгеновском снимке (или даже серии снимков, сделанных последовательно с определенными промежутками времени) их морфологические и функциональные особенности [22, 23]. Анализ полученных визуальных данных позволяет дифференцировать патологию от нормы, врожденную патологию от приобретенной, органические нарушения от функциональных [24, 22].
Учитывая, что практически все патологические процессы, в той или иной мере, сопровождаются нарушением локальной или тотальной гемодинамики, вазография, сделанная по методу рентгеноконтраста, – наиболее популярный метод среди всех контрастных исследований. Метод рентгеноконтрастной вазографии позволяет визуализировать ослабление гемодинамики в очагах гипотрофии, усиление гемодинамики в очагах гипертрофии и гиперплазии, гемостаз и вазодилатацию в очагах воспаления, а также атипичную васкуляризацию в доброкачественных и злокачественных новообразованиях. Кроме диагностических и дифференциально диагностических целей, с помощью метода рентгенконтрастной вазографии можно оценивать возможности и разрабатывать способ адресной доставки лекарственного средства к патологическому очагу гематогенным путем.
Однако на обычных рентгенограммах не видны артерии, вены и лимфатические сосуды, поскольку они поглощают рентгеновское излучение так же, так и окружающие их ткани. Для того чтобы сосуды можно было увидеть, применяются методы ангиографии. Исследование артерий называется артериографией, вен – венографией (флебографией), лимфотических сосудов – лимфографией [25]. Для искусственного контрастирования сосудов в них вводят раствор органического соединения йода (рис. 3). Естественно, период выведения контрастного вещества не позволяет длительно проводить измерения сердечно-сосудистой системы, и точно визуализировать микрососудистое русло. В некоторой степени только дополнительные методы компьютерной обработки полученных изображений позволяют более детально оценить сосуды разного калибра.
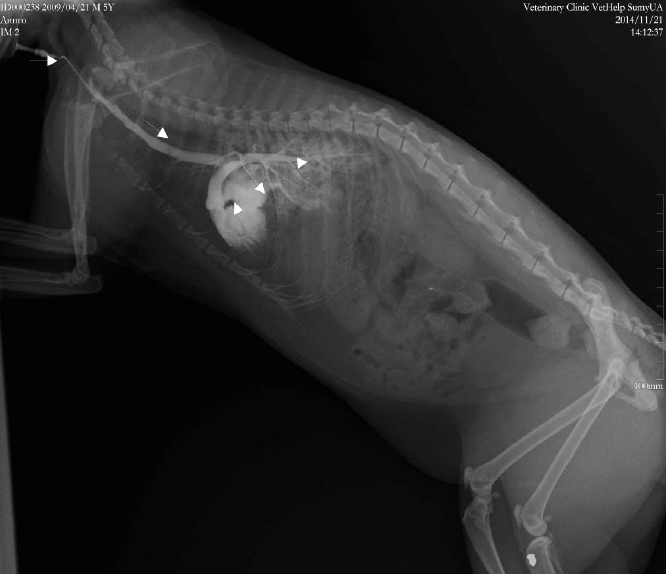
Ангиографию проводят после общеклинического обследования животного, если другие методы исследования не позволяют установить правильный диагноз. Результаты этого исследования помогают выявить повреждения и пороки развития сосудов (аневризмы, сужения сосудов, мальформации), нарушения проходимости сосудов, повреждения и пороки развития различных органов, образование опухолей. Ангиография обладает одним важным преимуществом, недоступные другим методам изображения сосудов — на экране аппарата можно увидеть физиологию движения крови по сосудам, выявить многие сосудистые болезни.
Еще одним из методов визуализации сосудов в медицинской и ветеринарной практике является магнитно-резонансная ангиография. Это высокоинформативный и безопасный метод диагностики, позволяющий оценить анатомические и функциональные особенности кровеносного русла интересующей области. Проведение магнитно-резонансной ангиографии головного мозга у мелких домашних и лабораторных животных требует выполнения ряда обязательных условий: обшей анестезии и подбора оптимальных программ сканирования [26, 27]. Для получения изображений движущихся жидкостей в артериях, венах и пространствах головного мозга, содержащих спинномозговую жидкость, применяют, как правило, 2 основные методики: времяпролетную и фазовоконтрастную ангиографию. Методики основаны на одном физическом принципе, но способ реконструкции изображения и возможности визуализации различаются. Обе методики позволяют получить как двухмерное (2D), так и трехмерное (3D) изображение. Получение изображения основано на селективном возбуждении (насыщении) радиочастотным импульсом тонкого среза исследуемой области. Затем происходит считывание суммарного магнитного спина, который увеличивается в сосуде из-за того, что происходит вымещение током крови.
Все наборы полученных «сырых» данных ангиографии в последующем подвергаются постпроцессорной обработке по алгоритму сложения проекций максимальных интенсивностей (Maximum Intensity Projection – MIP) c oдного суммирующего изображения, с возможностью реконструкции в любой проекции, в привычном для всех ангиографий виде. Результаты сканирования позвоночника, спинного и головного мозга животных – МР-томограммы и МР-ангиограммы – обрабатываются, как правило, на компьютере, совмещенном со сканером и используют для реконструкции изображения [28]. Учитывая отсутствие ионизирующего излучения и лучевой нагрузки на животное, магнитно-резонансную ангиографию смело можно считать безопасным, неинвазивным методом скрининга сосудистой патологии, позволяющим за короткое время получить изображение сосудистого русла, а также с помощью реконструкции полученных изображений в 3D-режиме оценить пространственное расположение и взаимоотношение сосудистых структур.
Наряду с прямыми методами изучения микроциркуляции, существуют и непрямые методы, основанные на изучении метаболитов тканевого обмена. По мнению А. Ткачук (2002), уровень лактата в крови применяется для мониторирования уровня тканевой гипоксии, а, следовательно, и нарушения микроциркуляции: утилизация пирувата зависит от наличия О2, а соответственно снижение доставки О2 к клеткам приводит к увеличению продукции лактата и повышению его уровня в крови. Гипоксия тканей определяется как дисбаланс между потребностью в кислороде и его доставкой (DO2). При снижении DO2 ткани обеспечивают потребность в кислороде, увеличивая экстракцию кислорода из артериальной крови. Это выражается в увеличении индекса экстракции кислорода (O2ER) и снижении сатурации смешанной венозной крови (SvO2 %). В норме в тканях экстрагируется около 25% О2, доставляемого артериальной кровью. П.А. Лебедев (2004) подчеркивает неспецифичность таких традиционных признаков критического нарушения микроциркуляторного кровотока, наиболее часто встречающемся при шоке, как ЧСС, АД, температура кожи, диурез. Даже интерпретация таких параметров гемодинамики, как давление заклинивания в легочной артерии и сердечный выброс, может быть неоднозначной при прогрессировании шока. Нарушение DO2 к тканям, приводящее к повреждению метаболизма пирувата, будет выражаться в накоплении лактата, увеличении дефицита оснований, анионного промежутка и снижении системного рН. Наиболее информативны прямые измерения DO2 и потребления кислорода тканями (VO2), производимые с обязательным вычислением Qt, SaO2%, SvO2 % [29, 30]
Кроме перечисленных методов, в настоящее время особое значение приобретают исследования по капилляроскопии (Marick, Le Roy, (1973, 2006); Carpentier, Franco (1981); Bollinger, Fagrell (1990). Так, в ряде исследований было убедительно показано важное значение капилляроскопической техники для диагностики микроциркуляторных расстройств, однако в ветеринарии данная технология пока прктически не используется. С помощью компьютерного капилляроскопа можно оценить диаметр капилляров, скорость капиллярного кровотока (объемную и линейную), плотность капиллярной сети, которые регистрируются в интересующих исследователя областях. Исследование с применением такого устройства проводится безболезненно, без отбора крови, в различных условиях и режимах. При этом объект исследования – капиллярная сеть ткани или органа, на которую наносится капля иммерсионного масла, далее объект фиксируется под объективом микроскопа, в специальном ложе. Для получения точного изображения в фокус оптической системы подводятся капилляры. Процесс выполняется в 2 этапа: проводится обзорное исследование (увеличение в 175-кратном размере), а затем основное исследование (×400/800).
Анализ полученных данных проводится автоматически с помощью персонального компьютера. Таким образом, с помощью капилляроскопа можно точно и качественно определять, фиксировать, а также анализировать множество показателей (параметры, спектры капиллярной крови, плотность капиллярной сети). Использование прибора особенно важно применять на ранних стадиях заболевания, когда другие диагностические устройства не способны замечать происходящие изменения, правильно и точно оценивать состояние микроциркуляции. Роль капилляроскопа неоценима в ходе проведения мониторинга состояния при операции или реабилитации.
Интерес к исследованию микрососудистого русла системы кровообращения обусловлен громадной ролью капилляров в осуществлении главнейших процессов жизнедеятельности организма, трофическом обеспечении органов и их непосредственном участии в тканевом и клеточном дыхании. От согласованной работы сердца, крупных кровеносных магистралей и микрососудов звена микрогемоциркуляции системы кровообращения в целом зависят здоровье и продолжительность жизни живого организма. Поэтому для глубокого анализа микроциркуляции используется фазочувствительный лазерный метод, предназначенный исследовать биомеханику микрососудов тканей и органов. Данный метод позволяет: регистровать поперечные перемещения стенок микрососудов – артериол, капилляров и венул; измерять амплитуды и частоты колебаний стенок микрососудов системы кровообращения; фиксировать перемещения стенок микрососудов – результат сокращения гладкомышечных элементов артериол и венул; регистрировать связь между наблюдаемым уширением пьедестала в спектре рассеяния от стенок микрососудов со скоростью кровотока в них [31, 32].
Помимо регистрации данных микроциркуляции сосудистого русла на различном оборудовании в комплексе с программным обеспечением существуют методы обычного микроскопического анализа фото- и видеофайлов на подходящей для исследователя аппаратуре в комплексе с дополнительным оборудованием и методиками исследования сосудов (в частности, магнитно-резонансной томографией) [33] (рис. 4).
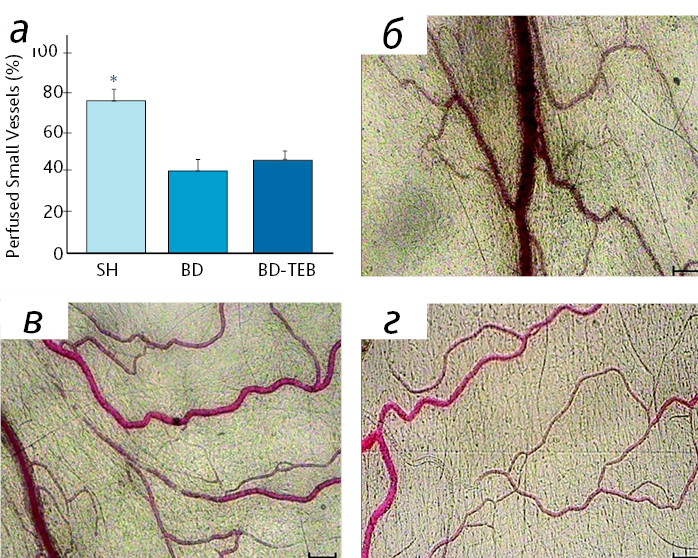
Примечание. * р<0,05 по сравнению с другими группами); б, в, г – микрофотографии брыжейки микрососудов в SH, BD и BD-TEB группы соответственно
При этом чаще всего проводят троекратный замер нужного сосуда – диаметр в каждый момент времени, с последующим усреднением значений, причем замеры осуществляются от внутренней полости, что очень важно. Плотность сосудов измеряется обычно при визуализации всех видимых сосудов в рабочем окне фото-, видео аппаратуры при увеличении ×100 и расчете длины объединенных сосудов для получения полноценного измерения общей длины на единицу площади участка [3, 34].
Кроме того, существует оборудование для работы на изолированных сосудах разного калибра – миографы. Они позволяют проанализировать функциональные способности сосудов артериального происхождения [35].
Заключение
Данные о состоянии микроциркуляции сосудистого русла у животных способствуют качественной дифференцированной диагностике в ветеринарной практике и правильному выбору модели патологического состояния для эксперимента. В настоящее время для визуализации и исследования микроциркуляции сосудистого русла предпочитают неинвазивные методы. Следует отметить, в зависимости от выбираемого метода исследования микроциркуляции сосудистого русла подбирается или применяется установленный алгоритм обработки данных. Методы визуализации позволяют вести не только видео- и фотофайлы, но также и выполнять прижизненные наблюдения. Кроме того, существуют различные подходы, основанные на методе, например, измерения скорости клеток в потоке с помощью видеозаписи движения клеток (анемометрия по изображениям частиц).
В связи с интенсивным развитием диагностических методов, сейчас особое практическое значение приобретают спектрофотометрия, реовазография, лазерная допплеровская флоуметрия. Наиболее популярными становятся ультразвуковая биомикроскопия, СВЧ-радиотермометрия, методы рентгеноконтрастных исследований, вазография, вено- и лимфографии; особое место в изучении микрососудистого русла по своей информативности занимают магнитно-резонансная ангиография, пульсовая оксиметрия и компьютерная капилляроскопия (в экспериментальной практике). Помимо этого, существуют и непрямые методы визуализации сосудов микроциркуляторного русла, основанные на изучении метаболитов тканевого обмена.
Однако оптическая техника (люминесцентный, ультрафиолетовый, интерференционный, фазовоконтрастный микроскопы), оптические квантовые генераторы, достижения электроники (электронный и телевизионный микроскопы), новые типы датчиков и усилителей имеют существующие ограничения в практическом применении (не позволяют проанализировать функциональный аспект в исследовании звеньев микроциркуляции). Поэтому знания в этой области в основном остаются на уровне морфологии и отдельных компонентов. Следует отметить, что интравитальная флюоресцентная цифровая микроскопия крови и лимфатического потока становится крайне привлекательным методом для применения на практике
Список источников
- Чернух А.М., Александров П.Н., Алексеев О.В. Микроциркуляция. Монография. Под общей ред. А. М. Чернуха. М.: Медицина. 1984; 432.
- Simas R., Ferreira S.G., Menegat L., Zanoni F.L., Correia Cr.J. and et. Mesenteric hypoperfusion and inflammation induced by brain death are not affected by inhibition of the autonomic storm in rats. Clinics (Sao Paulo). 2015; 70 (6): 446–52. doi: 10.6061/clinics/2015(06)11
- Wauters S., Somers J., De Vleeschauwer S., Verbeken E., Verleden G..M. et al. Evaluating lung injury at increasing time intervals in a murine brain death model. J. Surg. Res. 2013; 183 (1): 419–26.
- Андреева И.В., Виноградов А.А. Перспективы использования современных методов визуализации в морфологических и экспериментальных исследованиях. Наука молодых (Eruditio Juvenium). 2015; 4: 56–9.
- Карелин М.С. Магнитно-резонансная томография в ветеринарной медицине. Ветеринарный доктор. 2007; 4: 2–4.
- Hirche N. Real-time lymphography by indocyanine green fluorescence: improved navigation for regional lymph node staging. N. Hirche, H. Engel, Z. Hirche et al. Ann. Plast. Surg. 2014; 73 (6): 701–5. doi:10.1097/SAP.0b013e3182858831
- Unno N., Inuzuka K., Suzuki M. et al. Preliminary experience with a novel fluorescence lymphography using indocyanine green in patients with secondary lymphedema. J. Vasc. Surg. 2007; 45 (5): 1016–21. doi:10.1016/j.jvs.2007.01.023
- Zhu B. A review of performance of near-infrared fluorescence imaging devices used in clinical studies / B. Zhu, E.M. Sevick-Muraca. Br.J. Radio. 2015; l88 (1045): 20140547. doi:10.1259/bjr.20140547
- Lindken R. Micro-Particle Image Velocimetry (µPIV): Recent developments, applications, and guidelines / R. Lindken, M. Rossi, S. Große, J. Westerweel. Lab. Chip. 2009; 9: 2551–2567. doi:10.1039/B906558J
- Sugii Y. In vivo PIV measurement of red blood cell mesentery motion. Y. Sugii, S. Nishio, K. Okamoto. Physiol. Meas. 2002; 23: 403–16.
- Kazemzadeh A. The Effect of Contact Angles and Capillary Dimensions on the Burst Frequency of Super Hydrophilic and Hydrophilic Centrifugal Microfluidic Platforms, a CFD Study. Kazemzadeh A., Ganesan P., Ibrahim F. et al. PLoS One. 2013; 8 (9): e73002. doi:10.1371/journal.pone.0073002
- Shakeria M. Optical Imaging of Steady Flow in a Phantom Model of Iliac Artery Stenosis: Comparison of CFD Simulations with PIV Measurements. M. Shakeria, I. Khodarahmia, M. S. Keith, A. A. Aminia Proc. SPIE. 2010; 7626: 76260L-1.
- Гуревич М.И., Соловьев А.И., Литовченко Л.П., Доломан Л. Б. Импедансная реоплетизмография. Киев: Наукова думка, 2002; 176.
- Дерябин Е.И., Двинянинова Е.Е., Ваганова Н.В. Применение фотоплетизмографии для исследования локального кровотока челюстно-лицевой области. Лазерная медицина. 2000; 3 (2): 18–26.
- Лебедев П.А., Калакутский Л.И., Власова С.П., Горлов А.П. Диагностика функции сосудистого эндотелия у больных с сердечно-сосудистыми заболеваниями: методические рекомендации. Самара. 2004; 18.
- Крупаткина А.И. Лазерная допплеровская флоуметрия микроциркуляции крови: руководство для врачей. А.И. Крупаткина, В.В. Сидорова. М.: Медицина. 2005; 256.
- Козлов В.И. Оценка состояния гемомикроциркуляции в тканях с помощью лазерной допплеровской флоуметрии. В. И. Козлов. М.. 2001; 24.
- Маколкин В.И., Бранько В.В., Богданова Э.А. Метод лазерной допплеровской флоуметрии в кардиологии. Пособие для врачей. М., 2001; 42.
- Kelly R.P. Determination of age-related increases in large artery stiffness by digital pulse contour analysis /R.P. Kelly, S.C. Millasseau, P.J. Chowienczyk. Clinical Science. 2002; 103: 371–7.
- Zufferey P., Depairon M., Chamot A. M., Monti M. Prognostic significance of nailfold capillary microscopy ir patients with Raynaud’s phenomenon and scleroderma-pattern abnormalities. Clinical Rheumatology. 2002; 11 (4): 536–41.
- Терехов И.В., Дзюба М.А., Бондарь С.С. и др. Оценка альвеолярно-капиллярных нарушений при развитии тяжелого гемодинамического отека легких у крыс и их коррекция с помощью СВЧ - излучения. Саратовский научно-медицинский журнал. 2011; 7 (2): 389–92.
- Деннис Р. Диагностическая визуализация опухолей. Онкологические заболевания мелких домашних животных. М.: Аквариум. 2002; 31–81.
- Хан К. М., Херд Ч. Д. Ветеринарная рентгенография. М.: Аквариум. 2006; 296.
- Белов А.Д. Опухоли. Общая ветеринарная хирургия. М.: Агропромиздат. 1990; 592.
- Савельев В.С. Флебология. Руководство для врачей. М.: Медицина, 2001; 664.
- Козлов В.И., Мач Ф.Б., Литвин О.А. Метод лазерной допплеровской флоуметрии. Пособие для врачей. Москва. 2001; 48.
- Wessmann, A., Chandler, K., Garosi, L. Ischaemic and haemorrhaqic stroke in the dog. The Veterinary Journal, 2009; 180: 290–303. doi: 10.1016/j.tvjl.2007.12.023
- Ринк П. А. Магнитный резонанс в медицине. Основной учебник Европейского форума по магнитному резонансу: пер. с англ. В.Е. Синицина, Д.В. Устюжанина. Под.ред. В.Е. Синицина. М.: ГЭОТАР-МЕД, 2003; 256.
- Ткачук В.А. Клиническая биохимия. М.: ГЭОТАР МЕД, 2002; 306.
- Baskurt O.K. The effect of red blood cell aggregation on blood flow resistance. O.K. Baskurt, M. Bor-Kucukatay, O. Yalcin. Biorheology. 1999; 36 (5–6): 447-52.
- Багаев С.Н., Захаров В.Н., Орлов В.А., Панов С.В., Фомин Ю. Н. Исследование физических механизмов микроциркуляции крови и транскапиллярного обмена с использованием фазочувствительного метода. Российский журнал биомеханики, 2006; 10 (3): 22–40.
- Bagayev S.N. The phenomenon of formation of an acoustic field in the lumens of microvessels of the blood circulation system. S.N. Bagaev, V.N. Zakharov, Yu.D. Obraztsov, S.V. Panov, Yu.N. Fomin. Technical digest. Moscow LAT. 2002; 147. doi:10.1117/12.518705
- Saba L., Berritto D., Iacobellis F., Scaglione M. and et. Acute arterial mesenteric ischemia and reperfusion: Macroscopic and MRI findings, preliminary report. World J Gastroenterol. 2013; 19 (40): 6825–33. doi: 10.3748/wjg.v19.i40.6825
- Morris C.E., Skalak T.C. Chronic static magnetic field exposure alters microvessel enlargement resulting from surgical intervention. Journal of Applied Physiology. 2007; 103 (2): 629–36. 10.1152/japplphysiol.01133.2006
- McIntyre C.A., Williams B.C., Lindsay R.M., McKight J.A. Preservation of vascular function in rat mesenteric resistance arteries following cold storage, studied by small vessel myography. P.W.F. British Journal of Pharmacology. 1998; 123: 1555–60. doi: 10.1038/sj.bjp.0701768




