Опыт применения теста максимизации магнуссона и клигмана на морских свинках при оценке сенсибилизирующего потенциала химических веществ
Каргопольцева Д.Р., Крышень К.Л., Кательникова А.Е., Гущин Я.А., Макарова М.Н., Макаров В.Г. Опыт применения теста максимизации магнуссона и клигмана на морских свинках при оценке сенсибилизирующего потенциала химических веществ. Лабораторные животные для научных исследований. 2018; 4. https://doi.org/10.29296/2618723X-2018-04-06
Резюме
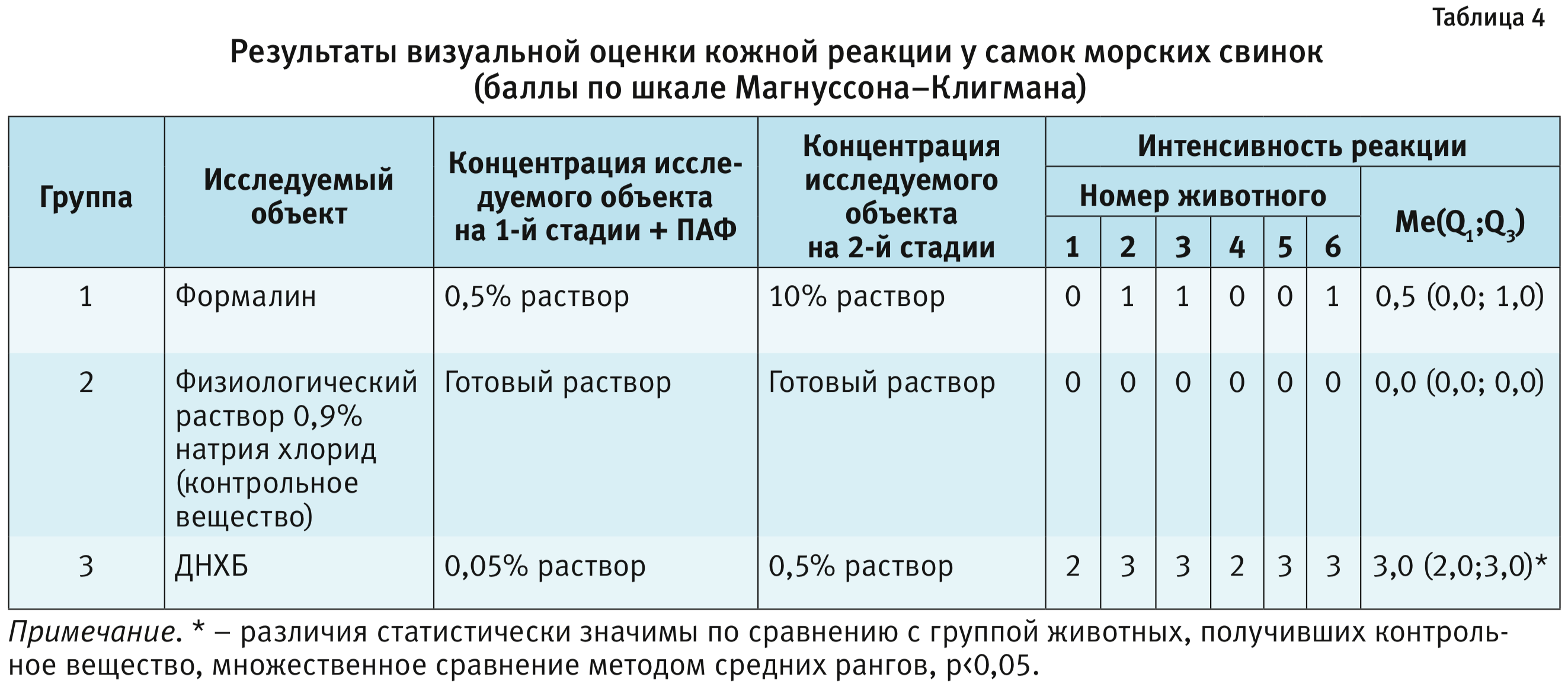
Резюме. Для регистрации лекарственных препаратов для накожного применения необходимо, согласно OECD Test No: 406, изучение сенсибилизирующего потенциала в тесте максимизации Магнуссона и Клигмана (адъювантный тест) и тесте Бюхлера (неадъювантный тест). В качестве адъюванта в тесте максимизации Магнуссона и Клигмана используется полный адъювант Фрейнда (ПАФ), который неспецифически усиливает иммунную реакцию на чужеродные антигены, способствуя, таким образом, усилению иммунного ответа на 1-й стадии сенсибилизации. Поскольку в Европейском Союзе рекомендовано применение теста максимизации Магнуссона и Клигмана, мы провели процедуру данного теста и описали ее. Приведен также анализ сенсибилизирующего потенциала химических веществ на примере растворов формалина и динитрохлорбензола, которые можно использовать в качестве позитивного контроля при проведении дальнейших исследований. Исследование включало в себя 3 стадии: стадия сенсибилизации (1-я) с внутрикожным введением исследуемых объектов и ПАФ, стадия сенсибилизации (2-я) и стадия разрешения с накожными аппликациями (3-я). На стадии сенсибилизации исследуемые объекты применяли в концентрации, описание которой имеется в литературе, которая не вызывает чрезмерного раздражения кожи и системной реакции организма, а на стадии разрешения концентрация исследуемых объектов вовсе не вызывает кожно-раздражающего действия. Оценку кожной реакции проводили через 48 и 72 ч после нанесения разрешающей дозы исследуемых объектов по балльной шкале Магнуссона–Клигмана. Согласно итогам исследования, более интенсивная кожная реакция, как при визуальной, так и микроскопической оценке, была выявлена при использовании динитролхлорбензола.
Введение
Для регистрации новых лекарственных препаратов в Российской Федерации и в рамках Евразийского Экономического Союза (ЕАЭС) должны быть предоставлены данные по изучению аллергизирующих свойств. В перечень доклинических исследований аллергизирующих свойств входит оценка сенсибилизирующего потенциала химических веществ и лекарственных средств (ЛС) для наружного применения с целью уточнения вероятности развития контактного дерматита [1]. Для этих исследований обычно используются морские свинки, на которых были разработаны 2 типа тестов: адъювантные тесты, где сенсибилизация инициируется введением полного адъюванта Фрейнда (ПАФ), и неадъювантные тесты. В настоящее время предпочтение отдается максимизационному адъювантному тесту на морских свинках (GPMT) Магнуссона и Клигмана, и неадъювантному тесту Бюхлера. Однако максимизационный тест имеет преимущество, поскольку потенциал сенсибилизации оптимизирован использованием ПАФ, который неспецифически усиливает иммунную реакцию на чужеродные антигены, способствуя таким образом, усилению иммунного ответа на 1-й стадии сенсибилизации. В Европейском Союзе в 90% случаев для выявления кожной сенсибилизации прибегают к тесту Магнуссона и Клигмана на морских свинках [2].
Тест максимизации на морских свинках впервые был предложен в 1969 г. дерматологами Бертилем Магнуссоном и Альбертом Клигманом [3] и далее описан в их книге «Аллергический контактный дерматит на морских свинках», опубликованной в 1970 г.
В настоящее время данный тест регламентируется Руководством OECD (Organization for Economic Cooperation and Development) Guidelines for testing of chemicals: Test No. 406: Skin Sensitisation [1], которое соответствует межгосударственному стандарту ГОСТ 32375-2013 [4].
Суть метода заключается во введении исследуемых объектов морским свинкам альбиносам в 3 этапа (рис. 1).
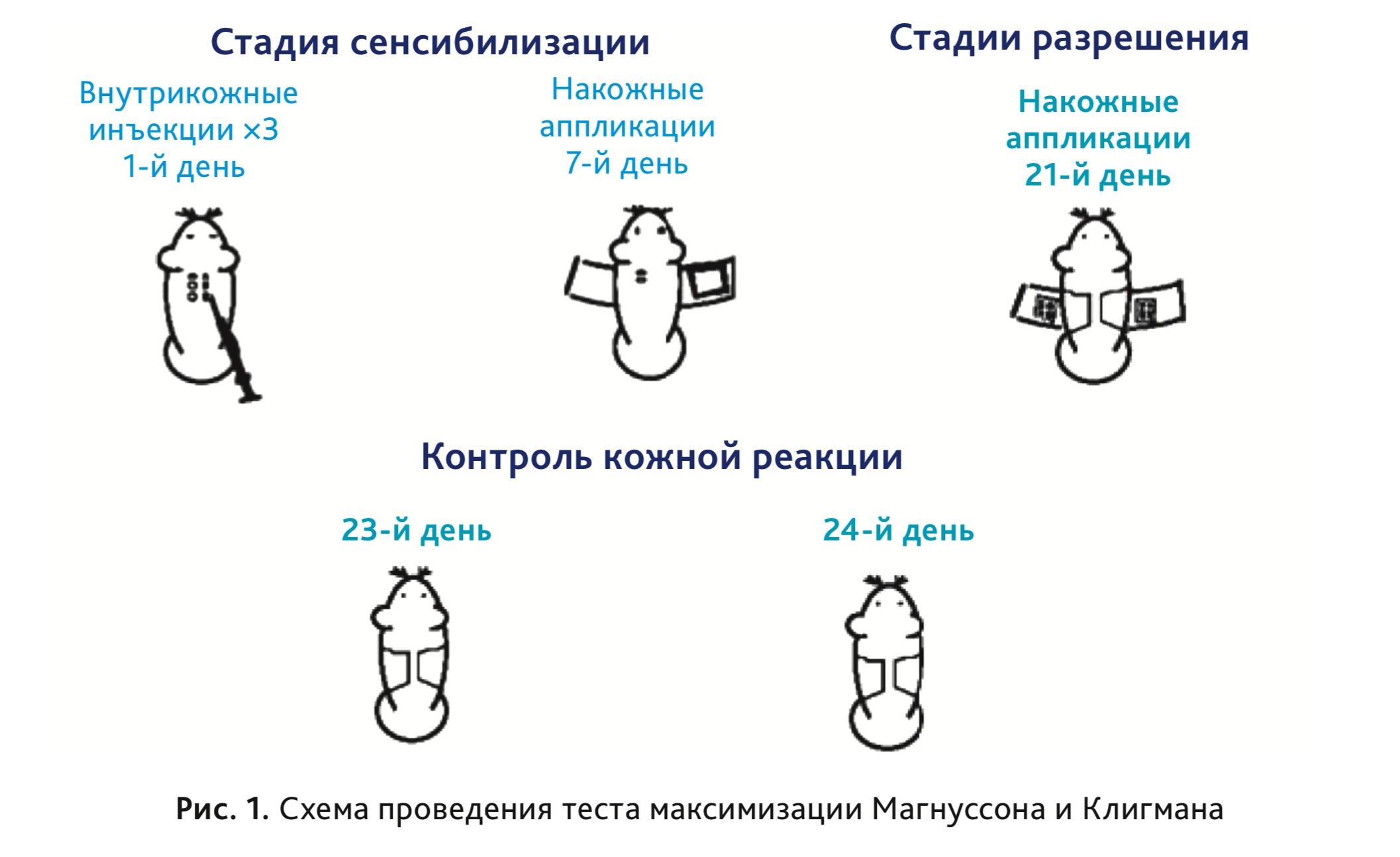
- 1-я стадия сенсибилизации: внутрикожное введение исследуемых объектов в концентрации, не вызывающей чрезмерного раздражения кожи и системной реакции в 1-й день эксперимента;
- 2-я стадия накожных аппликаций: накожные аппликации исследуемыми объектами в концентрации, не вызывающей чрезмерного раздражения кожи и системной реакции на 7-й день эксперимента;
- 3-я стадия разрешения: накожные аппликации в концентрации, не имеющей кожно-раздражающего действия на 21-й день эксперимента.
Через 48 ч после введения разрешающей дозы исследуемых объектов оценивается кожная реакция по шкале Магнуссона–Клигмана в баллах. Через 72 ч после введения разрешающей дозы проводят повторную оценку кожной реакции. Тест можно считать положительным в случае выявления кожной реакции у 30% животных из группы [1, 4].
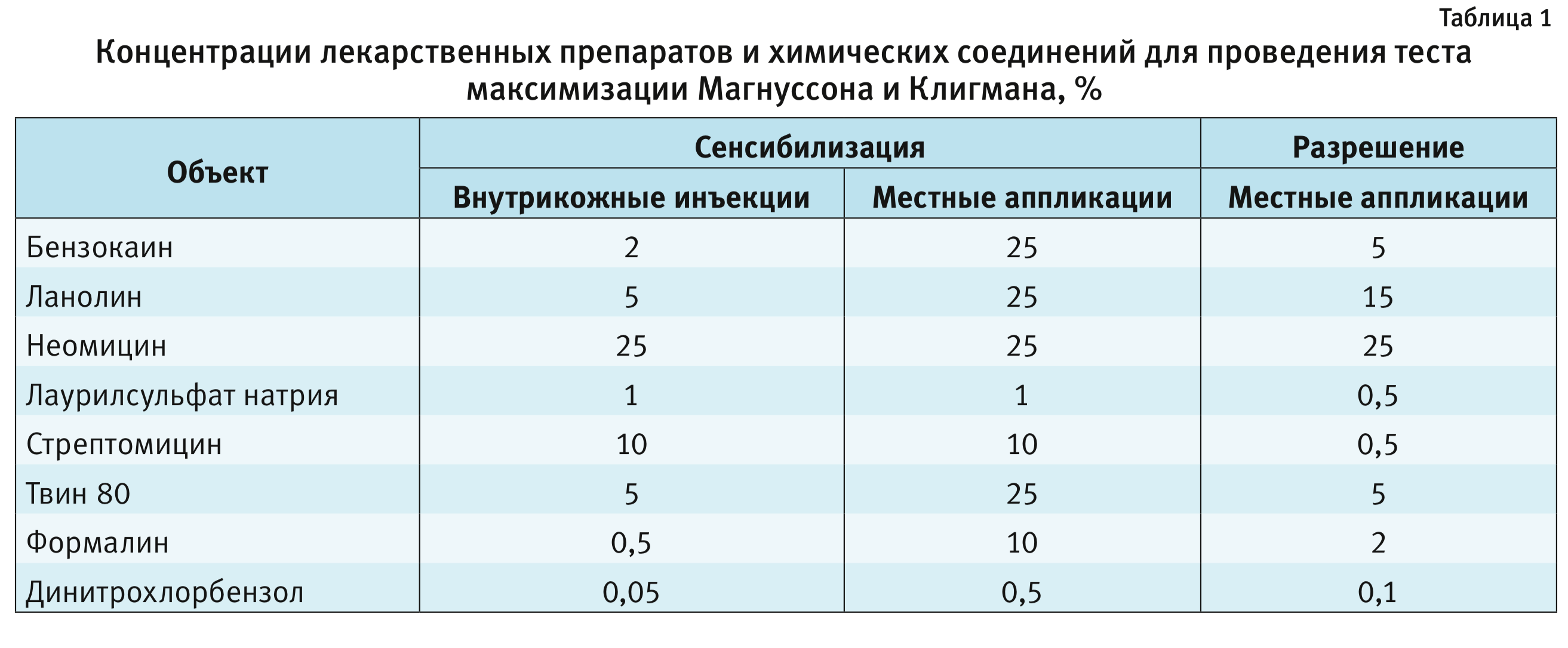
В настоящее время в литературе есть много данных с результатами проведения теста максимизации по методу Магнуссона и Клигмана и изучения сенсибилизирующих свойств различных лекарственных препаратов и химических соединений, некоторые из них представлены в табл. 1 [5–7].
С учетом анализа данных литературы были выбраны исследуемые объекты для проведения инициативного исследования по отработке теста максимизации с подтвержденным сенсибилизирующим потенциалом. Исследуемые объекты – медицинский формалин и динитрохлорбензол (ДНХБ), которые вызывают выраженную кожную реакцию в виде умеренной и сплошной эритемы, интенсивной эритемы и отека. Для последних уже были подобраны оптимальные концентрации для применения на всех стадиях эксперимента.
Цель данного исследования – оценка сенсибилизирующего потенциала химических веществ на примере формалина и динитрохлорбензола в тесте максимизации Магнуссона и Клигмана для применения в дальнейшей работе в качестве позитивного контроля.
Материал и методы
Экспериментальные животные. Исследования проводили на самках морских свинок альбиносов, полученных из питомника НПО «Дом Фармации».
Условия содержания. Морских свинок содержали группами по 3 особи в стандартных прозрачных пластиковых клетках, на древесном подстиле, в контролируемых условиях окружающей среды (температура воздуха – 20–26°C, относительная влажность – 30–70%). Световой режим: 12 ч света и 12 ч темноты. Стандартный корм для лабораторных животных: «ЛБК-120» (Тосненский комбикормовый завод); воду животные получали ad libitum. Дополнительно в рацион морских свинок входило сено. Данная научно-исследовательская работа была рассмотрена на биоэтической комиссии Института доклинических исследований и одобрена для проведения (№БЭК 1.10/18 от 2 февраля 2018 г.).
Исследуемые объекты. Согласно данным литературы, на стадии сенсибилизации исследуемые объекты необходимо применять в такой концентрации, которая не будет вызывать чрезмерного раздражения кожи и системной реакции организма, а на стадии разрешения концентрация исследуемых объектов вовсе не должна вызывать кожно-раздражающего действия [5, 11, 12]. В качестве исследуемых объектов были выбраны медицинский формалин и ДНХБ. Их концентрации выбирали, основываясь на данных литературы [1, 5, 6].
Дозы и способ введения. В соответствии с OECD Test No. 406, исследуемые объекты вводили однократно внутрикожно на стадии сенсибилизации на 1-й день эксперимента. На 7-й день эксперимента на стадии сенсибилизации животным однократно накожно наносили фрагменты фильтровальной бумаги, предварительно смоченные исследуемыми объектами, которые затем закрепляли на теле животного с помощью самофиксирующегося бинта на 48 ч. На 21-й день эксперимента в стадию разрешения животным однократно накожно наносили фрагменты фильтровальной бумаги, предварительно смоченные исследуемыми объектами, которые затем закрепляли на теле животного на 24 ч так, как это описано выше [7, 8].
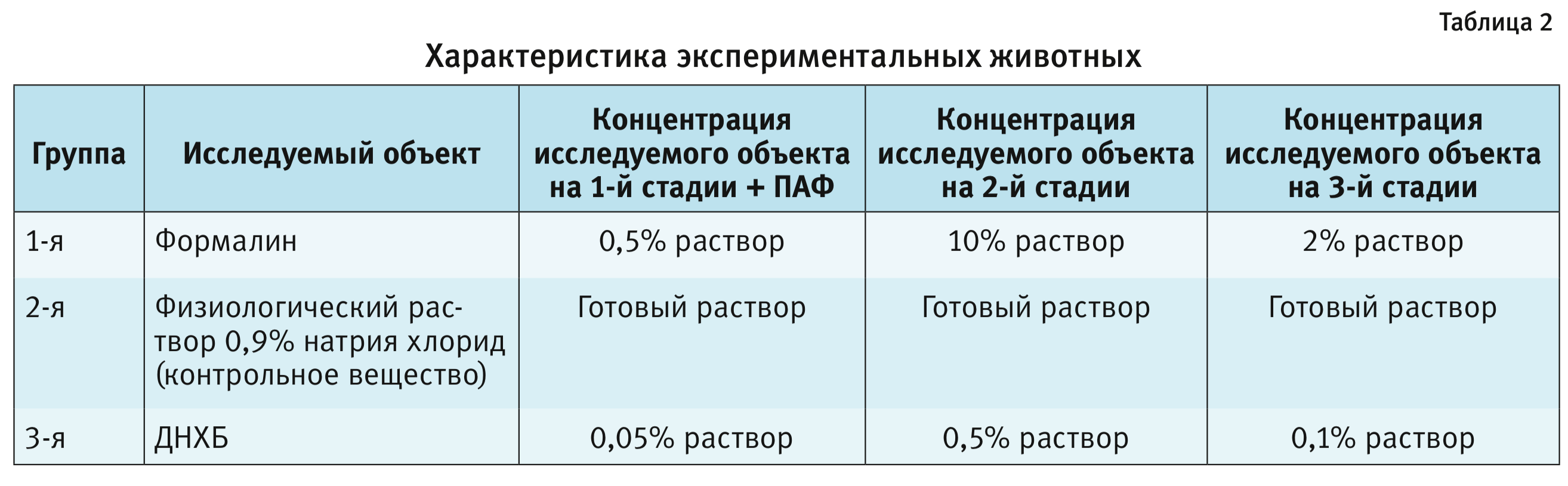
На 1-й стадии сенсибилизации в 1-й день эксперимента формалин и раствор ДНХБ вводили животным в виде 0,5% и 0,05% растворов соответственно. Далее, на 2-й стадии сенсибилизации на 7-й день эксперимента формалин и раствор ДНХБ наносили в виде 10 и 0,5% растворов соответственно. Разрешение проводили на 21-й день эксперимента путем накожного нанесения формалина и раст-вора ДНХБ в виде 2 и 0,1% растворов соответственно.
В качестве контроля в эксперимент была включена группа животных, которым вводили и наносили физиологический раствор 0,9% натрия хлорида по аналогичной схеме в готовой концентрации.
Дизайн исследования. Для проведения данного исследования было сформировано 3 группы животных по 6 самок морских свинок (табл. 2).
Стадия 1-я. Сенсибилизация: внутрикожные инъекции (1-й день эксперимента)
Перед внутрикожным введением исследуемых объектов участок кожи
3×2 см в области спины (куда
осуществляли введение) выбривали. Животным осуществляли 3 пары внутрикожных инъекций по обе стороны от срединной
линии спины (рис. 2).
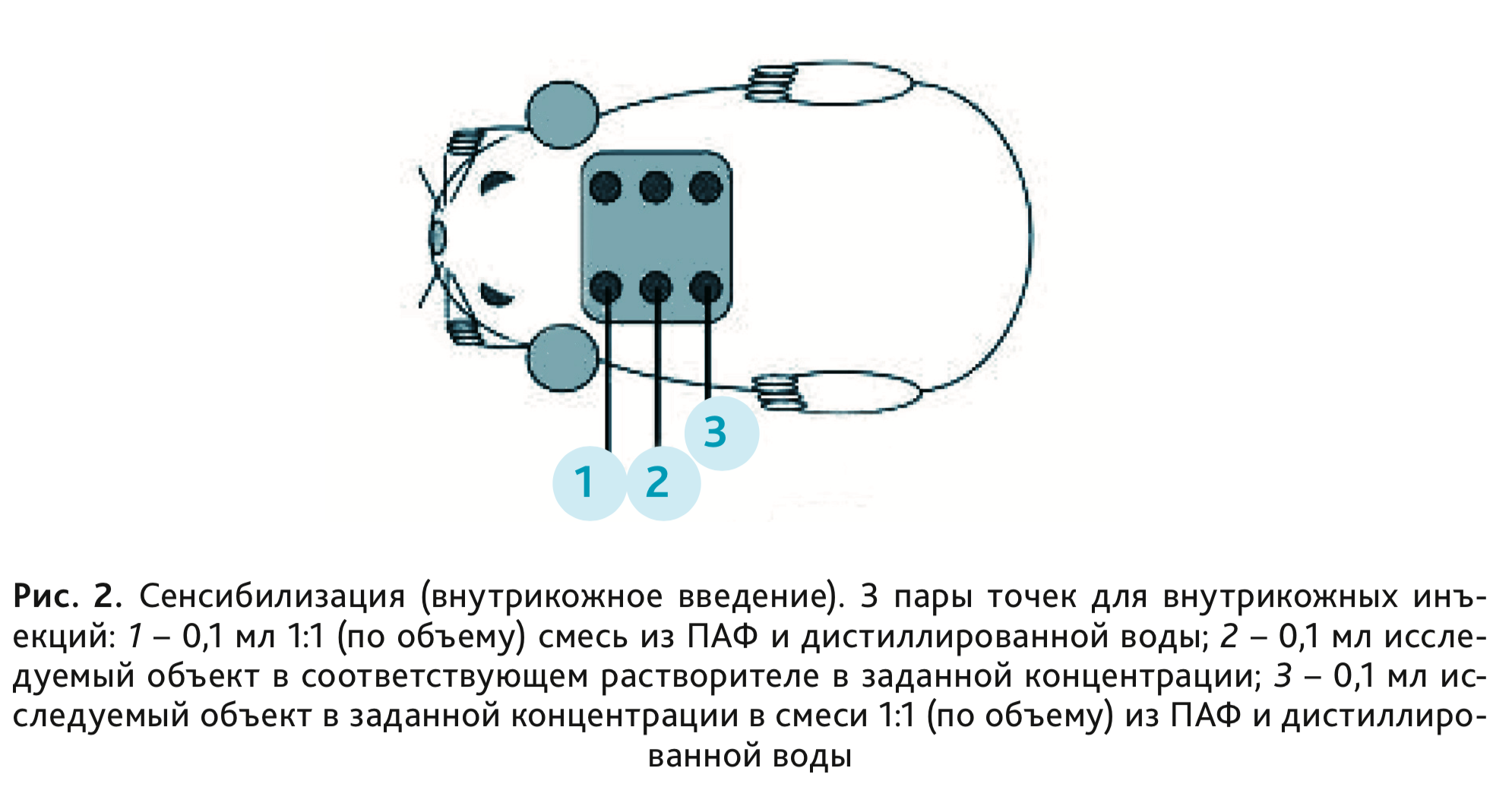
- Инъекция 1: смесь из ПАФ и дистиллированной воды в соотношении 1:1 (по объему).
- Инъекция 2: исследуемый объект в соответствующей концентрации.
- Инъекция 3: исследуемый объект в соответствующей концентрации в смеси из ПАФ и дистиллированной воды в соотношении 2:1:1 (по объему).
Инъекции 1 и 2 делали рядом друг с другом ближе к голове, инъекцию 3 – на некотором отдалении от первых двух инъекций, ближе к хвостовой части тела [5–8].
Стадия 2-я. Сенсибилизация: местная аппликация (7-й день эксперимента)
Перед накожным нанесением исследуемых объектов в виде местных аппликаций участок кожи 4×5 см в области спины (куда осуществляли нанесение) выбривали.
Животным на выбритый участок кожи прикладывали кусочек фильтровальной бумаги (размер 2×4 см), предварительно пропитанный исследуемыми объектами в соответствующей концентрации в объеме 0,3 мл и закрепляли под герметичной повязкой из самофиксирующегося бинта (бандажа) фирмы «Pet flex», используемого в ветеринарии. После этого поверх самофиксирующегося бинта накладывали фиксирующий пластырь для более надежной фиксации на 48 ч (рис. 3).
Стадия 3-я. Стадия разрешения: местная аппликация (21-й день эксперимента)
Перед накожным нанесением исследуемых объектов в виде местных аппликаций участок кожи 4×5 см в области боковых поверхностей туловища (куда осуществляли нанесение) выбривали.
Животным наносили фрагменты фильтровальной бумаги, пропитанные исследуемыми объектами в объеме 0,3 мл, которые закрепляли на теле животных с помощью самофиксирующегося бинта (бандажа) фирмы «Pet flex», используемого в ветеринарии. После этого поверх самофиксирующегося бинта накладывали фиксирующий пластырь для более надежной фиксации на 24 ч (рис. 4) [5–8].

Регистрация кожной реакции (визуальная оценка). Приблизительно через 48 ч от начала разрешающей аппликации проводили наблюдение за кожной реакцией, регистрировали реакцию и оценивали ее в баллах, согласно шкале Магнуссона–Клигмана.
Примерно через 24 ч (приблизительно через 72 ч от начала разрешающей аппликации) проводили повторное наблюдение и регистрацию реакции и оценку в баллах в соответствии со шкалой Магнуссона–Клигмана (табл. 3).

Согласно ГОСТ 32375-2013 и OECD Test No. 406: Skin Sensitisation, схема проведения данного теста не включает в себя дополнительных исследований, но для получения более полной информации о влиянии исследуемых объектов на организм животных было решено провести гистологическое исследование участка кожи, куда осуществляли нанесение разрешающей дозы исследуемых объектов.
Методы гистологического исследования
Для гистологического исследования кожи материал фиксировали в 10% растворе нейтрального формалина в течение 24 ч [9], после чего по общепринятой методике заливали в парафин [10]. Затем изготавливали срезы толщиной 5–7 мкм, которые окрашивали гематоксилином и эозином. Анализ гистологических препаратов осуществляли при помощи светооптического микроскопа Carl Zeiss Axio Scope A1 (Германия) при увеличении 50, 100, 200 и 400. Микрофотографирование выполняли с помощью цифровой фотокамеры AxioCam ICc 1 и программного обеспечения AxioVision Rel. 4.8 (Германия).
Методы статистического анализа данных
Данные эксперимента оценивали в баллах, визуально, по соответствующей шкале. Результаты представлены в индивидуальных первичных картах. Для всех данных теста Магнуссона и Клигмана были рассчитаны медиана и квартильный размах. Для анализа данных был использован критерий Краскела–Уоллиса (Kruskal–Wallis) с последующим множественным сравнением средних рангов. Различия определяли при уровне значимости р≤0,05.
Статистический анализ был выполнен с помощью программного обеспечения Statistica 10.0 (StatSoft, США).
Результаты и обсуждение
Одной из задач, поставленных перед началом исследования, была отработка метода фиксации фильтровальной бумаги на 2-й стадии сенсибилизации и на стадии разрешения, так как при проведении предыдущих исследований по изучению сенсибилизирующих свойств лекарственных препаратов по методу Магнуссона и Клигмана фиксацию фильтровальной бумаги, пропитанной исследуемыми объектами, осуществляли с помощью марлевых бинтов, которые не обеспечивали должной степени фиксации и в течение 30 мин животные их снимали. В данном исследовании с учетом итогов отработки был выбран более подходящий метод фиксации повязки на 2-й стадии сенсибилизации. Фрагменты фильтровальной бумаги, пропитанные исследуемыми объектами, в области спины закрепляли с помощью самофиксирующегося бинта (бандажа) «Pet flex» (Andover, США), используемого в ветеринарии, после чего поверх самофиксирующегося бинта накладывали фиксирующий пластырь для более надежной фиксации. Такой метод фиксации обеспечивал закрепление фрагментов фильтровальной бумаги на 48 ч. Однако данный метод оказался непригодным для стадии разрешения, поскольку фиксирующая повязка накладывалась на туловище животного вблизи тазовых конечностей, вследствие чего животные выбирались из нее через несколько часов, и повязки накладывались повторно.
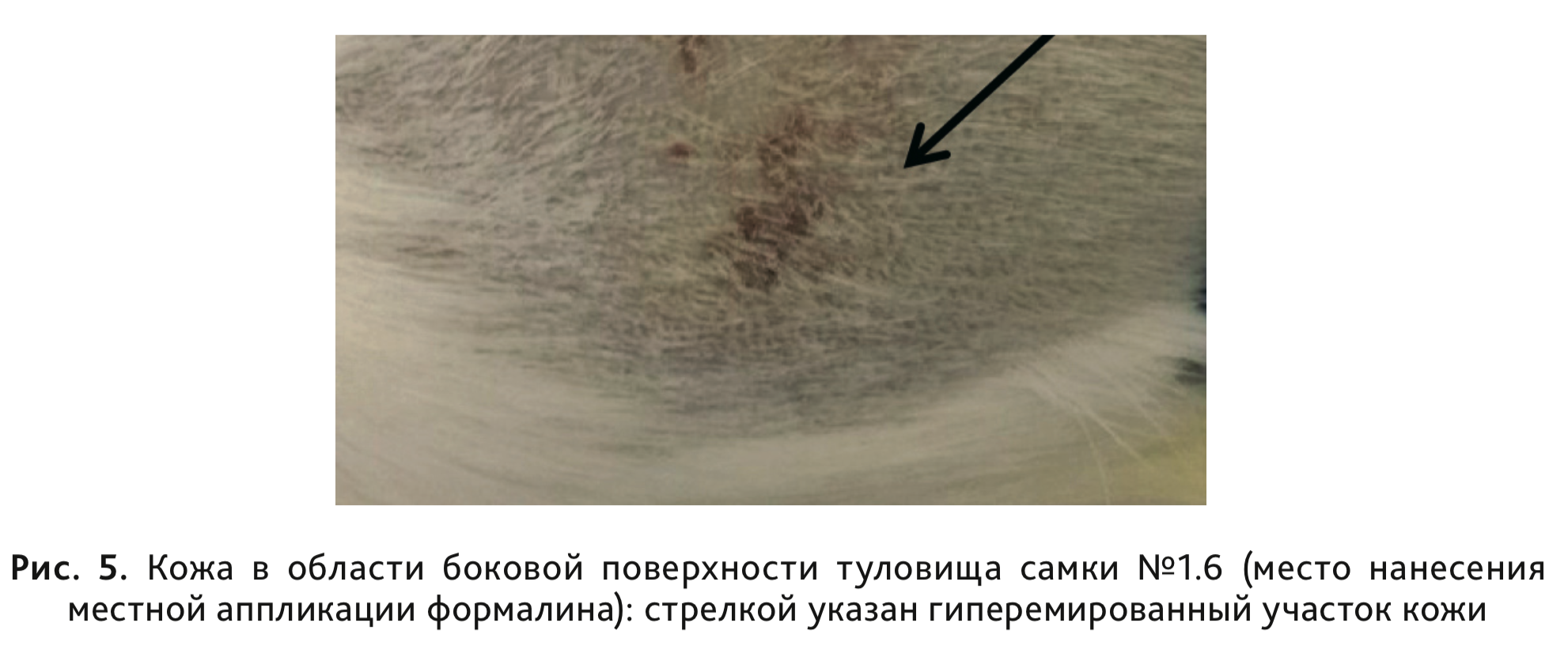
После накожного нанесения исследуемых объектов в разрешающей концентрации у морских свинок оценивали кожную
реакцию. Так, было зарегистрировано развитие разрозненной эритемы по шкале Магнуссона–Клигмана у 3 самок
морских свинок, сенсибилизированных раствором формалина
(рис. 5), еще у 3 – никаких видимых
изменений не обнаружено. Однако статистически значимых отличий по степени кожной реакции, выраженной в баллах,
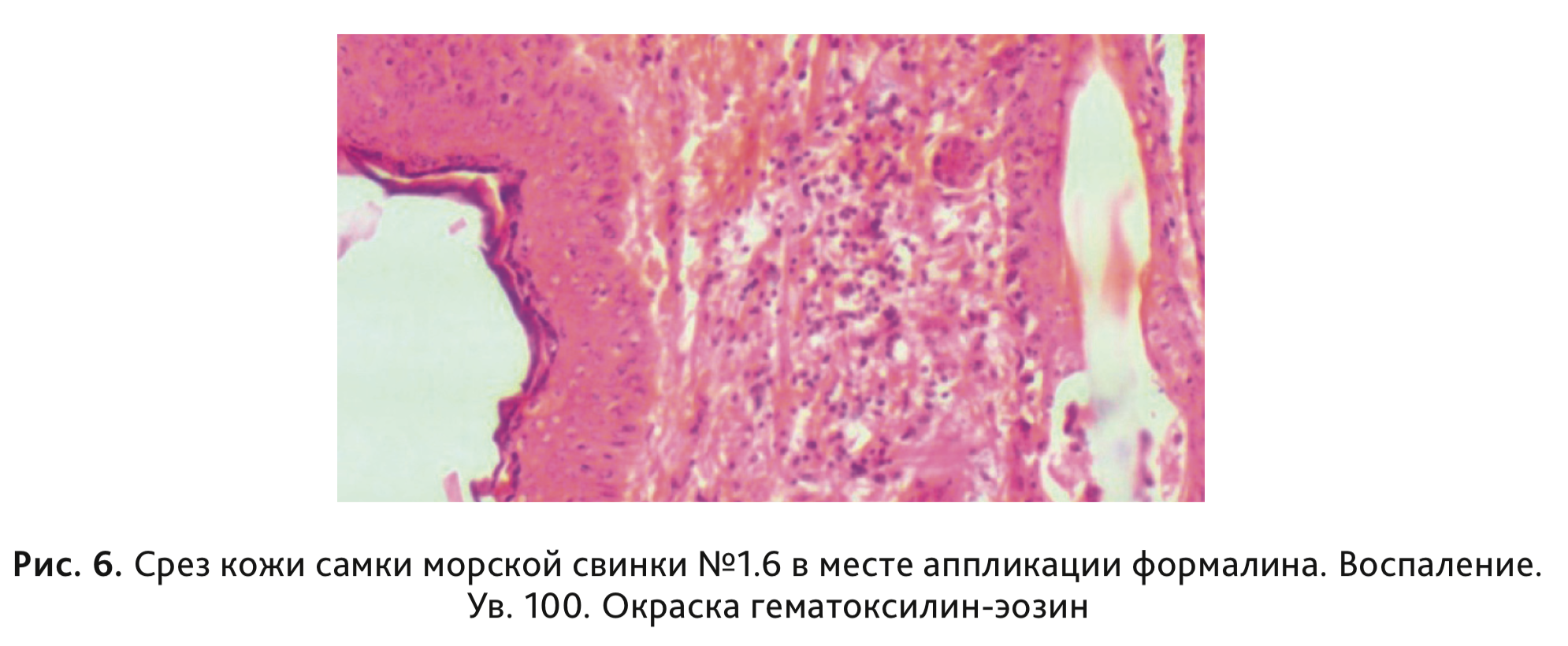
в сравнении с контрольной группой, выявлено не было (табл. 4). При проведении гистологического
исследования у 3 животных, сенсибилизированных формалином, в месте нанесения местных аппликаций было
отмечено наличие умеренно выраженного гипер- и паракератоза, скопление отслоившихся паракератических пластинок
на поверхности, со слабовыраженным воспалением (рис. 6).
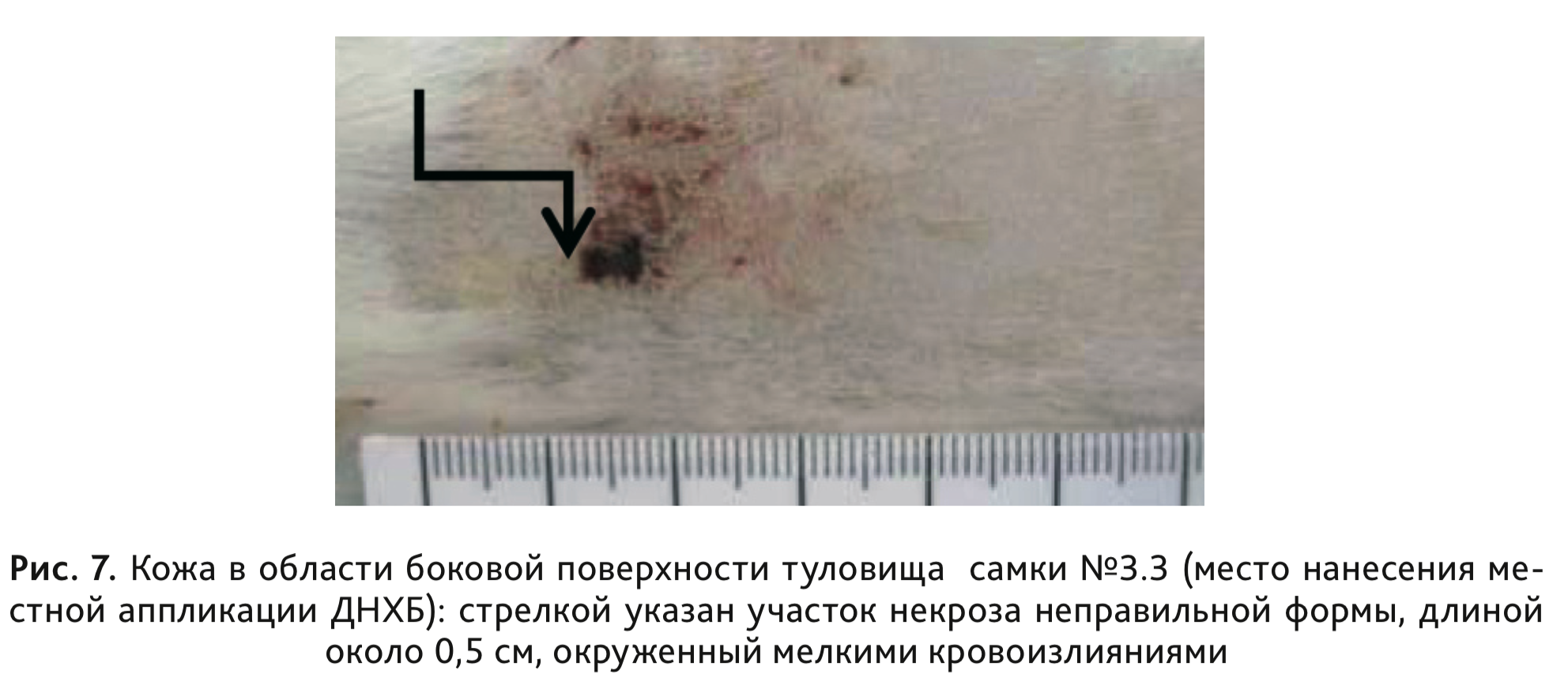
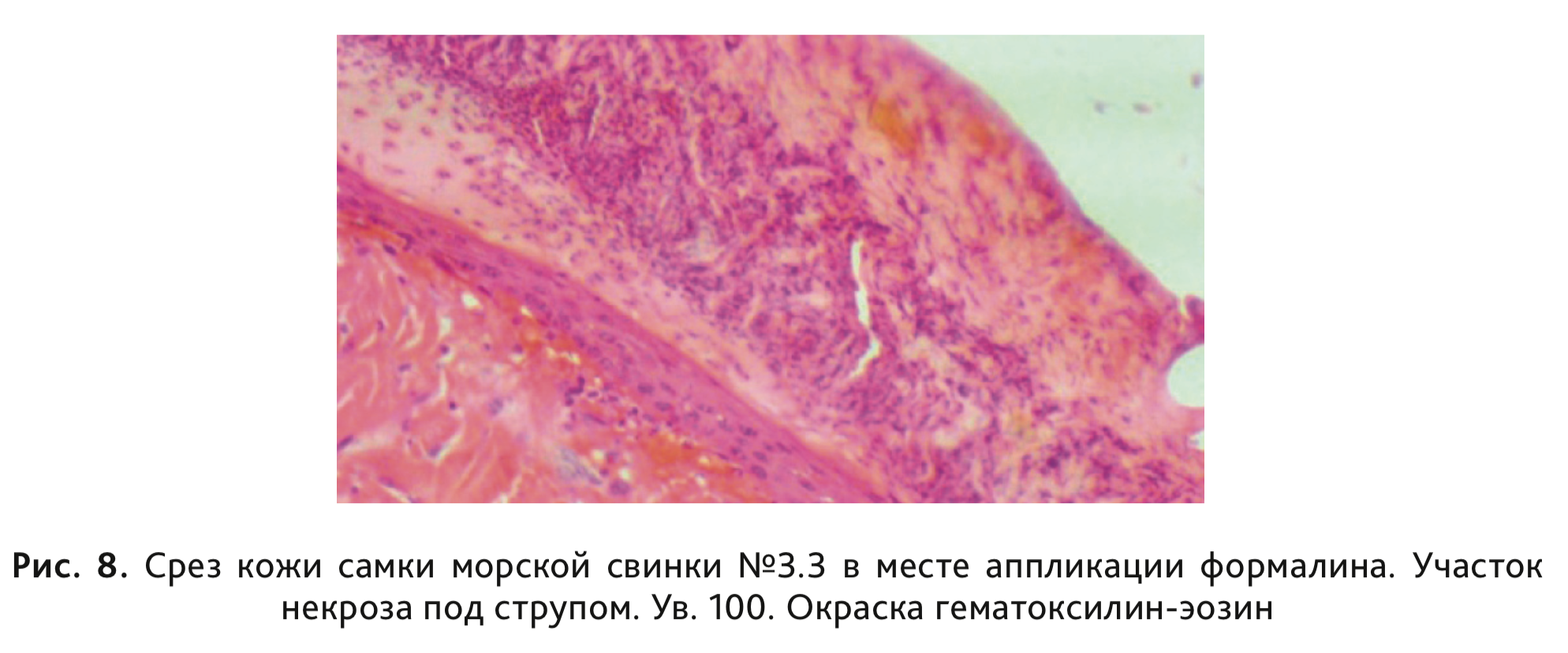
У морских свинок 3-й группы, сенсибилизированных раствором ДНХБ, после накожного нанесения разрешающей дозы 0,1% раствора ДНХБ в объеме 0,3 мл/животное на 23-й и 24-й дни эксперимента регистрировали развитие умеренной и сплошной эритемы у 2 самок морских свинок и еще у 4 – интенсивной эритемы и отека (рис. 7). При статистическом анализе с помощью критерия Краскела–Уоллиса и дальнейшем сравнении данных методом средних рангов были выявлены статистически значимые отличия по степени кожной реакции, выраженной в баллах, в сравнении с контрольной группой (см. табл. 4). При гистологическом исследовании у всех животных, сенсибилизированных раствором ДНХБ, в месте нанесения местных аппликаций было отмечено наличие умеренно выраженного гипер- и паракератоза, скопление отслоившихся паракератических пластинок на поверхности, с умеренно выраженным воспалением. У животных этой группы также наблюдались выраженная воспалительная реакция и отек в дерме. У 1 самки выявлен обширный участок некроза эпидермиса с образованием струпа, яркая воспалительная реакция и воспалительный компонент в подкожной жировой клетчатке (рис. 8).
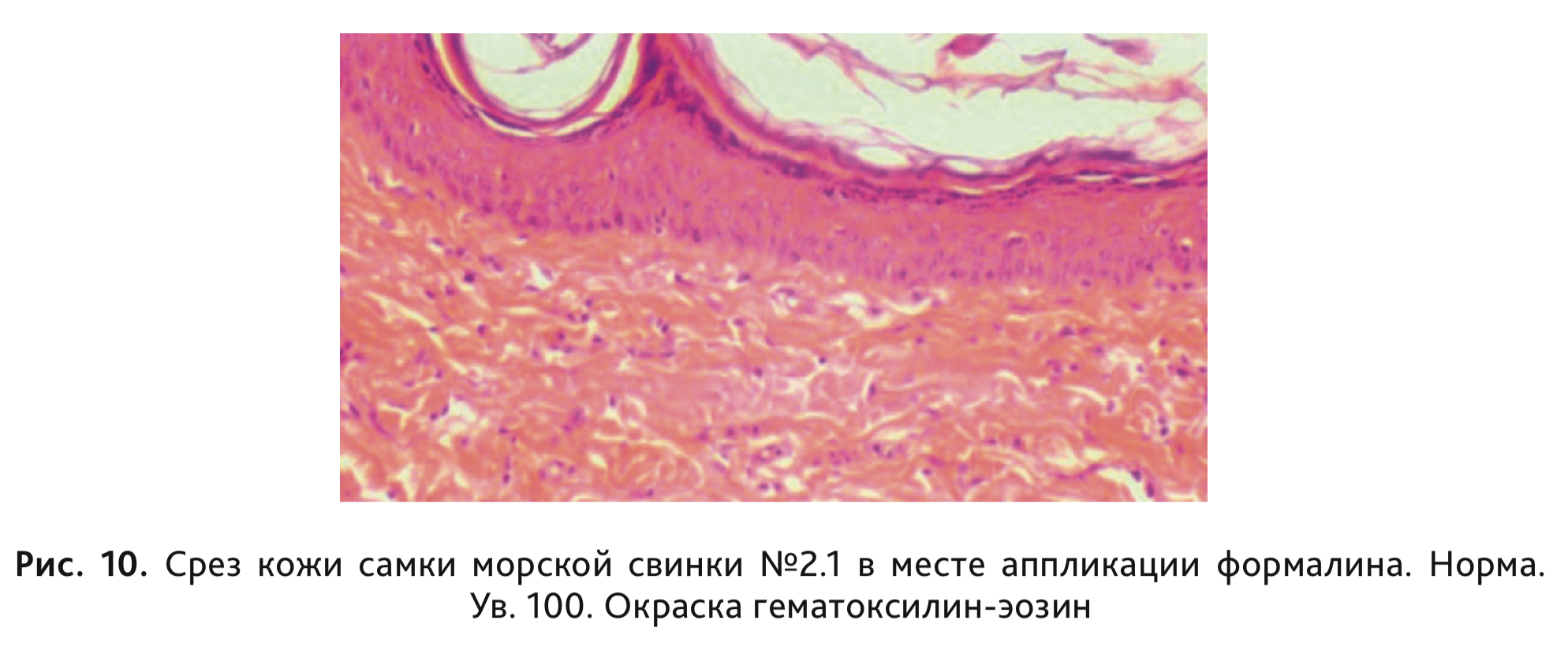
У животных 2-й контрольной группы, получавшей физиологический раствор, никаких видимых изменений кожных покровов не наблюдали (рис. 9). Микроскопические изменения также отсутствовали (рис. 10).

Таким образом, наиболее интенсивная кожная реакция, как при визуальной, так и микроскопической оценке, была выявлена при использовании ДНХБ, что соответствует данным литературы [2, 5, 6]. Результаты, полученные у животных, сенсибилизированных формалином, отличаются от данных литературных источников, в которых кожную реакцию регистрировали у большего количества животных.
Заключение
Данное исследование было направлено на оценку сенсибилизирующего потенциала химических веществ на примере формалина и динитрохлорбензола в тесте максимизации Магнуссона и Клигмана для применения в дальнейшей работе в качестве позитивного контроля.
Как показали итоги данного исследования, в дальнейшей работе на стадии разрешения необходимо подготавливать участки кожи на боковых поверхностях туловища не вблизи тазовых конечностей, а ближе к грудным. При этом вероятность того, что животные смогут снять с себя фиксирующие повязки будет меньше.
Согласно результатам кожной сенсибилизации, более выраженная кожная реакция была получена у животных, сенсибилизированных раствором ДНХБ, нежели раствором формалина. Поэтому при проведении дальнейших исследований сенсибилизирующего действия лекарственных препаратов в качестве позитивного контроля эффективнее использовать раствор ДНХБ.
При проведении визуальной оценки кожной реакции по шкале Магнуссона–Клигмана после нанесения разрешающей дозы исследуемых объектов сложностей с интерпретацией интенсивности кожной реакции не возникало, что подтверждает приемлемость балльной оценки в данном тесте.
Гистологическая оценка участка кожи после нанесения разрешающей дозы исследуемых объектов показала наличие воспалительной реакции у тех животных, у которых визуально была выявлена кожная реакция. Поэтому прямая необходимость в проведении гистологического исследования отсутствует. Гистологическое исследование поврежденного участка кожи может быть полезно для дополнительной оценки сенсибилизирующего потенциала.
Список источников
- OECD. Skin Sensitisation. OECD Guideline for the Testing of Chemicals. 1992; 406.
- Sargent E.V. Occupational toxicology testing. Comprehensive toxicology. 2018. Vol. 9: 44–63.
- Magnusson B. and Kligman A.M. Allergic Contact Dermatitis in the Guinea Pig. Charles G. Thomas; Springfield, Illinois. 1970.
- Методы испытания по воздействию химической продукции на организм человека. Испытания по оценке кожной сенсибилизации: ГОСТ 32375-2013. Введ. 01-08-2014. М.: Изд-во стандартов, 2014.
- Magnusson B. and Kligman A.M. The identification of contact allergens by animal assay. The guinea pig maximisation test. Journal of Investigative Dermatology. Vol. 52: 268–76.
- Maurer T. The maximization test for skin sensitization potential – updating the standard protocol and validation of a modified protocol. Food and Chemical Toxicology. 1989; 27 (12): 807–11.
- Klaus E. Andersen The guinea pig maximization test – with a Multiple dose design. Acta derm venereol. 1995; 75: 463–9.
- Shillaher O., Bell M. Guinea pig maximization test for skin sensitization the use of fewer test animals. Arch Toxicol. 1989. Vol. 63: 283–8.
- Гущин Я.А., Мужикян А.А. Влияние фиксирующих жидкостей на микроскопическую структуру органов мелких лабораторных животных. Международный вестник ветеринарии.2014; 3: 88–95.
- Мужикян А.А., Макарова М.Н., Гущин Я.А. Особенности гистологической обработки органов и тканей лабораторных животных. Международный вестник ветеринарии. 2014; 2: 103–9.




