Вариабельность биохимических показателей крови и установление референтных интервалов в доклинических исследованиях. Сообщение 11: собаки
Работа выполнена без спонсорской поддержки.
Мирошников М.В., Султанова К.Т., Ковалева М.А., Макарова М.Н. Вариабельность биохимических показателей крови и установление референтных интервалов в доклинических исследованиях. Сообщение 11: собаки. Лабораторные животные для научных исследований. 2023; 4. https://doi.org/10.57034/2618723X-2023-04-02
Резюме
Собаки являются распространенной тест-системой in vivo в доклинических исследованиях ввиду относительно большого размера тела, достаточного для проведения хирургических манипуляций, а также схожей с человеком патофизиологией при различных заболеваниях. Отдельным пунктом применения рассматриваемого вида животного в доклинических исследованиях является изучение и терапия онкологических заболеваний.
Цель работы состояла в создании собственной базы референтных интервалов биохимических показателей крови собак породы бигль. Данные нормы необходимы в доклинических исследованиях при оценке состояния здоровья животных, контроля формируемой патологической модели, а также проверке безопасности исследуемых лекарственных веществ. Биологические образцы, используемые для формирования референтных интервалов, были получены от интактных животных в АО «НПО «ДОМ ФАРМАЦИИ». Все проведенные манипуляции и эксперименты одобрены биоэтической комиссией. В исследование было включено 56 самцов и 48 самок. Возраст животных соответствовал диапазону 10–18 мес, масса тела самок составляла 7–11 кг, а самцов — 8–14 кг. Для осуществления единообразного подхода при создании референтных интервалов все манипуляции были проведены в одинаковых условиях. Использовали кровь, которую отбирали из латеральной подкожной вены передней лапы исследуемых животных натощак, без седации и анестезии. В сыворотке крови животных регистрировали следующие показатели: креатинин, мочевина, аланинаминотрансфераза, аспартатаминотрансфераза, щелочная фосфатаза, холестерин, триглицериды, общий белок, альбумин, глюкоза, креатинкиназа, лактатдегидрогеназа и общий билирубин, был рассчитан альбумин-глобулиновый коэффициент. Статистические выбросы оценивали с помощью метода Тьюки, вид распределения определяли, используя критерий Шапиро—Уилка, парное сравнение между животными разного пола проводили с применением U-критерия Манна—Уитни и t-критерия Стьюдента. Полученные диапазоны значений самцов и самок соотносились между собой по всем рассматриваемым показателям, статистической разницы выявлено не было. При сравнении полученных интервалов с референтными диапазонами собак из других источников литературы было показано, что в целом диапазоны рассматриваемых показателей схожи, но присутствуют и различия, которые могут быть объяснены широким перечнем факторов. К ним относятся образ содержания животных, а также преаналитический и аналитический этапы исследования. Сравнительный анализ межиндивидуальной вариабельности биохимических показателей крови собак и человека показал наличие некоторых видовых различий, которые необходимо учитывать в экспериментальной деятельности.
Введение
Доклинические исследования на животных до сих пор играют значимую роль в научных исследованиях, направленных на разработку и изучение эффективности новых лекарственных средств и хирургических методов коррекции патологических состояний. При этом исследования с использованием крупных лабораторных животных проводятся редко ввиду их экономической и организационной сложности. Несмотря на это, такие животные, как собаки, кошки, свиньи или яванские макаки, являются незаменимыми тест-системами в доклинических исследованиях на определенных этапах изучения лекарственных средств [1, 2].
Собака является распространенной моделью in vivo по нескольким причинам — относительно большой размер тела и анатомическое сходство с человеком. К тому же патофизиология некоторых естественных заболеваний собак более схожа с таковой человека, чем грызунов. Наиболее подходящая порода собак для проведения доклинических экспериментов — это бигль. Собаки, в отличие от грызунов, имеют примерно такое же количество генов, как и люди, и большинство этих генов являются близкими ортологами [3, 4].
Наиболее часто в доклинических исследованиях собаки применяются в изучении искусственного кровообращения, шунтирования коронарной артерии, устранения аневризмы аорты, коррекции врожденных пороков сердца и замены сердечного клапана [5–7]. Данный вид животных также используется для исследований в области трансплантации почек, легких и сердца, протезирования суставов, хирургии желудочно-кишечного тракта, при изучении хронического и геморрагического панкреатита, амилоидоза, заболевания межпозвоночных дисков, воспаления легких, гиперреактивности дыхательных путей, хронического бронхита, астмы, эмфиземы [8–11]. Данные животные также используются при моделировании заболеваний пародонта ввиду того факта, что десна собак реагирует аналогично человеческой десне в ответ на накопление зубного налета [12]. Разработаны модели офтальмологических заболеваний на собаках — прогрессирующая атрофия сетчатки и аномалия глаза. Также собаки являются подходящей моделью для изучения и терапии катаракты ввиду близкой анатомической схожести глаза собаки и человека [13, 14].
Отдельным пунктом применения собак в доклинических исследованиях являются изучение и терапия онкологических заболеваний [15, 16]. Собаки представляют собой значимую модель для оценки новых фармакологических и хирургических методов лечения онкологических патологий. Многие онкологические процессы у собак имеют общие черты с онкологическими патологиями человека, включая этиологическое и морфометрическое сходство. Наиболее часто изучаемые патологии — меланома, карцинома желудка, гемангиосаркома, лимфома, злокачественный гистиоцитоз и неходжкинская лимфома [17, 18].
Помимо всего вышеперечисленного, стоит упомянуть о системе цитохрома Р450 собаки и ее сходстве с человеческой. Известно, что функциональная активность семейств CYP1 и CYP3, а также подсемейств CYP2А, CYP2D и CYP2E собак сопоставима с ортологами человека. Соответственно можно предположить наличие определенной прогностической ценности и экстраполяции на человека данных, полученных при изучении лекарственных веществ, чей метаболизм в основном связан с ферментами данных семейств и подсемейств [19–22].
Ввиду широкой вовлеченности собак в доклинические исследования возникает необходимость контроля за состоянием здоровья животных, находящихся в эксперименте. Целью работы является создание базы референтных значений биохимических показателей крови собак породы бигль. Данные показатели необходимы в доклинических исследованиях при оценке состояния здоровья животных, адекватности сформированной патологической модели, повышения точности проведения исследований, интерпретации полученных значений, а также при проверке безопасности новых исследуемых лекарственных веществ. Референтные значения, полученные в исследовании, могут быть использованы в качестве исходных данных для анализа биохимических показателей крови собак породы бигль, используемых в доклинических исследованиях.
Материал и методы
Данные, используемые для формирования референтных интервалов (РИ), были получены от интактных животных за временной период май—сентябрь 2022 г. в АО «НПО «ДОМ ФАРМАЦИИ». Проведенные манипуляции и эксперименты одобрены биоэтической комиссией, одобрение получено до начала фактических работ на животных. В исследование было включено 56 самцов и 48 самок (небеременные и нерожавшие, без учета фазы менструального цикла) собак породы бигль. Возраст животных соответствовал диапазону 10–18 мес, масса тела самок была в пределах 7–11 кг, а самцов — 8–14 кг. Животных содержали в одинаковых стандартных условиях вивария: температура воздуха 22–26 °С, относительная влажность 40–75%, 12-часовой световой день. Кормление животных проводили в соответствии с Директивой 2010/63/EU Европейского парламента и Совета Европейского союза от 22 сентября 2010 г. по охране животных, используемых в научных целях. Исследование выполнено с соблюдением принципов Европейской конвенции о защите позвоночных животных, используемых для экспериментов и других научных целей (Страсбург, 1986), и в соответствии с правилами надлежащей лабораторной практики. Определение интересующих биохимических показателей проводили в одинаковых условиях с использованием общепринятых преаналитических и аналитических методов. Для исследования использовали кровь, которую отбирали из латеральной подкожной вены передней лапы исследуемых животных натощак, без седации и анестезии в вакуумные пластиковые пробирки с активатором свертывания и гелем (ООО «КОРВЕЙ», Россия). На момент забора крови животные были клинически здоровы. Затем для получения сыворотки кровь сразу после забора центрифугировали в течение 15 мин при 3000 об/мин на центрифуге ОПн-3.04 «Дастан» (Киргизия). Полученную сыворотку переносили в стерильные пробирки, в которых определяли биохимические показатели. В сыворотке крови животных на автоматическом биохимическом анализаторе Rendom Access A-25 (BioSystems, Испания) с использованием соответствующих наборов регистрировали следующие показатели: креатинин, мочевина, аланинаминотрансфераза, аспартатаминотрансфераза, щелочная фосфатаза, холестерин, триглицериды, общий белок, альбумин, глюкоза, креатинкиназа, лактатдегидрогеназа и общий билирубин. Концентрацию общего билирубина определяли с помощью набора реактивов («Вектор-Бест», Россия), для определения уровня остальных аналитов использовали биохимические наборы (BioSystems, Испания). Все статистические расчеты проводили с использованием программы GraphPad Prism 9.0 (США), статистические выбросы оценивали с помощью метода Тьюки, который был описан ранее [23–25], вид распределения определяли с помощью критерия Шапиро—Уилка, парное сравнение между животными разного пола проводили с применением U-критерия Манна—Уитни и t-критерия Стьюдента.
Результаты и обсуждение
Из последующего анализа были исключены значения, называемые «жесткие» и «мягкие» выбросы, то есть данные, лежащие за пределами интервала Q3 и Q1 (1-го и 3-го квартилей). Верхний и нижний пределы рассчитывали следующим образом:
Q1–1,5IQR и Q3+1,5IQR.
Данные, касающиеся доли статистических выбросов по каждому показателю и выходящие за пределы РИ, представлены в табл. 1.
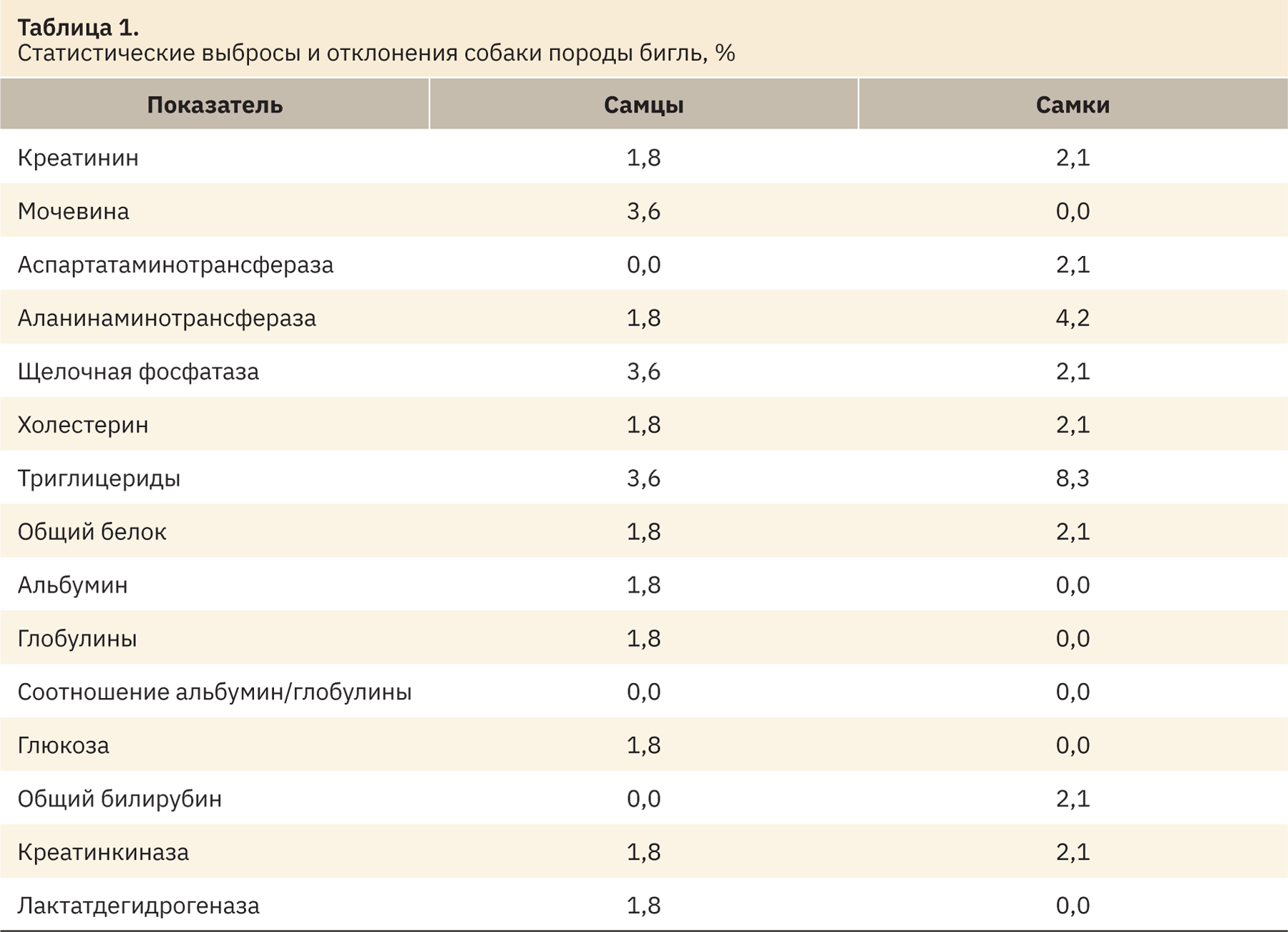
Наиболее часто статистические выбросы при анализе сыворотки крови собак у самцов отмечались в отношении мочевины, щелочной фосфатазы и триглицеридов 3,6% соответственно, у самок — в отношении аланинаминотрансферазы (4,8%) и триглицеридов (8,3%).
Вид распределения полученных значений определяли по критерию Шапиро—Уилка. В зависимости от вида распределения РИ рассчитывали следующим образом:
Хср±1,96SD — для нормального распределения;
2,5–97,5‰ (процентили) — для ненормального распределения (табл. 2).
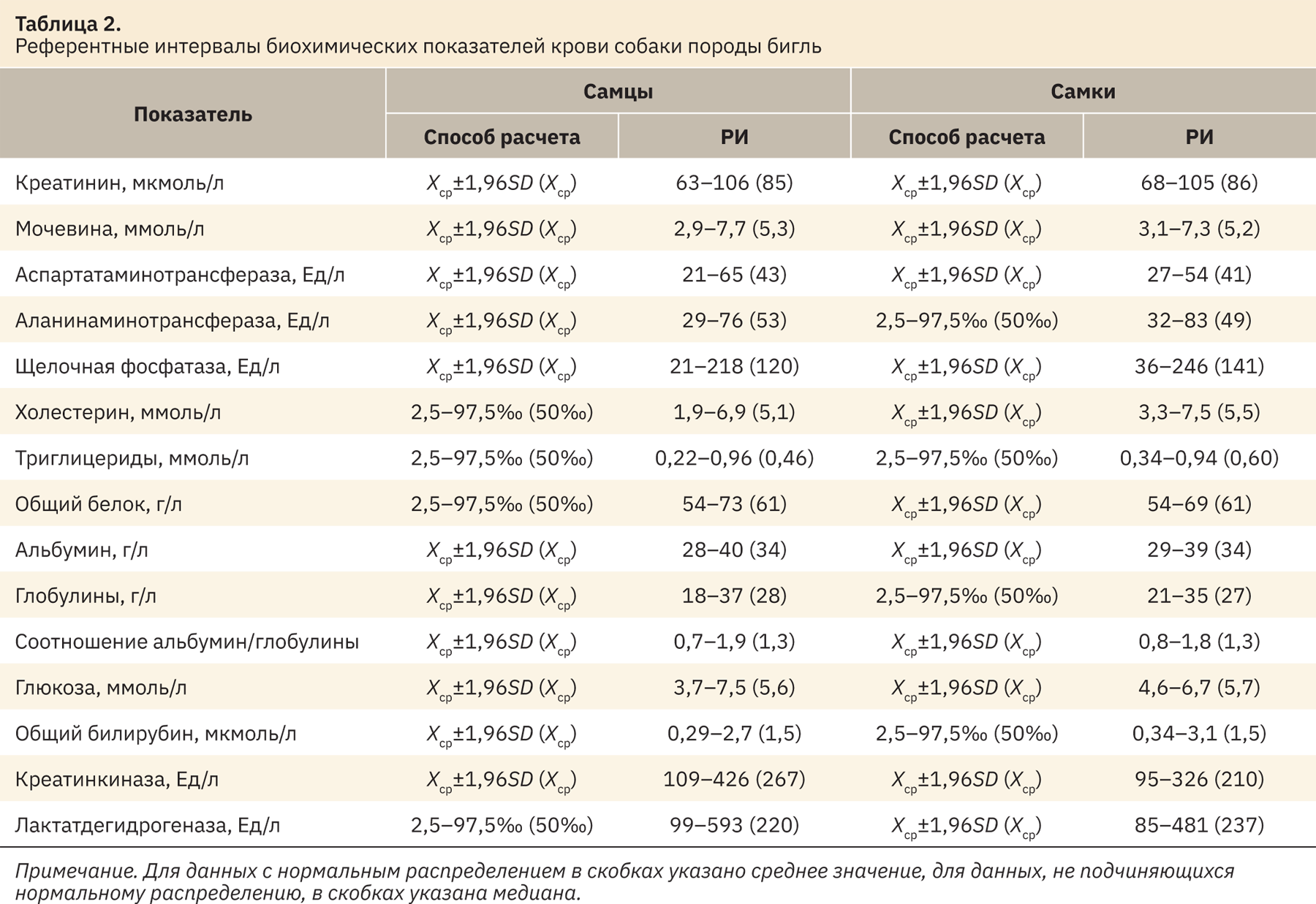
В табл. 2 представлены результаты РИ биохимических показателей крови собак.
Полученные диапазоны значений самцов и самок сопоставимы между собой по всем рассматриваемым показателям, статистической разницы выявлено не было. Можно отметить незначительное превышение верхнего предела РИ щелочной фосфатазы, холестерина и общего билирубина у самок, аспартатаминотрансферазы, креатинкиназы и лактатдегидрогеназы у самцов.
При сравнении полученных интервалов с референтными значениями из источников литературы (табл. 3) показано, что в целом диапазоны рассматриваемых показателей схожи, но присутствуют и различия. Так, интервалы значений креатинина, щелочной фосфатазы, креатинкиназы и лактатдегидрогеназы, полученные в ходе исследования, оказались шире аналогичных показателей, представленных в литературе. Рассчитанные интервалы аланинаминотрансферазы, холестерина, триглицеридов и общего билирубина собак были короче представленных в других публикациях. Данные различия могут быть объяснены широким перечнем факторов. К ним можно отнести состояние и возраст животных, условия содержания в питомнике, питание. Большую роль в составлении РИ играет преаналитический этап, а именно место и метод забора биоматериала, используемые расходные материалы, время от забора биообразца до проведения анализа, а также аналитический этап, связанный с используемыми реагентами и чувствительностью анализатора. Полученные в ходе исследования значения аспартатаминотрансферазы, общего белка, альбумина и глюкозы совпали с аналогичными показателями из научной литературы.
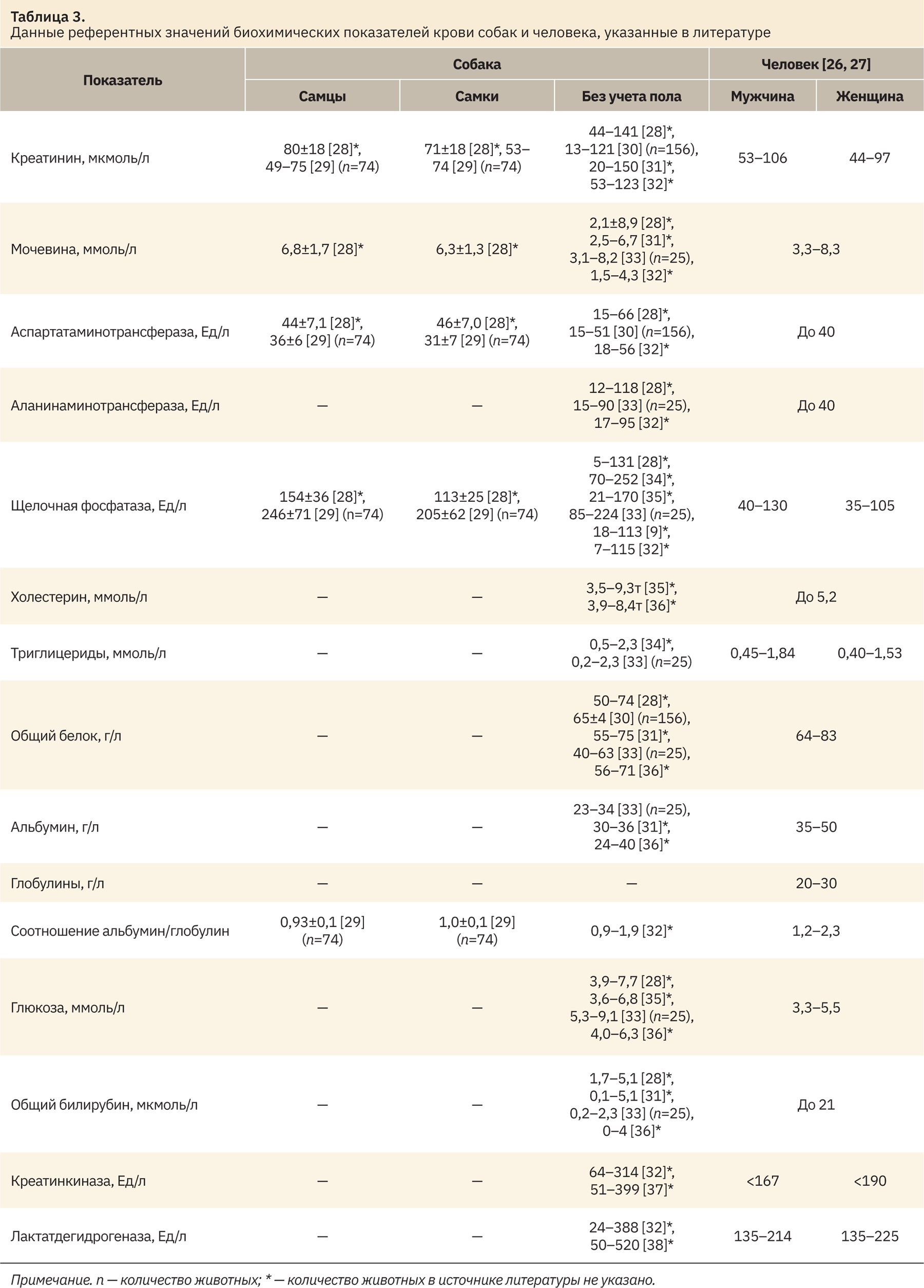
Сопоставляя полученные биохимические показатели крови собак породы бигль и соответствующие показатели человека (см. табл. 3), можно сделать вывод, что РИ креатинина, мочевины, общего белка и глобулинов собак сопоставимы с таковыми человека. Рассчитанные диапазоны аспартатаминотрансферазы, аланинаминотрансферазы, щелочной фосфатазы, холестерина, глюкозы, креатинкиназы и лактатдегидрогеназы собак шире, чем у человека. Стоит отметить, что средние значения данных показателей у собак соотносятся с верхней границей нормы у человека. Рассчитанные диапазоны триглицеридов, альбумина и общего билирубина собак короче, чем у человека.
Для получения значимых и надежных результатов в экспериментах на животных крайне важным является тот факт, чтобы вид и выбранная модельная патология должным образом соответствовали клинической патологии человека. Выбор релевантной модели требует глубоких знаний о конкретных видах и породах, это необходимо для того, чтобы убедиться в адекватности постановки модели и полученных данных. Ниже представлены справочные данные о биохимических показателях, рассматриваемых в статье и их изменениях при различных патологических и физиологических состояниях у собак породы бигль (табл. 4).

Известно, что повышение в сыворотке концентрации аланинаминотрансферазы у собак, как и у человека, является специфичным индикатором повреждения печени. Холестаз и обструкция желчных путей также могут увеличить сывороточную активность аланинаминотрансферазы вследствие токсических эффектов солей желчных кислот, оказываемых на гепатоциты. Увеличение активности аланинаминотрансферазы у собак наблюдается и при тяжелых поражениях мышечной ткани. Совместное исследование активности креатинкиназы, более специфичного фермента, помогает установить этиологию повышения аланинаминотрансферазы (мышцы или печень). Повышение сывороточной активности аланинаминотрансферазы у собак обычно рассматривается как патологическое состояние в случаях, когда ее значения превышают верхнюю границу нормы более чем в 2 раза. Период полувыведения аланинаминотрансферазы у собак в сыворотке крови составляет от 1 до 3 дней, а пик уровня фермента приходится на первые 48 ч. Такие препараты, как парацетамол, кортикостероиды, сульфаниламиды, рифампицин, фенобарбитал и фенитоин, могут вызвать повышение уровня аланинаминотрансферазы у собак [39–41].
Сывороточная активность аспартатаминотрансферазы у собак может быть либо в пределах нормы или незначительно увеличиваться даже при тяжелых заболеваниях печени, которые приводят к выраженному снижению печеночной массы, или обусловлены действием токсинов, ингибирующих активность трансаминаз. Метронидазол, цефалоспорины, циклоспорины и изониазид понижают активность аспартатаминотрансферазы, кортикостероиды, эритромицин, рифампицин, сульфаниламиды и ацетаминофен, наоборот, повышают ее активность [41–43].
Различные заболевания гепатобилиарной системы у собак могут привести к увеличению активности щелочной фосфатазы в сыворотке крови. При холестазе, наряду с повышением активности рассматриваемого фермента, одновременно могут увеличиваться концентрация общего билирубина и желчных кислот. Липидоз или воспаление паренхимы печени могут затруднить отток желчи по желчным канальцам и вызвать повышенную выработку и высвобождение щелочной фосфатазы. Также характерно повышение активности щелочной фосфатазы в сыворотке крови собак при увеличенной активности остеобластов. Это увеличение наиболее часто выявляется у молодых животных. Щелочная фосфатаза может увеличиваться при остеосаркоме и других костных новообразованиях, развитии доброкачественных и злокачественных опухолей. У собак общая активность щелочной фосфатазы в сыворотке крови может увеличиваться в 2–6 раз после введения некоторых противосудорожных препаратов — фенобарбитала, примидона и фенитоина [41–43].
У собак креатинкиназа чаще всего используется в качестве маркера повреждения мышечной ткани в результате травмы, хирургического вмешательства, внутримышечных инъекций или врожденной миопатии. Чувствительность и специфичность активности креатинкиназы в сыворотке крови наиболее информативны в диагностике повреждений скелетных мышц, миокарда, а также при неврологических расстройствах. Увеличение активности креатинкиназы после повреждения мышц происходит быстро и достигает максимума через 6–12 ч. У собак период полувыведения креатинкиназы в среднем составляет до 3 ч. Незначительное увеличение активности креатинкиназы в сыворотке крови возможно после физической нагрузки. Самый высокий уровень креатинкиназы отмечен у щенков, с возрастом этот показатель снижается. Кортикостероиды, стрептокиназа, инсулин, пенициллины, сульфаниламиды и фенитоин способны увеличивать активность фермента [41, 44].
Гипоальбуминемия у собак может возникать в результате прохождения альбумина в клубочковый ультрафильтрат (первичная моча) и предполагает поражение клубочков и хронический характер заболевания. При заболеваниях печени гипоальбуминемия не выявляется, пока не будут нарушены более 70% функции гепатобилиарной системы. Гипоальбуминемия часто сопровождается гиперглобулинемией. Снижение концентрации альбумина у собак может привести к значительному уменьшению онкотического давления и перемещению жидкости из внутрисосудистого пространства в интерстициальную область. В результате этого развивается гипотония, образуются подкожные отеки и отеки легких, а также полостные выпоты — плеврит и асцит. Ацетилсалициловая кислота способствует снижению альбумина в сыворотке крови. Увеличение концентрации альбумина, как правило, является результатом обезвоживания или гемоконцентрации. Тестостерон, эстроген, соматотропин и глюкокортикоиды способствуют повышению уровня альбумина в сыворотке крови. Снижение соотношения альбумина к глобулину у собак может возникать при почечной протеинурии [45, 46].
Билирубинемия у собак чаще всего возникает в результате усиленного разрушения эритроцитов, тяжелых гепатоцеллюлярных повреждений и угнетения конъюгационных или секреторных механизмов печени, снижения секреции билирубина и нарушения выведения желчи в кишечник. Увеличение содержания в крови билирубина может быть следствием приема лекарственных и токсических веществ, вызывающих гемолитическую анемию, острую печеночную недостаточность или печеночную дисфункцию. Фенобарбитал вызывает повышение уровня билирубина в сыворотке крови [43, 45].
Основной причиной гипергликемии у собак является сахарный диабет, который развивается в результате нехватки или дефекта инсулина. Необходимо дифференцировать сахарный диабет от гипергликемии, вызванной действием катехоламинов и кортизола при стрессе. Гипогликемия может развиться вследствие повышенного потребления глюкозы тканями, например, при физической перегрузке, сокращения количества поступающей глюкозы при голодании или печеночной недостаточности. Стойкая гипогликемия отмечается при новообразовании β-клеток и высокого потребления глюкозы. Бета-адреноблокаторы, антигистаминные препараты, этанол, производные сульфонилмочевины, салицилаты и анаболические стероиды могут снижать уровень глюкозы в крови. Кортикостероиды, агонисты центральных α2-адренорецепторов, фуросемид, тиазидные диуретики, производные фенотиазинов и гепарин вызывают гипергликемию [47, 48].
Повышение уровня креатинина у собак обычно свидетельствует о снижении фильтрации в почечных клубочках и понижении выделительной функции почек, также может наблюдаться при обезвоживании, поскольку вместе с этим повышается плотность мочи и, следовательно, содержание креатинина в моче. Увеличение рассматриваемого показателя в сыворотке крови не всегда является специфическим показателем заболевания почек и может изменяться под влиянием экстраренальных симптомов. Снижение образования креатинина возможно при сильном истощении организма и снижении мышечной массы животного [49].
У щенков до месячного возраста уровень мочевины в крови несколько выше референтных значений, у животных старше 2–3 мес уровень мочевины становится немного ниже референтных значений в результате быстрого роста и увеличения интенсивности анаболических процессов. Повышение уровня мочевины в крови наряду со снижением скорости клубочковой фильтрации и возрастанием уровня креатинина обусловливает развитие азотемии. Азотемия всегда сопоставляется со значением относительной плотности мочи и уровнем диуреза (анурия, олигурия или полиурия). Для определения типа азотемии часто используют расчет индекса отношения мочевины к креатинину в сыворотке крови. Это отношение у мелких домашних животных составляет примерно 20:1, а у крупных — 10:1. Повышение коэффициента может быть связано с обезвоживанием или кишечным кровотечением, тогда как понижение коэффициента чаще всего связано с увеличением диуреза. При желудочно-кишечном кровотечении возрастает уровень азота мочевины без увеличения уровня креатинина [45, 50].
Источниками высокой активности лактатдегидрогеназы в сыворотке крови у собак являются повреждения мышц, печени и разрушающиеся эритроциты. После повреждения тканей сывороточная активность лактатдегидрогеназы достигает пика через 24–48 ч и возвращается к норме в течение 7–10 дней. Для выявления повреждения мышечной ткани уровень лактатдегидрогеназы в крови является менее информативным показателем, чем креатинкиназы и аспартатаминотрансферазы, и на ее сывороточную активность существенно влияет даже незначительный гемолиз. В совокупности исследование сывороточной активности лактатдегидрогеназы может помочь в дифференциальной диагностике патологического процесса. Сообщалось об увеличении уровня фермента в сыворотке у собак, пораженных лейкемией [51, 52].
Обнаружение гипертриглицеридемии в образце крови собаки после 12-часового периода голодания указывает на стойкую или патологическую гиперлипидемию. Патологическая гипертриглицеридемия, как правило, вторична по отношению к основному заболеванию эндокринной системы, поджелудочной железы, печени или почек. Первичная гиперлипидемия встречается редко и, как правило, вызвана генетическими отклонениями [53].
Для каждого изученного показателя были рассчитаны коэффициенты вариации, что в грубом приближении соответствует межиндивидуальной вариабельности этих показателей в человеческой популяции. В широком смысле под этим определением подразумевается изменчивость качественных и/или количественных особенностей структуры и/или функций, присущих двум и более отдельным (индивидуальным) животным. Сравнительные данные приведены в табл. 5.
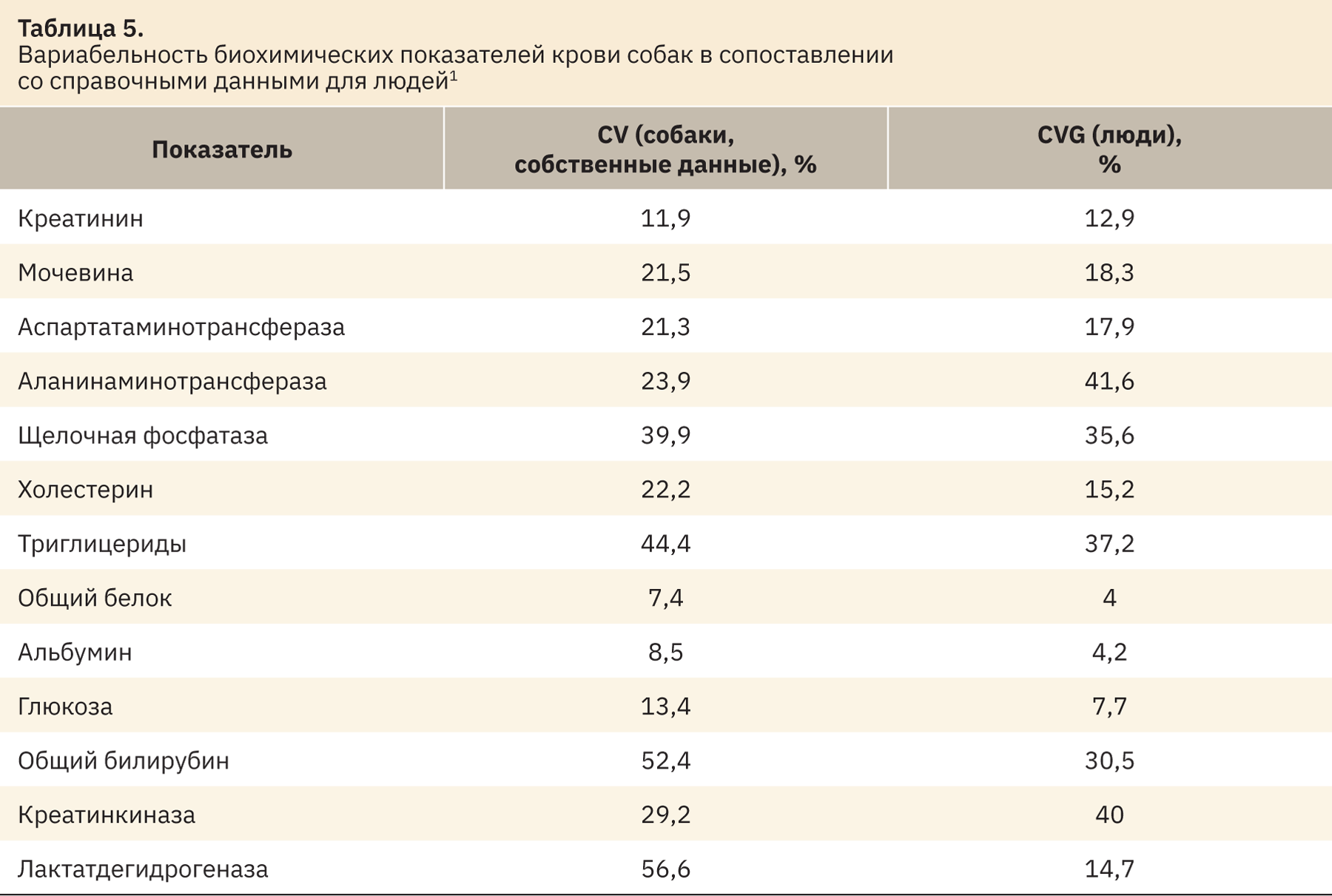
Схожая вариабельность отмечена по таким показателям, как креатинин, мочевина, аспартатаминотрансфераза, аланинаминотрансфераза, щелочная фосфатаза и триглицериды. Различия присутствуют среди таких показателей, как холестерин, общий белок, альбумин, глюкоза, общий билирубин, креатинкиназа и лактатдегидрогеназа. Рассматриваемые показатели имеют более широкую вариабельность у собак в отличие от человека. Данную информацию необходимо учитывать при интерпретации полученных значений в доклинических исследованиях.
Заключение
Собака является важной моделью в доклинических исследованиях. Данные, полученные от животных, используют для изучения патогенеза и лечения различных заболеваний систем организма, онкологических процессов и исследования новых лекарственных средств. В ходе работы были получены референтные интервалы биохимических показателей крови самцов и самок собак породы бигль. Рассчитанные значения проанализированы как между собой, так и с аналогичными показателями из других источников литературы. Сравнительный анализ межиндивидуальной вариабельности биохимических показателей крови собак и человека демонстрирует наличие некоторых видовых различий, которые необходимо учитывать в экспериментальной деятельности. Полученные референтные интервалы биохимических показателей рассматриваемого вида животных могут дать ценную информацию о моделируемой патологии или об изучаемых субстанциях в ходе проведения доклинического эксперимента и мониторинга здоровья животных.
Сведения о конфликте интересов
Авторы заявляют об отсутствии конфликта интересов.
Вклад авторов
М.В. Мирошников — идея разработки темы и обоснование актуальности работы, написание, редактирование и доработка текста рукописи, ответственность за все аспекты работы, связанные с достоверностью данных.
К.Т. Султанова — написание и редактирование текста рукописи, обобщение результатов исследования, работа с табличным материалом.
М.А. Ковалева — анализ научной и методической литературы, научное редактирование текста рукописи.
М.Н. Макарова — критический пересмотр текста.
- ГОСТ Р 53022.2–2008 Технологии лабораторные клинические. Требования к качеству клинических лабораторных исследований. Часть 2. Оценка аналитической надежности методов исследования (точность, чувствительность, специфичность) Москва, 2008. [GOST R 53022.2–2008 Tekhnologii labora tornye klinicheskie. Trebovaniya k kachestvu klinicheskih laboratornyh issledovanij. CHast’ 2. Ocenka analiticheskoj nadezhnosti metodov issledovaniya (tochnost’, chuvstvitel’nost’, specifi chnost’) Moskva, 2008. (In Russ.)].
Список источников
- Barré-Sinoussi F., Montagutelli X. Animal models are essential to biological research: issues and perspectives // Future science OA. 2015. Vol. 1. N. 4.
-
Ziegler A., Gonzalez L., Blikslager A. Large animal models: the key to translational discovery in digestive disease research // Cellular and molecular gastroenterology and hepatology. 2016. Vol. 2. N. 6. P. 716–724.
-
Луговик И.А., Шекунова Е.В. Оценка использования различных формул коррекции интервала QT (QTc) и референтные интервалы ЭКГ у наркотизированных собак породы бигль // Лабораторные животные для научных исследований. 2022. № 2. С. 32–43. [Lugovik I.A., SHekunova E.V. Ocenka ispol’zovaniya razlichnyh formul korrekcii intervala QT (QTc) i referentnye intervaly EKG u narkotizirovannyh sobak porody bigl’ // Laboratornye zhivotnye dlya nauchnyh issledovanij. 2022. N. 2. P. 32–43. (In Russ.)].
-
Schulte E., Arlt S.P. What Kinds of Dogs Are Used in Clinical and Experimental Research? // Animals. 2022. Vol. 12. N. 12. P. 1487.
- Byrom M.J., Bannon P. G., White G.H. et al. Animal models for the assessment of novel vascular conduits // Journal of vascular surgery. 2010. Vol. 52. N. 1. P. 176–195.
-
Freudenberger T., Kranz B., Lehmann W. et al. Identification of two preclinical canine models of atrial fibrillation to facilitate drug discovery // Heart Rhythm. 2021. Vol. 18. N. 4. P. 632–640.
-
Narayan S.K., Grace Cherian S., Babu Phaniti P. et al. Preclinical animal studies in ischemic stroke: Challenges and some solutions // Animal Models and Experimental Medicine. 2021. Vol. 4. N. 2. P. 104–115.
-
Packialakshmi B., Stewart I.J., Burmeister D.M. et al. Large animal models for translational research in acute kidney injury // Renal Failure. 2020. Vol. 42. N. 1. P. 1042–1058.
-
Farrell M., Draffan D., Gemmill T. et al. In vitro validation of a technique for assessment of canine and feline elbow joint collateral ligament integrity and description of a new method for collateral ligament prosthetic replacement // Veterinary surgery. 2007. Vol. 36. N. 6. P. 548–556.
-
Lambertini C., Pietra M., Galiazzo G. et al. Incidence of gastroesophageal reflux in dogs undergoing orthopaedic surgery or endoscopic evaluation of the upper gastrointestinal tract // Veterinary Sciences. 2020. Vol. 7. N. 4. P. 144.
-
Tanner L., Single A.B. Animal models reflecting chronic obstructive pulmonary disease and related respiratory disorders: translating pre-clinical data into clinical relevance // Journal of innate immunity. 2020. Vol. 12. N. 3. P. 203–225.
-
Kortegaard H.E., Eriksen T., Baelum V. Periodontal disease in research beagle dogs — an epidemiological study // Journal of small animal practice. 2008. Vol. 49. N. 12. P. 610–616.
-
Beltran W.A. The use of canine models of inherited retinal degeneration to test novel therapeutic approaches // Veterinary ophthalmology. 2009. Vol. 12. N. 3. P. 192–204.
-
Xu J., Fu Q., Chen X. et al. Advances in pharmacotherapy of cataracts // Annals of Translational Medicine. 2020. Vol. 8. N. 22.
-
Rowell J.L., McCarthy D.O., Alvarez C.E. Dog models of naturally occurring cancer // Trends in molecular medicine. 2011. Vol. 17. N. 7. P. 380–388.
-
Sun F., Báez-Díaz C., Sánchez-Margallo F.M. Canine prostate models in preclinical studies of minimally invasive interventions: Part I, canine prostate anatomy and prostate cancer models // Translational andrology and urology. 2017. Vol. 6. N. 3. P. 538.
-
Paoloni M., Khanna C. Translation of new cancer treatments from pet dogs to humans // Nature Reviews Cancer. 2008. Vol. 8. N. 2. P. 147–156.
-
Hansen K., Khanna C. Spontaneous and genetically engineered animal models: use in preclinical cancer drug development // European Journal of Cancer. 2004. Vol. 40. N. 6. P. 858–880.
-
Court M.H. Canine cytochrome P450 (CYP) pharmacogenetics // The Veterinary Clinics of North America. Small Animal Practice. 2013. Vol. 43. N. 5. P. 1027.
-
Nishimuta H., Nakagawa T., Nomura N. et al. Species differences in hepatic and intestinal metabolic activities for 43 human cytochrome P450 substrates between humans and rats or dogs // Xenobiotica. 2013. Vol. 43. N. 11. P. 948–955.
-
Mills B.M., Zaya M.J., Walters R.R. et al. Current cytochrome P450 phenotyping methods applied to metabolic drug-drug interaction prediction in dogs // Drug metabolism and disposition. 2010. Vol. 38. N. 3. P. 396–404.
-
Chen J., Tran C., Xiao L. et al. Co-induction of CYP3A12 and 3A26 in dog liver slices by xenobiotics: species difference between human and dog CYP3A induction // Drug Metabolism Letters. 2009. Vol. 3. N. 1. P. 61–66.
-
Мирошников М.В., Макарова М.Н. Вариабельность биохимических показателей крови и установление референсных интервалов в доклинических исследованиях. Сообщение 4: мыши // Лабораторные животные для научных исследований. 2021. № 3. С. 64–70. [Miroshnikov M.V., Makarova M.N. Variabel’nost’ biohimicheskih pokazatelej krovi i ustanovlenie referensnyh intervalov v doklinicheskih issledovaniyah. Soobshchenie 4: myshi // Laboratornye zhivotnye dlya nauchnyh issledovanij. 2021. N. 3. P. 64–70. (In Russ.)].
-
Мирошников М.В., Султанова К.Т., Ковалева М.А., Макарова М.Н. Вариабельность биохимических показателей крови и установление референсных интервалов в доклинических исследованиях. Сообщение 5: хорьки // Лабораторные животные для научных исследований. 2021. № 4. С. 29–39. [Miroshnikov M.V., Sultanova K.T., Kovaleva M.A., Makarova M.N. Variabel’nost’ biohimicheskih pokazatelej krovi i ustanovlenie referensnyh intervalov v doklinicheskih issledovaniyah. Soobshchenie 5: hor’ki // Laboratornye zhivotnye dlya nauchnyh issledovanij. 2021. N. 4. P. 29–39. (In Russ.)].
-
Мирошников М.В., Султанова К.Т., Ковалева М.А., Макарова М.Н. Вариабельность биохимических показателей крови и установление референтных интервалов в доклинических исследованиях. Сообщение 6: яванские макаки // Лабораторные животные для научных исследований. 2022. № 2. С. 14–25. [Miroshnikov M.V., Sultanova K.T., Kovaleva M.A., Makarova M.N. Variabel’nost’ biohimicheskih pokazatelej krovi i ustanovlenie referentnyh intervalov v doklinicheskih issledovaniyah. Soobshchenie 6: yavanskie makaki // Laboratornye zhivotnye dlya nauchnyh issledovanij. 2022. N. 2. P. 14–25. (In Russ.)].
-
Лившиц В.М., Сидельникова В.И. Биохимические анализы в клинике: справ.-3-е изд. 2011. [Livshits V.M., Sidel’nikova V.I. Biokhimicheskie analizy v klinike: sprav.-3-e izd. 2011. (In Russ.)].
-
Ингерлейб М.Б. Медицинские анализы. Самый полный современный справочник / М.Б. Ингерлейб. Москва: Изд-во АСТ, 2015. 416 с. [Ingerleib M.B. Meditsinskie analizy. Samyi polnyi sovremennyi spravochnik / M.B. Ingerleib. Moskva: Izd-vo AST, 2015. 416 p. (In Russ.)].
-
Nemzek J.A., Lester P.A., Wolfe A.M. et al. Biology and diseases of dogs // Laboratory animal medicine (Academic Press). 2015. P. 511–554.
-
Choi S.Y., Hwang J.S., Kim I.H. et al. Basic data on the hematology, serum biochemistry, urology, and organ weights of beagle dogs // Laboratory animal research. 2011. Vol. 27. N. 4. P. 283–291.
-
Miglio A., Gavazza A., Siepi D. et al. Hematological and biochemical reference intervals for 5 adult hunting dog breeds using a blood donor database // Animals. 2020. Vol. 10. N. 7. 1212.
-
Dunlop M.M., Sanchez-Vazquez M.J., Freeman K.P. et al. Determination of serum biochemistry reference intervals in a large sample of adult greyhounds // Journal of Small Animal Practice. 2011. Vol. 52. N. 1. P. 4–10.
-
Cornell University, college of university. URL: https://www.vet.cornell.edu/animal-health-diagnostic-center/laboratories/clinical-pathology/reference-intervals/chemistry (дата обращения: 08.2023).
-
Kley S., Tschudi P., Busato A. et al. Establishing canine clinical chemistry reference values for the Hitachi® 912 using the International Federation of Clinical Chemistry (IFCC) recommendations // Comparative clinical pathology. 2003. Vol. 12. N. 2. P. 106–112.
-
Vet Union. URL: https://vetunion.ru/analysis/bioximicheskie-issledovaniya-krovi/trygliceridy/ (дата обращения: 08.2023).
-
Davis U.C. Clinical chemistry reference intervals. 2009.
-
Reference Guide — Veterinary Diagnostic Services Laboratory. URL: https://diagnosticservices.avc.upei.ca/reference-guide/referenceintervals/ (дата обращения: 08.2023).
-
Veterinary Medical Teaching Hospital University of California. URL: https://www.vetmed.ucdavis.edu/sites/g/files/dgvnsk491/files/local_resources/pdfs/lab_pdfs/UC_Davis_VMTH_Chem_Reference_Intervals.pdf (дата обращения: 08.2023).
-
Iowa State Universitu College of veterinary medicine. URL: https://www.vetmed.iastate.edu/vpath/services/diagnostic-services/clinical-pathology/testing-and-fees/reference-intervals (дата обращения: 08.2023).
-
Mesher C.I., Rej R., Stokol T. Alanine aminotransferase apoenzyme in dogs // Veterinary clinical pathology. 1998. Vol. 27. N. 1. P. 26–30.
-
Center S.A. Interpretation of liver enzymes // Veterinary Clinics of North America: Small Animal Practice. 2007. Vol. 37. N. 2. P. 297–333.
-
Sharon A. Enzyme activity in hepatic disease in small animals // Merck Sharp and Dohme Corp., a subsidiary of Merck and Co., inc., White house Station, NJ, USA. 2013. Р. 145.
-
Ullal T., Ambrosini Y., Rao S. et al. Retrospective evaluation of cyclosporine in the treatment of presumed idiopathic chronic hepatitis in dogs // Journal of veterinary internal medicine. 2019. Vol. 33. N. 5. P. 2046–2056.
-
Bunch S.E. Hepatotoxicity associated with pharmacologic agents in dogs and cats // Veterinary Clinics of North America: Small Animal Practice. 1993. Vol. 23. N. 3. P. 659–670.
-
Aktas M., Auguste D., Lefebvre H.P. et al. Creatine kinase in the dog: a review // Veterinary research communications 1993. Vol. 17. N. 5. P. 353–369.
-
Merckvetmanual. URL: https://www.merckvetmanual.com/digestive-system/hepatic-disease-in-small-animals/other-serum-biochemical-measures-in-hepatic-disease-in-small-animals#v3267971 (дата обращения: 08.2023).
-
Conner B.J. Treating hypoalbuminemia // Veterinary Clinics: Small Animal Practice. 2017. Vol. 47. N. 2. P. 451–459.
-
Rand J.S. Diabetes Mellitus in Dogs and Cats // Clinical Small Animal Internal Medicine. 2020. P. 93–102.
-
Idowu O., Heading K. Hypoglycemia in dogs: Causes, management, and diagnosis // The Canadian Veterinary Journal. 2018. Vol. 6. P. 642.
-
Braun J.P., Lefebvre H.P., Watson A.D. J. Creatinine in the dog: a review // Veterinary Clinical Pathology. 2003. Vol. 32. N. 4. P. 162–179.
-
De Loor J., Daminet S., Smets P. et al. Urinary biomarkers for acute kidney injury in dogs // Journal of veterinary internal medicine. 2013. Vol. 27. N. 5. P. 998–1010.
-
Milne E.M., Doxey D.L. Lactate dehydrogenase and its isoenzymes in the tissues and sera of clinically normal dogs // Research in veterinary science. 1987. Vol. 43. N. 2. P. 222–224.
-
Klein R., Nagy O., Tóthová C. et al. Clinical and diagnostic significance of lactate dehydrogenase and its isoenzymes in animals // Veterinary medicine international. 2020. P. 2020.
- Xenoulis P.G., Steiner J.M. Lipid metabolism and hyperlipidemia in dogs // The Veterinary Journal. 2010. Vol. 183. N. 1. P. 12–21.



