Использование собак в доклинических исследованиях
Работа выполнена без спонсорской поддержки.
Макарова М.Н., Макаров В.Г. Использование собак в доклинических исследованиях. Лабораторные животные для научных исследований. 2023; 4. https://doi.org/10.57034/2618723X-2023-04-01
Резюме
Согласно отечественным и зарубежным нормативным документам, оценку токсических свойств новых лекарственных препаратов необходимо проводить с использованием двух видов лабораторных животных, один из которых не должен относиться к грызунам. В токсикологических исследованиях в качестве второго вида лабораторных животных широко используются собаки породы бигль. Широкое использование биглей стало возможным благодаря ряду преимуществ данной породы: средний размер, уравновешенный темперамент, дружелюбность, относительная простота в обращении. Вместе с тем, в последнее время привлечение собак к доклиническим исследованиям происходит все реже — по гуманным соображениям. Если альтернативы использованию собак в эксперименте нет, должны быть предприняты все усилия для реализации принципов 3Rs. Сокращение количества животных в исследовании может быть достигнуто за счет внедрения комбинированного дизайна экспериментов, когда в рамках эксперимента по оценке токсических свойств изучаются дополнительные параметры (фармакологическая безопасность, иммунотоксичность, репродуктивная токсичность, фармакокинетические параметры). Для препаратов с планируемым длительным клиническим применением требуется проведение длительных экспериментов токсичности (9 мес), при этом для поддержки первых этапов клинических исследований могут быть необходимы эксперименты меньшей продолжительности (3, 6 мес). Вместо проведения нескольких испытаний токсичности можно рассмотреть выполнение одного длительного эксперимента, где не предусмотрена эвтаназия животных на промежуточных этапах (3 или 6 мес введения препарата), но на этих сроках оцениваются показатели, спектр которых максимально приближен к оцениваемым в клинических испытаниях. За время использования биглей в биомедицинских целях накоплены данные о физиологии, биохимии, морфологии этой породы. Сведения литературы, а также имеющиеся внутрилабораторные данные позволяют сокращать количество животных в эксперименте, например, за счет снижения количества животных в контрольных группах и группах отсроченного наблюдения. Предварительный анализ имеющихся научных данных о тестируемом соединении или о соединениях-аналогах может способствовать сокращению животных в эксперименте без ущерба для прогнозирования клинической безопасности. Кроме того, благодаря применению научно обоснованного подхода и тщательному планированию эксперимента можно избежать эвтаназии всех животных в эксперименте. В настоящее время по завершении исследования более широко стала распространяться практика передачи участвовавших в исследовании собак частным лицам.
Введение
Использование собак в качестве лабораторных животных началось еще в ХVII веке. Сходство ряда физиологических и морфологических параметров собак и человека стимулировало разработку моделей с использованием собак во многих областях. Собаки используются в фундаментальных научных исследованиях для разработки моделей с целью определения терапевтической эффективности и безопасности лекарств, диагностических тестов, вакцин и медицинских изделий. Большой раздел исследований посвящен изучению физиологии и патофизиологии собак для улучшения ветеринарного обеспечения. В связи с относительно длительной продолжительностью жизни, а также высокой частотой злокачественных новообразований, присущих этому виду, накапливаются данные, полученные на отдельных животных, по этиологии, патогенезу и терапии онкологической патологии. Кроме того, обширная база данных по иммуногематологическим параметрам, полученным при использовании собак, сделала их чрезвычайно ценной моделью для исследований трансплантации органов, особенно почек, и оценки терапевтической эффективности иммунодепрессантов [1, 2].
Собака считается одним из самых древних домашних животных, и этот факт усложняет поиск ее диких предков. Вполне вероятно, что на протяжении многих веков эти животные напоминали один общий тип, похожий на современную австралийскую собаку динго. Считается, что люди довольно давно обрели навыки селекции собак по определенным признакам, что, вероятно, было вызвано широким их использованием в различных областях, например, для охоты. Разделение на современное множество пород произошло за последние 300 лет. Исторически сложилось, что наиболее активно селекционное разведение собак велось в Великобритании; к ХIХ веку были выведены породы для различных задач, включая спортивные (сеттер, пойнтер, спаниель, фокстерьер), пастушьи (староанглийский и шотландский колли), охотничьи (включая волкодава, фоксхаунда и бигля), охранные (мастиф) и породы, которые рассматривались в качестве домашних питомцев (кинг-чарльз-спаниель, мопс, шпиц) [1].
Долгое время в научных исследованиях использовались беспородные собаки. Однако со временем стало понятно, что у животных, выращенных в лабораторных условиях или в питомнике, обычно наблюдается меньше клинических проблем, что позволяет избежать негативного влияния индивидуальных особенностей клинического здоровья на результаты экспериментов. Постепенно исследователи перешли к использованию выведенных в лаборатории/питомнике собак.
Из многих существующих пород лишь ограниченное число обладает качествами (например, средний размер, уравновешенный темперамент и простота в обращении и содержании), желательными для экспериментальной работы. В области токсикологических исследований бигль, вероятно, является наиболее часто используемой породой собак [1]. Этих собак обычно содержат в питомниках исследовательских центров гомогенными группами по возрасту, массе тела, полу и репродуктивному статусу в стандартных контролируемых условиях. Контролируемый статус здоровья, накопленные данные по физиологии и биохимии этой породы способствуют получению корректных научных данных [3].
Использование собак для фундаментальных исследований и экспериментов, связанных с оценкой лекарственных препаратов, стало сокращаться в последние десятилетия из-за растущей озабоченности общественности благополучием животных и по гуманным соображениям. За прошедшие годы Европейский союз, Канада, США и ряд других стран приняли законы, регулирующие использование лабораторных животных для медицинских исследований. Для некоторых целей испытания на животных были запрещены. Например, с марта 2013 г. в Европе запрещено применение животных для тестирования косметики [2]. Современная тенденция биомедицинских разработок — использование методов исследований in vitro и in silico в качестве альтернативы экспериментам на животных. Если исследования на животных все же необходимы, в большинстве стран обязательным является рассмотрение их целесообразности и соответствие принципам 3Rs.
Существует точка зрения, указывающая на то, что хотя собаки исторически применялись в качестве лабораторных животных, это не оправдывает их дальнейшее использование, поскольку широкое использование собак в качестве экспериментальных моделей возникло из-за их размера, доступности и простоты использования, а не из-за научной обоснованности. Отмечается, что существует много фундаментальных отличий в физиологии между собаками и людьми, что не позволяет рассматривать данные, полученные на собаках, как имеющие трансляционную ценность [4].
Так, например, в масштабном анализе для оценки трансляционной ценности данных токсикологических исследований на собаках были проанализированы нежелательные эффекты 2366 препаратов, зафиксированные в доклинических и клинических исследованиях. Сделан вывод: отсутствие токсического действия у собак не свидетельствует о том, что нежелательных эффектов у людей не будет, однако наличие токсических эффектов у собак может прогнозировать нежелательные реакции у людей [5].
Тем не менее, количество собак, используемых во всем мире для медицинских исследований, в частности, для регуляторных токсикологических исследований, все еще велико [4].
Доклинические исследования in vivo
Цель доклинических исследований — установить эффективность, фармакокинетические параметры и безопасность лекарственных препаратов. Программа доклинической оценки должна включать следующее1,2:
-
Изучение фармакологических свойств лекарственного препарата:
а) основные фармакодинамические эффекты (первичная фармакодинамика);
б) фармакологические эффекты, не связанные с заявленным показанием к применению (вторичная фармакодинамика);
в) фармакологическая безопасность;
г) фармакодинамическое взаимодействие. -
Изучение фармакокинетических свойств.
-
Изучение токсических свойств:
а) токсичность при однократном введении;
б) токсичность при многократном введении и токсикокинетика;
в) генотоксичность;
г) канцерогенность;
д) репродуктивная и онтогенетическая токсичность; е) местная переносимость;
ж) другие токсикологические исследования (при необходимости) по изучению антигенности, иммунотоксичности, фототоксичности, лекарственной зависимости.
Ряд исследований, согласно регламентирующим документам, должен быть проведен с использованием лабораторных животных. Для некоторых исследований необходимым условием является использование двух видов животных, одним из которых должен быть вид, не относящийся к грызунам3. В доклинических программах разработки многих лекарственных препаратов в качестве второго вида животных применяются собаки.
Фармакодинамика
Оценка фармакологической эффективности лекарственного препарата с использованием моделей на животных имеет смысл только в том случае, если существует валидная модель рассматриваемого заболевания. При анализе возможности использования лабораторных животных для оценки фармакологической эффективности необходимо получить доказательства того, что данный вид животных является релевантным для оценки свойств рассматриваемого препарата, например, у данного вида животных экспрессируется мишень действия лекарственного средства.
В последнее время благодаря значительному сходству генома человека и собаки эти животные рассматриваются как модель, на которой можно исследовать редкие генетически детерминированные заболевания человека. У собак были описаны сотни спонтанных генетических заболеваний, многие из которых имеют значительное сходство с редкими заболеваниями человека. Например, в исследовании на собаках был идентифицирован ген SLC37A2, который рассматривается как связанный с патогенезом инфантильного гиперостоза человека (болезнь Каффи). Установленное патофизиологическое сходство многих патологических состояний человека и собак позволяет предположить, что исследования орфанных заболеваний на собаках могут внести значительный вклад в понимание патогенеза и терапии болезней у человека [3].
Одним из таких примеров редких заболеваний человека являются наследственные сенсорные невропатии, также известные как наследственные сенсорные и вегетативные невропатии — клинически и генетически гетерогенная группа заболеваний, характеризующихся прогрессирующей потерей чувствительности. На сегодняшний день уже обнаружено около 20 генов, связанных с развитием заболевания. У собак также диагностируются подобные невропатии, причем некоторые породы предрасположены к определенным формам заболевания. Недавно были обнаружены соответствующие гены у бордер-колли и охотничьих пород собак [6]. Модели на собаках могут быть использованы для изучения и оценки эффективности генной терапии такого редкого заболевания, как наследственная мышечная дистрофия Дюшенна [7].
Собаки рассматриваются как одна из возможных моделей болезни Альцгеймера. Когнитивная дисфункция собак, или деменция собак, — распространенное нейродегенеративное заболевание среди пожилых животных. Частота заболевания составляет 14–60% среди особей старше 8 лет и примерно 60% — в возрасте 11 лет. Когнитивная дисфункция собак имеет ряд схожих черт с заболеванием человека. Пептид β-амилоид естественным образом накапливается в мозгу, при этом его аминокислотная последовательность и паттерн накопления в структурах мозга собак схожи с таковыми человека. Патологические изменения у собак с когнитивной дисфункцией аналогичны тем, которые наблюдаются у людей с болезнью Альцгеймера. У собак с когнитивной дисфункцией отмечается атрофия и потеря нейронов в коре, гиппокампе и лимбической системе. Наиболее распространенные клинические симптомы имеют сходство с таковыми болезни Альцгеймера у людей и включают дезориентацию, тревогу, нарушение памяти, агрессию или апатию, трудности с контролем физиологических функций организма, нарушение циркадного ритма [8].
У возрастных собак присутствуют сходные с человеком признаки старения мозга, что делает модели на собаках особенно полезными для разработки профилактических или терапевтических вмешательств, направленных на улучшение функции мозга в пожилом возрасте [9].
На собаках проводятся не только исследования старения мозга, но и организма в целом. Эти разработки вносят вклад как в ветеринарию, позволяя улучшать благосостояние животных, так и в знания о физиологии старения человека, так как механизмы старения человека и собак имеют много общих черт. Недавно были начаты два крупномасштабных исследования старения собак. При исследовании жизни золотистых ретриверов (The Golden Retriever Lifetime Study) было отслежено более 3000 животных этой породы на протяжении всей их жизни с акцентом на риски развития онкологических заболеваний. Проект по изучению старения собак (Dog Aging Project) охватывает десятки тысяч собак всех пород на протяжении всей их жизни с акцентом на биологические и экологические детерминанты старения [10].
Учитывая, что типы онкологических заболеваний собак схожи с таковыми человека [10], исследования на собаках также могут иметь ценность для определения потенциальных методов терапии. Так, например, сходство патогенеза и течения остеосаркомы у домашних собак и людей позволило рассматривать данную модель как более полно отражающую особенности заболевания в гетерогенной популяции людей, чем существующие модели на грызунах, в том числе трансгенных [11].
Злокачественные меланомы собак представляют собой заболевания, также имеющие высокую гомологию с меланомами человека, что позволяет рассматривать эту модель как имеющую ценность для разработки и оценки методов лечения человека [12].
На собаках разработаны модели многих распространенных заболеваний человека. Известны модели с использованием собак, позволяющие воспроизводить хроническую почечную недостаточность [13].
Разработаны модели ишемического инсульта. С появлением новых эндоскопических технологий стало возможно использовать менее инвазивные эндоваскулярные методы инъекции тромбов для воспроизведения временной или постоянной окклюзии средней мозговой артерий. На собаках воспроизводятся и другие типы моделей инсульта, включая окклюзию позвоночной и базилярной артерии, которые также могут быть реализованы с помощью техники эндоваскулярной инъекции тромба [14].
Некоторые сходные черты в строении и функционировании глаза человека и собаки позволяют использовать модели на собаках для изучения патогенеза и потенциальных способов терапии болезней глаз, таких как синдром сухого глаза, аллергический конъюнктивит, микробный кератит, эндотелиальная дистрофия роговицы и др. Так, например, недавно была предложена модель конъюнктивита у собак. Модель на собаках особенно привлекательна, учитывая низкую стоимость, неинвазивность, саморазрешающийся характер, возможность регулировать продолжительность и тяжесть заболевания, а также общие черты с заболеваниями человека. Индукция конъюнктивита осуществляется закапыванием в глаза раствора гистамина. Тяжесть заболевания зависит от дозы, что позволяет исследователям вызывать легкий, умеренный или тяжелый конъюнктивит. Длительность заболевания также определяет доза, при этом продолжительность можно увеличить, повторяя местное введение гистамина через определенные промежутки времени [15].
Таким образом, на сегодняшний день существует большое количество моделей различных патологических состояний, которые воспроизводятся на собаках. Однако в силу этических и экономических причин использование собак в оценке и/или в подтверждении фармакологической эффективности лекарственных препаратов оправдано только в том случае, когда никаких других альтернатив (например, использование грызунов, методов in vitro) нет, и ценность полученной научной информации неоспоримо будет окупать применение собак в качестве лабораторных животных.
Фармакологическая безопасность
Основной набор исследований фармакологической безопасности включает оценку воздействия на сердечнососудистую, центральную нервную и дыхательную системы4,5. Изучение фармакологической безопасности лекарственного кандидата должно проводиться до начала клинической разработки, поскольку полученная на данном этапе информация о влиянии потенциального лекарства на функциональную активность основных органов и систем крайне важна для принятия решения о целесообразности его разработки.
Центральная нервная система
Для изучения влияния препарата на центральную нервную систему рекомендовано оценить двигательную активность, изменение поведения, координацию движений, сенсорные/моторные рефлексы и температуру тела. Можно использовать стандартные тесты оценки функционального состояния центральной нервной системы, модифицированный тест Ирвина или др.
Чаще всего в таких исследованиях участвуют грызуны, так как именно для них разработаны методы оценки [16, 17].
Если оценка эффектов в отношении центральной нервной системы проводится на этапе изучения токсических свойств, в ходе рутинных клинических наблюдений уже происходит первоначальная оценка наличия/отсутствия влияния лекарственного кандидата на функциональную активность нервной системы. При наблюдениях, указывающих на такое влияние, целесообразно проводить углубленную оценку с использованием теста Ирвина [16] или функциональной батареи тестов [17].
Данные тесты позволяют получить информацию о влиянии препарата на различные параметры, характеризующие функциональное состояние нервной системы [18].
Изначально разработанные для проведения тестирования на грызунах данные подходы с определенными модификациями применимы и для любых других видов лабораторных животных, в том числе и для собак, с учетом их видовых особенностей.
При работе с собаками необходимо учитывать разнообразие их темпераментов, любые оценки эффектов препарата следует проводить в сравнении с фоновыми показателями (до введения вещества). Большое значение имеют данные клинических наблюдений, осмотров, которые проводятся персоналом, работающим с данными животными длительное время. Таким образом могут быть замечены любые, даже незначительные изменения в поведении, настроении, которые потенциально могут свидетельствовать о центральном действии вещества.
Сердечно-сосудистая система
При изучении влияния лекарственного кандидата на сердечно-сосудистую систему in vivo рекомендовано оценить влияние на артериальное давление, частоту сердечных сокращений и показатели электрокардиограммы (ЭКГ), в том числе на интервал QT6.
В исследованиях по оценке влияния на сердечно-сосудистую систему in vivo рекомендовано использовать морских свинок, кроликов, хорьков, собак, приматов.
Собаки широко используются в исследованиях фармакологической безопасности в отношении сердечно-сосудистой системы благодаря сходству проводящей системы сердца с таковой у человека. Кроме того, на собаках было подтверждено наличие определенной связи между препаратами, удлиняющими интервал QT, и повышенной вероятностью развития желудочковой тахикардии [19].
Поскольку интервал QT зависит от частоты сердечных сокращений, его необходимо корректировать. Наиболее распространенные подходы состоят в использовании формулы Базетта (Bazett) или формулы Фридерика (Fridericia). Учитывая необходимость подбора поправочных формул для оценки QT, а также зависимость параметров ЭКГ от большого числа факторов, в каждой лаборатории должен быть разработан подход, позволяющий использовать собственные данные, полученные на конкретной породе собак и при определенных экспериментальных условиях, с учетом всех факторов, потенциально влияющих на результаты (циркадные ритмы, используемое оборудование, анализируемые отведения, наркотизация и др.). Проведенный анализ данных по параметрам ЭКГ, полученных в разных научных центрах, показал достаточно большую вариабельность параметров, которая определяется тем, была ли проведена регистрация параметров на бодрствующих или наркотизированных животных, а также какие именно препараты были использованы для наркотизации (в случае регистрации параметров на наркотизированных животных) [20].
При анализе ЭКГ у собак следует учитывать наличие выраженной синусовой аритмии и крайне нерегулярный размер и форму зубца Т. При анализе 12 последовательных сердечных циклов обычно охватывается период времени, эквивалентный как минимум трем дыхательным циклам, и это позволяет свести к минимуму последствия синусовой аритмии у собак [21].
С развитием технологий стало возможно использовать телеметрическое оборудование, позволяющее регистрировать в режиме реального времени большое количество параметров, характеризующих функциональное состояние сердечно-сосудистой системы. Существенным преимуществом данных систем является то, что регистрация проводится на бодрствующих животных, поэтому влияние наркотизации и/или стресса обездвиживания на регистрируемые параметры исключается.
Дыхательная система
При оценке влияния лекарственных препаратов на дыхательную систему необходимо оценить частоту дыхания и другие параметры (например, дыхательный объем или насыщение гемоглобина кислородом).
Компьютеризированные системы для оценки дыхательной системы позволяют проводить процедуры как на бодрствующих, так и на наркотизированных собаках. В случае оценки на бодрствующих собаках требуется предварительное приучение животных к процедуре (частичная иммобилизация, маска) в течение как минимум 2 нед до начала основного исследования. Стандартные оцениваемые показатели включают частоту дыхания, дыхательный объем, минутную вентиляцию, газы крови. Кроме того, при использовании анестезии могут быть вживлены датчики плеврального давления, позволяющие оценивать такие параметры, как сопротивление и эластичность легкого [22].
Считается, что поскольку большинство лекарственных препаратов предназначены для использования у пациентов в сознании, а анестетики, анальгетики и седативные средства могут изменять дыхательные рефлексы и реактивность дыхательных путей, доклинические исследования, оценивающие влияние лекарств на респираторную функцию, должны проводиться предпочтительно на животных в сознании. Действительно, в исследовании на собаках, в котором было проведено сравнение параметров, полученных на наркотизированных и бодрствующих животных, показана большая чувствительность модели в том случае, когда животные находились в сознании по сравнению с состоянием под наркозом. Так, сравнение газов артериальной крови и значений pH, зарегистрированных через 5 мин после введения физиологического раствора у наркотизированных и бодрствующих собак, ясно показало угнетение дыхания, вызванное анестезией пропофолом [22].
Фармакокинетика
Собаки широко используются в исследованиях фармакокинетики лекарственных препаратов благодаря возможности введения необходимых объемов/доз лекарственного препарата, а также забора биологического материала (кровь, моча, кал) в достаточных количествах. Так, в базе Национальных институтов здоровья PubMed по запросу «pharmacokinetic study in dogs» найдено 10 276 научных статей (рис. 1, информация на октябрь 2023 г.). В основном на собаках проводят изучение абсорбции и выведения лекарственных веществ.
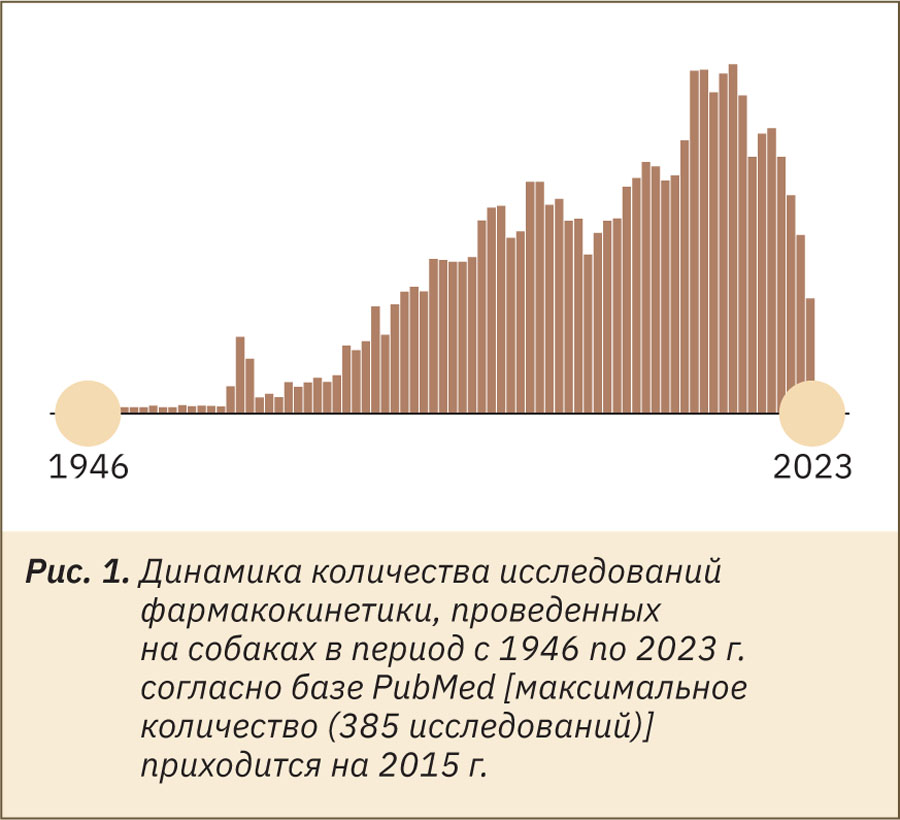
Следует сказать, что у собак есть некоторые видовые особенности физиологии, которые могут оказывать влияние на фармакокинетику лекарственных средств.
При пероральном введении лекарственного препарата рН желудка может влиять на растворимость вещества в желудочном соке и, как следствие, на последующую абсорбцию соединения, рН желудка натощак у собак сходен с таковым у человека и других млекопитающих (1,5–2,0), но базальная секреция кислоты у собак ниже, чем у людей, свиней или обезьян. Кроме того, рН желудка собак довольно вариативен и может повышаться до уровня, близкого к рН содержимого двенадцатиперстной кишки. Это может влиять на растворение и абсорбцию, особенно для лекарств, растворимость которых сильно зависит от рН. После приема пищи желудок собак интенсивно секретирует кислоту. Эта высокая секреторная способность может предотвращать постпрандиальное буферное действие пищи, наблюдаемое у многих других видов лабораторных животных. Таким образом, pH желудка у собак резко не изменяется сразу после приема пищи [23].
Желудочный муцин может влиять на способность желудочно-кишечного тракта нейтрализовать кислоту и на скорость желудочно-кишечного транзита некоторых лекарственных форм. Было обнаружено, что у собак и крыс слизистый слой муцина в желудке толще, чем у людей (примерно 400–700 мкм против приблизительно 25–300 мкм). Это в свою очередь, позволяет предположить, что влияние муцина на всасывание лекарств может быть более выражено у собак и крыс по сравнению с человеком [23].
Всасывание лекарственных препаратов происходит преимущественно в тонкой кишке. Степень всасывания зависит от физико-химических характеристик препарата, кишечной среды и времени нахождения в тонкой кишке; pH тонкого кишечника обычно самый низкий в проксимальном конце, в двенадцатиперстной кишке сильно зависит от количества желудочного сока и секреции бикарбоната поджелудочной железой. При голодании скорость секреции бикарбоната у собак выше, чем базальная скорость секреции желудочного сока. У людей верно обратное. В результате у собак натощак pH тонкого кишечника немного выше, чем у людей. У собак после приема пищи рН дуоденального содержимого имеет тенденцию к снижению в большей степени, чем у людей, из-за высокой способности собак к постпрандиальной секреции кислоты. Время прохождения содержимого через тонкий кишечник у собак зависит от размера частиц, при этом для более крупных частиц требуется больше времени для прохождения. Время транзита у собак натощак примерно в 2 раза меньше, чем у людей (111 мин против 238 мин), что также может сказываться на параметрах абсорбции [23].
В одном из исследований было проведено сравнение абсорбции при пероральном введении 43 соединений различных классов у человека, крыс и собак с целью ответа на вопрос, на каком из видов животных результаты исследований наиболее точно отражают параметры абсорбции, наблюдаемые у человека. У собак отмечена низкая корреляция (r2=0,51) с параметрами, установленными у людей. Авторы обнаружили, что лекарства, которые хорошо всасываются у людей, вероятно, также хорошо всасываются и у собак. Однако обратное может быть неверным: лекарственные препараты, хорошо усваиваемые собаками, могут не проявлять таких же свойств у людей. В отличие от собак в исследованиях на крысах наблюдалась высокая корреляция параметров абсорбции с отмеченными у людей (r2=0,97). Предполагается, что исследования на крысах могут более точно прогнозировать параметры абсорбции у человека. При этом более высокая абсорбция, обычно наблюдаемая у собак, может иметь преимущества в токсикологических исследованиях, поскольку она обеспечивает более значительную системную экспозицию лекарственного препарата [24].
Основными метаболизирующими лекарственные препараты ферментами печени являются цитохромы Р450. Количество ферментов CYP450 на 1 мг белка печени одинаково у собак и человека, но меньше, чем у крыс, обезьян и морских свинок. Общее содержание CYP450 в печени, однако, не предсказывает способность вида метаболизировать то или иное соединение.
В исследованиях, посвященных межвидовым сравнениям активности ферментов CYP450, были установлены отличия между собаками и другими видами лабораторных животных и человеком, но природа этих отличий до конца не ясна. Возможно, что субстраты, которые у человека и крыс, например, метаболизируются одним ферментом, у собак — несколькими [23].
В токсикокинетических исследованиях с повторным введением может наблюдаться индукция метаболизма, которая повлияет на фармакокинетику изучаемого лекарственного препарата. У собак, как и у других видов лабораторных животных, показана индукция печеночных ферментов в ответ на хроническое введение ксенобиотиков [23].
Элиминация лекарственных препаратов с желчью имеет особое значение, когда молекулярная масса препарата или его метаболитов более 300 Да. Другие факторы, влияющие на степень выведения соединения с желчью, включают полярность и заряд. Считается, что у собак выведение с желчью происходит достаточно интенсивно, как и у мышей и крыс, в то время как у людей, кроликов и обезьян этот процесс менее интенсивный [23].
Токсикология
С 1965 г. существуют требования о необходимости использования двух видов лабораторных животных в исследованиях токсичности [25].
Выбор видов животных для токсикологических исследований должен быть обоснован в каждом конкретном случае на основе анализа имеющихся научных данных с учетом фармакологической активности лекарственного препарата, его фармакокинетического профиля, возможности обеспечения достаточной экспозиции, релевантности видов лабораторных животных, этических и нормативных аспектов.
Следует помнить, что наиболее ценные данные о безопасности клинического применения лекарственного препарата могут быть получены только с использованием релевантной животной модели, а не наиболее доступной. Публикация полученных результатов по различным классам соединений также имеет большое значение, так как позволяет избежать дублирования исследований.
Вместе с тем вопрос о целесообразности использования собак в качестве второго вида в токсикологических исследованиях широко обсуждается. На примере исследований пестицидов был проведен ретроспективный анализ трансляционной ценности исследований на собаках по сравнению с используемыми грызунами. Было показано, что, например, данные, полученные на мышах, не дают никакой дополнительной информации, когда есть результаты, установленные на крысах и собаках. Однако подробный анализ исследований хронической и субхронической токсичности также показал, что собаки были более чувствительным видом (по сравнению с крысами) примерно в 15% исследований. Таким образом, исследования на собаках явно способствовали определению уровня дозы без наблюдаемого отрицательного эффекта (no-observed-adverse-effect level, NOAEL). Поскольку этот уровень доз используется в качестве отправной точки для оценки безопасности для человека, согласно проведенным ретроспективным исследованиям, было признано, что использование собак необходимо при исследовании пестицидов [25].
Проведено сравнение безопасности около 150 препаратов для человека с соответствующими данными доклинических исследований, полученными на грызунах и негрызунах. Выяснилось, что более высокую прогностическую ценность имели исследования, проведенные на двух видах животных (например, на собаках и крысах), по сравнению с экспериментами только на грызунах [26].
Эти данные часто воспринимаются как доказательство того, что виды животных, не являющихся грызунами, необходимы для оценки безопасности лекарственных препаратов для человека, а включение в программу исследований нескольких видов повышает чувствительность тестирования. Однако также хорошо известно, что этот подход снижает специфичность тестирования и приводит к большому количеству ложноположительных результатов [25].
Обсуждается, что надежных данных, демонстрирующих необходимость использования собак для анализа безопасности лекарств, нет, и можно двигаться в направлении сокращения использования собак в доклинических исследованиях без ущерба для безопасности человека [27, 28].
Действительно, за последние годы наблюдается сокращение использования собак в доклинических исследованиях, и одновременно повышенный интерес и признание получают карликовые свиньи в качестве альтернативного вида негрызунов. Однако понятно, что замена одного вида негрызунов на другой не является реализацией принципов 3Rs и не должна быть конечной целью [25].
В любом случае, если исследования in vivo на собаках признаны необходимыми, при проведении доклинических, в том числе токсикологических, исследований особое внимание должно уделяться реализации принципов 3Rs, (сократить/оптимизировать/заменить, reduce/refine/replace), что предусматривает улучшение и оптимизацию выполнения экспериментальных процедур с лабораторными животными.
Объемы и способы введения
В токсикологических исследованиях часто существует необходимость введения больших объемов лекарственного препарата для достижения требуемых доз. Введение больших объемов может быть затруднено на практике и вызвать неблагоприятные физиологические эффекты, ставящие под угрозу благополучие животных.
Учитывая размеры собак, в токсикологических исследованиях практически при любом способе введения можно протестировать необходимые дозы лекарственных препаратов, близкие к терапевтическим для человека и превышающие их.
Рекомендованный объем для однократного введения — это объем вводимого лекарственного средства, который не вызывает у животного дискомфорт, болевые ощущения и не влияет на его поведение. Максимальный объем вводимого лекарственного средства для однократного введения — это объем, который является физиологически возможным, но может вызвать кратковременный дискомфорт у животного и потребовать дополнительной подготовки перед проведением манипуляции (депривация кормом, установка внутривенного или артериального катетера, анестезия и другие) [29].

В табл. 1 представлены рекомендуемые и максимальные объемы введения для собак при наиболее часто используемых в исследованиях способах введения [30–34].
Энтеральное введение собакам может осуществляться через желудочный зонд, путем введения капсул/таблеток, суспензий, введение препарата с пищей. Объемы дозирования через желудочный зонд обычно находятся в диапазоне от 5 до 20 мл/кг, жидкость следует вводить медленно, чтобы предотвратить желудочный рефлюкс. Однако введение веществ собакам с помощью зонда трудоемко, и всегда существует вероятность ошибки или аспирации. Использование капсул, как правило, является предпочтительным методом перорального введения в исследованиях на собаках. Общий подход при применении желатиновой капсулы у собак заключается в том, чтобы сначала намочить капсулу водой, открыть пасть животного, а затем поместить капсулу как можно дальше на язык животного. Человек, вводящий препарат животным, должен увидеть признаки проглатывания; почти все собаки облизывают губы после проглатывания капсулы. Также возможно пероральное введение суспензий или растворов лекарственных препаратов с помощью шприца. Введение препаратов в составе корма часто используется у грызунов и является еще одним возможным способом, однако это не оптимальный вариант для собак по нескольким причинам. Повышенная активность собак, особенно когда люди входят или находятся в помещении для животных, может привести к постоянной проблеме с просыпанием корма. Другая проблема заключается в том, что собаки часто очень привередливы в еде и иногда едят мало или вовсе отказываются от пищи в течение дня и компенсируют недостаток, съедая больше на следующий день, а это может привести к колебаниям уровня тестируемого соединения в крови [1].
Также возможно ректальное и интравагинальное введение. Соединения, вводимые собакам ректально, могут использоваться в виде суппозиториев, ректальных желатиновых капсул (растворов и суспензий) или микроклизм. Однако наиболее часто такой лекарственной формой являются суппозитории. Микроклизмы обычно готовят в виде желатиново-солевого раствора или простого физиологического солевого раствора и вводят в объеме от 0,5 до 1 мл. Суппозитории обычно имеют массу от 0,5 до 1 г, короткие и затупленные по форме и вводятся примерно на 4 см от наружного ректального сфинктера. Соединения, вводимые вагинально, обычно представлены в форме суппозиториев или кремов. Кремы вводят во влагалище с помощью аппликатора. Затем вход во влагалище закрывается пластиковым зажимом на определенный период времени. Суппозитории и таблетки можно вводить вагинально с помощью пластикового тампонообразного аппликатора [1].
Во всех случаях, какой бы способ введения не использовался для того, чтобы процедура проходила успешно и не была стрессовой для животных, требуется определенный подготовительный этап, в течение которого собака приучается к процедуре и человеку, ее осуществляющему. По возможности лучше и во время исследования использовать ту же команду людей, которые участвовали в процессе обучения.
Оцениваемые параметры в ходе токсикологического исследования
Клиническое наблюдение
Клинические наблюдения и осмотры являются неотъемлемой частью токсикологических исследований, обычно проводятся как до введения препаратов, так и после и состоят в наблюдении за животными для регистрации любых признаков, свидетельствующих о плохом состоянии здоровья или об аномальном поведении (например, снижение двигательной активности, тремор, слюноотделение, аномальный стул и др.). Прежде чем проводить такие наблюдения, важно ознакомиться со спектром клинических признаков, которые можно увидеть в нормальной популяции собак. Например, при нормальном состоянии у собак может иногда отмечаться рвота, мягкий стул, легкое покраснение глаз, незначительные выделения из носа [1].
До начала исследования, в период введения препаратов и отсроченного наблюдения, проводится регистрация массы тела животных, потребление корма и воды один раз в неделю. При обычных условиях масса тела взрослых собак обычно не подвергается значительным изменениям, поэтому можно в ходе длительных исследований регистрировать данный показатель реже. Если на начальных этапах не установлено влияния препарата на массу тела в ходе долгосрочных исследований, этот показатель, как и потребление корма и воды, можно регистрировать реже (например, дважды в месяц).
Сердечно-сосудистая система
В ходе исследований токсичности должна проводиться оценка параметров, характеризующих функциональное состояние сердечно-сосудистой системы. Артериальное давление у собак можно определить либо непрямыми (неинвазивными) методами, либо прямым определением. При неинвазивном методе используется надувная манжета. Прямое определение артериального давления может быть выполнено путем введения специального датчика в артерию (например, бедренную) с помощью иглы для подкожных инъекций. Более инвазивной процедурой является телеметрия. Для этой процедуры животным с помощью хирургической операции имплантируют радиопередатчики, позволяющие непрерывно контролировать среднее, систолическое и диастолическое кровяное давление (а также параметры ЭКГ и температуру тела) [1].
Параметры артериального давления у собак без анестезии зависят от степени ее беспокойства и возбуждения. По этой причине измерение давления следует проводить в тихой комнате, при этом животные должны находиться в удобном положении. Некоторые исследователи считают полезным приучать собак в течение нескольких дней до регистрации давления лежать или сидеть в заданном положении. Обычно делают не менее трех измерений систолического и диастолического давления и определяют среднее систолическое и среднее диастолическое артериальное давление [1].
Регистрацию ЭКГ обычно проводят с использованием ветеринарных электрокардиографов. При этом возможна регистрация ЭКГ под наркозом. Регистрация ЭКГ у собак в сознании требует проведения предварительных тренировочных процедур с целью приучения животного к процедуре. Во время всех записей важно использовать одно и то же стандартное положение тела. При регистрации ЭКГ животных следует держать на теплой, непроводящей электрический ток поверхности, например на столе, покрытом резиновым ковриком или одеялом. В качестве электродов обычно используются зажимы типа «крокодил» из нержавеющей стали или меди. Рекомендуется записывать ЭКГ в течение 60 с [1].
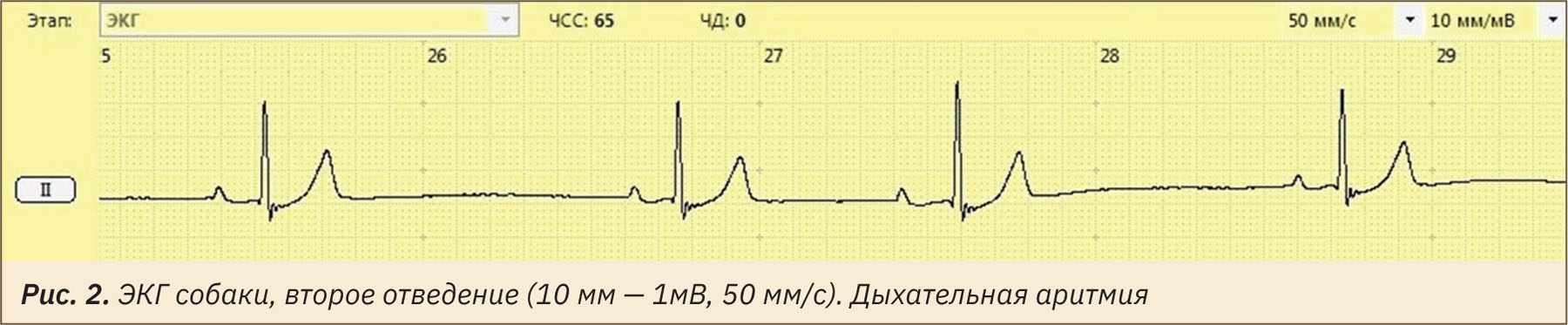
На ЭКГ собак может отмечаться синусовая аритмия. Это связано с тем, что у собак присутствует циклическое усиление и ослабление парасимпатической эфферентной активности с дыханием, это вызывает циклическое ускорение и замедление сердечного ритма — дыхательную синусовую аритмию. При анализе 12 последовательных сердечных циклов обычно охватывается период времени, эквивалентный как минимум трем дыхательным циклам, что позволяет свести к минимуму последствия синусовой аритмии у собак. На рис. 2 представлена типичная ЭКГ собаки породы бигль, находящейся в состоянии наркотизации (медетомидин внутримышечно, 10–15 мкг/кг и пропофол внутривенно, в начальной дозе 1 мг/кг). Синусовый ритм характеризовался периодами учащения и урежения сердечных циклов. Равномерность распределения этих периодов в ходе регистрации ЭКГ свидетельствует о том, что изменение частоты ритма происходило синхронно с фазами дыхания (частота сердечных сокращений увеличивалась при вдохе и снижалась при выдохе) [20].
Офтальмоскопия
Офтальмоскопия является необходимым исследованием при изучении токсичности новых веществ. Исследование проводится на собаках, находящихся в сознании. Для такой процедуры собаку удерживает в сидячем положении один человек, в то время как другой проводит осмотр. Осуществляются визуальный осмотр глаза, оценка слезотечения, зрачкового рефлекса (при приглушенном освещении), далее при помощи офтальмоскопа оценивается состояние глазного дна [35].
Следует отметить, что в последнее время модели офтальмологических заболеваний, воспроизведенные на собаках, рассматриваются как имеющие высокую трансляционную ценность. Сравнительная оценка анатомии и физиологии глаза собаки и человека свидетельствует, что собаки лучше, чем другие виды лабораторных животных, подходят для трансляционных исследований в офтальмологии. В отличие от мелких лабораторных животных собаки имеют сходные с людьми анатомические и физиологические особенности, на них влияют одинаковые факторы стресса окружающей среды и генетические вариации, при этом отмечается ряд естественных офтальмологических заболеваний, которые очень напоминают клинические фенотипы у людей. Для оценки эффективности и безопасности офтальмологических препаратов важно наличие сходства между собаками и людьми в частоте моргания, скорости продуцирования слезы (базальной, рефлекторной), объемной емкости глазной щели и других факторах, влияющих на диффузию лекарственных препаратов (например, объем глазного яблока, толщина роговицы) [36].
Сбор биологических образцов
Сбор крови
Кровь у собак может быть забрана из яремной, бедренной вены, плечевых и подкожных вен. Преимущество яремной вены состоит в том, что она большая и легкодоступная, поэтому подходит для многократного отбора проб. Место сбора выбривают и смазывают спиртовым раствором, для взятия образца используют иглу диаметром 20 или 21G. После забора необходимого объема крови (обычно всего 5–6 мл для клинических лабораторных определений и 1–2 мл для каждой точки фармакокинетического исследования) иглу извлекают и накладывают сухую марлю (с давлением) на место, пока кровотечение не остановится. Из-за того что коммерческие диеты могут влиять на такие биохимические параметры, как уровень мочевины, глюкозы и холестерина в крови, рекомендуется, чтобы животные голодали в течение ночи перед забором крови [1].
Сбор мочи
Обычными системами сбора мочи для собак являются метаболические клетки или желоба из нержавеющей стали, которые прикрепляются к домашней клетке. Во многих лабораториях сбор мочи у собак проводится в ночное время (приблизительно 15-часовой период) из-за сложности постоянного получения достаточных объемов мочи у некоторых собак в течение более коротких периодов сбора. Однако есть проблемы, связанные с таким длительным временем сбора. Бактериальная активность в образце мочи может увеличиваться, а билирубин расщепляться до биливердина при воздействии на образец света. Контейнеры для сбора также должны быть защищены от света. Свободный доступ к воде может повлиять на образцы мочи из-за случайного разбавления, поэтому собаки обычно не имеют доступа к воде в течение ночного периода сбора [1].
Также для забора мочи могут быть использованы катетеризация и цистоцентез. Цистоцентез требует использования стерильных игл и шприцев для извлечения мочи из мочевого пузыря. В процессе катетеризации образцы мочи извлекаются прямо из уретры. Использование катетеризации или цистоцентеза позволяет получить не загрязненные микробиологически образцы мочи. Однако для осуществления этих процедур требуется наличие специальных навыков у персонала, также может потребоваться наркотизация животного, есть вероятность травмирования [37].
Планирование исследований на собаках
Собаки используются в краткосрочных исследованиях с многократным введением препарата (2- или 4-недельные исследования), субхронических (до 13 нед) или хронических (более 13 нед, часто 26 нед или дольше) токсикологических исследованиях [1].
При планировании исследований на биглях нужно принимать во внимание их определенные преимущества и недостатки. Достоинства бигля в качестве экспериментальной модели обусловлены такими факторами, как его средний размер и уравновешенный темперамент. Относительная простота обращения позволяет выполнять любые рутинные манипуляции в исследовании (например, многократный сбор крови, возможность проведения электрокардиографического исследования у животного в сознании). Недостатки использования биглей включают часто большие различия в размерах и массе тела, повышенные требования к условиям содержания (пространство, возможность прогулок, наличие достаточного количества квалифицированного обслуживающего персонала). Еще одним недостатком биглей является громкий лай, который можно контролировать с помощью частичной вентрикулокордэктомии, процедуры, которая дает ощутимые результаты, но не влияет на самочувствие собаки. Тем не менее вентрикулокордэктомия не является обычной практикой в исследовательских учреждениях. У собак могут наблюдаться судороги в ответ на введение тестируемого соединения, что приводит к необходимости снижения дозы. Часто наблюдается рвота, что может затруднять правильное дозирование веществ при пероральном введении. Нестероидные противовоспалительные препараты приводят к повреждению желудочно-кишечного тракта у собак. Антигипертензивные препараты могут давать кардиотоксические эффекты. Самки крайне чувствительны к гормональным препаратам (эстрогенам и антиэстрогенам). Препараты, которые стимулируют высвобождение гистамина, могут вызывать псевдоаллергические реакции. Для собак может потребоваться большое количество тестируемого соединения (по сравнению с крысами, морскими свинками, хорьками), что часто бывает серьезным недостатком, когда доступно только ограниченное количество тестируемого соединения. У собак может наблюдаться реакция высвобождения гистамина на внутривенное введение некоторых растворителей (например, Tween®) [1].
Эксперименты с использованием большого количества собак, как правило, не могут быть проведены быстро, и необходимо тщательное предварительное планирование для гарантии того, что животные нужного возраста и количества будут получены и размещены вовремя, чтобы уложиться в запланированные сроки [1].
При планировании процедур следует учитывать, что многократные манипуляции с собаками, такие как сбор крови, проведение ЭКГ, офтальмологические и клинические обследования, вызывают у животных некоторый стресс. Для краткосрочных исследований это может стать проблемой, так как необходимо провести несколько манипуляций за относительно короткий период времени. При планировании следует разделять манипуляции так, чтобы в один и тот же день было запланировано не более двух процедур [1].
Несмотря на все сложности, бигли широко используются в исследованиях общей токсичности. Согласно нормативным требованиям, изучение безопасности новых фармакологических веществ включает исследования других видов токсичности: генотоксичность, канцерогенность, репродуктивная и онтогенетическая токсичность, местная переносимость, иммуногенность, иммунотоксичность и другие (при необходимости).
Генотоксичность и канцерогенность
Исследования генотоксичности in vivo при необходимости, как правило, проводятся на грызунах. Собаки широко не используются в таких исследованиях.
Исследования канцерогенных свойств новых лекарственных средств проводятся с целью выявления потенциального канцерогенного действия исследуемого вещества у лабораторных животных и определения возможного риска для человека. Любые факты, свидетельствующие о вероятности наличия такого эффекта, полученные в ходе лабораторных и токсикологических исследований у животных, а также клинического применения, могут обусловливать необходимость проведения исследований канцерогенных свойств. В общем случае исследования канцерогенных свойств проводят на мышах и/или крысах при многократном введении лекарственного средства на протяжении средней продолжительности жизни животного с регистрацией и последующим сравнением частоты развития новообразований в контрольной и экспериментальных группах7,8. Доклинические исследования канцерогенности на крупных лабораторных животных не проводят. Однако если на собаках запланировано длительное исследование токсичности, то в этом случае в качестве дополнительных параметров может быть включен мониторинг всех возникших в период введения и отсроченного наблюдения новообразований с их последующей морфологической оценкой. Данная информация может быть полезна при оценке риска канцерогенности тестируемого соединения.
Одним из способов оценки возможного канцерогенного потенциала и/или токсических эффектов может быть прижизненное взятие материала посредством биопсии.
Биопсия — это метод исследования, при котором проводится прижизненное взятие клеток или тканей из организма с диагностической или исследовательской целью. Биопсия является обязательной составляющей диагностики онкологических заболеваний у животных. С этой целью в ветеринарной практике разработаны различные методы взятия материала, зависящие от типа опухоли и ее расположения [38].
Цель биопсии — сбор как можно большего количества клеток для постановки диагноза, но без ущерба для здоровья животного. Также важно при взятии биопсии, чтобы процедура не привела к распространению патологического процесса на соседние ткани.
Для забора тканевого или клеточного материала в лабораторных условиях используют несколько способов, приведенных ниже.
Эксцизионная биопсия — в результате хирургического вмешательства происходит изъятие всего исследуемого образования или органа. Этот метод включает удаление массы вместе с узкой полосой нормальной ткани.
Инцизионная биопсия — забор для исследования части новообразования или патологически измененного органа. Это классическая техника взятия кусочка ткани как из очага поражения, так и из нормальной окружающей ткани с помощью скальпеля. Преимущество метода в том, что можно взять образцы большего размера, метод особенно полезен при наличии участков инфицированной или некротизированной ткани в очаге поражения. Также важно, чтобы при включении нормальной ткани степень диссеминации любых патологических клеток была сведена к минимуму.
Щипковая биопсия — получение материала для исследования при помощи специальных щипцов, применяется во время эндоскопии.
Тонкоигольная и тонкоигольная аспирационная биопсия — забор клеток из различных органов/тканей при помощи тонкой иглы. Этот метод применим как для кожных, так и для более глубоких образований. Он имеет особое преимущество, заключающееся в том, что его можно использовать под ультразвуковым контролем для получения биопсии паренхиматозных органов, таких как печень или почка. Недостатком этого метода является риск получения недостаточного количества клеток.
Соскоб — получение образца краем предметного стекла, скальпелем, а также путем соскабливания материала при помощи специальной цитологической щетки.
Трепанобиопсия — забор столбика ткани трепаном полой трубкой с заостренным краем. Наиболее часто этот метод используют для проверки костей и близких к ним по плотности опухолей, а также при получении костного мозга.
Петлевая — забор материала специальной петлей при проведении эндоскопического исследования.
В доклинических исследованиях прижизненный забор материала для диагностического исследования не имеет широкого распространения. Поскольку конечной точкой в рутинных протоколах токсикологического исследования является эвтаназия животных, необходимость прижизненной морфологической диагностики не всегда очевидна. Однако в тех случаях, когда эвтаназия животных в рамках исследования не предусмотрена и/или предполагается подвергнуть эвтаназии ограниченное число животных, взятие биоматериала с целью последующей морфологической оценки может быть оправдано. При наличии известных данных о потенциальных органах-мишенях либо клинических результатов, указывающих на возможные патологические изменения того или иного органа, может быть проведен прижизненный забор материала таких органов. Также в длительных исследованиях токсичности продолжительностью до года в качестве конечных точек может включаться мониторинг любых новообразований для оценки возможных канцерогенных свойств препарата. В этом случае прижизненный забор материала опухоли также может быть информативен. Данные методы исследования целесообразно сочетать с проведением ультразвуковой диагностики.
Репродуктивная и онтогенетическая токсичность
Изучение репродуктивной токсичности включает оценку влияния тестируемого соединения на фертильность, раннее эмбриональное, эмбриофетальное, пренатальное и постнатальное развитие, влияние на развитие неполовозрелого потомства.
Для исследований, направленных на оценку репродуктивной функции, собаки не являются предпочтительным видом, в первую очередь потому, что практически невозможно провести тестирование на фертильность из-за продолжительного анэструса и невозможности предсказать начало проэструса. Также не существует надежной процедуры индукции эструса или овуляции. Хотя сперму у собак получить относительно легко, количество сперматозоидов в эякуляте может широко варьировать в зависимости от таких факторов, как возраст, размер семенников и время года [1].
Однако в исследованиях токсичности может быть проведена оценка репродуктивной системы у самцов и самок по результатам стандартного гистопатологического исследования органов репродуктивной системы. Такая оценка считается сопоставимой по чувствительности к выявлению токсического действия на репродуктивные органы животных со специальными исследованиями фертильности9. Хотя самым распространенным биологическим видом при проведении исследований являются крысы в силу практичности, сравнимости с другими результатами, полученными для данного вида животных, и большой базе накопленных знаний по данному биологическому виду, полученные на другом виде животных результаты могут дать дополнительную информацию для прогнозирования рисков репродуктивной токсичности при клиническом применении.
В тератологических исследованиях собаки оказались не столь чувствительными для оценки тератогенных эффектов, как другие животные, не являющиеся грызунами, например, приматы и хорьки [1].
Собака, однако, является подходящей моделью для использования в педиатрических исследованиях для оценки влияния препаратов на постнатальное развитие (эквиваленты фаз развития новорожденного, младенца, ребенка и подростка) [1].
Местная переносимость (местнораздражающее действие)
Местная переносимость лекарственного препарата при его планируемом пути введения может быть изучена во время исследований общей токсичности, в таком случае выполнение отдельного исследования местной переносимости лекарственного препарата не требуется10. Соответственно оценка местной переносимости должна включаться в дизайн токсикологического исследования.
Возможности для снижения количества животных в исследовании
Продолжительность исследований токсичности регламентирована и, в зависимости от стадии разработки препарата, определяется предполагаемой продолжительностью клинических исследований или длительностью применения человеком в клинической практике.
На различных этапах жизненного цикла лекарственного препарата может потребоваться проведение нескольких доклинических исследований различной продолжительности на негрызунах, что, очевидно, требует вовлечения большого количества животных. Современная тенденция проведения любых исследований in vivo — это поиск путей сокращения количества животных в эксперименте.
Часто первым этапом изучения токсикологии новых соединений являются исследования по поиску максимально переносимой дозы и подбору доз [dose range finding (DRF) studies]. Исследования проводятся не только на грызунах, но и на крупных лабораторных животных, на которых далее планируется изучать токсические эффекты при многократном введении. Для подобных предварительных исследований использовалось большое число собак. Учеными-токсикологами различных фармацевтических компаний на основании опыта проведения таких исследований был разработан оптимизированный дизайн, позволяющий минимизировать количество собак в исследованиях по подбору доз (максимум 6 животных).
Для фазы эскалации доз используют 1 самца и 1 самку, которые получают увеличивающиеся дозы до достижения максимально переносимой дозы. Далее эти и два других животных (1 самец и 1 самка) получают в течение не менее 4 дней дозу, равную максимально переносимой или ниже. Если два животных, которые участвовали в исследовании с эскалацией доз, не могут быть повторно использованы (максимально переносимая доза была превышена), то для тестирования при многократном введении используют еще двух животных, таким образом, суммарное количество животных составляет 3 самца и 3 самки. Одним из важных факторов, который следует учитывать в фазе повышения дозы, является необходимость оптимальных промежутков между дозированием. При отсутствии фармакокинетических данных обычно интервал между последовательными дозами составляет 2 или 3 дня [39].
Что касается основных исследований, в соответствии с протоколом OECD TG 40911 минимальное количество животных, которое должно быть включено в каждую основную группу, — это 4 самца и 4 самки. Количество доз — три, также в исследовании должна быть включена контрольная группа. Для оценки обратимости токсических эффектов могут быть включены группы отсроченного наблюдения, в которых также должно быть не менее 4 самцов и 4 самок/в группе.
В протоколе указано также, что на основании имеющихся знаний о химическом веществе или его близких аналогах следует рассмотреть вопрос о включении групп отсроченного наблюдения из 8 животных (4 самца, 4 самки) в контрольную группу и группу с максимальной дозой. Таким образом, количество групп отсроченного наблюдения при изучении веществ с прогнозируемым профилем токсичности может быть снижено, что позволяет уменьшить общее количество животных в эксперименте.
Традиционно доклиническая программа исследований на собаках включала проведение краткосрочного (1 мес) исследования, а также нескольких исследований большей продолжительности: 3-, 6-, 9- или 12-месячных.
Для сокращения количества животных программа может включать 1-месячное исследование, после которого проводится одно продолжительностью 9–12 мес. В ходе длительного эксперимента собираются промежуточные данные (через 3 и/или 6 мес), чтобы обосновать продолжение клинических исследований. Эвтаназия собак на этих промежуточных точках не проводится, но выполняется анализ показателей, аналогичных запланированным в клинических исследованиях. Предварительная оценка необходимости конкретных исследований может позволить снизить количество собак, участвующих в длительном эксперименте [40].
Был проведен анализ данных по количеству собак в группе при проведении токсикологических исследований в 12 европейских фармацевтические компаниях [40]. Результаты представлены ниже.
При продолжительности исследования 1 мес основное исследование обычно включало: 3 самца + 3 самки/группа (варианты — от 2 до 6 животных одного пола в группе); отсроченное наблюдение: 2 самца + 2 самки/группа (варианты — от 0 до 2 животных одного пола в группе).
При продолжительности исследования 3 мес основное исследование обычно включало: 3 самца + 3 самки/группа (варианты — от 3 до 6 животных одного пола в группе); отсроченное наблюдение: 2 самца + 2 самки/группа (варианты — от 0 до 2 животных одного пола в группе).
При продолжительности исследования 6 мес основное исследование обычно включало: 4 самца + 4 самки/группа (варианты — от 3 до 6 животных одного пола в группе); отсроченное наблюдение: 2 самца + 2 самки/группа (варианты — от 0 до 2 животных одного пола в группе).
При продолжительности исследования 9–12 мес основное исследование обычно включало: 4 самца + 4 самки/группа (варианты — от 3 до 6 животных одного пола в группе); отсроченное наблюдение: 2 самца + 2 самки/группа (варианты — от 0 до 2 животных одного пола в группе).
Как видно из представленных данных, большинство компаний использовали количество животных в группе в соответствии с нормативными требованиями, но тем не менее использовали возможности для оптимизации дизайна [40]. Один из подходов к сокращению количества животных — это уменьшение их числа в группах отсроченного наблюдения. Например, отсроченное наблюдение проводится не для всех групп, а только в тех, где применяется максимальная доза. Также возможно сокращение количества контрольных животных в группах отсроченного наблюдения.
Сокращения количества собак в токсикологических исследованиях можно также добиться, используя комбинированный дизайн, в котором в рамках исследования токсических свойств оцениваются параметры фармакологической безопасности, иммунотоксичности, репродуктивной токсичности, фармако- и токсикокинетики.
Ниже приведен пример комбинированного дизайна 90-дневного исследования токсичности лекарственного препарата для обоснования продолжительности применения препарата человеком в течение 1 мес (при регистрации лекарственного препарата) (табл. 2).
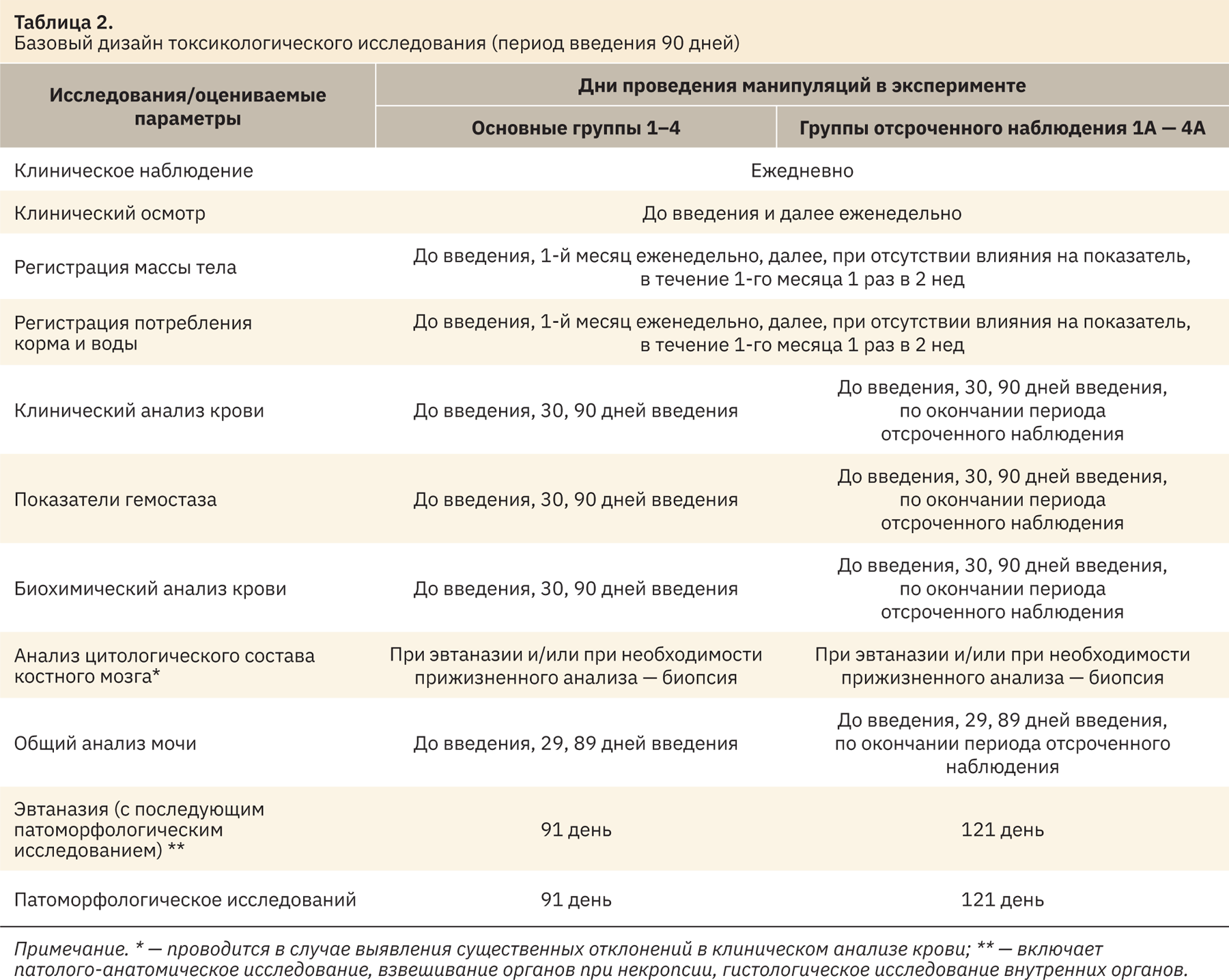
Основные группы
- Группа 1 — контроль (плацебо), 4 самца + 4 самки.
- Группа 2 — лекарственный препарат. Доза 1. 4 самца + 4 самки.
- Группа 3 — лекарственный препарат. Доза 1. 4 самца + 4 самки.
- Группа 4 — лекарственный препарат. Доза 1. 4 самца + 4 самки.
Группы отсроченного наблюдения*
- Группа 1А — контроль, 2 самца + 2 самки.
- Группа 2А — лекарственный препарат. Доза 1. 2 самца + 2 самки.
- Группа 3А — лекарственный препарат. Доза 1. 2 самца + 2 самки.
- Группа 4А — лекарственный препарат. Доза 1. 2 самца + 2 самки.
Ежедневное пероральное введение препарата или плацебо всем животным в течение 90 дней, эвтаназия всех животных основных групп на 91-й день, животных групп отсроченного наблюдения на 120-й день**.
Примечание. * При наличии научного обоснования (данные о потенциальной токсичности лекарственного препарата или близких по структуре соединений) можно включить две группы отсроченного наблюдения (например, контроль и максимальная доза). ** В случае отсутствия выраженной токсичности можно рассмотреть вопрос о выборочной эвтаназии (например, только группы с максимальной дозой). При наличии надежных исторических данных лаборатории количество животных контрольных групп, подвергнутых эвтаназии, также может быть уменьшено12.
В рамках исследования могут быть проведены:
- оценка местнораздражающего действия (по данным клинических осмотров места введения и патоморфологического исследования тканей в месте введения и регионарных лимфатических узлов);
- оценка иммунотоксических свойств:
- включает анализ клинических и биохимических показателей крови (общее количество лейкоцитов, абсолютные дифференциальные показатели лейкоцитов, уровень глобулинов), патолого-анатомическое исследование органов иммунной системы (тимус, селезенка, лимфатические узлы), гистологическое исследование органов (тимус, селезенка, лимфатические узлы, костный мозг), оценка массовых коэффициентов органов (тимус, селезенка)13; - оценка репродуктивной (генеративной) токсичности:
- у животных, подлежащих эвтаназии на 91-й день эксперимента и на 120-й день эксперимента, проводится патолого-анатомическое исследование органов репродуктивной системы, оценка массовых коэффициентов семенников и яичников, гистологическое исследование органов репродуктивной системы, оценка морфофункционального состояния сперматозоидов; - оценка возможных канцерогенных свойств:
- предварительная оценка состоит в выявлении любых новообразований в ходе клинических осмотров, патолого-анатомическое исследование, вырезка и фиксация новообразований для последующего гистологического и/или иммуногистохимического исследования; - оценка фармакологической безопасности:
- проводится в отношении дыхательной, сердечно-сосудистой, центральной нервной систем (см. раздел «Фармакологическая безопасность»); - оценка фармако- и токсикокинетических параметров:
- после первого введения препарата и после последнего введения на 10 временных точках забираются образцы крови для оценки концентрации активного вещества в крови и расчета фармакокинетических параметров.
Следует отметить, что при необходимости проведения длительных исследований на собаках (9 мес) в дизайн токсикологического исследования в качестве промежуточных точек оценки клинического состояния могут быть включены проведение ультразвуковых исследований для выявления изменений в потенциальных органах-мишенях и прижизненный забор материала с использованием биопсии. Такие подходы также позволяют снизить количество животных в эксперименте и избежать эвтаназии как конечной точки.
Заключение
В исследованиях токсичности традиционно собака считается предпочтительным видом, не относящимся к грызунам. Лабораторные собаки (бигли) разводятся специально для целей биомедицинских исследований, за длительное время их использования в научных целях накоплены обширные данные по физиологии, биохимии и морфологии. Однако выбор видов животных для токсикологических исследований должен быть обоснован в каждом конкретном случае на основе анализа имеющихся научных данных с учетом фармакологической активности лекарственного препарата, его фармакокинетического профиля, возможности обеспечения достаточной экспозиции, релевантности видов лабораторных животных, этических и нормативных аспектов. Следует помнить, что наиболее ценные данные о безопасности клинического применения лекарственного препарата могут быть получены только с использованием релевантной животной модели, а не наиболее доступной.
Вопрос о целесообразности использования собак в качестве второго вида в токсикологических исследованиях широко обсуждается. Существует точка зрения, что надежных данных, демонстрирующих необходимость использования собак для анализа безопасности лекарств, нет и можно двигаться в направлении сокращения использования собак в доклинических исследованиях без ущерба для безопасности человека.
Действительно, использование биглей и собак в целом для фундаментальных исследований и экспериментов, связанных с оценкой безопасности лекарственных препаратов, стало сокращаться в последние десятилетия из-за растущей озабоченности общественности благополучием животных.
Если исследования in vivo на собаках признаны необходимыми, при проведении доклинических исследований, в том числе токсикологических, особое внимание должно уделяться реализации принципов 3Rs, (сократить/оптимизировать/заменить, reduce/refine/replace), что предусматривает улучшение и оптимизацию проведения экспериментальных процедур с лабораторными животными. Снижение количества животных в эксперименте, избегание эвтаназии как конечной точки эксперимента — все это современные тенденции исследований на животных. Также особое внимание уделяется судьбе животных после завершения исследований. В настоящее время все более распространенной становится практика передачи лабораторных собак в частные руки.
Сведения о конфликте интересов
В.Г. Макаров является главным редактором журнала «Лабораторные животные для научных исследований». М.Н. Макарова является членом редакционной коллегии журнала «Лабораторные животные для научных исследований».
Вклад авторов
М.Н. Макарова — поиск, обобщение данных литературы, написание и редактирование текста рукописи.
В.Г. Макаров — критический пересмотр текста и одобрение окончательного варианта рукописи для публикации.
- Решение Совета ЕЭК от 03.11.16 № 78 О правилах регистрации и экспертизы лекарственных средств. [Reshenie Soveta EE’K ot 03.11.16 N. 78 O pravilax registracii i e’kspertizy’ lekarstvenny’x sredstv. (In Russ.)].
-
Решение Коллегии ЕЭК от 26.11.19 № 202 Об утверждении Руководства по доклиническим исследованиям безопасности в целях проведения клинических исследований и регистрации лекарственных препаратов. [Reshenie Kollegii EE’K ot 26.11.19 N. 202 Ob utverzhdenii Rukovodstva po doklinicheskim issledovaniyam bezopasnosti v celyax provedeniya klinicheskix issledovanij i registracii lekarstvenny’x preparatov. (In Russ.)].
- Там же.
-
ГОСТ Р 56700–2015 Лекарственные средства для медицинского применения. Доклинические фармакологические исследования безопасности. [GOST R 56700–2015 Lekarstvenny’e sredstva dlya medicinskogo primeneniya. Doklinicheskie farmakologicheskie issledovaniya bezopasnosti. (In Russ.)].
-
ICH S7A Safety Pharmacology studies for human pharmaceuticals.
- ISH S7B The non-clinical evaluation of the potential for delayed ventricular repolarization (QT interval prolongation) by human pharmaceuticals.
-
ГОСТ Р 57146–2016 Лекарственные средства для медицинского применения. Изучение канцерогенности лекарственных средств и вспомогательных веществ. [GOST R 57146–2016 Lekarstvenny’e sredstva dlya medicinskogo primeneniya. Izuchenie kancerogennosti lekarstvenny’x sredstv i vspomogatel’ny’x veshhestv. (In Russ.)].
- ICH S1A Guideline on the need for carcinogenicity studies of pharmaceuticals.
-
Решение Коллегии ЕЭК от 26.11.19 № 202 Об утверждении Руководства по доклиническим исследованиям безопасности в целях проведения клинических исследований и регистрации лекарственных препаратов. [Reshenie Kollegii EE’K ot 26.11.19 N. 202 Ob utverzhdenii Rukovodstva po doklinicheskim issledovaniyam bezopasnosti v celyax provedeniya klinicheskix issledovanij i registracii lekarstvenny’x preparatov. (In Russ.)].
- Там же.
- OECD G UIDELINE FOR THE TESTING OF CHEMICALS 409 Repeated Dose 90-day Oral Toxicity Study in Non-Rodents.
-
Рекомендация Коллегии ЕЭК № 10 от 21 мая 2020 г. О руководстве по проведению доклинических исследований токсичности при повторном (многократном) введении действующих веществ лекарственных препаратов для медицинского применения. [Rekomendaciya Kollegii EE’K N. 10 ot 21 maya 2020 g. O rukovodstve po provedeniyu doklinicheskix issledovanij toksichnosti pri povtornom (mnogokratnom) vvedenii dejstvuyushhix veshhestv lekarstvenny’x preparatov dlya medicinskogo primeneniya. (In Russ.)].
- ICH S8 Immunotoxicity studies for human pharmaceuticals.
Список источников
-
Gad S.C. (ed.). Animal models in toxicology. CRC Press, 2007. 933 р.
-
Schulte E., Arlt S.P. What Kinds of Dogs Are Used in Clinical and Experimental Research? // Animals (Basel). 2022. Vol. 12. N. 12. P. 1487. DOI: 10.3390/ani12121487.
-
Hytönen M.K., Lohi H. Canine models of human rare disorders // Rare Dis. 2016. Vol. 28. N. 4 (1). P. e1241362. DOI: 10.1080/21675511.2016.1241362.
-
Ending the Use of Dogs in Research (humanesociety.org). URL: https://www.humanesociety.org/sites/default/files/docs/Ending%20the%20Use%20of%20Dogs%20in%20Research_1.pdf. (Дата обращения: 04.2023).
-
Bailey J., Thew M., Balls M. An analysis of the use of dogs in predicting human toxicology and drug safety // Altern. Lab. Anim. 2013. Vol. 41. N. 5. P. 335–350. DOI: 10.1177/026119291304100504.
-
Correard S., Plassais J., Lagoutte L. et al. Canine neuropathies: powerful spontaneous models for human hereditary sensory neuropathies // Hum. Genet. 2019. Vol. 138. N. 5. P. 455–466. DOI: 10.1007/s00439-019-02003-x.
-
Nghiem P.P., Kornegay J.N. Gene therapies in canine models for Duchenne muscular dystrophy // Hum. Genet. 2019. Vol. 138. N. 5. P. 483–489. DOI: 10.1007/s00439-019-01976-z.
-
Chen Z.Y., Zhang Y. Animal models of Alzheimer’s disease: Applications, evaluation, and perspectives // Zool Res. 2022. Vol. 43. N. 6. P. 1026–1040. DOI: 10.24272/j.issn.2095-8137.2022.289.
-
Head E. A canine model of human aging and Alzheimer’s disease // Biochim Biophys. Acta. 2013. Vol. 1832. N. 9. P. 1384–1389. DOI: 10.1016/j.bbadis.2013.03.016.
-
Ruple A., MacLean E., Snyder-Mackler N. et al. Dog Models of Aging // Annu Rev. Anim. Biosci. 2022. Vol. 15. N. 10. P. 419–439. DOI: 10.1146/annurev-animal-051021-080937.
-
Beck J., Ren L., Huang S., Berger E. et al. Canine and murine models of osteosarcoma // Vet. Pathol. 2022. Vol. 59. N. 3. P. 399–414. DOI: 10.1177/03009858221083038.
-
Prouteau A., André C. Canine Melanomas as Models for Human Melanomas: Clinical, Histological, and Genetic Comparison // Genes (Basel). 2019. Vol. 10. N. 7. P. 501. DOI: 10.3390/genes10070501.
-
Finco D.R., Brown S.A., Brown C.A. et al. Progression of chronic renal disease in the dog // J. Vet. Intern. Med. 1999. Vol. 13. N. 6. P. 516–528. DOI: 10.1892/0891-6640(1999)013<0516:pocrdi>2.3.co;2.
-
Atchaneeyasakul K., Guada L., Ramdas K. et al. Large animal canine endovascular ischemic stroke models: A review // Brain Res. Bull. 2016. Vol. 127. P. 134–140. DOI: 10.1016/j.brainresbull.2016.07.006.
-
Sebbag L., Mochel J.P. An eye on the dog as the scientist’s best friend for translational research in ophthalmology: Focus on the ocular surface // Med. Res. Rev. 2020. Vol. 40. N. 6. P. 2566–2604. DOI: 10.1002/med.21716.
-
Irwin S. Comprehensive observational assessment: Ia. A systematic, quantitative procedure for assessing the behavioral and physiologic state of the mouse // Psychopharmacologia. 1968. Vol. 13. N. 3. P. 222–257. DOI: 10.1007/BF00401402.
-
Mathiasen J.R., Moser V.C. The Irwin Test and Functional Observational Battery (FOB) for Assessing the Effects of Compounds on Behavior, Physiology, and Safety Pharmacology in Rodents // Curr. Protoc. Pharmacol. 2018. Vol. 83. N. 1. P. e43. DOI: 10.1002/cpph.43.
-
Макарова М.Н., Макаров В.Г., Шекунова Е.В. Методические подходы к оценке нейротоксичности фармакологических веществ. Ведомости научного центра экспертизы средств медицинского применения // 2017. Т. 7. № 2. С. 111–116. [Makarova M.N., Makarov V.G., Shekunova E.V. Metodicheskie podhody k ocenke neirotosichnosti farmakologicheskih veshestv // Vedomosti Nauchnogo tsentra ekspertizy sredstv meditsinskogo primeneniya. 2017. Vol. 7. N. 2. P. 111–116. (In Russ.)].
-
Dennis S.G., Wotton P. R., Bоswood A., Flaherty D. Comparison of the effects of thiopentone and propofol on the electrocardiogram of dogs // The Veterinary Record. 2007 URL: http://veterinaryrecord.bmj.com/. (Дата обращения: 04.2023). DOI: 10.1136/vr.160.20.681.
-
Луговик И.А., Шекунова Е.В. Оценка использования различных формул коррекции интервала QT (QTc) и референтные интервалы ЭКГ у наркотизированных собак породы бигль // Лабораторные животные для научных исследований. 2022. № 2. [Lugovik I.A., Shekunova E.V. Ocenka ispolzovaniya razlichnyh formul korrekcii intervala QT (QTc) i referentnye intervali ECG u narkotizirovannih sobak porody bigl // Laboratornye zhivotnye dlya nauchnyh issledovanij. 2022. N. 2. DOI: 10.29296/2618723X-2022-02-04 (In Russ.)].
-
Agudelo C.F., Scheer P., Tomenendalova J. How to approach the QT interval in dogs — state of the heart: a review // Veterinarni Medicina. 2011. Vol. 56. N. 1. P. 14–21.
-
Authier S., Legaspi M., Gauvin D. et al. Validation of respiratory safety pharmacology models: conscious and anesthetized beagle dogs // J. Pharmacol. Toxicol. Methods. 2008. Vol. 57. N. 1. P. 52–60. DOI: 10.1016/j.vascn.2007.08.001.
-
Tibbitts J. Issues related to the use of canines in toxicologic pathology-issues with pharmacokinetics and metabolism // Toxicol. Pathol. 2003. Vol. 31. Suppl. 17–24. DOI: 10.1080/01926230390174896.
-
Chiou W.L., Jeong H.Y., Chung S.M., Wu T.C. Evaluation of using dog as an animal model to study the fraction of oral dose absorbed of 43 drugs in humans // Pharm. Res. 2000. Vol. 17. P. 135–140.
-
Hasiwa N., Bailey J., Clausing P. et al. Critical evaluation of the use of dogs in biomedical research and testing in Europe // ALTEX. 2011. Vol. 28. N. 4. P. 326–340. DOI: 10.14573/altex.2011.4.326.
-
Olson H., Betton G., Robinson D. et al. Concordance of the toxicity of pharmaceuticals in humans and in animals // Regul Toxicol Pharmacol. 2000. Vol. 32. N. 1. P. 56–67. DOI: 10.1006/rtph.2000.1399.
-
Broadhead C.L., Betton G., Combes R. et al. Prospects for reducing and refining the use of dogs in the regulatory toxicity testing of pharmaceuticals // Hum. Exp. Toxicol. 2000. Vol. 19. N. 8. P. 440–447. DOI: 10.1191/096032700682694242.
-
Bower N., Achanzar W.E., Boulifard V. et al. The Dog as a Second Species for Toxicology Testing Provides Value to Drug Development // Int. J. Toxicol. 2022. Vol. 41. N. 6. P. 431–441. DOI: 10.1177/10915818221125670.
-
Рыбакова А.В., Макарова М.Н., Кухаренко А.Е. и др. Существующие требования и подходы к дозированию лекарственных средств лабораторным животным // Ведомости Научного центра экспертизы средств медицинского применения. 2018. Т. 8. № 4. С. 207–217. [Rybakova A.V, Makarova M.N., Kukharenko A.E. i dr. Sushestvuyushie trebovaniya i podhody k dosirovaniyu lekarstvennih sredstv laboratornym zhivotnim // Vedomosti Nauchnogo tsentra ekspertizy sredstv meditsinskogo primeneniya. 2018. Vol. 8. N. 4. P. 207–217. (In Russ.)]. DOI: 10.30895/1991-2919-2018-8-4-207-217.
-
Acceptable Volumes for Drug Administration UCDAVIS. Office of research. URL: https://research.ucdavis.edu/policiescompliance/animal-care-use/iacuc/acceptable-volumes-for-drug-administration/. (Дата обращения: 04.2023).
-
Substance Administration — Recommended Volumes (Informational Sheet) URL: https://animal.research.uiowa.edu/oar-informational-sheet-recommended-volumes-administered-substances. (Дата обращения: 04.2023).
-
Washington State University Institutional Animal Care and Use Committee Guideline 10: Drug and Chemical Administration. URL: https://iacuc.wsu.edu/documents/2018/09/guidelines-for-drug-and-chemical-administration.pdf. (Дата обращения: 04.2023).
-
Morton D.B., Jennings M., Buckwell A. et al. Joint Working Group on Refinement. Refining procedures for the administration of substances. Report of the BVAAWF/FRAME/RSPCA/UFAW Joint Working Group on Refinement. British Veterinary Association Animal Welfare Foundation/Fund for the Replacement of Animals in Medical Experiments/Royal Society for the Prevention of Cruelty to Animals/Universities Federation for Animal Welfare // Lab. Anim. 2001. Vol. 35. N. 1. P. 1–41. DOI: 10.1258/0023677011911345.
-
Turner P.V., Brabb T., Pekow C., Vasbinder M.A. Administration of substances to laboratory animals: routes of administration and factors to consider // J. Am. Assoc. Lab. Anim. Sci. 2011. Vol. 50. N. 5. P. 600–613.
-
Kuiper B., Boevé M.H., Jansen T. et al. Ophthalmologic examination in systemic toxicity studies: an overview // Lab. Anim. 1997. Vol. 31. N. 2. P. 177–183. DOI: 10.1258/002367797780600206.
-
Sebbag L., Mochel J.P. An eye on the dog as the scientist’s best friend for translational research in ophthalmology: Focus on the ocular surface // Med. Res. Rev. 2020. Vol. 40. N. 6. P. 2566–2604. DOI: 10.1002/med.21716.
-
Yadav S.N., Ahmed N., Nath A.J. et al. Urinalysis in dog and cat: A review. Vet World. 2020. Vol. 13. N. 10. P. 2133–2141. DOI: 10.14202/vetworld.2020.2133-2141.
-
Williams J. Surgical Biopsy Techniques. World Small Animal Veterinary Association World Congress Proceedings. 2014. URL: https://www.vin.com/apputil/content/defaultadv1.aspx?pId=12886&catId=57132&id=7054729. (Дата обращения: 04.2023).
-
Smith D., Combes R., Depelchin O. et al. Optimising the design of preliminary toxicity studies for pharmaceutical safety testing in the dog // Regul. Toxicol. Pharmacol. 2005. Vol. 41. N. 2. P. 95–101. DOI: 10.1016/j.yrtph.2004.10.006.
- Phillips B., Smith D., Combes R. et al. An approach to minimise dog use in regulatory toxicology: production of a best practice guide to study design // Altern. Lab. Anim. 2004. Vol. 32. Suppl. 1B. P. 447–451. DOI: 10.1177/026119290403201s72.



