Рискориентированный подход к мониторингу здоровья лабораторных кроликов
Работа выполнена без спонсорской поддержки.
Бондарева Е.Д., Макарова М.Н., Акимов Д.Ю., Пастухова А.В., Дурнева А.А., Челахова С.А. Рискориентированный подход к мониторингу здоровья лабораторных кроликов. Лабораторные животные для научных исследований. 2023; 3. https://doi.org/10.57034/2618723X-2023-03-01
Резюме
Кролики считаются классическими лабораторными животными и широко используются во множестве разных исследований. Лабораторные кролики применяются и как самостоятельные тест-системы, и как дополнительные (дублирующие) при проведении исследований на других мелких грызунах. Последние несколько лет лабораторные кролики занимают 3-е место среди млекопитающих лабораторных животных по количеству использования для исследований и испытаний в научных и образовательных целях после крыс и мышей1. Тест-система должна соответствовать требованиям, для чего необходимо создать для животных условия содержания, кормления и поения, отвечающие их потребностям, а также осуществлять контроль их микробиологического статуса и обеспечить тщательный ветеринарный уход. Первый вопрос, который возникает при планировании программы мониторинга здоровья лабораторных кроликов, касается перечня патогенов для данных животных. В связи с отсутствием рекомендуемого перечня для лабораторных животных, находящихся в России, испытательным центрам приходится ориентироваться на международные рекомендации (в частности, FELASA), которые составлены с учетом особенностей разных регионов Европы и не включают данные по инфекционным болезням в России. Вместе с тем авторы рекомендаций FELASA отмечают необходимость учитывать эпидемиологические и эпизоотологические характеристики каждого из регионов в зависимости от географического расположения. При обосновании перечня контролируемых патогенов для лабораторных кроликов мы применили рискориентированный подход. Для оценки рисков использовали метод FMEA/FMECA (Failure Mode Effect Analysis/Failure Mode Effect Criticality Analysis, анализ видов и последствий потенциальных несоответствий). В настоящей статье рассмотрен перечень патогенных микроорганизмов, имеющих практическое значение при использовании лабораторных кроликов в научных исследованиях на территории России. Полученные результаты могут быть применены в качестве рекомендуемых при проведении мониторинга здоровья лабораторных кроликов.
Введение
Кролики считаются классическими лабораторными животными и широко используются в производстве антител, токсикологических и офтальмологических исследованиях, моделировании атеросклероза и многих сердечно-сосудистых заболеваний. Уникально использование кроликов для проверки пирогенности парентеральных средств благодаря их высокой чувствительности к пирогенам, часто кроликов применяют в качестве обязательного второго вида в сопровождении исследований на мышах и крысах. Немаловажной является возможность использования кроликов для исследования вакцин, сывороток, а также в экспериментальной хирургии [1–3].
Как и любая другая биологическая модель, кролики должны обладать определенными свойствами и отвечать всем требованиям, необходимым для проведения качественного эксперимента, при этом свойства лабораторных кроликов в качестве биомодели не должны оказывать влияние на результаты исследований. Искажение результатов исследований может быть спровоцировано чрезмерным стрессом, болью, инфекционными заболеваниями и др. Для исключения нежелательных факторов лабораторных кроликов содержат при определенных условиях, при которых удовлетворяются естественные нужды животных. Говоря об инфекционных заболеваниях, различные вирусы, бактерии, грибковые и паразитарные агенты, носителями которых являются кролики, могут не представлять опасности как для самого животного, так и для экспериментальных данных, однако есть и агенты, способные изменять физиологию хозяина, делая его непригодным для использования в качестве биомодели.
Если лабораторные животные с рождения находятся в одном экспериментальном центре, контролировать их микробиологический статус гораздо проще, но в большинстве случаев кроликов закупают в специализированных питомниках, что подразумевает транспортировку животных, смену среды обитания, подвергание их стрессу, что может стимулировать развитие заболеваний, а также требует высокой компетентности специалистов экспериментального центра для бережного восстановления животных в период адаптации, карантинирования и определения их качества как биомодели [4].
Микробиологический контроль качества животных является одним из наиболее важных факторов, который необходимо учитывать при использовании лабораторных животных. В настоящее время мониторингу здоровья лабораторных животных (МЗЖ) уделяется большое внимание, а лабораторные исследования микробиологического статуса животных в рамках МЗЖ являются практически обязательными. Сейчас уже не возникает вопрос, проводить мониторинг здоровья животных или нет, самым актуальным при этом в настоящее время является вопрос об определении перечня контролируемых патогенов. Необходимо определить, на какие патогены существует острая необходимость контроля животных, а какие не будут являться значимыми. Федерация европейских научных ассоциаций по лабораторным животным (FELASA, англ. Federation of European Laboratory Animals Science Associations) одной из первых предложила список наиболее опасных патогенов для разных видов лабораторных животных и указала периодичность их контроля. Однако сама FELASA отмечает необходимость учитывать эпидемиологические и эпизоотологические характеристики каждого из регионов в зависимости от географического расположения [5].
Для обоснования перечня контролируемых патогенов, на наш взгляд, хорошо подходит система оценки рисков. Например, метод FMEA/FMECA (Failure Mode Effect Analysis/Failure Mode Effect Criticality Analysis) — анализ видов и последствий потенциальных несоответствий. Метод позволяет оценить риски на самых ранних стадиях планирования.
Материал и методы
Система управления рисками состоит из нескольких следующих этапов: идентификация риска, анализ и оценка риска, принятие решения по риску, информирование и мониторинг. При анализе риска определяют уровень риска, вероятность его возникновения, масштаб воздействия, причины и последствия. При этом оценивают, является ли риск приемлемым или недопустимым.
Рискориентированный подход для определения патогенных микроорганизмов при проведении оценки здоровья лабораторных кроликов выполнен на базе АО «НПО «ДОМ ФАРМАЦИИ».
Для анализа риска составляли список потенциальных болезней кроликов на территории преимущественно Северо-Западного региона и на территориях разной удаленности от него, определяли пути передачи патогенов, клиническую картину заболеваний и другие показатели риска.
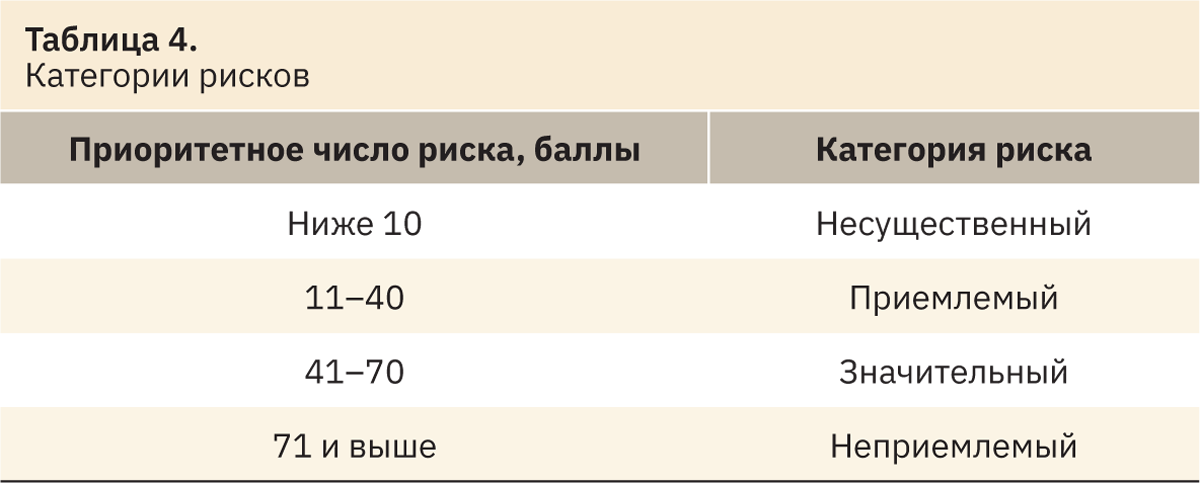
Риск оценивали по произведению трех составляющих — S (тяжесть вреда последствий) (табл. 1), O (вероятность возникновения опасности), D (вероятность выявления опасности). Результат произведения — приоритетное число риска (ПЧР=S×O×D), по которому оценивается его категория.

Каждой составляющей присваивался один из пяти вариантов значимости и соответствующий балл (от 1 до 5). Если значимость определялась двумя показателями, то каждому показателю присваивались баллы, поделенные на 2. Например, при определении вероятности возникновения опасности значимость состояла из показателей «распространенность» и «механизм передачи». Если заболевание регистрировалось в России, присваивалось 2,5 балла, наличие респираторного механизма передачи заболевания также оценивалось в 2,5 балла, сумма баллов по составляющей риска О=5, значимость «катастрофическая».
Показатель вероятности возникновения опасности (O) складывается из суммы баллов по распространенности заболевания и пути передачи (табл. 2). В случае нескольких вариантов пути передачи балл присваивается, исходя из наиболее контагиозного.
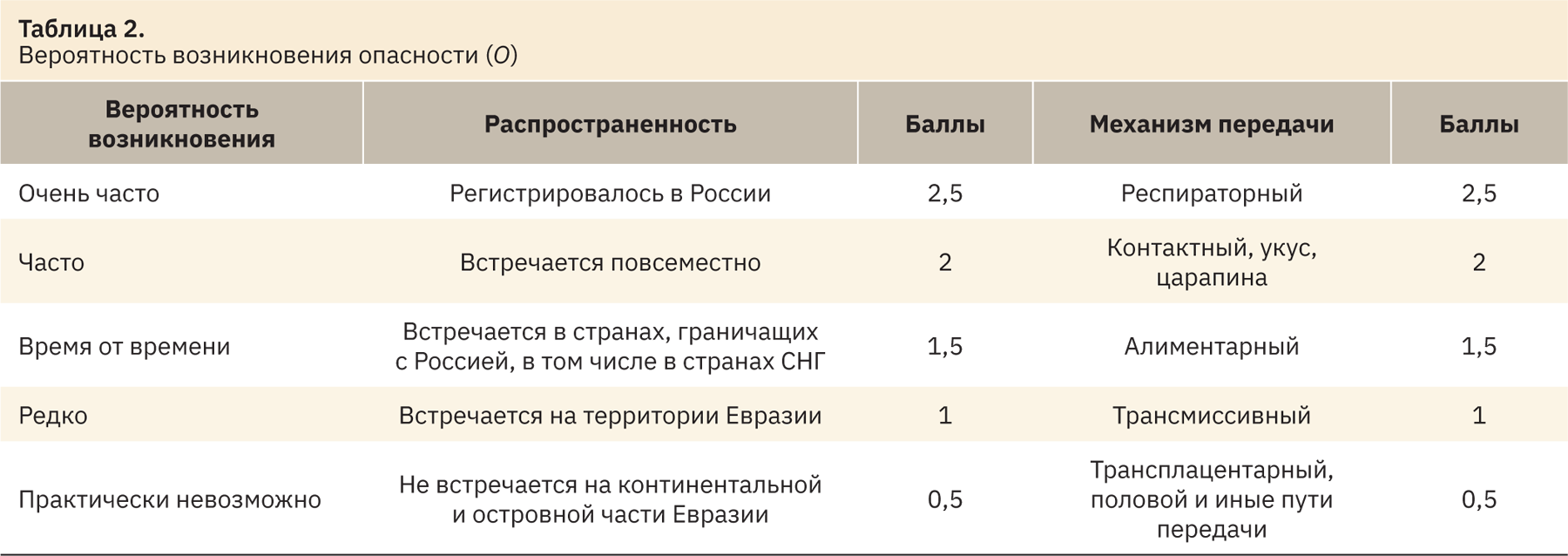
Показатель вероятности выявления опасности (D) включает сумму баллов, определенную по клинической картине и инкубационному периоду (табл. 3).
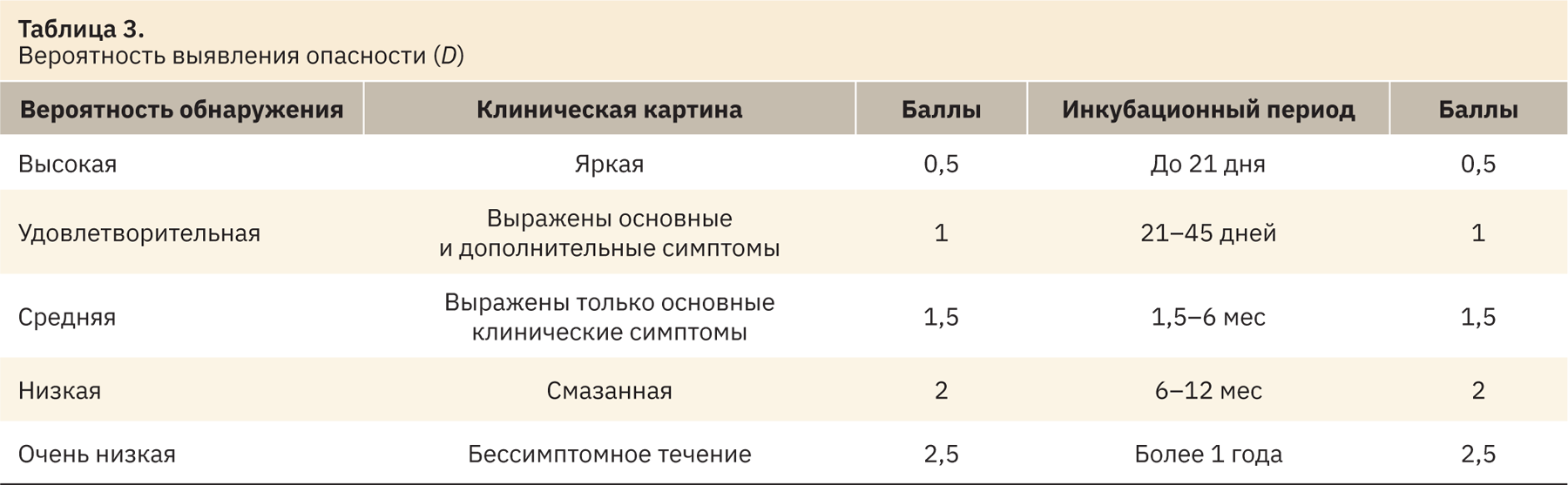
Приоритетное число риска (ПЧР) оценивали по табл. 4.
Результаты и обсуждение
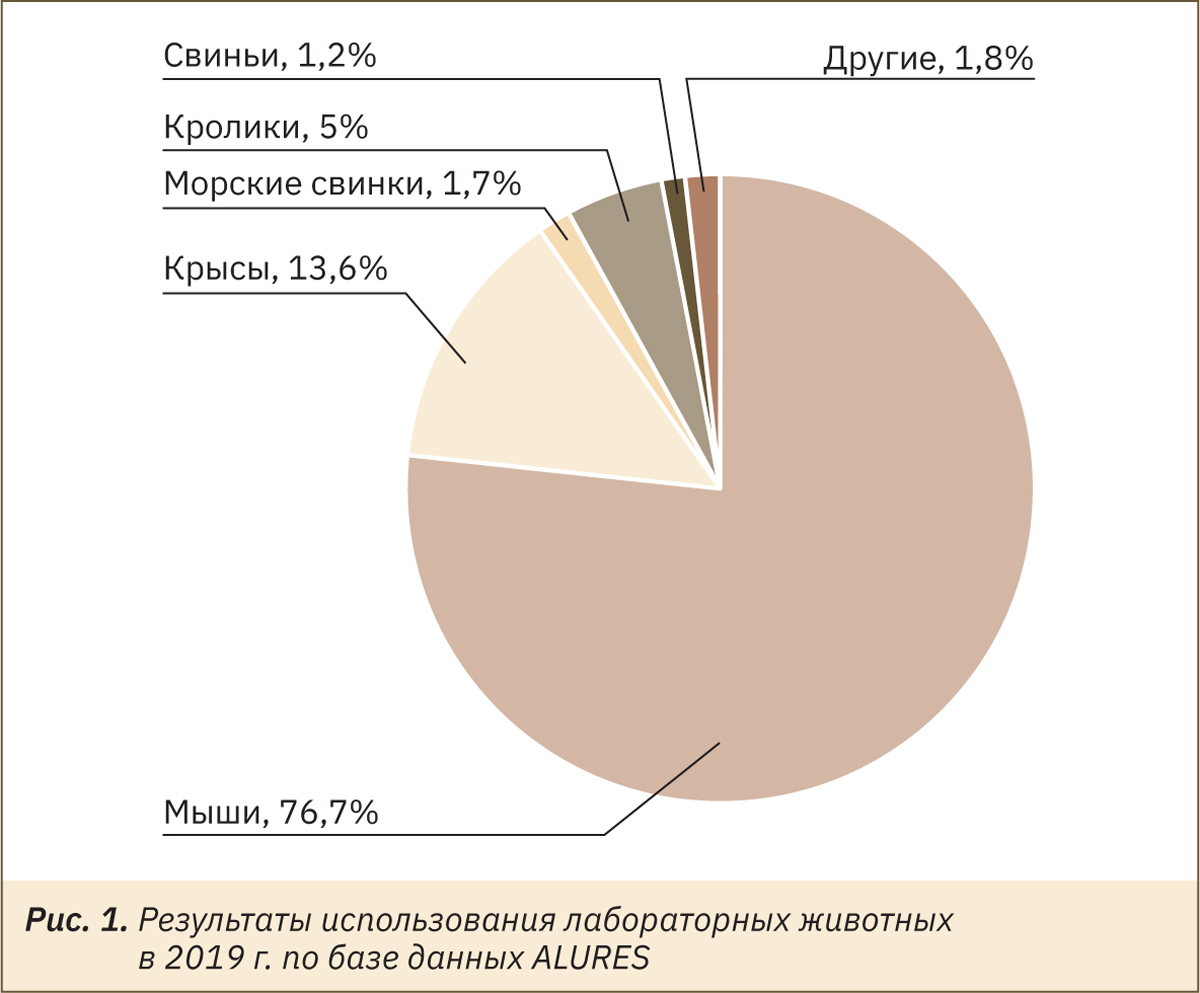
Согласно статистическим данным базы данных ЕС по использованию животных в научных целях2, в 2019 г. лабораторные кролики заняли 3‑е место среди млекопитающих лабораторных животных по количеству использованных особей для исследований и испытаний, в научных и образовательных целях на территории стран ЕС-28 и Норвегии (рис. 1).
Известно, что в большинстве лабораторий не воспроизводят, а покупают различные породы кроликов у специализированных поставщиков и, несмотря на то что улучшение условий содержания животных проводится непрерывно, классическим режимом содержания в настоящее время является индивидуальное, в небольших клетках, что вызывает ряд проблем со здоровьем кроликов [6]. Все эти факторы обосновывают необходимость включения в программу МЗЖ довольно обширного перечня патогенов.
При интерпретации микробиологического статуса лабораторных животных важно помнить, что существование различных инфекционных агентов не указывает на наличие болезни. Обнаружение инфекционных агентов в ходе лабораторных исследований означает их присутствие, микробиологические агенты могут быть патогенными или условно-патогенными, находиться в микрофлоре хозяина в норме и не оказывать влияния на организм [7].
В табл. 5 представлены международные рекомендации и требования законодательства РФ по проведению лабораторных исследований на кроликах, а также данные о зарегистрированных заболеваниях кроликов на территории РФ за последнее время.

При сравнении рекомендаций FELASA и выявленных заболеваний на территории РФ были установлены различия по некоторым показателям. Ряд заболеваний, установленных у кроликов в различных хозяйствах, не включен в перечень FELASA, и, наоборот, некоторые показатели никогда не выявляли. В Решении комиссии Таможенного союза № 830 представлены требования к территориям содержания кроликов. Среди этого перечня Francisella tularensis (туляремия) и Listeria spp. (листериоз) в рекомендациях FELASA отсутствуют, вместе с тем на территории РФ периодически встречаются локальные энзоотические вспышки туляремии, но не листериоза.
Часть показателей из сведений о заболеваниях на территории РФ являются условно-патогенными (на основании чего предположительно отсутствуют в рекомендациях FELASA) и могут составлять нормальную микрофлору кроликов, однако при наличии провоцирующих факторов все же возможно развитие инфекций.
Среди показателей, не включенных в состав рекомендуемого перечня FELASA, но имеющих значение на территории России, были обнаружены следующие: Streptococcus spp., Pseudomonas aeruginosa, Francisella tularensis, Rabies Lyssavirus. Целесообразность включения данных показателей в программу мониторинга лабораторных кроликов зависит от частоты их встречаемости, тяжести заболевания и некоторых других факторов, которые могут быть учтены при проведении оценки рисков.
Streptococcus spp. встречается повсеместно, является условно-патогенной флорой, но вместе с тем представляет опасность и для людей с ослабленным иммунитетом [8]. Инфицирование Pseudomonas aeruginosa опасно для людей, в животноводческих хозяйствах вызывает быструю гибель поголовья, встречается довольно часто в разных регионах России (в 2015, 2018 и 2021 гг.). В первую очередь P. aeruginosa представляет собой условно-патогенную микрофлору и может встречаться в качестве нормальной микрофлоры в носоглотке, ротоглотке и нижних отделах пищеварительного тракта многих видов позвоночных. У животных с ослабленным иммунитетом может размножаться и вызывать псевдомоноз. Основным симптомом заболевания является резкое повышение температуры тела при отсутствии других признаков. Больные кролики быстро погибают3 [9, 10].
Francisella tularensis — грамотрицательная коккобацилла, вызывающая туляремию у широкого круга млекопитающих-хозяев, включая кроликов и людей. Инфекция больше распространена среди диких кроликов, но редко встречается у лабораторных кроликов, так как чаще всего передача происходит членистоногими переносчиками. Однако при закупке лабораторных кроликов у заводчиков, где условия содержания могут включать содержание на открытом воздухе, не стоит исключать данный патоген из перечня контролируемых для лабораторных животных [10].
Одним из наиболее часто встречаемых на территории РФ заболеваний сельскохозяйственных животных является бешенство, возбудитель которого (Rabies Lyssavirus) в перечне FELASA не присутствует. Территориально бешенство было зарегистрировано более чем в 30 областях России уже в 2023 г.4 Известны 2 формы протекания заболевания: буйная и тихая. Первая, начальная, стадия длится от 12 ч до 3 дней, сопровождается повышенной температурой, животное быстро погибает. Тихая форма связана с чрезмерной тактильностью животного в первую стадию. Кролик лижет сородичей и человека. Дальнейшее развитие болезни не отличается от буйной формы.
В списке патогенов, предложенных FELASA, также есть показатели, которые не были зафиксированы у кроликов на территории РФ, среди них Rabbit rotavirus, Adenovirus, Coronavirus, Bordetella bronchiseptica, реснично-ассоциированная респираторная палочка (Cilia-associated respiratory bacillus), Pneumocystis oryctolagi, Treponema paraluiscuniculi.
Изолят ротавируса, поражающего кроликов, (серотип 3 группы А) также заражает людей и других животных. Инфекция распространена как у диких, так и лабораторных кроликов. Вирус чрезвычайно заразен, при этом передача происходит алиментарным путем. Клинические признаки варьируют в зависимости от возраста хозяина, истории воздействия и присутствия других инфекционных агентов. Следует отметить, что в большинстве случаев чистые ротавирусные инфекции протекают в легкой форме, более опасные формы заболевания сопровождаются усугублением инфекции другими агентами, например, Escherichia coli, в результате чего развивается более тяжелая диарея [10]. Это предположительно и являлось отсутствием официальных записей о вспышках ротавируса среди кроликов в РФ.
Аденовирусные инфекции у кроликов встречаются редко, о них сообщалось только в Европе [10], в связи с чем присутствие данного патогена в рекомендациях FELASA целесообразно, однако он не представляют особого интереса для контроля у животных, разводимых на территории РФ. В то же время Myxomatosis virus, представленный в FELASA, но обозначенный как необязательный, для лабораторных кроликов, выращенных на территории России, имеет высокое значение, так как встречается нередко, а тяжесть заболевания чаще всего критическая. Myxomatosis virus поражает невакцинированное поголовье кроликов. Болезнь протекает сверхостро, остро, подостро и хронически. Сверхострое и острое течение быстро охватывает 95–100% поголовья кроликов. При сверхостром течении происходит внезапная гибель кроликов на 2–3‑и сутки после заражения. Острое течение характеризуется появлением студенистых отеков на теле (классическая форма). Болезнь обычно заканчивается летальным исходом. Чаще всего встречается у молодых особей. Смертность в этом случае составляет 50–70%, а сама болезнь длится от 30 до 40 дней [11, 12].
Данные о Coronavirus у кроликов на территории РФ также не найдены.
Bordetella bronchiseptica вызывает заболевания дыхательных путей, быстро распространяется среди кроликов, инфекция часто является персистирующей. Бактерия считается условно-патогенным микроорганизмом, который может провоцировать клиническое заболевание. B. bronchiseptica была обнаружена в Японии, Китае, Западной Европе и других странах. В РФ в связи с недостаточностью изучения и условно-патогенной категорией, заболевания кроликов, вызванные данным патогеном, зафиксированы не были [13–16]. Однако с учетом имеющейся практики завоза кроликов в РФ из хозяйств других стран существует большая вероятность наличия данного патогена и на территории России.
Реснично-ассоциированная респираторная палочка (Cilia-associated respiratory bacillus) также является возбудителем респираторных заболеваний, но распространенность патогена среди кроликов недостаточно изучена.
Pneumocystis — является условно-патогенным агентом, поражающим ткани легких у широкого спектра видов млекопитающих, преимущественно проявляется в виде атипичной пневмонии. Распространен в Африке, наиболее восприимчивы животные с ослабленным иммунитетом [17–20].
Treponema paraluiscuniculi время от времени встречается в странах Европы, в 2011 г. было зарегистрировано широкое распространение инфекции в Нидерландах [19, 20].
Что касается паразитарных агентов, в рекомендациях FELASA уточнений нет. В ходе изучения данных литературы на территории РФ обнаруживались различные виды паразитов, в основном встречающиеся у диких кроликов. У лабораторных животных рекомендуется проводить идентификацию паразитов до названия вида по возможности.
Поскольку цель исследования — определить четкие стандарты микробиологического статуса лабораторных кроликов при проведении мониторинга здоровья животных, необходимо уточнить уровни риска потенциальных исследуемых показателей. От этого будет зависеть и частота контроля.
В оценке рисков участвовали все потенциальные патогены по рекомендациям FELASA, в том числе не найденные на территории РФ, и в обязательном порядке патогены, зарегистрированные на территории РФ (табл. 6).

По результатам оценки выявили несколько патогенов, приоритетное число риска которых оказалось более 40, они были определены в категорию «значительный риск». Среди них 4 патогена, совпадающие с международными рекомендациями: вирус геморрагической болезни кроликов (ВГБК), Pasteurella multocida, Salmonella spp. и Clostridium piliforme.
При этом Francisella tularensis, Streptococcus spp., Giardia spp. в списке FELASA отсутствуют, а Staphylococcus aureus, Myxomatosis virus и Escherichia coli находятся в дополнительном списке необязательных агентов, однако для нашего региона все перечисленные патогены относятся к категории «значительного риска» и могут представлять угрозу для лабораторных животных, проживающих на территории России.
По полученным данным мы составили сводную таблицу по категориям риска и провели дополнительный итоговый анализ (табл. 7).
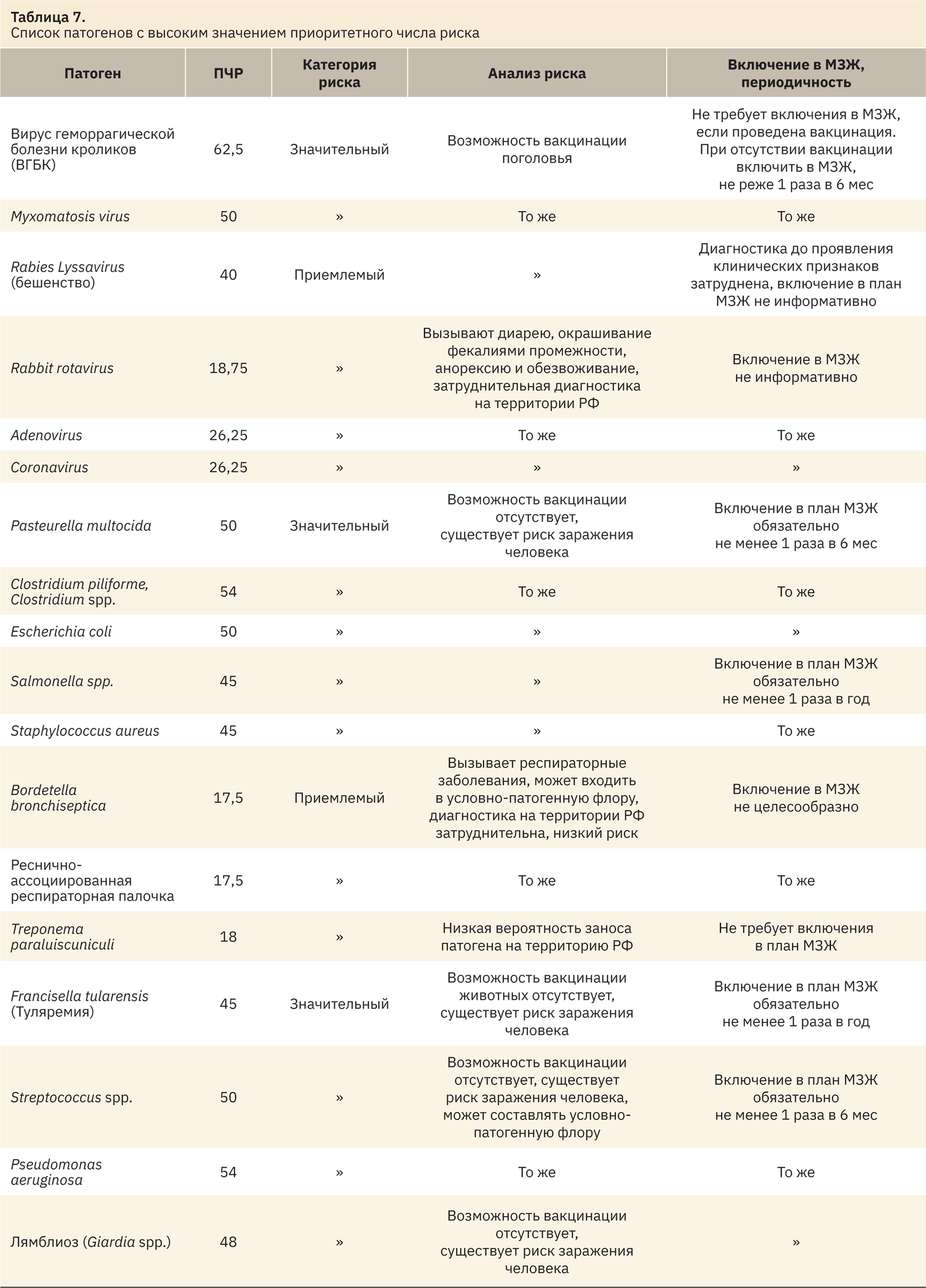
Проведя итоговый анализ рисков, выявили несколько патогенов, рекомендуемых к включению в план мониторинга здоровья кроликов. Перечень патогенов и периодичность контроля представлены в табл. 8.
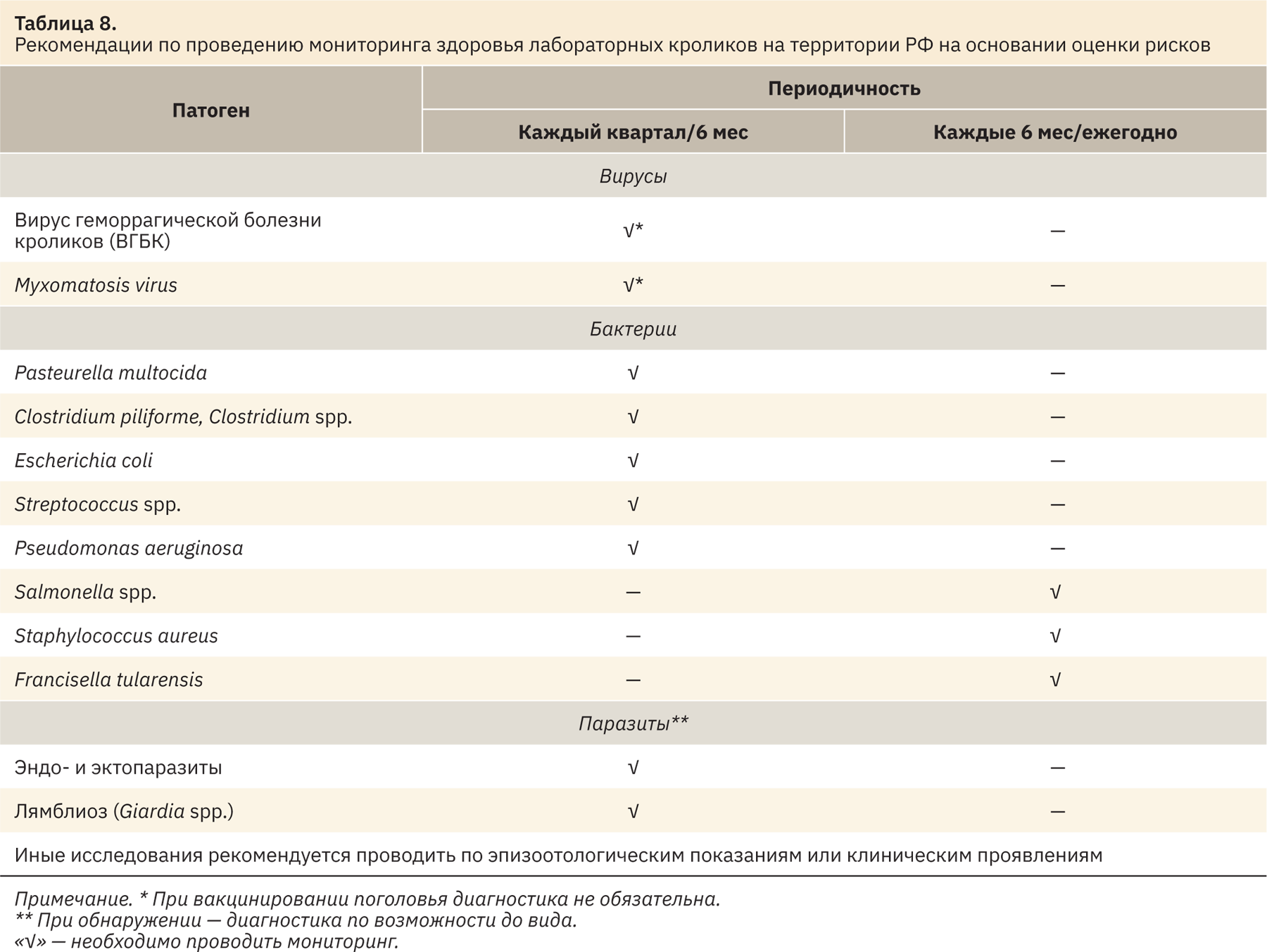
На основании проведенной оценки рисков был составлен перечень микроорганизмов для контроля статуса лабораторных кроликов, разводимых и используемых на территории России. Предлагаемый перечень не является исчерпывающим и может быть расширен на усмотрение ветеринарных врачей испытательных центров, работающих с лабораторными кроликами. Перечень может быть расширен на основании эпизоотологических показаний при наличии каких‑либо клинических проявлений, а также рекомендаций ветеринарных служб с учетом благополучия территории по инфекционным болезням сельскохозяйственных животных.
Заключение
Проведенная оценка рисков позволила подтвердить только часть перечня патогенов в международных рекомендациях, являющегося актуальным для лабораторных животных, выращиваемых и используемых на территории России, другая часть рекомендаций оказалась неактуальной для нашего региона. Патогены, не входящие в состав перечня FELASA, но имеющие важное значение, следует учитывать при проведении мониторинга здоровья кроликов, проживающих в РФ.
Определению перечня патогенов в значительной степени способствовало применение рискориентированного подхода. Предложенная система оценки рисков может быть применена для определения перечня патогенов для других видов и/или категорий лабораторных животных на разных территориях России, а также для лабораторных животных пребывающих из‑за рубежа.
Сведения о конфликте интересов
М.Н. Макарова является членом редакционной коллегии журнала «Лабораторные животные для научных исследований». Остальные авторы заявляют об отсутствии конфликта интересов, требующего раскрытия в данной статье.
Вклад авторов
Е.Д. Бондарева — дизайн, сбор и анализ данных, оценка рисков, написание статьи.
М.Н. Макарова — идея, редактирование статьи, утверждение окончательного варианта статьи для публикации.
Д.Ю. Акимов — редактирование статьи, проверка процедуры оценки рисков.
А.В. Пастухова — работа с литературными источниками, сбор и подготовка данных, обработка данных, оценка рисков.
А.А. Дурнева — работа с литературными источниками, сбор и подготовка данных.
С.А. Челахова — работа с литературными источниками, сбор и подготовка данных.
- https://webgate.ec.europa.eu/envdataportal/content/alures/section1_number-of-animals.html
- Там же.
- Федеральная служба по ветеринарному и фитосанитарному надзору: официальный сайт. Россия. URL: https://fsvps.gov.ru/fsvps-docs/ru/iac/operative-messages/2021-08-04.pdf.
- Федеральная служба по ветеринарному и фитосанитарному надзору: официальный сайт. Россия. URL: https://fsvps.gov.ru/ru/iac/rf/operative-messages.
Список источников
- Peng X., Knouse J.A., Hernon K.M. Rabbit models for studying human infectious diseases // Comparative medicine. 2015. Vol. 65. N. 6. P. 499–507.
-
Серая О.Ю. Животные модели в биомедицинских исследованиях. I. Кролики // Кролиководство и звероводство. 2019. № 4. С. 35–39. [Seraya O.Yu. Zhivotnye modeli v biomeditsinskikh issledovaniyakh. I. Kroliki // Krolikovodstvo i zverovodstvo. 2019. N. 4. P. 35–39. (In Russ.)].
-
Мохов Е.М., Кадыков В.А., Морозов А.М. и др. О возможности использования лабораторных животных в экспериментальной хирургии // Хирургическая практика. 2018. № 2. С. 33–38. [Mokhov E.M., Kadykov V.A., Morozov A.M. et al. O vozmozhnosti ispol’zovaniya laboratornykh zhivotnykh v eksperimental’noi khirurgii // Khirurgicheskaya praktika. 2018. N. 2. P. 33–38. (In Russ.)].
-
Добрянская С.С., Акимов Д.Ю., Акимова М.А. и др. Входной контроль лабораторных животных от аудита поставщика до передачи в эксперимент // Лабораторные животные для научных исследований. 2022. № 3. С. 30–39. [Dobryanskaya S.S., Akimov D.Yu, Akimova M.A. et al. Vkhodnoi kontrol’ laboratornykh zhivotnykh ot audita postavshchika do peredachi v eksperiment // Laboratornye zhivotnye dlya nauchnykh issledovanii. 2022. N. 3. P. 30–39. (In Russ.)].
-
Литвинова Е.А., Васютина М.Л., Макарова М.Н. и др. Мониторинг здоровья лабораторных животных // Консультант GLP-PLANET. Мнение фармацевтической отрасли. 2021. С. 109–112. [Litvinova E.A., Vasyutina M.L., Makarova M.N. at al. Monitoring zdorov’ya laboratornykh zhivotnykh // Konsul’tant GLP-PLANET. Mnenie farmatsevticheskoi otrasli. 2021. P. 109–112. (In Russ.)].
-
Lidfors L., Edström T., Lindberg L. The welfare of laboratory rabbits // The Welfare of Laboratory Animals. 2007. P. 211–243.
-
Baker D.G. Natural pathogens of laboratory mice, rats, and rabbits and their effects on research // Clinical microbiology reviews. 1998. Vol. 11. N. 2. P. 231–266.
-
Шевченко А.А., Черных О.Ю., Стрельников В.В. и др. Биологические особенности и болезни нутрий, кроликов. Краснодар: КубГАУ, 2008. [Shevchenko A.A., Chernykh O.Yu., Strel’nikov V.V. et al. Biologicheskie osobennosti i bolezni nutrii, krolikov. Krasnodar: KubGAU, 2008. (In Russ.)].
-
Леонтюк С.В., Малышева Л.А., Шаповалов А.В. Болезни кроликов. Москва: Колос, 1974. № 1. [Leontyuk S.V., Malysheva L.A., Shapovalov A.V. Bolezni krolikov. Moskva: Kolos, 1974. N. 1. (In Russ.)].
-
Baker D.G. Natural pathogens of laboratory mice, rats, and rabbits and their effects on research // Clinical microbiology reviews. 1998. Vol. 11. N. 2. P. 231–266.
-
Kerr P.J. Myxomatosis in Australia and Europe: a model for emerging infectious diseases // Antiviral research. 2012. Vol. 93. N. 3. P. 387–415.
-
Sumption K.J., Flowerdew J.R. The ecological effects of the decline in rabbits (Oryctolagus cuniculus L.) due to myxomatosis // Mammal Review. 1985. Vol. 15. N. 4. P. 151–186.
-
Kameyama H., Fujimoto Y., Tomioka Y. et al. Pathogenicity of Bordetella bronchiseptica isolated from apparently healthy rabbits in guinea pig, rat, and mouse // Journal of Veterinary Medical Science. 2022. Vol. 84. N. 4. P. 574–581.
-
Wang J., Sun S., Chen Y. et al. Characterisation of Bordetella bronchiseptica isolated from rabbits in Fujian, China // Epidemiology & Infection. 2020. N. 148. P. e237.
-
Никульшина Ю.Б., Сверкалова Д.Г., Никулина Е.Н. Разработка методов индикации и идентификации Bordetella bronchiseptica, выделенных у домашних животных // Ветеринарная патология. 2007. № 4. С. 103–106. [Nikul’shina Yu.B., Sverkalova D.G., Nikulina E.N. Razrabotka metodov indikatsii i identifikatsii Bordetella bronchiseptica, vydelennykh u domashnikh zhivotnykh // Veterinarnaya patologiya. 2007. N. 4. P. 103–106. (In Russ.)].
-
Boot R. et al. An enzymelinked immunosorbent assay (ELISA) for monitoring guineapigs and rabbits for Bordetella bronchiseptica antibodies // Laboratory Animals. 1993. Vol. 27. N. 4. P. 342–349.
-
FELASA Working Group on Revision of Guidelines for Health Monitoring of Rodents and Rabbits et al. FELASA recommendations for the health monitoring of mouse, rat, hamster, guinea pig and rabbit colonies in breeding and experimental units // Laboratory animals. 2014. Vol. 48. N. 3. P. 178–192.
-
Ceré N., Drouet-Viard F., Dei-Cas E. et al. In utero transmission of Pneumocystis carinii sp. f. oryctolagi // Parasite. 1997. Vol. 4. N. 4. P. 325–330.
-
Lumeij J.T. Widespread treponemal infections of hare populations (Lepus europaeus) in the Netherlands // European journal of wildlife research. 2011. Vol. 57. N. 1. P. 183–186.
- Verin R., Pestelli M., Poli A. Treponemal infection in free-ranging European brown hares (Lepus europaeus) in Central Italy: Serology and epidemiology // Journal of Wildlife Diseases. 2012. Vol. 48. N. 4. P. 1079–1082.



