Наркотизация в доклинических исследованиях. Сообщение 2: карликовые свиньи
Работа выполнена без спонсорской поддержки.
Акимов Д.Ю., Шабанов П.Д., Хан С.О. Наркотизация в доклинических исследованиях. Сообщение 2: карликовые свиньи. Лабораторные животные для научных исследований. 2023; 2. https://doi.org/10.57034/2618723X-2023-02-05
Резюме
Наркотизация карликовых свиней в зависимости от предполагаемой степени тяжести процедур является актуальным вопросом в доклинических исследованиях. Было проведено исследование влияния различных доз и комбинаций препаратов: Ксила® (ксилазина гидрохлорид, Эстония) и Золетил® (тилетамина гидрохлорид и золазепама гидрохлорид, Франция); Золетил® и Пропофол® (пропофол, Германия); Медитин® (медетомидина гидрохлорид, РФ) и Изофлуран® (Индия); Ксила® (Эстония) и Изофлуран®, Пропофол® (Германия) и Изофлуран® (Индия); Медитин® (РФ) на продолжительность анестезии, уровень глюкозы и физиологические показатели карликовых свиней. Было установлено, что для проведения процедур, характеризующихся легкой степенью продолжительности (до 20 мин), следует использовать комбинацию ксилазина гидрохлорида (0,1 мг/кг) в сочетании с тилетамина гидрохлоридом и золазепама гидрохлоридом (2 мг/кг). Для проведения процедур умеренной степени тяжести можно использовать комбинации ксилазина гидрохлорида (1 мг/кг) и тилетамина гидрохлорида с золазепама гидрохлоридом (6 мг/кг) при необходимости анестезиологического обеспечения около 1 ч; если достаточно 40-минутной анестезии, можно использовать медетомидина гидрохлорид (100 мкг) + изофлуран (4,5:1,0 об.%); ксилазина гидрохлорид (5 мг/кг) + изофлуран (4,5:1,0 об.%); при 30-минутной анестезии — ксилазина гидрохлорид (5 мг/кг) + изофлуран (4,5:1,0 об.%). В случае анестезиологического обеспечения процедур, характеризующихся как тяжелые или «без выхода из наркоза», применимы комбинация ксилазина гидрохлорида (22 мг/кг) и тилетамина гидрохлорида в сочетани с золазепамом гидрохлоридом (8,8 мг/кг), продолжительность анестезии до 84 мин; а также медетомидина гидрохлорид (100 мкг) + изофлуран (4,5:1,5 об.%), продолжительность действия до 40 мин; ксилазина гидрохлорид (8 мг/кг) + изофлуран (4,5:1,5 об.%). Использование комбинации тилетамина гидрохлорида и золазепама гидрохлорида совместно с пропофолом, пропофола и изофлурана не рекомендовано или требует дополнительного изучения. Комбинация медетомидина гидрохлорида (100 мкг) и изофлурана (4,5:1,0 об.%) приводит к повышению уровня глюкозы у самцов карликовых свиней. В случае применения сочетания ксилазина гидрохлорида (8 мг/кг) и изофлурана (4,5:1,5 об.%) уровень глюкозы повышается как у самцов, так и у самок. Ксилазина гидрохлорид в сочетании с тилетамина гидрохлоридом и золазепама гидрохлоридом в зависимости от дозы приводит к уменьшению сатурации, увеличению интервалов P и PQ (зубца Р и интервала PQ) и независимо от дозы повышает частоту дыхательных движений. Медетомидина гидрохлорид и изофлуран приводят к повышению артериального давления и увеличению зубца P и интервала PQ при умеренной степени наркотизации. Использование комбинации ксилазина гидрохлорида и изофлурана при умеренной и глубокой степени наркотизации приводит к увеличению PQ.
Введение
В настоящее время карликовые свиньи как модели используются для изучения большого спектра вопросов, связанных со здоровьем человека и касающихся области офтальмологии, гастроэнтерологии, кардиологии, а также проблем ожирения, психических, нервно-психических расстройств, ортопедической и стоматологической имплантологии [1–3].
Актуальность применения карликовых свиней подтверждает и динамика использования их зарубежными коллегами [4]. Согласно данным «COMMISSION STAFF WORKING DOCUMENT. Summary Report on the statistics on the use of animals for scientific purposes in the Member States of the European Union and Norway in 2018», во всем мире, повсеместно наблюдается повышенный интерес к использованию карликовых свиней в медицинских исследованиях и как следствие — увеличение количества используемых животных [5]; по сравнению с 2017 г. их численность увеличилась более чем на 10%. Всего было использовано около 11 млн животных, в том числе более 85 тыс. голов свиней.
Директива 2010/63/ЕС требует сообщать о фактической степени тяжести, с которой сталкивается каждое животное, когда используется в научных целях1. В 2018 г. около половины (50%) исследований, где были использованы карликовые свиньи, зарегистрировано как легкие, 34% — умеренные, 10% — тяжелые. В 6% случаев отмечена крайняя степень тяжести эксперимента — «без выхода из наркоза». В зависимости от уровня потенциальных страданий животного необходимо ему обеспечить должное обезболивание, а в ряде случаев, например, при проведении ультразвукового исследования (УЗИ) или выполнении электрокардиографии (ЭКГ) — безопасное сдерживание [6, 7].
Фиксация карликовых свиней крайне трудоемкий процесс, причиняющий животному бóльшие страдания, чем сама процедура. В некоторых случаях ее следует заменить легкой степенью наркотизации или просто использовать миорелаксанты. Кроме эмоциональных страданий, процедура сдерживания может закончиться инвалидизацией животного. Таким образом, R. Hejazi (2009) в своей работе [8], посвященной изучению переломов бедренной кости у свиней, указывает, что неправильное сдерживание животных является причиной переломов в 7–10% случаев. Данные цифры повторяются и в более поздних исследованиях. Спустя 9 лет L.J. Pedersen (2018) [9], анализируя проблемы свиноводства и благополучия животных, говорит о частом травматизме, приводящем к острой или хронической боли, а иногда даже к их гибели. Не стоит забывать о том, что дистресс и страдания карликовых свиней вследствие проведения процедур фиксации могут приводить к получению неконтролируемых искажений первичных данных.
У экспериментатора и/или биоэтической комиссии перед животным существует моральное обязательство минимизировать боль [7]. Свиньи, используемые в биомедицинских исследованиях, подвергаются процедурам, которые считаются болезненными для людей, но не получают достаточного уровня обезболивания. Вопросы анестезии и наркотизации у карликовых свиней достаточно хорошо раскрыты в работах отечественных и зарубежных авторов, однако остается ряд нерешенных проблем: а) обеспечение стадии наркоза, соответствующей планируемой степени боли и страданий животного, при этом на рынке ветеринарных средств для наркоза наблюдается дефицит эффективных препаратов; б) установление фонового влияния препаратов для предоставления наркотизации на ряд физиологических показателей, полученных при выполнении ЭКГ, на данные артериального давления (АД), биохимические показатели крови, что способствует дифференциации отклонений, вызванных наркотизацией от воздействия тестируемых препаратов на организм животного в ходе доклинических и иных исследований. Таким образом, для процедур, характеризующихся как легкие, следует использовать легкий уровень анестезии, для умеренных процедур — умеренную анестезию, а тяжелых и так называемых «без выхода из наркоза» — глубокую.
Цель исследования — изучение влияния препаратов для предоставления анестезии на карликовых свиней при разных режимах дозирования для достижения легкой, умеренной, глубокой стадии наркотизации. Исходя из цели были поставлены следующие задачи:
- дать рекомендации к применению комбинации препаратов в зависимости от планируемой степени тяжести процедур;
- изучить влияние тестируемых объектов тестируемых комбинаций на уровень глюкозы;
- определить изменение физиологических параметров.
Материал и методы
Исследование проводилось на базе АО «НПО «ДОМ ФАРМАЦИИ». План исследования одобрен на заседании биоэтической комиссии, заключение № 2.31/20. В качестве тест-системы были использованы карликовые свиньи в количестве 6 голов (3 самца и 3 самки) в возрасте 6–9 мес, диапазон массы тела (M±SD) на момент начала эксперимента у самцов составлял 14±2 кг, у самок — 18±3 кг. Еще 1 самка и 1 самец были доступны на случай необходимости замены.
Животных содержали в стандартных условиях. Они находились в вольерах, группами не более 3 особей одного пола, в качестве подстила использовали древесные пеллеты.
Карликовые свиньи получали влажный тип питания (сыворотка, яблоки, травяная мука, отруби, морковь) из индивидуальных гастроемкостей и воду, очищенную и нормированную в соответствии с требованиями.
За период адаптации и эксперимента температура и влажность находились в пределах установленных параметров окружающей среды (соответственно 22–26 °C, 40–75%), уровень аммиака и углекислого газа не превышал нормы, NH3 — 2 мг/м3, CO2 — 0,05 об.% (измерения от 25 мая 2020 г. и 24 ноября 2020 г.), световой режим составлял 12 ч темноты/12 ч света.
Животных подвергали кормовой депривации на 8–12 ч и лишали воды не более чем на 4 ч перед взвешиванием и введением препаратов для анестезии и анальгезии. Поскольку выбор метода анестезии определяется типом исследования, характером формирования патологии, локализацией патологического очага, объемом и длительностью предполагаемой процедуры, степенью ее тяжести, то комбинации и дозы препаратов для проведения исследования были выбраны с учетом данных литературы [6, 10–14].
Исследуемые объекты и дозы
- Ксила® (действующее вещество ксилазина гидрохлорид, Эстония), во всех случаях в данной комбинации вводили внутримышечно (в/м) и Золетил® (действующие вещества тилетамина гидрохлорид и золазепама гидрохлорид, Франция) — внутривенно (в/в);
- Золетил® (Франция) — в/м и Пропофол® — в/в (действующее вещество пропофол, Германия);
- Медитин® (действующее вещество медетомидина гидрохлорид, Российская Федерация — РФ) — в/м и Изофлуран® (действующее вещество изофлуран, Индия), вводимый ингаляционно с помощью маски;
- Ксила® (Эстония) — в/м и Изофлуран® (Индия) вводили ингаляционно с помощью маски;
- Пропофол® (Германия) — в/в и Изофлуран® (Индия) вводили ингаляционно с помощью маски;
- Медитин® (РФ) — в/м.
Дозы для предоставления легкой, умеренной и глубокой стадии анестезии представлены в табл. 1.
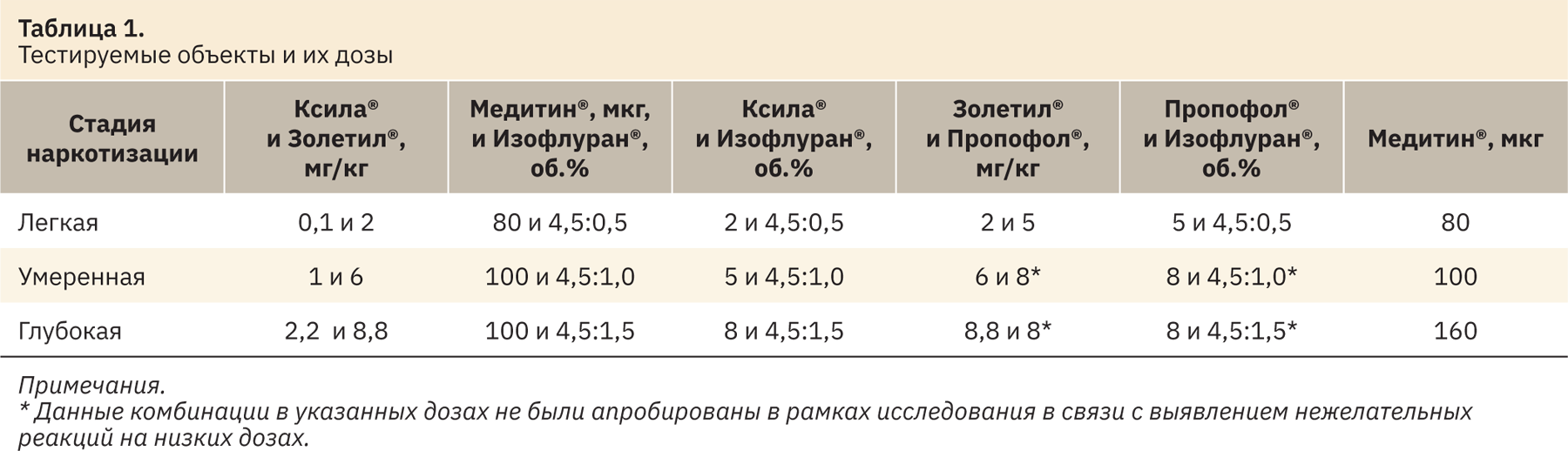
Для оценки степени анестезии требуется использовать комплексный подход, при этом проводят оценку рефлексов, согласно табл. 2, где 0 — полное отсутствие рефлекса; 1 — заторможенность или гиперреакция; 2 — полное сохранение рефлекса.
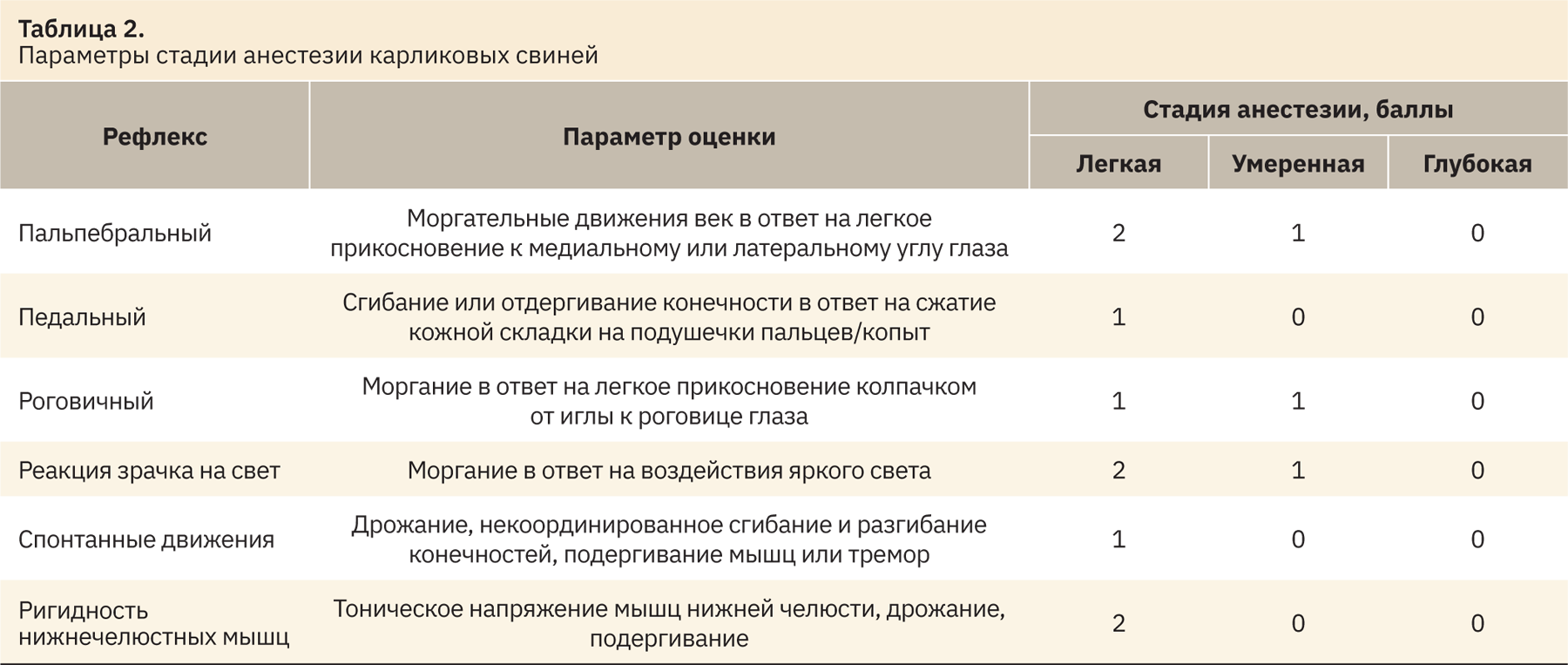
Тонус челюсти является наиболее надежным индикатором глубины анестезии у свиней и оценивается на протяжении всей процедуры.
В эти же временные интервалы регистрировали физиологические параметры:
- уровень насыщения кислородом крови (SpO2) определяли с помощью датчика ветеринарного монитора пациента («Zoomed IM-10», Россия), который присоединяли к щеке животного;
- количество частоты дыхательных движений (ЧДД) в минуту определяли, подсчитывая движения грудной клетки;
- регистрацию систолического и диастолического артериального давления осуществляли неинвазивным методом при помощи ветеринарного монитора давления («Zoomed BPM-1», Россия), манжету для измерения № 4 накладывали на грудную конечность животных;
- регистрацию ЭКГ проводили в отведении II в течение 1 мин с помощью компьютерного электрокардиографа для ветеринарии «Поли-спектр-8/Е».
Возможность снятия показателей ЭКГ, АД, частоты сердечных сокращений (ЧСС) оценивалась как «+» — можно в 100% случаев, «±» — можно, но не у всех животных, так как животные двигались и приходилось измерять повторно, «—» — невозможно.
Через 15 мин после введения тестируемых объектов осуществляли взятие крови из латеральной или центральной ушной вены для определения влияния тестируемых препаратов на уровень глюкозы. Затем фиксировали время выхода животного из наркоза для расчета продолжительности анестезии.
Согласно Директиве 2010/63/ЕС, дозы подобраны с учетом стадии анестезии по отношению к степени тяжести процедуры. Полученные данные обрабатывали с помощью программного обеспечения Statistica.
Результаты и обсуждение
Анестезия свиней обычно делится на премедикацию (седацию), вводную анестезию и поддерживающую анестезию. Как и в случае с другими видами, анестезию (поддерживающую) можно проводить ингаляционными или парентеральными методами.
Введение седативных препаратов снижает возбуждение и вызывает расслабление, что позволяет установить постоянные катетеры (для внутривенного введения лекарств) или интубационную трубку (для ингаляционной анестезии).
Комбинация ксилазина гидрохлорида в сочетании с тилетамина гидрохлоридом и золазепама гидрохлоридом. При использовании данной комбинации первоначально вводили ксилазина гидрохлорид (в/м), и по достижении животным достаточного миорелаксирующего действия (через 3–5 мин) применяли тилетамина гидрохлорид и золазепама гидрохлорид (в/в).
Для достижения легкой стадии наркоза использовали дозы ксилазина гидрохлорида 0,1 мг/кг (в/м), тилетамина гидрохлорида и золазепама гидрохлорида 2 мг/кг (в/в). В результате исследования было проведено влияние данных доз на отклонение физиологических параметров от нормы, сведения представлены в табл. 3.
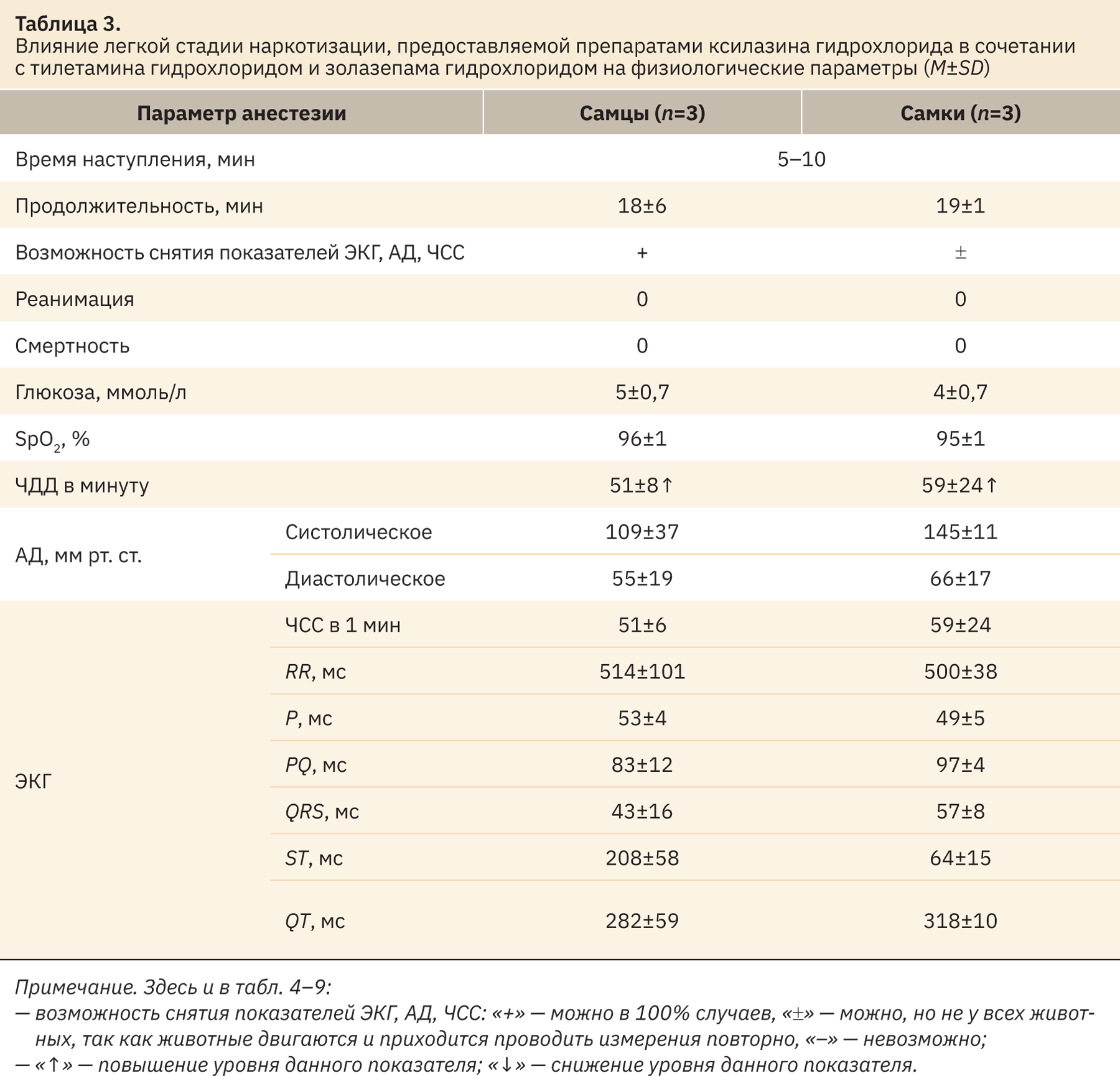
На основании проведенной оценки пальпебрального, педального, роговичного рефлексов, реакции зрачка на свет, наличия спонтанных движений и ригидности нижнечелюстных мышц мы можем утверждать, что данная комбинация в апробированных дозах может быть использована для применения процедур на карликовых свиньях, в результате которых они могут испытывать кратковременную легкую боль, страдания или дистресс, определяемые согласно Директиве 2010/63/EU как легкие.
При апробации дозы комбинации для достижения легкой глубины наркоза установлено, что у самок через 5 мин после введения тестируемых препаратов отмечены спонтанные движения, вследствие чего регистрация данных ЭКГ была проведена с помехами, у самцов спонтанные движения зарегистрированы через 15 мин после введения тестируемых препаратов. Продолжительность анестезии 18–19 мин.
Уровень (в ммоль/л) глюкозы находился в пределах физиологической нормы и референсных интервалов, при норме для самцов 3,15–6,63 (4,89) уровень глюкозы в сыворотке составлял 5±0,7; у самок — 4±0,7, что было сопоставимо с данными литературы — 2,69–10,34 (6,52) [14]. Насыщаемость крови кислородом (SpO2, %) у самцов и самок находилась в пределах физиологической нормы и составляла 96±1 и 95±1 соответственно [14].
При физиологической норме от 20 до 44 дыхательных движений в минуту в нашем случае ЧДД как у самцов, так и самок составляла 51±8 и 59±24 в минуту соответственно, что говорит об увеличении данного показателя [15].
Результаты АД и ЭКГ укладывались в ретроспективные данные внутрилабораторных норм.
Для достижения умеренной стадии анестезии с применением ксилазина гидрохлорида в сочетании с тилетамина гидрохлоридом и золазепама гидрохлоридом использовались следующие дозы: соответственно 1 мг/кг + 6 мг/кг. Продолжительность наркотизации составляла у самцов 63 мин, у самок 56 мин. На основании оценки параметров стадии анестезии, а именно пальпебрального (1), педального (0), роговичного рефлексов (1), реакции зрачка на свет (1), наличия спонтанных движений (0) и ригидности нижнечелюстных мышц (0) было установлено, что данная комбинация применима для обеспечения карликовым свиньям процедур умеренной степени тяжести. Данные об отклонении физиологических параметров от нормы, вызванные данной комбинацией, представлены в табл. 4.
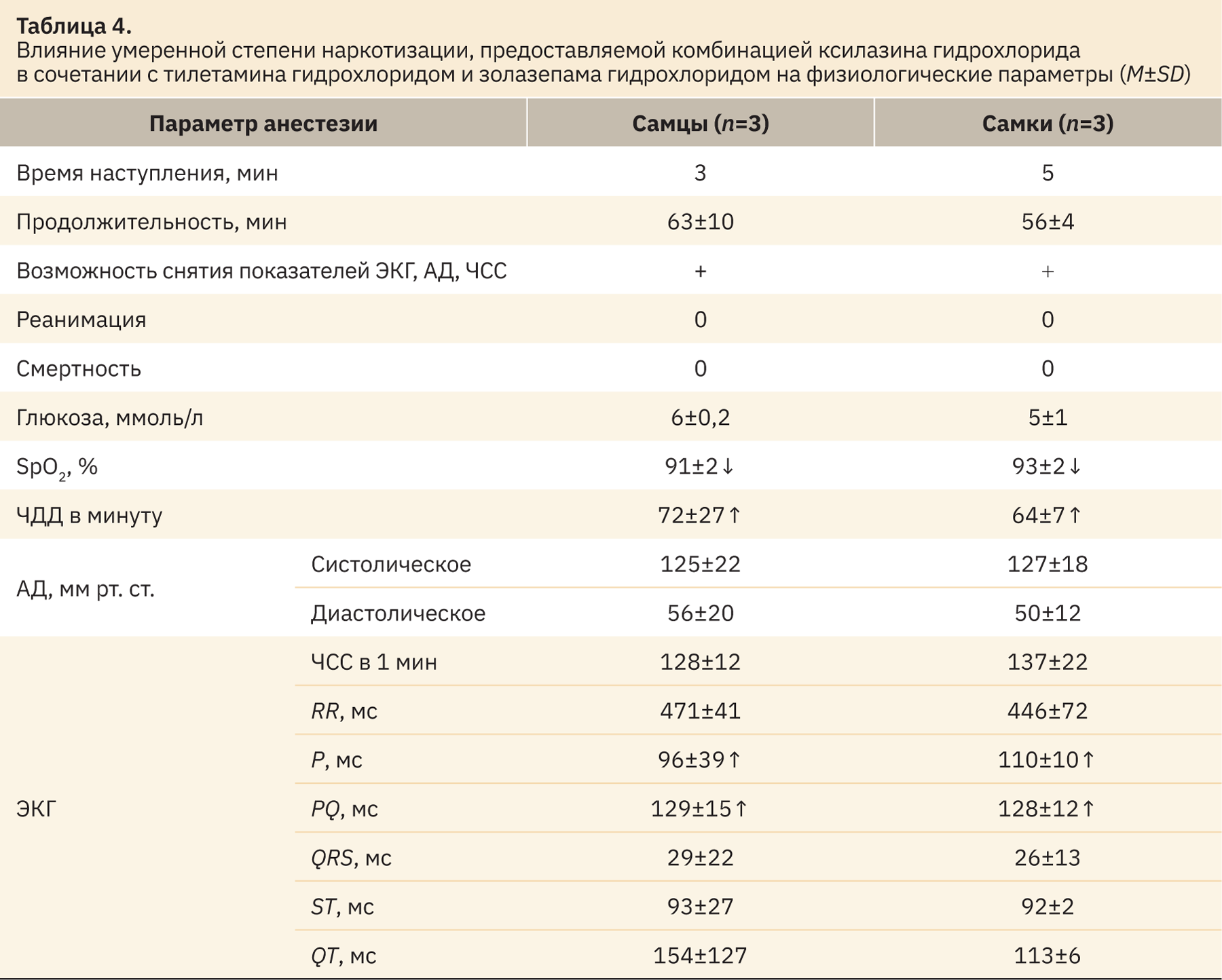
За фоновые изменения, связанные с действием данного типа наркоза, следует принимать уменьшение сатурации, увеличение ЧДД до 72±27 и 64±7 в минуту у самцов и самок соответственно. Со стороны ЭКГ следует отметить увеличение зубца P и интервала PQ. Иных изменений физиологических параметров при предоставлении умеренной степени анестезии у животных не наблюдалось.
Одним из наиболее важных аспектов наркотизации является предоставление достаточного уровня анальгезии для процедур, относящихся к тяжелым и «без выхода из наркоза», для данного вида процедур применимо использование лишь глубокого наркоза. При применении комбинации ксилазина гидрохлорида в сочетании с тилетамина гидрохлоридом и золазепама гидрохлоридом (соответственно 2,2 мг/кг + 8,8 мг/кг) у самок зарегистрировано отсутствие всех рефлексов, согласно данным табл. 1, через 5 мин после введения, у самцов — через 3 мин. Продолжительность анестезии у самцов 75 мин, у самок 84 мин. Дозы могут быть использованы для применения. Фоновое влияние данного уровня анестезии на животное отражено в табл. 5.
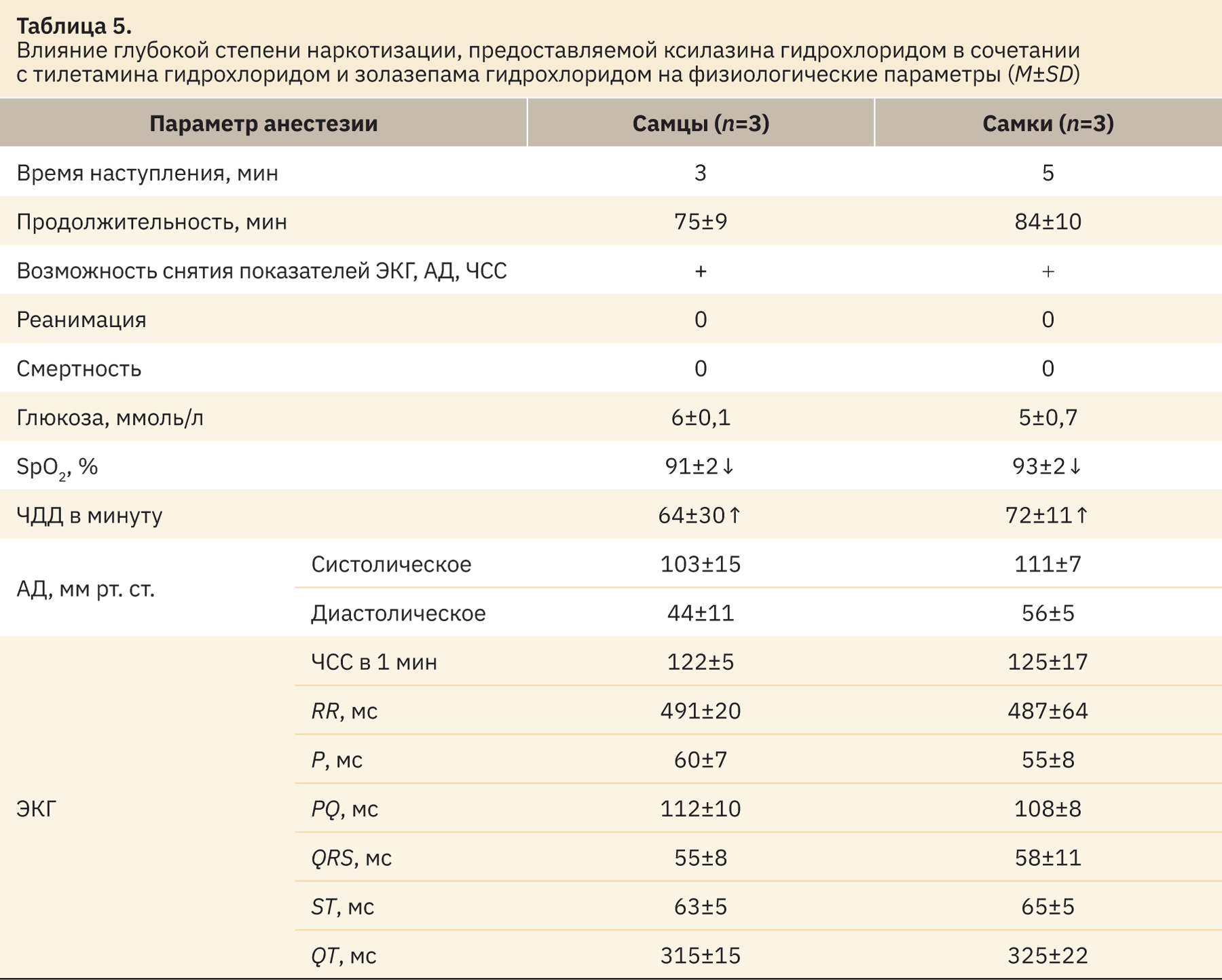
При использовании данной комбинации в указанных дозах мы наблюдаем изменения, идентичные умеренной степени анестезии (см. табл. 4), — снижение сатурации до 91±2% у самцов и до 93±2% у самок. Зеркальные для самцов и самок изменения ЧДД составляют 64±30 и 72±11 в минуту. Однако по остальным параметрам показатели остаются в пределах нормы.
Комбинация медетомидина гидрохлорида и изофлурана. Введение препаратов производилось последовательно. Первоначально вводили медетомидина гидрохлорид в/в для достижения эффекта миорелаксации и только спустя 7–15 мин ингаляционно вводили изофлуран. Интубации произведено не было, подача осуществлялась с помощью дыхательной маски.
Для предоставления легкой стадии анестезии использовали медетомидина гидрохлорид в дозе 80 мкг/кг и изофлуран 4,5:0,5 об.%. Регистрация данных ЭКГ при легкой стадии анестезии была невозможна, поскольку присутствовали спонтанные движения животного, создававшие помехи. Животное находилось в полном сознании, сопротивлялось, на протяжении 15 мин ингаляции пыталось снять маску. Исходя из данного фактора, можем заключить, что согласно Директиве 2010/63/EU использование такой комбинации в указанных дозах не применимо для обеспечения процедур легкой степени тяжести.
При использовании медетомидина гидрохлорида и изофлурана (соответственно 100 мг/кг + 4,5:1,0 об.%), минуя легкую стадию наркотизации, формировалась устойчивая умеренная стадия. Данный факт был подтвержден на основании оценки рефлексов согласно табл. 2. При этом продолжительность эффекта составляла от 32 до 45 мин с момента предоставления ингаляционного наркоза. Данные о физиологическом состоянии и изменении параметров отражены в табл. 6.
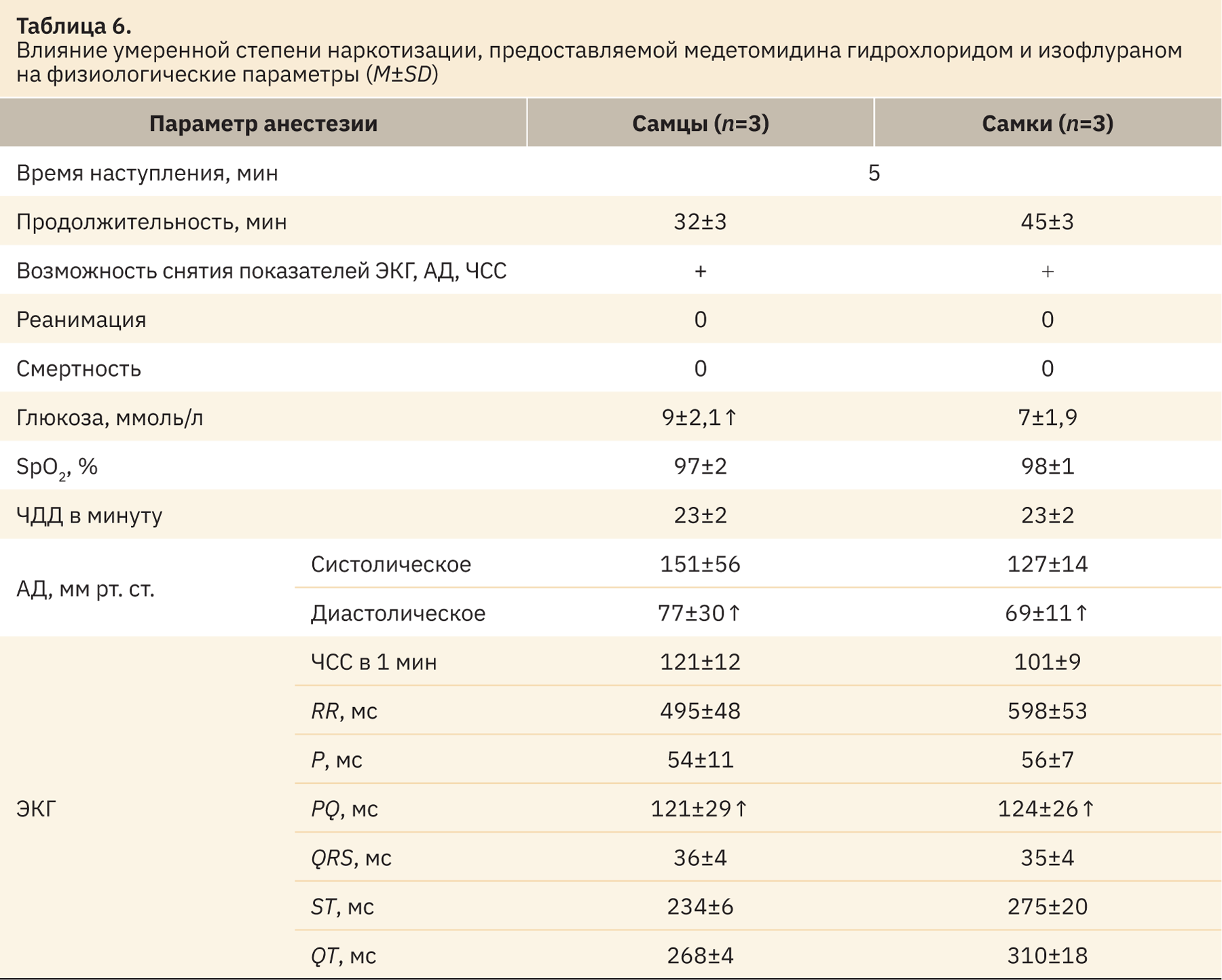
В результате данного этапа исследования установлено, что использование медетомидина гидрохлорида (100 мг/кг) и изофлурана (4,5:1,0 об.%) позволяет обеспечить анестезию у карликовых свиней, используемых в процедурах умеренной степени тяжести. При проведении доклинических исследований стоит учитывать, что при использовании данного наркоза у самцов отмечается увеличение уровня глюкозы по сравнению с референсными данными [14]. У обоих полов регистрируется увеличение диастолического давления и интервала PQ до 124±26 мс, иные показатели ЭКГ в пределах нормы.
Для процедур, определяемых как тяжелые и «без выхода из наркоза», были отработаны дозы медетомидина гидрохлорида (100 мг/кг) и изофлурана (4,5:1,5 об.%). Апробированная комбинация соответствует глубокой стадии наркотизации. В табл. 7 указана детальная информация об изменении регистрируемых параметров у животных данной группы.
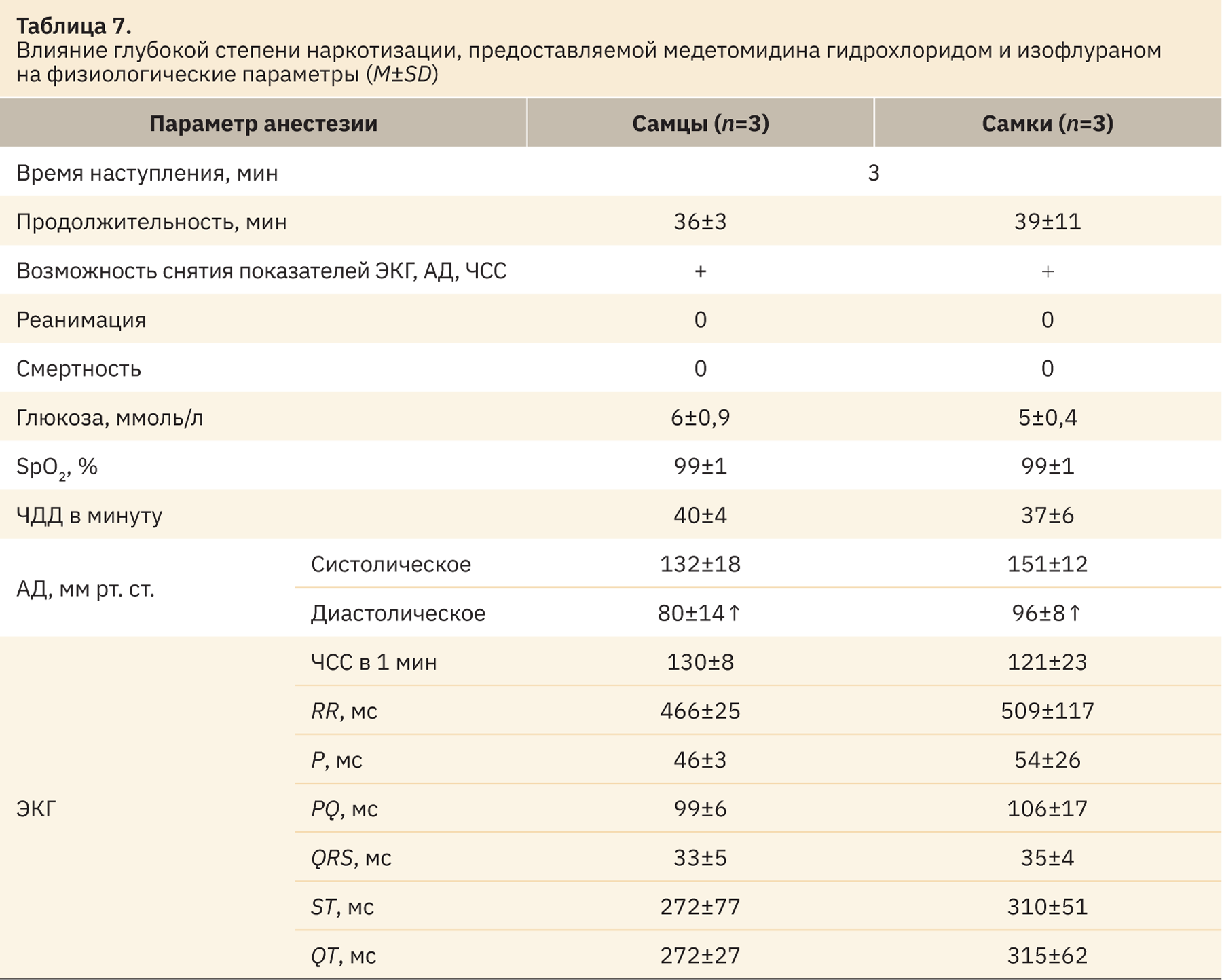
Отработанная на данном этапе схема на основании рефлексов, указанных в табл. 2, позволяет проводить на животных манипуляции тяжелые и «без выхода из наркоза» в соответствии с Директивой 2010/63/EU. При использовании данной дозировки следует учитывать фоновое влияние данной комбинации. Уровень ЧДД почти вдвое превышает аналогичный показатель, регистрируемый при умеренной стадии, но данные которого входят в диапазон физиологической нормы. Наиболее чувствительным к комбинации показателем оказалось диастолическое давление, которое у самцов поднималось до 80±14, а у самок — до 96±8 мм рт.ст.
Комбинация ксилазина гидрохлорида и изофлурана. Для предоставления легкой стадии анестезии использовали ксилазина гидрохлорид в дозе 2 мг/кг и изофлуран 4,5:0,5 об.%. Регистрация данных ЭКГ и получение достоверных результатов была невозможна, так как животное продолжало двигаться. Мы можем сделать вывод, что применение данной комбинации в таких дозах не допустимо.
При использовании ксилазина гидрохлорида и изофлурана в дозах 5 мг/кг + 4,5:1,0 об.% соответственно была получена устойчивая умеренная стадия. Данные, установленные при регистрации физиологических параметров, представлены в табл. 8.
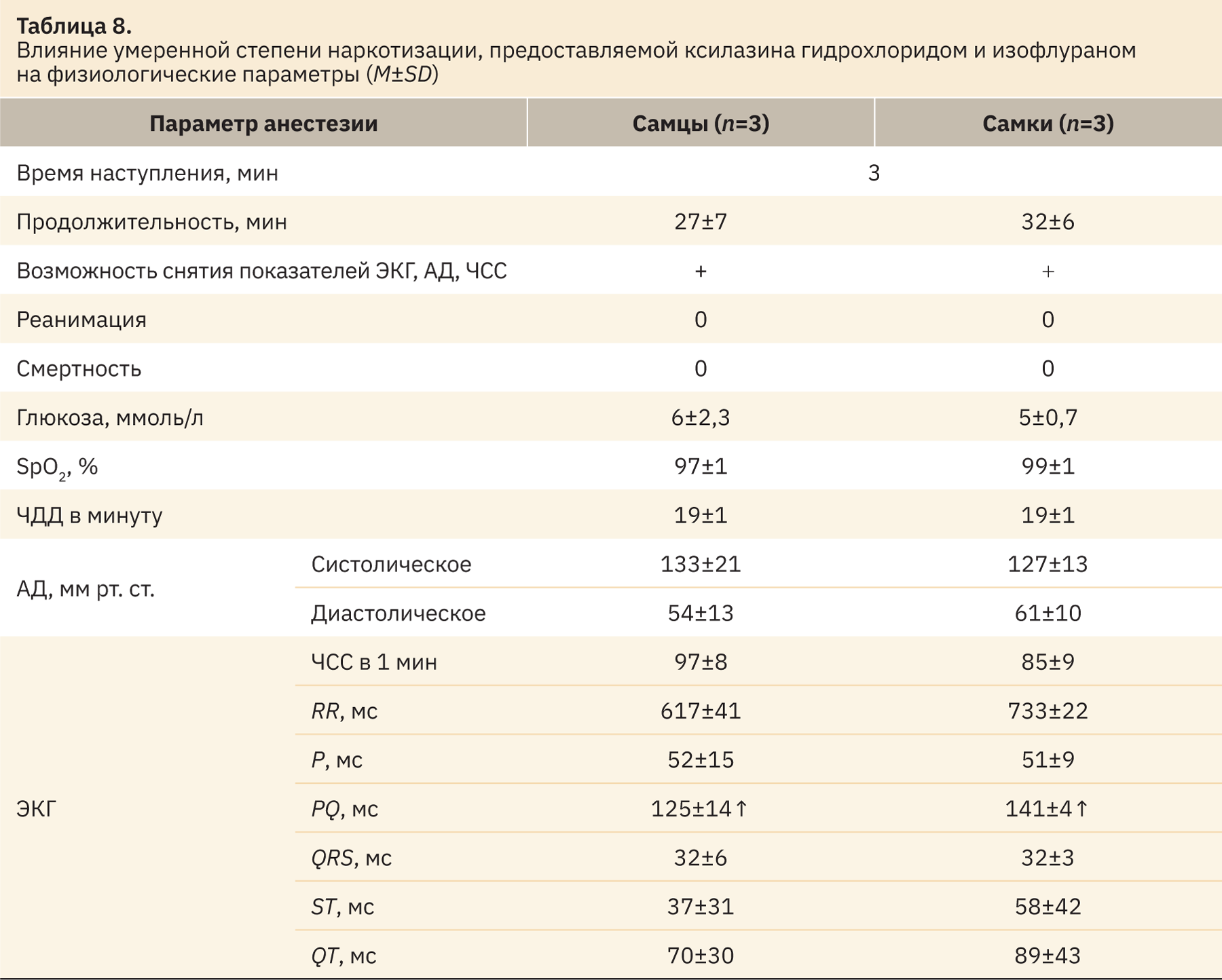
На основании оценки рефлексов согласно данным табл. 2 установлено, что при использовании препаратов ксилазина гидрохлорида (5 мг/кг) и изофлурана (4,5:1,0 об.%) получена наркотизация умеренной степени. В процессе проведения доклинических исследований нужно учитывать, что и у самцов и у самок наблюдается повышение показателя PQ соответственно до 125±14 и 141±4 мс по данным ЭКГ, другие значения остаются в норме.
К процедурам, которые определяются как тяжелые и «без выхода из наркоза», применимы препараты ксилазина гидрохлорида и изофлурана (8 мг/кг + 4,5:1,5 об.%). На основании отсутствия рефлексов (реакция зрачка на свет, спонтанные движения, полная расслабленность нижнечелюстных мышц) следует, что данная комбинация в указанных дозах предоставляет уровень наркотизации, равный глубокой степени. Значения регистрируемых параметров при проведенной наркотизации представлены в табл. 9.
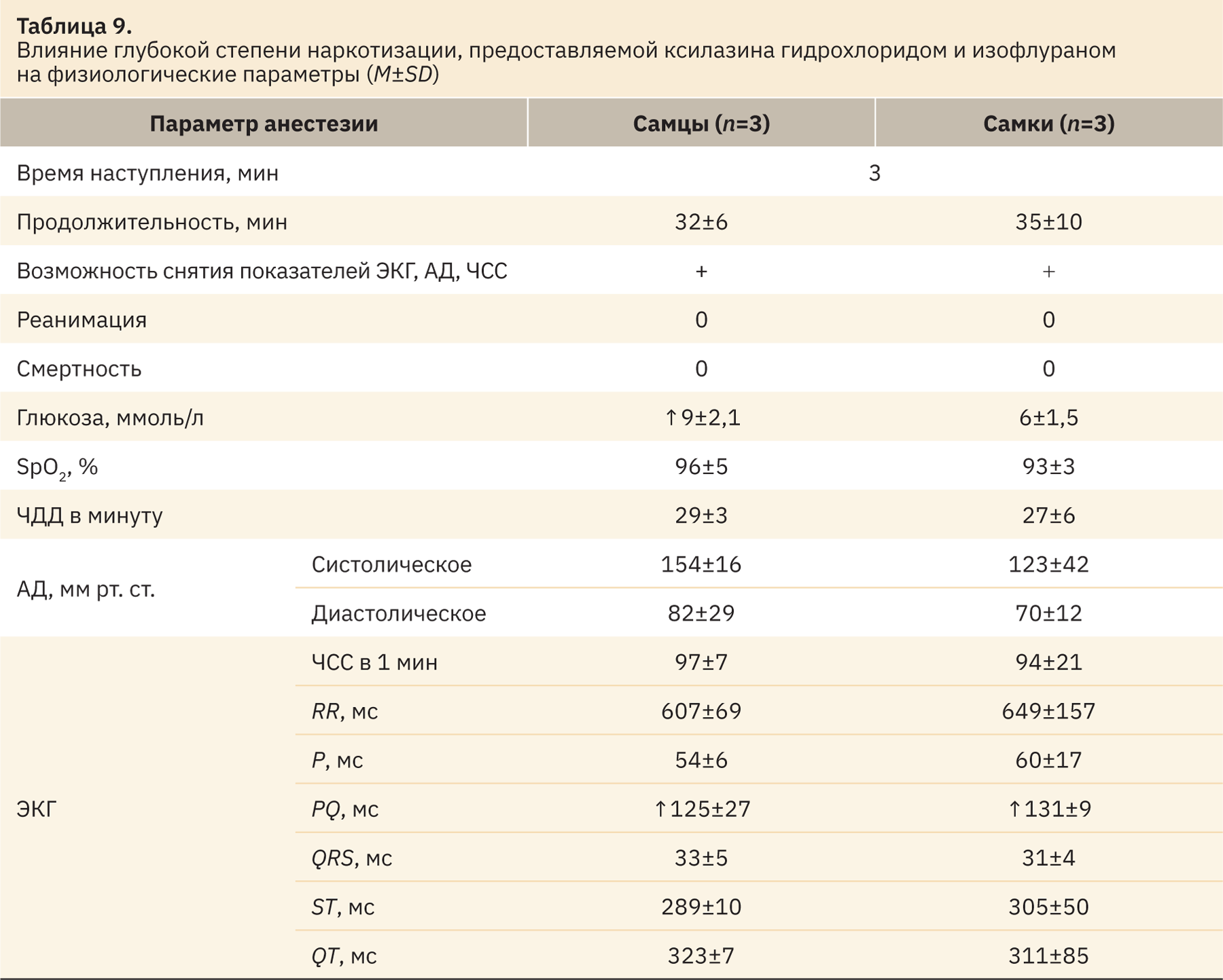
При проведении доклинических исследований необходимо обратить внимание на то, что при глубокой степени наркотизации уровень глюкозы повышается до показателя 9±2,1 ммоль/л у самцов карликовых свиней. Также наркотизация оказывает влияние на показатель PQ при измерении данных ЭКГ, который повышается до 125±27 мс у самцов и 131±9 мс у самок.
Согласно Директиве 2010/63/EU, допустимо использование данной комбинации препаратов с описанными дозами для применения при глубокой наркотизации лабораторных карликовых свиней.
Комбинация тилетамина гидрохлорида и золазепама гидрохлорида с пропофолом. По данным Е.А. Корнюшенкова (2011), общая наркотизация с использованием тилетамина гидрохлорида и золазепама гидрохлорида совместно с пропофолом обеспечивает достаточно надежный уровень анестезии [12], но при этом важным фактором является обязательная интубация и респираторная поддержка животного во время использования данной комбинации [11].
В нашем случае после внутривенного введения пропофола у 2 самцов были отмечены симптомы передозировки: сатурация (SpO2) менее 50%, мгновенная синюшная окраска кожных покровов, акроцианоз и апноэ. Регистрация физиологических показателей при данном состоянии животных была невозможна, поскольку потребовалась экстренная помощь.
В связи с установленным влиянием комбинации золетила и пропофола при легкой стадии наркоза у самцов иные дозы данной комбинации не исследовались.
Возможно, отмеченные эффекты вызваны слишком быстрым введением пропофола. Требуется дополнительное изучение особенностей введения данной комбинации на карликовых свиньях.
Комбинация пропофола и изофлурана. Такая комбинация была исключена из эксперимента на основании данных, касающихся использования тилетамина гидрохлорида и золазепама совместно с гидрохлоридом и пропофолом, в связи с негативным влиянием на дыхательную систему животных пропофола и аналогичным известным действием изофлурана, а также возможным суммированием эффекта, который предполагает гибель лабораторных животных.
Применение медетомидина гидрохлорида. Предпосылками к выбору медетомидина гидрохлорида был анализ данных литературы и современного рынка ветеринарных препаратов. Медетомидина гидрохлорид — это седативное и обезболивающее лекарственное средство, предназначенное для собак и кошек, его также можно успешно применять у многих других видов животных [16]. Кроме этого, значительным преимуществом является наличие антагониста препарата Антимедин® (РФ), введение которого приводит к полному восстановлению состояния животного (активность, сознание).
В нашем случае медетомидина гидрохлорид при внутримышечном введении в дозе 80, 100, 160 мкг/кг не проявил своей эффективности. У животных сохранялись все оцениваемые рефлексы. Карликовые свиньи были активны, уверенно стояли на всех лапах и перемещались по клетке содержания весь период наблюдения, который составлял 60 мин непрерывного наблюдения, и далее каждые 15 мин на протяжении часа.
Медетомидина гидрохлорид как монопрепарат не применим для обеспечения анестезии или миорелаксации карликовых свиней. В рамках эксперимента мы установили, что данный препарат может работать в комбинации, например, с изофлураном. Кроме того, исследования кафедры ветеринарной хирургии сельскохозяйственного факультета Токийского университета (Япония) под руководством M. Sakaguchi (1992) [17] установили седативное действие медетомидина, мощного селективного и специфического агониста альфа-2‑адренорецепторов, на свиньях при использовании 5 различных доз (30, 50, 80, 100 и 150 мкг/кг). Однако в данном исследовании медетомидина гидрохлорид использовали с атропином (25 мкг/кг). Все препараты вводили внутримышечно. Ученые говорят о том, что медетомидина гидрохлорид в дозе 30 мкг/кг вызывал более сильный седативный эффект, чем ксилазина гидрохлорид. Глубина седации, вызываемой ксилазина гидрохлоридом, зависела от дозы (30–80 мкг/кг).
Исходя из данных литературы и собственного эксперимента, считаем, что комбинирование препарата Медитин требует дополнительного исследования.
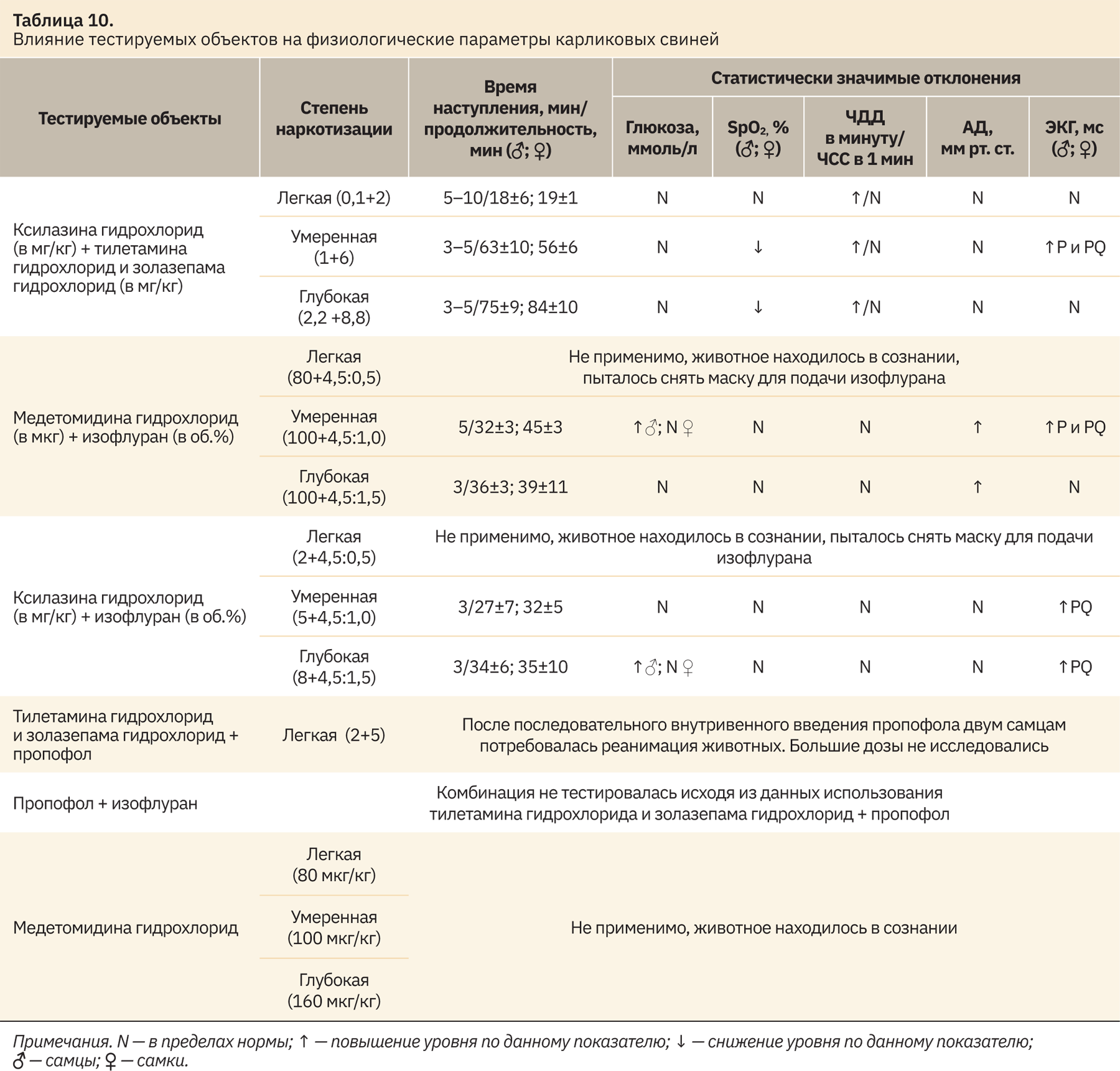
Однозначно наркотизация в зависимости от глубины наркоза и комбинации препаратов может влиять на получаемые данные, время наступления анестезии, ее продолжительность, что обобщено и отражено в табл. 10.
Заключение
На основании проведенного исследования можно сделать следующие выводы.
- При проведении процедур, характеризующихся легкой степенью продолжительности (до 20 мин), следует использовать комбинацию ксилазина гидрохлорида (0,1 мг/кг) в сочетании с тилетамина гидрохлоридом и золазепамом гидрохлоридом (2 мг/кг). Для проведения процедур умеренной степени тяжести, то есть при необходимости анестезиологического обеспечения около одного часа, можно использовать комбинации ксилазина гидрохлорида (1 мг/кг) и тилетамина гидрохлорида с золазепамом гидрохлоридом (6 мг/кг); в случае если достаточно до 40 мин анестезии, можно использовать комбинацию медетомидина гидрохлорида (100 мкг) и изофлурана (4,5:1,0 об.%); ксилазина гидрохлорида (5 мг/кг) и изофлурана (4,5:1,0 об.%); до 30 мин — ксилазина гидрохлорида (5 мг/кг) и изофлурана (4,5:1,0 об.%). При анестезиологическом обеспечении процедур, характеризующихся как тяжелые или «без выхода из наркоза», применимы комбинации ксилазина гидрохлорида (22 мг/кг) и тилетамина гидрохлорида с золазепамом гидрохлоридом (8,8 мг/кг), продолжительность анестезии до 84 мин; введение медетомидина гидрохлорида (100 мкг) и изофлурана (4,5:1,5 об.%) обеспечивает продолжительность анестезии до 40 мин; ксилазина гидрохлорида (8 мг/кг) и изофлурана (4,5:1,5 об.%). Кроме предложенных схем важно подобрать подходящий протокол для анальгезии животных в интра- и постоперационном периоде. Применение комбинации тилетамина гидрохлорида и золазепама гидрохлорида с пропофолом, а также пропофола и изофлурана не рекомендовано или требует дополнительного изучения.
- Установлено, что при использовании медетомидина гидрохлорида (100 мкг) и изофлурана (4,5:1,0 об.%) наблюдается повышение уровня глюкозы у самцов карликовых свиней, а при сочетании ксилазина гидрохлорида (8 мг/кг) и изофлурана (4,5:1,5 об.%) уровень глюкозы увеличивался как у самцов, так и самок.
- Ксилазина гидрохлорид в сочетании с тилетамина гидрохлоридом и золазепама гидрохлоридом в зависимости от дозы может приводить к уменьшению сатурации, увеличению интервалов P и PQ (зубца Р и интервала PQ) и независимо от дозы к увеличению частоты дыхательных движений. Медетомидина гидрохлорид и изофлуран приводят к увеличению артериального давления и увеличению показателей P и PQ при умеренной степени наркотизации. Использование комбинации ксилазина гидрохлорида и изофлурана при умеренной и глубокой степени наркотизации способствует увеличению интервала PQ.
Сведения о конфликте интересов
Авторы заявляют об отсутствии конфликта интересов.
Вклад авторов
Д.Ю. Акимов — разработка дизайна исследования, планирование работы, получение данных и анализ результатов, написание текста статьи; ответственность за все аспекты работы, связанные с достоверностью данных, утверждение окончательного варианта статьи для публикации.
П.Д. Шабанов — критический пересмотр статьи.
С.О. Хан — уход за животными.
- Directive 2010/63/EU of the European Parliament and of the Council of 22 September 2010 on the protection of animals used for scientific purposes Text with EEA relevance.
Список источников
-
Blanc-Sylvestre N., Bouchard P., Chaussain C., Bardet C. Pre-Clinical Models in Implant Dentistry: Past, Present, Future // Biomedicines. 2021. Vol. 9. N. 11. Р. 1538. DOI: 10.3390/biomedicines9111538.
-
Kinder H.A., Baker E.W., West F.D. The pig as a preclinical traumatic brain injury model: current models, functional outcome measures, and translational detection strategies // Neural regeneration research. 2019. Vol. 14. N. 3. Р. 413. DOI: 10.4103/1673-5374.245334.
-
Henze L.J., Koehl N.J., O’Shea J.P. et al. The pig as a preclinical model for predicting oral bioavailability and in vivo performance of pharmaceutical oral dosage forms: a PEARRL review // Journal of pharmacy and pharmacology. 2019. Vol. 71. N. 4. Р. 581–602. DOI: 10.1111/jphp.12912.
-
Busquet F., Kleensang A., Rovida C. et al. New European Union statistics on laboratory animal use — what really counts! // ALTEX-Alternatives to animal experimentation. 2020. Vol. 37. N. 2. Р. 167–186. DOI: 10.14573/altex.2003241.
-
Report on the statistics on the use of animals for scientific purposes in the Member States of the European Union and Norway in 2018. Brussels. 2021. SWD 204 final PART 1/2. 103 p.
-
EFSA Panel on Animal Health and Welfare (AHAW) et al. Welfare of pigs at slaughter // EFSA Journal. 2020. Vol. 18. N. 6. Р. e06148.
-
Ison S.H., Clutton R.E., Di Giminiani P., Rutherford K. A review of pain assessment in pigs // Frontiers in Veterinary Science. 2016. Vol. 3. Р. 108.
-
Hejazi R., Danyluk A.J. Epidemiological investigation of femoral fractures in market pigs and the associated economic implications // The Canadian Veterinary Journal. 2009. Vol. 50. N. 5. Р. 516.
-
Pedersen L.J. Overview of commercial pig production systems and their main welfare challenges // Advances in Pig Welfare. Woodhead Publishing. 2018. Р. 3–25. DOI: 10.1016/B978-0-08-101012-9.00001-0.
-
Разина А.В., Фролова А.И., Сергеев М.А. Оптимизация метода общей анестезии на кроликах // Актуальные вопросы ветеринарной биологии. 2010. № 1 (5). С. 32–35. [Razina A.V., Frolova A.I., Sergeev M.A. Optimizatsiya metoda obshchei anestezii na krolikakh // Aktual’nye voprosy veterinarnoi biologii. 2010. N. 1 (5). P. 32–35. (In Russ.)].
-
Корнюшенков Е.А., Гимельфарб А.И. Фармакодинамические эффекты пропофола при использовании у собак и кошек // VetPharma. 2011. № 1. С. 45–51. [Kornyushenkov E.A., Gimel’farb A.I. Farmakodinamicheskie ehffekty propofola pri ispol’zovanii u sobak i koshek // VetPharma. 2011. N. 1. P. 45–51 (In Russ.)].
-
Корнюшенков Е.А., Данилевская Н.В. Влияние комбинации Пропофол-Золетил и Кетамин-Ксилазин на кардиореспираторные показатели при тотальной внутривенной анестезии у собак // VetPharma. 2011. № 2. С. 36–40. [Kornyushenkov E.A., Danilevskaya N.V. Vliyanie kombinatsii Propofol-Zoletil i Ketamin-Ksilazin na kardiorespiratornye pokazateli pri total’noi vnutrivennoi anestezii u sobak // VetPharma. 2011. N. 2. P. 36–40. (In Russ.)].
-
Корнюшенков Е.А. Особенности клинической фармакологии препаратов для анестезии и седации мелких домашних животных. Часть 2 // РВЖ. 2013. № 1. С. 33–39. [Kornyushenkov E.A. Osobennosti klinicheskoi farmakologii preparatov dlya anestezii i sedatsii melkikh domashnikh zhivotnykh. Chast’ 2 // RVZH. 2013. N. 1. P. 33–39. (In Russ.)].
-
Traustason S., Kiilgaard J.F., Karlsson R.A. et al. Spectrophotometric retinal oximetry in pigs // Investigative ophthalmology & visual science. 2013. Vol. 54. N. 4. Р. 2746–2751. DOI: 10.1167/iovs.12-11284.
-
Carpenter J.W., Marion C. Miniature pigs. Exotic Animal Formulary-E-Book. Elsevier Health Sciences, 2017. 665 p.
-
Vainio O. Introduction to the clinical pharmacology of medetomidine // Acta Veterinaria Scandinavica. Supplementum. 1989. Vol. 85. Р. 85–88.
- Sakaguchi M., Nishimura R., Sasaki N. et al. Sedative effects of medetomidine in pigs // Journal of Veterinary Medical Science. 1992. Vol. 54. N. 4. Р. 643–647.



