Риск-ориентированный подход к проведению мониторинга здоровья обезьян
Акимов Д.Ю., Макарова М.Н., Акимова М.А., Бондарева Е.Д., Хан С.О. Риск-ориентированный подход к проведению мониторинга здоровья обезьян . Лабораторные животные для научных исследований. 2021; 2. https://doi.org/10.29296/2618723X-2021-02-09
Резюме
Эксперименты на животных используются во многих биомедицинских исследованиях, включая фармацевтические. Приматы высоко ценятся в исследованиях из-за их генетического сходства с людьми. Подсчитано, что нечеловекообразные приматы составляют очень небольшую долю (0,5%) от общего числа животных, используемых в экспериментах. Широкоприменяемых в исследованиях обезьян можно разделить на виды Нового Света (игрунковые) и Старого Света (макаки и зеленые мартышки).
Вследствие большого разнообразия видов приматов актуализируются вопросы мониторинга здоровья животных, так как вирулентность одного и того же патогенного агента может варьировать у особей разного вида. Существуют рекомендации группы FELASA, которые неоспоримо являются ориентиром в данном направлении. В последнем пересмотре рекомендаций по мониторингу здоровья приматов (2018) указывается, что следует учитывать географическое положение, государственные нормативные требования, распространение эндемичных организмов при составлении планов такого мониторинга.
Цель исследования – разработка собственного плана мониторинга здоровья лабораторных обезьян с применением риск-ориентированного подхода. Использовались общие аналитические, эпизоотологические и риск-ориентированные методы подхода к данной проблеме. Установлено следующее:
1. Наиболее часто используемыми видами для доклинических исследований являются макак-крабоед (Macaca fascicularis), макака-резус (Macaca mulatta), зеленые мартышки (Chlorocebus sabaeus) и игрунковые.
2. Сравнительная характеристика рекомендации FELASA (2018), требований законодательства РФ и методических пособий показала, что, несмотря на общую цель, которую преследуют все представленные программы, наблюдается довольно много различий в сути указанных документов и перечне патогенов для осуществления мониторинга здоровья у приматов.
3. Рекомендации по проведению мониторинга здоровья у лабораторных приматов в условиях разведения и содержания в Северо-Западном регионе России должны включать входной, эпизодический, полугодовой и годовой контроль. Кроме выявления основных паразитарных агентов, при входном контроле стоит проводить исследование на наличие амебиаза и лямблиоза, при эпизодическом контроле – сальмонеллеза, шигеллеза, эшерихиоза, кампилобактериоза, иерсиниоза, включая Yersinia pestis, Y. Pseudotuberculosis, лептоспироза, листериоза. Полугодовой мониторинг здоровья животных следует производить для выявления гепатитов типа А, В, С; годовой контроль – для установления вируса обезьяньего иммунодефицита (SIV), Т-клеточного лейкоза обезьян (STLV), обезьяньего ретровируса типа D (SRV) и туберкулеза. Годовой мониторинг здоровья животных должен включать диагностирование бешенства и кори, если не предусмотрена вакцинация животных от данных патогенных агентов.
Введение
Россия обладает невероятным разнообразием экосистем и связанных с ними диких животных, на которых обитает около 320 видов млекопитающих [1]. Обезьяны для России не являются аборигенными видами. Нечеловекообразные приматы (NHP) имеют естественный географический ареал, охватывающий Африку, Центральную и Южную Америку и некоторые части Азии, включая острова и небольшие участки суши, прилегающие к этим континентам [2]. Широкий ассортимент видов, местообитания и значительный географический ареал приматов означают, что возбудители болезней, поражающих данный отряд, разнообразны.
Первые упоминания о начале масштабных исследований на обезьянах в сфере медицины и физиологии на территории СССР начались в 1927 г. Именно в начале ХХ века по многочисленным просьбам отечественных ученых Правительством СССР было принято решение о создании в Сухуми, научного питомника обезьян Всесоюзного института эндокринологии [3].
Нечеловекообразные обезьяны являются важными моделями в доклинических исследованиях (ДКИ), позволяющих понять патогенные механизмы заболеваний человека, служат хорошими моделями для оценки лекарственных средств. Тестирование безопасности и эффективности биологических препаратов, таких как моноклональные антитела, цитокины, не обходится без исследований на приматах. Эти проблемы объясняют растущий интерес к нечеловекообразным приматам, несмотря на затраты и этические ограничения [4, 5].
Однако ввиду ряда сдерживающих факторов за почти 100-летний период развитие приматологических центров в России не получило широкого распространения.
На сегодняшний день эксперименты на NHP проводятся лишь в 0,5% случаев от числа всех животных [6, 7], участвующих в текущих биомедицинских и доклинических исследованиях. Такие животные используются для поиска лекарства от рака, СПИДа, болезни Альцгеймера, Паркинсона, ожирения, диабета и десятков других заболеваний [8].
В настоящее время наиболее точная информация о применении лабораторных животных, в том числе NHP, формируется в Отчете комиссии Европейскому парламенту и консульству по статистике использования животных в научных целях [7].
Согласно данным отчета, наиболее часто используемыми видами/семействами являются макак-крабоед (Macaca fascicularis), макака-резус (Macaca mulatta), зеленые мартышки (Chlorocebus sabaeus) и представители семейства игрунковых (Callitrichidae).
При работе с приматами в Российской Федерации необходимо учитывать ряд вопросов, в том числе установление перечня патогенов, необходимых для проведения мониторинга здоровья; кратность его выполнения по тем или иным показателям.
Рабочая группа FELASA и их рекомендации являются важным ориентиром в данном направлении. В последнем пересмотре (2018) рекомендаций по мониторингу здоровья приматов подчеркивается, что следует учитывать, географическое положение, нормативные требования, распространение эндемичных организмов в зависимости от страны и локации конкретного места проведения исследований [9].
Многие страны, например, такие как Австралия, разработали собственный мониторинг здоровья приматов, применяя систему оценки рисков [10]. В общемировой практике анализ рисков признается в качестве важного компонента любого процесса, в том числе и мониторинга здоровья животных (МЗЖ), а также биобезопасности, связанной с поступлением лабораторных животных в организацию. К сожалению, в Российской Федерации нет единого плана мониторинга здоровья для приматов.
Цель настоящего исследования – разработка собственного плана мониторинга здоровья лабораторных обезьян с применением риск-ориентированного подхода, в соответствии с этим были поставлены следующие задачи:
- Установить наиболее часто используемые виды NHP для проведения доклинических исследований.
- Провести сравнительный анализ требований FELASA с имеющимися в России регламентирующими стандартами или схожими процессами для нечеловекообразных обезьян.
- Дать рекомендации по проведению мониторинга здоровья у лабораторных приматов в условиях их разведения и содержания в Северо-Западном регионе России.
Материал и методы
Исследование проведено на базе АО «НПО «Дом Фармации» в мае 2021 г. Данное исследование является обзорным и не требующим согласования с биоэтической комиссией. В ходе исследования использованы общепринятые эпизоотологические методы анализа и работа с источниками литературы. Проведена комплексная оценка риска.
Комплексный риск оценивали исходя из приоритетного числа риска (ПЧР), который рассчитывали по формуле:
ПЧР = S • O • D,
где S – тяжесть вреда (последствий опасности); O – вероятность возникновения опасности и D – вероятность выявления опасности, все вышеперечисленные показатели представлены в баллах от 1 до 5. В ходе рассмотрения и анализа различных критериев и вариантов расчета мы не смогли вычленить единственно верный критерий для D и O, поэтому решили, что показатель D (вероятность выявления опасности) складывается из яркости клинической картины и инкубационного периода заболевания (табл. 1).
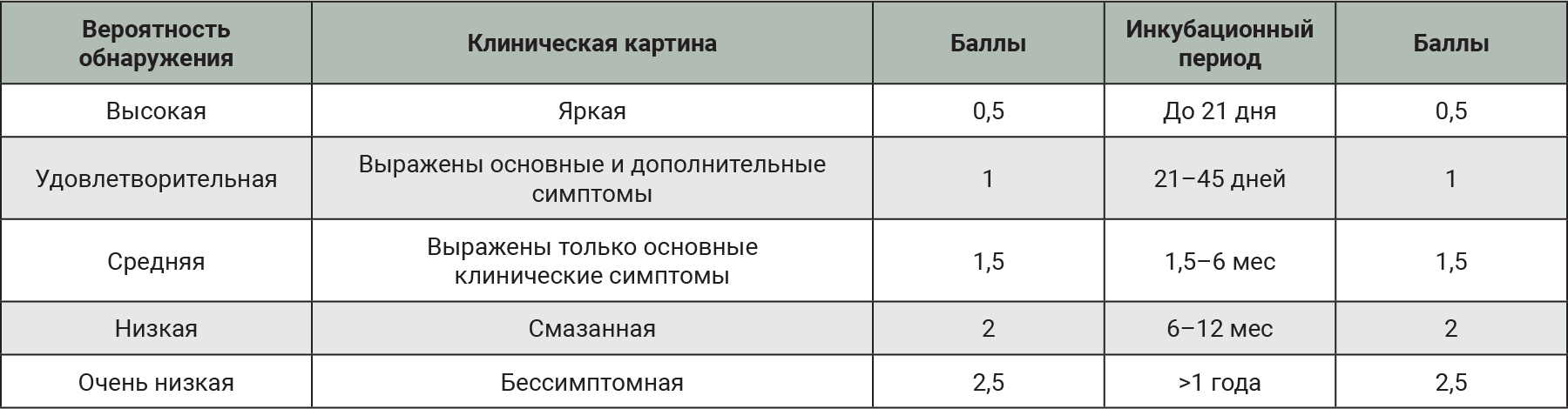
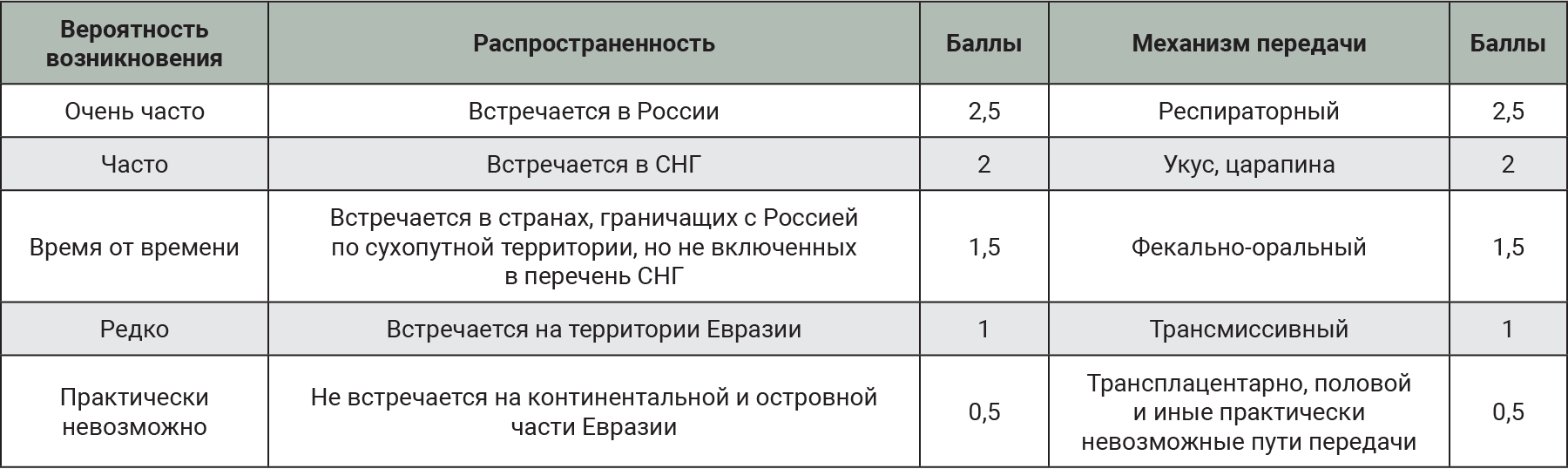
Показатель O должен складываться из суммы баллов по распространенности заболевания и пути передачи (табл. 2). В случае нескольких вариантов пути передачи балл присваивался исходя из наиболее контагиозного.
Тяжесть вреда (S) рассчитывали, исходя из табл. 3.

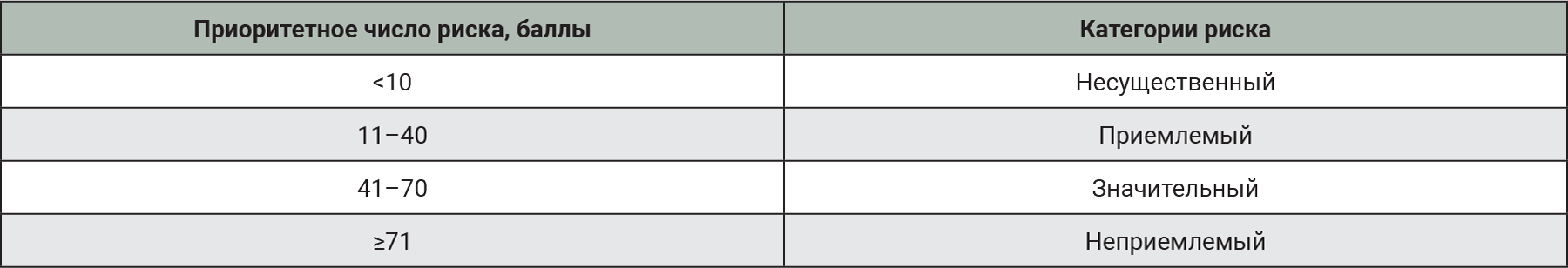
После получения ПЧР производили оценку категорийности риска согласно табл. 4.
Для составления рекомендаций к МЗЖ приматов был проведен анализ с учетом возможности воздействия на риск.
Результаты и обсуждение
Одним из основных критериев для формирования плана по мониторингу здоровья приматов является их востребованность в доклинических и фундаментальных исследованиях. Поэтому на начальном этапе сравнивали использование видов/семейств лабораторных NHP в странах ЕС и число цитированных научных работ на официальном сайте PubMed с участием этих же видов/семейств NHP. Наибольшие количественные показатели были приняты за наиболее привлекательные (рентабельные) виды/семейства. В табл. 5 представлены данные по количеству лабораторных животных согласно Отчету по статистике использования животных в научных целях в государствах Европейского Союза [7] и данным упоминания видов/семейств на официальном сайте PubMed [11].
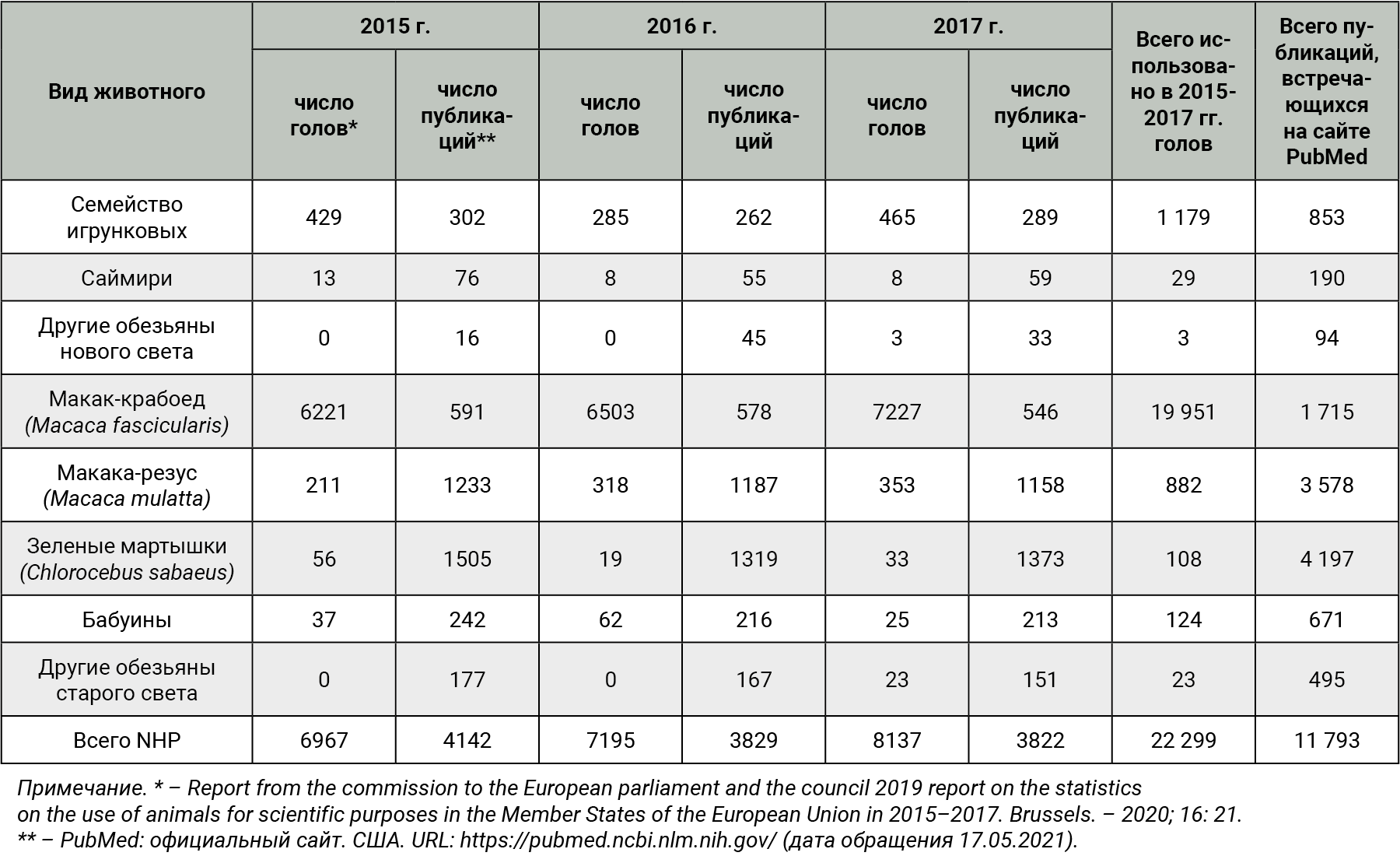
Исходя из данных табл. 5, можно утверждать, что, несмотря на призывы правозащитников животных к снижению использования NHP в экспериментах, наблюдается рост их применения. Наиболее часто используют макак-крабоедов (Macaca fascicularis), за 3 года их число составило 19 951, далее идут игрунковые – 1179 голов. В публикациях чаще всего встречаются макака-резус (Macaca mulatta) и зеленые мартышки (Chlorocebus sabaeus), упоминания о них зарегистрировано в 3578 и 4197 публикациях на PubMed соответственно.
Именно для данных видов провели сравнительный анализ рекомендаций FELASA (2018) с требованиями законодательства об импорте в Российскую Федерацию приматов, а также с методическими рекомендациями (МР) по правилам содержания и работы с обезьянами в карантине при поступлении животных из внешних источников. Данные представлены в табл. 6.
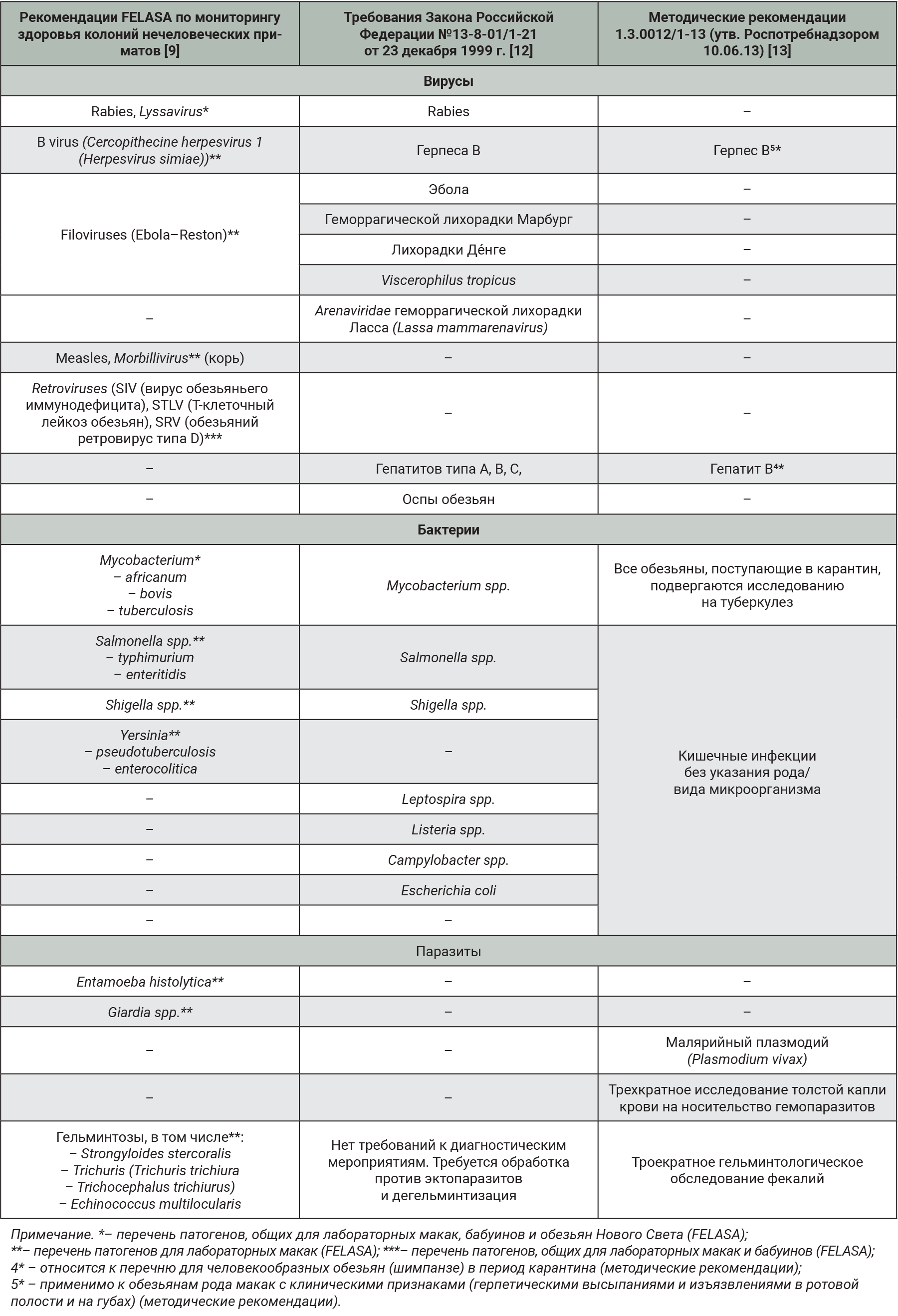
Проводя сравнительный анализ полученных результатов, установили, что все три стандарта солидарны в необходимости проведения исследований на герпесвирус В, туберкулез и гельминтозы. Во всех трех случаях нет рекомендаций по включению арахноэнтомозов и микозов в постоянный план МЗЖ.
Рекомендации FELASA и ФЗ N 13-8-01/1-21 совпадают по ряду вирусных агентов (Rabies, Filoviruses). МР 1.3.0012/1-13 и FELASA существенно различаются и совпадают только в рекомендациях по диагностированию герпеса В. ФЗ №13-8-01/1-21 и МР 1.3.0012/1-13 говорят о необходимости контроля вирусного гепатита. Рекомендации по остальным вирусным агентам разнятся.
Относительно бактериального профиля МР 1.3.0012/1-13 рекомендуют проведение диагностических исследований на кишечные инфекции без указания их вида/рода. В отношении сальмонелл и шигелл мнения ФЗ №13-8-01/1-21 и FELASA совпадают. Кроме того, в программу FELASA входит контроль на иерсиниоз, тогда как федеральный закон требует проверки на лептоспироз, листериоз, кампилобактериоз и эшерихиоз.
В отношении паразитарной инвазии зарубежные специалисты рекомендуют проводить исследования на амебиаз и лямблиоз, российские требования не имеют детализации. Программа методических рекомендаций дополнительно включает исследования для выявления малярийного плазмодия и других гемопаразитозов.
Дополнительно программа FELASA предполагает проведение исследований на дерматофитию при подозрении на нее, а также оставляет на усмотрение учреждения программу по инсектоакарицидным обработкам.
Как видно из представленных данных, несмотря на то что все программы преследуют общую цель, наблюдается довольно много различий в практических рекомендациях и перечне патогенов для осуществления МЗЖ у приматов.
В связи с этим провели оценку рисков по перечню потенциальных заболеваний у приматов, которая была нацелена на условия разведения и содержания приматов в Северо-Западном регионе Российской Федерации. В этом случае руководствовались рядом эпидемиологических соображений.
Согласно принципам надлежащей лабораторной практики, NHP должны содержаться в условиях контролируемой среды. Следовательно, отсутствует риск контакта с дикими животными.
Законодательством РФ к перемещению между субъектами допускаются NHP только из районов, благополучных по заразным болезням животных, в том числе: африканской чумы свиней, африканской чумы лошадей, чумы верблюдов, чумы крупного рогатого скота; ящура; сибирской язвы; геморрагических лихорадок: Ласса, Эбола и Марбург; оспы обезьян; чумы людей.
Отобранные для отправки животные не менее чем на 30 дней помещаются на карантинизацию под наблюдение государственной ветеринарной службы, во время которой проводится поголовный клинический осмотр с обязательной ежедневной термометрией.
Перемещение животных возможно только после проведения процедуры согласования на ввоз животных, которое выдает Управление ветеринарии по Ленинградской области. Прием животных осуществляется принимающей стороной в присутствии государственного ветеринарного врача.
Многие заболевания, которые поражают нечеловекообразных приматов, также могут вызывать заболевания людей. Таким образом, особое внимание следует уделять антропозоонозному потенциалу каждого инфекционного агента. Поскольку в России нет диких или одичавших NHP, риски биобезопасности, связанные с их ввозом, в основном ограничиваются потенциальным занесением болезней человека, хотя может существовать некоторый риск и для других животных.
При первоначальном анализе рисков в список патогенов были включены паразитарные агенты, так как регулярный мониторинг экто- и эндопаразитов и соответствующее лечение являются стандартной практикой в зоопарках и научно-исследовательских институтах, но дальнейшему анализу подвергаются только патогены, предложенные FELASA.
Возбудители болезней, которые поражают нечеловеческих приматов, но не заражают людей или других животных, не были включены в список потенциальных опасностей.
Проанализированы также потенциальные патогены, не регламентированные ни одним из руководящих документов:
а) бактерии: Aeromonas hydrophila, Actinobacillus spp., Actinobaculum spp., Actinomyces spp., Arcanobacterium spp., Bacillus spp., Bacteroides spp., Bordetella bronchiseptica, Burkholderia spp., Chromobacterium violaceum, Clostridium spp., Corynebacterium spp., Coxiella burnetti, Dermatophilus spp., Erysipelothrix spp., Fusobacterium spp., Haemophilus influenza, Helicobacter pylori, Klebsiella spp.,Pasteurella spp., Plesiomonas shigelloides, Proteus spp., Pseudomonas spp., Rhodococcus equi, Serratia marcescens и Streptococcus spp.;
б) патогенные грибы: Absidia spp., Actinomyces spp., Aspergillus fumigates, Candida albicans, Coccidioides immitis, Conidiobolus spp., Cryptococcus neoformans, Entomorphthora spp., Histoplasma spp., Microsporum spp., Mortierella spp., Mucor spp., Paracoccidioides brasiliensis, Pneumocystis carini, Rhizomucor spp., Rhizopus spp., Trichophyton spp. и Trichosporon beigelii;
в) простейшие: Babesia spp., Balantidium spp., Blastocystis hominis, Chilomastix spp., Cyclospora cayentanensis, Cryptosporidium parvum, Eimeria spp., Encephalitozoon cuniculi, Entamoeba spp., Enterocytozoon bienusi, Entopolypoides macaci, Giardia spp., Haemogregarina cynomolgi, Hepatocystis spp., Isospora spp., Neospora spp., Pentatrichomonas spp., Plasmodium spp., Sarcocystis spp., Trichomonas spp., Tritrichomonas spp., Toxoplasma gondii, Troglodytella spp. и Trypanosoma spp.;
г) вирусы: астровирусы, цитомегаловирус (цитомегаловирус африканской зеленой мартышки), вирусы иммунодефицита человека, Т-лимфотропный вирус человека, вирусы гриппа (A, B и C), ротавирусы, вирус краснухи, аденовирусы обезьян, энтеровирус обезьян А, пенистый вирус обезьян и вирус геморрагической лихорадки.
Для данных патогенов была представлена оценка рисков, которая позволила расценить их как несущественные, результаты по ним не указаны.
В табл. 7 приведена оценка рисков для патогенов, рекомендованных к оценке руководящими документами и потенциально представляющих собой значимый риск.
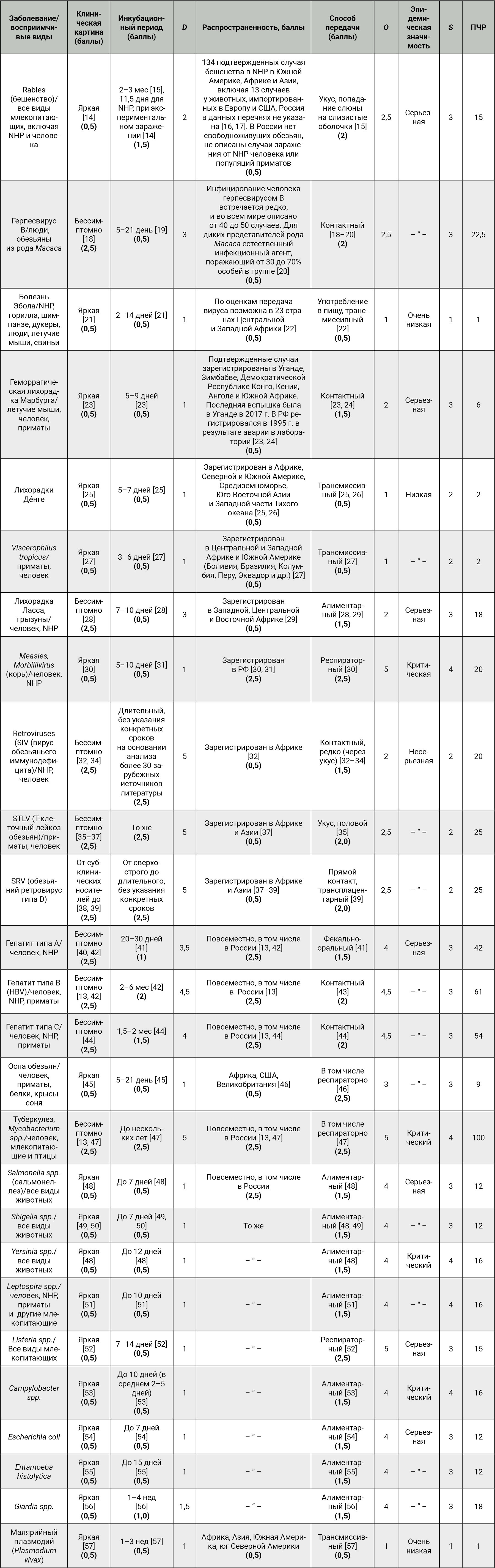
На основании данных табл. 7 выделен перечень патогенов, относящихся к несущественным рискам. ПЧР таких заболеваний, как болезнь Эбола, Марбурга, лихорадка Денге, Viscerophilus tropicus, оспа обезьян и малярия, <10 баллов. Дополнительная оценка и воздействие на риск для данных патогенов нецелесообразен, так же, как и включение в перечень МЗЖ.
Дополнительная оценка и воздействие на риск
На следующем этапе работы для патогенов, набравших ПЧР ≥11 баллов провели дополнительную оценку риска с учетом возможных профилактических мероприятий, а следовательно, и воздействий на риск (табл. 8).
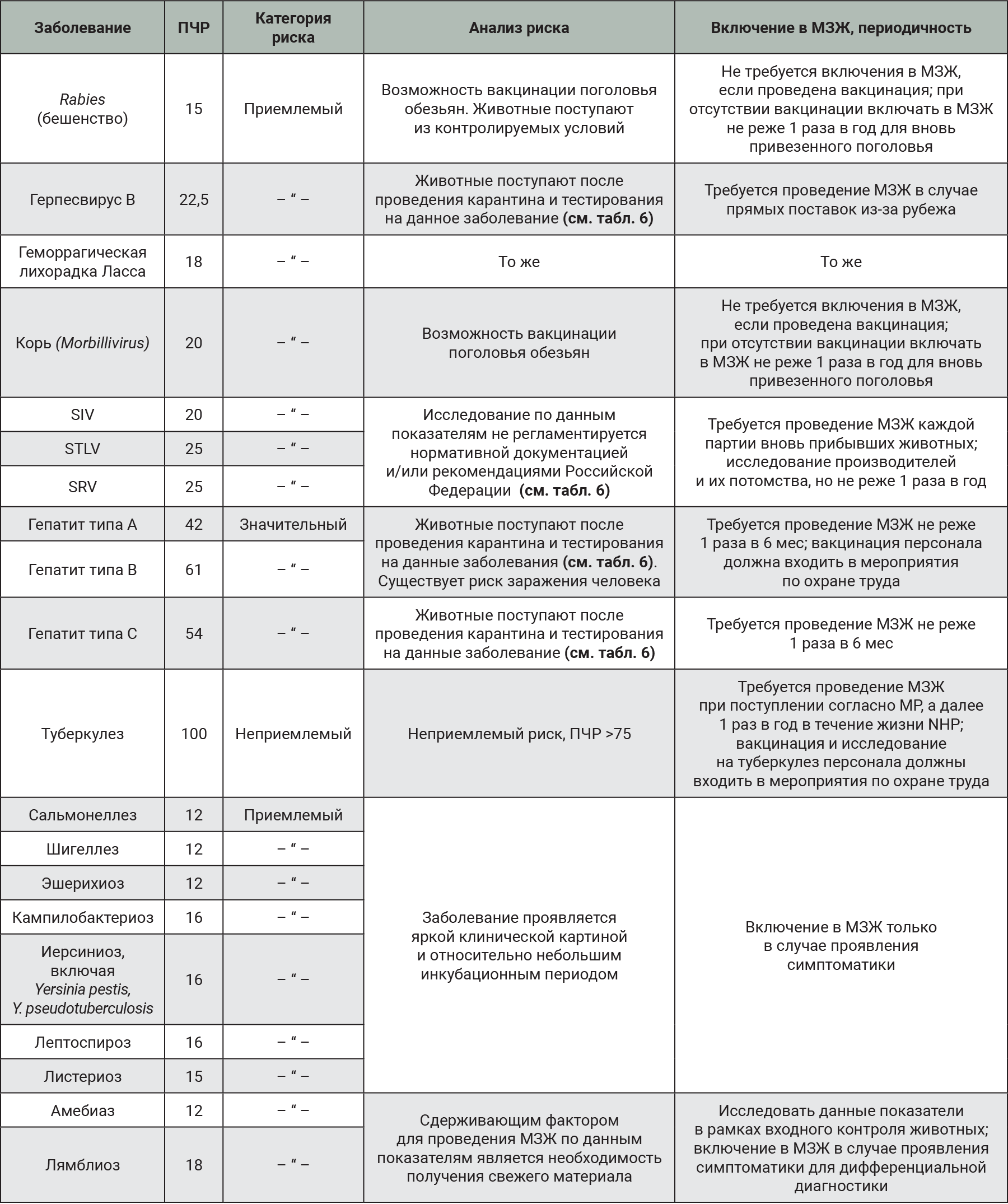
На основании данных, отраженных в табл. 8, мы исключили из МЗЖ для стабильной колонии NHP герпесвирус В и геморрагическую лихорадку Ласса. При ввозе животных из других государств (страны Африки, Азии, Южной и Северной Америки и др.) на животных распространяются требования Закона Российской Федерации №13-8-01/1-21 от 23 декабря 1999 г. По мониторингу других заболеваний целесообразно применять входной, эпизодический, полугодовой и годовой контроль.
Входной контроль, кроме определения основных паразитарных агентов, стоит проводить исследование на наличие амебиаза и лямблиоза, данные протозоонозы необходимо дифференцировать от кишечных инфекций, перечисленных ниже в эпизодическом контроле.
Эпизодический контроль стоит выполнять при выявлении симптомов одного из заболеваний: сальмонеллез, шигеллез, эшерихиоз, кампилобактериоз, иерсиниоз, включая Yersinia pestis, Y. pseudotuberculosis; лептоспироз, листериоз.
Полугодовой МЗЖ следует проводить на наличие гепатитов типа А, В, С.
Годовой контроль следует осуществлять с целью выявления SIV, STLV, SRV и туберкулеза. Если программа превентивных мероприятий не включает вакцинацию обезьян от бешенства и кори, то данные маркеры также необходимо включать в годовую программу МЗЖ.
Заключение
Проведенная оценка рисков подтверждает рекомендации FELASA (2018) и определяет необходимость сопоставления таких факторов, как географическое положение, нормативные требования, распространение и встречаемость тех или иных патогенов для формирования программы МЗЖ в организации. В дополнение можно отметить, что следует учитывать природно-климатические условия и наличие эндемичных для региона видов диких животных, требования страны/региона к ввозу животных из-за рубежа (Требования Закона Российской Федерации N 13-8-01/1-21 от 23 декабря 1999 г.). Необходимо также учитывать видовую восприимчивость приматов к тем или иным патогенным агентам.
По результатам изложенного сделаны следующие выводы:
1. Наиболее часто используемыми в доклинических исследованиях видами NHP являются макак-крабоед (Macaca fascicularis), макака-резус (Macaca mulatta), зеленые мартышки (Chlorocebus sabaeus) и игрунковые.
2. Анализируя рекомендации FELASA (2018), Требования Закона Российской Федерации N 13-8-01/1-21 от 23 декабря 1999 г. и Методические рекомендации 1.3.0012/1-13, установили, что во всех вышеперечисленных нормативных документах общим указанием является лишь необходимость проведения исследований на герпесвирус В, туберкулез и гельминтозы. Во всех трех случаях нет рекомендаций по включению арахноэнтомозов и микозов в постоянный план МЗЖ.
3. Рекомендации по проведению мониторинга здоровья у лабораторных приматов в условиях их разведения и содержания в Северо-Западном регионе России должны включать входной, эпизодический, полугодовой и годовой контроль. Входной контроль, кроме основных паразитарных агентов, стоит проводить на наличие амебиаза и лямблиоза. Эпизодический контроль выполняют для выявления сальмонеллеза, шигеллеза, эшерихиоза, кампилобактериоза, иерсиниоза, включая Yersinia pestis, Y. pseudotuberculosis; лептоспироза, листериоза. Полугодовой МЗЖ следует проводить по гепатитам типа А, В, С. Годовой контроль – по SIV, STLV, SRV и туберкулезу. Годовой МЗЖ должен включать выявление патогенных агентов бешенства и кори, если не предусмотрена вакцинация животных против этих заболеваний.
Риск-ориентированный подход к мониторингу здоровья приматов в неизменном или модернизированном виде может быть использован в качестве удобного и достаточно надежного инструмента при оценке и в других регионах.
Благодарности
Работа выполнена без спонсорской поддержки.
Вклад авторов:
Д.Ю. Акимов – оформление статьи, обобщение результатов исследования, ответственность за все аспекты работы, связанные с достоверностью данных.
М.Н. Макарова – идея, критический пересмотр статьи, утверждение окончательного варианта статьи для публикации.
М.А. Акимова – сбор и систематизация данных научной литературы.
Е.Д. Бондарева – сбор и систематизация данных научной литературы.
С.О. Хан – сбор и систематизация данных научной литературы.
Сведения о конфликте интересов
Авторы заявляют об отсутствии конфликта интересов.
Список источников
- Динец В.Л., Ротшильд Е.В. Звери Энциклопедия природы России // – Москва. – ABF. – 1998. – 344 с. [Dinets V.L., Rotshil'd E.V. Zveri "Entsiklopediya prirody Rossii" // – Moskva. – ABF. – 1998. – 344 s. (In Russ.)]
- Федеральное государственное бюджетное научное учреждение "научно-исследовательский институт медицинской приматологии": официальный сайт. – Адлер. URL: http://primatologia.ru/istoriya (дата обращения: 22.03.2021). [Federal'noe gosudarstvennoe byudzhetnoe nauchnoe uchrezhdenie "nauchno-issledovatel'skii institut meditsinskoi primatologii": ofitsial'nyi sait. – Adler. URL: http://primatologia.ru/istoriya (data obrashcheniya: 22.03.2021). (In Russ.)]
- Карал-оглы Д.Д. Приматы как востребованная тест-система современной экспериментальной науки (краткое сообщение). Лабораторные животные для научных исследований. 2019; 4. doi.org/10.29296/2618723X-2019-04-10 [Karal-ogly D.D. Primaty kak vostrebovannaya test-sistema sovremennoi eksperimental'noi nauki (kratkoe soobshchenie). Laboratornye zhivotnye dlya nauchnykh issledovanii. 2019; 4. doi.org/10.29296/2618723X-2019-04-10 (In Russ.)]
- Hart B.A, Abbott D.H, Nakamura K, Fuchs E. The marmoset monkey: a multi-purpose preclinical and translational model of human biology and disease // Drug Discov Today. – 2012. – V 17. – P. 1160-1165. doi: 10.1016/j.drudis.2012.06.009.
- Петербургский журнал Город 812: официальный сайт. Санкт-Петербург. URL: https://gorod-812.ru/zachem-nam-obezyanyi-iz-vetnama (дата обращения: 22.03.2021) [Peterburgskii zhurnal Gorod 812: ofitsial'nyi sait. Sankt-Peterburg. URL: https://gorod-812.ru/zachem-nam-obezyanyi-iz-vetnama (data obrashcheniya: 22.03.2021). (In Russ.)]
- Royal Society for the Prevention of Cruelty to Animals (RSPCA): официальный сайт. Великобритания. URL: https://www.rspca.org.uk/adviceandwelfare/laboratory (дата обращения: 27.05.2021) [Royal Society for the Prevention of Cruelty to Animals (RSPCA): ofitsial'nyi sait. Velikobritaniya. URL: https://www.rspca.org.uk/adviceandwelfare/laboratory (data obrashcheniya: 27.05.2021) (In Russ.)]
- Report from the commission to the european parliament and the council 2019 report on the statistics on the use of animals for scientific purposes in the Member States of the European Union in 2015-2017. – Brussels. – 2020. – V 16. – Р. 21.
- Friedman H., Ator N., Haigwood N., Newsome W., Allan J.S., Golos T.G., Bianchi P. The critical role of nonhuman primates in medical research //Pathogens & immunity. – 2017. – V. 2. – №. 3. – P. 352. doi: 10.20411/pai.v2i3.186
- Balansard I., Cleverley L., Cutler K.L., Spångberg M.G., Thibault-Duprey K., Langermans J.A. Revised recommendations for health monitoring of non-human primate colonies (2018): FELASA Working Group Report //Laboratory animals. – 2019. – V. 53. – №. 5. – P. 429-446
- Importation of captive non-human primates Review of import conditions Final Report // Australian Government Department of Agriculture and Water Resources. -. 2017. – P. 77.
- PubMed: официальный сайт. США. . URL: https://pubmed.ncbi.nlm.nih.gov/ (дата обращения 17.05.2021) [PubMed: ofitsial'nyi sait. SShA. . URL: https://pubmed.ncbi.nlm.nih.gov/ (data obrashcheniya 17.05.2021) (In Russ.)]
- Российская Федерация. Законы. Ветеринарные требования при импорте в Российскую Федерацию приматов N 13-8-01/1-21 от 23 декабря 1999 года утверждены Министерством сельского хозяйства Российской Федерации Текст: непосредственный. [Rossiiskaya Federatsiya. Zakony. Veterinarnye trebovaniya pri importe v Rossiiskuyu Federatsiyu primatov N 13-8-01/1-21 ot 23 dekabrya 1999 goda utverzhdeny Ministerstvom sel'skogo khozyaistva Rossiiskoi Federatsii Tekst: neposredstvennyi. (In Russ.)]
- Лапин Б.А., Джикидзе Э.К., Яковлева Л.Я., Егорова Т.И., Корзая Л.И. Болезни обезьян, опасные для человека. Правила содержания и работы с обезьянами в карантине при поступлении животных из внешних источников, а также при экспериментальном инфицировании: Методические рекомендации. МР 1.3.0012/1-13 / М.: Федерал. центр гигиены и эпидемиологии Роспотребнадзора. 2014. 52 с. [Lapin B.A., Dzhikidze E.K., Yakovleva L.Ya., Egorova T.I., Korzaya L.I. Bolezni obez'yan, opasnye dlya cheloveka. Pravila soderzhaniya i raboty s obez'yanami v karantine pri postuplenii zhivotnykh iz vneshnikh istochnikov, a takzhe pri eksperimental'nom infitsirovanii: Metodicheskie rekomendatsii. MR 1.3.0012/1-13 / M.: Federal. tsentr gigieny i epidemiologii Rospotrebnadzora. 2014. 52 s. (In Russ.)].
- Reaves E.J., Salmón-Mulanovich G., Guevara C., Kochel T.J., Steinbach T.J., Bentzel D.E., Montgomery J.M. Susceptibility and lack of evidence for a viremic state of rabies in the night owl monkey, Aotus nancymaae //Virology journal. – 2012. – V. 9. – №. 1. – P. 1-9.
- Всемирная организация здравоохранения (ВОЗ) официальный сайт. Россия. URL: https://www.who.int/news-room/fact-sheets/detail/rabies (дата обращения: 29.05.2021) [Vsemirnaya organizatsiya zdravookhraneniya (VOZ) ofitsial'nyi sait. Rossiya. URL: https://www.who.int/news-room/fact-sheets/detail/rabies (data obrashcheniya: 29.05.2021 (In Russ.)]
- Gautret P., Blanton J., Dacheux L., Ribadeau-Dumas F., Brouqui P., Parola P., Esposito D.H., Bourhy H. Rabies in nonhuman primates and potential for transmission to humans: a literature review and examination of selected French national data // PLoS Negl Trop Dis. – 2014. – V. 8. – №. 5. – P. e2863. doi: 10.1371 / journal.pntd.0002863
- Gautret P., Blanton J., Dacheux L., Ribadeau-Dumas F., Brouqui P., Parola P., Esposito D.H., Bourhy H. Correction: Rabies in Nonhuman Primates and Potential for Transmission to Humans: A Literature Review and Examination of Selected French National Data //PLoS Negl Trop Dis. – 2015. - V. 9. – №. 5. – P. e0003799.
- Huff J. L., Barry P. A. B-virus (Cercopithecine herpesvirus 1) infection in humans and macaques: potential for zoonotic disease //Emerging infectious diseases. – 2003. – V. 9. – №. 2. – Р. 246-250. doi: 10.3201/eid0902.020272
- Elmore D., Eberle R. Monkey B virus (Cercopithecine herpesvirus 1) //Comparative medicine. – 2008. – V. 58. – №. 1. – Р. 11-21.
- Cohen J.I., Davenport D.S., Stewart J.A., Deitchman S., Hilliard J.K., Chapman L.E., B Virus Working Group Recommendations for prevention of and therapy for exposure to B virus (Cercopithecine herpesvirus 1) //Clinical Infectious Diseases. – 2002. – V. 35. – №. 10. – P. 1191-1203.
- Gumusova S., Sunbul M., Leblebicioglu H. Ebola virus disease and the veterinary perspective //Annals of clinical microbiology and antimicrobials. – 2015. – V. 14. – №. 1. – Р. 30 doi: 10.1186 / s12941-015-0089-x
- Devaux C.A., Mediannikov O., Medkour H., Raoult D. Infectious disease risk across the growing human-non human primate interface: A review of the evidence //Frontiers in public health. – 2019. – V. 7. – Р. 305.
- Mehedi M., Groseth A., Feldmann H., Ebihara H. Clinical aspects of Marburg hemorrhagic fever //Future virology. – 2011. – V. 6. – №. 9. – Р. 1091-1106 doi: 10.2217/fvl.11.79
- Всемирная организация здравоохранения (ВОЗ) официальный сайт. Рос-сия. URL: https://www.afro.who.int/health-topics/marburg-haemorrhagic-fever (дата обра-щения: 29.05.2021) [Vsemirnaya organizatsiya zdravookhraneniya (VOZ) ofitsi-al'nyi sait. Rossiya. URL: https://www.afro.who.int/health-topics/marburg-haemorrhagic-fever (data obrashcheniya: 29.05.2021 (In Russ.)]
- Murugesan A., Manoharan M. Dengue Virus //Emerging and Reemerging Viral Pathogens. – Academic Press, 2020. – Р. 281-359. doi: 10.1016 / B978-0-12-819400-3.00016-8
- Всемирная организация здравоохранения (ВОЗ) официальный сайт. Рос-сия. URL: https://www.who.int/news-room/fact-sheets/detail/dengue-and-severe-dengue (дата обра-щения: 29.05.2021) [Vsemirnaya organizatsiya zdravookhraneniya (VOZ) ofitsi-al'nyi sait. Rossiya. URL: https://www.who.int/news-room/fact-sheets/detail/dengue-and-severe-dengue (data obrashcheniya: 29.05.2021 (In Russ.)]
- Жаворонок С.В., Мицура В.М., Красавцев Е.Л., Михайлов М.И., Карпов И.А., Семенов В.М. Тропические и паразитарные болезни // — Минск. – Высшая школа. – 2014. — 400 c. [Zhavoronok S.V., Mitsura V.M., Krasavtsev E.L., Mikhailov M.I., Karpov I.A., Semenov V.M. Tropicheskie i parazitarnye bolezni // — Minsk. – Vysshaya shkola. – 2014. — 400 s. (In Russ.)]
- Hallam H.J., Hallam S., Rodriguez S.E., Barrett A.D., Beasley D.W., Chua A., Reece L.M. Baseline mapping of Lassa fever virology, epidemiology and vaccine research and development //Npj Vaccines. – 2018. – V. 3. – №. 1. – Р. 1-12. doi: 10.1038 / s41541-018-0049-5
- Ogunro B.N., Olugasa B.O., Kayode A., Ishola O.O., Kolawole O.N., Odigie E.A., Happi C. Detection of antibody and antigen for Lassa virus nucleoprotein in monkeys from southern Nigeria //Journal of epidemiology and global health. – 2019. – V. 9. – №. 2. – Р. 125. doi: 10.2991/jegh.k.190421.001
- Takeda M., Seki F., Yamamoto Y., Nao N., Tokiwa H. Animal morbilliviruses and their cross-species transmission potential //Current opinion in virology. – 2020. – V. 41. – Р. 38-45. doi: 10.1016 / j.coviro.2020.03.005
- Корзая Л.И., Догадов Д.И., Гончаренко А.М., Лапин Б.А. Сравнительное изучение противокоревого иммунитета у взрослого населения города сочи и обезьян адлерского приматологического центра// Журнал микробиологии, эпидемиологии и иммунобиологии. – 2019. – № 2. – С. 61-67. [Korzaya L.I., Dogadov D.I., Goncharenko A.M., Lapin B.A. Sravnitel'noe izuchenie protivokorevogo immuniteta u vzroslogo naseleniya goroda sochi i obez'yan adlerskogo primatologicheskogo tsentra// Zhurnal mikrobiologii, epidemiologii i immunobiologii. – 2019. – № 2. – S. 61-67. (In Russ.)]
- Van der Kuyl A.C. Contemporary Distribution, Estimated Age, and Prehistoric Migrations of Old World Monkey Retroviruses //Epidemiologia. – 2021. – V. 2. – №. 1. – Р. 46-67. doi.org/10.3390/epidemiologia2010005
- Steve, A.M., Ahidjo A., Placide M.K., Caroline F., Mukulumanya M., Simon-Pierre N.K., Martine P. High prevalences and a wide genetic diversity of simian retroviruses in non-human primate bushmeat in rural areas of the Democratic Republic of Congo //EcoHealth. – 2017. – V. 14. – №. 1. – Р. 100-114 doi: 10.1007 / s10393-016-1202-0
- Locatelli S., Peeters M. Cross-species transmission of simian retroviruses: how and why they could lead to the emergence of new diseases in the human population //Aids. – 2012. – V. 26. – №. 6. – Р. 659-673. doi: 10.1097/QAD.0b013e328350fb68
- Mahieux R., Chappey C., Georges-Courbot M.C., Dubreuil G., Mauclere P., Georges A., Gessain A. Simian T-cell lymphotropic virus type 1 from Mandrillus sphinx as a simian counterpart of human T-cell lymphotropic virus type 1 subtype D //Journal of virology. – 1998. – V. 72. – №. 12. – Р. 10316-10322. doi: 10.1128 / JVI.72.12.10316-10322.
- Liégeois F., Boué V., Mouacha F., Butel C., Ondo B.M., Pourrut X., Rouet, F. New STLV-3 strains and a divergent SIVmus strain identified in non-human primate bushmeat in Gabon //Retrovirology. – 2012. – V. 9. – №. 1. – Р. 1-16. doi: 10.1186 / 1742-4690-9-28
- Peeters M., Delaporte E. Simian retroviruses in African apes //Clinical microbiology and infection. – 2012. – V. 18. – №. 6. – Р. 514-520. doi.org/10.1111/j.1469-0691.2012.03843.x
- Frenkel L.M., Kuller L., Beck I.A., Tsai C.C., Joy J.P., Mulvania T.M., Anderson D.M. Immunization by exposure to live virus (SIVmne/HIV-2287) during antiretroviral drug prophylaxis may reduce risk of subsequent viral challenge //Plos one. – 2021. – V. 16. – №. 4. – Р. e0240495. doi.org/10.1371/journal.pone.0240495
- Lerche N. W. Simian retroviruses: infection and disease—implications for immunotoxicology research in primates //Journal of immunotoxicology. – 2010. – V. 7. – №. 2. – С. 93-101. doi.org/10.3109/15476911003657406
- Balayan M.S. Natural hosts of hepatitis A virus // Vaccine. -1992. - V.10 - Issue 1 - P. S27-31
- Robertson B. H. Viral hepatitis and primates: historical and molecular analysis of human and nonhuman primate hepatitis A, B, and the GB‐related viruses //Journal of viral hepatitis. – 2001. – V. 8. – №. 4. – Р. 233-242.
- Dogadov D.I., Korzaya L.I., Karlsen A.A., Kyuregyan K.K. Molecular genetic identification of isolates of the hepatitis A virus (HAV) from monkeys at Adler Primate Center //Journal of medical primatology. – 2018. – V. 47. – №. 2. – Р. 87-92. doi.org/10.1111/jmp.12333
- Müller S.F., König A., Döring B., Glebe D., Geyer J. Characterisation of the hepatitis B virus cross-species transmission pattern via Na+/taurocholate co-transporting polypeptides from 11 New World and Old World primate species //PLoS One. – 2018. – V. 13. – №. 6. – Р. e0199200. doi.org/10.1371/journal.pone.0199200
- Berggren K.A., Suzuki S., Ploss A. Animal models used in hepatitis C virus research //International journal of molecular sciences. – 2020. – V. 21. – №. 11. – Р. 3869. doi.org/10.3390/ijms21113869
- de Vries R. D., Kuiken T., de Swart R. L. Morbillivirus Infections in Non-human Primates: From Humans to Monkeys and Back Again //Neglected Diseases in Monkeys. – Springer. – Cham. – 2020. – Р. 205-231.
- Всемирная организация здравоохранения (ВОЗ) официальный сайт. Рос-сия. URL: https://www.who.int/health-topics/monkeypox/#tab=tab_2 (дата обра-щения: 29.05.2021) [Vsemirnaya organizatsiya zdra-vookhraneniya (VOZ) ofitsi-al'nyi sait. Rossiya. URL: https://www.who.int/health-topics/monkeypox/#tab=tab_2 (data obrashcheniya: 29.05.2021 (In Russ.)]
- Mendoza A. P., Mitman S., Rosenbaum M. H. Mycobacterial Infections in Monkeys //Neglected Diseases in Monkeys. – Springer. – Cham. – 2020. – Р. 41-94.
- Bezerra-Santos M.A., Mendoza-Roldan J.A., Thompson R.A., Dantas-Torres F., Otranto D. Illegal wildlife trade: a gateway to zoonotic infectious diseases //Trends in Parasitology. – 2021.– V. 37. – №. 3. – Р. 181-184..
- Balasubramaniam K.N., Malaivijitnond S., Kemthong T., Meesawat S., Hamada Y., Jeamsripong S., Atwill E. Prevalence of Enterobacteriaceae in Wild Long-Tailed Macaques (Macaca fascicularis) in Thailand //International Journal of Primatology. – 2021. – Р. 1-5. doi.org/10.1007/s10764-021-00209-3
- Balasubramaniam K.N., Malaivijitnond S., Kemthong T., Meesawat S., Hama-da Y., Jeamsripong S., Atwill E. Correction to: Prevalence of Enterobacteriaceae in Wild Long-Tailed Macaques (Macaca fascicularis) in Thailand doi.org/10.1016/j.pt.2020.12.005
- Cilia G., Bertelloni F., Albini S., Fratini, F. Insight into the Epidemiology of Leptospirosis: A Review of Leptospira Isolations From “Unconventional” Hosts //Animals. – 2021. – V. 11. – №. 1. – Р. 191. doi.org/10.3390/ani11010191
- D'Orazio S. E. F. Animal models for oral transmission of Listeria monocytogenes //Frontiers in cellular and infection microbiology. – 2014. – V. 4. – Р. 15-21. doi.org/10.3389/fcimb.2014.00015
- Tegner C., Sunil-Chandra N.P., Wijesooriya W.R.P.L.I., Perera B.V., Hansson I., Fahlman Å. Detection, Identification, and Antimicrobial Susceptibility of Campylobacter spp. and Salmonella spp. from Free-ranging Nonhuman Primates in Sri Lanka //Journal of wildlife diseases. – 2019. – V. 55. – №. 4. – Р. 879-884.
- Foster-Nyarko E., Alikhan N. F., Ravi A., Thilliez G., Thomson N. M., Baker D., Pallen M. J. Genomic diversity of Escherichia coli isolates from non-human primates in the Gambia //Microbial genomics. – 2020. – V. 6. – №. 9. mgen000428. Published online 2020 Sep 14. doi: 10.1099/mgen.0.000428
- Elsheikha H. M., Regan C. S., Clark C. G. Novel Entamoeba findings in nonhuman primates //Trends in parasitology. – 2018. – V. 34. – №. 4. – Р. 283-294. doi.org/10.1016/j.pt.2017.12.008
- Mravcová K., Štrkolcová G., Mucha R., Goldová M. Zoonotic assemblages of Giardia duodenalis in captive non-human primates from the largest zoo in Slovakia //Journal of Parasitic Diseases. – 2020. – Р. 1-4.
- Antinori S., Bonazzetti C., Giacomelli A., Corbellino M., Galli M., Parravicini, C., Ridolfo A.L. Non-human primate and human malaria: past, present and future //Journal of Travel Medicine. – 2021. doi.org/10.1093/jtm/taab036



