Характеристика модели асцитной карциномы Эрлиха и перспективы ее применения в экспериментальной фармакологии ветеринарных препаратов
Работа выполнена без спонсорской поддержки.
Востроилова Г.А., Хохлова Н.А., Шабанов Д.И., Михайлов Е.В., Корчагина А.А., Шабунин Б.В., Некрасов А.В. Характеристика модели асцитной карциномы Эрлиха и перспективы ее применения в экспериментальной фармакологии ветеринарных препаратов. Лабораторные животные для научных исследований. 2023; 3. https://doi.org/10.57034/2618723X-2023-03-10
Резюме
В статье приведен обзор наиболее значимых трудов отечественных и зарубежных авторов, посвященных биологической модели асцитной карциномы Эрлиха. Анализ доступных источников литературы показал, что, несмотря на длительную историю существования данной модели и использование в биомедицинских исследованиях, в ветеринарии она пока не получила широкого распространения. Следует отметить, что модель асцитной карциномы Эрлиха обладает рядом особенностей, позволяющих использовать ее для нужд ветеринарной медицины, в частности экспериментальной фармакологии на этапе разработки и доклинических испытаний препарата. Высокая устойчивость малигнизированных клеток и приживаемость опухоли у экспериментальных животных, а также простота ее культивирования и относительно быстрый опухолевый рост делают данную модель удобным биологическим объектом для исследований. Воздействие опухолевых клеток на организм животного-опухоленосителя приводит к изменению ряда биохимических показателей различных тканей и органов и общему токсическому действию. При этом наблюдается разбалансировка свободно-радикальной и антиоксидантной систем, организм подвергается оксидативному стрессу. Иммунная система под действием асцитной карциномы Эрлиха также претерпевает ряд изменений. Так, в ответ на развитие опухолеиндуцированных патологических процессов наблюдаются рекрутирование иммунокомпетентных клеток и противоопухолевая иммунная реакция, которая вместе с тем подавляется по мере роста клеток карциномы под действием продуцируемых опухолью иммуносупрессирующих физиологически активных соединений, ускользания клеток опухоли от иммунологического надзора и ремоделирования иммунных клеток в опухолевом микроокружении. Данные процессы приводят к угнетению иммунной системы и в итоге к гибели животных. Эти особенности позволяют использовать модель перевиваемой асцитной карциномы Эрлиха для испытания новых препаратов ветеринарного назначения, обладающих потенциальными антибластомными, иммуномодулирующими, антитоксическими свойствами, а также лекарственных составов для восстановления биохимических показателей и окислительно-восстановительного гомеостаза в условиях опухолеиндуцированной иммуносупрессии и хронического воспалительного процесса, а также исследовать механизмы адаптации клеток, в том числе иммунной системы, в условиях действия факторов канцерогенеза.
Введение
Проблема изыскания новых высокоэффективных фармакологических веществ по сей день не теряет своей актуальности [1]. В настоящее время биологическое моделирование различных патологических процессов является важнейшим методом научного познания, что определяет необходимость создания на лабораторных животных таких экспериментальных моделей, которые наиболее адекватно отражали бы патогенез возникновения, особенности течения и исход, возможность воздействия на происходящие процессы, а также механизмы выздоровления [2].
Проведение доклинических исследований лекарственных средств, в том числе предназначенных для ветеринарного применения, включает целый спектр методов экспериментальной фармакологии. Экспериментальные модели широко используются для выявления фармакологических свойств лекарственных веществ различных групп, что позволяет воссоздать в модельном организме определенное состояние, например, формирование иммуносупрессии для подтверждения эффекта новых иммуномодуляторов; установления потенциальных антибластомных свойств путем инициации опухолевого роста; моделирования искусственного инфекционного процесса при отработке схем назначения антибактериальных препаратов, а также определения безопасности, профилактической и терапевтической эффективности препаратов [3–5].
Одной из самых распространенных экспериментальных моделей опухолевого роста является асцитная карцинома Эрлиха (АКЭ). Исходной опухолью для нее послужил спонтанный рак молочной железы у самок мышей, полученный в 1905 г. двумя исследователями — Р. Ehrlich и Н. Apolant [6]. Они использовали ее в качестве экспериментальной путем подкожной трансплантации клеток карциномы от мыши к мыши. В 1932 г. Loewenthal и Jahn получили жидкую форму данной опухоли путем введения раковых клеток в перитонеальную полость, в результате чего образовывалась взвесь клеток карциномы в асцитной жидкости. Эти исследователи и предложили назвать данную опухоль «асцитная карцинома Эрлиха» [7].
Методика воспроизведения модели карциномы Эрлиха
Клетки АКЭ поддерживают in vivo в форме асцита у белых беспородных лабораторных мышей путем серийного внутрибрюшинного пассажа с интервалом 4–7 сут. Мыши содержатся в стандартных условиях вивария при свободном доступе к корму и воде и находятся под ежедневным наблюдением и контролем опухолевой прогрессии [8].
При моделировании асцитного варианта опухоли используют 7-дневную суспензию клеток аденокарциномы Эрлиха, перевиваемую на белых беспородных лабораторных мышах-самках массой 18–20 г. Для трансплантации опухоли опытным мышам интроперитонеально вводят по 3×106 опухолевых клеток на мышь в объеме 0,2 мл с раствором Хенкса (pH 7,4). Для взятия асцитной жидкости животное-опухоленоситель выводят из эксперимента путем передозировки СО2 в специальной камере и фиксируют в положении на спине на специальном столике. Кожу с шерстным покровом в области вентральной брюшной стенки обрабатывают ватным тампоном, смоченным 70° этиловым спиртом, стерильным шприцем отбирают асцитную жидкость, используя чрезбрюшинный доступ [8].
При индукции солидного варианта опухоли суспензию первичных клеток аденокарциномы Эрлиха (1,5×106 кл/мышь) в 0,2 мл раствора Хенкса трансплантируют подкожно во внутреннюю часть бедра правой задней лапы экспериментальных животных белых лабораторных мышей [9].
Влияние исследуемых фармакологических веществ на опухолевый процесс можно исследовать как на стадии формирования, так и интенсивного роста опухоли. В первом случае ведут наблюдение за экспериментальными животными, в период которого фиксируют изменение количества животных с опухолью и размера опухоли (средний объем опухоли) в каждой группе животных [10].
В терминальные сутки эксперимента животных подвергают эвтаназии путем передозировки СО2, после чего препарируют и отделяют поверхностный пласт опухолевой ткани для оценки массы опухоли. Эффективность противоопухолевой терапии исследуемыми соединениями оценивают по торможению роста опухоли в процентах в каждой группе животных-опухоленосителей [9, 10].
Цитологические особенности форм АКЭ
Таким образом, аденокарцинома Эрлиха может существовать в виде двух штаммов: асцитного и подкожного (солидного).
У асцитной формы аденокарциномы Эрлиха клетки имеют округлую форму и диаметр около 30–40 мкм, хотя и имеет место значительная вариабельность вследствие неоднородности материала (плоидности) и разных стадий развития клеток [11].
Ядро занимает значительную часть клетки (рис. 1). Некоторые авторы отмечают его неправильную форму, наличие лопастей и выростов. Цитоплазматическая мембрана клеток АКЭ схожа с таковой у большинства клеток животного происхождения, имеет двойную структуру и пронизана порами диаметром около 30–40 нм [11]. Она не имеет каких-либо специализированных структур, однако образует амебоидные выросты, при помощи которых осуществляется движение клетки в асцитной жидкости и увеличивается ее поверхность. Кроме того, данное образование участвует в активном захвате адсорбированного на наружной мембране вещества и окружающей жидкости (различные виды пиноцитоза) [11]. Основные органеллы асцитной клетки [эндоплазматический ретикулум (ЭПР), аппарат Гольджи, митохондрии] не отличаются по строению от таковых у нормотипичных клеток. Клетки АКЭ насыщены митохондриями удлиненной, чаще неправильной формы. Обычно они расположены неравномерно, так же как и ЭПР, концентрируясь с вогнутой стороны ядра и образуя зону интенсивного обмена [11, 12].
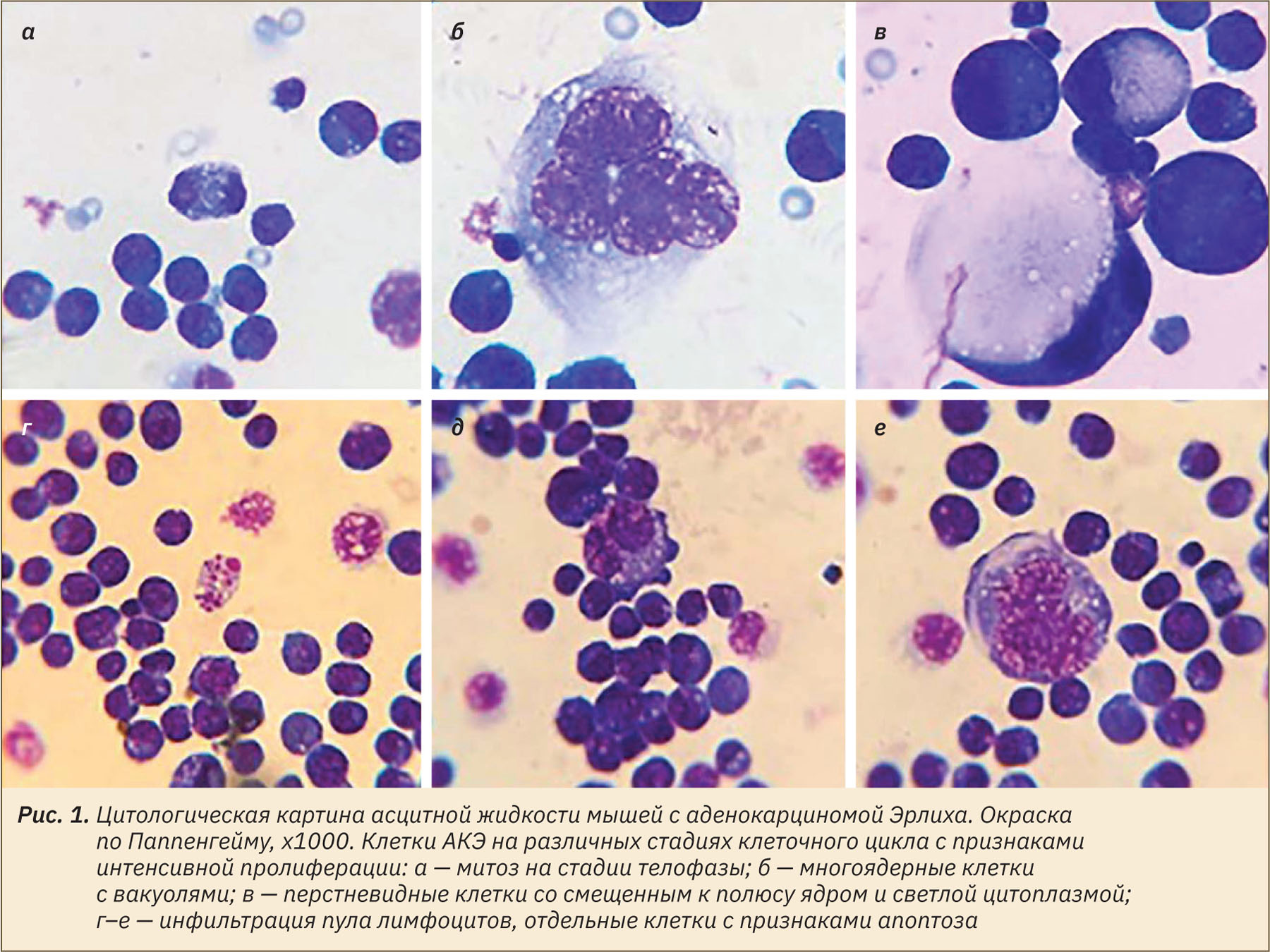
Состав ДНК-липидов, хроматин-липидов и ядерных матрикссвязанных липидов в опухолевых клетках значительно отличается от состава этих липидов в нормальных клетках. Почти во всех клетках АКЭ присутствует метацентрическая хромосома. Также обнаруживаются хромосомы со спорной вторичной перетяжкой. Особенно часто эти хромосомы встречаются в гипердиплоидной линии. Все остальные хромосомы акроцентрические и различаются только размерами [7].
Асцитная жидкость с клетками карциномы Эрлиха обычно имеет серо-белый цвет, иногда розоватый оттенок и в среднем содержит 1×106 клеток неоплазмы в 1 мл. Клетки АКЭ не прикрепляются к синтетическим поверхностям и растут в брюшной полости в виде суспензии. На 4-е или 6-е сутки роста АКЭ в брюшной полости мыши накапливается около 5–12 мл асцита [7].
Характеристика фаз развития АКЭ
Латентный период после инокуляции опухолевых клеток составляет около 4–6 дней. Средняя продолжительность жизни мышей при внутрибрюшинном введении 10–16 дней [13].
Рост опухоли происходит неравномерно, что проявляется в фазном изменении количества опухолевых клеток (рис. 2).
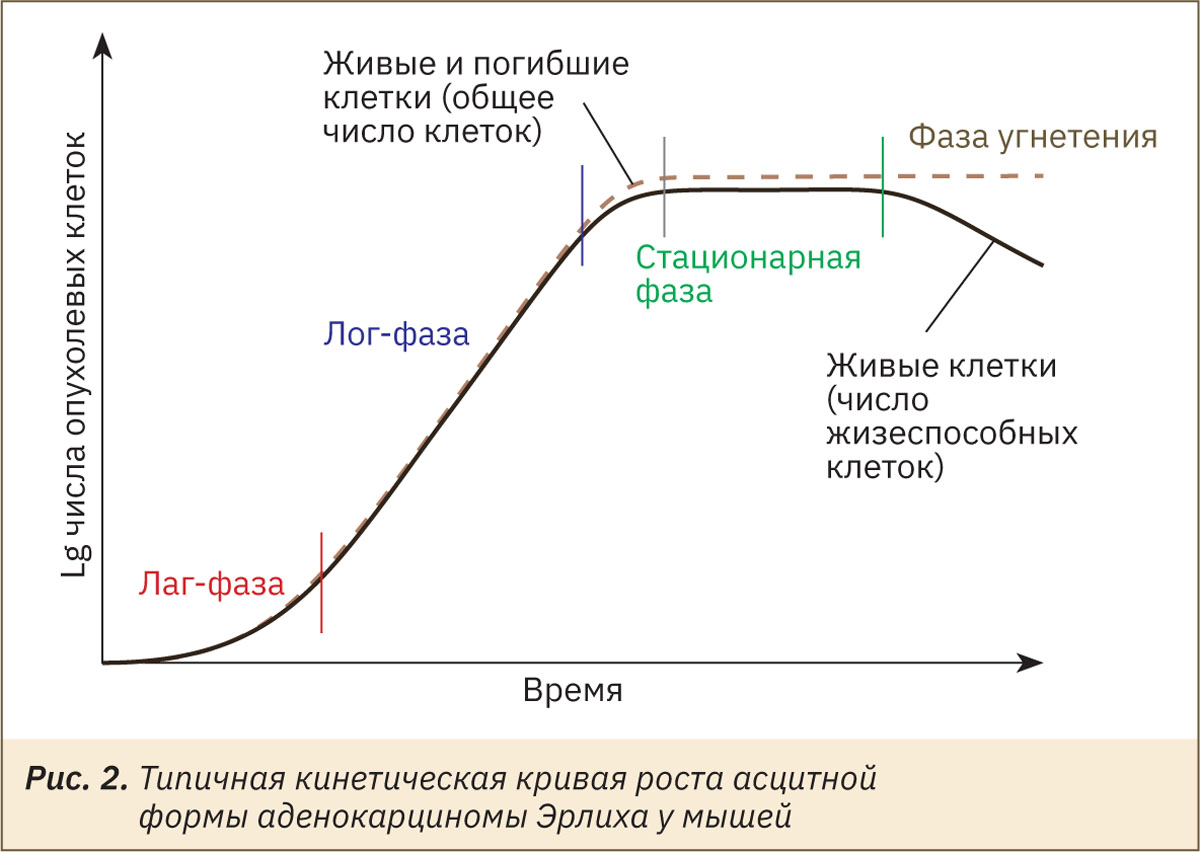
Обычно на кривой роста АКЭ различают 4 фазы: латентный период (лаг-фаза) длится 1–5 сут; фаза экспоненциального роста (период логарифмического увеличения числа клеток, лог-фаза) — 7–12 сут; стационарная фаза — плато, переходящая в терминальный период (фаза угнетения) — 13–16 сут, за которым следует гибель организма. Длительность лаг-фазы зависит от величины инокулята. При достаточно значительном количестве вводимых клеток (4×107 кл/мл) лаг-фаза не наблюдается, при малом количестве вводимых клеток латентный период может быть растянут до 15–20 сут [14, 15].
Во время перехода АКЭ из пролиферирующей фазы к терминальной в клетках опухоли развиваются метаболические и морфологические изменения: снижается число митохондрий, скорость синтеза ДНК и РНК; происходит потеря внутриклеточных пуриновых и пиримидиновых оснований, нуклеотидов и нуклеозидов; снижается концентрация и скорость образования АТФ, биосинтеза белка; увеличивается концентрация тимидина, снижается активность тимидинкиназы, концентрация глутатиона; повышается уровень триглицеридов, холестериновых эфиров и свободных жирных кислот. Однако в результате жизнеспособность клеток АКЭ существенно не изменяется [7].
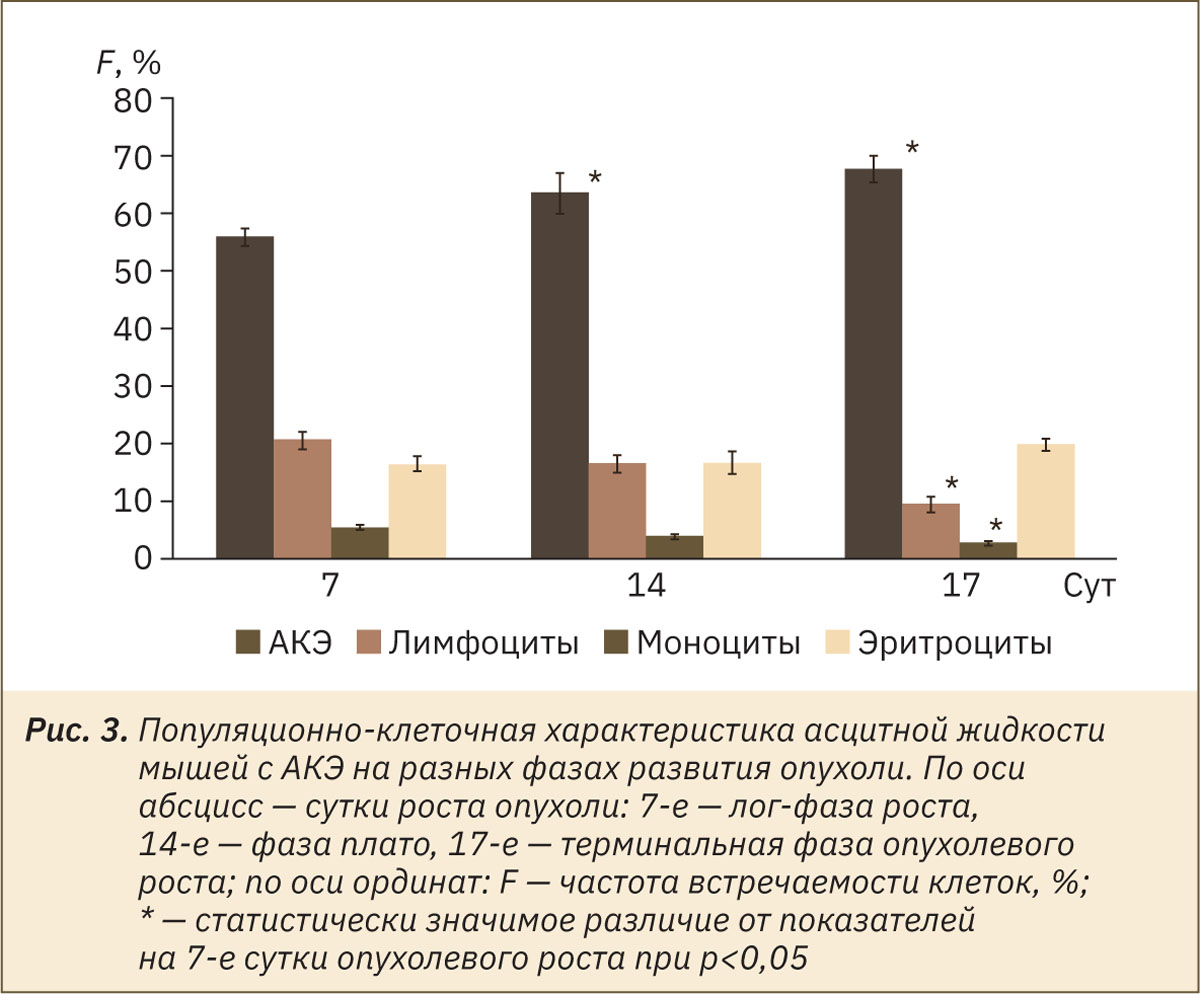
Опухолевый рост сопровождается изменением доли популяций клеток в асцитной жидкости (рис. 3). Накопление асцитной жидкости в перитонеальной полости происходит параллельно росту АКЭ и в конечном счете является одним из факторов (помимо разрушающего действия неоплазии), приводящих к смерти животного-опухоленосителя в результате давления, оказываемого на органы. Клетки АКЭ секретируют сосудорасширяющий фактор, который стимулирует накопление асцитной жидкости (но не нормальной плазмы и сыворотки) в перитонеальной полости [7]. В различных исследованиях показано промитотическое действие асцита на клетки АКЭ, а также увеличение регенерации поврежденных органов мыши-опухоленосителя под действием промитотических EACF (Ehrlich ascites carcinoma factor) — факторов асцитной карциномы Эрлиха, однако опухолевые факторы, содержащиеся в асците, снижают пролиферацию клеток костного мозга и иммунокомпетентных клеток. Таким образом, асцитная жидкость вместе с факторами, секретируемыми АКЭ, оказывает защитное действие на клетки опухоли [16, 17].
Влияние АКЭ на иммунную систему
В ряде исследований показано иммуносупрессивное действие факторов, секретируемых АКЭ, на иммунную систему. Например, сиаломуцины, секретируемые АКЭ, способны связываться с сиалоадгезинами макрофагов, тем самым способствуя супрессии миелопоэза [18, 19]. Действие гуморальных факторов, секретируемых АКЭ [углеводов, простагландина E2 (рrostaglandin E2, PGE2), фактора роста эндотелия сосудов (vascular endothelial growth factor, VEGF) и др.], может способствовать нейтрофилезу, тромбоцитозу, экстрамедуллярному гематопоэзу, спленомегалии, иммуносупрессивному действию, изменениям в миелоидной составляющей костного мозга и селезенки, которые происходят при росте АКЭ [19–23]. Возможна секреция опухолью колониестимулирующих факторов [например, гранулоцитарно-макрофагального колониестимулирующего фактора (granulocyte-macrophage colony stimulating factor, GM-CSF)], что может вести к увеличению числа клеток-предшественников макрофагов и гранулоцитов. Способность гемопоэтических тканей продуцировать и рекрутировать фагоциты к месту инфекции и роста опухоли имеет центральное значение для обеспечения раннего иммунологического ответа [18]. При этом наблюдается массовая миграция этих клеток в кровь с последующим накоплением в селезенке [23]. Вырабатываемые клетками АКЭ растворимые протеины муцина-1 (MUC-1) препятствуют стимуляции Т-клеток благодаря активации системы комплимента к анти-MUC-1-антителам, связавшим антиген [24]. Экспрессия опухолевыми клетками во внеклеточное пространство трансформирующего фактора роста β (transforming growth factor beta, TGF-β) ингибирует пролиферацию NK- и Т-клеток через негативную регуляцию интерлейкином-2 (IL-2) пролиферативных сигналов [25, 26], а также функции Th [27, 28]. Обнаружено супрессивное действие опухолевых цитокинов на INF-γ-секретирующие клетки, в результате чего наблюдается торможение Т-хелперов типа 1 (Th1) клеточного действия, приводя к недостаточной активности опухолеспецифичных Т-лимфоцитов [29, 30].
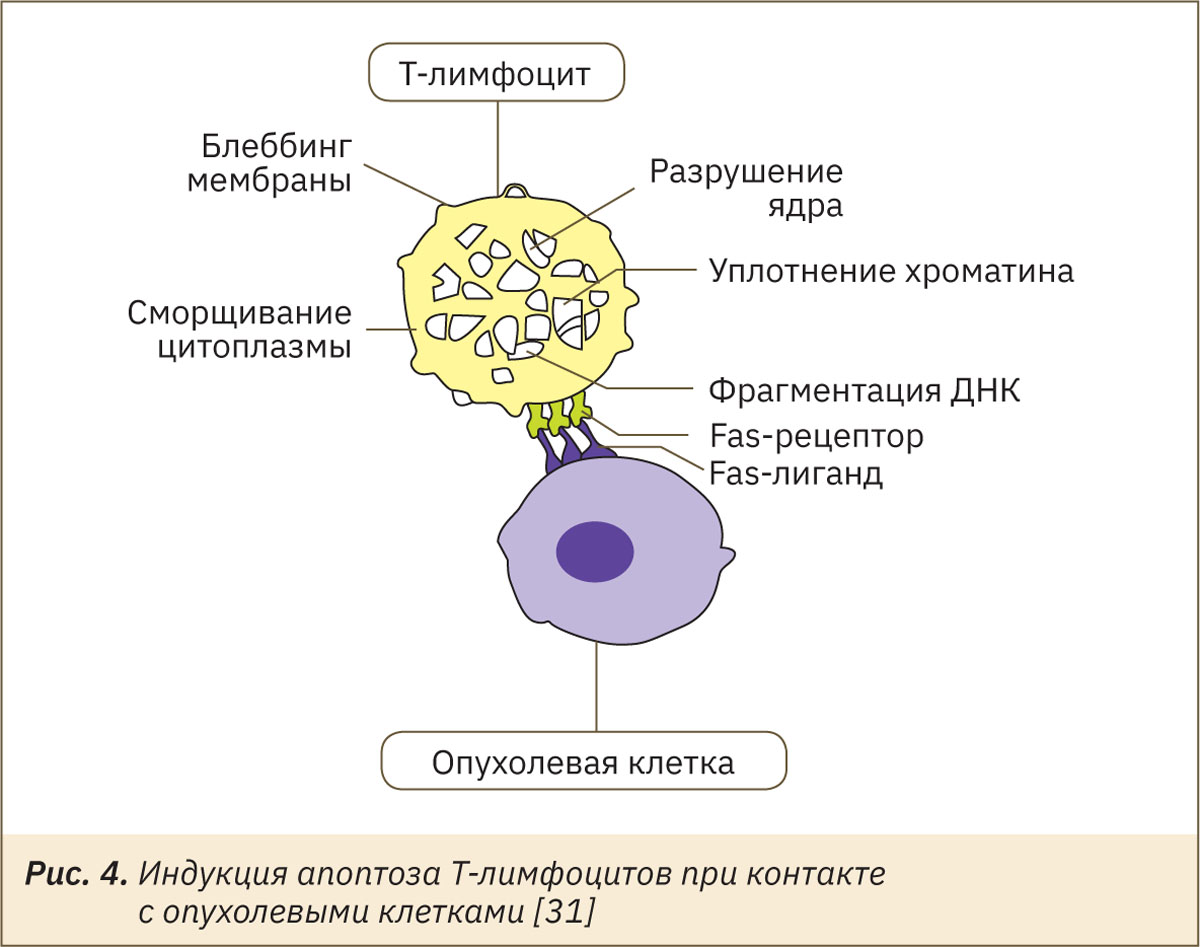
Клетки аденокарциномы Эрлиха способны не только противостоять действию цитотоксических Т-лимфоцитов (CTL клетки) и NK-клеток, но и целенаправленно индуцировать механизмы программируемой гибели этих клеток (рис. 4). Установлено, что подобное действие малигнизированных клеток на иммуноциты осуществляется с помощью белков, один из которых является рецептором активированных клеток иммунной системы Fas (Apo-1/CD95), другой представляет его лиганд FasL (CD95L) и экспрессируется на цитоплазматической мембране злокачественно-трансформированных клеток [31].
Таким образом, факторы, экспресcируемые клетками АКЭ, приводят к систематическому снижению адаптивного и врожденного иммунитета. Имеются данные о стимуляции АКЭ не только регуляторных Т-лимфоцитов (клеток-супрессоров лимфоцитарной активности, CD25+), но и супрессорных клеток миелоидного происхождения (myeloid-derived suppressor cells, MDSC), которые способны ингибировать действие различных компонентов иммунной системы, подавляя развитие противоопухолевого ответа [32, 33]. Таким образом, очевидно влияние опухолевых клеток на иммунную систему, что позволяет исследовать эффекты препаратов, обладающих иммунотропной активностью.
Рост клеток неоплазмы в перитонеальной полости сопровождается инфильтрацией клетками иммунной системы и генерацией хронического воспаления в связи с продукцией в зоне роста опухоли таких хемоаттрактантов, как IL-8, стимулирующий макрофаги протеин-1 (Macrophage-stimulating protein-1, MSP-1 и др.) [34]. Так, было показано повышение содержания циклооксигеназы-1 [ЦОГ-1 (COX1)] и индуцибельной NO-синтазы (iNOS) в клетках перитонеальной жидкости, сопровождающееся увеличением содержания их продуктов (NOх и PGE2) в ходе роста АКЭ [35, 36]. Кроме того, наблюдалось повышение уровней IL-2, IL-6, PGE2 и NOх в сыворотке крови мышей на экспоненциальной фазе опухолевого роста [37].
Важным фактором миграции миелоидных клеток в процессе опухолевого роста, приводящим к их накоплению, в том числе и в крови, является GM-CSF. При этом существуют данные как о противо-, так и проопухолевом действии полиморфно-ядерных гранулоцитов в ходе роста АКЭ [38].
Мигрировавшие в область опухоли моноциты становятся опухолеассоциированными макрофагами (tumor associated macrophages, TAM) двух типов: М1, проявляющими противоопухолевую активность через высокий синтез NOх и провоспалительные цитокины, или М2, играющими важную роль в иммуносупрессии и прогрессии опухоли (рис. 5) [39].
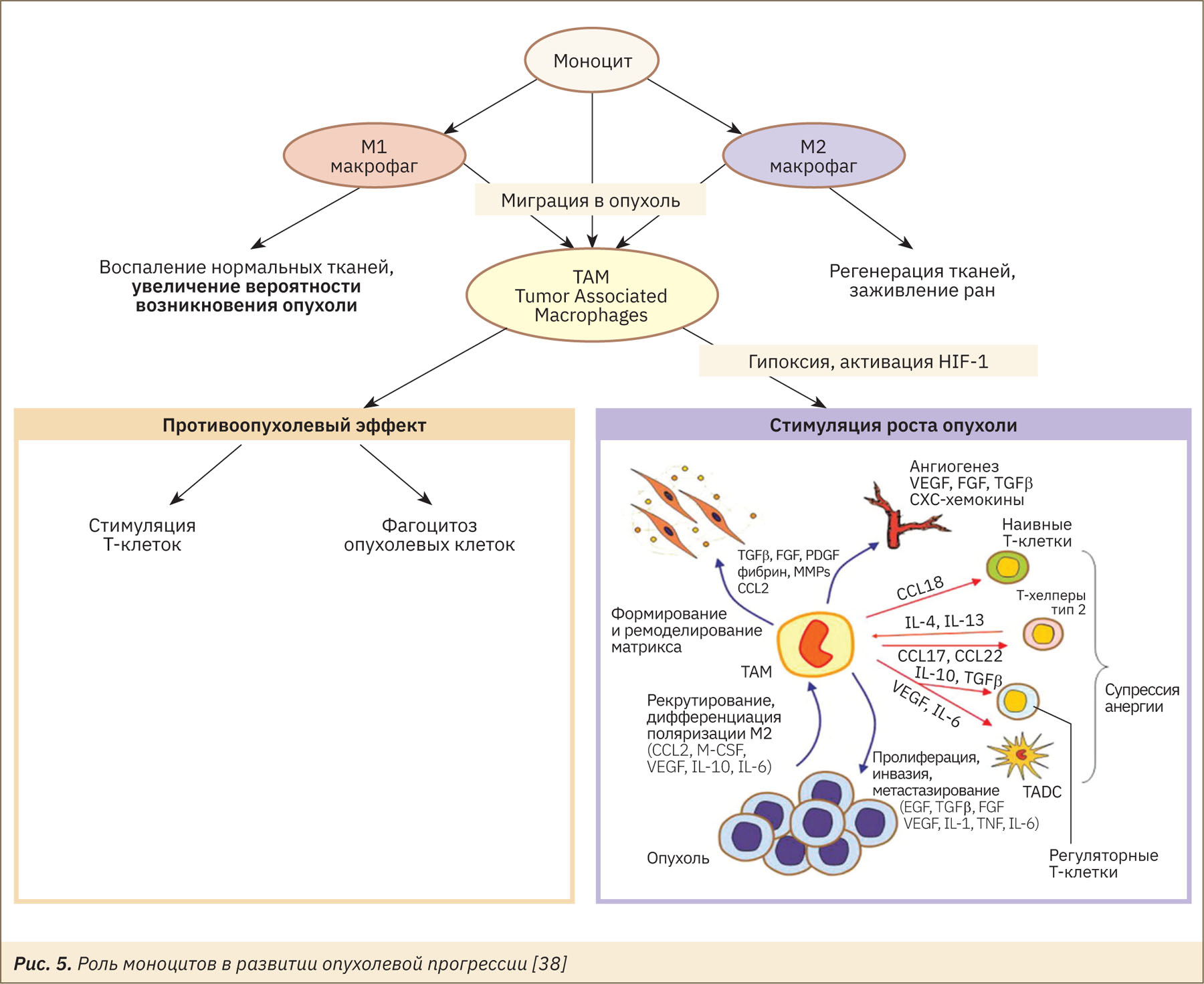
Предполагается, что в течение лаг-фазы макрофаги сохраняют активированный фенотип и контроль над ростом опухоли, однако со временем в асците происходит увеличение уровней PGE2, IL-10, VEGF, TGFβ и других факторов опухолевого микроокружения (гипоксия, измененный рН), что стимулирует переход фенотипа макрофагов из М1 в М2 [39–43]. Выявлено накопление MDSC в перитонеальном экссудате мышей с АКЭ уже на 6-е сутки роста опухоли, при этом содержание клеток MDSC в крови не изменяется [35].
Следует отметить, что АКЭ в ходе опухолевого роста способна изменять активность различных иммунокомпетентных клеток. Например, вызывать состояние пониженной реактивности Т-лимфоцитов на энтеротоксин Staphylococcus aureus главным образом благодаря влиянию на CD8+ Т-клетки, а также вызывая уменьшенную экспрессию IFN-γ [22]. Кроме того, выявлена повышенная способность к образованию активных форм кислорода (АФК) нейтрофилами крови и макрофагами перитонеальной жидкости на поздних стадиях развития опухоли при стимуляции клеток опсонизированным зимозаном и Candida albicans [44].
Заключение
Хорошая воспроизводимость in vivo, возможность роста в двух формах тканевой организации, высокая способность к трансплантации, отсутствие регрессии, быстрая пролиферация, 100% злокачественность, отсутствие опухолеспецифического трансплантационного антигена (Tumor-specific transplantation antigen, TSTA), а также относительная стабильность гистопатологических свойств позволяют использовать перевиваемую аденокарциному Эрлиха для решения многих задач в экспериментальной фармакологии. Информация об особенностях взаимодействия модели с тестируемыми на ней соединениями поможет получить новые данные не только о свойствах тестируемых агентов, а также позволит оценить биологические характеристики используемых экспериментальных моделей [6, 45, 46].
Модель АКЭ хорошо зарекомендовала себя при скрининге веществ, обладающих антибластомными свойствами, и оценке эффективности противоопухолевых препаратов. Также получено много информации о реализации механизмов ингибирующего действия исследуемых веществ на рост опухоли, в первую очередь за счет влияния на основные процессы канцерогенеза, подавления клеточной пролиферации, стимуляции апоптоза в трансформированных клетках, а также вследствие повышения противоопухолевого иммунитета.
Данная модель как в асцитной, так и в солидной форме позволяет воспроизводить онкогенез у лабораторных животных и изучать влияние фармакологических веществ на опухолевый рост и состояние иммунного ответа в условиях опухолеиндуцированной иммуносупрессии и хронического воспалительного процесса, а также исследовать механизмы адаптации клеток, в том числе иммунной системы, в условиях действия факторов канцерогенеза.
Сведения о конфликте интересов
Авторы заявляют об отсутствии конфликта интересов, требующего раскрытия в данной статье.
Вклад авторов
Г.А. Востроилова — научное руководство, критический пересмотр текста и одобрение окончательного варианта рукописи для публикации.
Н.А. Хохлова — идея, анализ данных научной литературы, редактирование текста рукописи, подготовка табличного материала и рисунков.
Д.И. Шабанов — идея, анализ данных научной литературы, редактирование текста рукописи, подготовка табличного материала и рисунков.
Е.В. Михайлов — критический пересмотр текста и одобрение окончательного варианта рукописи для публикации.
А.А. Корчагина — анализ данных научной литературы, редактирование текста рукописи.
Б.В. Шабунин — поиск, обобщение данных литературы.
А.В. Некрасов — поиск, обобщение данных литературы.
Список источников
-
Казанчева О.Д., Герасименко А.С. Методология поиска новых биологически активных фармакологических веществ с рецепторной активностью // Международный журнал прикладных и фундаментальных исследований. 2016. № 8–4. С. 522–525. [Kazancheva O.D., Gerasimenko A.S. Metodologiya poiska novyh biologicheski aktivnyh farmakologicheskih veshchestv s receptornoj aktivnost’yu // Mezhdunarodnyj zhurnal prikladnyh i fundamental’nyh issledovanij. 2016. N. 8–4. P. 522–525. (In Russ.)].
-
Ибадуллаева Г.С., Джадранов Е.С., Ергазина М.Ж. и др. Структурные особенности метастатических поражений легких лабораторных крыс и мышей при развитии различных видов опухолей // Вестник КазНМУ. 2016. № 4. С. 297–304. [Ibadullaeva G.S., Dzhadranov E.S., Ergazina M.ZH. et al. Strukturnye osobennosti metastaticheskih porazhenij legkih laboratornyh krys i myshej pri razvitii razlichnyh vidov opuholej // Vestnik KazNMU. 2016. N. 4. P. 297–304. (In Russ.)].
-
Рыжова Н.И., Дерягина В.П., Савлучинская Л.А. Значение модели аденокарциномы Эрлиха в изучении механизмов канцерогенеза, противоопухолевой активности химических и физических // Международный журнал прикладных и фундаментальных исследований. 2019. № 4. С. 220–227. [Ryzhova N.I., Deryagina V.P., Savluchinskaya L.A. Znachenie modeli adenokarcinomy Erliha v izuchenii mekhanizmov kancerogeneza, protivoopuholevoj aktivnosti himicheskih i fizicheskih // Mezhdunarodnyj zhurnal prikladnyh i fundamental’nyh issledovanij. 2019. N. 4. P. 220–227. (In Russ.)]. DOI: 10.17513/mjpfi.12727.
-
Богачева Н.В., Зайцева И.В., Попова С. В. и др. Основные проблемы экспериментальных исследований новых иммунобиологических препаратов на биологических моделях лабораторных животных // Вятский медицинский вестник. 2020. № 4 (68). C. 74–81. [Bogacheva N.V., Zajceva I.V., Popova S.V. et al. Osnovnye problemy eksperimental’nyh issledovanij novyh immunobiologicheskih preparatov na biologicheskih modelyah laboratornyh zhivotnyh // Vyatskij medicinskij vestnik. 2020. N. 4 (68). P. 74–81. (In Russ.)]. DOI: 10.24411/2220-7880-2020-10135.
-
Бузлама А.В., Николаевский В.А., Чернов Ю.Н., Сливкин А.И. Экспериментальная фармакология — принципы, модели, анализ. Воронеж: Воронежский государственный университет, 2013. 362 с. [Buzlama A.V., Nikolaevskij V.A., CHernov YU.N., Slivkin A.I. Eksperimental’naya farmakologiya — principy, modeli, analiz. Voronezh: Voronezhskij gosudarstvennyj universitet, 2013. 362 p. (In Russ.)].
-
Ehrlich P., Apolant H. Beobachtungen Über Maligne Mausentumoren // Berlin. Klin. Wschr. 1905. Vol. 28. P. 871–874.
-
Ozaslan M., Karagos I.D., Kils I.H. et al. Erlich ascites carcinoma // African Journal of Biotechnology. 2011. Vol. 10. P. 2375–2378.
-
Инжеваткин Е.В. Практикум по экспериментальной онкологии на примере асцитной карциномы Эрлиха. Метод. разработка. Красноярск: Красноярский Государственный Университет, 2004. 10 с. [Inzhevatkin E.V. Praktikum po eksperimental’noi onkologii na primere astsitnoi kartsinomy Erlikha. Metod. razrabotka. Krasnoyarsk: Krasnoyarskii Gosudarstvennyi Universitet, 2004. 10 p. (In Russ.)].
-
Popov A., Klimovich A., Styshova O. et al. Design, synthesis and biomedical evaluation of mostotrin, a new water soluble tryptanthrin derivative // Int. J. Mol. Med. 2020. Vol. 46. N. 4. P. 1335–1346. DOI: 10.3892/ijmm.2020.4693.
-
Побяржин В.В., Пашинская Е.С., Семенов В.М. и др. Методологические аспекты постановки онкологических моделей в условиях эксперимента // Вестник ВГМУ. 2018. Т. 17. № 6. С. 32–45. [Pobyarzhin V.V., Pashinskaya E.S., Semenov V.M. et al. Metodologicheskie aspekty postanovki onkologicheskih modelej v usloviyah eksperimenta // Vestnik VGMU. 2018. Vol. 17. N. 6. P. 32–45. (In Russ.)]. DOI: 10.22263/2312-4156.2018.6.32.
-
Гвичия А.Ш. Морфология поверхности асцитных опухолевых клеток / А.Ш. Гвичия. Тбилиси: Мецниереба, 1983. 118 с. [Gvichiya A.SH. Morfologiya poverhnosti ascitnyh opuholevyh kletok / A.SH. Gvichiya. Tbilisi: Mecniereba, 1983. 118 p. (In Russ.)].
-
Заридзе Д.Г. Эпидемиология и этиология злокачественных опухолей // Вестник РАМН. 2001. № 9. С. 6–14. [Zaridze D.G. Epidemiologiya i etiologiya zlokachestvennyh opuholej // Vestnik RAMN. 2001. N. 9. P. 6–14. (In Russ.)].
-
Агабабова А.А., Мовсесян Н.О., Акопян А.M. и др. Морфoгистохимические изменения при асцитной карциноме Эрлиха на фоне воздействия кишечной палочки // Доклады НАН Армении. 2013. № 3 (113). С. 303–310. [Agababova A.A., Movsesyan N.O., Akopyan A.M. et al. Morfogistohimicheskie izmeneniya pri ascitnoj karcinome Erliha na fone vozdejstviya kishechnoj palochki // Doklady NAN Armenii. 2013. N. 3 (113). P. 303–310. (In Russ.)].
-
Эммануэль Н.М. Кинетика экспериментальных опухолевых процессов / Н.М. Эммануэль. Москва: Наука, 1977. 419 с. [Emmanuel’ N.M. Kinetika eksperimental’nyh opuholevyh processov / N.M. Emmanuel’. Moskva: Nauka, 1977. 419 p. (In Russ.)].
-
Замай А.С., Коловская О.С., Кондрасенко А.А. и др. Изменение энергетического статуса опухоли в процессе развития // Сибирское медицинское обозрение. 2016. № 3(99). С. 17–26. [Zamaj A.S., Kolovskaya O.S., Kondrasenko A.A. Izmenenie energeticheskogo statusa opuholi v processe razvitiya // Sibirskoe medicinskoe obozrenie. 2016. N. 3(99). P. 17–26. (In Russ.)].
-
Xian L.J., Li H.X., Liu Z.C. et al. Effect of mitoxantrone on DNA polymerase of Ehrlich ascites carcinoma cells // Zhongguo Yao Li Xue Bao. 1998. Vol. 19. N. 4. Р. 356–358.
-
Ibrahim S.S.A., El-Aal S.A.A., Reda A.M. et al. Anti-neoplastic action of Cimetidine/Vitamin C on histamine and the PI3K/AKT/mTOR pathway in Ehrlich breast cancer // Sci. Rep. 2022. Vol. 12. P. 11514. DOI: 10.1038/s41598-022-15551-6.
-
Queiroz M.L., Justo G.Z., Valadares M.C. et al. Evaluation of Caesalpinia ferrea extract on bone marrow hematopoiesis in the murine models of listeriosis and Ehrlich ascites tumor // Immunopharm. and Immunotoxicol. 2001. Vol. 23. N. 3. Р. 367–382. DOI: 10.1081/iph-100107337.
-
Queiroz M.L. S., Valadares M.C., Bincoletto C. et al. Ehrlich ascites tumor as a tool in the development of compounds with immunomodulatory properties // Immunopharm. and Immunotoxicol. 2004. Vol. 26. N. 4. P. 511–525. DOI: 10.1081/iph-200042289.
-
Morsi D.S., El-Nabi S.H., Elmaghraby M.A. et al. Anti-proliferative and immunomodulatory potencies of cinnamon oil on Ehrlich ascites carcinoma bearing mice // Sci. Rep. 2022. Vol. 12. N. 1. Р. 11839. DOI: 10.1038/s41598-022-14770-1.
-
Siddika A., Zahan T., Khatun L. et al. In vivo the antioxidative extract of Averrhoa carambola Linn. leaves induced apoptosis in Ehrilch ascites carcinoma by modulating p53 expression // Food Sci. Biotechnol. 2020. Vol. 29. N. 9. P. 1251–1260. DOI: 10.1007/s10068-020-00775-x.
-
Segura J.A., Barbero L.G., Márquez J. Ehrlich ascites tumour unbalances splenic cell populations and reduces responsiveness of T cells to Staphylococcus aureus enterotoxin B stimulation // Immunol. Lett. 2000. Vol. 74. N. 2. Р. 111–115. DOI: 10.1016/s0165-2478(00)00208-x.
-
Morales J.R., Vélez D., Subiza J.L. et al. Ehrlich tumor stimulates extramedullar hematopoiesis in mice without secreting identifiable colony-stimulating factors and without engagement of host T cells // Experimental Hematology. 1999. Vol. 27. N. 12. Р. 1757–1767.
-
Chan A.K., Lockhart D.C., von Bernstorff W. et al. Soluble MUC1 secreted by human epithelial cancer cells mediates immune suppression by blocking T-cell activation // Int. J. Cancer 1999. Vol. 82. P. 721–726.
-
Ahuja S.S. et al. Effect of transforming growth factor-beta on early and late activation events in human T cells // J. Immunol. 1993. Vol. 150. P. 3109–3118.
-
Roy L.O., Poirier M.B., Fortin D. Differential Expression and Clinical Significance of Transforming Growth Factor-Beta Isoforms in GBM Tumors // Int. J. Mol. Sci. 2018. Vol. 19. N. 4. Р. 1113. DOI: 10.3390/ijms19041113.
-
Tada T., Ohzeki S., Utsumi K. et al. Transforming growth factor-beta-induced inhibition of T cell function. Susceptibility difference in T cells of various phenotypes and functions and its relevance to immunosuppression in the tumor-bearing state // J. Immunol. 1991. Vol. 146. P. 1077–1082.
-
Maus M.V., Levine B.L. Chimeric Antigen Receptor T-Cell Therapy for the Community Oncologist // Oncologist. 2016. Vol. 21. N. 5. Р. 608–617. DOI: 10.1634/theoncologist.2015-0421.
-
Ghosh P. Gradual loss of T-helper 1 populations in spleen of mice during progressive tumor growth // Cancer Inst. 1995. Vol. 87. P. 1478–1483. DOI: 10.1093/jnci/87.19.1478.
-
Biragyn A., Longo D.L. Neoplastic “Black Ops”: cancer’s subversive tactics in overcoming host defenses // Semin. Cancer Biol. 2012. Vol. 22. N. 1. P. 50–59. DOI: 10.1016/j.semcancer. 2012.01.005.
-
Антонов В.Г., Козлов В.К. Патогенез онкологических заболеваний: иммунные и биохимические феномены и механизмы. Внеклеточные и клеточные механизмы общей иммунодепрессии и иммунной резистентности // Цитокины и воспаление. 2004. Т. 3. № 1. С. 8–19. [Antonov V.G., Kozlov V.K. Patogenez onkologicheskih zabolevanij: immunnye i biohimicheskie fenomeny i mekhanizmy. Vnekletochnye i kletochnye mekhanizmy obshchej immunodepressii i immunnoj rezistentnosti // Citokiny i vospalenie. 2004. Vol. 3. N. 1. P. 8–19. (In Russ.)].
-
Youn J.-I. Characterization of the nature of granulocytic myeloid-derived suppressor cells in tumor-bearing mice // J. of Leukocyte Biology. 2012. Vol. 91. N. 1. P. 167–181.
-
Wu Y., Yi M., Niu M. et al. Myeloid-derived suppressor cells: an emerging target for anticancer immunotherapy // Mol. Cancer. 2022. Vol. 21. N. 1. P. 184. DOI: 10.1186/s12943-022-01657-y.
-
Tavares-Murta B.M., Fernando E., Murta C. Systemic Leukocyte Alterations in Cancer and their Relation to Prognosis // The Open Cancer Journal. 2008. Vol. 2. P. 53–58. DOI: 10.2174/1874079000802010053.
-
Fernandes P.D., Guerra F.S., Sales N.M. et al. Characterization of the inflammatory response during Ehrlich ascitic tumor development // J. Pharmacol. Toxicol. Methods. 2015. Vol. 71. P. 83–89. DOI: 10.1016/j.vascn.2014.09.001.
-
Song X.D., Wang Y.N., Zhang A.L. et al. Advances in research on the interaction between inflammation and cancer // J. Int. Med. Res. 2020. Vol. 48. N. 4. P. 1–11. DOI: 10.1177/0300060519895347.
-
Gentile L.B., Queiroz-Hazarbassanov N., Massoco Cde O. et al. Modulation of Cytokines Production by Indomethacin Acute Dose during the Evolution of Ehrlich Ascites Tumor in Mice // Mediators Inflamm. 2015. Vol. 2015. P. 1–8. DOI: 10.1155/2015/924028.
-
Bergami-Santos P.C., Mariano M., Barbuto J.A. Dual role of polymorphonuclear neutrophils on the growth of Ehrlich ascites tumor (EAT) in mice // Life Sci. 2004. Vol. 75. N. 2. P. 245–255. DOI: 10.1016/j.lfs.2004.02.003.
-
Sica A., Allavena P., Mantovani A. Cancer related inflammation: the macrophage connection // Cancer Lett. 2008. Vol. 267. P. 204–215. DOI: 10.1016/j.canlet.2008.03.028.
-
Кораблев Р.В., Васильев А.Г. Неоангиогенез и опухолевый рост // Российские биомедицинские исследования. 2017. № 4. С. 3–10. [Korablev R.V., Vasil’ev A.G. Neoangiogenez i opuholevyj rost // Rossijskie biomedicinskie issledovaniya. 2017. N. 4. P. 3–10. (In Russ.)].
-
Светозарский Н.Л., Артифексова А.А., Светозарский С.Н. Фактор роста эндотелия сосудов: биологические свойства и практическое значение (обзор литературы) // Journal of Siberian Medical Sciences. 2015. № 5. С. 24–36. [Svetozarskij N.L., Artifeksova A.A., Svetozarskij S.N. Faktor rosta endoteliya sosudov: biologicheskie svojstva i prakticheskoe znachenie (obzor literatury) // Journal of Siberian Medical Sciences. 2015. N. 5. P. 24–36. (In Russ.)].
-
Kalish S.V., Lyamina S.V., Usanova E.A. et al. Macrophages Reprogrammed In Vitro Towards the M1 Phenotype and Activated with LPS Extend Lifespan of Mice with Ehrlich Ascites Carcinoma // Med. Sci. Monit. Basic Res. 2015. Vol. 21. P. 226–234. DOI: 10.12659/msmbr.895563.
-
Harradine K.A. Mutations of TGF-ß signaling molecules in human disease // Annals of medicine. 2006. Vol. 38. N. 6. P. 403–414.
-
Дерягина В.П., Рыжова Н.И., Голубева И.С. Функциональная активность фагоцитов и образование оксида азота в организме мышей с перевиваемыми опухолями // Вестник РОНЦ им. Н.Н. Блохина РАМН. 2011. Т. 22. № 2. С. 47–58. [Deryagina V.P., Ryzhova N.I., Golubeva I.S. Funkcional’naya aktivnost’ fagocitov i obrazovanie oksida azota v organizme myshej s perevivaemymi opuholyami // Vestnik RONC im. N.N. Blohina RAMN. 2011. Vol. 22. N. 2. P. 47–58. (In Russ.)].
-
Смирнова Л.П., Кондакова И.В. Тип тканевой организации опухоли в определении активности антиоксидантных ферментов // Сибирский онкологический журнал. 2002. № 1. С. 65–69. [Smirnova L.P., Kondakova I.V. Tip tkanevoj organizacii opuholi v opredelenii aktivnosti antioksidantnyh fermentov // Sibirskij onkologicheskij zhurnal. 2002. N. 1. P. 65–69. (In Russ.)].
- Savluchinskaya L.A., Ryzhova N. I., Deryagina V.P. Study of the influence of different factors on tumor growth on a model of transplanted ehrlich’s mammary gland adenocarcinoma // European Journal of Natural History. 2021. N. 2. P. 22–29. DOI: 10.17513/ejnh.34160.



