Методические аспекты проведения ДНК-комет-теста в условиях in vivo в доклинических исследованиях
Гайдай Е.А., Дорофеева А.А., Крышень К.Л., Гайдай Д.С. Методические аспекты проведения ДНК-комет-теста в условиях in vivo в доклинических исследованиях. Лабораторные животные для научных исследований. 2020; 3. https://doi.org/10.29296/2618723X-2020-03-03
Резюме
Длительное воздействие неблагоприятных факторов окружающей среды на любую биологическую систему сопровождается накоплением повреждений структуры дезоксирибонуклеиновой кислоты (ДНК) и изменением активности системы репарации, что приводит к закрепляемым мутациям, онкогенезу и гибели клеток.
В обзоре приведены методические и методологические аспекты проведения метода ДНК-комет для определения степени повреждения геномной ДНК. В последние годы разработано много методов, позволяющих регистрировать повреждения ДНК, однако не все они обладают достаточной чувствительностью и специфичностью, необходимыми для мониторинга широкого спектра повреждений ДНК. Метод ДНК-комет, впервые описанный Д. Остлингом и К. Йохансоном (1984) [1], – быстрый и чувствительный тест для оценки степени повреждений геномной ДНК и изучения активности систем репарации ДНК на уровне отдельных ядросодержащих клеток и может быть применен для определения целостности генома. Усовершенствования и модификации метода ДНК-комет позволили значительно повысить его чувствительность и расширить сферу применения, однако практически не затронули принципы, составляющие его основу.
В настоящее время ДНК-комет-тест находит применение в различных сферах – исследованиях генотоксического действия химических веществ (в том числе и фармацевтических препаратов), репарации ДНК, апоптоза, клинических исследованиях по пренатальной диагностике, предрасположенности к онкологическим заболеваниям, при терапии рака, катаракты. Метод ДНК-комет постепенно становится неотъемлемой частью программ по биомониторингу: влиянию пищевого рациона на организм, факторов внешней среды, изменений метаболизма и физиологического состояния, старения организма; по изучению механизмов радиопротекторных воздействий и формирования радиоадаптивного ответа; исследований по экологии.
ДНК-комет-тест имеет ряд особенностей, влияющих на результативность метода, среди этих особенностей ключевыми являются: возможность заморозки исследуемого материала при больших объемах, температурный режим обработки материала, световые условия и т.п. Для обеспечения повторяемости достоверных результатов необходима унификация проводимых мероприятий в ДНК-комет-тесте для снижения вариабельности результатов.
Введение
Постоянное воздействие негативных факторов окружающей среды (физических, химических и др.) в диапазонах интенсивности, выходящих за границы биологического оптимума жизнедеятельности, может приводить к повреждению генома. Это происходит как за счет прямого влияния (например, повреждение молекул ДНК ионизирующим излучением по принципу «мишени»), так и опосредовано, за счет образования в клетке свободных радикалов и активных форм кислорода. Угнетение и нарушение работы систем репарации ДНК приводят к накоплению повреждений, что в свою очередь приводит к закрепляемым мутациям, онкогенезу и гибели клеток. Образование повреждений ДНК – важное инициирующее событие в развитии патологических процессов в организме. В связи с этим особую актуальность приобретает оценка повреждений в структуре ДНК на ранних этапах, когда патологические процессы в организме еще не могут быть диагностированы на физиологическом уровне [2, 3]. Предупреждение контакта живых организмов с химическими соединениями (в том числе лекарственными средствами), способными оказывать генотоксическое действие, представляется наиболее конструктивным способом защиты от последствий индуцированного мутагенеза, поэтому возникает необходимость в совершенствовании методов для определения мутагенных свойств соединений [4].
Метод ДНК-комет (Сomet assay, «комета-тест», электрофорез нуклеотидов отдельных клеток в геле агарозы) является наиболее перспективным из имеющихся на сегодняшний день тестов по оценке генотоксичности и канцерогенности различных химических соединений. Это быстрый и чувствительный тест, предназначенный для обнаружения повреждений ДНК и изучения эффективности функционирования систем репарации ДНК на уровне отдельных ядросодержащих клеток, при воздействии широкого спектра повреждающих агентов химической, физической и биологической природы. Данный метод также может применяться для оценки целостности генома. Преимущество метода – простота, небольшое количество экспериментального материала, экономичность, быстрота получения результатов, высокая чувствительность и производительность [4].
Значимость данного метода трудно переоценить, тем не менее важно учитывать биоэтические аспекты научных исследований. Для проведения исследования по оценке генотоксичности соединений методом ДНК-комет минимальное число животных для каждой группы составляет 5 самцов и 5 самок. При этом помимо экспериментальных групп животных, в исследование должны включаться 2 контрольные группы: интактные животные и животные, получающие вещество с доказанной мутагенной активностью (например, этилметансульфонат – ЭМС). При самых скромных подсчетах для проведения исследования необходимо приблизительно 50 голов животных. Согласно Руководству ICH S2 (R1) и Руководству по проведению доклинических исследований лекарственных средств, ДНК-комет-тест входит в стандартную батарею тестов по изучению безопасности химических соединений. В соответствии с данными руководствами и принципами гуманности рекомендовано проведение ДНК-комет-теста в рамках исследования общетоксических свойств (в частности хронической и субхронической токсичности) с целью сокращения числа участвующих в эксперименте животных.
Традиционно анализируемые ткани в ДНК-комет-тесте готовят из небольшого свежего фрагмента ткани, используемого сразу после некропсии животных. Агенты, вызывающие повреждение ДНК, в первую очередь воздействуют на органы кроветворения (костный мозг, селезенка), биотрансформации (печень, почки) и специфические органы-мишени. В связи с этим используется ДНК-комет-тест для большого количества органов, что приводит к необходимости их криоконсервации для дальнейшего исследования. Замороженные клетки и ткани некоторые исследователи считают непригодными для теста, другие успешно применяют заморозку образцов. Основной проблемой экстренной заморозки является кристаллизация внутриклеточной жидкости, что приводит к разрушению клеточной структуры, в том числе и ядерной ДНК, необходимой для анализа [5].
Цель исследования заключалась в адаптации проведения ДНК-комет-теста в условиях in vivo с подбором условий криоконсервации образцов тканей. В данной работе представлены методические рекомендации при осуществлении ДНК-комет-теста и ключевые особенности сохранения образцов органов и тканей животных для последующего анализа.
Общие принципы ДНК-комет-теста
Первым успешным опытом исследования повреждений ДНК индивидуальных клеток принято считать работу шведских ученых Д. Остлинга и К. Йохансона (1984) [1]. Основные процедуры метода ДНК-комет, описанные в первоначальном варианте метода, заключались в иммобилизации облученных клеток в низкоплавкой агарозе, нанесенной на предметное стекло. Далее проводили лизис клеточных мембран и экстракцию белков в растворе с высоким содержанием соли. Молекулы ДНК разделяли электрофорезом, треки ДНК окрашивали флюоресцентным красителем, после чего образцы изучали микроскопически. При наличии разрывов ДНК нарушается структурная организация хроматина и утрачивается сверхспирализация ДНК, что приводит к ее релаксации, формируются фрагменты ДНК. В электрическом поле релаксированные петли и фрагменты ДНК вытягиваются по направлению к аноду, формируя электрофоретический след, визуально напоминающий хвост кометы. Кометы анализируют либо визуально с дифференциацией по степени поврежденности ДНК, либо с использованием компьютерных программных средств обработки изображений [3].
В 1988 г. предложена модификация метода ДНК-комет [6]. В ней предлагалось подвергать лизированные клетки щелочной обработке для денатурации ДНК и последующего электрофореза в щелочной среде, что позволяло улучшить качество метода (появилась возможность обнаружения однонитевых разрывов ДНК и щелочелабильных сайтов, в которых разрывы ДНК образуются при щелочных условиях среды) и повысить его чувствительность и воспроизводимость, однако это практически не затрагивает основные принципы метода [7, 8]. Большинство лабораторий, внедривших данный методический подход в исследования, разработали многочисленные вариации протокола, в частности, касающихся продолжительности и условий лизиса клеток, денатурации, электрофореза и окрашивания ДНК [2].
На базе лаборатории клеточной биологии и цитогенетики (АО НПО «Дом Фармации», Ленинградская область, 2019) отработана методика ДНК-комет-теста в условиях in vivo. В качестве тест-системы использовали самцов и самок аутбредных крыс в возрасте 6–8 нед. Для теста выбраны печень, почки (как органы биотрансформации и выведения), селезенка, костный мозг (как органы кроветворения). Для сохранения образцы подвергали экстренной заморозке при температуре -80°C. Гомогенизированные органы иммобилизировали в низкоплавкой агарозе, нанесенной на предметное стекло для микроскопии. Далее образцы лизировали в буфере с высоким содержанием соли. После щелочной обработки молекулы ДНК разделяли электрофорезом в щелочной среде, треки ДНК визуализировали при помощи флюоресцентного красителя SYBR Green I (например, Sigma-Aldrich, США), после чего проводили микроскопию. Общая схема постановки теста представлена на рис. 1.

Выбор животных
Эксперимент предпочтительно проводить на мелких лабораторных грызунах – мышах или крысах, половозрелых самцах и/или самках. Также допускается использование других видов животных, если это научно обосновано. Во избежание большого разброса оцениваемых показателей необходимо использовать генетически однородных животных, отклонение по массе тела и возрасту которых на момент эксперимента не должно превышать 10%. Ни одна из инбредных или аутбредных линий не выделяется как предпочтительная [9, 10].
В целях уменьшения количества задействованных животных, а также оптимизации и удешевления ДНК-комет-тест допускается проводить в рамках исследования общетоксических свойств химических соединений, в частности хронической токсичности [9, 11].
Вещества для положительного контроля
В качестве положительного контроля используют вещества супермутагены, оказывающие генотоксическое действие. Наиболее часто применяют ЭМС (например, Chem Cruz, США) в дозе 200 мг/кг, также могут быть выбраны и другие вещества, если это научно обосновано. Примеры веществ, дающих генотоксический эффект, некоторые их ткани-мишени и используемые дозы приведены в таблице. Животных подвергают эвтаназии через 3 ч после введения контрольных веществ.

Особенности криоконсервации органов лабораторных животных
Поскольку объект для ДНК-комет-теста – целый ряд органов и тканей, анализ может быть продолжителен по времени, поэтому требуется криоконсервация для дальнейшего постепенного их исследования. Для проведения ДНК-комет-теста достаточно небольшого фрагмента исследуемого органа, оставшийся фрагмент подлежит рутинному гистологическому анализу (если это предусмотрено дизайном эксперимента). Этот аспект весьма важен при проведении ДНК-комет-теста в рамках изучения хронической токсичности. В ходе различных экспериментов выявлено, что наилучшим методом сохранения фрагментов органов и тканей без разрушения ядерной ДНК является экстренная заморозка в морозильной камере при -80°C в фосфатно-солевом буфере, содержащем 20 мМ ЭДТА и 10% диметилсульфоксид (ДМСО) [5].
Очень важно не давать препаратам долго нагреваться выше 2–8°C до и после заморозки, так как ДМСО при нагревании оказывает генотоксическое действие [17].
Процедуру сохранения органов и тканей необходимо наладить таким образом, чтобы препараты были заморожены в течение 10 мин после эвтаназии животного. Для этого удобно использовать контейнер с сухим льдом, который должен находиться рядом с животным, подвергнутым вскрытию для извлечения органов и тканей.
Также стоит обратить внимание на размер замораживаемой ткани, фрагмент должен быть тонким и небольшим (75–100 мг), чтобы ДМСО успел пропитать все клетки. P. Jackson и соавт. [18] описывают метод быстрого измельчения образца ткани на льду перед его заморозкой при -80°C с целью снижения количества криоповреждений ДНК.
Приготовление препаратов клеток
Важнейшим этапом, от которого зависит продолжительность всего исследования и его качество, является приготовление препаратов с иммобилизированными в агарозу клетками. Заранее готовят 1% раствор универсальной агарозы, с этой целью в 50 мл приготовленного фосфатно-солевого буфера (10 мМ ЭДТА) растворяют 0,5 г универсальной агарозы, нагревают в микроволновой печи до полного растворения и ставят на термостатируемую поверхность электрической плитки, нагретую до 50°C. Особое внимание следует обращать на чистоту предметных стекол. Для соблюдения этого условия стекла замачивают на 4–8 ч в 95% спирте и удаляют спирт со стекол при помощи горелки. Подготовленные предметные стекла помещают на термостатируемую поверхность, нагретую до 50°C, затем опускают в горячий 1% раствор универсальной агарозы так, чтобы агароза покрывала всю действующую поверхность стекла, захватив примерно 5 мм шероховатой части; протирают нижнюю поверхность стекла от агарозы и помещают на горизонтальную поверхность сушиться.
После этого наносят второй и третий слои агарозы, 1 и 0,5% растворы легкоплавкой агарозы для второго и третьего слоев следует приготовить заранее, чтобы агароза успела остыть до температуры 37°C.
Далее все манипуляции необходимо проводить в комнате с желтым светом, не допуская попадания ультрафиолетовых лучей на микропрепараты. Воздействие ультрафиолета оказывает повреждающее действие на молекулы ДНК клеток и может влиять на результаты анализа [4].

Размораживать образцы следует в воде, нагретой до 37°C. Как только буфер растаял, орган немедленно промывают в прохладном (4°C) фосфатно-солевом буфере, растирают в ступке на холоде с тем же буфером и быстро измельчают до образования суспензии клеток. Ждут не больше 1 мин, чтобы крупные фрагменты органа осели на дно, после чего 10–50 мкл суспензии клеток помещают в пробирку типа «эппендорф» с 250–290 мкл фосфатно-солевого буфера, при этом концентрация суспензии должна составлять примерно 4×104 клеток.
В эппендорфах смешивают 300 мкл суспензии клеток и 300 мкл 1% легкоплавкой агарозы и наносят на предметное стекло с одним слоем агарозы в объеме 70 мкл, накрывают покровным стеклом для равномерного распределения суспензии и ставят на холод до застывания геля. После затвердевания геля покровные стекла удаляют (рис. 2). Наносят третий слой 0,5% легкоплавкой агарозы, так же накрывают покровным стеклом и помещают на холод до застывания геля.
Лизис клеток
Через 10 мин покровные стекла снимают, микропрепараты помещают в тару для замачивания предметных стекол, заливают рабочим лизирующим раствором (2,5 М NaCl, 10 мМ Tris, 100 мМ Трилон Б, 1% Triton X-100, pH 10,0, 4°C) и помещают в холодильник при 4°C на 1 ч для проведения лизиса. Оптимальное время лизирования клеток составляет 1 ч, но этот процесс можно продлить до 24 ч [19]. Для предотвращения попадания света на клетки тару необходимо упаковать в фольгу.
Щелочная денатурация
По окончании лизиса стекла в течение 20 мин обрабатывают охлажденным щелочным буфером (0,3 M NaOH, 1 мМ ЭДТА, pН 13,0, 4°C) для раскручивания двойной спирали ДНК и образования щелочелабильных сайтов [19].
Электрофорез
Следующий этап проведения ДНК-комет-теста – электрофорез. Для электрофореза используют горизонтальную камеру SE-2 (170×180) (ООО «Хеликон», Россия) и источник питания PowerPac HV (BioRad, США). Для этого обработанные стекла выкладывают по всей площади камеры в один слой. Далее заливают охлажденным до 4°C щелочным электрофорезным буфером так, чтобы препараты были на 2–3 мм ниже уровня буфера.

Точное количество буфера необходимо для того чтобы уравновесить электродвижущую силу в 25 V при взятой за константу силе электрического тока 300 А. Объем буфера зависит от объема и площади электрофорезной камеры. Для облегчения регулировки необходимых параметров электрофореза в последующих экспериментах можно замерить необходимый объем буфера в электрофорезной камере. Электрофорез длится 20 мин (рис. 3).
Для предотвращения перегрева и поддержания температуры буфера 4°C при температуре окружающей среды 20–25°C необходимо сверху и снизу обложить камеру хладагентами. Отклонения в указанных температурных режимах может приводить к вариабельности получаемых результатов [20].
По окончании электрофореза микропрепараты аккуратно (не допуская сползания агарозного слоя со стекла) помещают в контейнер с 70% этанолом на 2–3 мин для дегидратации и фиксации.
Окраска микропрепаратов
Микропрепараты окрашивают раствором SYBR Green I (например, Sigma-Aldrich, США) путем нанесения и распределения по всему препарату нескольких капель красителя. Окраску производят в течение 5 мин. Перед микроскопией остатки красителя с микропрепаратов не следует убирать [21].
Визуализация и анализ ДНК-комет
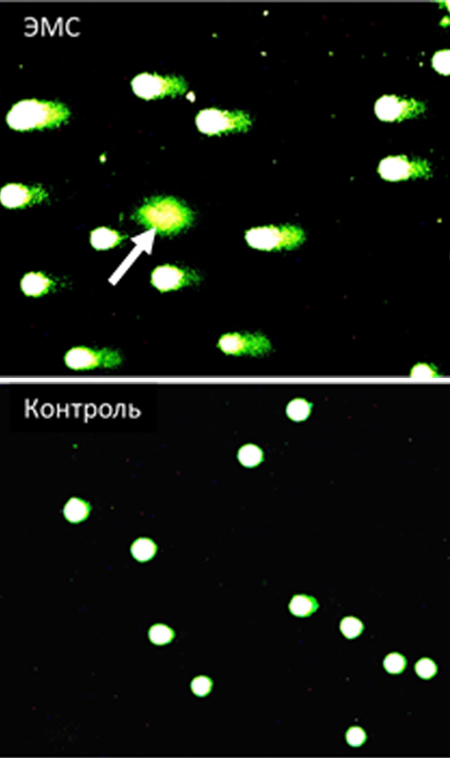
Визуализируют готовые и окрашенные микропрепараты с использованием флюоресцентной микроскопии, например, в флюоресцентном режиме (набор фильтров 09) микроскопа Axio Scope A1 (Carl Zeiss, Германия) с высокочувствительной камерой. Обработку комет осуществляют с помощью специализированного программного обеспечения (например, Comet-Д версия 2.0), проводят анализ результатов исследования определяя процент ДНК в «хвосте кометы».
Данные обрабатывают на сохраненных цифровых изображениях либо в режиме реального времени в зависимости от программного обеспечения. Важно отметить, что из анализа исключаются апоптотические клетки, выявляемые на микропрепаратах в виде слабофлюоресцирующих ДНК-комет с широким диффузным «хвостом» и практически отсутствующей «головой» (рис. 4) [22].
Ожидаемые результаты
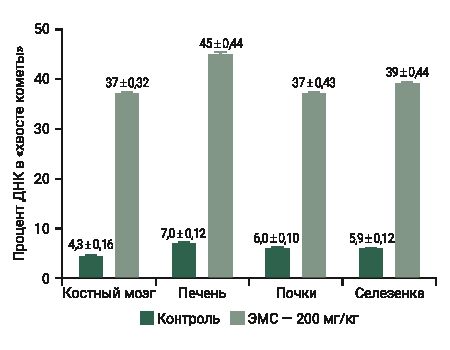
На рис. 5 приведены собственные результаты анализа повреждений ДНК в 3500 клеток в четырех органах – печени, почках, селезенке, костном мозге. Группе положительного контроля вводили внутрижелудочно ЭМС в дозе 200 мг/кг, контрольной группе животных – дистиллированную воду (растворитель).
Результаты исследования показали зависимость, при которой наблюдается в «хвосте кометы» до 10% ДНК у клеток без воздействия препарата и 30–50% ДНК у клеток, подвергшихся токсическому воздействию мутагена (см. рис. 5) [22].
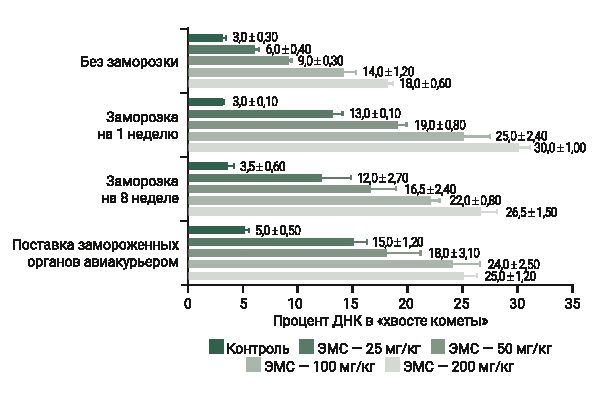
В сравнительном исследовании свежих и замороженных образцов тканей крыс линии SD (рис. 6) показано, что замороженные ткани демонстрируют аналогичный свежим тканям дозозависимый эффект при внутрижелудочном введении ЭМС в дозе 0, 25, 50, 100 и 200 мг/кг [23].
Также есть данные, опубликованные W. Barfield, B. Burlinson [24], в которых процент «хвоста кометы» в интактных клетках варьирует от 3,2 до 14,9, а процент «хвоста» в положительном контроле колеблется от 50,4 до 64,4. При этом можно сделать вывод, что данные контрольных групп должны значимо различаться, однако могут иметь небольшой диапазон вариаций от лаборатории к лаборатории.
Ключевые рекомендации
ДНК-комет-тест имеет ряд особенностей, влияющих на результативность метода. При постановке пилотных экспериментов мы столкнулись с определенными трудностями. Для того чтобы избежать ошибок и наладить эксперимент должным образом, советуем обратить внимание на следующие аспекты:
- время заморозки и разморозки играет значительную роль для результатов анализа (препараты должны быть заморожены как можно быстрее после эвтаназии животного, а затем разморожены и зафиксированы в агарозные слои за максимально короткий промежуток времени);
- гомогенизацию органов стоит проводить быстро, в холодной ступке;
- все манипуляции с органами, начиная с гомогенизации, следует проводить в защищенном от ультрафиолета месте при желтом освещении;
- особое внимание необходимо уделять температуре буферных растворов, которая не должна превышать 4°C;
- при застывании агарозных слоев на хладагенте важно следить за температурой стекол, нельзя давать агарозным слоям замораживаться;
- стекла должны быть чистыми и обезжиренными для предотвращения сползания агарозных слоев со стекол во время электрофореза;
- для облегчения регулировки необходимых параметров электрофореза объем буфера в электрофорезной камере рекомендуется замерить.
Заключение
ДНК-комет-тест находит применение в различных сферах (при клинических и доклинических исследованиях, в области экологии и др.) и может использоваться для изучения разнообразных воздействий (лекарственных средств, радиационного излучения, бытовой химии, промышленных химических веществ, различных заболеваний и др.) на живые клетки. От лаборатории к лаборатории метод может изменяться и модернизироваться.
Описанный метод криоконсервации тканей животных может быть применен для проведения ДНК-комет-теста в рамках исследования общетоксических свойств, что позволит значительно сократить количество животных, используемых для реализации программы доклинических исследований.
Благодарности
Работа выполнена без спонсорской поддержки.
Вклад авторов
Е.А. Гайдай – сбор и анализ данных, концепция и дизайн исследования, написание и редактирование текста статьи
А.А. Дорофеева – постановка эксперимента, сбор данных литературных источников, написание текста статьи
К.Л. Крышень, Д.С. Гайдай – сбор данных литературных источников, редактирование текста статьи
Сведения о конфликте интересов
Авторы заявляют об отсутствии конфликта интересов.
Список источников
- Ostling D. Microelectrophoretic study of radiation-induced DNA damages in individual mammalian cells / D. Ostling, K.J. Johanson // Biochemical and biophysical research communications. – 1984. – P. 291-298. DOI:10.1016/0006-291x(84)90411-x
- Сорочинская У.Б. Применение метода ДНК-комет для оценки повреждений ДНК, вызванных различными агентами окружающей среды / У.Б. Сорочинская, В.М. Михайленко // Онкология. – 2008. – T. Х. №3. – C. 303-309 [Sorochinskaya U.B. Primenenie metoda DNK-komet dlya otsenki povrezhdenii DNK, vyzvannykh razlichnymi agentami okruzhayushchei sredy / U.B. Sorochinskaya, V.M. Mikhailenko // Onkologiya. – 2008. –Vol. №3. – P. 303-309 (In Russ.)].
- Филиппов Э.В. Использование метода «ДНК-комет» для детекции и оценки степени повреждений ДНК клеток организмов растений, животных и человека, вызванных факторами окружающей среды (обзор) / Э.В. Филиппов // Наука и образование. – 2014. – №2. – С. 72-78 [Filippov E.V. Ispol'zovanie metoda «DNK-komet» dlya detektsii i otsenki stepeni povrezhdenii DNK kletok organizmov rastenii, zhivotnykh i cheloveka, vyzvannykh faktorami okruzhayushchei sredy (obzor) / E.V. Filippov // Nauka i obrazovanie. – 2014. – №2. – P. 72-78 (In Russ.)].
- MP 4.2.0014-10 Оценка генотоксических свойств методом ДНК-комет in vitro: Методические рекомендации. – 2010. – 16 с [MP 4.2.0014-10 Otsenka genotoksicheskikh svoistv metodom DNK-komet in vitro: Metodicheskie rekomendatsii. – 2010. – 16 p (In Russ.)].
- Hu M.L. Simple Cryoprotection and Cell Dissociation Techniques for Application of the Comet Assay to Fresh and Frozen Rat Tissues / M.L. Hu, C.H. Chuang, H.M. Sio, S.L. Yeh // Free Radic Res. – 2002. – Vol. 36. №2 – P. 203-9. DOI:10.1080/10715760290006420
- Singh N.P. A simple technique for quantitation of low levels of DNA damage in individual cells. / N.P. Singh, M.T. McCoy, R.R. Tice, E.L. Schneider // Exp Cell Res. – 1988 – Р. 184–91. DOI:10.1016/0014-4827(88)90265-0
- Жанатаев А.К. Методические аспекты оценки ДНК-повреждений методом ДНК-комет / А.К. Жанатаев, В.А. Никитина, Е.С. Воронина, А.Д. Дурнев // Прикладная токсикология. – 2011. – Т.11. №2(4). – С. 28-37 [Zhanataev A.K. Metodicheskie aspekty otsenki DNK-povrezhdenii metodom DNK-komet / A.K. Zhanataev, V.A. Nikitina, E.S. Voronina, A.D. Durnev // Prikladnaya toksikologiya. – 2011. – T.11. №2(4). – P. 28-37 (In Russ.)].
- Olive P.L. The comet assay: a method to measure DNA damage in individual cells / P.L. Olive, J.P. Banath // Nat Protoc. – 2006. – Vol.1. №1. – P. 23–9. DOI:10.1038/nprot.2006.5
- Guideline I. C. H. H. T. Guidance on genotoxicity testing and data interpretation for pharmaceuticals intended for human use S2 (R1) //International conference on harmonization of technical requirements for registration of pharmaceuticals for human use, ICH Expert Working Group. – 2012. – P. 1-25
- OECD No 489 guideline for the testing of chemicals. In vivo mammalian alkaline comet assay, Publishing, Paris. – 2014.
- Руководство по проведению доклинических исследований лекарственных средств. Часть первая // под ред. А.Н. Миронова. М.: Гриф и К. – 2012. – С. 845 – 855 [Rukovodstvo po provedeniyu doklinicheskikh issledovanii lekarstvennykh sredstv. Chast' pervaya // pod red. A.N. Mironova. M.: Grif i K. – 2012. – P. 845 – 855 (In Russ.)].
- Recio L. et al. Dose-response assessment of four genotoxic chemicals in a combined mouse and rat micronucleus (MN) and Comet assay protocol //The Journal of toxicological sciences. – 2010. – Vol. 35. №. 2. – P. 149-162. DOI:10.2131/jts.35.149
- Suzuki T. A comparison of the genotoxicity of ethylnitrosourea and ethyl methane sulfonate in lacZ transgenic mice (Muta Mouse) / T. Suzuki, M. Hayashi, X. Wang, K. Yamamoto, T. Ono, B.C. Myhr, T. Sofuni // Mutat. Res. – 1997. – Vol.395. – P. 75-82. DOI: 10.1016/s1383-5718(97)00144-7
- Sasaki Y.F. Simple detection of chemical mutagens by the alkaline single-cell gel electrophoresiм (Comet) assay in multiple mouse organs (liver, lung, spleen, kidney, and bone marrow) / Y.F. Sasaki, E. Nishidate, F. Izumiyama, N. Matsusaka, S. Tsuda // Mutat Res. – 1997. – Vol.391. №3. – P. 215-31. DOI: 10.1016 / s1383-5718 (97) 00073-9.
- Sasaki Y.F. Organspecific genotoxicity of the potent rodent colon carcinogen 1,2-dimethylhydrazine and three hydrazine derivatives: difference between intra-peritoneal and oral administration / Y.F. Sasaki, A. Saga, M. Akasaka, S. Ishi-bashi, K. Yoshida, Y.Q. Su, N. Matsusaka, S. Tsuda // Mutat Res. – 1998. – Vol.415. №1-2. – P. 1-12. DOI: 10.1016/s1383-5718(98)00002-3
- Monroe J.J. A comparative study of in vivo mutation assays: analysis of hprt, lacI, cII/cI and as mutational targets for N-nitroso-N-methylurea and benzo[a]pyrene in Big Blue mice / J.J. Monroe, K.L. Kort, J.E. Miller, D.R. Marino, T.R. Skopek // Mutat Res. – 1998. – Vol.12. – P. 121-36. DOI: 10.1016/s0027-5107(98)00171-7
- Костяев А.А. Токсичность криопротекторов и криоконсервантов на их основе для компонентов крови и костного мозга (обзорная статья) / А.А. Костяев, А.К. Мартусевич, А.А. Андреев // Научное обозрение. Медицинские науки. – 2016. – № 6 – С. 54-74 [Kostyaev A.A. Toksichnost' krioprotektorov i kriokonservantov na ikh osnove dlya komponentov krovi i kostnogo mozga (obzornaya stat'ya) / A.A. Kostyaev, A.K. Martusevich, A.A. Andreev // Nauchnoe obozrenie. Meditsinskie nauki. – 2016. – № 6 – P. 54-74 (In Russ.)].
- Jackson P. Validation of freezing tissues and cells for analysis of DNA strand break levels by comet assay / P. Jackson, L.M. Pedersen, Z.O. Kyjovska, N.R. Jacobsen, A.T. Saber, K.S. Hougaard, U. Vogel, H. Wallin // Mutagenesis. – Vol.28. №6. – P. 699–707. DOI: 10.1093/mutage/get049
- Enciso J.M. Does the duration of lysis affect the sensitivity of the in vitro alkaline comet assay? / J.M. Enciso, O. Sanchez, A.L. de Cerain, A. Azqueta // Mutagenesis. – 2015. – Vol.30. – P. 21-28. DOI: 10.1093/mutage/geu047
- Hartmann A. Recommendations for conducting the in vivo alkaline Comet assay / A. Hartmann, E. Agurell, C. Beevers, S. Brendler-Schwaab, B. Burlinson, P. Clay, A. Collins, A. Smith, G. Speit, V. Thybaud, R.R. Tice // Mutagenesis. – 2003. – Vol.18. No.1. – P. 45–51. DOI: 10.1093/mutage/18.1.45
- Sirota N.P. Some causes of inter-laboratory variation in the results of comet assay / N.P. Sirota, A.K. Zhanataevb, E.A. Kuznetsova, E.P. Khizhnyaka, E.A. Anisinab, A.D. Durnev // Mutation Research. – 2014. – Vol.770. – P. 16–22. DOI: 10.1016/j.mrgentox.2014.05.003
- Жанатаев А.К. Феномен атипичных ДНК-комет / А.К. Жанатаев, Е.А. Анисина, З.В. Чайка, И.А. Мирошкина, А.Д. Дурнев // Цитология. – 2017. – Т.59. – №3. – С. 163-168 [Zhanataev A.K. Fenomen atipichnykh DNK-komet / A.K. Zhanataev, E.A. Anisina, Z.V. Chaika, I.A. Miroshkina, A.D. Durnev // Tsitologiya. – 2017. – Vol.59. №3. – P. 163-168 (In Russ.)].
- Recio L. Comparison of Comet assay dose-response for ethyl methane sulfonate using freshly prepared versus cryopreserved tissues / L. Recio, G.E. Kissling, C.A. Hobbs, K.L. Witt // Environmental and Molecular Mutagenesis. – 2011. – Vol.53. No 2. – P. 101–113. DOI: 10.1002/em.20694
- Barfield W., Burlinson B. p-Chloroaniline, t-butylhydroquinone, and methyl carbamate: Rat in vivo comet test, JaCVAM trial phase 4.2 //Mutation Research / Genetic Toxicology and Environmental Mutagenesis. – 2015. – Vol. 786. – P. 98-103. DOI: 10.1016/j.mrgentox.2015.05.007




