Опыт моделирования гнойно-воспалительной раны на фоне иммуносупрессии
Парийская Е.Н., Захарова Л.Б., Орлова О.Г., Рыбальченко О.В., Голованова Н.Э., Астратенкова И.В. Опыт моделирования гнойно-воспалительной раны на фоне иммуносупрессии. Лабораторные животные для научных исследований. 2018; 4. https://doi.org/10.29296/2618723X-2018-04-09
Резюме
Резюме. В настоящее время лечение гнойных осложнений мягких тканей является одной из самых распространенных проблем в медицинской практике. Постоянно совершенствуются методы воздействия и анализа влияния лекарственных средств на различных моделях гнойных ран животных. Модели, описанные в литературе, не всегда могут успешно воспроизводиться на практике. Рассмотрены несколько вариантов моделирования развития гнойно-воспалительного процесса в кожных ранах у крыс. На 1-м этапе для выбора наиболее эффективного иммуносупрессора проводили сравнительный анализ выживания крыс при воздействии гидрокортизона и метотрексата. Затем в качестве инфицирующих раны микроорганизмов апробировали бактерии 2 видов: Staphylococcus aureus 6 – представитель нормальной микробиоты кожи и Pseudomonas indica 23 – аналог наиболее распространенного вида псевдомонад – возбудителей внутрибольничных инфекций. Инфицирование ран проводили, используя однородную и смешанную суспензию 2 указанных выше бактериальных культур, а также монокультуры в виде биопленок. По результатам проведенных исследований определили наиболее оптимальную модель получения гнойных ран, а именно вариант с применением иммуносупрессии гидрокортизоном. Воздействие гидрокортизона в течение 7 сут (25 мг/кг), в отличие от метотрексата, не приводило к летальности животных. При этом однократное введение суспензионной смешанной бактериальной культуры S. aureus 6 и P. indica 23 вызывало развитие гнойно-воспалительного процесса в течение 48 ч. Увеличение диаметра внутреннего отверстия силиконового фиксатора, в котором располагается рана, позволило более точно проводить планиметрическую оценку повреждений и визуально наблюдать за скоростью краевой эпителизации.
Введение
Гнойная патология мягких тканей остается одной из самых распространенных и актуальных групп заболеваний человека. Как известно, широкий круг факторов влияет на все фазы заживления ран.
У здоровых людей гнойно-воспалительные раны встречаются редко. Они обычно возникают у пациентов с хроническими заболеваниями или получающих иммуносупрессивную терапию, например глюкокортикоиды. В настоящее время пациенты с гнойно-воспалительными заболеваниями составляют около 40% больных хирургического профиля, а послеоперационные гнойные осложнения развиваются в среднем у 30% больных [1]. Такие осложнения сопровождаются снижением показателей иммунитета (количества и функций иммунокомпетентных клеток); ингибированием ангиогенеза, пролиферации фибробластов и синтеза компонентов внеклеточного матрикса [2].
В опубликованных научных статьях для проведения экспериментов предлагаются разнообразные модели гнойных ран, что ставит исследователей перед сложным выбором, так как неотъемлемой частью изучения новых направлений в лечении ран является использование адекватной модели гнойно-воспалительного процесса мягких тканей in vivo.
Цель данной работы – получение модели гнойно-воспалительного процесса в кожных ранах крыс для последующего исследования лечебного воздействия на раневую поверхность холодной плазмы атмосферного давления, а также различных лекарственных препаратов.
Материал и методы
Эксперимент был выполнен на 44 белых беспородных крысах-самцах массой 180–190 г (питомник РАН «Рапполово», Россия). Условия содержания животных соответствовали стандартным условиям вивария. Температуру воздуха поддерживали на уровне 20–24°С, влажность – 45–65%, световой режим – 12 ч свет/12 ч темнота. Акклиматизацию животных осуществляли в течение 14 сут.
Крыс содержали в индивидуальных клетках со свободным доступом к пище и воде. Эксперименты на животных проводили в полном соответствии с Директивой Европейского Совета по соблюдению этических принципов в работе с лабораторными животными (The European Council Directive (86/609/EEC)) и Директивой 2010/63/EU Европейского Парламента и Совета Европейского Союза.
Индукцию патологии (оперативное вмешательство по нанесению кожных ран) осуществляли под наркозом. В качестве
наркоза и анестезирующего вещества использовали «Золетил 100» (Virbac, Франция) (30 мг/кг массы
тела, внутримышечно) – диссоциативный анестетик, разрешенный к применению на территории Российской
Федерации. Перед нанесением полнокожных ран у животного в области операционного поля на спине между
лопатками ножницами состригали шерсть. Остатки шерсти удаляли с помощью крема для депиляции (Eveline Cosmetics,
Польша), который наносили на 3 мин. Затем операционное поле последовательно обрабатывали однократно 5%-ым спиртовым
раствором йода и 70º этиловым спиртом. С помощью стерильного стилета для биопсии кожи Dermo-punch
диаметром 5 мм (Sterylab, Италия) крысам через оттянутую кожную складку на спине между лопатками, наносили 2
полнослойные кожные раны глубиной до поверхностной фасции мышц [3]. Вырезанный участок кожи удаляли с помощью
пинцета и ножниц, затем пришивали (шовный материал лавсан 4-0) силиконовое кольцо толщиной 1 мм
с диаметром внутреннего отверстия
5 мм [4, 5] или 8 мм. Наличие раны не доставляло животным дискомфорта,
не влияло на их двигательную активность и аппетит.
Для иммуносупрессии использовали введение метотрексата-эбеве (раствор для инъекций 10 мг/мл, шприц – 2 мл, «Ebeve», Австрия). Метотрексат вводили по 2 схемам: однократное введение – в дозе 10 мг/кг внутримышечно (6 животных) [6] и ежедневное введение – в течение 4 сут в дозе 150 мкг/кг внутримышечно (8 животных). Для получения желаемой концентрации метотрексат разводили стерильным физиологическим раствором. В качестве 2-го варианта иммуносупрессии применяли гидрокортизон (125 мг) («Гедеон Рихтер», Венгрия) в дозе 25 мг/кг (внутримышечно) в течение 7 сут (1-й укол – за 1 сут до нанесения раны) [2].
Для инфицирования ран, с целью получения локального воспалительного процесса использовали 2 вида бактерий S. aureus 6 и P. indica 23. Суточную культуру микроорганизмов выращивали до концентрации 108-9 КОЕ/мл на жидкой питательной среде сердечно-мозговой бульон (Brain Heart Infusion Broth, HiMedia, Индия). Биопленку S. aureus 6 и P. indica 23 (1011-12 КОЕ/см2) формировали предварительно на поверхности плотной питательной среды (агар Мюллера–Хинтона, HiMedia, Индия) в течение 24 ч при температуре 37ºС. В экспериментах использовали культуры микроорганизмов из коллекции ФГБУ «НИЦЭМ им. Н.Ф. Гамалеи» Минздрава России.
Раны однократно инфицировали разными способами. В область дна раны вносили суспензию бактерий 109 КОЕ/мл в количестве 0,1 мл S. aureus 6 или P. indica 23 на рану. 2-й способ – внесение суспензии смешанной бактериальной культуры S. aureus 6 и P. indica 23 в концентрации 108-9 КОЕ/мл в количестве 0,1 мл на рану. В 3-м случае на рану наносили фрагменты плотной питательной среды со сформированной биопленкой (1011-12 КОЕ/см2) S. aureus 6 или P. indica 23. Для этого, вырезанные из плотной питательной среды фрагменты с биопленкой, равные по размеру диаметру раны (5 мм), помещали на дно раны. После внесения микроорганизмов раневую поверхность изолировали от внешней среды стерильной прозрачной пищевой пленкой на 2 сут. Пленка крепилась к поверхности силиконового круга благодаря своим свойствам, без постороннего клеящего средства.
Эвтаназия животных не осуществлялась.
В течение всего эксперимента раны ежедневно фотографировали. Полученные изображения переносили в компьютер, калибровали и измеряли площадь раневого поражения с помощью программы Scion Image (NIH, США). После чего рассчитывали площадь раневой поверхности на 3-и, 5-е и 7-е сутки. Результаты выражали в % от исходной площади. Количество микроорганизмов в инфицированных ранах определяли с помощью высевов. Для этого ежедневно отделяемое раны отбирали с помощью стерильного тампона и распределяли по поверхности плотной питательной среды (агар Мюллера–Хинтона). Посевы помещали в термостат и выдерживали в течение 24 ч при температуре 37ºС. Результаты посевов, т.е. количество колониеобразующих единиц, подсчитывали и выражали в КОЕ/см2.
Каждое животное взвешивали до начала эксперимента и в последующие дни.
Статистическую обработку полученных данных выполняли с помощью программы Statistics 19.
Результаты и обсуждение
Заживление раны начиналось с пролиферативной стадии и выражалось в появлении краевой эпителизации, приводящей к уменьшению площади раны путем сокращения и фиброплазии (образование соединительной ткани). Динамику течения воспалительного процесса в эксперименте оценивали по появлению краевой эпителизации.
Фиксация краев раны с помощью силиконового кольца позволяла предупредить преждевременное стягивание краев раны,
что давало возможность «стандартизировать» площадь раны, независимо от индивидуальных особенностей
процесса заживления у экспериментального животного, а также оценить воздействие изучаемого препарата.
Поскольку диаметр внутреннего отверстия силиконового кольца (5 мм) совпадал с диаметром наносимой раны [4], то
возникала трудность с оценкой появления краевой эпителизации при заживлении раны (рис. 1). В связи
с этим было решено применять силиконовое кольцо с диаметром внутреннего отверстия 8 мм, что на 3 мм больше
диаметра самой раны, что позволило с легкостью осуществлять визуальную оценку появления краевой эпителизации
(рис. 2).


Введение метотрексата однократно в дозе 10 мг/кг привело к гибели 2 из 6 животных (~30%) на 3-й день от
начала эксперимента. Введение препарата в дозе
0,15 мг/кг в течение 4 сут вызвало на
3-и сутки гибель 6 из 8 (75%) животных. Животные теряли примерно 20–30% массы тела. У выживших
животных отмечалось воспаление слизистой оболочки глаз (слизистое или гнойное отделение из глаз), жидкий стул,
снижение двигательной активности, потеря аппетита.
Метотрексат – антиметаболит группы структурных аналогов фолиевой кислоты. Препарат оказывает противоопухолевое, цитостатическое и иммунодепрессивное действия. Подавляет синтез и репарацию ДНК, клеточный митоз, в меньшей степени влияет на синтез РНК и белка. Наиболее чувствительны к препарату активно делящиеся клетки [7]. Согласно полученным результатам, использовать этот препарат нерационально.
Гидрокортизон входит в группу глюкокортикостероидов (ГКС), которые, как известно, предотвращают активацию фосфолипазы A2, стимулируя образование ее ингибитора – липокортина, нарушают синтез простагландинов и выделение макрофагального хемотаксического фактора, ингибируют активацию тканевых кининов, уменьшают миграцию макрофагов и лимфоцитов в очаг воспаления. Преимущество гидрокортизона в моделировании гнойно-воспалительного процесса обусловлено тем, что ГКС подавляют различные стадии иммуногенеза, но не оказывают митостатического действия [8]. Воздействуя на функции клеток, которые играют важную роль при заживлении ран, ГКС вызывают значительное замедление процесса репарации тканей. Известно, что у пациентов, принимающих ГКС или получающих другую иммуносупрессивную терапию, наблюдается значительное замедление заживления кожных ран [2].
В экспериментах с гидрокортизоном животные были разделены на 5 групп по 6 крыс в каждой в зависимости от способа инфицирования раны (см. таблицу).

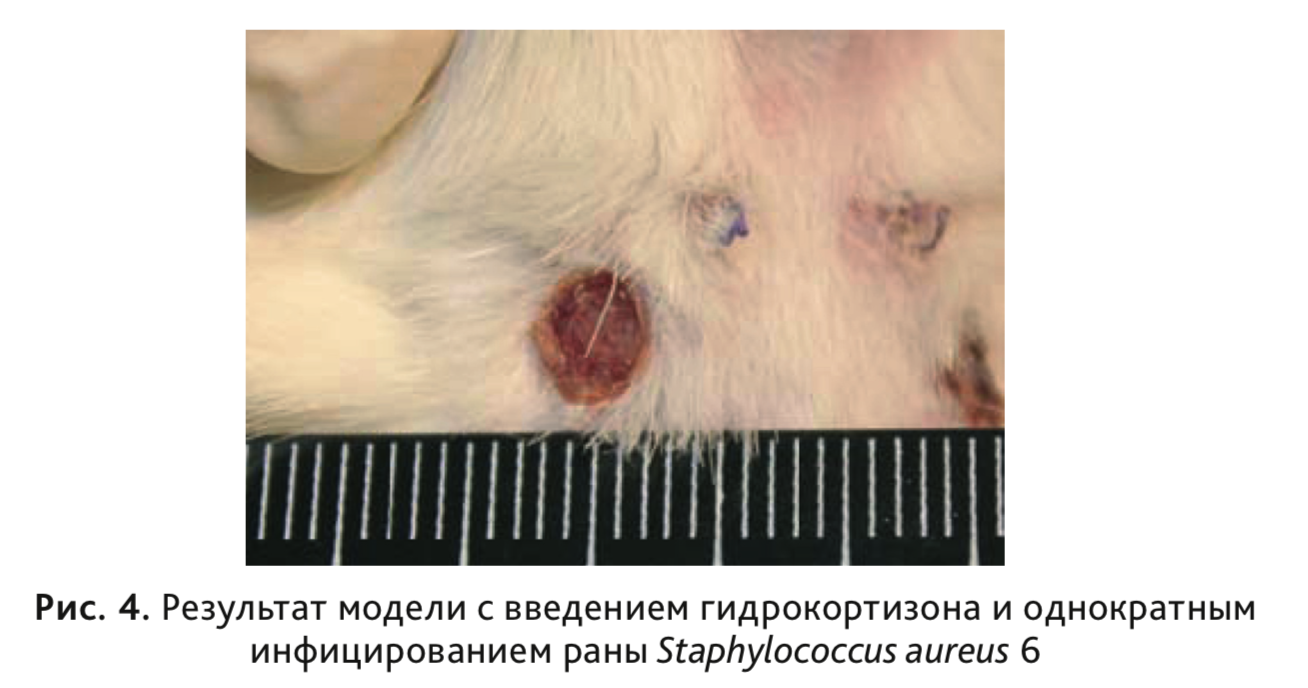
Результаты исследования показали, что на всем протяжении эксперимента значения степени заживления у крыс I и II группы, практически не отличались, и на 5-е сутки эксперимента площадь раневой поверхности составила около 75%, на 7-е сутки – 55% от площади нанесенной раны (рис. 3). В этих группах не формировался гнойно-воспалительный процесс (рис. 4), и на 3-и сутки роста микроорганизмов не обнаружено.
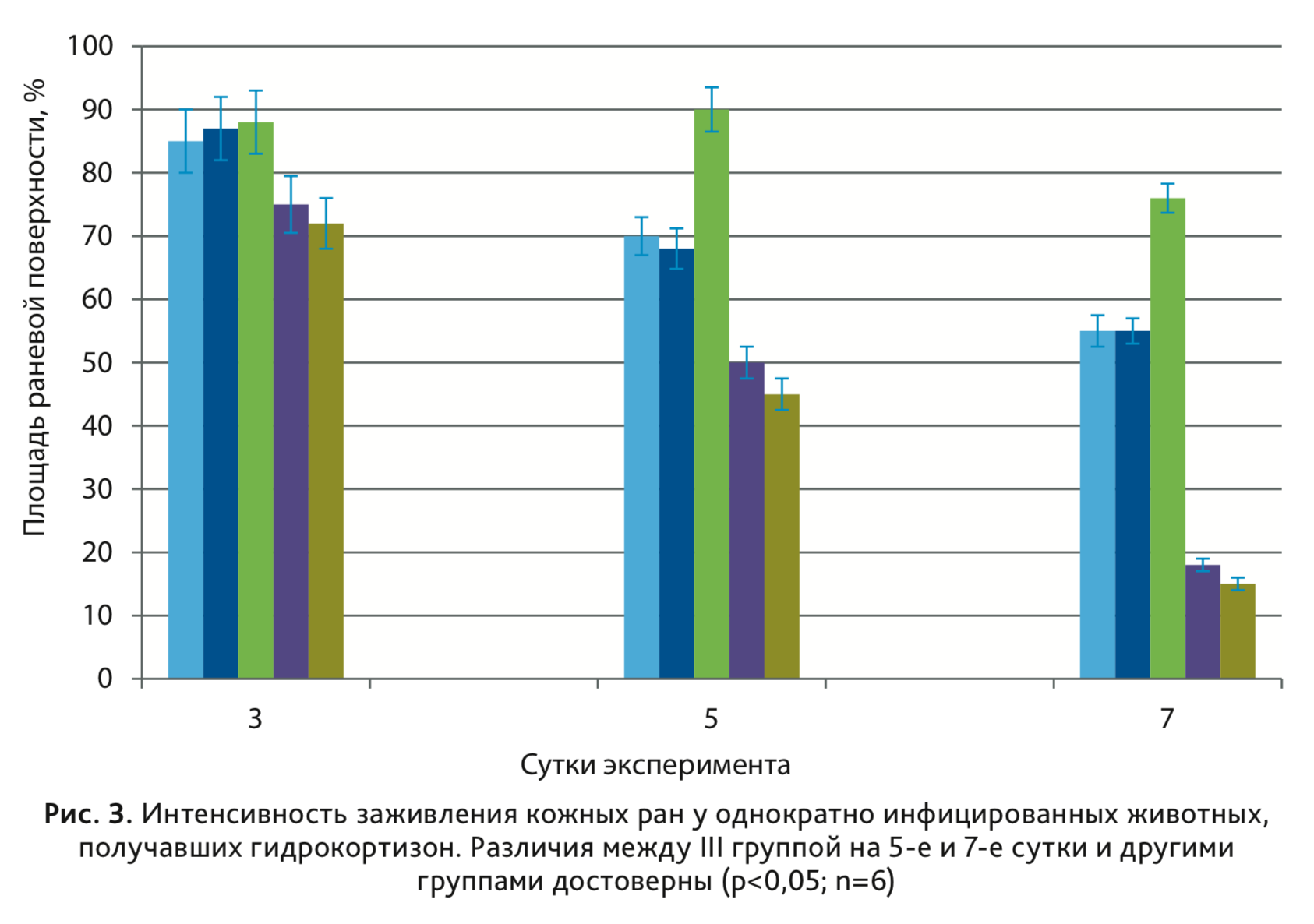
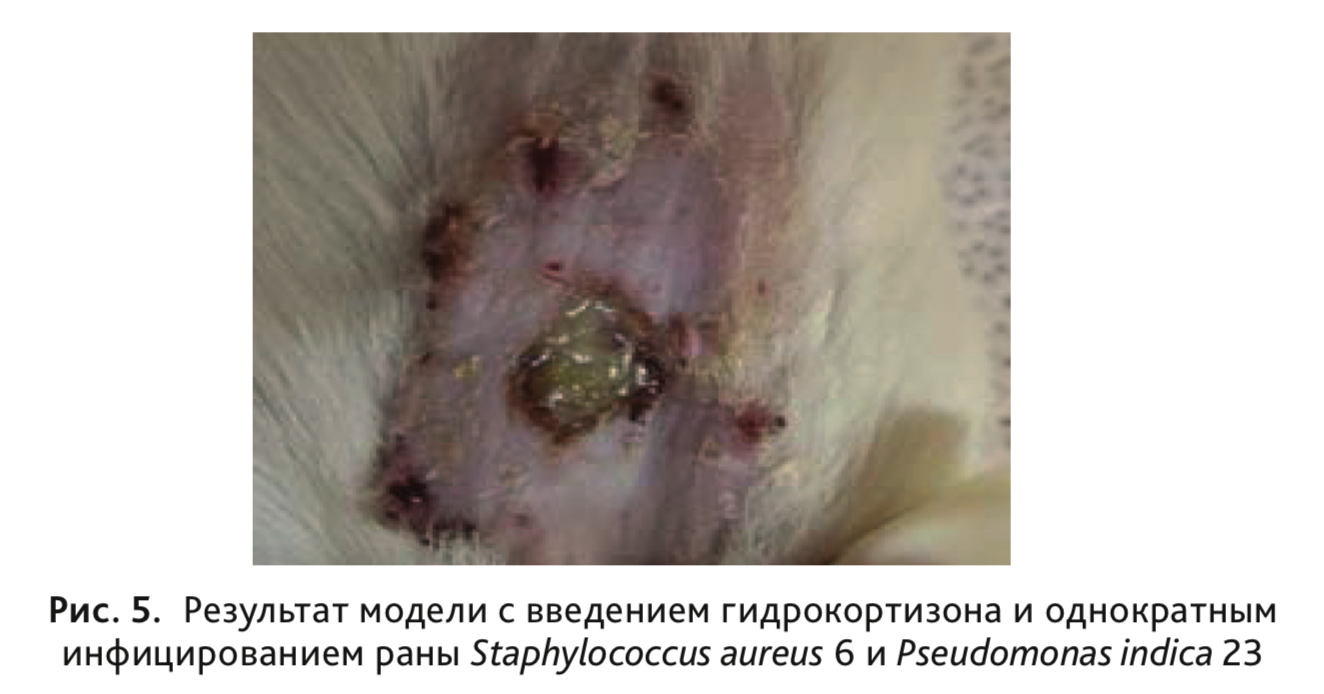
У животных III группы при использовании микробной суспензии в жидкой питательной среде, содержащей клетки S. aureus 6 и P. indica 23 в концентрации 108 КОЕ/мл в количестве 0,1 мл, на 2-е сутки от начала эксперимента получили гнойную кожную рану с заданной бактериальной обсемененностью, которая по своим характеристикам была максимально приближена к реальному клиническому течению раневого процесса (рис. 5). На 3-и сутки микробная обсемененность раны составила 106 КОЕ/см2, к 5-м суткам уровень обсемененности еще оставался высоким 105 КОЕ/см2, а к 7-м суткам обсемененность снижалась до 102 КОЕ/см2. Площадь раневой поверхности на 5-е сутки составляла 90%, а к 7-м суткам достигала 75% от площади исходной нанесенной раны (см. рис. 3).
В группах IV и V инфицирование осуществляли при помещении на рану кусочка плотной питательной среды со сформированной биопленкой S. aureus 6 или P. indica 23 в концентрации 1011-12 КОЕ/мл. На сегодняшний день принято считать, что биопленка микроорганизмов – хорошо сформированное сообщество физиологически активных клеток, погруженных в биополимерный матрикс, обладающий повышенной устойчивостью к факторам окружающей среды. Развитие любого инфекционного процесса бактериальной природы связано с развитием биопленки [9]. Помещение хорошо сформированной биопленки на раневую поверхность может привести к развитию острого воспалительного процесса в ране. Однако результаты исследования показали, что на протяжении эксперимента показатели заживления у крыс были высокими. Так, на 5-е сутки эксперимента площадь раневой поверхности составила около 50%, на 7-е сутки – меньше 20% от площади нанесенной раны (см. рис. 3). В этих группах не отмечалось гнойно-воспалительного процесса, и на 3-и сутки обсемененность ран отсутствовала.
Одной из более вероятных гипотез, объясняющих это явление, является наличие агаризованной питательной среды в ране. Возможно, агар-агар проявляет сорбционные свойства и нейтрализует выделяемые микроорганизмами факторы патогенности в ране, тем самым улучшая показатели заживления. По результатам исследования на 7-е сутки инфицированные биопленками на агаре раны заживали лучше, чем при других условиях.
Заключение
В результате проведенных исследований была выбрана оптимальная модель получения гнойной раны на фоне иммуносупрессии. Использование гидрокортизона (25 мг/кг в течение 7 сут), в отличие от метотрексата, не приводило к летальности животных, а однократное введение суспензии смешанной культуры S. aureus 6 и P. indica 23 вызывало развитие гнойно-воспалительного процесса в течение 48 ч. Увеличение диаметра внутреннего отверстия силиконового фиксатора краев раны позволило более точно проводить планиметрическую оценку ран и визуально наблюдать за скоростью краевой эпителизации.
Работа выполнена при поддержке гранта Санкт-Петербургского государственного университета № 037.218.2016
Список источников
- Григорьян А.Ю., Бежин А.И., Панкрушева Т.А., Чекмарева М.С., Мишина Е.С., Жиляева Л.В. Раневое покрытие с хлоргексидином биглюконатом и метронидазолом для лечения ран. Международный журнал прикладных и фундаментальных исследований. 2016, 4 (4): 694–7.
- Варюшина, Е.А., Анциферова М.А., Александров Г.В. и др. Модель осложненного течения раневого процесса у мышей на фоне иммуносупрессии, вызванной введением гидрокортизона. Цитокины и воспаление . 2004, 4: 14–20.
- Naldaiz-Gastesi N. et al. Identification and Characterization of the Dermal Panniculus Carnosus Muscle Stem Cells. StemCellReports 7.3 (2016): 411–24. PMC. Web. 5 Feb. 2018.
- Dunn, L., Prosser, H. C., Tan, J. T., Vanags, L. Z., Ng, M. K., Bursill, C. A. Murine Model of Wound Healing. J. Vis. Exp. (75), e50265, doi:10.3791/50265 (2013).
- Wong V.W., Sorkin M., Glotzbach J.P., Longaker M.T. and Gurtner G.C. Surgical Approaches to Create Murine Models of Human Wound Healing. Journal of Biomedicine and Biotechnology, Vol. 2011, Article ID 969618, 8 pages, 2011. DOI:10.1155/2011/969618
- Железнова А.Д. Экспериментальное обоснование применения милиацина для коррекции иммуносупрессии, индуцированной метотрексатом. Автореф. дисс. канд. мед. наук, Пермь, 2010, Медицинские диссертации http://medical-diss.com/medicina/eksperimentalnoe-obosnovanie-primeneniya-miliatsina-dlya-korrektsii-immunosupressii-indutsirovannoy-metotreksatom#ixzz5W53b56Rk
- Видаль-2016. Справочник Видаль. Лекарственные препараты в России Изд. «Видаль Рус», 2016, 1240 с.
- Cain D.W., Cidlowski J.A. Immune regulation by glucocorticoids. Nature Reviews Immunology. 2017, 17: 233–47.
- Афиногенова А.Г., Даровская Е.Н. Микробные биопленки ран: состояние вопроса. Травматология и ортопедия России. 2011, 3: 119–25.




