Характеристика модели циклофосфамидиндуцированной иммуносупрессии у мышей линии Balb/c
Работа выполнена без спонсорской поддержки.
Полюга Н.Л., Крышень К.Л., Муразов Я.Г. , Трофимец Е.И., Гущин Я.А., Бельтюков П.П., Скворцов Н.В. Характеристика модели циклофосфамидиндуцированной иммуносупрессии у мышей линии Balb/c. Лабораторные животные для научных исследований. 2023; 1. https://doi.org/10.57034/2618723X-2023-01-01
Резюме
Химиотерапия (ХТ) остается одним из основных методов лечения злокачественных новообразований. Однако применение ряда химиотерапевтических агентов ассоциировано с развитием значимых побочных эффектов, связанных с цитотоксическим действием препаратов на клетки иммунной системы. Для профилактики жизнеугрожающих состояний, связанных с иммуносупрессивным действием ХТ, предложен ряд средств сопроводительной и поддерживающей терапии. Предпринимаются многочисленные попытки поиска иммуномодулирующих агентов, способных снизить выраженность иммунотоксических эффектов ХТ у онкологических больных. Для доклинической оценки фармакологической активности данных препаратов используются подходы, моделирующие состояния, наблюдаемые в клинической практике. Цель работы — охарактеризовать модель иммуносупрессии у мышей линии Balb/с, индуцированной высокой дозой циклофосфамида. Исследование выполнено на мышах-самцах линии Balb/с в возрасте 5–7 нед. Сформировано 2 группы животных: 1-я (контрольная) группа (n=21) получала носитель — 0,9% раствор натрия хлорида, внутрибрюшинно, однократно; 2-я (экспериментальная) группа (n=21) — циклофосфамид, доза 150 мг/кг, внутрибрюшинно, однократно. После введения циклофосфамида по 7 животных из каждой группы подвергали эвтаназии на 5, 11 и 18-й день. На некропсии осуществляли забор и взвешивание тимуса и селезенки для оценки массовых коэффициентов и гистологического анализа. Во время эвтаназии у мышей отбирали кровь для подсчета общего количества лимфоцитов, анализа их субпопуляционного состава с помощью проточной цитометрии и определения уровня IgG методом иммуноферментного анализа. Однократное введение циклофосфамида в высокой дозе приводило не только к дистрофическим изменениям тимуса и селезенки, а также к транзиторным, при этом изменялись изученные показатели клеточного и гуморального звеньев иммунитета животных, включая динамику общего количества лимфоцитов, их субпопуляционный состав (T- и B-лимфоциты, CD4+ и CD8+ Т-лимфоциты), уровень IgG. Максимальные изменения параметров регистрировали на 5-й день исследования с постепенным восстановлением к 18-му. Предложенная модель циклофосфамидиндуцированной иммуносупрессии может применяться в доклинических исследованиях эффективности перспективных средств профилактики и лечения иммунодефицитных состояний различного генеза.
Введение
В мире и в Российской Федерации наблюдается неуклонный рост заболеваемости и смертности от злокачественных новообразований (ЗНО), в том числе среди трудоспособного населения [1, 2]. Несмотря на значительный успех, достигнутый в области разработки и внедрения новых опций лекарственного лечения ЗНО (таргетная, иммунотерапия), химиотерапия (ХТ) и по сей день остается важной составляющей терапии (лечения) рака [3]. Циклофосфамид является алкилирующим агентом, производным азотистого иприта и уже более 60 лет применяется в лечении солидных опухолей и лимфопролиферативных заболеваний. Помимо антимитотической и антипролиферативной активности, в высоких дозах циклофосфамид дает выраженный иммуносупрессивный эффект. Следует отметить, что влияние циклофосфамида на иммунную систему многообразно и зависит от вводимой дозы препарата (рис. 1).
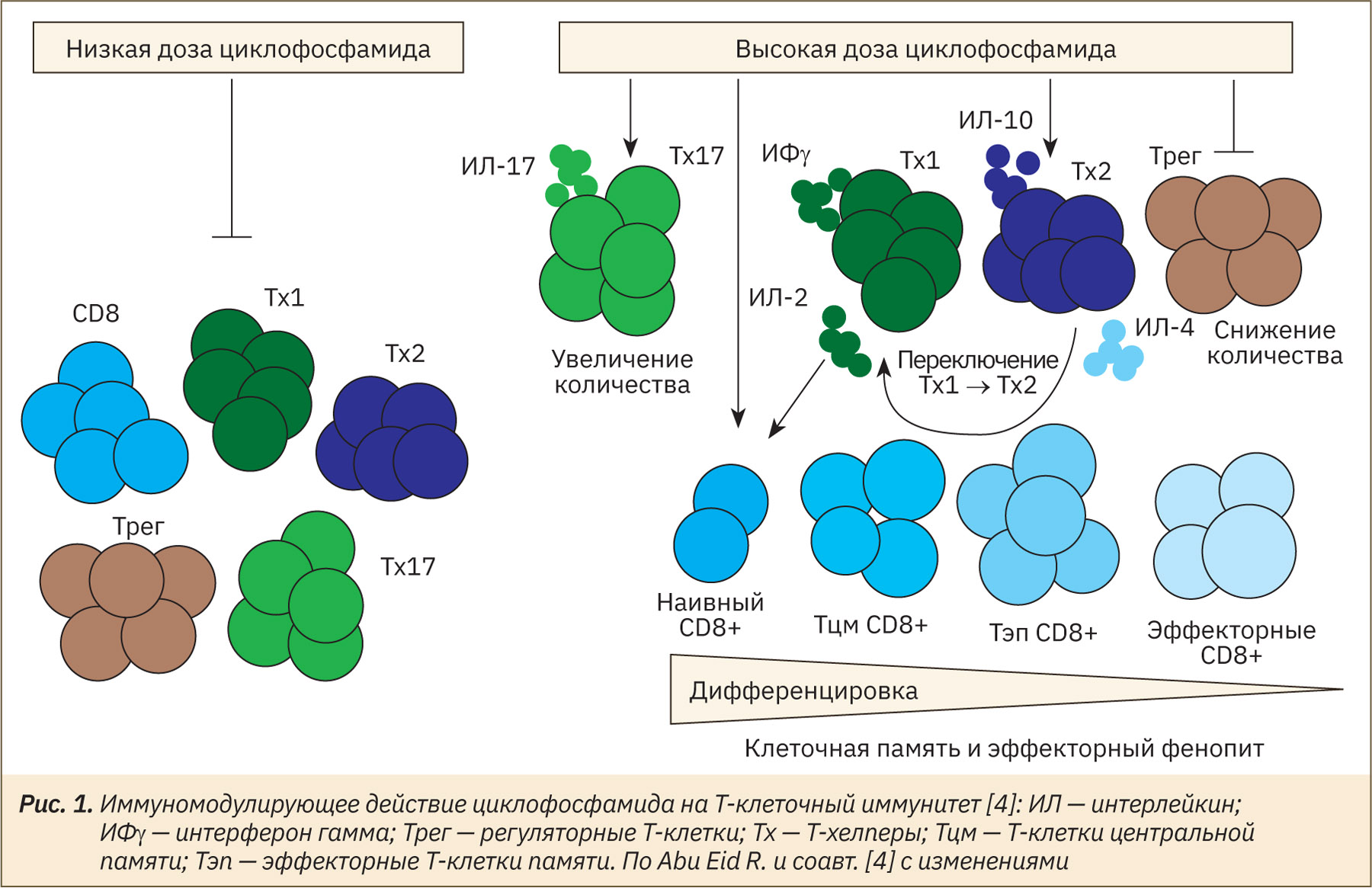
Введение циклофосфамида в высоких дозах приводит к неспецифическому снижению количества Т-клеток. Однако в низких дозах циклофосфамид оказывает действие на различные субпопуляции Т-лимфоцитов: происходит избирательное снижение количества регуляторных Т-клеток (Tрег) и ингибирование их супрессивной функции; переключение секреции цитокинов с Tх2 на Tх1; повышение количества и активности Tх17‑клеток памяти и цитотоксических CD8+ Т-клеток.
Наличие у данного препарата иммуносупрессивных эффектов обусловило его применение в клинике для лечения аутоиммунных заболеваний и хронической реакции трансплантат против хозяина у реципиентов после аллогенной трансплантации гемопоэтических стволовых клеток [4]. Следует отметить, что иммуносупрессия является не только значимым нежелательным явлением, которое развивается на фоне ХТ (в том числе циклофосфамидом), она также может возникать при инфекционных заболеваниях, например, при коронавирусной инфекции (COVID-19), вызванной коронавирусом SARS-CoV-2. Установлено, что общее количество Т-клеток, CD4+ и CD8+ Т-клеток было резко снижено у пациентов с COVID-19, особенно у лиц, нуждающихся в интенсивной терапии [5].
Основным видом токсичности, лимитирующим применение циклофосфамида, является угнетение гемопоэза. На фоне терапии циклофосфамидом наблюдается снижение количества эритроцитов, лейкоцитов и тромбоцитов с последующим относительно быстрым их восстановлением [6]. Иммунодефицитные состояния, вызванные циклофосфамидом, повышают частоту вторичных инфекций и смертность онкологических больных, что также ограничивает применение этого препарата в онкологической практике. В последние годы предпринимаются многочисленные попытки создания иммуномодулирующих агентов синтетического и природного происхождения, которые способны снизить выраженность гематологических побочных эффектов цитостатиков и оказывать благоприятное действие на иммунитет пациентов, получающих ХТ. Для поиска таких средств широко используется модель фармакологически индуцированной иммуносупрессии циклофосфамидом у мышей [7–11]. Данная модель также применяется при изучении противоопухолевых средств в случае трансплантации животным ксенографтов опухолей человека как альтернатива иммунодефицитным мышам, которые требуют особых условий содержания, дорого стоят и демонстрируют высокую смертность [12]. Иммуносупрессия, вызванная введением циклофосфамида, применяется при экспериментальном моделировании грибковых инфекций у мышей для ослабления иммунного ответа к возбудителям человеческих микозов, вызванных грибами рода Candida [13].
Несмотря на большое число публикаций, посвященных фармакологической индукции иммуносупрессии циклофосфамидом, в настоящее время отсутствует единый протокол для воспроизведения этой модели. Доза введения циклофосфамида значимо различается и составляет от 50 до 200 мг/кг. Кроме того, используются различные пути введения индуктора патологии — внутрибрюшинный, подкожный и внутривенный, схема введения может быть последовательной или интервальной, а кратность его введения — однократной или многократной.
Цель работы — характеристика модели иммуносупрессии у мышей линии Balb/с, вызванной однократным внутрибрюшинным введением раствора циклофосфамида в дозе 150 мг/кг, с оценкой показателей выраженности иммунотоксических эффектов в отношении иммунокомпетентных органов и субпопуляционного состава лимфоцитов крови животных.
Материал и методы
Животные
В исследовании использовали самцов мышей линии Balb/c в возрасте 5–7 нед (2 группы по 21 животному; n=42). Проведение эксперимента было одобрено биоэтической комиссией АО «НПО «ДОМ ФАРМАЦИИ».
Всех животных содержали в стандартных условиях в соответствии с Директивой 2010/63/EU Европейского парламента и Совета Европейского союза от 22 сентября 2010 г. по охране животных, используемых в научных целях1 и Руководством по содержанию и использованию лабораторных животных2. Световой режим составлял 12 ч день и 12 ч темноты. Мыши получали полнорационный гранулированный комбикорм и питьевую воду ad libitum. Животных содержали в стандартных пластиковых клетках по 7 особей.
Дизайн эксперимента
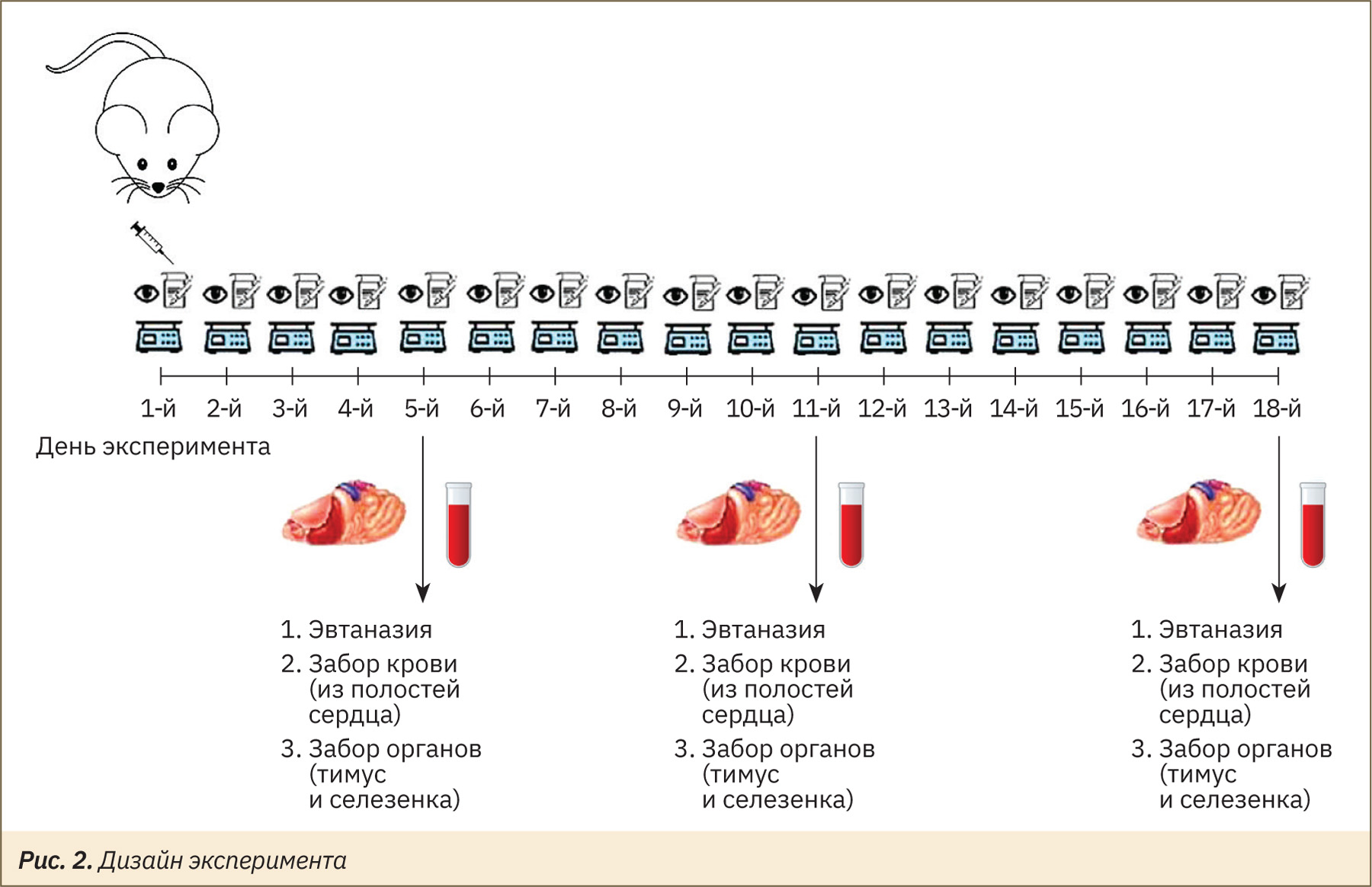
Индукцию иммуносупрессии у животных во 2‑й (экспериментальной) группе выполняли путем внутрибрюшинного введения циклофосфамида (Sigma-Aldrich, США, серия MKCL254, CAS-Номер: 6055‑19‑2) на 1‑й день эксперимента в дозе 150 мг/кг и объеме 20 мл/кг. Контрольной, 1‑й группе животных вводили носитель (0,9% раствор натрия хлорида) в аналогичном объеме.
Ежедневно проводили клиническое наблюдение и оценку динамики массы тела животных. По окончании эксперимента по 7 мышей из каждой группы подвергали эвтаназии путем постепенного наполнения камеры CO2 с последующим обескровливанием полостей сердца на 5, 11 и 18‑й дни эксперимента.
При проведении эвтаназии у животных отбирали кровь из полостей сердца в 3 пробирки ЭДТА-К3 (Improve, Китай) объемом 0,2 мл для дальнейшей оценки общего количества лимфоцитов, анализа их субпопуляционного состава и определения уровня IgG. После эвтаназии у животных осуществляли отбор и взвешивание тимуса и селезенки для оценки массовых коэффициентов и гистологического анализа. Дизайн эксперимента представлен на рис. 2.
Исследование субпопуляционного состава лимфоцитов крови проводили с помощью проточного цитометра СytoFLEX (Beckman Coulter, США) и коммерчески доступного набора антител к CD19 (кат. номер № B324740, серия 115546), CD8 (кат. номер №B312598, серия 100722), CD3 (кат. номер № B321239, серия 100236), CD45 (кат. номер № B324364, серия 103116), CD4 (кат. номер № B336799, серия 100540) компании Biolegend (CША). В образцах крови определяли следующие субпопуляции клеток: B- и Т-лимфоциты, цитотоксические Т-лимфоциты, Т-хелперы.
В образцах цельной крови регистрировали абсолютные значения количества лимфоцитов с помощью гематологического анализатора MYTHIC 18 (Orphee, Швейцария). Концентрацию IgG в плазме крови мышей определяли методом ИФА с помощью коммерчески доступного набора (MyBioSource, США, серия 25).
Тимус и селезенку фиксировали в 10% растворе нейтрального формалина в течение 24 ч, после чего по общепринятой методике заливали в парафин [14]. Затем изготавливали срезы толщиной 5–7 мкм, которые окрашивали гематоксилином и эозином [15]. Анализ гистологических препаратов проводили при помощи светооптического микроскопа Accu-Scope 3000 SERIES (США) при увеличении 40, 100, 400 и 1000. Микрофотографирование проводили при помощи цифровой фотокамеры TOUPCAM UCMOS05100KPA (Китай) и программного обеспечения ToupView 3.7.7892 (Hangzhou ToupTek Photonics Co., Ltd., Китай).
Статистический анализ
Статистический анализ выполняли с помощью лицензированного программного обеспечения GraphPad Prism, версия 9 (GraphPad, США). Нормальность распределения проверяли с помощью критерия Шапиро–Уилка и графиков квантиль-квантиль (QQ plot). Данные, имеющие нормальное распределение, представлены как M±SEM, где M — среднее арифметическое; SEM — стандартная ошибка среднего. В случае ненормального распределения результаты представлены в виде Me (Q1;Q3), где Me — медиана; Q1;Q3 — межквартильный размах. В зависимости от типа распределения данных применяли параметрические (t-критерий для парных сравнений) и непараметрические методы (критерий Манна–Уитни). Все критерии были двусторонними. Различия считали статистически значимыми при p<0,05.
Результаты и обсуждение
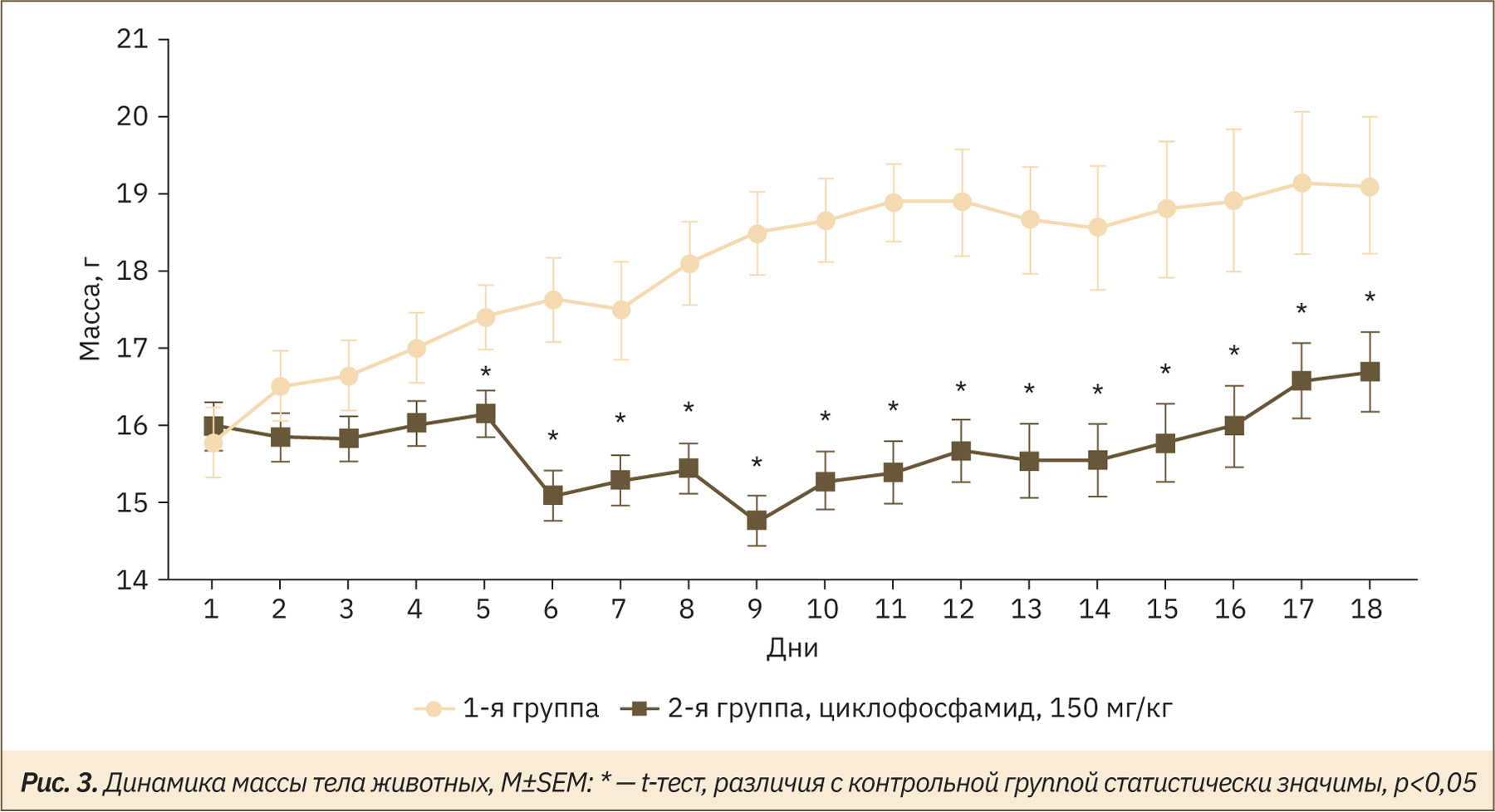
Масса тела является интегральным показателем оценки общетоксического действия циклофосфамида. Начиная с 5‑го дня эксперимента и вплоть до последней эвтаназии наблюдались статистически значимые различия в массе тела животных экспериментальной и контрольной групп (рис. 3). С 9‑го дня эксперимента масса тела животных экспериментальной группы постепенно увеличивалась, что свидетельствовало о восстановлении функций физиологических систем и органов животных.
Известно, что помимо клинического применения циклофосфамид широко используется в экспериментальных исследованиях для индукции иммунодефицита у животных [11]. В проведенном исследовании наблюдали уменьшение абсолютного количества лимфоцитов на 5‑й день с последующим увеличением к 11‑му и повторным незначительным снижением к 18‑му дню эксперимента (рис. 4).
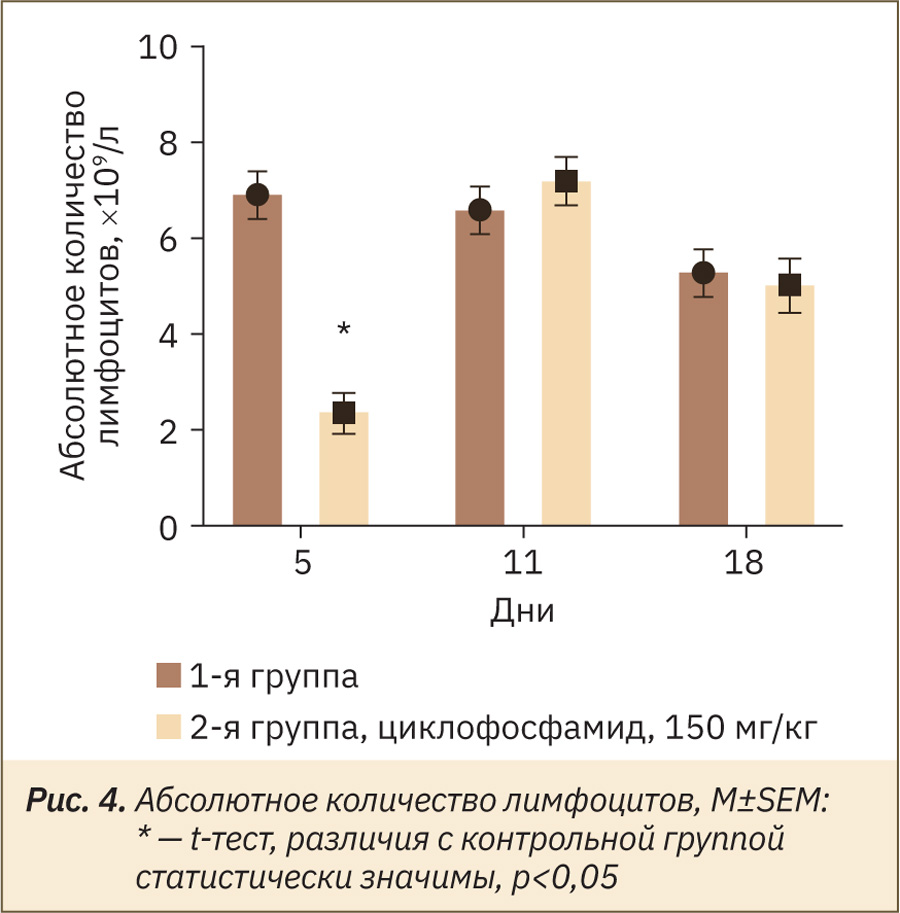
Аналогично, в работе X.‑H. Huyan и соавт. [16] у мышей, получавших циклофосфамид внутрибрюшинно в дозе 100–200 мг/кг, абсолютное количество лимфоцитов снижалось уже на 1‑й день эксперимента и достигало минимума на 4‑й, затем восстановилось на 10‑й день и снова снижалось на 17‑й.
Циклофосфамид оказывал действие на относительное содержание В-лимфоцитов (статистически значимое уменьшение на 5‑й день эксперимента и тенденция к увеличению на 18‑й), Т-лимфоцитов (увеличение доли, но без достижения статистической значимости на 5‑й день и последующая тенденция к уменьшению на 11‑й и 18‑й дни эксперимента), CD4+ Т-хелперов (увеличение на 5‑й день эксперимента, уменьшение на 11‑й и повторное увеличение к 18‑му дню эксперимента), наивных CD8+ Т-цитотоксических клеток (постепенное уменьшение к 11‑му дню и увеличение на 18‑й день эксперимента) (рис. 5).
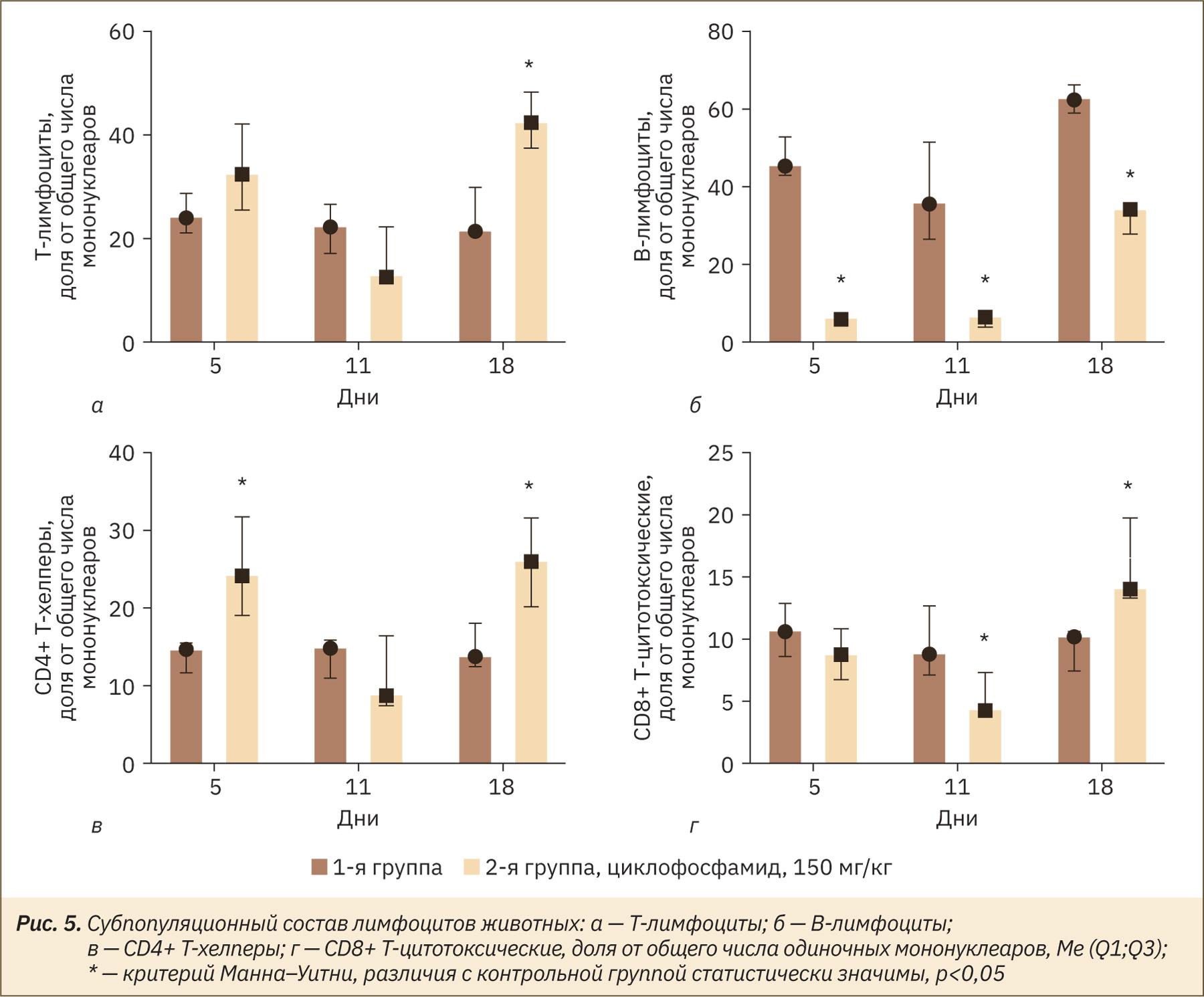
В проведенном исследовании наиболее выраженный супрессорный эффект циклофосфамид оказал на B-лимфоциты, снижая их относительное содержание на 5‑й и 11‑й дни на 87% и 83% соответственно. И.Ф. Суфияров и соавт. [17] на модели циклофосфамидиндуцированной иммуносупрессии в разных дозах у мышей также установили, что циклофосфамид оказывает выраженное иммуносупрессивное действие с угнетением различных субпопуляций лимфоцитов в зависимости от дозы. Так, в малых дозах существенно снижались субпопуляции Т-лимфоцитов, а в больших дозах — преимущественно субпопуляции B-лимфоцитов.
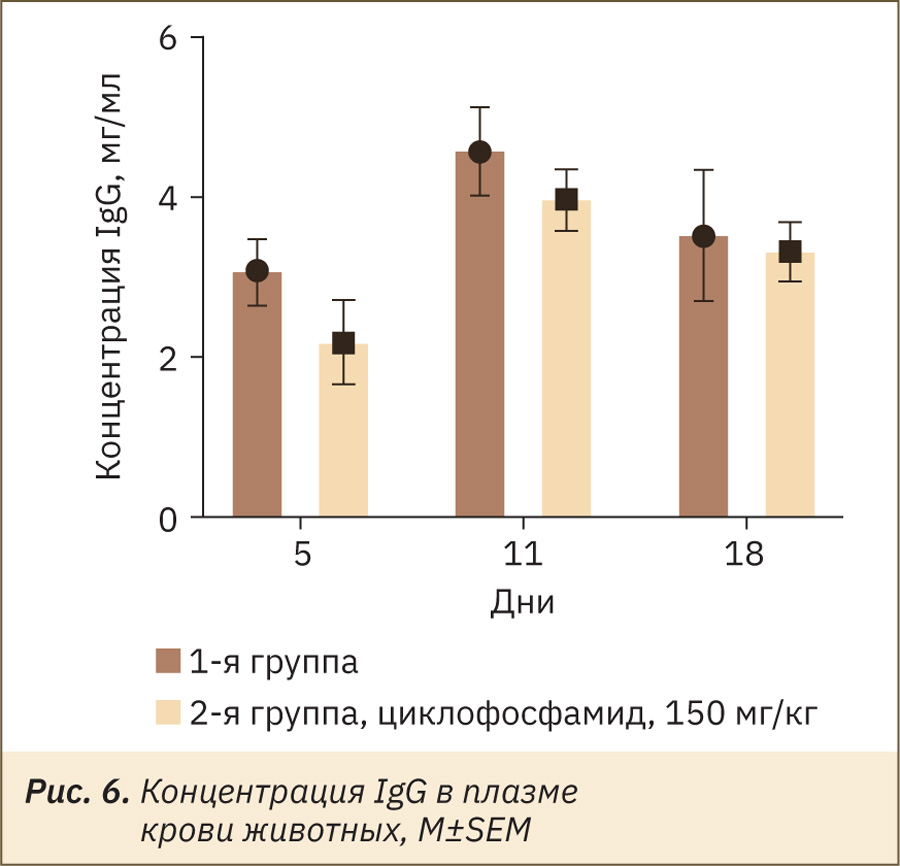
По сравнению с контрольной группой, в экспериментальной у животных наблюдался тренд к снижению концентрации специфических IgG на 29% на 5‑й день эксперимента (рис. 6). На 11‑й и 18‑й дни эксперимента концентрация IgG восстанавливалась и коррелировала с восстановлением общего количества лимфоцитов и доли B-лимфоцитов, в частности (по результатам оценки субпопуляционного состава, см. рис. 4 и рис. 5).
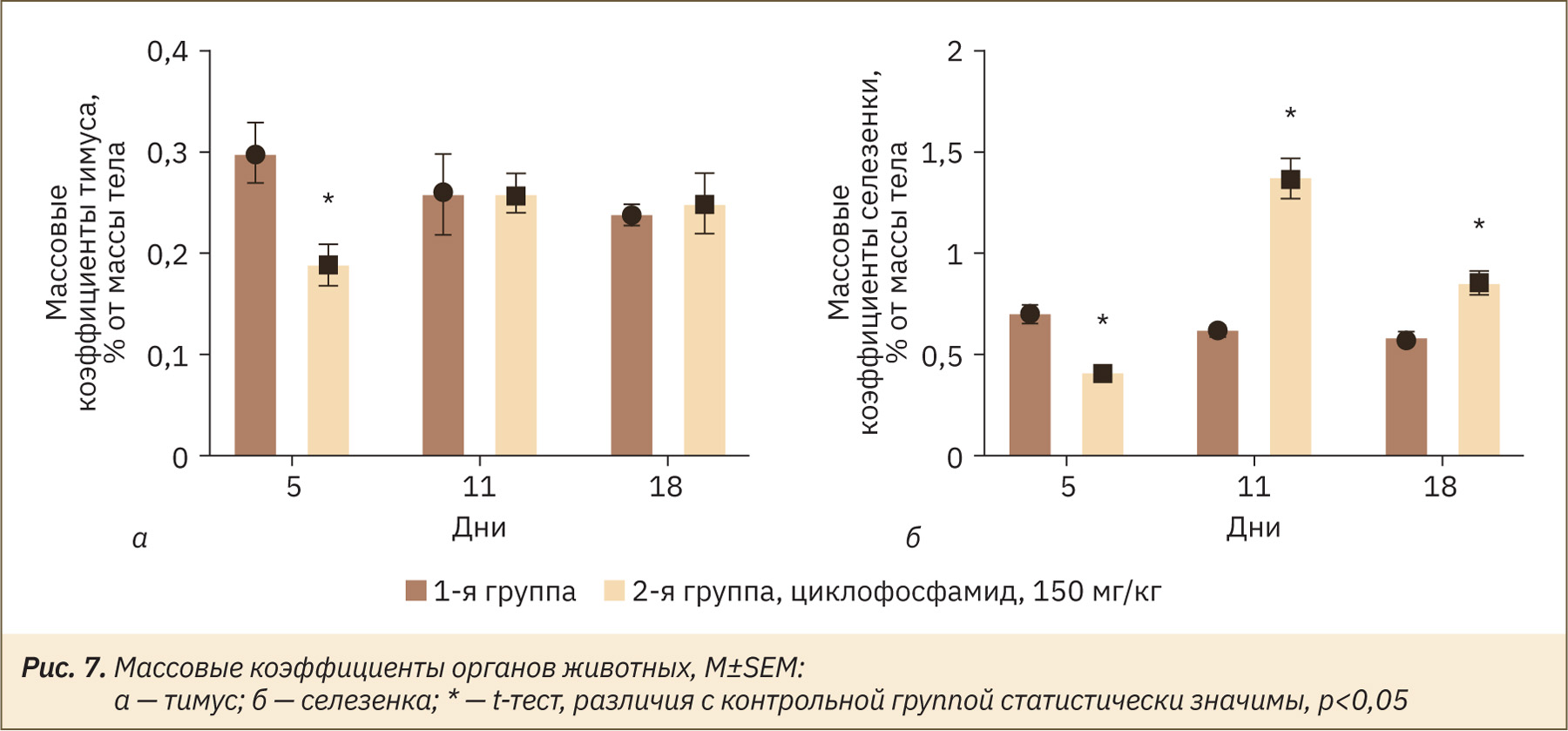
При сравнении массовых коэффициентов тимуса установлено статистически значимое снижение данного показателя в экспериментальной группе животных, получавших циклофосфамид, на 5‑й день эксперимента на 33% (рис. 7а) в сравнении с контрольной группой. На 11‑й и 18‑й дни различия с контрольной группой были статистически незначимы. Подобную динамику наблюдали и в работе A. Miyauchi и соавт. [18] на циклофосфамидиндуцированной модели иммуносупрессии у мышей Balb/c в дозе 200 мг/кг. У животных регистрировали статистически значимое снижение массового коэффициента тимуса на 2‑й день, а уже к 7–14‑му дню отмечали его восстановление.
Гистологический анализ тимуса животных после введения циклофосфамида в дозе 150 мг/кг на 5‑й день исследования выявил преобладание коркового вещества, что свидетельствует о снижении количества Т-клеток в мозговом веществе. К 11‑му дню отмечали значительную атрофию тимуса с нарушением архитектоники органа — присутствие дистрофичных и разрушенных клеток, наличие нейтрофильных гранулоцитов, замещение жировой тканью функциональных структур органа. К 18‑му дню исследования наблюдали регенерацию ткани тимуса. У большинства животных практически полностью восстанавливалась тканевая структура. В работе A. Miyauchi и соавт. [18] изучали методом проточной цитометрии клеточный состав тимоцитов. На 2‑й день исследования наблюдали значительное снижение (более чем в 2 раза) уровня CD4+CD8+ клеток и увеличение популяций СD4+ (T-хелперов), CD8+ цитотоксических Т-лимфоцитов с постепенным восстановлением субпопуляционного состава к 14‑му дню.
У животных, получавших циклофосфамид и подвергнутых эвтаназии на 5‑й день, отмечалось статистически значимое снижение массового коэффициента селезенки на 40%, а на 11‑й и 18‑й дни, напротив, наблюдалось статистически значимое увеличение этого показателя по сравнению с контрольной группой (рис. 7б).
Аналогичную динамику изменения массового коэффициента селезенки наблюдали в работе Y. Wang и соавт. [19] при внутрибрюшинном введении циклофосфамида в дозе 300 мг/кг мышам линии Balb/c: на 3‑й день отмечали снижение массовых коэффициентов, а к 7‑му дню — увеличение. Авторы объясняют это как следствие развития компенсаторного экстрамедуллярного кроветворения, которое может играть существенную роль в восстановлении иммунитета после химиотерапии. С помощью метода проточной цитометрии авторы показали увеличение доли CD34+, CD117+ клеток-предшественников. В работе Z. Zhang и соавт. [20] статистически значимое снижение массового коэффициента селезенки наблюдали в течение 5 дней, на 7‑й день после внутрибрюшинного введения циклофосфамида в дозе 40 мг/кг.
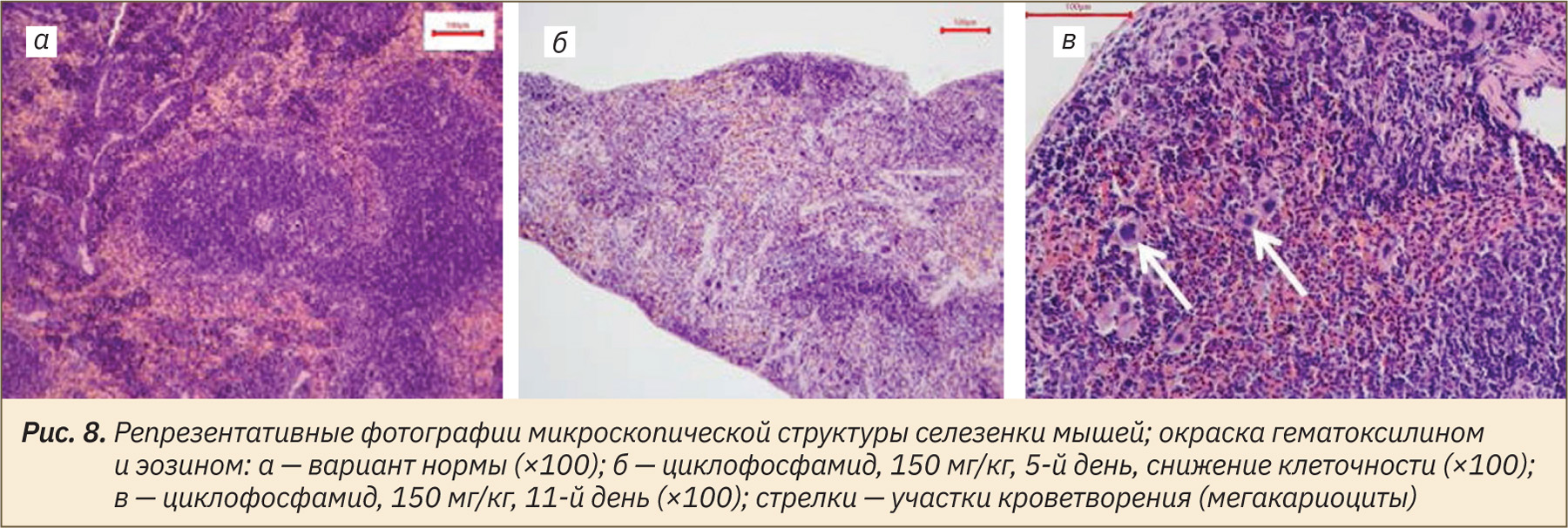
При гистопатологическом анализе ткани селезенки животных, получавших циклофосфамид в дозе 150 мг/кг, установили обеднение клеточного состава на 5‑й день эксперимента (рис. 8а) и наличие участков экстрамедуллярного кроветворения на 11‑й и 18‑й дни (рис. 8в).
Таким образом, циклофосфамидиндуцированная иммуносупрессия у мышей характеризовалась снижением массы тела на протяжении всего эксперимента, тенденцией к снижению концентрации общего уровня IgG в плазме крови, достигающей максимума на 5‑й день развития патологии, значительным снижением общего количества лимфоцитов на 5‑й день с последующим постепенным восстановлением к 18‑му дню, изменением субпопуляционного состава лимфоцитов крови в большей степени за счет снижения доли B-лимфоцитов на 5‑й и 11‑й дни, а также выраженным повреждением иммунокомпетентных органов (тимуса и селезенки) на 5‑й день эксперимента. Наиболее яркие признаки иммуносупрессии на фоне однократного внутрибрюшинного введения циклофосфамида в дозе 150 мг/кг наблюдали на 5‑й день эксперимента с последующим постепенным восстановлением иммунной системы к 18‑му дню.
Заключение
Проведенное исследование дополняет сведения о модели иммуносупрессии у мышей линии Balb/с, индуцированной однократным внутрибрюшинным введением высокой дозы (150 мг/кг) циклофосфамида. Введение циклофосфамида привело к обратимым изменениям изученных показателей клеточного и гуморального звеньев иммунитета: общего числа лейкоцитов, субпопуляций лимфоцитов (T- и B-лимфоцитов, CD4+ и CD8+ Т-лимфоцитов), уровня IgG, дистрофических изменений тимуса и селезенки. Наиболее выраженные изменения указанных показателей регистрировали на 5‑й день с постепенным восстановлением к 18‑му дню после введения циклофосфамида. Снижение массового коэффициента селезенки было отмечено на 5‑й день эксперимента с последующим его восстановлением к 11‑му и 18‑му дню. Наблюдаемые изменения селезенки свидетельствуют о развитии компенсаторного экстрамедуллярного кроветворения, что связано с восстановлением иммунитета. Предложенная модель циклофосфамидиндуцированной иммуносупрессии может применяться в доклинических исследованиях эффективности перспективных средств профилактики и лечения иммунодефицитных состояний различного генеза.
Сведения о конфликте интересов
Авторы заявляют об отсутствии конфликта интересов, требующего раскрытия в данной статье.
Вклад авторов
Н.Л. Полюга — концепция и дизайн, сбор и систематизация материала, написание текста статьи.
К.Л. Крышень — критический пересмотр, утверждение окончательного текста рукописи.
Я.Г. Муразов — статистический анализ, написание текста статьи.
Е.И. Трофимец — сбор и систематизация материала, работа с источниками литературы.
Я.А. Гущин — подготовка и гистологический анализ некропсийного материала.
П.П. Бельтюков — выполнение анализа методом проточной цитометрии.
Н.В. Скворцов — выполнение анализа методом проточной цитометрии.
Список источников
- Каприн А.Д., Старинский В.В., Петрова Г.В. Злокачественные новообразования в России в 2020 году (заболеваемость и смертность). Москва: МНИОИ им. П.А. Герцена — филиал ФГБУ «НМИЦ радиологии» Минздрава России, 2021. [Kaprin A.D., Starinsky V.V., Petrovа G.V. Zlokachestvennye novoobrazovanija v Rossii v 2020 godu (zabolevaemost’ i smertnost’). Moskva: MNIOI im. P.A. Herzen — branch FGBI “NERC” Ministry of health of Russia, 2021. (In Russ.)].
- Sung H., Ferlay J., Siegel R.L. et al. Global Cancer Statistics 2020: GLOBOCAN Estimates of Incidence and Mortality Worldwide for 36 Cancers in 185 Countries // CA: A Cancer Journal for Clinicians. 2021. Vol. 71. P. 209–249. DOI: 10.3322/caac.21660.
-
Anand U., Dey A., Chandel AKS et al. Cancer chemotherapy and beyond: Current status, drug candidates, associated risks and progress in targeted therapeutics. Genes and Diseases. DOI: 10.1016/j.gendis.2022.02.007.
-
Abu Eid R., Razavi GSE, Mkrtichyan M., Janik J., Khleif SN. Old-School Chemotherapy in Immunotherapeutic Combination in Cancer, A Low-cost Drug Repurposed // Cancer Immunol Res. 2016. Vol. 4. P. 377–382. DOI: 10.1158/2326-6066.CIR-16-0048.
-
Diao B., Wang C., Tan Y. et al. Reduction and Functional Exhaustion of T Cells in Patients With Coronavirus Disease 2019 (COVID-19) // Front Immunol. 2020. Vol. 11. P. 827. DOI: 10.3389/fimmu.2020.00827.
-
Feng L., Huang Q., Huang Z. et al. Optimized Animal Model of Cyclophosphamide-induced Bone Marrow Suppression // Basic Clin. Pharmacol Toxicol. 2016. Vol. 119. P. 428–435. DOI: 10.1111/bcpt.12600.
-
Wang S., Huang S., Ye Q. et al. Prevention of Cyclophosphamide-Induced Immunosuppression in Mice with the Antimicrobial Peptide Sublancin // J. Immunol Res. 2018. Vol. 2018. P. 4353580. DOI: 10.1155/2018/4353580.
-
Yan H., Lu J., Wang J. et al. Prevention of Cyclophosphamide-Induced Immunosuppression in Mice With Traditional Chinese Medicine Xuanfei Baidu Decoction // Front Pharmacol. 2021. Vol. 12. P. 730567. DOI: 10.3389/fphar.2021.730567.
-
Zhou X., Dong Q., Kan X. et al. Immunomodulatory activity of a novel polysaccharide from Lonicera japonica in immunosuppressed mice induced by cyclophosphamide // PLoS One. 2018. Vol. 13. P. e0204152. DOI: 10.1371/journal.pone.0204152.
-
Yu J., Cong L., Wang C. et al. Immunomodulatory effect of Schisandra polysaccharides in cyclophosphamide-induced immunocompromised mice // Exp. Ther. Med. 2018. Vol. 15. P. 4755–4762. DOI: 10.3892/etm.2018.6073.
-
Włodarczyk M., Ograczyk E., Kowalewicz-Kulbat M. et al. Effect of Cyclophosphamide Treatment on Central and Effector Memory T Cells in Mice // Int. J. Toxicol. 2018. Vol. 37. P. 373–382. DOI: 10.1177/1091581818780128.
-
Jivrajani M., Shaikh MV., Shrivastava N., Nivsarkar M. An improved and versatile immunosuppression protocol for the development of tumor xenograft in mice // Anticancer Res. 2014. Vol. 34. P. 7177–7183.
-
Боровкова К.Е., Макарова М.Н., Никифорова Л.Р., Салмова Ю.В. Модели грибковых инфекций на животных // Лабораторные животные для научных исследований. 2021. № 3. DOI: 10.29296/2618723X-2021‑03‑05. [Borovkova К.E., Makarova M.N., Nikiforova L.R., Salmova J.V. Animal models of fungal infections // Laboratory Animals for Science. 2021. N. 3. (In Russ.)].
-
Гущин Я.А., Мужикян А.А. Влияние фиксирующих жидкостей на микроскопическую структуру органов мелких лабораторных животных // Международный вестник ветеринарии. 2014. № 3. С. 88–95. [Gushchin Ya., Muzhikyan A. Effect of Fixing Liquids on Microscopic Structure of Small Laboratory Animals // Mezhdunarodnyj vestnik veterinarii=International Bulletin of Veterinary Medicine. 2014. N. 3. P. 88–95. (In Russ.)].
-
Мужикян А.А., Макарова М.Н., Гущин Я.А. Особенности гистологической обработки органов и тканей лабораторных животных // Международный вестник ветеринарии. 2014. № 2. С. 103–109. [Muzhikyan A.A., Makarova M.N., Gushhin Ya.A. Osobennosti gistologicheskoy obrabotki organov i tkaney laboratornyh zhivotnyh // Mezhdunarodnyy vestnik veterinarii. 2014. N. 2. P. 103–109. (In Russ.)].
-
Huyan X-H, Lin Y-P, Gao T, Chen R-Y, Fan Y-M. Immunosuppressive effect of cyclophosphamide on white blood cells and lymphocyte subpopulations from peripheral blood of Balb/c mice // Int. Immunopharmacol. 2011. Vol. 11. P. 1293–1297. DOI: 10.1016/j.intimp.2011.04.011.
-
Суфияров И.Ф., Латыпов Р.З., Сибиряк С.В., Шафиков Р.М. Влияние иммуносупрессии индуцированной циклофосфамидом на развитие послеоперационных брюшинных спаек // Медицинский вестник Башкортостана. Россия, Уфа: Федеральное государственное бюджетное образовательное учреждение высшего образования «Башкирский государственный медицинский университет» Министерства здравоохранения Российской Федерации. 2009. № 4. С. 64–67. [Sufiyarov I.F., Latypov R.Z., Sibiryak S.V., Shafikov R.M. Vliyanie immunosupressii inducirovannoj ciklofosfamidom na razvitie posleoperacionny’x bryushinny’x spaek // Medicinskij vestnik Bashkortostana. Rossiya, Ufa: Federal'noe gosudarstvennoe byudzhetnoe obrazovatel'noe uchrezhdenie vysshego obrazovaniya "Bashkirskij gosudarstvennyj medicinskij universitet" Ministerstva zdravoohraneniya Rossijskoj Federacii. 2009. N. 4. P. 64–67. (In Russ.)].
-
Miyauchi A., Hiramine C., Tanaka S., Hojo K. Differential effects of a single dose of cyclophosphamide on T cell subsets of the thymus and spleen in mice: flow cytofluorometry analysis // Tohoku J. Exp. Med. 1990. Vol. 162. P. 147–167. DOI: 10.1620/tjem.162.147.
-
Wang Y., Meng Q., Qiao H., Jiang H., Sun X. Role of the spleen in cyclophosphamide-induced hematosuppression and extramedullary hematopoiesis in mice // Arch. Med. Res. 2009. Vol. 40. P. 249–255. DOI: 10.1016/j.arcmed.2009.04.003.
-
Zhang Z., Pan T., Liu C. et al. Cyclophosphamide induced physiological and biochemical changes in mice with an emphasis on sensitivity analysis // Ecotoxicology and Environmental Safety. 2021. Vol. 211. P. 111889. DOI: 10.1016/j.ecoenv.2020.111889.




