Применение методов морфометрии для оценки гистопатологии в доклинических исследованиях
Работа выполнена без спонсорской поддержки.
Гущин Я.А. Применение методов морфометрии для оценки гистопатологии в доклинических исследованиях. Лабораторные животные для научных исследований. 2024; 1. https://doi.org/10.57034/2618723X-2024-01-04
Резюме
Морфометрия является одним из важных инструментов доклинических исследований. Она стала неотъемлемой частью микроскопической диагностики. Основными проблемами микроскопического анализа являются вариативность патологических состояний, отсутствие единства формулировок и терминов, субъективность восприятия изображения. В связи с этим традиционная описательная гистология не может быть применена для проведения полноценной и объективной оценки экспериментальной патологии. Гистолог может поставить диагноз, оценив морфологическую картину поражения по совокупности признаков. Однако визуально трудно различить небольшие изменения, которые могут иметь решающее значение при сравнительном анализе. Применение методов морфометрии помогает выявить тонкие различия в выраженности патологии. Кроме того, проведение количественных измерений при помощи подсчета элементов ткани, измерения размеров структур или использование различных ранговых шкал позволяет снизить или полностью исключить субъективность оценки. В данном обзоре описаны методы количественной и качественной морфометрии, опираясь на обычно используемые типы шкал измерения. Самым простым средством анализа является описательная гистология. Она является «поисковым» методом, применяется во всех исследованиях для оценки материала, выявления органов-мишеней, определения частоты развития патологии в группе животных. Однако наиболее часто в своей работе патоморфологи используют полуколичественную оценку. Она проста в использовании, не требует специального оборудования. В отличие от предыдущего метода, эта оценка позволяет сравнивать выраженность эффектов воздействия тестируемого объекта на органы-мишени. Преобразование описательных (качественных) характеристик патологии в числовые значения позволяет значительно повысить достоверность и воспроизводимость результатов. При этом, исходя из модельной патологии, необходимо тщательно подходить к выбору системы балльной оценки. К количественной морфометрии относятся планиметрия и стереология. В данном случае возникает необходимость в специальных измерительных инструментах или программном обеспечении. Результаты анализа позволяют сравнить выраженность процесса и определить, во сколько раз один метод эффективнее другого. Кроме того, появляется возможность математического моделирования процессов, например, расчета соотношения доза—эффект. Планиметрия основана на измерении линейных размеров и подсчете структур в двухмерной плоскости среза ткани. Стереологические измерения производят в объеме, что дает количественную характеристику структуры и элементов в целом объекте, а не в отдельной его части, как в случае планиметрии. Метод обладает максимальной объективностью и достоверностью, но он трудозатратен и требует тщательного предварительного планирования и применения строгих методов выборки. Описанные методы не заменяют друг друга и могут сочетаться, что значительно повышает качество исследования.
Введение
Интерпретация микроскопических изменений, выявленных у животных в ходе проведения доклинических исследований, является неотъемлемой частью процесса тестирования новых медицинских изделий, фармацевтических препаратов и химических веществ. В ходе выполнения научной работы патоморфолог применяет свои теоретические и практические знания, а также опыт в изучении чрезвычайно изменчивых биологических объектов. Основная задача гистолога — предоставить как можно более объективные данные, избежав внесения ошибок и искажений в результаты работы. Итог гистологического анализа, основанного на изучении стандартных срезов тканей, представляют в виде морфологического диагноза или отчета [1]. Качество и полноценность отчета достигается тремя принципами — тщательностью идентификации всех изменений, единообразием используемой терминологии и номенклатуры и, наконец, точностью сопоставления всех патологических признаков воедино, придерживаясь одних и тех же диагностических критериев. Однако микроскопическая оценка имеет очень большую долю субъективности, которая зависит как от объекта исследования, так и от наблюдателя, которым является врач-гистолог. Снизить или даже полностью исключить влияние данных факторов на конечный результат помогает введение систем оценки патологии, то есть морфометрического анализа. К настоящему времени он стал неотъемлемой частью гистологической диагностики не только в области клинических, но и доклинических исследований. Во многих научных работах морфометрию используют как средство повышения точности и достоверности информации. Однако у специалистов, прежде всего мало знакомых с системой оценки, может возникнуть проблема выбора метода измерения модельной патологии, а также трудность с последующей интерпретацией результатов. Это связано, во-первых, с недопониманием принципов морфометрии. Во-вторых, с чрезмерной верой в сведения, полученные из источников литературы, в которых подробно описан алгоритм анализа, но по тем или иным причинам он не может быть интегрирован в текущее исследование. И в-третьих, с ошибочным мнением, что «уж гистология точно все покажет».
В данном обзоре мы попытались описать исследователям, только начинающим свою научную деятельность, или тем, чьи интересы изначально находятся вне области микроскопии, проблемы гистологической диагностики и способы предоставления ее результатов. При этом главная цель статьи — осветить ключевые идеи и базовые принципы качественных и количественных измерений, доступных патоморфологу при выполнении повседневных исследований.
Проблемы микроскопической диагностики и источники ошибок
Одной из основных проблем микроскопического анализа является вариативность поражения тканей при тех или иных патологических состояниях. Выявленные диагностические признаки болезней можно условно разделить на два типа — дискретные и непрерывные. Часть заболеваний имеет свою строго определенную картину, которую обученный специалист легко может определить, поэтому такие диагнозы независимы и дискретны [2], однако относящиеся ко второму типу — непрерывному — динамичны и изменчивы. Наблюдаемая при этом картина поражений преобразуется со временем, видоизменяются и морфологические структуры, вовлеченные в патологический процесс. Ярким примером могут быть опухоли. Процесс канцерогенеза в ряде случаев начинается с безобидной гипертрофии, проходит через дисплазию к атипии и далее к инвазивному злокачественному раку. Именно переходы и являются зачастую источниками диагностических ошибок. Два врача, независимо оценивающие один и то же срез ткани, могут по-разному интерпретировать тяжесть патологической картины и, испытывая затруднения в формулировке конкретного диагноза, ограничиваются описанием увиденного в препарате [3]. Подобное заключение не только снижает качество исследования, оставляя некую «недосказанность», но и может привести к недопониманию, поскольку используемая терминология для одних и тех же поражений будет похожей, но редко идентичной. Из чего вытекает следующая проблема, заключающаяся в единообразии или формулировке. Составленное описание может включать различные дополнения, такие как отношение, к примеру, новообразования к окружающим тканям (инфильтративное или ограниченное), его распространение в тканях (локальное, мультифокальное или диффузное), клеточный состав воспалительного инфильтрата и многие другие особенности поражения. Кроме того, можно выделить два полярных стиля изложения: развернутое микроописание, которое крайне подробно, но трудоемко и часто содержит лишнюю информацию, и тезисное, которое, наоборот, более стандартизировано, но может упускать некоторые детали [4]. Выбирая стиль описания, врач обычно ориентируется на вид патологии, ведь, например, в одном случае достаточно констатировать наличие в материале некротизированной ткани, а в другом, кроме диагноза, необходимо детально расписывать края резекции опухоли и ее клеточный состав. В этом кроется еще одна ошибка патоморфологической диагностики — терминологическая, или «словесно-смысловая». Используемые термины могут ввести в заблуждение. Такие понятия, как «много/мало», «вероятно», «имеет признаки злокачественности» и многие другие, неся в себе большую долю субъективизма, воспринимаются разными людьми по-своему.
В доклинических исследования редко можно применить развернутое описание, поскольку, имея дело с большим количеством животных со схожей патологией, велика вероятность возникновения трудности на постаналитическом этапе с точностью сопоставления данных. Приходится группировать обнаруженные изменения по каким-либо морфологическим признакам, ограничиваясь в отчете кратким гистологическим (например, «острый катаральный гастрит») или описательным диагнозом (таким как «лимфоцитарная инфильтрация»). В процессе чего происходят классификация и формирование категорийных групп данных, что является чисто качественным анализом. Подобной простой описательной морфологии с ее двоичной системой — «норма/патология» — может быть достаточно в исследованиях, где необходимо выявить точку приложения негативного эффекта тестируемого вещества, определить орган-мишень и оценить обратимость наступивших изменений. Например, гастрит, выявленный у животных во всех группах, в том числе и в интактной, может свидетельствовать о своем «фоновом» характере, в таком случае его диагностическая ценность не будет иметь существенного значения. Однако если задачей научной работы является нахождение различий между дозами одного или нескольких тестируемых объектов или подтверждение ранее полученных результатов, то возникает необходимость проведения группового сравнения. В итоге небольшие различия, даже не в частоте, а в выраженности или тяжести данного «фонового» поражения, могут указать на эффект применения тестируемых объектов [1]. И все это осложняется тем фактом, что, как указывалось выше, многие заболевания не имеют патогномоничных признаков и не формируют легкоузнаваемые дискретные шаблоны (паттерны), представляя собой постепенные переходы из одного патологического состояния в другое [2]. Также подобный «описательно-двоичный» подход крайне нежелателен в случае узкоспециализированных исследований, направленных на конкретные патологические процессы или заболевания.
Исходя из сказанного, можно выделить следующие проблемы, затрудняющие качественный анализ гистологических препаратов в доклинических исследованиях:
- большая вариативность картины поражения в рамках модельной патологии;
- проблема номенклатуры или единообразия диагноза;
- проблема смысловой нагрузки описания;
- проблема интерпретации данных и межгруппового сравнения.
Минимизировать, а зачастую и исключить влияние этих факторов можно, введя измерения или дополнительные системы оценки. В отличие от обычной визуальной оценки, которая, как упоминалось выше, является описательной и исключительно качественной, морфометрический анализ оперирует числами, то есть становится количественным или полуколичественным. Это дает ряд несомненных преимуществ — объективность и воспроизводимость, кроме того, появляется возможность обнаружить «скрытые» отклонения, которые не видны глазом [5].
Использование измерительных шкал
Морфометрию в патологии можно охарактеризовать как раздел биометрии, помогающий дать количественную оценку параметров клеточных и тканевых структур на гистологических и цитологических препаратах при помощи счета (количество клеток, структурных единиц, очагов поражения и прочего), измерения (длина, высота, ширина структур и элементов) или различных ранговых шкал (например, баллов или степени тяжести) [6]. Уровни морфометрии или, образно говоря, достоверность получаемых данных неразрывно связаны со шкалами измерения, которые можно сгруппировать в четыре основных вида [1, 7, 8], предложенные еще 1946 г. S.S. Stevens [9] (табл. 1).
Эти шкалы отличаются друг от друга по своей «силе». Каждая последующая основывается на предыдущей, добавляя ей еще один уровень точности, при этом увеличивается количество допустимых математических операций, производимых с данными. Таким образом, чем шкала «сильнее», тем больше полезной информации об изучаемом признаке можно получить при последующей математической и статистической обработке [8].
Номинальная шкала — самая слабая, является качественной и используется для идентификации событий, явлений или вещей, несмотря на описательный характер представления результатов, это тоже часть морфометрического анализа. При исследовании материала можно, выявляя какие-либо общие патологические изменения, формировать диагностические группы. Это позволяет рассчитать проценты распределения или частоту развития заболевания в конкретной выборке животных. Однако нельзя провести сравнение между признаками, поскольку полученные диагностические группы не являются равноценными. Например, нельзя сказать, что катаральный гастрит у животных в первой группе тяжелее, чем гастрит у животных во второй группе, можно только утверждать, что он чаще развивается.
Порядковая шкала — это самая часто используемая в патоморфологии шкала. Несмотря на то что данный тип относится к качественным, чаще применяют термин «полуколичественный», поскольку в процессе анализа происходит преобразование описательных (качественных) характеристик в числовые значения, что в свою очередь позволяет проводить полноценное статистическое сравнение групп [1, 10]. Примерами порядковой шкалы является степень тяжести (grade), выраженности поражения или стадийности процесса, которая представляет собой относительную меру микроскопических поражений [4]. Хотя при анализе материала не требуются инструменты измерения или специализированное программное обеспечение, увеличивается скорость получения экспериментальных данных, но главное, значительно повышается достоверность исследования. К примеру, очень удобно в исследовании ввести градацию воспаления в тканях в зависимости от инфильтрации ткани нейтрофильными гранулоцитами: 0 — нет, 1 — минимальное, 2 — слабое, 3 — умеренное и 4 — выраженное, или площадь некроза ткани выражать в баллах: 0 — норма, 1 — до 25%, 2 — от 26% до 50%, 3 — от 51% до 75%, 4 — более 75%.
Систему подсчета баллов необходимо строить на трех cледующих принципах [3]:
- уровни (баллы) следует четко обозначать;
- системе полагается быть воспроизводимой;
- итоговый результат должен быть значимым.
Из этого следует, прежде чем использовать порядковую шкалу, необходимо четко определить критерии оценки. Они должны быть как можно менее субъективны и основываться на конкретных морфологических проявлениях изучаемой патологии. Не стоит ограничиваться тремя степенями, поскольку в дальнейшем при сравнении статистические различия между группами животных могут быть незначительны или отсутствовать. В то же время при увеличении количества степеней больше пяти границы между ними становятся не очевидны, что приводит к различию в результатах при анализе того же материала другим врачом [1, 4]. Можно в каждый уровень шкалы (или дескриптор) включить несколько оценочных критериев (например, выраженность воспаления и наличие/отсутствие пролиферации), что повысит точность, но в то же время ухудшит воспроизводимость. Поэтому оптимальным является использование не одного дескриптора с большим набором оценочных критериев, а выбор нескольких специфических показателей, каждый из которых можно ранжировать в баллах [11]. После изучения материала суммирование результатов позволит вывести общую оценку тяжести патологии.
Выбор шкалы и разделение ее на дескрипторы — это непростой и в некотором роде творческий процесс. В клинической патологии существует очень много различных классификаций и вариантов оценки, однако в доклинических исследованиях чрезвычайно трудно придерживаться систем градации уже использованных ранее и описанных в научных статьях. При моделировании патологии на животных есть множество факторов, которые влияют на конечный результат. Это и сила воздействия поражающего агента, время его воздействия, период наблюдения, вид и порода животных и много прочих. Поэтому, даже используя модель неоднократно проверенную, стоит предполагать последующую коррекцию системы оценки. Еще на этапе планирования руководитель исследования совместно с патоморфологом должны обсудить предстоящий эксперимент, варианты оценки патологии с учетом механизма воздействия, органов-мишеней, а также ожидаемого результата. При этом окончательный выбор показателей, количество их степеней и формирование границ уровней в зависимости от критериев возможны только в процессе гистологического исследования, когда появляется возможность идентифицировать патологические изменения и ранжировать их от наименьшего к наибольшему, тем самым «подогнать» систему оценки [1, 4]. Например, может сложиться ситуация, когда поражения, наблюдаемые при моделировании бактериальной пневмонии, на 3-й день будут существенно отличаться от таковых на 7-й день, таким образом, шкала станет неэффективна. В дальнейшем при составлении патоморфологического отчета необходимо описать использованную шкалу и дать полную характеристику степеням тяжести.
Шкала интервалов является уже количественной, в ней категории упорядочены и имеют равные промежутки-интервалы, что позволяет не только определить какое значение больше или меньше, но и рассчитать на сколько. Важной характеристикой шкалы является отсутствие истинного нулевого значения, которое задается произвольно или относительно чего-либо [7, 8]. Классическим примером шкалы является температура, однако при патоморфологических исследованиях она редко применяется.
Шкала отношений — наиболее «сильная» среди всех. В отличие от интервальной шкалы, где нулевое значение — переменная величина, в данном случае ноль абсолютен, то есть это означает отсутствие измеряемого свойства. С единицами измерения можно выполнять любые математические операции и, главное, определить, во сколько раз свойство одного предмета или явления превосходит другое. Можно сказать, что морфометрический анализ, оперирующий шкалой отношений, является истинно количественным. Произведенные измерения наиболее достоверны и объективны, поскольку почти полностью отсутствует субъективизм исследователя. Полученные числовые значения увеличивают точность описания биологических процессов и явлений, усиливают силу и логику доказательств, кроме того, дают возможность построения математических моделей [2, 12].
Количественная морфометрия
Количественную морфометрию гистологических препаратов корректнее называть «количественная микроскопия», но термин «морфометрия» используют гораздо чаще и именно под ним подразумевают любые проводимые измерения.
Традиционно морфометрия опирается на использование величин, представляющих собой два класса признаков — метрические, или непрерывные (длина, высота, объем), и дискретные, или счетные (количество структур, клеток, митозов). В результате появляется возможность описать любую биологическую структуру в количественном отношении в трех измерениях: 0d — количество, 1d — протяженность, 2d — площадь и 3d — объем [13]. Например, исследуя ткань легких, можно в числовом выражении описать объем альвеол, площадь их поверхности, протяженность воздухоносных путей, количество пневмоцитов.
Самым простым и базовым методом является планиметрия — измерение линейных размеров и подсчет структур в двухмерной плоскости, которую представляет собой срез ткани, толщина которого настолько мала (в пределах 3–5 мкм), что ею можно пренебречь [10]. При наличии соответствующего оборудования (окулярные сетки, линейки, стандартные объекты-микрометры) или программного обеспечения, позволяющего анализировать изображения, такие простые измерения дают чрезвычайно много информации. В исследованиях кардиопротективных препаратов можно сравнить их влияние на толщину кардиомиоцитов и сосудистой стенки; при моделировании энтеропатии измерить невидимые глазом изменения высоты и площади ворсинок тонкой кишки; при изучении цирроза печени рассчитать площадь замещения здоровой ткани соединительной. Подобных «рутинных» примеров в экспериментальной патоморфологии можно привести нескончаемое множество, даже не касаясь опухолевой патологии или специфических методов, таких как иммуногистохимия, флуоресцентная микроскопия или конфокальная микроскопия.
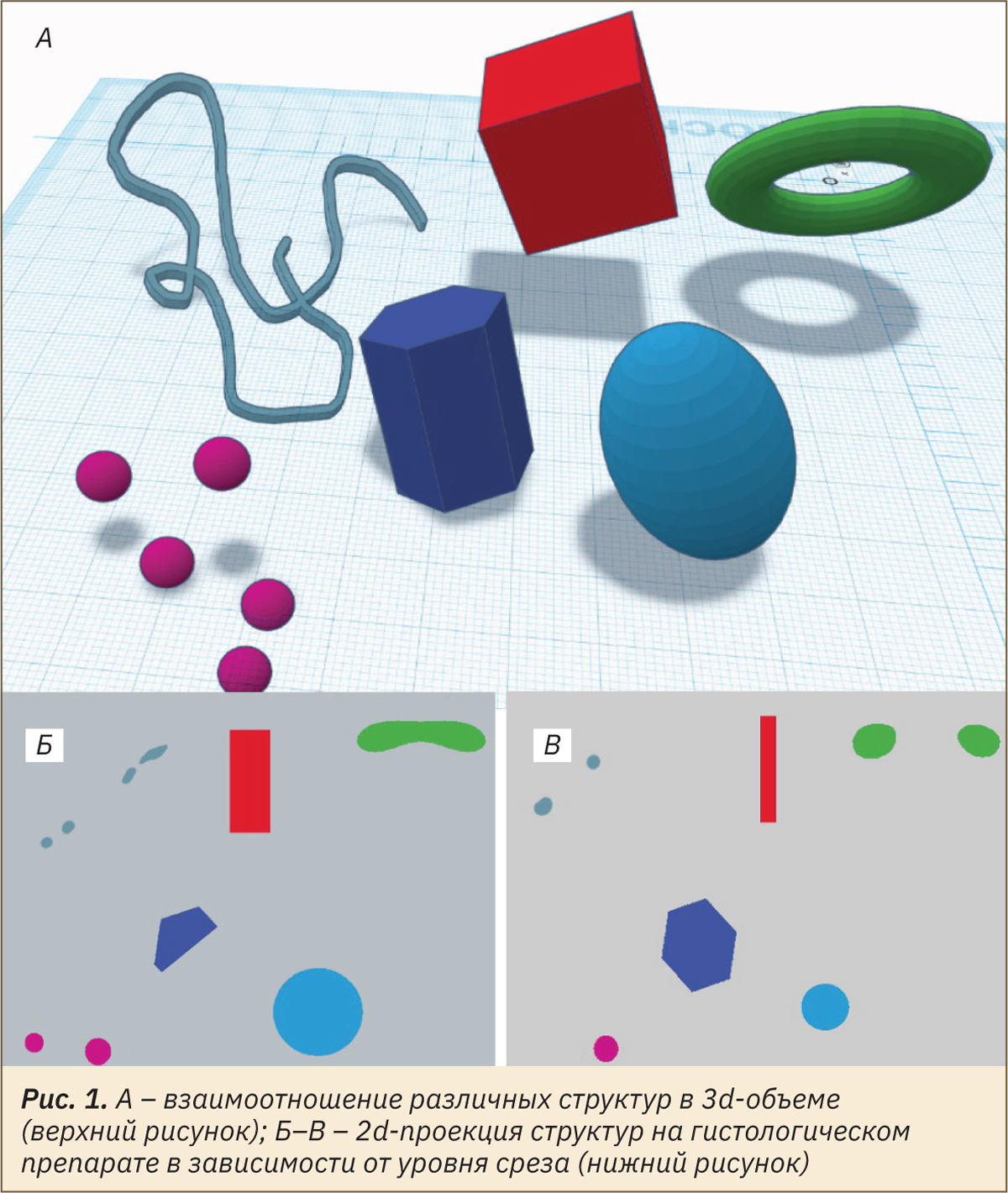
Применяя планиметрические методы измерения, можно провести более сложное исследование — стереологическое. Простые измерения, описанные выше, имеют существенный недостаток — они позволяют провести измерения только одной плоскости без учета трехмерных особенностей объекта, но основная проблема заключается в том, что один срез не может быть репрезентативным в отношении всего объекта [13, 14]. В результате происходит искажение данных о количественных характеристиках и пространственном отношении структурных элементов ткани. На рис. 1 изображено, как в срезе объемные тела становятся плоскими, линейные — отдельными точками поверхности преобразуются в линии, а истинное количество структур в объеме ткани не поддается счету.
Разрешить обозначенные проблемы помогает стереология. Это не просто метод, а полноценная наука, которая является разделом стохастической геометрии, используется для получения объективных количественных данных о трехмерных структурах на основе измерений почти двухмерных гистологических срезов [15]. В отличие от плоскостной морфометрии, где главным инструментом является линейка, в стереологии применяют «тестовые системы» или зонды, состоящие из контрольных элементов — точек, линий или дуг [14]. Количественную оценку производят, подсчитывая пересечения контрольных элементов тест-системы с интересующими объектами на изображении, после чего, применяя математические формулы и статистические приемы, рассчитывают «плотность» элементов на единицу объема: объемная плотность (Vv), плотность длины (Lv), поверхностная плотность (Sv) или числовая плотность (Nv) [15–17]. В табл. 2 приведены примеры взаимосвязи объектов, тест-систем и математического выражения плотности элементов.

Важно понимать, что результаты стереологического измерения носят вероятностный характер и имеют погрешность. Точность исследования напрямую зависит от размера выборки, то есть от количества используемых животных или срезов, или полей зрения. Поэтому основополагающим принципом стереологии является систематическая случайная выборка образца (рандомизация), гарантирующая эффективное измерение без предвзятости исследователя [12, 14, 15].
Cтереологические исследования, конечно, трудоемки, их нельзя проводить «по случаю», они требуют большой подготовительной работы, тщательного планирования, но полученные в итоге данные беспристрастны и надежны, кроме того, в настоящее время с развитием сканирующих систем и программного обеспечения упрощается процесс анализа материала.
Обсуждение
В большинстве случаев гистологическое исследование является описательным. Врач в процессе анализа среза ткани визуализирует характерные признаки и определяет паттерны заболеваний, таким образом формируя диагноз. Однако в случае доклинических исследований перед патоморфологом стоит задача не только выявить возможную патологию, но и, главное, предоставить данные, которые в дальнейшем могут быть использованы для достижения целей эксперимента — выявление механизма действия, оценка безопасности или эффективности лекарственных веществ. В таком случае простой описательной гистологии недостаточно, и возникает необходимость применения методов морфометрии.
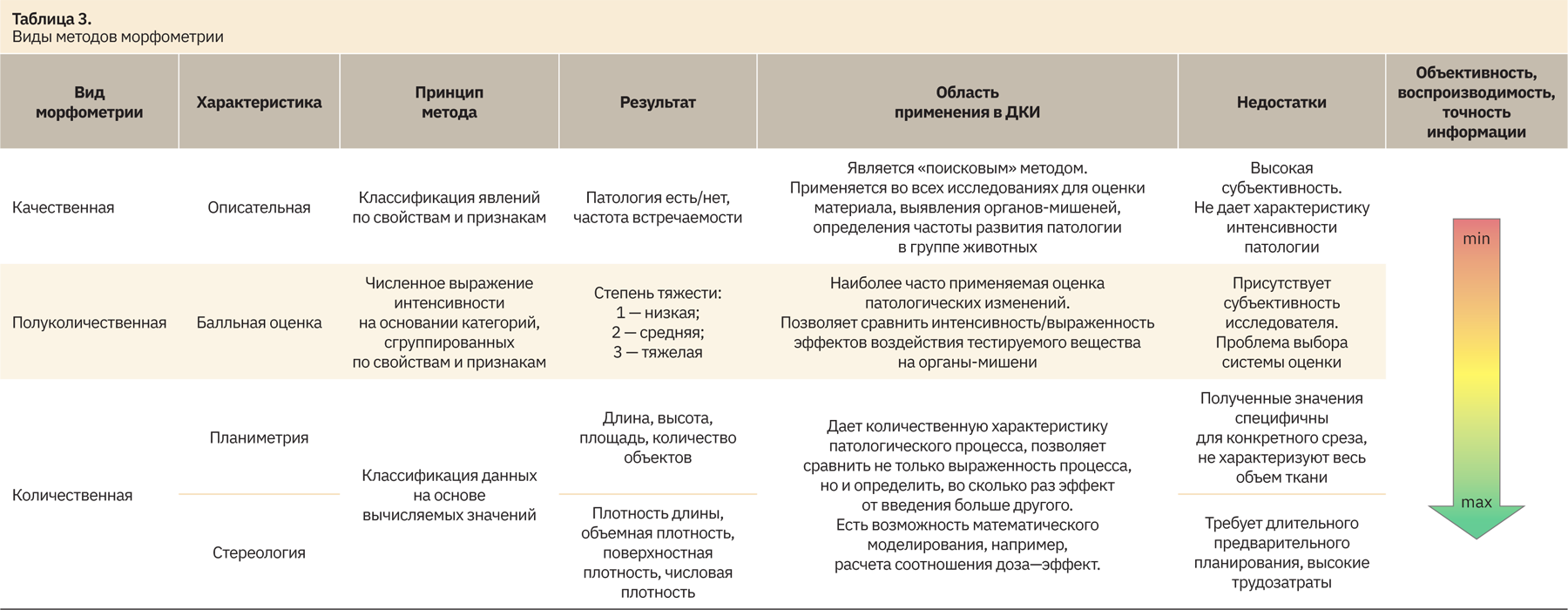
Исходя из используемых шкал измерения и их «силы», можно определить уровни достоверности данных, получаемых при гистологическом анализе органов и тканей, следовательно, вид морфометрического исследования:
- качественная морфометрия;
- полуколичественная морфометрия;
- количественная морфометрия: планиметрия и стереология.
Первый уровень, или качественная морфометрия, является основополагающим, поскольку изучение срезов тканей под микроскопом уже дает информацию о выявляемой патологии у конкретного животного и помогает оценить ее распространенность или частоту развития и в экспериментальной группе. Однако эти данные не показывают выраженность изменений, что зачастую крайне важно при сравнении эффективности тестируемых веществ.
Ведение полуколичественных шкал отчасти решает проблему статистического сравнения, но значительно повышает качество проводимых исследований. Балльная оценка степени выраженности патологии является наиболее популярным приемом у патоморфологов, поскольку быстра и легка в использовании, не требует инструментального обеспечения, обладая гибкостью, может быть приспособлена для решения широкого спектра задач. Следует отметить, что при формировании дескрипторов (например, степеней тяжести) необходимо четко очерчивать их границы, задавать соответствующие однозначные критерии, не допуская разных трактовок обнаруженных изменений. В таком случае субъективизм исследователя будет минимален, а воспроизводимость повысится. Стоит отметить, что в доклинических исследованиях допускается использование полуколичественной морфометрии по принципу «ad hoc», то есть по ситуации, поскольку в условиях моделирования патологии на животных чрезвычайно сложно заранее учесть все переменные факторы, влияющие на конечную микроскопическую картину.
Третьим по силе уровнем является количественная морфометрия, которая позволяет не только сравнить изменения, но и отвечает на вопрос: во сколько раз один параметр больше или меньше другого. Можно выделить два основных вида количественной морфометрии: планиметрию и стереологию.
Используемая повсеместно планиметрия при помощи измерительных инструментов изучает количественные признаки объекта в двухмерной плоскости гистологического среза. Метод обладает достаточно высокой по сравнению с описанными выше достоверностью и объективностью. Полученные в результате анализа числовые значения могут быть использованы при математическом моделировании. В итоге мы имеем абсолютно верную и истинную информацию об объекте (органе), но в одном его конкретном месте, а не во всем объеме. Образно выражаясь, данную ситуацию можно сравнить с изучением «целого слона по хоботу».
В отличие от планиметрии стереология как наука позволяет с максимальной объективностью произвести количественные измерения в объеме, охарактеризовать структуры и их соотношение в целом, что выгодно отличает ее от всех остальных методов. Однако применение методов стереологии без предварительного планирования, такого как определение объема выборки и рандомизация, все же не даст ожидаемого результата.
В табл. 3 приведено сравнение различных методов морфометрии и возможность их применения.
Заключение
Рассмотренные методы морфометрии не заменяют друг друга, но они могут гармонично сочетаться, что только повышает качество исследования. Задача патоморфолога совместно с исследователем в ходе планирования — выбрать наиболее целесообразные и адекватные приемы анализа гистологического материала, исходя из поставленных задач и выдвинутых гипотез, основываясь на предполагаемом воздействии тестируемого объекта на организм животного или особенности используемой модели патологии. Кроме того, с развитием цифровых систем и нового программного обеспечения возможности морфометрического анализа в гистопатологии значительно расширились, что позволяет, снизив трудозатраты, достичь высокой достоверности и результативности.
Сведения о конфликте интересов
Автор заявляет об отсутствии конфликта интересов, требующего раскрытия в данной статье.
Список источников
-
Gibson-Corley K.N., Olivier A.K., Meyerholz D.K. Principles for valid histopathologic scoring in research // Vet. Pathol. 2013. Vol. 50. N. 6. P. 1007–1015. DOI: 10.1177/0300985813485099.
-
Baak Jan P.A., Oort Jan. A Manual of Morphometry in Diagnostic Pathology. Berlin: Springer-Verlag, 1983. 208 p.
-
Crissman J.W., Goodman D.G., Hildebrandt P.K. et al. Best practices guideline: toxicologic histopathology // Toxicol. Pathol. 2004. Vol. 32. N. 1. P. 126–131. DOI: 10.1080/01926230490268756.
-
Шуравин П.В. Описание гистологических препаратов: руководство. Москва: Simple Pathology, 2020. 209 c. [Shuravin P.V. Opisanie gistologicheskix preparatov: rukovodstvo. Moskva: Simple Pathology, 2020. 209 p. (In Russ.)].
-
Hamilton P.W., Allen D.C. Morphometry in histopathology // J. Pathol. 1995. Vol. 175. N. 4. P. 369–379. DOI: 10.1002/path.1711750403.
-
Зиматкин С.М. Гистология, цитология и эмбриология: учебное пособие. 2-е изд. Минск: Вышэйшая школа. 2013. 229 с. [Zimatkin S.M. Histology, cytology and embryology: a textbook. 2nd ed. Minsk: Vyshehishaya shkola. 2013. 229 p. (In Russ.)].
-
Орлов А.И. Теория измерений как часть методов анализа данных: размышления над переводом статьи П.Ф. Веллемана и Л. Уилкинсона // Социология: методология, методы, математическое моделирование. 2012. № 35. С. 155–174. [Orlov A.I. Teoriya izmerenij kak chast’ metodov analiza danny’x: razmy’shleniya nad perevodom stat’i P.F. Vellemana i L. Uilkinsona // Sotsiologiya: metodologiya, metody, matematicheskoe modelirovanie. 2012. N. 35. P. 155–174. (In Russ.)].
-
Савина А.Г., Блок А.В. Роль и место измерительных шкал в математической статистике // Проблемы современной науки и образования. 2015. № 3 (33). С. 71–75. [Savina A.G., Blok A.V. Rol’ i mesto izmeritel’ny’x shkal v matematicheskoj statistike // Problemy sovremennoi nauki i obrazovaniya. 2015. N. 3 (33). P. 71–75 (In Russ.)].
-
Stevens S.S. On the Theory of Scales of Measurement // Science. 1946 Vol. 103. N. 2684. P. 677–680. DOI: 10.1126/science.103.2684.677.
-
Shackelford C., Long G., Wolf J. et. al. Qualitative and quantitative analysis of nonneoplastic lesions in toxicology studies // Toxicol. Pathol. 2002. Vol. 30. N. 1. P. 93–96. DOI: 10.1080/01926230252824761.
-
Schafer K.A., Eighmy J., Fikes J.D. et al. Use of Severity Grades to Characterize Histopathologic Changes // Toxicologic Pathology. 2018. Vol 46. N. 3. P. 256–265. DOI: 10.1177/0192623318761348.
-
Автандилов Г.Г. Медицинская морфометрия. Руководство. Москва: Медицина, 1990. 384 c. [Avtandilov G.G. Medicinskaya morfometriya. Rukovodstvo. Moskva: Meditsina, 1990. 384 p. (In Russ.)].
-
Ochs M., Mühlfeld C. Quantitative microscopy of the lung: a problem-based approach. Part 1: basic principles of lung stereology // Am. J. Physiol. Lung Cell Mol. Physiol. 2013. Vol. 305. N. 1. P. 15–22. DOI: 10.1152/ajplung.00429.2012.
-
West M.J. Basic Stereology for Biologists and Neuroscientists // Cold Spring Harb. Protoc. 2012. P. 203.
-
Schneider J.P., Ochs M. Stereology of the lung // Methods Cell Biol. 2013. Vol. 113. P. 257–294. DOI: 10.1016/B978-0-12-407239-8.00012-4.
-
Mandarim-de-Lacerda C.A., Del Sol M. Tips for studies with quantitative morphology (morphometry and stereology) // Int. J. Morphol. 2017. Vol. 35. N. 4. P. 1482–1494. DOI: 10.4067/S0717-95022017000401482.
- Boyce R.W., Dorph-Petersen K.A., Lyck L., Gundersen H.J. Design-based stereology: introduction to basic concepts and practical approaches for estimation of cell number // Toxicol. Pathol. 2010. Vol. 38. N. 7. P. 1011–1025. DOI: 10.1177/0192623310385140.



