Использование песчанок в доклинических исследованиях
Работа выполнена без спонсорской поддержки.
Макарова М.Н., Макаров В.Г. Использование песчанок в доклинических исследованиях. Лабораторные животные для научных исследований. 2024; 1. https://doi.org/10.57034/2618723X-2024-01-01
Резюме
Монгольская песчанка (Meriones unguiculatus) используется в биомедицинских исследованиях недавно по сравнению с другими грызунами (мыши, крысы, морские свинки). Песчанка обычно неагрессивна и является одним из наиболее простых в содержании и обращении видов грызунов. Относительная устойчивость к естественным инфекционным заболеваниям и приспособляемость к окружающей среде способствовали расширению использования этого вида в экспериментальных исследованиях. Благодаря тому, что песчанки обладают рядом уникальных анатомических и физиологических характеристик, на них можно моделировать патофизиологические состояния, которые сложно или невозможно воспроизводить на крысах и мышах.
Одной из анатомических особенностей сосудистой системы головного мозга монгольских песчанок является то, что они имеют неполный виллизиев круг, в результате чего песчанки очень восприимчивы к перевязке одной общей сонной артерии, что приводит к нарушению кровоснабжения мозга. По этой причине песчанок используют в исследованиях инсульта. У песчанок наблюдаются спонтанные эпилептические припадки, имеющие некоторое сходство с идиопатической эпилепсией человека. Были выведены сублинии песчанок, восприимчивых и устойчивых к судорожной активности. Возможно, из-за повышенной функциональной активности нефронов у песчанок в почках накапливалось в 4–6 раз больше свинца, чем у крыс, поэтому песчанка была предложена в качестве экспериментальной модели для изучения нефропатии, вызванной свинцом. На стандартных диетах приблизительно у 10% животных развивается ожирение, а у некоторых регистрируются снижение толерантности к глюкозе, повышение уровня инсулина в сыворотке и диабетические изменения в поджелудочной железе и других органах. Хотя диеты с добавлением холестерина не вызывают выраженного атеросклероза, песчанки используются в других исследованиях абсорбции и метаболизма холестерина.
Наиболее широко песчанки используются в исследованиях эпилепсии, инсульта, слуха, метаболических расстройств, заболеваний органов желудочно-кишечного тракта, при изучении инфекционных заболеваний.
В регуляторных исследованиях безопасности (общая токсичность, канцерогенность, генотоксичность, репродуктивная токсичность) песчанки используются реже, чем другие лабораторные грызуны. Одной из причин этого является не только ограниченный объем справочных данных, но и меньший опыт применения по сравнению с широко используемыми в токсикологии другими видами грызунов.
В данном обзоре рассмотрены некоторые направления биомедицинских исследований, в которых используются песчанки для моделирования заболеваний и изучения патофизиологических механизмов их развития.
Введение
Монгольская песчанка (Meriones unguiculatus) используется в биомедицинских исследованиях недавно по сравнению с другими грызунами (мыши, крысы, морские свинки). Песчанка обычно неагрессивна и является одним из наиболее простых в содержании и обращении видов грызунов. Относительная устойчивость к естественным инфекционным заболеваниям и приспособляемость к окружающей среде способствовали расширению использования этого вида в экспериментальных исследованиях [1].
Песчанки относятся к классу млекопитающих, отряду грызунов. Родовое название Meriones произошло от имени греческого воина, носившего боевой шлем, украшенный клыками кабана. Название вида (unguiculatus) на латыни означает когтистый, или ноготь, «gerbil» (песчанка) происходит от арабского слова «ярбу», которым называли обитающих в пустыне грызунов. Ярбу было переведено на латынь как «gerbo» и на английский язык как «gerbil» [1].
Известно около 15 родов и 81 вид песчанок. Песчанки обитают в степях, пустынях и полупустынях Северной Африки, Индии, Монголии, Юго-Западной и Центральной Азии, северо-восточного Китая и районах Восточной Европы [2]. Поскольку дикие песчанки живут в засушливых регионах, они роют норы на глубину от 50 см до 1,5 м, в которых температура остается относительно постоянной в течение дня и ночи.
Приручение монгольской песчанки произошло сравнительно недавно. Этот вид обнаружил французский миссионер, много путешествовавший по Монголии и Китаю в 1860-х годах. Некоторое количество пойманных в дикой природе животных было отправлено в Японию. Монгольские песчанки, используемые в лабораториях сегодня, произошли от 20 пар отловленных животных, которых начали разводить в 1935 г. в Институте Китасато (Kitasato Institute) в Японии [3].
У лабораторных песчанок низкий уровень генетической изменчивости по сравнению с дикими песчанками, что обусловлено их происхождением от нескольких животных-основателей колоний. Исследования 2001 г. показали, что у монгольских песчанок, используемых в научных лабораториях, генетическая изменчивость минимальна, даже несмотря на то что существует несколько разных линий или сублиний [4].
Песчанки имеют несколько уникальных анатомических и физиологических особенностей, благодаря чему они стали широко применяться для моделирования ряда патологических состояний.
Несмотря на довольно широкое использование песчанок в качестве модельных животных для изучения терапевтической эффективности лекарственных средств, эти животные не часто применяются в регуляторных исследованиях безопасности (общая токсичность, канцерогенность, генотоксичность, репродуктивная токсичность). Одной из причин этого является ограниченный не только объем справочных данных, но и меньший опыт применения по сравнению с широко используемыми в токсикологии другими видами грызунов (мыши, крысы, морские свинки). Кроме этого, в протоколах (например, OECD TG 4071, OECD TG 4082), описывающих методики проведения регуляторных токсикологических исследований на грызунах, указывается, что предпочтительным видом являются крысы. По этой причине сложно обосновать применение песчанок для конкретного токсикологического исследования, если только это не имеет очевидного научного обоснования (например, фармакологические эффекты лекарственного кандидата наиболее точно и полно воспроизводятся на данном виде грызунов). В плане оценки безопасности субстанций песчанки, по-видимому, не имеют существенных преимуществ по сравнению, например, с мышами или крысами как с регуляторной, так и с точки зрения научной целесообразности.
В данном обзоре будут рассмотрены некоторые направления биомедицинских исследований, в которых используются песчанки благодаря их уникальным анатомическим и физиологическим особенностям.
Основные анатомические, физиологические, поведенческие особенности песчанок
Песчанки имеют несколько уникальных анатомических и физиологических особенностей.
Взрослые песчанки меньше крыс, но крупнее мышей. Длина тела взрослых особей обоих полов варьирует от 11,5 до 14,5 см, при этом самцы весят в среднем 100 г, а самки — 87,5 г. У песчанок широкая короткая голова с выступающими ушами и большими черными, слегка навыкате глазами. Большие глаза — адаптация, обусловленная образом жизни. Зрение у песчанок очень хорошо развито, поскольку песчанки проявляют активность днем и ночью. Обоняние очень острое и также хорошо развито. Было показано, что песчанки используют различные запахи в качестве социальных сигналов: это могут быть запахи мочи, выделений сальных и гардеровых желез [1].
Анатомия монгольских песчанок была подробно исследована и описана W.M. Williams [5]. Он показал, что анатомия песчанки и лабораторной крысы-альбиноса в целом сходна, за исключением некоторых отличий. У песчанок нет препуциальной железы, есть желчный пузырь, у этих животных 12 пар ребер.
Около 40% монгольских песчанок имеют частично незамкнутый виллизиев круг, что позволяет моделировать развитие очаговой церебральной ишемии и используется для изучения патофизиологии и лечения ишемического инсульта [6].
У песчанок необычно большие вилочковая железа (тимус) и надпочечники по сравнению с другими грызунами такого же размера. Масса надпочечников по сравнению с массой тела примерно в 3 раза превышает аналогичный показатель у крыс. Значение этих анатомически увеличенных структур неизвестно, хотя считается, что увеличенные надпочечники способствуют уникальной способности песчанок концентрировать мочу путем интенсивной реабсорбции воды, что позволяет им сохранять воду в организме [7].
Дыхательная система очень похожа на таковую у других грызунов в том смысле, что у песчанок, по-видимому, нет дыхательных бронхиол в легких. Правое легкое состоит из четырех долей, тогда как левое — из трех [5].
Ферменты печени монгольской песчанки, участвующие в метаболизме холестерина и образовании эфира холестерина в печени, отличаются от ферментов, обнаруженных у других грызунов, и делают песчанку прекрасной моделью для исследования гиперхолестеринемии [8]. Уровень холестерина в сыворотке крови песчанок очень чувствителен к повышенному содержанию холестерина в пище. Песчанки устойчивы к атероматозным изменениям, возникающим при применении диет с высоким содержанием холестерина, но при отсутствии существенных изменений в сосудах у них развивается липидоз печени, и образуются холестериновые камни в желчном пузыре [9].
На стандартных диетах приблизительно у 10% животных развивается ожирение, а у некоторых — снижение толерантности к глюкозе и изменения в поджелудочной железе [9].
Изучение клеточного состава периферической крови и кроветворных органов на молодых песчанках показало их уникальность в том, что у них наблюдается выраженный половой диморфизм в уровне лейкоцитов в циркулирующей крови и костном мозге [10].
Поскольку это пустынные животные, у песчанок есть несколько характеристик, которые позволили им адаптироваться к засушливой среде. Песчанки обладают отличной способностью к терморегуляции и имеют высокий уровень теплоустойчивости. У них уникальный водный метаболизм, поэтому для функционирования им требуется очень мало воды. Песчанки могут получать достаточное количество воды из своего рациона, а их почки обладают высокоэффективной способностью концентрировать мочу, чтобы обеспечить адекватную гидратацию [11]. Соотношение нефронов с длинной и короткой петлей у песчанок высокое, 96% нефронов имеет длинную петлю, что позволяет им эффективно концентрировать мочу [12]. Пищеварительная система также очень эффективно поглощает и удерживает воду, которая может аккумулироваться в жировых клетках. Песчанки производят и выделяют небольшое количество концентрированной мочи и сухих фекалий в день, поэтому у них требуется реже чистить клетку, чем у других лабораторных грызунов.
Песчанки обычно просты в обращении и редко кусаются. Они весьма любопытны, о чем свидетельствует их повышенная активность в тесте «открытое поле» и поведение типа «прижимание к стене» по сравнению с мышами. В природе песчанки живут семейными группами в сложных норах. Их поведение рытья нор не исчезает и в лабораторных условиях, они часто царапают стенки и дно клеток, пытаясь зарыться. Хотя песчанки ведут преимущественно ночной образ жизни, они активны и в светлое время суток, периоды интенсивной активности чередуются со сном или отдыхом [1].
Песчанки территориальные животные и метят почти любой объект окружающей их среды, выделяя феромон брюшной пахучей железой. Эта увеличенная специализированная железа находится под контролем половых гормонов. Животные обоих полов с более высоким уровнем андрогенов метят территорию более часто и имеют обычно преимущество при социальных взаимодействиях. Самцы песчанок метят территорию чаще, чем самки, а песчанки с черным окрасом шерсти — чаще, чем с коричневым [1].
Моделирование патологических состояний
Наиболее широко песчанки используются в исследованиях эпилепсии, инсульта, слуха, при изучении инфекционных заболеваний.
Эпилепсия
Песчанки считаются хорошей моделью наследственной эпилепсии. У песчанок проявляются спонтанные повторяющиеся генерализованные судороги, начинающиеся примерно в возрасте 6 нед. Возможность использования монгольских песчанок для изучения эпилепсии была впервые установлена в 1968 г. Сразу же после этого был опубликован ряд статей о перспективах использования песчанок для изучения эпилепсии [1].
В 1970-х годах в Калифорнийском университете в Лос-Анджелесе была начата программа селекции для выведения подверженных и устойчивых к судорогам песчанок. Селективное разведение трех пар подверженных судорогам песчанок, происходящих из фермы Тамблбрук в Массачусетсе, в течение 18 поколений привело к формированию сублинии подверженных судорогам песчанок. Эти песчанки были идентифицированы как WJL/UC, а устойчивые к судорогам — как STR/UC [13].
В обычной популяции у 10–20% песчанок судороги развиваются при помещении в новую среду или при взятии в руки и фиксации. Поскольку у песчанок часто возникают судороги в ответ на внешние раздражители, было изучено влияние такого раздражителя, как струя сжатого воздуха, на индукцию судорог. Песчанок (7 животных) тестировали 1 раз в неделю в течение 15 нед с регистрацией электроэнцефалограммы (ЭЭГ). Когда животных подвергали воздействию струи сжатого воздуха, у них развивались судороги, но с различной интенсивностью и частотой. В первые недели у большинства песчанок судорог не было, но они становились восприимчивыми к раздражителю с 5-й или 6-й недели эксперимента. У 4 из 7 животных приступы переходили в более тяжелую форму, характеризующуюся клонико-тоническим компонентом. Паттерн судорог соответствовал изменениям ЭЭГ. В целом имеющиеся данные указывают на то, что данная модель может быть полезна для изучения механизмов, лежащих в основе «спонтанных» припадков [14].
Данная модель хорошо воспроизводима. При воздействии сжатого воздуха (5 бар в течение 10 с) более чем у 98% песчанок можно вызвать эпилептические припадки. Напротив, только у небольшого числа животных наблюдаются судороги в ответ на такие раздражители, как перемещение в новую клетку или взятие в руки. Показано, что тяжесть приступов увеличивается с возрастом и достигает максимума примерно в 7 мес [15].
В обычной популяции встречаются песчанки с малыми (миоклоническими) и большими (в основном генерализованными тонико-клоническими) припадками, которые по-разному реагируют на противоэпилептические препараты и, по-видимому, представляют собой интересные модели эпилепсии у человека [16].
Монгольские песчанки и сегодня продолжают использоваться в качестве модели наследственной эпилепсии. В настоящее время известно, что у подверженных судорогам песчанок есть аномалии, связанные с изменениями ГАМКергической синаптической передачи в головном мозге. Изучение патофизиологических механизмов того, как и почему происходят припадки, продолжается [1].
Инсульт (церебральная ишемия)
У млекопитающих виллизиев круг состоит из сообщающихся на вентральной части головного мозга артерий — внутренних сонных, передних мозговых, передних соединительных, задних соединительных, задних мозговых и базилярных. Эта структура обеспечивает попеременный приток крови к мозгу в случае прекращения кровотока в одной из артерий. В 1966 г. было показано, что у песчанок имеется анатомическая аномалия виллизиева круга, характеризующаяся отсутствием у них задней соединительной артерии, соединяющей сонную и вертебробазилярную артериальную систему. Это было названо неполным виллизиевым кругом (рис. 1). Исследователи обнаружили, что перевязка левой сонной артерии у песчанки вызывала гораздо более выраженную острую церебральную ишемию, чем аналогичная перевязка у крыс [17, 18].
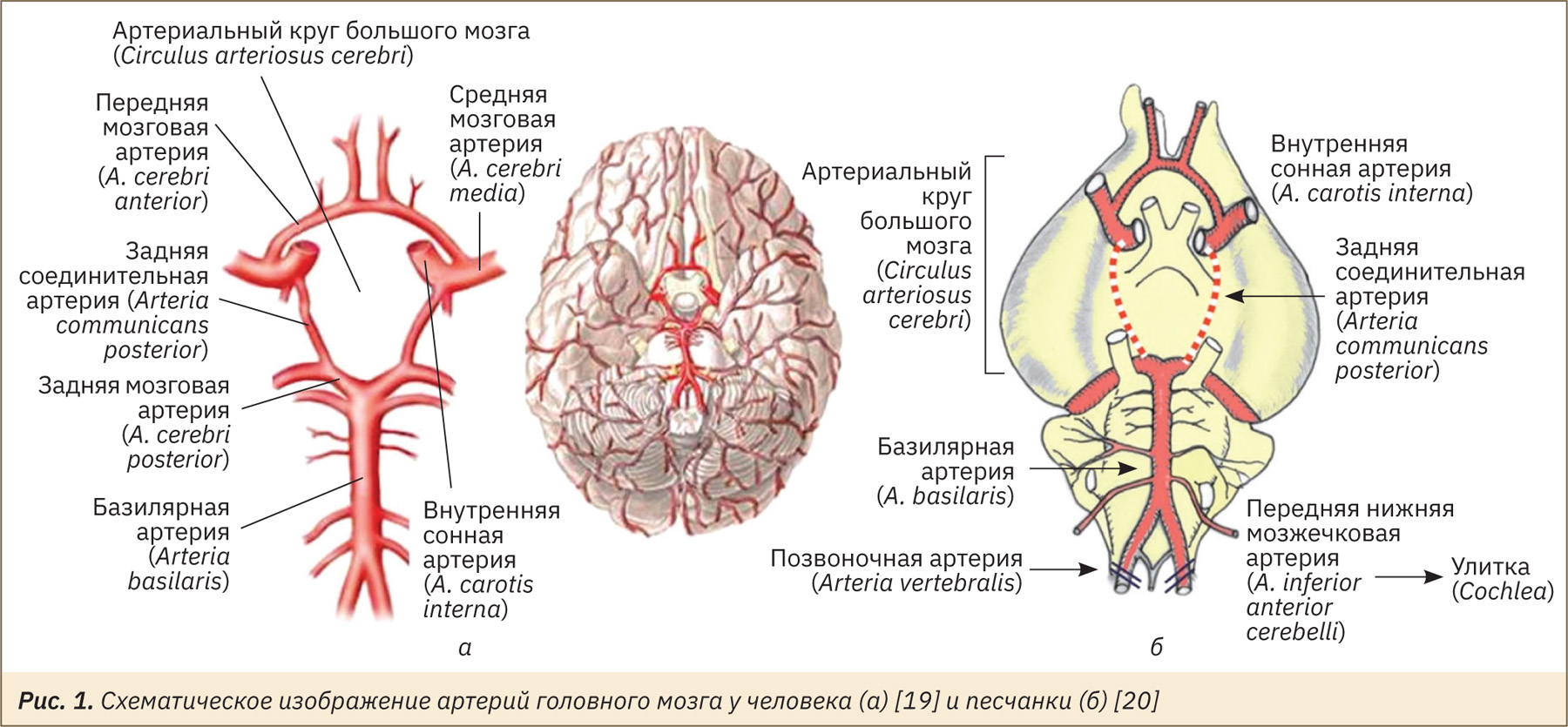
По этой причине песчанок стали использовать в исследованиях инсульта. Постепенно накапливалось все больше информации об их цереброваскулярной анатомии. Было установлено, что не все песчанки имеют неполный виллизиев круг, и можно выделить «предрасположенных» и «устойчивых» к инсульту песчанок [21, 22].
Даже при двусторонней перевязке сонных артерий у песчанок мозг получает кровоснабжение за счет коллатералей артерий. Этот остаточный кровоток после двусторонней перевязки артерий 30–45 мин может поддерживать жизнеспособность мозга, при этом в течение 60 мин смертность достигает 100% [23].
Была обнаружена значительная вариабельность как степени повреждения после двусторонней окклюзии артерий, так и процента предрасположенных к инсульту песчанок в популяции. Количество варьировало в зависимости от пола (42,9% самцов предрасположены к развитию инсульта и 26,7% самок) [24], также была отмечена зависимость от источника получения животных [1].
Несмотря на то что виллизиев круг песчанок нельзя считать полностью разобщенным в области задних соединительных артерий, этих животных продолжают использовать в качестве модели инсульта [1].
Учитывая различие в анатомии сосудов головного мозга, последствия окклюзии сонных артерий могут быть различными по выраженности, что следует учитывать при планировании экспериментов. Кроме того, подбор параметров, в частности время окклюзии сосудов, при моделировании данной патологии — важный этап при постановке методики в конкретной лаборатории. Выбор параметров должен способствовать тому, чтобы минимизировать процент гибели животных. Вместе с тем необходимо добиться равномерной выраженности патологических проявлений в выборке животных. Контролируемыми показателями при моделировании инсульта могут служить: смертность, неврологический статус (балльная шкала оценки), оценка зоны ишемического поражения головного мозга (окраска 2,3,5-трифенилтетразолина хлоридом) и гистологическое исследование головного мозга (окраска гематоксилином и эозином) [25].
В исследовании по оценке влияния времени окклюзии артерий на выраженность патологических изменений у песчанок лигировали правую общую сонную артерию и временно накладывали сосудистый зажим на левую общую сонную артерию (фаза глобальной ишемии). Период ишемии составлял от 15 до 30 мин, после чего с левой общей сонной артерии снимали зажим (фаза реперфузии). При значительном снижении частоты дыхательных движений зажим с левой общей сонной артерии снимали ранее, чем через 30 мин (но не раньше 15 мин), в отсутствие этих признаков — через 30 мин. За весь эксперимент частота летальных исходов составила 41%. Смертность животных возрастала по мере увеличения времени билатеральной окклюзии, у выживших животных, у которых время окклюзии составило более 20 мин, неврологический дефицит был более выражен по сравнению с животными с менее продолжительным периодом окклюзии. Уже на 3-й и 4-й дни после моделирования патологии у большинства выживших животных наблюдалось улучшение общего состояния, восстановление рефлексов. На 2-й день эксперимента у животных с выраженным неврологическим дефицитом область ишемии хорошо идентифицировалась, относительная площадь составляла от 17% и выше. У животных, эвтаназированных на 3–4-й день после моделирования патологии, область ишемии при данном методе оценки уже практически не определялась. При гистологическом исследовании головного мозга песчанок в коре больших полушарий наблюдали нейроны с признаками дистрофии, обнаруживали поля со слабовыраженным глиозом. В коре мозжечка наблюдали «красные» нейроны — клетки с необратимыми изменениями, потерявшие базофильное окрашивание. У большинства животных со слабовыраженным неврологическим дефицитом или с отсутствием неврологических отклонений при гистологическом исследовании выявляли патологические изменения ткани головного мозга уже на 2-й день эксперимента [25].
Развитие мозга, старение, поведение
С 1980-х годов песчанки широко использовались в исследованиях развития мозга, нейрональной пластичности, поведения, а также нормальных и патологических аспектов старения [10].
Для изучения различных аспектов старения (в том числе изменения нейрональной функции с возрастом) песчанки подходят по ряду причин. Например, для экспериментального изучения старения продолжительность жизни модельного объекта должна быть относительно короткой. Продолжительность жизни песчанки, по данным ряда исследований, составляет от 25,7 до 35,4 мес для самцов и от 32,4 до 38,2 мес для самок. Для исследований должно быть доступно не только достаточное количество объектов по оптимальной цене, но также необходимы небольшие размеры, простота в разведении, выращивании и обращении. Песчанка обладает всеми этими характеристиками [10].
Песчанки используются для изучения различных форм поведения, например, для исследования агрессивного поведения и его изменения с возрастом. Модель агрессии на песчанках в некотором отношении отличается от таковой у других грызунов. Песчанки являются социальными животными, которые мирно живут в смешанных или однополых группах. Однако и самцы, и самки песчанок очень агрессивны по отношению к незнакомым особям, попадающим на их территорию (интрудерам). Использование данной модели позволяет изучать агрессивное поведение у социальных животных [10].
Песчанки используются для оценки когнитивных функций. Они значительно любознательнее и в большей мере, чем крысы, проявляют исследовательское поведение, у них менее выражен страх новизны. Песчанки с готовностью исследуют новые объекты, а затем теряют к ним интерес. Используя в качестве модели песчанок, можно разграничить несколько различных показателей поведения, таких как внимание к новому стимулу, и компоненты поведения, которые можно рассматривать как аналогичные поддержанию, избирательности и переключению внимания [10].
Ухудшение памяти связано со старением, особенно при возрастных заболеваниях, например, при болезни Альцгеймера. Песчанка может служить моделью возрастных изменений когнитивной функции в таких парадигмах, как обучение с использованием визуальных и обонятельных стимулов, обучение с аверсивными вкусовыми стимулами, оперантное поведение. В экспериментах с обучением было обнаружено, что песчанки хорошо обучаются, если требуется активно реагировать. Они легко воспроизводят активные реакции с отрицательным или положительным подкреплением, но медленно усваивают пассивное избегание [10].
Примеры изучения развития различных систем и структур мозга на песчанках включают исследования изменений мускариновых рецепторов в таламусе песчанок в возрасте от 6 до 36 мес [26], онтогенеза дофаминовой иннервации в прилежащем ядре у песчанок разных возрастов (14–720 дней), которые выявили различия в динамике созревания дофаминергической иннервации прилежащего ядра и его оболочки, отражающие разницу в развитии моторных и лимбических функций, опосредованных нигростриарной и мезолимбической системами соответственно [27], изучение нейрохимических изменений в мозге песчанок, особенно в гиппокампе, в связи со старением [28].
Также песчанки оказались интересным объектом при исследовании нейрокининовых (NK) рецепторов. NK-рецепторы в значительной степени различаются у разных видов в отношении их сродства к низкомолекулярным антагонистам. При исследовании активности нескольких антагонистов NK-рецепторов на всех известных подтипах NK-рецепторов человека, собак, песчанок и крыс было обнаружено, что песчанки демонстрируют большее сходство с человеком в рецепторной активности и сродстве к антагонистам по сравнению с крысами и мышами [29].
В связи со сказанным песчанки стали предпочтительным видом для исследований антагонистов рецепторов нейрокинина-1 (NK1), предположительно обладающих антидепрессивной активностью. Для оценки антидепрессивного эффекта нового антагониста рецептора NK1 было предложено адаптировать тест Порсолта для песчанок. Критическими факторами при этом стали диаметр плавательного бассейна, масса тела и пол тестируемых животных. Фармакологическая валидация теста была проведена с использованием стандартных антидепрессантов. В целом результаты показали, что песчанки являются идеальным видом для использования в тесте Порсолта, это может иметь прогностическую ценность для идентификации новых антидепрессантов [30].
Интрацеребровентрикулярное введение агонистов тахикининовых NK-1 рецепторов вызывает у песчанок реакцию в виде постукивания задними лапами (foot tapping behaviour), которая, как считается, отражает реакцию, связанную со страхом. Данная модель позволяет изучать механизмы этого поведения [31].
Песчанки также используются для изучения тревожности в тестах «приподнятый крестообразный лабиринт» и «черный/белый ящик». Так, например, в тестах «приподнятый крестообразный лабиринт» и «черный/белый ящик» на песчанках изучали анксиолитические свойства вдыхаемого запаха розы в сравнении с применением диазепама. Запах розы проявлял умеренный анксиолитический эффект [32].
Исследования слуха
Потеря слуха, связанная со старением (пресбиакузис), является одной из распространенных проблем. С возрастом дегенеративные изменения в слуховой системе приводят к прогрессирующей потере слуха к высокочастотным тонам. Песчанка представляет собой хорошую модель для изучения слуха. Костные структуры, удаление которых обеспечивает доступ к структурам среднего и внутреннего уха, очень тонкие, после их изъятия обеспечивается легкий доступ для хирургических манипуляций или прямого размещения электрода на слуховом нерве. Показано, что наилучшая чувствительность уха песчанки находится в том же диапазоне, что и вокализация песчанки (3–5 кГц). Ухо песчанки реагирует на широкий диапазон частот. Стимулы на уровне 50 дБ или менее вызывают ответы в диапазоне 0,2–32 кГц. Более низкая частотная характеристика слуха песчанки отличается от оптимальной чувствительности на более высоких частотах для других мелких грызунов, таких как крыса, хомяк или мышь. Частотный диапазон чувствительности уха песчанки очень похож на диапазон человеческого уха [10].
Благодаря легкому доступу к структурам среднего и внутреннего уха, а также из-за крайней незрелости слуховой системы при рождении песчанка представляет собой идеальный объект для изучения развития морфологии и физиологии слуховой системы. Активность, вызванная звуком, не обнаруживается до 12-дневного возраста. Изучение слуха у старых песчанок с точки зрения физиологических функций и соответствующих анатомических структур улитки и ЦНС по сравнению с более молодыми песчанками может быть полезным для оценки причин слуховой недостаточности у пожилых людей [10].
Песчанки использовались в качестве модели слуховой нейропатии на животных, при этом было показано, что существует потенциальная возможность использования стволовых клеток для лечения потери слуха [33].
Заболевания органов желудочно-кишечного тракта
Песчанки все чаще используются в исследованиях по изучению патологии органов желудочно-кишечного тракта, вызванных Helicobacter pylori (H. pylori). В этом отношении песчанки представляют собой эффективную и экономичную модель, которая воспроизводит многие характеристики воспаления желудка, вызванного H. pylori, а также развития рака органов желудочно-кишечного тракта у людей. Впервые описание этой модели было опубликовано в 1991 г. Сообщалось, что инфицирование песчанок H. pylori через 2 мес вызывало легкий гастрит. Многочисленные последующие исследования показали, что у песчанок, инфицированных H. pylori, после экспериментального заражения развивались язвы желудка, двенадцатиперстной кишки и метаплазия кишечника. Позднее было установлено, что у песчанок образуется карцинома желудка после совместного введения H. pylori и химических канцерогенов, таких как N-метил-N-нитрозомочевина или N-метил-N-нитро-N-нитрозогуанидин. При этом после длительного периода инфицирования H. pylori у монгольских песчанок развивалась аденокарцинома желудка в отсутствие дополнительных химических канцерогенов. Карциномы, которые выявлялись у песчанок, инфицированных H. pylori, обычно возникали в дистальном отделе желудка и пилорической области и характеризовались хорошо дифференцированным эпителием кишечного типа, что сходно с особенностями аденокарциномы желудка кишечного типа у людей. Как и в клинической ситуации, эрадикация H. pylori у песчанок значительно снижает тяжесть гастрита, предраковых осложнений и частоту возникновения аденокарциномы желудка [34].
Песчанки рассматриваются как одна из моделей воспалительных заболеваний кишечника. На мышах была разработана модель колита, индуцированного декстрансульфатом натрия, который животные получали с питьевой водой в течение нескольких дней в 10% концентрации. Это приводило к повреждениям слизистой оболочки за счет токсического действия на эпителиальные клетки и впоследствии к острому колиту, проявлявшемуся кровянистой диареей, снижением массы тела, изъязвлением и нейтрофильной инфильтрацией слизистой оболочки кишечника. Повторное введение декстрансульфата натрия приводило к хронической форме заболевания. Данную модель удалось воспроизвести и на песчанках. Оптимальные результаты были получены при потреблении песчанками 3% раствора декстрансульфата натрия в течение 9 дней. Воспалительные поражения ограничивались толстой кишкой. Наиболее сильное воспаление было выявлено в слепой кишке песчанок. По результатам гистологического исследования показано, что эта модель демонстрирует сходство как с язвенным колитом, так и с болезнью Крона [35].
Метаболические расстройства
Две уникальные особенности песчанки делают ее предпочтительной моделью для изучения метаболизма холестерина и желчных кислот. Во-первых, песчанки, как и люди, более восприимчивы, чем крысы, к холестерину и жирам, поступающим с пищей. У песчанок повышается уровень холестерина в крови и печени при избытке жира или холестерина в рационе. Во-вторых, первичными желчными кислотами песчанок, как и у человека, являются холевая и хенодезоксихолевая кислоты. У крыс хенодезоксихолевая кислота быстро метаболизируется, так что накопление холестерина контролируется. Таким образом, песчанка является более подходящей моделью для изучения метаболизма холестерина и желчных кислот, чем крыса [1, 10].
Еще в исследованиях 80-х годов прошлого века было показано, что у песчанок быстро повышается уровень холестерина в сыворотке и эфиров холестерина в печени на введение пищевых жиров и холестерина. Потребление холестерина крысами вызывало относительно небольшое повышение содержания эфиров холестерина в печени, в то время как уровень холестерина в сыворотке практически не увеличивался [8, 36].
Эти наблюдения подтвердились и в последующих исследованиях. Использование при кормлении песчанок (масса тела 50–60 г) и крыс (масса тела 160–200 г) диеты с высоким содержанием жиров (~1,67 ккал/г), состоящей из 80,5% стандартного рациона, 2% холестерина, 7% сала, 10% желточного порошка и 0,5% солей желчных кислот, уже через 4 нед эксперимента вызывало у песчанок значительное увеличение концентрации общего холестерина, триглицеридов, липопротеинов низкой плотности и липопротеинов высокой плотности в сыворотке крови. По мере использования диеты с высоким содержанием жиров уровни липидов продолжали повышаться, также увеличивались уровни активности трансаминаз (АСТ и АЛТ) в сыворотке крови. У крыс значимо увеличилось только содержание триглицеридов в сыворотке крови. В печени у песчанок была более выражена вакуолизация липидов по сравнению с крысами. Через 12 нед у песчанок отмечен фиброз печени, у крыс такие изменения практически отсутствовали [37].
Данные другого исследования, где у монгольских песчанок в возрасте 7–8 нед (масса тела 50–60 г) использовали аналогичную диету, показали сходные результаты с увеличением уровня общего холестерина и холестерина липопротеинов низкой плотности в сыворотке крови песчанок уже через 2 нед потребления диеты. Отмечается важность наличия в составе диеты солей желчных кислот, так как они способствуют всасыванию холестерина в кишечнике и аккумуляции его в печени. Нормализация параметров происходила через 2 нед после перевода животных на стандартный рацион [38].
Следует учитывать, что у песчанок практически не развиваются атеросклеротические изменения в сосудах на диетах с высоким содержанием холестерина, но у них могут развиться липидоз печени и образоваться холестериновые камни в желчном пузыре при таком питании [1, 9].
В 70-х годах прошлого века был проведен эксперимент, в котором самцы и самки песчанок, наивные и уже участвовавшие в разведении, получали диету с низким содержанием жиров, после чего животные подвергались эвтаназии с последующим патоморфологическим исследованием. У каждого животного брали кровь на биохимический анализ. По результатам эксперимента ни у одного из наивных животных не было выявлено каких-либо отклонений ни по биохимическим показателям, ни в сосудистой системе, ни в других органах. У рожавших самок песчанок наблюдали атеросклероз от минимального до тяжелого в брюшной аорте. При гистологическом исследовании у большинства участвовавших в разведении самок и самцов были обнаружены различные изменения артериальной соединительной ткани, например, эластолитическая дегенерация или кальцификация. У этих животных уровни триглицеридов, свободных жирных кислот, холестерина, глюкозы, мочевины и кортизола в сыворотке крови были повышены. Обсуждается, что спонтанный атеросклероз и другие метаболические нарушения, развивающиеся у песчанок-производителей, очень напоминают аналогичный «синдром», обнаруживаемый у крыс-производителей, при этом наблюдаемые гормональные метаболические изменения и сопутствующая сосудистая дегенерация являются проявлениями гиперактивности гипоталамо-гипофизарной системы, а также оси гипофиз—надпочечники—гонады вследствие репродуктивной активности [39].
Результаты данного эксперимента показывают, что спонтанные атеросклеротические изменения могут развиться у песчанок с возрастом и при наличии репродуктивной активности.
На стандартных диетах приблизительно у 10% песчанок спонтанно развивается ожирение, а у некоторых — гипергликемия, снижение толерантности к глюкозе, гиперплазия островков Лангерганса в поджелудочной железе [9, 10].
Использование песчанок для потенциального моделирования диабета было описано в 1972 г. L. Boquist и соавт. [40], которые обнаружили, что у некоторых песчанок в их колонии отмечались повышенный уровень глюкозы в крови натощак и ожирение. Количество песчанок с высоким уровнем глюкозы в крови был небольшим (3/42, или 7,14%). Позже китайскими учеными при изучении колонии инбредных монгольских песчанок была выявлена более высокая частота животных (21,33%) с повышенным уровнем глюкозы в крови. Был проведен выборочный инбридинг этой подлинии, чтобы создать новую линию песчанок как модель диабета. Оценивали различные параметры, включая уровень инсулина, триглицеридов, холестерина, лептина, адипонектина в сыворотке крови. Также оценивали уровни экспрессии инсулинзависимого белка-переносчика глюкозы (GLUT4), киназы Akt, лептина, адипонектина и кальпаина 10 в печени, скелетных мышцах и белой жировой ткани. Процент животных с уровнем «голодной» глюкозы 5,2 ммоль/л и более и уровнем глюкозы более 6,8 ммоль/л через 2 ч в глюкозотолерантном тесте повышался с увеличением количества племенных поколений от F0 (21,33%) до F6 (38,46%). У этих песчанок с развившимся диабетом наблюдалась резистентность к инсулину и лептину, снижение уровня адипонектина в сыворотке крови, а также снижение экспрессии адипонектина и повышение экспрессии лептина в скелетных мышцах. Данная модель рассматривается как возможная модель диабета 2-го типа [41].
Гемохроматоз
На песчанках разработана первая модель in vivo гемохроматоза — наследственного заболевания, которое проявляется нарушением обмена железа с накоплением его в тканях и органах. При подкожном введении декстрана железа еженедельно в течение 7 нед у песчанок развивался тяжелый гемосидероз особенно печени и сердца. Через 1, 2 и 3 мес после последней инъекции железа в сердце и печени обнаруживался гемохроматоз. Гемохроматоз печени проявлялся в виде рубцового фиброза. Выявленные патологические изменения печени и сердца у песчанок сходны с патологией, наблюдаемой на терминальной стадии болезни у человека. Эта модель позволяет детально изучить механизм индуцированного железом повреждения тканей, а также используется для оценки эффективности методов терапевтического лечения [1, 42].
Токсичность свинца
Благодаря особенностям мочевыделительной системы (высокая способность концентрировать мочу) монгольская песчанка используется как модель для изучения нефротоксичности свинца. Монгольским песчанкам в состав диеты вводили ацетат свинца. Включения свинца в ядра эпителиальных клеток проксимальных извитых канальцев почек наблюдались через 4 нед, а к 12-й неделе их количество увеличивалось примерно до 50 в поле зрения. Цитоплазматические изменения, наблюдаемые в клетках проксимальных канальцев, содержащих включения свинца, расценивались как острое летальное повреждение. По данным атомно-абсорбционной спектрофотометрии через 12 нед общее количество свинца, присутствующего в почках песчанки, было в 4–6 раз больше, чем в почках крысы, что связано особенностями физиологии нефрона почки песчанки [43].
Инфекционные заболевания
Песчанки, по-видимому, очень хорошо подходят для переноса паразитарных инфекций от других видов и поэтому часто используются для изучения широкого спектра паразитов. Например, песчанки могут служить экспериментальными хозяевами для ряда нематод. Одним из наиболее важных применений песчанок в биомедицинских исследованиях является изучение нитевидных нематод, к которым относятся Brugia malayi, Brugia pahangi, Loa loa и Litomosoides sigmodontis. Песчанки были экспериментально заражены этими нематодами для изучения иммунологии, антигенности и жизненных циклов паразитов. С использованием этих моделей были разработаны серологические тесты и схемы лечения [1].
Песчанки использовались для рассмотрения не только всех аспектов жизненного цикла трематод, но и возможных методов лечения. Они являются хорошими моделями животных для исследования различных типов кишечной инфекции [1].
Песчанки также применяются для изучения ряда вирусных инфекций. Болезнь Борна вызывается нейротропным вирусом, который индуцирует острый или подострый энцефалит у лошадей и овец. Этот вирус может быть причиной развития нейропсихических расстройств у людей. Болезнь Борна считается моделью для изучения пластичности нейронов, поскольку вирус может сохраняться в ЦНС и вызывать изменения в функции клеток головного мозга [44]. Новорожденные песчанки очень восприимчивы к инфицированию вирусом Борна, что приводит к воспалительным реакциям в головном мозге, а также к дальнейшей персистенции вируса в головном мозге [45].
Вирус Ла-Кросс — арбовирус, который является одной из наиболее частых причин детской арбовирусной инфекции в США. В 1996 г. американские исследователи обнаружили, что песчанки являются идеальной моделью для изучения этого вируса. Песчанки были восприимчивы к инфекции, выживали, у них развивалась виремия, определялись нейтрализующие антитела после воздействия путем внутримышечной инъекции и укуса инфицированных комаров [46].
Как отмечалось выше, при изучении бактериальных инфекций песчанка используется многими исследователями в качестве модели для исследования H. pylori, потому что при заражении у песчанки развиваются тяжелый гастрит и язва желудка.
Монгольская песчанка используется для изучения листериоза, болезни, возникающей в результате заражения Listeria monocytogenes (L. monocytogenes). L. monocytogenes вызывает пищевую инфекцию у человека, приводящую к гастроэнтериту, менингоэнцефалиту. InlA и InlB, два поверхностных белка L. monocytogenes, которые путем взаимодействия со своими соответствующими клеточными рецепторами опосредуют проникновение бактерий в культивируемые клетки человека. Песчанка имеет эти два клеточных рецептора, сходных с человеческими, что позволяет использовать их для изучения инфекций, вызванных этой бактерией [47].
Легочное кровотечение является тяжелым, часто смертельным последствием лептоспироза, вызываемого L. interrogans, хотя патогенез остается неясным. На песчанках изучают патогенетические механизмы вызванного данной бактерией легочного кровотечения. Песчанки сходным образом реагируют с человеком на инфекцию путем повышения количества PAF-ацетилгидролазы — фактора активации тромбоцитов (platelet-activating factor acetylhydrolase). Базовый уровень активности фермента песчанки сравним с человеческим, а повышенный напрямую связан с течением легочного кровотечения при тяжелом лептоспирозе [48].
Экспериментальные манипуляции
Песчанки относительно просты в содержании и обращении. Экспериментальные методы, используемые для песчанок, аналогичны тем, которые применяются для других грызунов, таких как мыши и крысы. Песчанки, как правило, неагрессивны, с ними легко обращаться, практически не рискуя быть укушенными. Их можно перемещать сложенными чашечкой руками или аккуратно поднимать за основание хвоста. Следует соблюдать осторожность, захватывая только основание хвоста, так как кожа на дистальных частях хвоста может легко сползти как перчатка. Если требуется более надежная фиксация, песчанок можно удерживать за свободную кожу на задней части шеи. С помощью этого захвата их ориентируют в любом положении, однако песчанки не любят, когда их держат на спине, и могут сопротивляться этому положению [1].
Для песчанок можно использовать механические удерживающие устройства, предназначенные для мышей или мелких крыс. Однако при размещении животного в устройстве необходимо следить, чтобы хвост был фиксирован только у основания, чтобы предотвратить травмирование кожи хвоста [1].
Методы отбора проб
Для сбора крови у песчанок используют несколько мест. Для облегчения взятия крови из боковой хвостовой вены можно нагреть хвост для улучшения кровотока, а также надавить на вену у основания хвоста. Можно забирать кровь из латеральной подкожной и из нижнечелюстной вены. При необходимости отбора небольшого количества крови можно подрезать ноготь на пальце ноги или перерезать кончик хвоста (1–2 мм). Следует принять необходимые меры для своевременной остановки кровотечения, забирать кровь из кончика хвоста надо только один или два раза, чтобы избежать повреждения копчиковых позвонков, рекомендовано также использовать анестезию. Большие объемы крови можно собрать из ретроорбитального синуса, яремной вены или путем пункции сердца. Все эти процедуры должны выполняться под анестезией, а пункция сердца должна быть терминальной из-за риска перикардиального кровоизлияния и тампонады сердца. Максимальный объем забора крови, который имеет наименьшее влияние на физиологические функции песчанки, составляет 0,77 мл/100 г массы тела [1].
Сбор мочи у песчанок затруднен из-за очень небольшого объема, выделяется от нескольких капель до 3–4 мл в день. Если моча не может быть собрана при надавливании на мочевой пузырь или путем свободного сбора, можно использовать метаболические клетки. При этом следует следить за тем, чтобы моча, которая выделяется животными в небольших количествах, не испарялась из пробирки для сбора мочи.
Способы введения
Энтеральное введение соединений чаще всего осуществляется с помощью внутрижелудочного зонда (игла с шарообразным наконечником), как это используется у других мелких грызунов. Длину иглы следует проверить при положении животного на боку, «примерив» иглу от ротовой полости до уровня последнего ребра, чтобы убедиться, что ее длины достаточно для введения вещества в желудок. Игла должна легко пройти в желудок, любое сопротивление может указывать на то, что игла находится в трахее и ее следует извлечь и перенаправить. Животным также можно вводить вещества в составе диеты или с водой. Если используется этот метод, необходимо контролировать потребление корма и воды животными, убедиться, что препарат не делает вкус корма или воды неприятными. Снижение потребления воды или корма приводит к тому, что животные получают меньшую дозу вещества [1].
Наиболее частым местом внутривенной инъекции у песчанок является боковая хвостовая вена. Выполнение инъекции можно упростить, согревая хвост, чтобы стимулировать кровоток, а также надавливая на вену у основания хвоста, чтобы расширить сосуд. Следует использовать иглу диаметром G23 или меньше [1].
Внутримышечные инъекции делают в мышцы бедра, при этом важно не задеть седалищный нерв. Объем внутримышечной инъекции должен быть достаточно мал, чтобы избежать повреждения мышц и боли. Объемы более 0,1 мл должны быть разделены между двумя участками [1].
Большинство подкожных инъекций делается под кожу на шее и плечах песчанки. Кожу натягивают, иглу вводят параллельно стенке тела, чтобы избежать попадания в более глубокие ткани [1].
Песчанкам можно вводить вещества внутрибрюшинно в нижнюю часть живота слева или справа, как и у других мелких видов грызунов. Однако, поскольку песчанки могут сопротивляться, если их держать на спине, во время дозирования их следует удерживать в вертикальном положении. Следует соблюдать особую осторожность при введении иглы, необходимо убедиться, что игла не попала в кишечник или мочевой пузырь перед инъекцией [1].
Для интраназального введения используют пипетки или механические одноканальные дозаторы. Также в качестве устройств для интраназального введения используют внутривенный катетер без иглы и шприц Гамильтона. Перед введением, если необходимо, животному выполняют общую анестезию и фиксируют. При проведении манипуляции наконечник устройства подносят на расстояние 1–2 мм от носового хода, выдавливают каплю, далее капля под своей тяжестью капает в носовой ход. После введения 1 капли перед следующей нужно сделать паузу для предотвращения накапливания жидкости и ее проглатывания. Вставлять наконечник устройства в носовой ход животного или подносить слишком близко нельзя из-за возможной травматизации ходов, особенно при повторных вмешательствах [49].
Песчанкам, как и другим мелким лабораторным грызунам, можно осуществлять эндотрахеальное введение при помощи катетеров или специального эндотрахеального зонда, как правило, имеющего шариковый наконечник для предупреждения травматизации. Применение специальных эндотрахеальных зондов дает возможность более точно дозировать исследуемые вещества и вводить их в количестве, не приводящем к механической обструкции дыхательных путей. Также для эндотрахеального введения могут применяться атравматические зонды для внутрижелудочного введения с параметрами, аналогичными эндотрахеальным зондам. Самым простым и наименее инвазивным методом является введение эндотрахеального зонда через ротоглотку. Эндотрахеальное введение, как правило, проводится под общей анестезией, однако при достаточном опыте процедуру можно выполнять без наркотизации животного. В таком случае необходимо использовать местные анестетики [50].
Другие пути введения включают накожный, внутрикожный, ректальный, интравагинальный, интраназальный и церебровентрикулярный. Любое вещество, используемое для парентерального введения, должно быть стерильным и апирогенным.
Если дозирование проводится повторно, за животным следует внимательно следить на предмет каких-либо осложнений. Снижение активности, одышка, сутулость, признаки боли или раздражения в месте инъекции должны быть доведены до сведения ветеринарного персонала. Альтернатива повторным парентеральным введениям — имплантация осмотической помпы. Эти устройства предназначены для имплантации подкожно или внутрибрюшинно и впоследствии обеспечивают постоянное дозирование соединения на срок до нескольких недель.
Объемы введения
В токсикологических исследованиях часто существует необходимость введения больших объемов лекарственного препарата для достижения требуемых доз. Использование больших объемов может быть затруднено на практике и вызвать неблагоприятные физиологические эффекты, ставящие под угрозу благополучие животных.
Принимая во внимание тот факт, что песчанки практически не используются в токсикологических исследованиях, необходимость во введении больших объемов исследуемых субстанций возникает, вероятно, нечасто. В случае отсутствия точных рекомендаций о возможном объеме того или иного способа введения при определении допустимых объемов для песчанок целесообразно использовать универсальные рекомендуемые для лабораторных животных в расчете на массу тела животного и/или придерживаться данных о возможных объемах для крыс и хомяков [51, 52].

В таблице 1 представлены рекомендуемые и максимальные объемы введения для песчанок при наиболее часто используемых в исследованиях способах [49, 50, 53–56].
Особенности содержания и ухода
Песчанки являются отличными объектами для лабораторных исследований, хотя они восприимчивы к бактериальным, вирусным и паразитарным патогенам, поражающим людей и другие виды, у них очень мало болезней, характерных только для них. Некоторые из наиболее распространенных патологических состояний, наблюдаемых у лабораторных песчанок, связаны с неправильным обращением, содержанием или с возрастом песчанок. В целом, ветеринарные методы ветеринарного сопровождения, применяемые для других лабораторных грызунов, также подходят и для лабораторных песчанок.
Правильное содержание песчанок поможет сохранить их здоровье. Задние ноги песчанок длиннее передних, и они любят стоять прямо на задних лапах. Чтобы обеспечить им такую возможность, высота клетки содержания от пола до крышки должна быть достаточной, чтобы песчанка могла стоять. Песчанок следует содержать в клетках с твердым дном и глубиной подстилки не менее 3–5 см, чтобы они могли рыть норы. Животные также любят грызть предметы, им нужны нетоксичные твердые материалы, чтобы реализовывать это поведение [1].
У песчанок могут возникать спонтанные судороги, например, в результате стресса, вызванного взятием в руки, сменой клетки, резким звуком. Как правило, судороги проходят через 30–90 с самостоятельно и, по-видимому, не имеют длительных последствий [1].
При взятии песчанки за кончик или середину хвоста легко повредить кожу хвоста: кожа снимается как перчатка. Песчанок всегда следует брать за основание хвоста или под передние лапы. Хвост с поврежденной кожей можно ампутировать хирургическим путем.
У песчанок часто развивается назальный дерматит (экзема) — заболевание, которое, вероятно, имеет многофакторную этиологию. Клинические признаки начинаются с эритемы в области ноздрей и перерастают в алопецию лицевой части черепа, дерматит, образуются струпья. В некоторых случаях может развиться влажный дерматит, поражающий голову, передние конечности и грудь. Из гардеровой железы песчанок выделяется сложная смесь пигментов и липидов. При груминге секрет, выделяемый через ноздри, смешивается со слюной и распределяется по шерсти песчанки. В дикой природе этот секрет с шерсти песчанки удаляют, купаясь в песке. В исследованиях показано, что секрет гардеровых желез может действовать раздражающим образом на кожу и быть причиной развития назального дерматита. Показано, что удаление гардеровых желез или содержание животных на песке либо предотвращало поражения, либо способствовало излечению уже существующих поражений [1].
Кисты яичников обычно наблюдаются у самок песчанок старше 1 года. Клинические признаки включают симметричную алопецию, вздутие живота, вялость, анорексию, одышку и снижение фертильности [1].
Заключение
Песчанки относительно недавно стали использоваться как объект биомедицинских исследований. Эти животные просты в обращении и содержании, их анатомия и физиология, за некоторым исключением, сходны с таковыми других наиболее широко используемых в научных исследованиях представителей отряда грызунов: крыс и мышей. Благодаря ряду физиологических и анатомических особенностей на песчанках воспроизводятся патофизиологические состояния, которые сложно (или невозможно) моделировать на крысах и мышах. На песчанках разработаны модели инсульта, эпилепсии, метаболических нарушений, заболеваний желудочно-кишечного тракта, проводятся исследования физиологии и патофизиологии слуховой системы. Песчанки широко используются для изучения патогенеза и терапии инфекционных заболеваний.
При этом в рутинных исследованиях токсичности песчанки практически не используются. Это может быть обусловлено несколькими причинами. В частности, объем справочного материала, накопленный для песчанок, существенно уступает таковому для других наиболее часто используемых в токсикологии видов грызунов (крысы, мыши, морские свинки). В протоколах, описывающих методики проведения регуляторных токсикологических исследований на грызунах, указывается, что предпочтительным видом являются крысы. Учитывая отсутствие существенных преимуществ песчанок в плане их использования в токсикологических исследованиях, сложно обосновать применение этого вида для конкретного токсикологического исследования, если только это не имеет очевидного научного обоснования (например, фармакологические эффекты лекарственного кандидата наиболее точно и полно воспроизводятся на данном виде грызунов).
По мере накопления экспериментальных данных, не исключено, что песчанки станут более востребованы и для проведения рутинных токсикологических исследований.
Сведения о конфликте интересов
В.Г. Макаров является главным редактором журнала «Лабораторные животные для научных исследований». М.Н. Макарова является членом редакционной коллегии журнала «Лабораторные животные для научных исследований».
Вклад авторов
М.Н. Макарова — поиск, обобщение данных литературы, написание и редактирование текста рукописи.
В.Г. Макаров — критический пересмотр текста и одобрение окончательного варианта рукописи для публикации.
- OECD Guidelines for the testing of chemicals. Repeated Dose 28‑Day Oral Toxicity Study in Rodents. 407 Adopted: 3 October 2008.
- OECD Guidelines for the testing of chemicals. Repeated dose 90‑day oral toxicity study in rodents 408 Adopted: 25 June 2018.
Список источников
-
Batchelder M., Keller L.S., Sauer M.B., West W. Gerbils // The Laboratory Rabbit, Guinea Pig, Hamster, and Other Rodents. 2012. P. 1131–1155. DOI: 10.1016/B978-0-12-380920-9.00052-3.
-
Robinson D.G. Ecology of the Mongolian gerbil // Gerbil Digest. 1976. Vol. 3. N. 2. P. 1–2.
-
Robinson D.G. Tumblebrook Gerbils: 25th Anniversary // Gerbil Digest. 1979. Vol. 6. N. 3. P. 1–4.
-
Neumann K., Maak S., Stuermer I.W., von Lengerken G., Gattermann R. Low microsatellite variation in laboratory gerbrils // J. Hered. 2001. Vol. 92. N. 1. P. 71–74. DOI: 10.1093/jhered/92.1.71.
-
Williams W.M. The anatomy of the Mongolian gerbil (Meriones ungiculatus). Tumblebrook Farm, Inc. West Brookfield, MA, 1974.
-
Başkaya M.K., Doğan A., Dempsey R.J. Application of endovascular suture occlusion of middle cerebral artery in gerbils to obtain consistent infarction // Neurol Res. 1999 Vol. 21. N. 6. P. 574–578. DOI: 10.1080/01616412.1999.11740979.
- Wagner J.E., Farrar P. L. Husbandry and medicine of small rodents // Vet. Clin. North Am. Small Anim. Pract. 1987. Vol. 17. N. 5. P. 1061–1087. DOI: 10.1016/s0195-5616(87)50105-x.
-
Temmerman A.M., Vonk R.J., Niezen-Koning K., Berger R., Fernandes J. Effects of dietary cholesterol in the Mongolian gerbil and the rat: a comparative study // Lab. Anim. 1989 Vol. 23. N. 1. P. 30–35. DOI: 10.1258/002367789780886948.
-
Vincent A.L., Rodrick G.E., Sodeman W.A.Jr. The pathology of the Mongolian Gerbil (Meriones unguiculatus): a review // Lab. Anim. Sci. 1979. Vol. 29. N. 5. P. 645–651.
-
Cheal M.L. The gerbil: a unique model for research on aging // Exp. Aging Res. 1986. Vol. 12. N. 1. P. 3–21. DOI: 10.1080/03610738608259430.
-
Goyal S.P., Ghosh P. K., Sasidharan T.O., Chand P. Body water relations in two species of gerbil (Tatera indica indica and Meriones hurrianae) of the Indian desert // J. Comp. Physiol. B. 1988. Vol. 158. N. 1. P. 127–134. DOI: 10.1007/BF00692736.
-
Ichii O., Yabuki A., Ojima T., Matsumoto M., Suzuki S. Species specific differences in the ratio of short to long loop nephrons in the kidneys of laboratory rodents // Exp. Anim. 2006. Vol. 55. N. 5. P. 473–476. DOI: 10.1538/expanim.55.473.
-
Loskota W.J., Lomax P., Rich S.T. The gerbil as a model for the study of the epilepsies. Seizure patterns and ontogenesis // Epilepsia. 1974. Vol. 15. P. 109–119.
-
Bertorelli R., Adami M., Ongini E. The Mongolian gerbil in experimental epilepsy // Ital. J. Neurol. Sci. 1995. Vol. 16. N. 1–2. P. 101–106. DOI: 10.1007/BF02229081.
-
Löscher W., Frey H.H. Evaluation of anticonvulsant drugs in gerbils with reflex epilepsy // Arzneimittelforschung. 1984. Vol. 34. N. 11. P. 1484–1488.
-
Löscher W. Genetic animal models of epilepsy as a unique resource for the evaluation of anticonvulsant drugs. A review // Methods Find. Exp. Clin. Pharmacol. 1984. Vol. 6. N. 9. P. 531–547.
-
Wexler B.C. Pathophysiological responses to acute cerebral ischemia in the gerbil // Stroke. 1972. Vol. 3. P. 71–78.
-
Lee J.C., Won M.H. Neuroprotection of antioxidant enzymes against transient global cerebral ischemia in gerbils // Anat. Cell Biol. 2014. Vol. 47. N. 3. P. 149–156. DOI: 10.5115/acb.2014.47.3.149.
-
MedlinePlus. Circle of Willis. URL: https://medlineplus. gov/ency/imagepages/18009.htm. (Дата обращения: 06.2023).
-
Gyo K. Experimental study of transient cochlear ischemia as a cause of sudden deafness // World J. Otorhinolaryngol. 2013. Vol. 3. N. 1. P. 1–15 DOI: 10.5319/wjo.v3.i1.1.
-
Delbarre G., Delbarre B., Barrau Y. A suitable method to select gerbils with incomplete circle of Willis // Stroke. 1988. Vol. 19. N. 1. P. 126. DOI: 10.1161/01.str.19.1.126.
-
Kitagawa K., Matsumoto M., Handa N., Fukunaga R. et al. Prediction of stroke-prone gerbils and their cerebral circulation // Brain Res. 1989. Vol. 479. N. 2. P. 263–269. DOI: 10.1016/0006-8993(89)91627-2.
-
Jarrott D.M., Domer F.R. A gerbil model of cerebral ischemia suitable for drug evaluation // Stroke. 1980. Vol. 11. N. 2. P. 203–209. DOI: 10.1161/01.str.11.2.203.
-
Hall E.D., Pazara K.E., Linseman K.L. Sex differences in postischemic neuronal necrosis in gerbils // J. Cereb. Blood Flow Metab. 1991. Vol. 11. N. 2. P. 292–298. DOI: 10.1038/jcbfm.1991.61.
-
Вавилова В.А., Гущин Я.А. Моделирование глобальной церебральной ишемии у монгольских песчанок // Лабораторные животные для научных исследований. 2019. № 2. [Vavilova V.A., Gushin Ya.A. Modelirovaniye globalnoy cerebralnoy ishemii u mongolskih peschanok // Laboratornye zhivotnie dlia nauchnih issledovaniy. 2019. N. 2. (In Russ.)]. DOI: 10.29296/2618723X-2019-02-03.
-
Pilar-Cuéllar F., Paniagua M.A., Díez-Alarcia R., Dos Anjos S. et al. Muscarinic receptor changes in the gerbil thalamus during aging // Brain Res. 2008. Vol. 1243. P. 38–46. DOI: 10.1016/j.brainres.2008.09.038.
-
Lesting J., Neddens J., Teuchert-Noodt G. Ontogeny of the dopamine innervation in the nucleus accumbens of gerbils // Brain Res. 2005. Vol. 1066. N. 1–2. P. 16–23. DOI: 10.1016/j.brainres.2005.08.058.
-
Lee C.H., Yoo K.Y., Choi J.H., Park O.K. et al. Cyclooxygenase-2 immunoreactivity and protein level in the gerbil hippocampus during normal aging // Neurochem Res. 2010. Vol. 35. N. 1. P. 99–106. DOI: 10.1007/s11064-009-0034-5.
-
Leffler A., Ahlstedt I., Engberg S., Svensson A. et al. Characterization of species-related differences in the pharmacology of tachykinin NK receptors 1, 2 and 3 // Biochem. Pharmacol. 2009. Vol. 77. N. 9. P. 1522–1530. DOI: 10.1016/j.bcp.2009.01.020.
-
Wallace-Boone T.L., Newton A.E., Wright R.N., Lodge N.J., McElroy J.F. Behavioral and pharmacological validation of the gerbil forced-swim test: effects of neurokinin-1 receptor antagonists // Neuropsychopharmacology. 2008. Vol. 33. N. 8. P. 1919–1928. DOI: 10.1038/sj.npp.1301586.
-
Sundqvist M., Kristensson E., Adolfsson R., Leffler A. et al. Senktide-induced gerbil foot tapping behaviour is blocked by selective tachykinin NK1 and NK3 receptor antagonists // Eur. J. Pharmacol. 2007. Vol. 577. N. 1–3. P. 78–86. DOI: 10.1016/j.ejphar.2007.08.042.
-
Bradley B.F., Starkey N. J., Brown S.L., Lea R.W. The effects of prolonged rose odor inhalation in two animal models of anxiety // Physiol. Behav. 2007. Vol. 92. N. 5. P. 931–938. DOI: 10.1016/j.physbeh.2007.06.023.
-
Matsuoka A.J., Kondo T., Miyamoto R.T., Hashino E. Enhanced survival of bone-marrow-derived pluripotent stem cells in an animal model of auditory neuropathy // Laryngoscope. 2007. Vol. 117. N. 9. P. 1629–1635. DOI: 10.1097/MLG.0b013e31806bf282.
-
Noto J.M., Romero-Gallo J., Piazuelo M.B., Peek R.M. The Mongolian Gerbil: A Robust Model of Helicobacter pylori-Induced Gastric Inflammation and Cancer // Methods Mol. Biol. 2016. Vol. 1422. P. 263–280. DOI: 10.1007/978-1-4939-3603-8_24.
-
Bleich E.M., Martin M., Bleich A., Klos A. The Mongolian gerbil as a model for inflammatory bowel disease // Int. J. Exp. Pathol. 2010. Vol. 91. N. 3. P. 281–287. DOI: 10.1111/j.1365-2613.2009.00701.x.
-
Temmerman A.M., Vonk R.J., Niezen-Koning K., Berger R., Fernandes J. Long-term and short-term effects of dietary cholesterol and fats in the Mongolian gerbil // Ann. Nutr. Metab. 1988. Vol. 32. N. 4. P. 177–185. DOI: 10.1159/000177439.
-
Ying H., Yu C., Wang Z., Yu B. et al. Characterization and mechanisms of lipid metabolism in high-fat diet induced hyperlipidemia in Mongolian gerbil (Meriones unguiculatus) // African Journal of Biotechnology. 2012. Vol. 11. N. 97. P. 16347–16352. DOI: 10.5897/AJB12.336.
-
Li C., Guo H., Dai F., Huo X. et al. SREBP 2 expression pattern contributes to susceptibility of Mongolian gerbils to hypercholesterolemia // Molecular Medicine Reports. 2018. Vol. 17. N. 2. P. 3288–3296. DOI: 10.3892/mmr.2017.8195.
-
Wexler B.C., Judd J.T., Lutmer R.F., Saroff J. Spontaneous arteriosclerosis in male and female gerbils (Meriones unguiculatus) // Atherosclerosis. 1971. Vol. 14. N. 1. P. 107–119. DOI: 10.1016/0021-9150(71)90042-6.
-
Boquist L. Obesity and pancreatic islet hyperplasia in the Mongolian gerbil // Diabetologia. 1972. Vol. 8. N. 4. P. 274–282. DOI: 10.1007/BF01225571.
-
Li X., Lu J., Wang Y., Huo X. et al. Establishment and Characterization of a Newly Established Diabetic Gerbil Line // PLoS One. 2016. Vol. 11. N. 7. P. e0159420. DOI: 10.1371/journal.pone.0159420.
-
Carthew P., Dorman B.M., Edwards R.E., Francis J.E., Smith A.G. A unique rodent model for both the cardiotoxic and hepatotoxic effects of prolonged iron overload // Lab. Invest. 1993. Vol. 69. N. 2. P. 217–222.
-
Port C.D., Baxter D.W., Richter W.R. The Mongolian gerbil as a model for lead toxicity. I. Studies of acute poisoning // Am. J. Pathol. 1974. Vol. 76. N. 1. P. 79–94.
-
Gonzalez-Dunia D., Volmer R., Mayer D., Schwemmle M. Borna disease virus interference with neuronal plasticity // Virus Res. 2005. Vol. 111. N. 2. P. 224–234. DOI: 10.1016/j.virusres.2005.04.011.
-
Nakamura Y., Nakaya T., Hagiwara K., Momiyama N. et al. High susceptibility of Mongolian gerbil (Meriones unguiculatus) to Borna disease virus // Vaccine. 1999. Vol. 17. N. 5. P. 480–489. DOI: 10.1016/s0264-410x(98)00222-9.
-
Osorio J.E., Schoepp R.J., Yuill T.M. Effects of La Crosse virus infection on pregnant domestic rabbits and mongolian gerbils // Am. J. Trop. Med. Hyg. 1996. Vol. 55. N. 4. P. 384–390. DOI: 10.4269/ajtmh.1996.55.384.
-
Disson O., Nikitas G., Grayo S., Dussurget O. et al. Modeling human listeriosis in natural and genetically engineered animals // Nat. Protoc. 2009. Vol. 4. N. 6. P. 799–810. DOI: 10.1038/nprot.2009.66.
-
Yang J., Zhang Y., Xu J., Geng Y. et al. Serum activity of platelet-activating factor acetylhydrolase is a potential clinical marker for leptospirosis pulmonary hemorrhage // PLoS One. 2009. Vol. 4. N. 1. P. e4181. DOI: 10.1371/journal.pone.0004181.
-
Кательникова А.Е., Крышень К.Л., Зуева А.А., Макарова М.Н. Интраназальное введение лекарственных средств лабораторным животным // Лабораторные животные для научных исследований. 2019. № 2. [Katelnikova A.E., Kryshen K.L., Zueva A.A., Makarova M.N. Intranazalnoe vvedenie lekarstvennih sredsnv laboratornym zhivotnym // Laboratornye zhivotnie dlia nauchnih issledovaniy. 2019. N. 2. (In Russ.)]. DOI: 10.29296/2618723X-2019-02-09.
-
Трофимец Е.И., Макарова М.Н., Кательникова А.Е., Крышень К.Л. Эндотрахеальный способ введения лекарственных средств лабораторным животным // Лабораторные животные для научных исследований. 2020. № 2. [Trofimets E.I., Makarova M.N., Katelnikova A.E., Kryshen K.L. Endotrachealniy sposob vvedeniya lekarstvennih sredstv laboratornym zhivotnim // Laboratornye zhivotnie dlia nauchnih issledovaniy. 2020. N. 2. (In Russ.)]. DOI: 10.29296/2618723X-2020-02-08.
-
Morton D.B., Jennings M., Buckwell A. et al. Joint Working Group on Refinement. Refining procedures for the administration of substances. Report of the BVAAWF/FRAME/RSPCA/UFAW Joint Working Group on Refinement. British Veterinary Association Animal Welfare Foundation/Fund for the Replacement of Animals in Medical Experiments/Royal Society for the Prevention of Cruelty to Animals/Universities Federation for Animal Welfare // Lab Anim. 2001. Vol. 35. N. 1 P. 1–41. DOI: 10.1258/0023677011911345.
-
Turner P. V., Brabb T., Pekow C., Vasbinder M.A. Administration of substances to laboratory animals: routes of administration and factors to consider // J. Am. Assoc. Lab. Anim. Sci. 2011. Vol. 50. N. 5. P. 600–613.
-
Acceptable Maximum and Absolute Maximum Volumes for Research Compound Administrationю UC Davis Institutional Animal Care and Use Committee (IACUC). August 4, 2022. URL: https://research.ucdavis.edu/wp-content/uploads/IACUC-50.pdf. (Дата обращения: 06.2023).
-
Recommended Dose Volumes for Common Laboratory Animals IQ 3Rs Leadership Group — Contract Research Organization Working Group. URL: https://iqconsortium.org/images/LG-3Rs/IQ-CRO_Recommended_Dose_Volumes_for_Common_Laboratory_Animals_June_2016_%282%29.pdf. (Дата обращения: 06.2023).
-
IACUC Policy for Dose Volumes in Laboratory Animals. Indiana University. May 23, 2017. URL: https://research.iu.edu/
doc/compliance/animal-care/bloomington/iub-biacuc-dose-volumes-in-laboratory-animals.pdf. (Дата обращения: 06.2023).
- Чернышова А.В., Рощина Е.А., Алексеева Л.И., Кательникова А.Е., Макарова М.Н. Рекомендованные и максимально допустимые объемы для ректального и интравагинального введения лекарственных средств разным видам животных // Лабораторные животные для научных исследований. 2023. № 1. [Chernyshova A.V., Roshchina E.A., Alekseeva L.I., Katelnikova A.E., Makarova M.N. Rekomendovannie i maksimalnie dopustimie obiemi dlia rektalnogo i intravaginalnogo vvedeniya lekarstvennih sredstv raznim vidam zhivotnyh // Laboratornye zhivotnie dlia nauchnih issledovaniy. 2023. N. 1. (In Russ.)]. DOI: 10.57034/2618723X-2023‑01‑04.



