Содержание общих желчных кислот в крови и желчи лабораторных животных
Работа выполнена без спонсорской поддержки.
Симонова Е.В. , Султанова К.Т., Фаустова Н.М., Романенко А.Ю. Содержание общих желчных кислот в крови и желчи лабораторных животных. Лабораторные животные для научных исследований. 2023; 4. https://doi.org/10.57034/2618723X-2023-04-08
Резюме
Желчные кислоты в организме человека и животных оказывают влияние на обмен углеводов и липидов, участвуют в процессе эмульгирования пищевых липидов, холестерина и жирорастворимых витаминов в просвете кишечника. Наиболее часто изменение уровня и состава желчных кислот ассоциировано с патологиями гепатобилиарной системы. При изучении фармакодинамической активности некоторых лекарственных препаратов на экспериментальных моделях патологии гепатобилиарной системы у лабораторных животных одним из параметров оценки является уровень общих желчных кислот в различных биологических материалах. Для анализа и интерпретации результатов уровня общих желчных кислот необходимо учитывать вид животного, состав используемого корма и режим голодания. Также важно учесть вид анализируемого биологического материала и ряд других факторов, которые способны повлиять на определяемый показатель и на результат исследования.
В данной статье представлены сведения об уровне общих желчных кислот в периферической крови и желчи интактных половозрелых лабораторных животных. В эксперименте регистрировали низкий уровень общих желчных кислот в сыворотке крови относительно данных, полученных при исследовании желчи. Результаты значительно варьируют в зависимости от вида животного и анализируемого материала. В крови индивидуальные значения уровня желчных кислот у всех животных не выходили за границу 48,7 мкмоль/л, в то время как в желчи интервалы находились в пределах 8,2–8710,7 ммоль/л в зависимости от вида животного. Минимальные значения желчных кислот в крови, как и максимальные в желчи, были зарегистрированы у хорьков: 0–0,6 мкмоль/л и 226–8711 ммоль/л соответственно, что, вероятнее всего, связано с питанием хищных млекопитающих, при этом наиболее высокие показатели в крови были определены у кроликов [24,4 (16,7; 34,5) мкмоль/л], что также может быть связано с особенностями пищеварения травоядных. Значения желчных кислот в желчи были на порядок ниже у всех грызунов по сравнению с остальными видами, у морских свинок показатель имел самые низкие пределы — 19±2 ммоль/л.
Проведенный анализ выявил высокую вариабельность уровня общих желчных кислот в крови и желчи у разных видов животных и в пределах одного вида, что может затруднить интерпретацию данных при оценке влияния лекарственного средства. В связи с этим при планировании исследования, связанного с определением уровня общих желчных кислот, необходимо увеличивать выборку животных, планировать и контролировать единообразие отбора биологического материала.
Введение
Желчные кислоты представляют собой растворимые продукты, образующиеся в результате катаболизма холестерина [1]. Синтез желчных кислот в печени составляет основную часть суточного оборота холестерина [2]. Вновь синтезированные желчные кислоты секретируются в желчь и доставляются в просвет тонкой кишки, где они действуют как эмульгаторы пищевых липидов, холестерина и жирорастворимых витаминов, также они действуют как сигнальные молекулы, оказывая множественное влияние на метаболизм [3]. Желчные кислоты транспортируются из кишечника в печень портальным кровотоком, а затем снова секретируются в желчь. Синтез желчных кислот строго регулируется, чтобы обеспечить катаболизм достаточного количества холестерина для поддержания гомеостаза и адекватного эмульгирования в кишечнике. Если организм находится в состоянии сытости, то избыток желчных кислот в крови подавляет их дальнейший синтез, и наоборот, при недостатке желчных кислот их синтез увеличивается. У некоторых видов лабораторных животных, включая крыс и мышей, биосинтез желчных кислот усиливается в ответ на потребление холестерина с пищей и его накопление [4, 5].
Изменение уровня желчных кислот в крови и их соотношения чаще всего говорит о заболеваниях печени различной этиологии. Так, желчные кислоты определяются в периферической крови здоровых людей и лиц с заболеваниями, не связанными с энтерогепатической циркуляцией желчных кислот, в очень малых количествах (приравнивается к 0). В то же время при патологии печени различного генеза их концентрация существенно увеличивается [6, 7]. Вторичные и третичные желчные кислоты участвуют в регуляции обмена углеводов и липидов, а также задействованы в воспалительных процессах преимущественно энтерогепатических тканей. Соответственно нарушение обмена желчных кислот может способствовать развитию неалкогольной жировой болезни печени, сахарного диабета 2-го типа и ожирения [7, 8].
В доклинических исследованиях нередко стоит задача определения уровня желчных кислот в различном биологическом материале, наиболее часто это требуется в фармакодинамических экспериментах, проводимых на здоровых животных или на животных с моделируемыми патологиями гепатобилиарной системы. Для того чтобы интерпретировать результаты определения количества и состава желчных кислот в организме животных, важно иметь представление об интервалах значений, которые могут сильно меняться в зависимости от вида животного и забираемого материала (кровь, моча, желчь, фекалии, содержимое различных отделов кишечника) [9].
Таким образом, цель исследования — определение значений общих желчных кислот в периферической крови и желчи интактных половозрелых самцов и самок лабораторных мышей, крыс, морских свинок, кроликов, хорьков, а также самцов карликовых свиней как наиболее часто используемых в доклинических исследованиях лабораторных животных.
Материал и методы
Исследование выполнено в соответствии с Директивой 2010/63/EU Европейского парламента и Совета Европейского союза от 22 сентября 2010 г. по охране животных, используемых в научных целях1 и Руководством по содержанию и использованию лабораторных животных2. В эксперименте использовали 8 самцов и 8 самок каждого из видов животных: мыши, крысы, морские свинки, кролики, а также по 4 самца и самки хорьков и 6 самцов карликовых свиней. Все животные были клинически здоровы на момент взятия биоматериала. В табл. 1 приведены данные об использованных животных.

Животные содержались в стандартных условиях в соответствии с Директивой 2010/63/EU Европейского парламента и Совета Европейского союза от 22 сентября 2010 г. по охране животных, используемых в научных целях. Параметры окружающей среды в ходе эксперимента поддерживали в пределах установленных норм, световой режим был 12 ч темноты/12 ч света. В качестве корма использовали комбикорм ЛБК-120 для грызунов, приготовленный в соответствии с требованиями ГОСТа 34566–20193, ПК-90 для кроликов и хорьков, приготовленный в соответствии с требованиями ГОСТа 32897–20144 и комбикорм СК-1-Т для карликовых свиней, приготовленный согласно ГОСТу Р 52255–20045, для последнего вида также осуществляли докорм: отруби, сыворотка сухая, травяная мука, морковь, яблоко. Воду, соответствующую нормам СанПиН 2.1.3684–216, давали животным в стандартных поилках со стальными крышками-носиками ad libitum. В качестве подстила у всех видов животных применяли древесные гранулы из лиственных пород древесины.
У всех перечисленных лабораторных животных образцы крови и желчи отбирали в утренние часы (9:00–12:00). Депривация корма соблюдалась у тех видов животных, у которых она допустима (мыши, крысы, морские свинки) в соответствии с Директивой 2010/63/EU7, у остальных (кролики, хорьки, карликовые свиньи) образцы были отобраны в утренние часы перед кормлением. Методика отбора образцов крови и желчи у разных видов животных представлена в табл. 2.
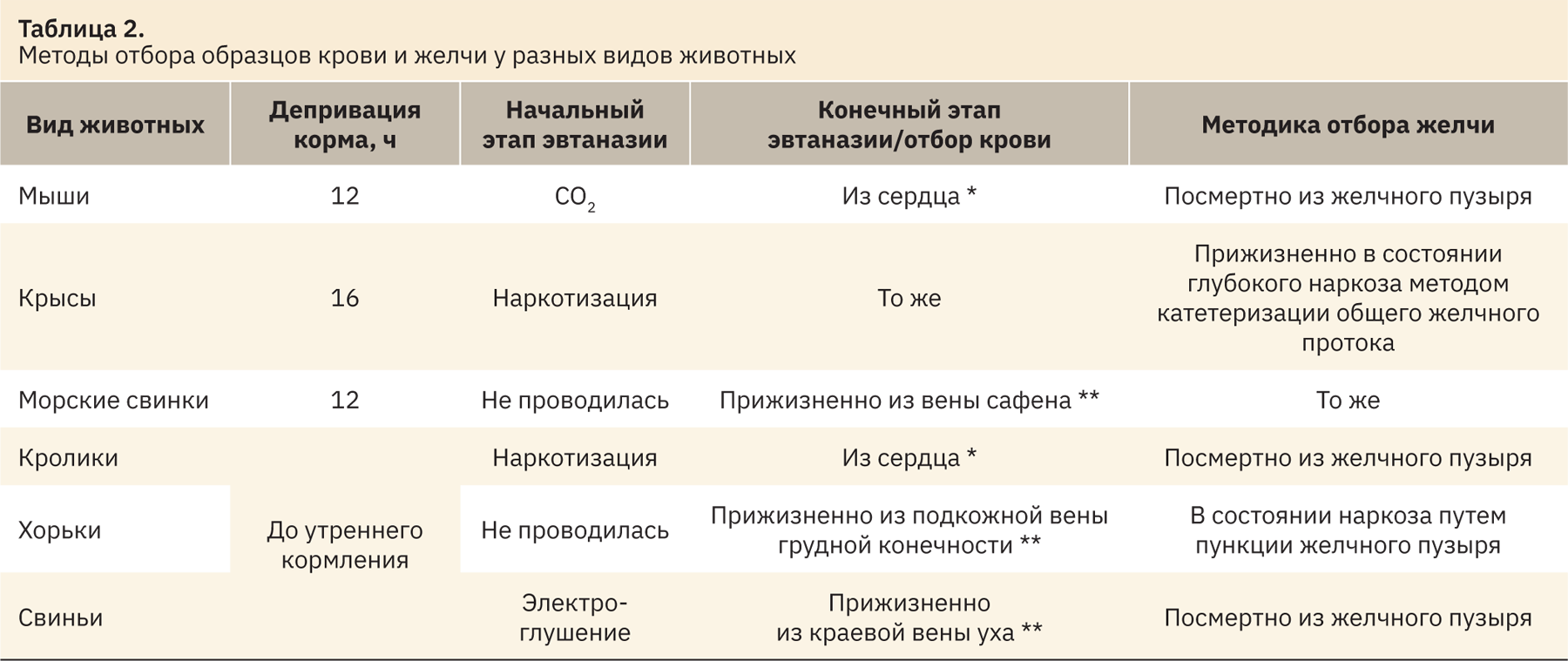
Наркотизацию крыс и морских свинок осуществляли при помощи внутримышечного введения Zoletil 50 (Virbac Sante Animale) и Xila (Interchemie Werken De Adelaar Eesti AS), кроликов наркотизировали, используя внутривенное введение аналогичных препаратов, хорькам предварительно вводили супрастин (ЗАО «Фармацевтический завод ЭГИС») и использовали в качестве наркоза Zoletil 100 (Valdepharm) и рометар (АО «Биовета»).
У мышей, крыс и кроликов кровь отбирали из сердца (конечный этап эвтаназии) при помощи шприца, у остальных животных — прижизненно, применяя внутривенный катетер: из подкожной вены грудной конечности у хорьков, из вены сафена согласно методике Shukla у морских свинок [10], из краевой вена уха у карликовых свиней. Кровь забирали в пробирки с активатором свертывания для получения сыворотки в объеме 1 мл у морских свинок, кроликов, хорьков и карликовых свиней и в максимально возможном объеме у мышей и крыс.
Желчь забирали в пробирки типа «эппендорф». У мышей и кроликов желчь отбирали посмертно из желчного пузыря при помощи двухкомпонентных шприцов разного объема (у мышей ввиду малого объема желчного пузыря использовали инсулиновые шприцы с интегрированной иглой). Для отбора желчи крыс и морских свинок вводили в состояние глубокого наркоза, после чего делали широкий разрез брюшной стенки по белой линии вплоть до диафрагмы для обеспечения доступа к брюшной полости. Далее визуализировали двенадцатиперстную кишку и общий желчный проток (сосуд с желтым содержимым) и фиксировали кишку зажимом так, чтобы желчный проток оказался под натяжением. Катетер (26G, 0,6×19 мм) вводили в желчный проток на несколько миллиметров выше места соединения с кишкой и оставляли в таком положении на 10–15 мин (желчь набиралась в канюле катетера), после чего собранное количество переливали в пробирку. У морских свинок отбор желчи проводили в течение 5 ч [10]. Хорьки для проведения процедуры также находились в глубоком наркозе, желчь отбирали методом пункции желчного пузыря под контролем УЗИ с помощью аппарата ультразвуковой диагностики Mindray DP-50 (Mindray, Китай) при помощи инъекционной иглы 23G (0,6х30 мм) и шприца 5 мл.
Кровь выдерживали 60 мин после отбора, центрифугировали при 3000 оборотах в минуту в течение 15 мин, отбирали сыворотку и замораживали при температуре ниже –18 °C. Желчь предварительно аликвотировали и замораживали при тех же условиях.
Анализ выполняли с использованием коммерческого набора реагентов Total Bile Acids (TBA) Assay kit (colorimetric) (№ MAK382, Sigma-Aldrich, США) в соответствии с методикой, описанной в инструкции к набору. Принцип анализа — ферментативный циклический метод в присутствии НАДН и хромофора. Измерения оптической плотности проводили в микропланшетном анализаторе CLARIOstar® (BMG Labtech, Германии). Линейный диапазон методики 12–120 пмоль/лунка (0,24–2,4 мМ). Предел обнаружения составлял 1 мкМ желчных кислот. Образцы сыворотки крови и желчи, в которых концентрация общих желчных кислот была выше верхнего предела количественного определения (2,4 мМ) разбавляли водой очищенной.
Для статистического анализа использовали программное обеспечение Prism 9.1.1 (GraphPad Software, США). Для показателей желчи рассчитывали среднее значение (M) и стандартную ошибку среднего (SEM), медиану (Me) и квартили 25, 75 (Q1; Q3) для показателей крови.
Результаты и обсуждение
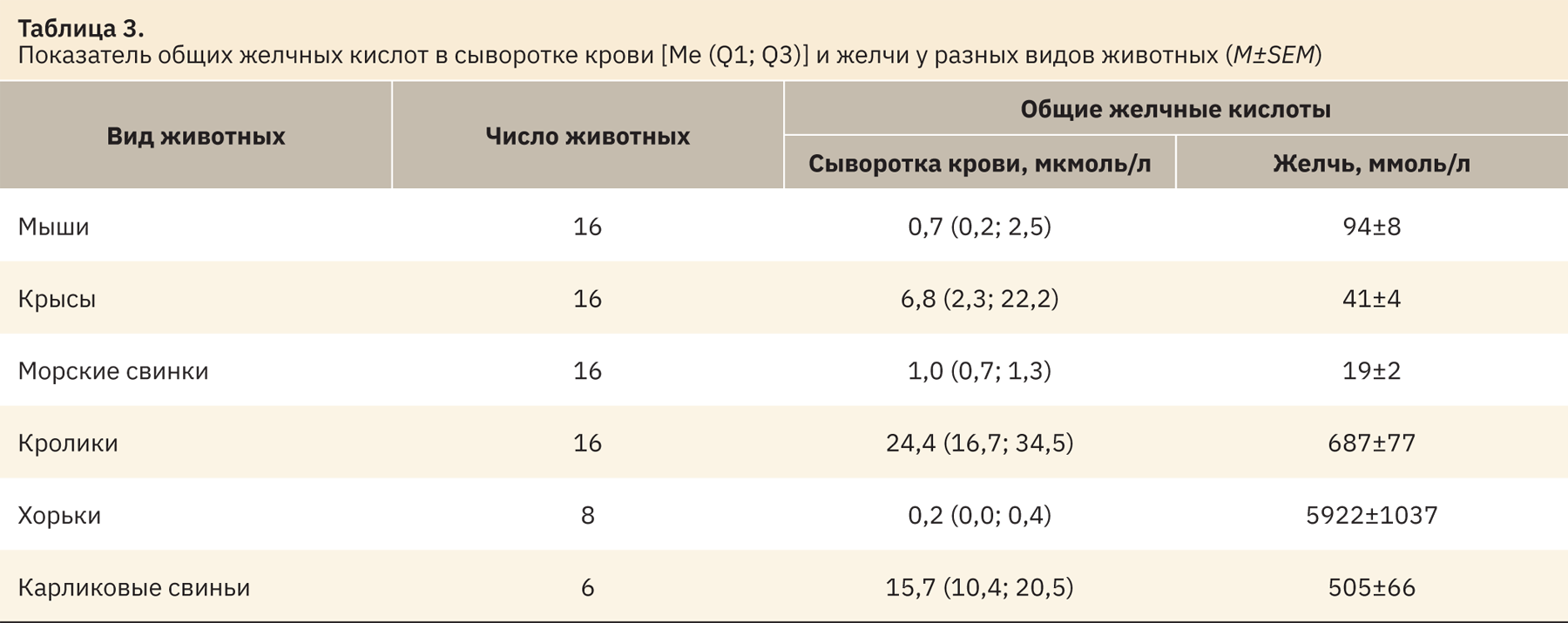
В табл. 3 представлены средние значения общих желчных кислот в сыворотке и желчи по каждому виду животных.
Выборка животных (8 особей каждого пола всех видов, кроме хорьков, которых брали по 4 особи каждого пола) не позволяет сделать однозначных выводов о межполовых различиях, в связи с чем данные по самцам и самкам были объединены (табл. 4).

Индивидуальные значения общих желчных кислот в сыворотке крови лабораторных животных незначительно варьируют. Так, у морских свинок диапазон колеблется от 0,5 до 1,9 мкмоль/л, в то время как у крыс, кроликов и карликовых свиней значения не выходят за пределы 0,7–48,7 мкмоль/л, у мышей и хорьков значения не поднимаются выше 1 мкмоль/л. Уровень общих желчных кислот крыс и мышей как совпадает с диапазонами, данными в литературе [9, 11, 12], так и отличается от них [13]. Измерение общих желчных кислот в крови у остальных видов животных, вероятно, проводится не так часто, в связи с этим достоверных данных для сравнения полученных результатов найдено не было (см. табл. 4).
В желчи, забранной из желчного пузыря и общего желчного протока, уровень общих желчных кислот у разных видов животных значительно варьирует. Индивидуальные значения общих желчных кислот у грызунов имеют схожий диапазон. Так, у мышей диапазон значений находится в пределах от 41 до 135 ммоль/л, у крыс — от 8,2 до 73 ммоль/л, у морских свинок — от 7,4 до 30 ммоль/л, при этом у самок показатель незначительно выше. У кроликов и карликовых свиней индивидуальные значения не выходят за пределы 260–1572 ммоль/л, при этом данные, полученные у кроликов, не совпадают с указанными в литературе (см. табл. 4) [14]. Уровни общих желчных кислот хорьков сильно варьируют вне зависимости от пола и находятся в широких границах 226–8711 ммоль/л.
Повышенное содержание желчных кислот в желчи хорьков, вероятно, связано с их видом. Одна из основных функций желчных кислот — эмульгирование и солюбилизация липидов из просвета кишечника [1], а так как хорьки являются хищными млекопитающими, то предполагается повышенное потребление ими жиров (естественный рацион питания) по сравнению с остальными видами исследуемых животных.
Стоит отметить, что у крыс, мышей и морских свинок (грызуны) средние значения находятся примерно на одном уровне (до 100 ммоль/л) и индивидуальные значения варьируют в достаточно близких друг от друга пределах. В то время как у кроликов индивидуальные значения общих желчных кислот в желчи находятся незначительно выше. Это может быть связано с тем, что у травоядных животных пища поступает в кишечник относительно непрерывно, желчь образуется с постоянной высокой скоростью [15], также имеет место влияние разницы используемых при их содержании кормов.
Несмотря на высокую вариабельность, данные, полученные в исследовании концентрации общих желчных кислот у разных видов животных, и результаты из разных источников литературы имеют схожие диапазоны.
Заключение
Установленные в эксперименте значения уровня общих желчных кислот в сыворотке крови крыс и мышей сопоставимы с данными литературы, в то время как результаты, полученные при исследовании желчи кроликов, отличаются от найденных в источниках. Значения уровня общих желчных кислот в крови и желчи у морских свинок, хорьков и карликовых свиней в литературе не представлены, в связи с этим сопоставить полученные результаты с другими источниками затруднительно.
Исходя из полученных результатов, влияния пола животных на количественные показатели общих желчных кислот в сыворотке крови и желчи не обнаружено, однако их пределы сильно варьируют в зависимости от вида животных и анализируемого материала.
Значения общих желчных кислот в желчи имеют более высокие пределы по сравнению с таковыми в сыворотке крови, что обусловлено процессом их обмена в организме. Самые высокие показатели отмечены у хорьков, что характерно для хищных млекопитающих. Диапазон значений показателя в сыворотке крови у разных видов животных находится в достаточно узких границах по сравнению с таковыми в желчи.
Индивидуальные значения желчных кислот животных, как правило, варьируют в пределах одного вида, при планировании исследования выборка животных должна быть достаточной для успешности последующей статистической обработки данных. Целесообразно проводить отбор материала при наличии такой возможности до начала экспериментальной части (фоновые значения), соблюдая единообразие методики отбора образцов.
Полученные данные в дальнейшем могут быть использованы для составления референсных интервалов уровня общих желчных кислот у лабораторных животных.
Сведения о конфликте интересов
Авторы заявляют об отсутствии конфликта интересов.
Вклад авторов
Е.В. Симонова — анализ научной и методической литературы, сбор и систематизация материала, статистическая обработка данных, написание, редактирование и доработка текста рукописи.
К.Т. Султанова — написание и редактирование текста рукописи, обобщение результатов исследования.
Н.М. Фаустова — создание аналитического подхода, проведение аналитического этапа исследования.
А.Ю. Романенко — пробоподготовка образцов крови и желчи, проведение аналитического этапа исследования.
-
Директива 2010/63/EU Европейского парламента и Совета Европейского союза по охране животных, используемых в научных целях / пер. с англ. Под ред. М.С. Красильщиковой, И.В. Белозерцевой. Санкт-Петербург, 2012. 48 с. [Direktiva 2010/63/EU Yevropeyskogo Parlamenta i Soveta Yevropeyskogo Soyuza po okhrane zhivotnykh, ispol’zuyemykh v nauchnykh tselyakh / transl. from English. Ed. M.S. Krasilshchikova, I.V. Belozertseva. St. Petersburg, 2012. 48 p. (In Russ.)].
-
Руководство по содержанию и использованию лабораторных животных. 8-е издание / пер. с англ. Под ред. И.В. Белозерцевой, Д.В. Блинова, М.С. Красильщиковой. Москва: ИРБИС, 2017. 336 с. [Rukovodstvo po soderzhaniyu i ispolsovaniyu laboratornykh zhivotnykh. Vos’moe izdanie / transl. from English. Ed. I.V. Belozercevoi, D.V. Blinova, M.S. Krasil’shikovoi. Moskva: IRBIS, 2017. 336 p. (In Russ.)].
-
ГОСТ 34566–2019 Комбикорма полнорационные для лабораторных животных. Технические условия. [GOST 34566–2019 Kombikorma polnoracionny’e dlya laboratorny’x zhivotny’x. Texnicheskie usloviya. (In Russ.)].
-
ГОСТ 32897–2014 Комбикорма для пушных зверей, кроликов, нутрий. Общие технические условия. [GOST 32897–2014 Kombikorma dlya pushny’x zverej, krolikov, nutrij. Obshhie texnicheskie usloviya. (In Russ.)].
-
ГОСТ Р 52255–2004 Комбикорма для свиней. [GOST R 52255–2004 Kombikorma dlya svinej. (In Russ.)].
- СанПиН 2.1.3684–21 Санитарно-эпидемиологические требования к содержанию территорий городских и сельских поселений, к водным объектам, питьевой воде и питьевому водоснабжению, атмосферному воздуху, почвам, жилым помещениям, эксплуатации производственных, общественных помещений, организации и проведению санитарно-противоэпидемических (профилактических) мероприятий. [SanPiN 2.1.3684–21 Sanitarno-e’pidemiologicheskie trebovaniya k soderzhaniyu territorij gorodskix i sel’skix poselenij, k vodny’m ob’ektam, pit’evoj vode i pit’evomu vodosnabzheniyu, atmosfernomu vozduxu, pochvam, zhily’m pomeshheniyam, e’kspluatacii proizvodstvenny’x, obshhestvenny’x pomeshhenij, organizacii i provedeniyu sanitarno-protivoe’pidemicheskix (profilakticheskix) meropriyatij. (In Russ.)].
- Директива 2010/63/EU Европейского парламента и Совета Европейского союза по охране животных, используемых в научных целях / пер. с англ. Под ред. М.С. Красильщиковой, И.В. Белозерцевой. Санкт-Петербург, 2012. 48 с. [Direktiva 2010/63/EU Yevropeyskogo Parlamenta i Soveta Yevropeyskogo Soyuza po okhrane zhivotnykh, ispol’zuyemykh v nauchnykh tselyakh / transl. from English. Ed. M.S. Krasilshchikova, I.V. Belozertseva. St. Petersburg, 2012. 48 p. (In Russ.)].
Список источников
-
de Aguiar Vallim T.Q., Tarling E.J., Edwards P.A. Pleiotropic roles of bile acids in metabolism // Cell metabolism. 2013. Vol. 17. N. 5. P. 657–669. DOI: 10.1016/j.cmet.2013.03.013.
-
Fiorucci S., Carino A., Baldoni M. et al. Bile acid signaling in inflammatory bowel diseases // Digestive Diseases and Sciences. 2021. Vol. 66. P. 674–693. DOI: 10.1007/s10620-020-06715-3.
-
Angelin B.O., Björkhem I., Einarsson K. et al. Hepatic uptake of bile acids in man: fasting and postprandial concentrations of individual bile acids in portal venous and systemic blood serum // The Journal of clinical investigation. 1982. Vol. 70. N. 4. P. 724–731. DOI: 10.1172/jci110668.
-
Russell D.W. The enzymes, regulation, and genetics of bile acid synthesis // Annual review of biochemistry. 2003. Vol. 72. N. 1. P. 137–174. DOI: 10.1146/annurev.biochem.72.121801.161712.
-
McGlone E.R., Bloom S.R. Bile acids and the metabolic syndrome // Annals of clinical biochemistry. 2019. Vol. 56. N. 3. P. 326–337. DOI: 10.1177/0004563218817798.
-
Rudman D., Kendall F.E. Bile acid content of human serum. I. Serum bile acids in patients with hepatic disease // Journal of clinical investigation. 1957. Vol. 36. N. 4. P. 530–537. DOI: 10.1172/JCI103450.
-
Chávez-Talavera O., Tailleux A., Lefebvre P. et al. Bile acid control of metabolism and inflammation in obesity, type 2 diabetes, dyslipidemia, and nonalcoholic fatty liver disease // Gastroenterology. 2017. Vol. 152. N. 7. P. 1679–1694. DOI: 10.1053/j.gastro.2017.01.055.
-
Губергриц Н.Б. и др. Желчные кислоты и неалкогольная жировая болезнь печени и поджелудочной железы: скованные одной цепью? // Доктор.Ру. 2020. Т. 19. № 7. С. 21–30. [Gubergrits N.B. et al. Bile acids and non-alcoholic fatty liver disease and pancreas disease: going together? // Doktor.Ru. 2020. Vol. 19. N. 7. P. 21–30. (In Russ.)].
-
Yang T., Shu T., Liu G. et al. Quantitative profiling of 19 bile acids in rat plasma, liver, bile and different intestinal section contents to investigate bile acid homeostasis and the application of temporal variation of endogenous bile acids // The Journal of steroid biochemistry and molecular biology. 2017. Vol. 172. P. 69–78. DOI: 10.1016/j.jsbmb.2017.05.015.
-
Shukla B., Visen P.K.S., Patnaik G.K. et al. Choleretic effect of andrographolide in rats and guinea pigs // Planta medica. 1992. Vol. 58. N. 02. P. 146–149. DOI: 10.1055/s-2006-961416.
-
Tripodi V., Contin M., Fernández M.A. et al. Bile acids content in brain of common duct ligated rats // Annals of Hepatology. 2012. Vol. 11. N. 6. P. 930–934.
-
Fu Z.D., Klaassen C.D. Increased bile acids in enterohepatic circulation by short-term calorie restriction in male mice // Toxicology and applied pharmacology. 2013. Vol. 273. N. 3. P. 680–690. DOI: 10.1016/j.taap.2013.10.020.
-
Rodrigues C.M., Kren B.T., Steer C.J. et al. Formation of delta 22-bile acids in rats is not gender specific and occurs in the peroxisome // Journal of lipid research. 1996. Vol. 37. N. 3. P. 540–550.
-
Taylor W., Ellis W.R., Bell G.D. The effect of cholesterol feeding on gallbladder bile acids of the rabbit. Evidence that lithocholic acid is a primary bile acid in the rabbit // Biochemical Journal. 1981. Vol. 198. N. 3. P. 639–643. DOI: 10.1042/bj1980639.
- Shaw H.M., Heath T.J. Regulation of bile formation in rabbits and guinea pigs // Quarterly Journal of Experimental Physiology and Cognate Medical Sciences: Translation and Integration. 1974. Vol. 59. N. 2. P. 93–102. DOI: 10.1113/expphysiol.1974.sp002259.



