Действие 1-метил-4-(4-фторфенил)- 1,2,3,6-тетрагидропиридина на биохимические показатели сыворотки крови и обмен моноаминов в головном мозге мышей
Работа выполнена без спонсорской поддержки.
Клименко Д.И., Краснов К.А., Евтеева Д.А., Островидова Е.В., Матвеева Е.В., Попов А.С., Евдокимова Н.Р., Бычков Е.Р., Карпова И.В. Действие 1-метил-4-(4-фторфенил)- 1,2,3,6-тетрагидропиридина на биохимические показатели сыворотки крови и обмен моноаминов в головном мозге мышей. Лабораторные животные для научных исследований. 2023; 4. https://doi.org/10.57034/2618723X-2023-04-07
Резюме
На самцах белых беспородных мышей, подвергшихся воздействию 1-метил-4-(4-фторфенил)-1,2,3,6-тетрагидропиридина (MPTP-F), исследованы изменения метаболических показателей плазмы крови и моноаминергических процессов. Методом высокоэффективной жидкостной хроматографии (ВЭЖХ) в коре больших полушарий, гиппокампе, обонятельном бугорке и стриатуме правой и левой стороны мозга определяли уровень норадреналина, дофамина, серотонина и их метаболитов — диоксифенилуксусной, гомованилиновой и 5-гидроксииндолуксусной кислот. Введение MPTP-F животным из опытной группы не приводило к значимым изменениям метаболических показателей плазмы крови. Обнаружено повышение концентрации норадреналина и снижение дофамина в стриатуме правого полушария у животных экспериментальной группы. Асимметрии по содержанию моноаминов и их метаболитов в других исследованных структурах мозга выявлено не было. Полученные результаты могут свидетельствовать о перспективности использования MPTP-F для моделирования симптомов ранней стадии болезни Паркинсона.
Введение
Экспериментальные модели паркинсонического синдрома (ПС) являются основой для доклинической оценки разрабатываемых противопаркинсонических препаратов. Одна их наиболее адекватных методик моделирования экстрапирамидных нарушений основана на системном введении селективного нейротоксина 1-метил-4-фенил-1,2,3,6-тетрагидропиридина (MPTP) [1]. MPTP хорошо проникает через гематоэнцефалический барьер и не требует интракраниального введения. Тем не менее МРТР обладает высокой токсичностью, поэтому поиск новых соединений для моделирования ПС остается актуальным.
Ранее было показано, что действие MPTP основано на способности его метаболита 1-метил-4-фенилпиридина (MPP+) избирательно повреждать дофаминергические нейроны черной субстанции [2]. Помимо MPTP, поражение дофаминергических нейронов могут вызывать и другие вещества родственной структуры, например, гербицид паракват [3]. В настоящей работе для моделирования ПС был выбран ранее не исследованный аналог MPTP 1-метил-4-(4-фторфенил)-1,2,3,6-тетрагидропиридин (MPTP-F), обладающий более высокой липофильностью и предположительно меньшей скоростью метаболизма.
Клинические наблюдения свидетельствуют, что дебют ПС происходит чаще всего унилатерально [4]. Мы не нашли работ, посвященных изучению особенностей действия MPTP на правые и левые структуры головного мозга.
Как правило, для оценки нейротоксического эффекта исследователи определяют уровень дофамина и его метаболитов либо только с одной стороны, либо в обоих стриатумах сразу [5, 6].
Цель данной работы — исследование действия фторзамещенного производного MPTP на показатели обмена моноаминов в структурах левой и правой стороны переднего мозга у мышей и метаболические параметры плазмы крови.
Материал и методы
Эксперимент выполнен на половозрелых самцах белых беспородных мышей массой тела 40–46 г (n=12), полученных из питомника «Рапполово» (Ленинградская область). Животных содержали в стандартных условиях в соответствии с ГОСТом 33215–20141 от 01.07.16 и ГОСТом 33216–20142. За 14 дней до начала эксперимента животных случайным образом разделили на две группы по 6 особей. На животных опытной группы (n=6) моделировали ПС, применяя 1-метил-4-(4-фторфенил)-1,2,3,6-тетрагидропиридина гидрохлорид (MPTP-F), предоставленный ЗАО «Интербиоскрин» (Москва). Для проведения эксперимента была выбрана схема введения препарата, описанная для моделирования ПС с использованием 1-метил-4-фенил-1,2,3,6-тетрагидропиридина (MPTP). Для введения выбиралась доза MPTP-F, составившая 35,4 мг/кг, эквимолярная 27 мг/кг препарата MPTP, для которого изначально была разработана методика [7]. MPTP-F предварительно растворяли в физиологическом растворе до концентрации 1,18 мг/мл и на протяжении всего курса введения (7 дней) хранили в темноте при температуре 4–6 °С. Процедура моделирования ПС занимала 7 экспериментальных дней.
Схема введения исследуемого соединения была следующей. В 1-й день эксперимента животным опытной группы внутрибрюшинно трехкратно с интервалом в 1 ч вводили MPTP-F в дозе 35,4 мг/кг и объеме 0,3 мл на 10 г массы животного.
На 3, 5, 6 и 7-й день экспериментальные мыши подвергались однократным внутрибрюшинным инъекциям MPTP-F (35,4 мг/кг).
На протяжении всего эксперимента животным контрольной группы по описанной выше схеме внутрибрюшинно вводили эквивалентный объем физиологического раствора.
На 8-е сутки всех животных декапитировали. После декапитации туловищную кровь собирали в сухие пластиковые пробирки, затем отстаивали 20 мин при комнатной температуре. Пробы центрифугировали при 1500 g и температуре 4 °С в течение 10 мин. В супернатанте (сыворотке крови) определяли следующие биохимические показатели: общее содержание белка, глюкозы, холестерина, мочевины, креатинина, билирубина (общий билирубин) и оценивали активность следующих ферментов: аланинаминотрансферазы (АЛТ), аспартатаминотранферазы (АСТ), щелочной фосфотазы (ЩФ) с помощью биохимического анализатора Au480 (Beckman Coulter, США).
Из правой и левой половин мозга на льду выделяли определенные морфологические структуры: кору больших полушарий, гиппокамп, обонятельный бугорок и стриатум. Ткань мозга гомогенизировали в 0,1 М растворе соляной кислоты механическим гомогенизатором (10 000 об/мин) и центрифугировали в течение 20 мин при 15 000 g и температуре 6 °С. В супернатанте методом обращенно-фазовой высокоэффективной жидкостной хроматографии определяли содержание норадреналина (НА), дофамина (ДА), серотонина (5-ГТ) и их метаболитов: диоксифенилуксусной (ДОФУК), гомованилиновой (ГВК) и 5-гидроксииндолуксусной (5-ГИУК) кислот на хроматографе Shimadzu (Япония) с электрохимическим детектором Decade elite (Нидерланды). Хроматографическая система включала инжектор Rheodyne 7125 (Rheodyne LLC, США) с петлей на 20 мкл для ввода образцов и колонку С18 (5,6 × 250 мм) с сорбентом ODS 5 мкм (Phenomenex, США). Детектирование искомых веществ проводили при потенциале +70 В. Подвижная фаза содержала 5,5 мМ цитратно-фосфатного буфера с 1,38 мМ октансульфоновой кислоты, 0,5 мМ ЭДТА и 6% ацетонитрила (pH 3,0). Скорость элюции подвижной фазы составляла 1 мл/мин. Пробы левой и правой стороны мозга анализировали отдельно.
Результаты обрабатывали с использованием пакета статистических прикладных программ Graph Pad Prism 6.0. Группы сравнивали попарно, используя критерий Вилкоксона для сравнения парных выборок и Манна—Уитни для непарных. Различия считали статистически значимыми при p<0,05.
Результаты и обсуждение
После введения MPTP-F у животных опытной группы визуально наблюдалось ухудшение общего состояния: они были малоподвижны, проявляли признаки сниженного мышечного тонуса; мыши лежали, при этом у них наблюдалось периодическое изменение дыхательного ритма. Описанный токсический эффект продолжался около 40–50 мин, и через 1 ч после выполнения очередной инъекции животные снова выглядели нормально. В 1-й день эксперимента, через 5 мин после 3-й инъекции, у одного животного из экспериментальной группы возникли судороги, которые продолжались в течение 1 мин; на 7-й минуте из носа начались пенистые выделения с прожилками крови, а на 10-й минуте мышь погибла. На аутопсии было отмечено изменение в легких по типу яркого пестрого легкого. При извлечении легких из грудной клетки зафиксировано пенистое выделение из трахеи с прожилками крови. У остальных подопытных животных, начиная со 2-го дня инъекций MPTP-F и на протяжении всего эксперимента, отмечались шумное дыхание и периодический кашель. У мышей контрольной группы подобных проявлений отмечено не было. Данные изменения свидетельствуют о возможном токсическом действии MPTP-F на бронхолегочную систему.
Результаты исследования биохимических показателей крови представлены в табл. 1. Несмотря на многократные введения экспериментального препарата, у мышей опытной группы биохимические показатели сыворотки крови не отличались от соответствующих значений, измеренных у контрольных животных (p>0,05, см. табл. 1). При выборе MPTP-F в качестве нейротоксиканта мы ожидали, что введение атома фтора в молекулу MPTP позволит повысить селективность и замедлить его биотрансформацию в организме. Известно, что наличие атома галогена, особенно фтора, защищает органическую молекулу от окислительной трансформации в организме [8]. Кроме того, введение фтора часто приводит к повышению сродства препарата к нервной ткани, что сопровождается усилением нейротропных эффектов [9]. В связи с этим мы ожидали, что введение атома фтора в молекулу MPTP позволит повысить липофильность и замедлить биотрансформацию в организме, а также, возможно, добиться более селективного нейротоксического эффекта. Ранее при изучении влияния MPTP на показатели сыворотки крови в исследовании А.Л. Павловой [10] было показано, что введение нейротоксина не оказывает влияние на биохимические показатели сыворотки крови у крыс. Данные результаты, возможно, объясняются тем, что MPTP характеризуется высокой скоростью поступления в мозг и избирательным влиянием на дофаминергические системы. Так, S.P. Markey и соавт. [11] выяснили, что соединение обнаруживается в головном мозге уже в течение первой минуты после инъекции нейротоксина. Планируя исследование, мы допускали, что MPTP-F в силу своей относительно низкой скорости биотрансформации может обладать более выраженными общетоксическими свойствами и, как следствие, повлиять на биохимические показатели сыворотки крови. Однако MPTP-F не привел к значимым изменениям данных параметров (см. табл. 1).
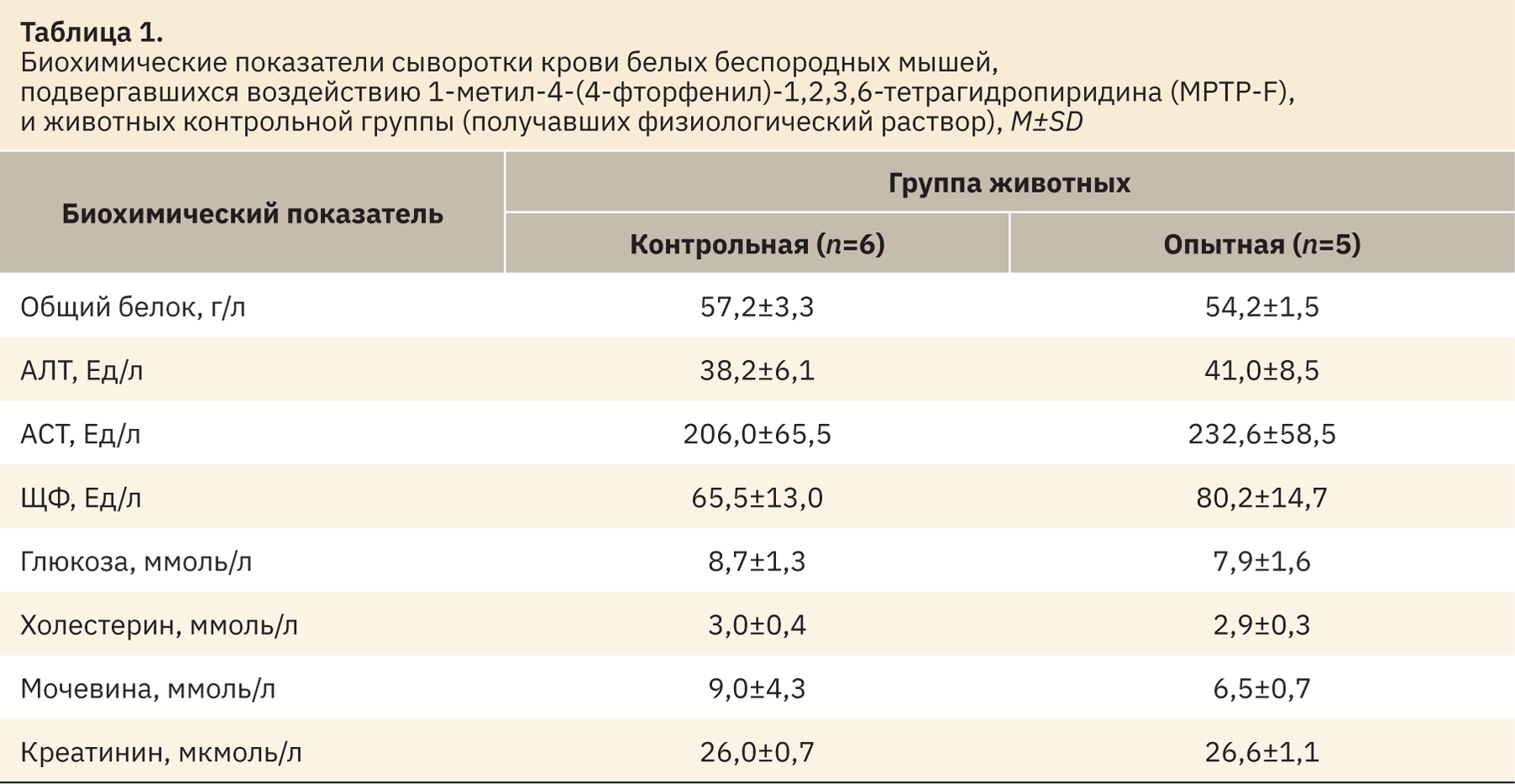
Результаты исследования показателей обмена моноаминов представлены в табл. 2.
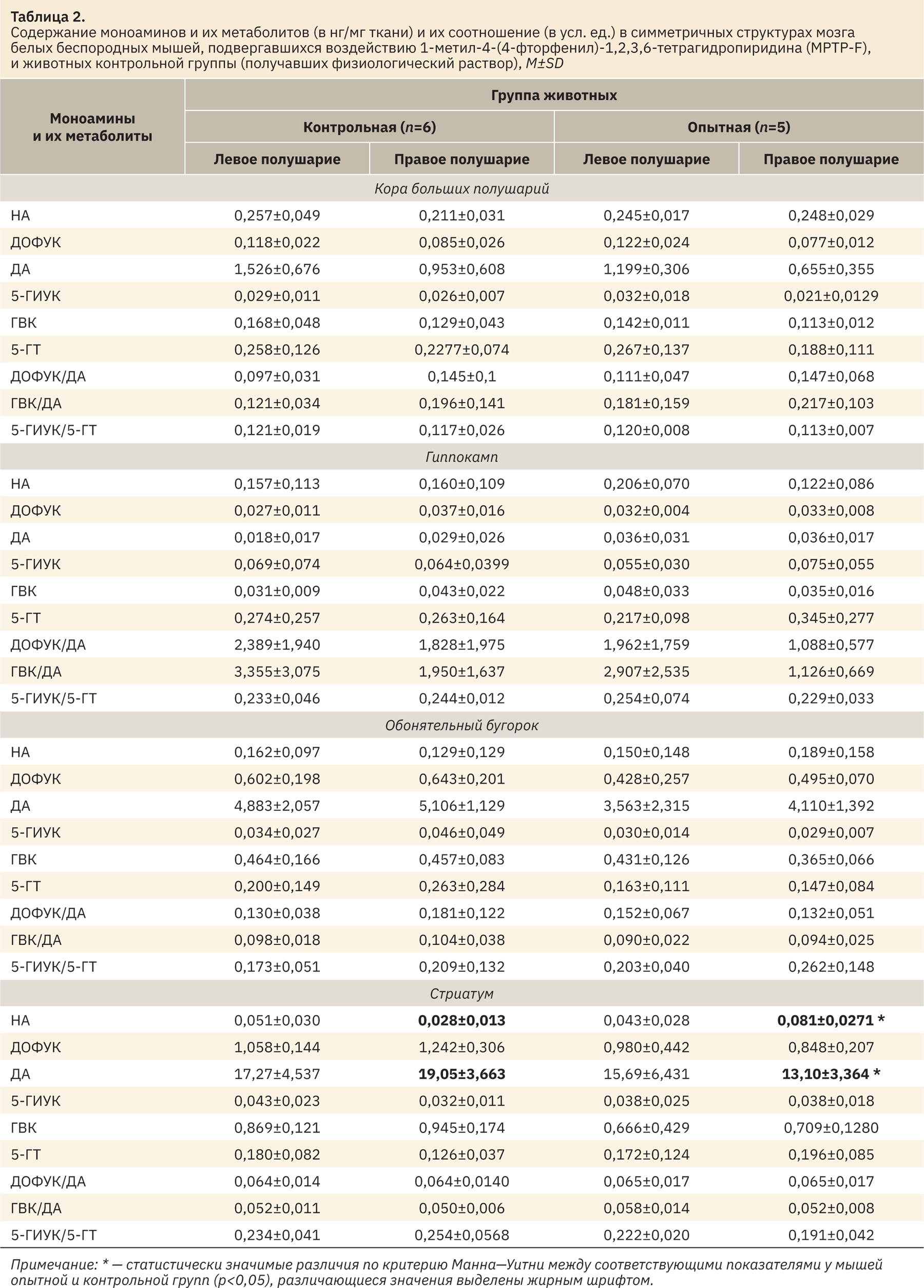
При исследовании действия MPTP-F на показатели обмена моноаминов изменения были обнаружены только в правом стриатуме. Выявлены достоверные изменения содержания норадреналина и дофамина. У животных, получавших MPTP-F, по сравнению с контрольной группой в правом стриатуме было отмечено статистически значимое увеличение уровня норадреналина (p=0,0159, см. табл. 2). Вместе с тем содержание дофамина в данной структуре мозга у животных опытной группы было значимо ниже, чем у контрольных мышей (p=0,0381, см. табл. 2). В левом стриатуме и других структурах мозга значимых различий между контрольной и опытной группой выявлено не было (см. табл. 2).
Известно, что MPTP является липофильным соединением, которое способно проходить через гематоэнцефалический барьер. Селективная цитотоксичность реализуется, когда данное вещество попадает в астроциты головного мозга, где под действием МАО-В подвергается биотрансформации и превращается в активный катионный метаболит MPР+ [2]. Данный катион имеет тропизм к специфическим переносчикам дофамина (DAT) дофаминергических нейронов [12], а также к транспортерам норадреналина и серотонина [13]. Попадая в нейрон через соответствующий переносчик, активный метаболит блокирует первый комплекс дыхательной цепи переноса электронов в митохондриях [14] и таким образом приводит к оксидативному стрессу в дофаминергических нейронах и их гибели [14].
Ранее было показано, что MPTP оказывает угнетающее действие на серотонинергическую систему стриатума, который выражен преимущественно с левой стороны, а также билатерально подавляет норадренергическую систему коры больших полушарий [15]. Эти данные согласуются с результатами G.J. Masilamoni и соавт. [16], которые подтвердили, что хроническое воздействие низких доз MPTP приводит к значительному снижению серотонинергической иннервации моторных, премоторных, префронтальных и лимбических областей коры у взрослых макак-резусов. Полученный результат указывает на то, что введение фтора в молекулу MPTP не оказывает действия на показатели обмена серотонина в исследованных структурах переднего мозга.
Наблюдаемое влияние замещенного MPTP исключительно на правые структуры стриатума можно объяснить тремя механизмами.
Во-первых, известно, что распределение дофаминовых нейронов в головном мозге неодинаково. У человека разница в количестве дофаминергических клеток между симметричными структурами может доходить до 30% [17]. Аналогичные морфологические исследования на лабораторных животных нам не известны. Однако можно предположить, что одним из механизмов первичного поражения правого стриатума является неодинаковое число нервных клеток черной субстанции с левой и правой стороны мозга.
Вторым предполагаемым механизмом, объясняющим наши результаты, являются возможные функциональные нарушения гематоэнцефалического барьера (ГЭБ). Известно, что у человека дебют болезни Паркинсона проявляется односторонне, преимущественно с правой стороны, при этом повреждается дофаминергическая система с левой (контралатеральной) стороны [4]. В свою очередь обнаружено, что на стороне поражения отмечается функциональное нарушение ГЭБ [18].
Третьим фактором, который определяет преимущественно правостороннее поражение дофаминергической системы стриатума, по-видимому, является различная скорость кровотока по правой и левой сонным артериям [19].
Таким образом, совокупность таких факторов, как скорость проникновения нейротоксина через ГЭБ, количественное распределение дофаминовых нейронов между полушариями, разная скорость кровотока по правой и левой сонным артериям и состояние ГЭБ, вносит вклад в развитие экспериментального ПС на лабораторных животных.
Заключение
В ходе проведенного исследования показано унилатеральное (исключительно правостороннее) влияние MPTP-F на дофаминергическую и норадренергическую системы стриатума, что делает данное соединение перспективным для моделирования ранней стадии болезни Паркинсона у мышей. Введение MPTP-F не приводит к значимым изменениям биохимических показателей сыворотки крови.
Сведения о конфликте интересов
Авторы заявляют об отсутствии конфликта интересов.
Вклад авторов
Д.И. Клименко — разработка концепции исследования, планирование эксперимента, создание экспериментальной модели на животных, отбор биоматериала, подготовка проб, статистический анализ экспериментальных даных, написание статьи.
К.А. Краснов — разработка концепции исследования, выбор экспериментального соединения, редактирование и утверждение окончательного варианта статьи для публикации.
Д.А. Евтеева — анализ биохимических показателей сыворотки крови.
Е.В. Островидова — подготовка оборудования для ВЭЖХ.
Е.В. Матвеева — создание экспериментальной модели на животных, отбор биоматериала.
А.С. Попов — критический пересмотр рукописи и утверждение окончательного варианта статьи для публикации.
Н.Р. Евдокимова — работа с экспериментальными животными.
Е.Р. Бычков — существенный вклад в концепцию работы, планирование эксперимента.
И.В. Карпова — отбор и первичная подготовка проб головного мозга, анализ показателей обмена моноаминов методом ВЭЖХ, критический пересмотр рукописи и утверждение окончательного варианта статьи для публикации.
-
ГОСТ 33215–2014 от 01.07.16 «Руководство по содержанию и уходу за лабораторными животными. Правила оборудования помещений и организации процедур». Москва: Стандартинформ, 2019. 11 с. [GOST 33215–2014 ot 01.07.16 “Rukovodstvo po soderzhaniyu i uxodu za laboratorny’mi zhivotny’mi. Pravila oborudovaniya pomeshhenij i organizacii procedur”. Moskva: Standartinform, 2019. 11 p. (In Russ.)] .
- ГОСТ 33216–2014 от 01.07.16 «Руководство по содержанию и уходу за лабораторными животными. Правила содержания и ухода за лабораторными грызунами и кроликами». Москва: Стандартинформ, 2019. 8 с. [GOST 33216–2014 ot 01.07.16 “Rukovodstvo po soderzhaniyu i uxodu za laboratorny’mi zhivotny’mi. Pravila soderzhaniya i uxoda za laboratorny’mi gry’zunami i krolikami”. Moskva: Standartinform, 2019. 8 p. (In Russ.)].
Список источников
-
Хаиндрава В.Г., Козина Е.А., Кучеряну В.Г. и др. Моделирование преклинической и ранней клинической стадий болезни Паркинсона // Журнал неврологии и психиатрии им. С.С. Корсакова. 2010. Т. 110 № 7. С. 4147. [Xaindrava V.G., Kozina E.A., Kucheryanu V.G. et al. Modelirovanie preklinicheskoj i rannej klinicheskoj stadij bolezni Parkinsona // Zhurnal nevrologii i psixiatrii im. S.S. Korsakova. 2010. Vol. 110. N. 7. P. 41–47. (In Russ.)].
-
Przedborski S., Jackson-Lewis V., Naini A.B. et al. The parkinsonian toxin 1-methyl-4-phenyl-1,2,3,6-tetrahydropyridine (MPTP): a technical review of its utility and safety // Journal of Neurochemistry. 2001. Vol. 76. P. 1265–1274. DOI: 10.1046/j.1471-4159.2001.00183.x.
-
Tong T., Duan W., Xu Y. et al. Paraquat exposure induces Parkinsonism by altering lipid profile and evoking neuroinflammation in the midbrain // Environment international. 2022. Vol. 169. P. 107512. DOI: 10.1016/j.envint.2022.107512.
-
Коломан И.И., Чимагомедова А.Ш. Влияние асимметрии моторных симптомов на когнитивные функции при болезни Паркинсона // Журнал неврологии и психиатрии им. С.С. Корсакова. Спецвыпуски. 2020. Т. 120. № 102. С. 7479. [Coloman I.I., Chimagomedova A.Sh. Vliyanie asimmetrii motorny’x simptomov na kognitivny’e funkcii pri bolezni Parkinsona // Zhurnal Nevrologii i Psikhiatrii imeni S.S. Korsakova. Speczvy’puski. 2020. Vol. 120. N. 102. P. 7479. (In Russ.)]. DOI: 10.17116/jnevro202012010274.
-
Сафандеев В.В. Использование нейротоксинов в фундаментальных, медицинских и биологических науках на примере 1-метил-4-фенил-1,2,3,6-тетрагидропиридина (МФТП) // Токсикологический вестник. 2022. Т. 30. № 5. С. 307–314. [Safandeev V.V. Ispol’zovanie nejrotoksinov v fundamental’ny’x, medicinskix i biologicheskix naukax na primere 1-metil-4-fenil-1,2,3,6-tetragidropiridina (MFTP) // Toksikologicheskij vestnik. 2022. Vol. 30. N. 5. P. 307–314. (In Russ.)]. DOI: 10.47470/0869-7922-2022-30-5-307-314.
-
Бережной Д.С., Куликова О.И., Федорова Т.Н., Иноземцев А.Н., Стволинский С.Л. Нейрохимические и поведенческие нарушения в модели ранней стадии паркинсонизма у крыс Вистар при интраназальном введении МФТП // Журнал высшей нервной деятельности им. И.П. Павлова. 2018. Т. 68. № 4. С. 514–523. [Berezhnoy D.S., Kulikova O.I., Fedorova T.N., Inozemtsev A.N., Stvolinsky S.L. Nejroximicheskie i povedencheskie narusheniya v modeli rannej stadii parkinsonizma u kry’s Vistar pri intranazal’nom vvedenii MFTP // Zhurnal vy’sshej nervnoj deyatel’nosti im. I.P. Pavlova. 2018. Vol. 68. N. 4. P. 514–523. (In Russ.)]. DOI: 10.1134/S0044467718040032.
-
Руководство по проведению доклинических исследований лекарственных средств // Научный центр экспертизы средств медицинского применения Минздравсоцразвития России. Том Часть 1. Москва: Гриф и К, 2012. 944 с. [Rukovodstvo po provedeniyu doklinicheskikh issledovanii lekarstvennykh sredstv // Nauchnyi tsentr ehkspertizy sredstv meditsinskogo primeneniya Minzdravsotsrazvitiya Rossii. Moskva: Grif i K, 2012. 944 p. (In Russ.)]. ISBN 978-5-8125-1466-3.
-
Бирюков B.B., Кузнецов А.Е. Градова Н.Б. Научные основы экобиотехнологии (учебное пособие). Москва: Мир, 2006. 504 с. [Biryukov B.B. Kuznetsov A.E., Gradova N.B. Nauchnye osnovy ehkobiotekhnologii (uchebnoe posobie). Moskva: Mir, 2006. 504 p. (In Russ.)].
-
Gillis E.P., Eastman K.J., Hill M.D. et al. Applications of Fluorine in Medicinal Chemistry // Journal of medicinal chemistry. 2015. Vol. 58. N. 21. P. 8315–8359. DOI: 10.1021/acs.jmedchem.5b00258.
-
Павлова А.В. Изучение производных природных монотерпеноидов в качестве основы для создания высокоэффективных противопаркинсонических и анальгетических лекарственных средств: дис. … доктора биологических наук: 3.3.6. Новосибирск, 2021. 276 с. [Pavlova A.V. Izuchenie proizvodnykh prirodnykh monoterpenoidov v kachestve osnovy dlya sozdaniya vysokoehffektivnykh protivoparkinsonicheskikh i anal’geticheskikh lekarstvennykh sredstv: dis. … doktora biologicheskikh nauk: 3.3.6. Novosibirsk, 2021. 276 p. (In Russ.)].
-
Markey S.P., Johannessen J.N., Chiueh C.C. et al. Intraneuronal generation of a pyridinium metabolite may cause drug-induced parkinsonism // Nature. 1984. Vol. 311. P. 464–467.
-
Chaprov K.D., Teterina E.V., Roman A.Y. et al. Comparative Analysis of MPTP Neurotoxicity in Mice with a Constitutive Knockout of the alpha-Synuclein Gene // Mol. Biol. 2021. Vol. 55. N. 1. P. 152–163.
-
Gluck M.R., Krueger M.J., Ramsay R.R. et al. Characterization of the inhibitory mechanism of 1-methyl-4- phenylpyridinium and 4-phenylpyridine analogs in inner membrane preparations // J. Biol. Chem. 1994. Vol. 269. N. 5. P. 3167–3174.
-
Przedborski S., Chen Q., Vila M. et al. Oxidative post-translational modifications of alpha-synuclein in the 1-methyl-4-phenyl-136 1,2,3,6-tetrahydropyridine (MPTP) mouse model of Parkinson’s disease // J. Neurochem. 2001. Vol. 76. N. 2. P. 637–640.
-
Клименко Д.И., Пальчикова С. А., Бычков Е.Р. и др. Недофаминэргические эффекты применения MPTP при моделировании паркинсонического синдрома // Мечниковские чтения-2023: Сборник материалов конференции. 96-я Всероссийская научно-практическая конференция студенческого научного общества с международным участием, Санкт-Петербург, 26–27 апреля 2023 года. Санкт-Петербург: Северо-Западный государственный медицинский университет имени И.И. Мечникова, 2023. С. 669–670. [Klimenko D.I., Pal’chikova S.A., Bychkov E.R. et al. Nedofaminehrgicheskie ehffekty primeneniya MPTP pri modelirovanii parkinsonicheskogo sindroma // Mechnikovskie chteniya-2023: Sbornik materialov konferentsii. 96-ya Vserossiiskaya nauchno-prakticheskaya konferentsiya studencheskogo nauchnogo obshchestva s mezhdunarodnym uchastiem, Sankt-Peterburg, 26–27 aprelya 2023 goda. Sankt-Peterburg: Severo-Zapadnyi gosudarstvennyi meditsinskii universitet imeni I.I. Mechnikova, 2023. P. 669–670. (In Russ.)].
-
Masilamoni GJ., Weinkle A., Papa S.M., Smith Y. Cortical Serotonergic and Catecholaminergic Denervation in MPTP-Treated Parkinsonian Monkeys // Cerebral cortex. 1991. Vol. 32 N. 9 P. 1804–1822. DOI: 10.1093/cercor/bhab313.
-
McRitchie D.A., Halliday G.M., Cartwright H. Quantitative analysis of the variability of substantia nigra pigmented cell clusters in the human // Neuroscience. 1995. Vol. 68. N. 2. P. 539–551. DOI: 10.1016/0306-4522(95)00163-d.
-
Kortekaas R., Leenders K.L., van Oostrom J.C.H. et al. Blood-brain barrier dysfunction in parkinsonian midbrain in vivo // Annals of Neurology. 2005. Vol. 57. N. 2. P. 176–179. DOI: 10.1002/ana.20369.
- Филатова О.В., Сидоренко А.А. Возрастные и половые особенности гемодинамических характеристик артерий головного мозга // Acta Biologiсa Sibirica. 2015. Т. 1 № 3–4. С. 199–243. [Filatova O.V., Sidorenko A.A. Vozrastnye i polovye osobennosti gemodinamicheskikh kharakteristik arterii golovnogo mozga // Acta Biologisa Sibirica. 2015. Vol. 1 N. 3–4. P. 199–243. (In Russ.)]. DOI: 10.14258/abs.v1i3-4.922.




