Референтные интервалы в репродуктивной токсичности крыс Вистар
Работа выполнена без спонсорской поддержки.
Чернышова А.В., Матичин А.А., Кательникова А.Е. Референтные интервалы в репродуктивной токсичности крыс Вистар. Лабораторные животные для научных исследований. 2023; 3. https://doi.org/10.57034/2618723X-2023-03-09
Резюме
Необходимость оценки риска репродуктивной и онтогенетической токсичности лекарственного средства зависит от ряда факторов — свойств препарата, показаний к применению и целевой популяции пациентов. Следует отметить, что данный вид исследования является распространенным. Для повышения надежности интерпретации данных исследования оценка результатов должна включать не только сравнение с контрольными значениями, но и с референтными, полученными в том же испытательном центре. Целью исследования являлось создание референтных интервалов основных показателей, оцениваемых в исследованиях репродуктивной токсичности и онтогенетического развития для крыс Вистар. Для расчета референтных интервалов использовались данные, полученные в ходе исследований в АО «НПО «ДОМ ФАРМАЦИИ» в период с 2015 по 2021 г., для этого были созданы контрольные группы животных. Все манипуляции и эксперименты одобрены биоэтической комиссией. Оценку пренатального развития проводили по следующим показателям: количество живых и мертвых плодов, желтых тел, мест имплантации, а также определяли процент пред- и постимплантационной гибели. В постнатальный период у крысят еженедельно измеряли массу тела, оценивали ряд физиологических показателей и скорость созревания сенсорно-двигательных рефлексов. Для данных был применен непараметрический метод определения референтных интервалов. Наиболее вариабельными показателями являются количество мест имплантации, процент пред- и постимплантационной гибели и время опускания семенников, что необходимо учитывать при анализе полученных данных. Показано, что расчетные значения референтных интервалов в целом сопоставимы с данными литературы.
Введение
Под репродуктивной токсичностью следует понимать возможное токсическое воздействие вещества на половую функцию, способность к размножению, а также патологическое влияние на потомство. Доклинические исследования репродуктивной токсичности основываются на обнаружении любого воздействия одного или нескольких действующих веществ на репродукцию животных1.
Крысы являются одним из наиболее используемых видов тест-систем в исследованиях, в частности в изучении репродуктивной токсичности2. У данного вида животных хорошо изучены репродуктивные процессы, они обладают схожими с человеком анатомическим строением репродуктивных органов, плаценты, а также процессами гормональной регуляции функции воспроизводства потомства. Данные, полученные в ходе экспериментов на крысах, можно экстраполировать на системы человека для последующих исследований и работ.
Для оценки влияния препарата на животных, в том числе на репродуктивную функцию, в экспериментах чаще всего проводят сравнение с контрольной группой и последующую статистическую обработку данных для определения значимости полученных отличий. Иногда исследователи не могут четко определить, является ли изменение какого-либо параметра воздействием препарата или выявленное отличие все же вариант нормы. Кроме того, не во всех исследовательских центрах ведут базу внутрилабораторных норм. В данном случае можно ссылаться на дополнительные источники, которыми могут служить референтные интервалы (РИ).
РИ — статистический показатель, отображающий 95% центральный диапазон референтных значений, ограниченный верхним и нижним референтными пределами. Этот показатель отражает межиндивидуальную биологическую вариацию [1]. Актуальность расчета РИ в репродуктивной токсичности обусловлена недостаточным количеством открытых баз и норм в источниках литературы.
Цель работы — создание референтных интервалов основных показателей, оцениваемых в исследованиях репродуктивной токсичности и онтогенетического развития крыс Вистар.
Материал и методы
Для расчета РИ использовали данные, установленные в ходе исследований в АО «НПО «ДОМ ФАРМАЦИИ». Изучали результаты, полученные от животных, находившихся в контрольных экспериментальных группах в период с 2015 до 2021 г. (все проведенные исследования были одобрены биоэтической комиссией). В сформированном массиве представлены данные от 312 самок крыс линии Вистар (на 165 исследовали эмбриотоксичность, на 147 — постнатальное развитие потомства) и 1800 детенышей.
Животных содержали в одинаковых стандартных условиях вивария: температура воздуха 18–26 °С, относительная влажность 46–65%, 12-часовой световой день. Крысы находились в стандартных пластиковых клетках, самки в период беременности содержались группами не более 5 животных в каждой, в период вскармливания — индивидуально с пометом. Площадь пола на одно животное соответствовала регламентирующим стандартам3. В качестве корма использовали «Корм для содержания лабораторных животных» ПК-120-1, приготовленный по ГОСТу Р50258–92 (Россия). Воду в стандартных поилках со стальными крышками-носиками давали ad libitum.
На 20-й день беременности у половины самок из группы изучали пренатальное развитие потомства (оценка эмбриотоксичности). Основными показателями при данной оценке являются количество живых плодов, желтых тел, мест имплантации, процент пред- и постимплантационной гибели (ИПредГ и ИПостГ соответственно). Данные показатели оценивали визуально, расчетные параметры вычисляли согласно формулам:
ИПредГ=[(КЖТ–КМИ)/КЖТ]×100%, (1)
ИПостГ=[(КМИ–КЖП)/КМИ]×100%, (2)
где КЖТ — количество желтых тел, КМИ — количество мест имплантации, КЖП — количество живых плодов.
Вторую половину беременных самок оставляли для оценки развития плодов в постнатальном периоде. У крысят после рождения измеряли массу тела на 1, 4, 7 и 14-й дни после рождения [для данных манипуляций использовали электронные весы «Adventurer» модель RV214 (OHAUS, Китай), максимальный предел взвешивания — 210 г, минимальный предел взвешивания — 0,01 г, цена поверочного деления — 0,001 г, класс точности — 1], оценивали ряд физиологических показателей и скорость созревания сенсорно-двигательных рефлексов.
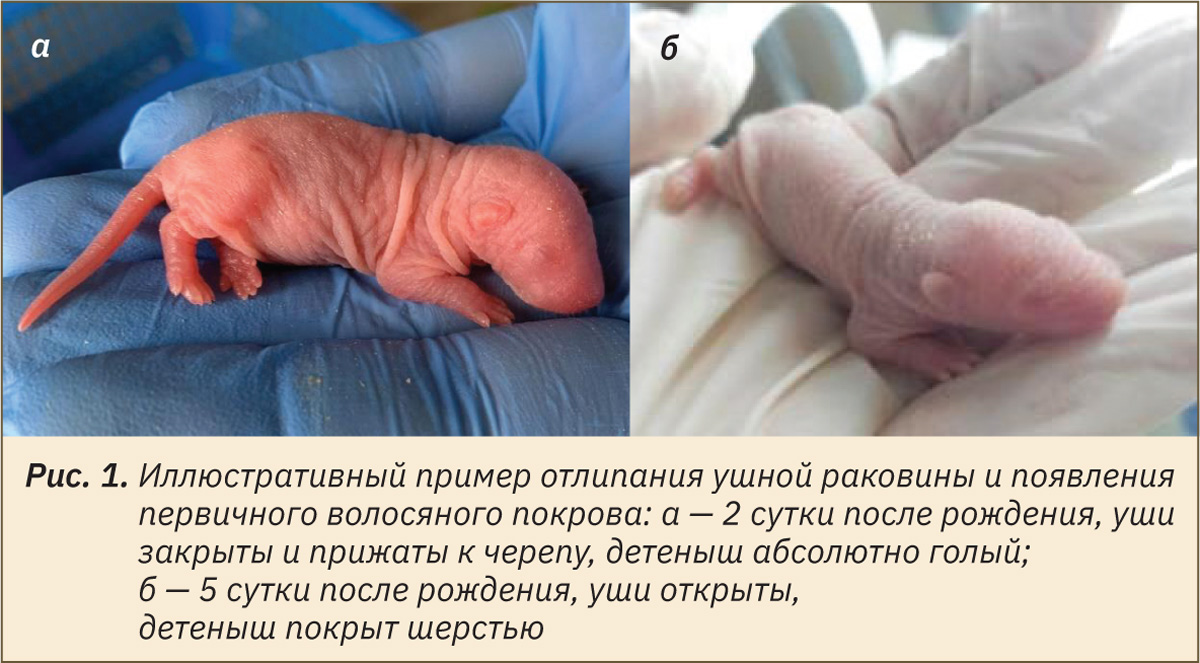
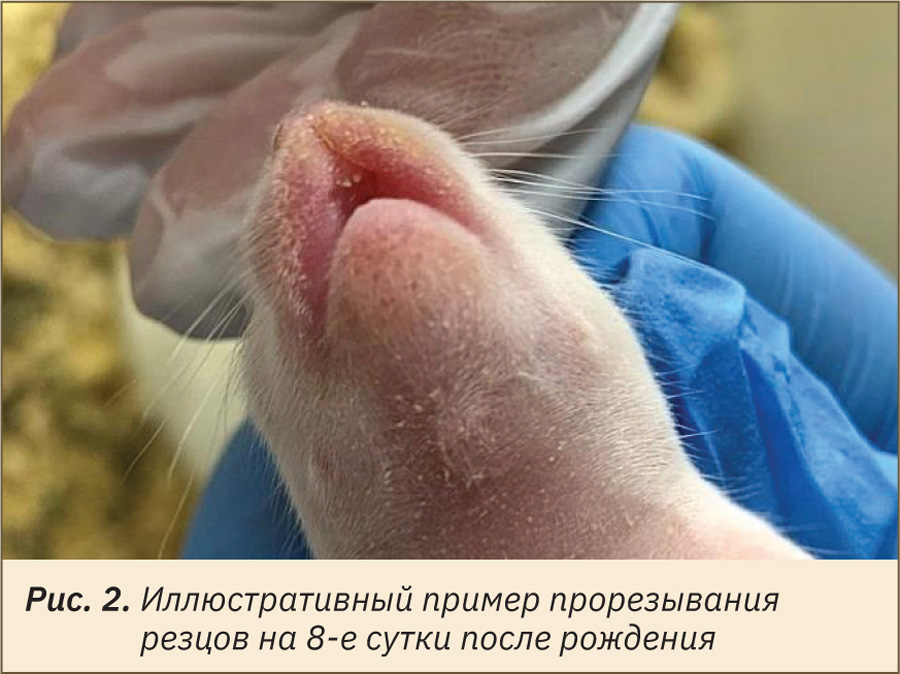
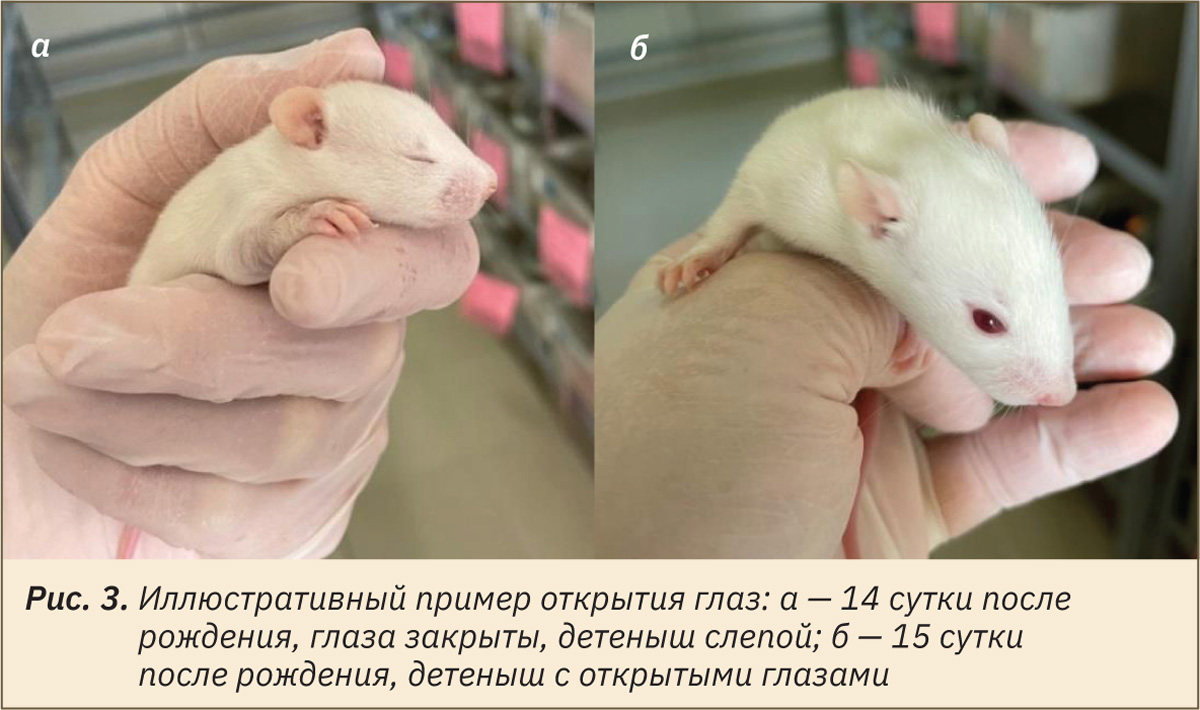
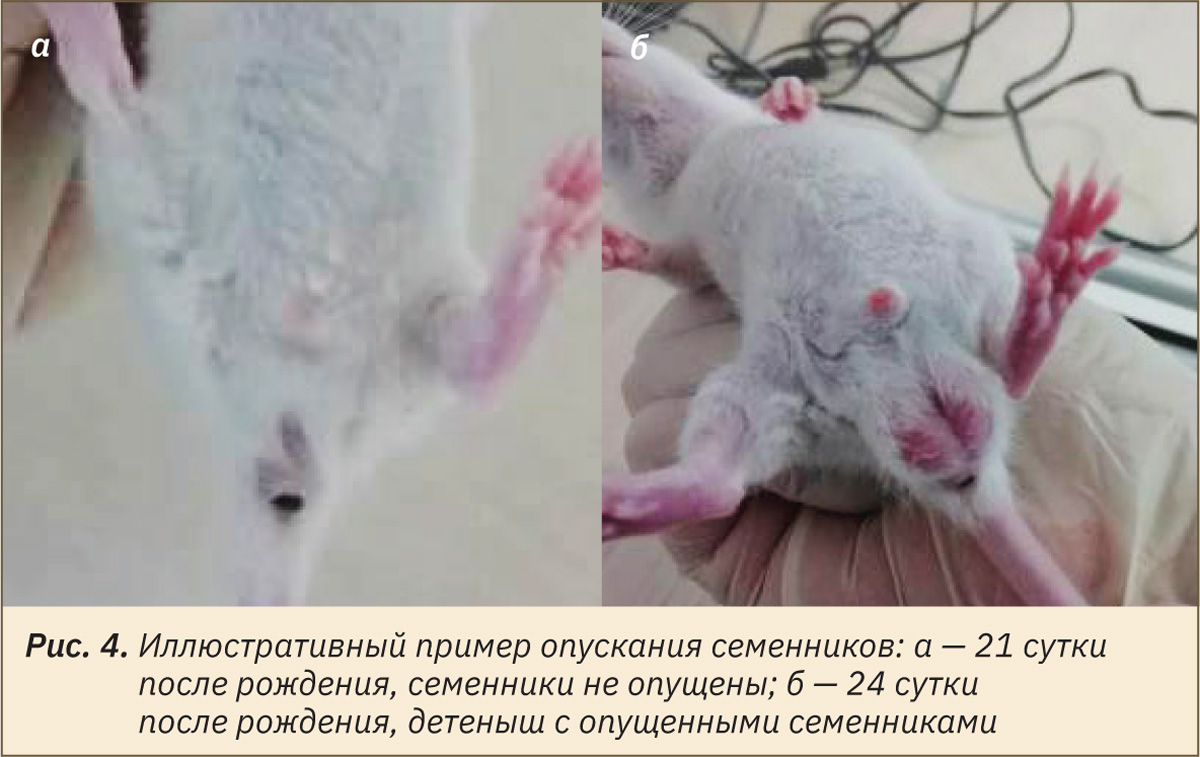
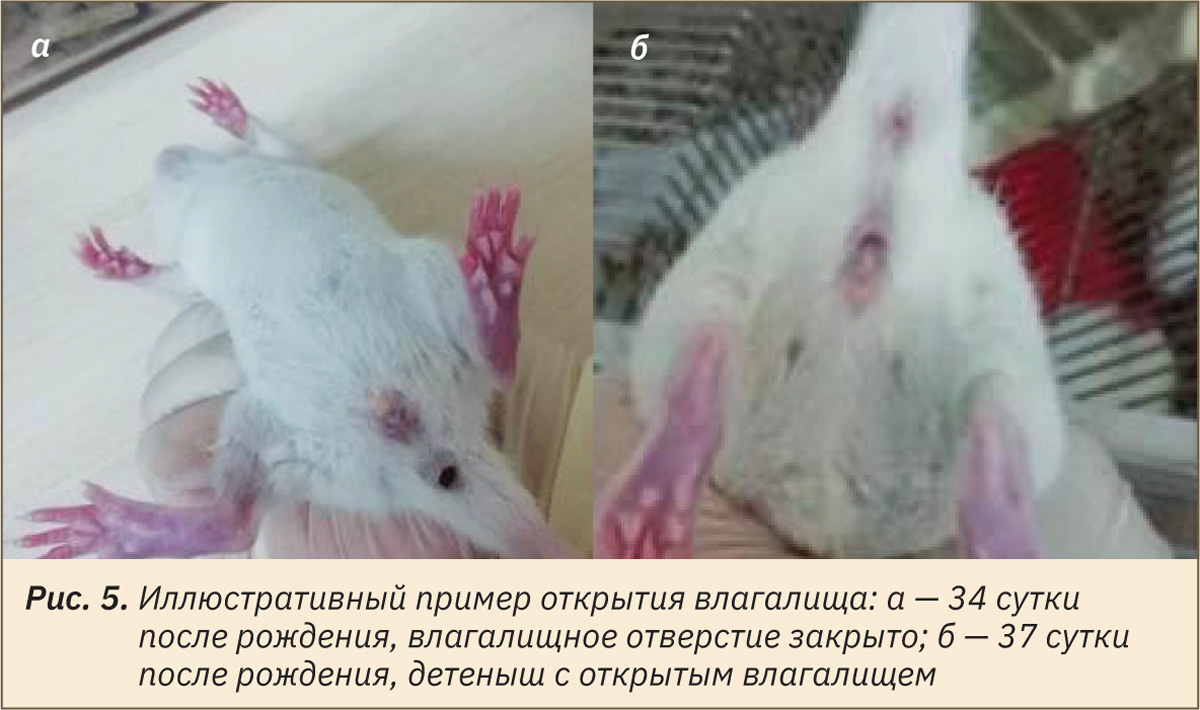
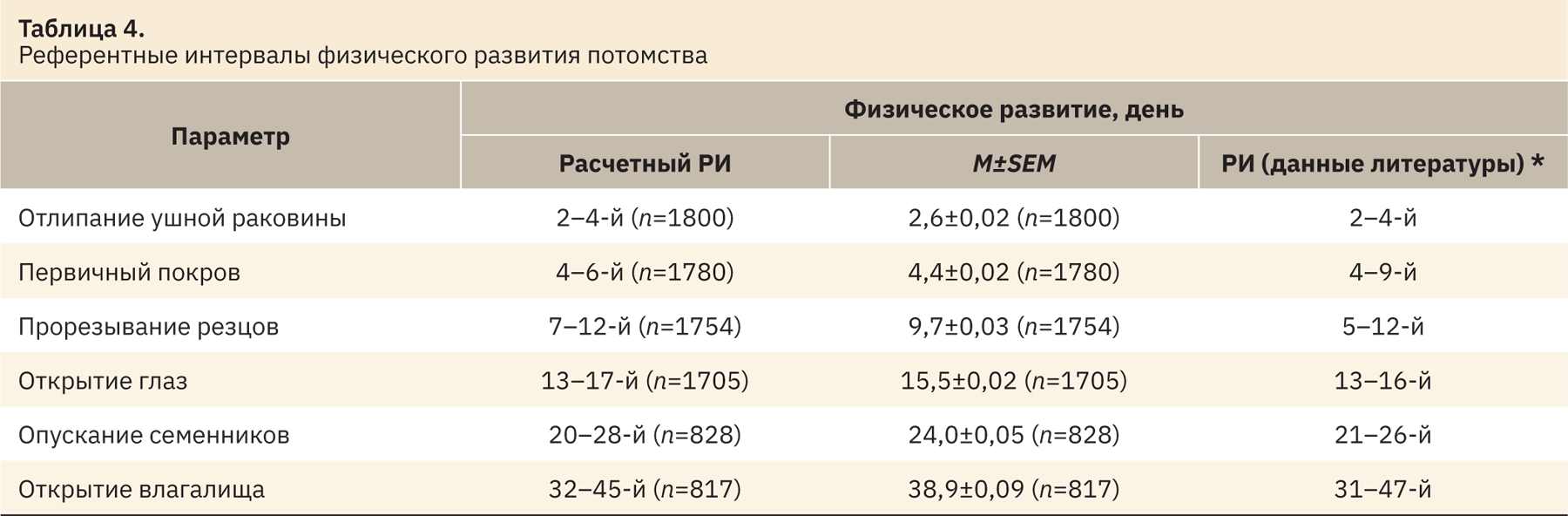
Оценку физического состояния потомства начинали в пределах 24 ч после рождения. Визуально определяли и отмечали день проявления следующих признаков: отлипание ушной раковины (рис. 1), появление первичного волосяного покрова (см. рис. 1), прорезывание резцов (рис. 2), открытие глаз (рис. 3), опускание семенников у самцов или открытие влагалища у самок (рис. 4 и 5).
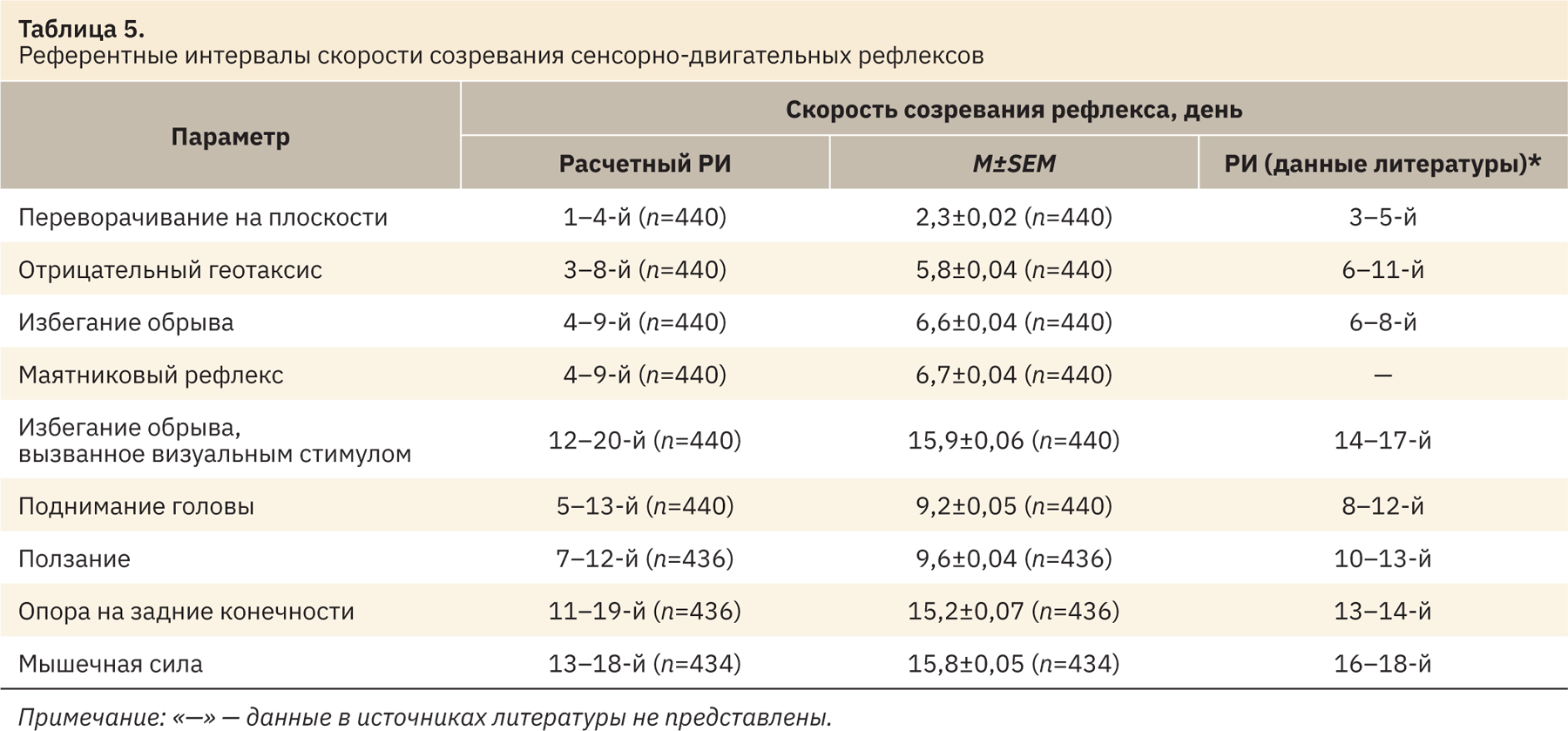
Со 2-го дня после рождения оценивали скорость созревания сенсорно-двигательных рефлексов у потомства в период грудного вскармливания. Скорость созревания рефлексов регистрировали у части помета, для чего случайным образом отбирали 20 детенышей из каждой группы, примерно равное число самцов и самок (пол определяли по аногенитальному расстоянию), и проводили опыты согласно следующим методикам4.
«Переворачивание на плоскости». Детеныша клали на спину на стол, быстро отпускали и фиксировали число детенышей, вернувшихся в нормальное положение на все 4 лапы. Продолжительность опыта составляла не более 30 с на каждое отдельное животное. Опыт проводили со 2-го дня после рождения.
«Отрицательный геотаксис». Детеныша помещали на плоскость, угол наклона которой составлял 25° относительно горизонта, головой вниз. Фиксировали число детенышей, которые в течение 60 с разворачивались на 180° относительно начального положения. Опыт проводили с 5-го дня после рождения.
«Избегание обрыва». Детеныша клали передними лапами к краю стола. Фиксировали число детенышей, отползших от края не более чем за 10 с. Опыт проводили с 6-го дня после рождения.
«Маятниковый рефлекс». Крысят клали на стол, фиксировали задние конечности (при проведении опыта они должны быть поджаты и неподвижны), фиксировали число детенышей, поворачивающих голову и туловище в горизонтальной плоскости приблизительно на 90° за счет перемещения передних лап. Опыт проводили в течение 60 с на каждое отдельное животное на 6–8-й день после рождения.
«Ползание». Детеныша помещали на стол, фиксировали число детенышей, которые поднимались на 4 лапы и перемещались по поверхности стола. Опыт проводили с 9-го дня после рождения.
«Опора на задние конечности». Крысят клали на стол, визуально регистрировали количество животных, которые осуществляли подъем всего тела на задние лапы. Опыт проводили с 13-го дня после рождения.
«Избегание обрыва, вызванное визуальным стимулом». Детеныша помещали передними лапами к краю стола. Избегание падения принимали за положительное решение. Опыт проводили после открытия глаз (примерно с 14–15-го дня после рождения).
«Мышечная сила». Детеныша помещали на густую москитную сетку, жестко натянутую на металлическую решетку. Сетку медленно поворачивали на 180° и регистрировали число детенышей, которые удерживались под сеткой в течение 15 с и более. Опыт проводили с 15-го дня.
«Переворачивание в свободном падении». Детеныша брали и отпускали спиной вниз над мягкой поверхностью (поролоновая подушка) с высоты около 60 см. Визуально регистрировали переворот животного в воздухе и падение его на все 4 лапы. Опыт проводили с 17-го дня после рождения.
Все вышеуказанные опыты проводили до формирования рефлекса у 20 детенышей в группе.
Для установления РИ использовали непараметрический метод расчета: он менее строгий относительно нормальности распределения данных, его можно использовать при выборке менее 200 расчетных значений. Для расчета экстремальных выбросов использовался метод Тьюки. Статистическую обработку результатов (расчет среднего значения — M и стандартной ошибки среднего — SEM) осуществляли в программе Statistica 10 (StatSoft, США).
Результаты и обсуждение
Согласно рекомендациям Института клинических и лабораторных стандартов (CLSI), для расчета РИ из массива данных были исключены статистические выбросы, которые определяли отдельно по каждому показателю. Исключали данные, лежащие за пределами полуторного межквартильного интервала (в границах квартилей Q1 и Q3) [2] (табл. 1).
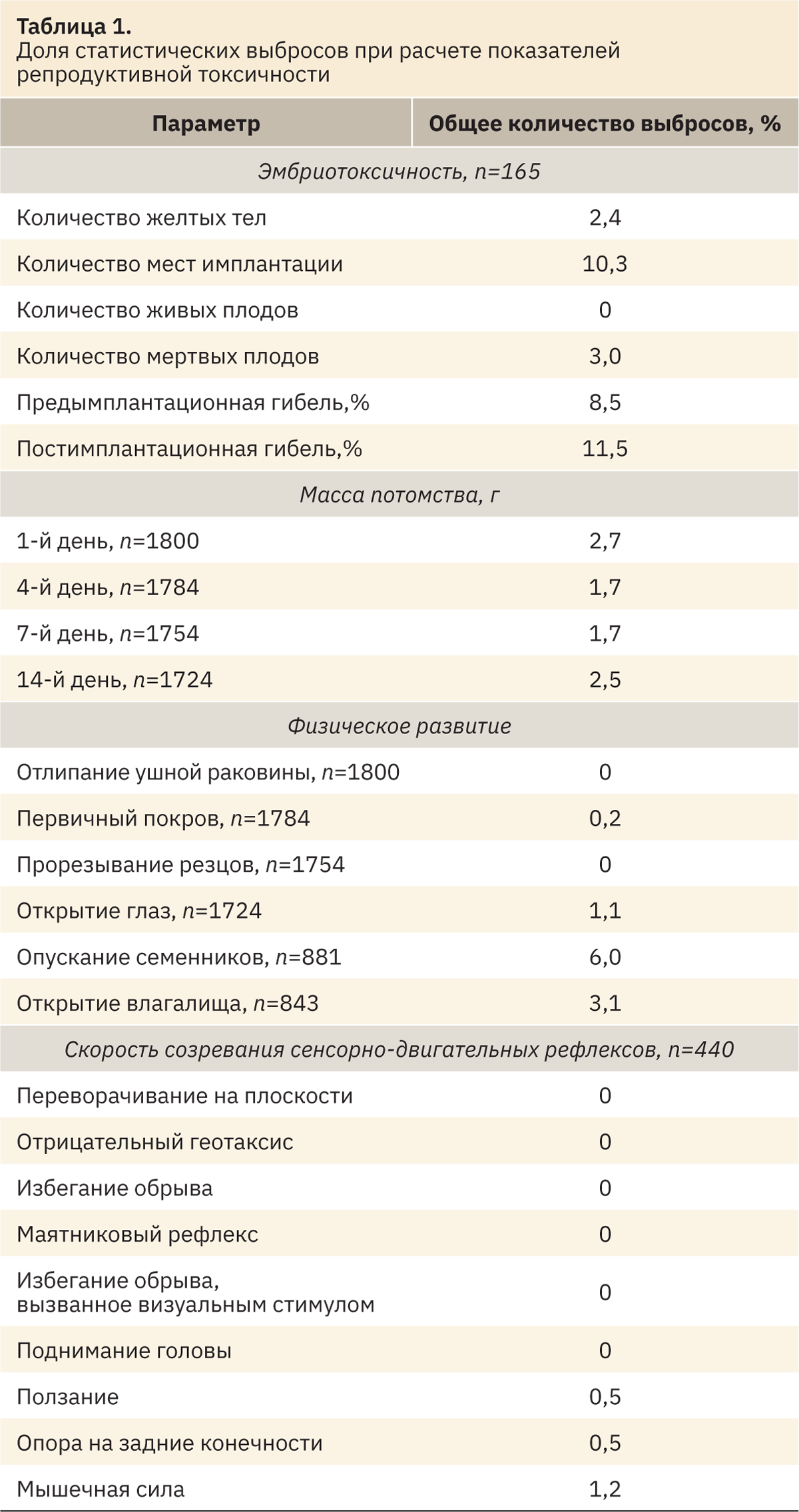
Наиболее вариабельными показателями являются количество мест имплантации, процент пред- и постимплантационной гибели и время опускания семенников (у данных параметров наибольший процент выбросов), что необходимо учитывать при анализе полученных данных.
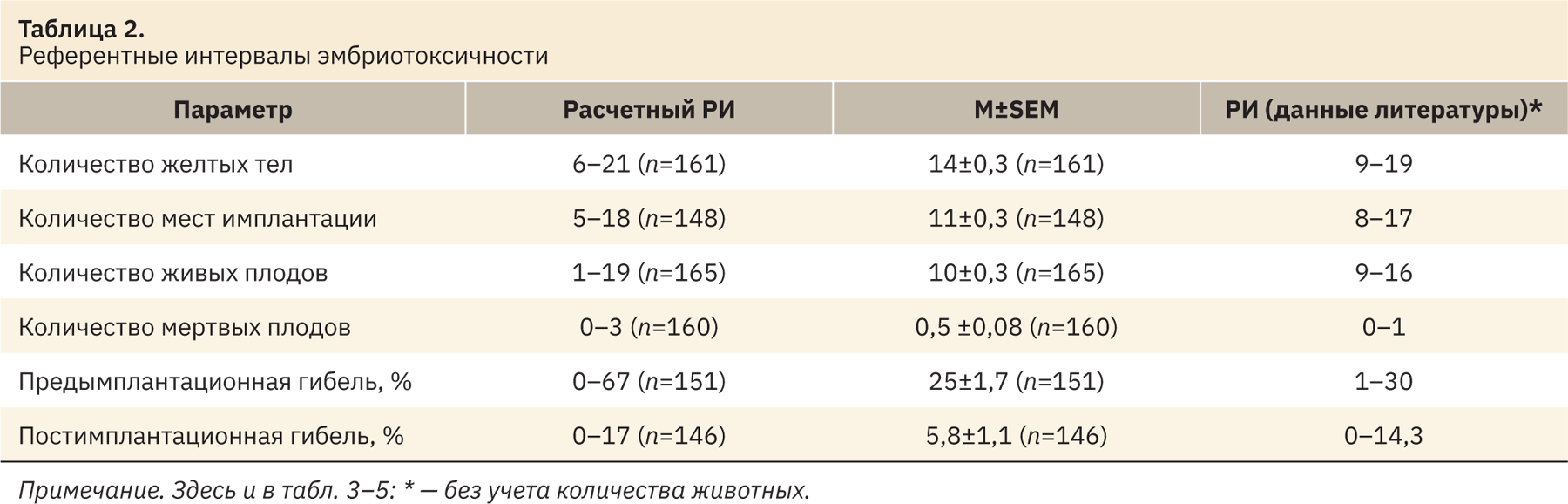
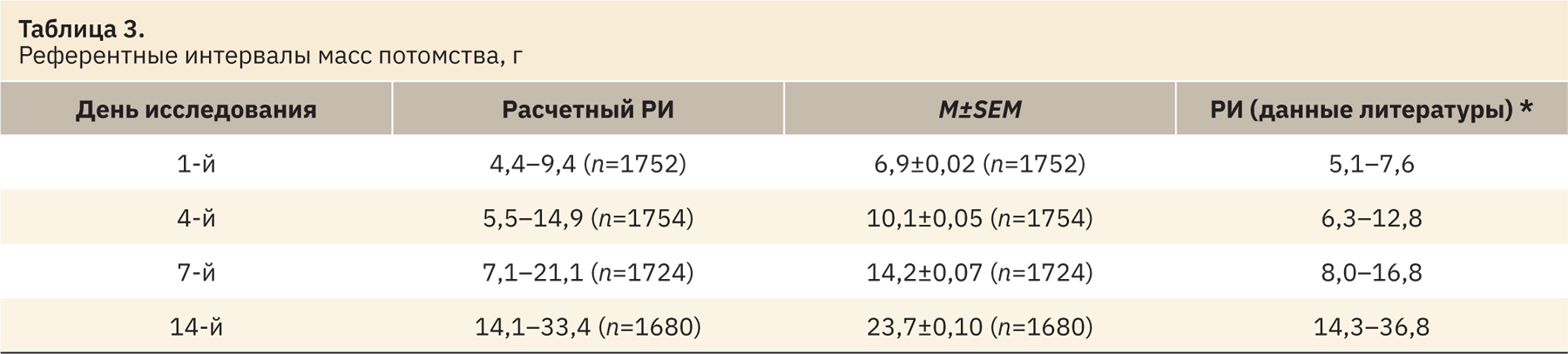
После устранения статистических выбросов из выборки были рассчитаны РИ, полученные данные представлены в табл. 2–5. Результаты находились в промежутке 2,5–97,5‰. Число n в таблицах представлено с учетом выбросов. Все показатели сопоставлены с указанными в источниках литературы [3–39].
Заключение
При интерпретации результатов доклинических исследований важно учитывать данные контрольной группы, которые, как правило, имеют большую значимость, дополнительно целесообразно сопоставлять их с референтными интервалами, установленными в конкретном испытательном центре.
В ходе исследования для крыс Вистар определены референтные интервалы основных показателей, оцениваемых в исследованиях репродуктивной токсичности и онтогенетического развития. Показано, что полученные результаты в целом сопоставимы с данными в источниках литературы.
Сведения о конфликте интересов
Авторы заявляют об отсутствии конфликта интересов.
Вклад авторов
А.В. Чернышова — анализ научной и методической литературы, сбор и систематизация материала, статистическая обработка данных,
написание и редактирование текста статьи.
А.А. Матичин — анализ научной и методической литературы, сбор и систематизация материала.
А.Е. Кательникова — идея исследования, научное консультирование, редактирование текста рукописи.
-
Миронов А.Н. Руководство по проведению доклинических исследований лекарственных средств. Часть первая. Москва: Гриф и К, 2012. 944 с. [Mironov A.N. Rukovodstvo po provedeniyu doklinicheskikh issledovanii lekarstvennykh sredstv. Chast’ pervaya. Moskva: Grif i K, 2012. 944 p. (In Russ.)].
-
ICH S5 (R3) Guideline on detection of reproductive and developmental toxicity for human pharmaceuticals // Scientific guideline. EMA, 2020.
- Директива 2010/63/EU Европейского парламента и Совета Европейского союза по охране животных, используемых в научных целях / пер. с англ. Под ред. М.С. Красильщиковой, И.В. Белозерцевой. Санкт-Петербург, 2012. 48 с. [Direktiva 2010/63/EU Evropeiskogo Parlamenta i Soveta Evropeiskogo Soyuza po okhrane zhivotnykh, ispol’zuemykh v nauchnykh tselyakh / per. s angl. Pod red. M.S. Krasil’shchikovoi, I.V. Belozertsevoi. Sankt-Peterburg, 2012. 48 p. (In Russ.)].
- Там же.
Список источников
-
Евгина С.А., Савельев Л.И. Современные теория и практика референтных интервалов // Лабораторная служба. 2019. Т. 8. № 2. С. 36–44. [Evgina S.A., Savel’ev L.I. Sovremennye teoriya i praktika referentnykh intervalov // Laboratornaya sluzhba. 2019. Vol. 8. N. 2. P. 36–44. (In Russ.)]. DOI: 10.17116/labs2019802136.
-
Луговик И.А., Макарова М.Н. Токсикологические исследования. Референтные интервалы массовых коэффициентов внутренних органов на выборке в 1000 аутбредных крыс // Лабораторные животные для научных исследований. 2021. № 1. C. 3–11. [Lugovic I.A., Makarova M.N. Toksicologicheskie issledovaniya. Referentnye intervaly massovykh koefficientov vnutrennykh organov na vyborke v 1000 autbrednykh krys // Laboratory animals for scientific research. 2021. N. 1. P. 3–11. (In Russ.)]. DOI: 10.29296/2618723X-2021-01-01.
-
Abd-Allah E.R., Abd El Rahman H.A. Influence of doxycycline administration on rat embryonic development during organogenesis // J. Biochem. Mol. Toxicol. 2020. Vol. 35. N. 1. DOI: 10.1002/jbt.22613.
-
Baldrick P., Hewings S., Skinner M. Reproduction and juvenile animal toxicology studies in the rat with a new allergy vaccine adjuvanted with monophosphoryl lipid A (MPL®) for the treatment of grass pollen allergy // Reproductive Toxicology. 2011. Vol. 32. N. 3. P. 322–328. DOI: 10.1016/j.reprotox.2011.06.120.
-
Borella A., Bindra M., Whitaker-Azmitia P.M. Role of the 5-HT1A receptor in development of the neonatal rat brain: preliminary behavioral studies // Neuropharmacology. 1997. Vol. 36. N. 4–5. P. 445–450. DOI: 10.1016/s0028-3908(97)00056-7.
-
Campion S.N., Han B., Cappon G.D. et al. Decreased maternal and fetal cholesterol following maternal bococizumab (anti-PCSK9 monoclonal antibody) administration does not affect rat embryo-fetal development // Regulatory Toxicology and Pharmacology. 2015 Vol. 73. N. 2. P. 562–570. DOI: 10.1016/j.yrtph.2015.08.007.
-
Catlin N., Waidyanatha S., Mylchreest E. et al. Embryo-fetal development studies with the dietary supplement vinpocetine in the rat and rabbit // Birth Defects Research. 2018. Vol. 110. N. 10. P. 883–896. DOI: 10.1002/bdr2.1207.
-
Chung M.K., Han S.S., Kim J.C. Evaluation of the toxic potentials of a new camptothecin anticancer agent CKD-602 on fertility and early embryonic development in rats // Regulatory Toxicology and Pharmacology. 2006. Vol. 45. N. 3. P. 273–281. DOI: 10.1016/j.yrtph.2006.05.004.
-
Costlow R.D., Nasshan H., Frenkel P. et al. Simulated gastric hydrolysis and developmental toxicity of dibutyltin bis (2-ethylhexyl thioglycolate) in rats // Journal of Applied Toxicology. 2021. Vol. 41. N. 11. P. 1794–1802. DOI: 10.1002/jat.4162.
-
Delannois F., Planty C., Giordano G. et al. Signal management in pharmacovigilance and human risk assessment of CpG 7909, integrating embryo-fetal and post-natal developmental toxicity studies in rats and rabbits // Reproductive Toxicology. 2018. Vol. 75. P. 110–120. DOI: 10.1016/j.reprotox.2017.09.006.
-
Domingo J.L., Paternain J.L., Llobet J.M. et al. The effects of aluminium ingestion on reproduction and postnatal survival in rats // Life Sciences. 1987. Vol. 41. N. 9. P. 1127–1131. DOI: 10.1016/0024-3205(87)90631-x.
-
Jhou B.Y., Liu H.H., Yeh S.H. et al. Oral reproductive and developmental toxicity of Lignosus rhinocerotis mycelium in rat // Journal of Ethnopharmacology. 2017. Vol. 208. P. 66–71. DOI: 10.1016/j.jep.2017.06.029.
-
Harazono A, Ema M, Ogawa Y. Pre-implantation embryonic loss induced by tributyltin chloride in rats // Toxicology Letters. 1996. Vol. 89. N. 3. P. 185–190. DOI: 10.1016/s0378-4274(96)03805-2.
-
Hilbish K.G., Breslin W.J., Johnson J.T. et al. Fertility and developmental toxicity assessment in rats and rabbits with LY500307, a selective estrogen receptor beta (ERβ) agonist // Developmental and Reproductive Toxicology. 2013. Vol. 98. N. 5. P. 400–415. DOI: 10.1002/bdrb.21083.
-
Kim JC., Kim SH., Shin DH. et al. Effects of prenatal exposure to the environmental pollutant 2-bromopropane on embryo-fetal development in rats // Toxicology. 2004. Vol. 196. P. 77–86. DOI: 10.1016/j.tox.2003.11.006.
-
Kim S.H., Lee I.C., Lim JH. et al. Effects of melamine on pregnant dams and embryo-fetal development in rats // Journal of Applied Toxicology. 2011. Vol. 6. P. 506–514. DOI: 10.1002/jat.1703.
-
Koëter H.B.W.M., Bär A. Embryotoxicity and Teratogenicity Studies with Lactitol in Rats // Journal of the American College of Toxicology. 1992. Vol. 11. N. 2. P. 249–257. DOI: 10.3109/10915819209141502.
-
Kurosaki T., Maeno M., Mennear J.H. et al. Studies of the toxicological potential of tripeptides (L-valyl-L-prolyl-L-proline and L-isoleucyl-L-prolyl-L-proline): VI. Effects of Lactobacillus helveticus-fermented milk powder on fertility and reproductive performance of rats // International Journal of Toxicology. 2005. Vol. 24. N. 4. P. 61–89. DOI: 10.1080/10915810500259630.
-
Matsumoto M, Takano M., Takabe M. et al. Initial hazard assessment of ethyl(dimethyl)(tetradecyl)ammonium ethyl sulfate: Genotoxicity tests and combined repeated-dose and reproductive/developmental toxicity screening in rats // Regulatory Toxicology and Pharmacology. 2021. Vol. 122. DOI: 10.1016/j.yrtph.2021.104914.
-
Melo P., Rodrigues LG., Silva M.C. et al. Effects of prenatal exposure to methamphetamine on the development of the rat retina // Annals of the New York Academy of Sciences. 2006. Vol. 1074. P. 590–603. DOI: 10.1196/annals.1369.058.
-
Mylchreest E., Malley LA. O’Neill AJ. et al. Reproductive and developmental toxicity of inhaled 2,3-dichloro-1,3-butadiene in rats // Reproductive Toxicology. 2006. Vol. 22. N. 4. P. 613–622. DOI: 10.1016/j.reprotox.2006.04.002.
-
Mylchreest E., Smiley M.A., Ballin J.D. et al. Developmental and reproductive safety evaluation of AV7909 anthrax vaccine candidate in rats // Birth Defects Research. 2021. Vol. 113. N. 1. P. 1–11. DOI: 10.1002/bdr2.1815.
-
O’Connor J.C., Munley S.M., Serex T.L. et al. Evaluation of the reproductive and developmental toxicity of 6:2 fluorotelomer alcohol in rats // Toxicology. 2014. Vol. 317. P. 6–16. DOI: 10.1016/j.tox. 2014.01.002.
-
Schmuck G., Klaus A.M., Langewische F.W. Developmental and reproductive toxicity studies on artemisone // Developmental and Reproductive Toxicology. 2009. Vol. 86. N. 2. P. 131–143. DOI: 10.1002/bdrb.20192.
-
Siddiqui W.H., Stump D.G., Plotzke K.P. et al. A two-generation reproductive toxicity study of octamethylcyclotetrasiloxane (D4) in rats exposed by whole-body vapor inhalation // Reproductive Toxicology. 2007. Vol. 23. N. 2. P. 202–215. DOI: 10.1016/j.reprotox.2006.11.011.
-
Terry K.K., Cappon G.D., Hurt M.E. et al. Reproductive toxicity assessment of lasofoxifene, a selective estrogen receptor modulator (SERM), in female rats // Developmental and Reproductive Toxicology. 2004. Vol. 71. N. 3. P. 150–160. DOI: 10.1002/bdrb.20009.
-
Tsubokura Y., Hasegawa R., Aso S. et al. Combined repeated-dose and reproductive/developmental toxicity screening test of 1-tert-butoxy-4-chlorobenzene in rats // Drug and Chemical Toxicology. 2017. Vol. 40. N. 3. P. 344–358. DOI: 10.1080/01480545.2016.1236265.
-
Yu W.J., Son J.M., Lee J. et al. Effects of silver nanoparticles on pregnant dams and embryo-fetal development in rats // Nanotoxicology. 2014. Vol. 8. N. 1. P. 85–91. DOI: 10.3109/17435390.2013.857734.
-
Zhang Q., Ye X., Wang L. et al. Embryo-fetal development toxicity of honokiol microemulsion intravenously administered to pregnant rats // Regulatory Toxicology and Pharmacology. 2016. Vol. 74. P. 117–122. DOI: 10.1016/j.yrtph.2015.11.012.
-
Chahoud I., Paumgartten F.J. Influence of litter size on the postnatal growth of rat pups: is there a rationale for litter-size standardization in toxicity studies? // Environmental Research. 2009. Vol. 109. N. 8. P. 1021–1027. DOI: 10.1016/j.envres.2009.07.015.
-
Белякова Н.А. Репродуктивная токсичность морфина // Российский биомедицинский журнал Medline.ru. 2017. Т. 18. № 27. С. 395–408. [Belyakova N.A. Reproduktivnaya toksichnost’ morfina // Rossiiskii biomeditsinskii zhurnal Medline.ru. 2017. Vol. 18. N. 27. P. 395–408. (In Russ.)].
-
Heuland E., Germaux MA., Galineau L. et al. Prenatal MDMA exposure delays postnatal development in the rat: a preliminary study // Neurotoxicology and Teratology. 2010. Vol. 32. N. 4. P. 425–431. DOI: 10.1016/j.ntt.2010.03.006.
-
Hrubá L., Schutová B., Slamberová R. et al. Effect of methamphetamine exposure and cross-fostering on sensorimotor development of male and female rat pups // Developmental Psychobiology. 2009. Vol. 51. N. 1. P. 73–83. DOI: 10.1002/dev.20346.
-
Ozyurek H., Bozkurt A., Bilge S. et al. Effect of prenatal levetiracetam exposure on motor and cognitive functions of rat offspring // Brain and Development. 2010. Vol. 32. N. 5. P. 396–403. DOI: 10.1016/j.braindev.2009.05.003.
-
Zhou L., Zhou J., Jiang J. et al. Reproductive toxicity of ZishenYutai pill in rats: Perinatal and postnatal development study // Regulatory Toxicology and Pharmacology. 2016. Vol. 81. P. 120–127. DOI: 10.1016/j.yrtph.2016.07.015.
-
Altman J., Sudarshan K. Postnatal development of locomotion in the laboratory rat // Animal Behavioral. 1975. Vol. 23. N. 4. P. 896–920. DOI: 10.1016/0003-3472(75)90114-1.
-
Белякова Н.А. Влияние пептидных препаратов на сенсорно-двигательное развитие потомства самок неинбредных крыс // Российский биомедицинский журнал Medline.ru. 2020. Т. 21. № 9. С. 100–106. [Belyakova N.A. Vliyanie peptidnykh preparatov na sensorno-dvigatel’noe razvitie potomstva samok neinbrednykh krys // Rossiiskii biomeditsinskii zhurnal Medline.ru. 2020. Vol. 21. N. 9. P. 100–106. (In Russ.)].
-
Бугаева Л.И., Денисова Т. Д. и др. Постнатальное развитие потомства от крыс самок, получавших адепрофен в период беременности // Вестник ВолГМУ. 2021. № 4 (80). С. 144–148. [Bugaeva L.I., Denisova T.D. et al. Postnatal’noe razvitie potomstva ot krys samok, poluchavshikh adeprofen v period beremennosti // Vestnik VolGMU. 2021. N. 4 (80). P. 144–148. (In Russ.)].
- Боровская Т.Г., Вычужанина А.В., Машанова В.А. и др. Экспериментальное исследование влияния иммобилизированных субтилизинов на репродуктивную токсичность. II. Постнатальный период // Сибирский научный медицинский журнал. 2016. Т. 37. № 4. С. 42–46. [Borovskaya T.G., Vychuzhanina A.V., Mashanova V.A. et al. Eksperimental’noe issledovanie vliyaniya immobilizirovannykh subtilizinov na reproduktivnuyu toksichnost’. II. Postnatal’nyi period // Sibirskii nauchnyi meditsinskii zhurnal. 2016. Vol. 37. N. 4. P. 42–46. (In Russ.)].



