Вариабельность биохимических показателей крови и установление референтных интервалов в доклинических исследованиях. Сообщение 8: сирийские хомячки
Работа выполнена без спонсорской поддержки.
Мирошников М.В., Султанова К.Т., Ковалева М.А., Макарова М.Н. Вариабельность биохимических показателей крови и установление референтных интервалов в доклинических исследованиях. Сообщение 8: сирийские хомячки. Лабораторные животные для научных исследований. 2023; 2. https://doi.org/10.57034/2618723X-2023-02-08
Резюме
Биохимические показатели сыворотки крови — важные параметры для оценки здоровья лабораторных животных. Сирийский хомячок является широко используемой тест-системой в экспериментах на животных. Они обладают уникальными анатомическими и физиологическими особенностями, такими как оптимальный размер тела, большой защечный мешок, высокая скорость размножения и короткий жизненный цикл, что в совокупности делает хомячков удобной тест-системой, используемой в доклинических исследованиях. Данный вид животных применяется не только в ходе изучения токсикологических свойств и оценке фармакологической безопасности, но и задействован в различных фармакодинамических исследованиях как модельный организм для изучения широкого спектра патологических состояний, связанных с иммунным ответом, дыхательной системой, канцерогенезом, метаболическими нарушениями. В ходе исследования были установлены референтные интервалы основных биохимических показателей крови сирийских хомячков. Данная процедура необходима для адекватного понимания состояния животных, находящихся в эксперименте, оценки токсичности и безопасности новых фармакологических веществ, контроля формирования модельных патологий и определения эффективности фармакологических агентов. Значения, используемые для формирования референтных интервалов, были получены от интактных животных за временной период июнь–декабрь 2022 г. в АО «НПО «ДОМ ФАРМАЦИИ». В исследование были включены биообразцы 30 самцов и 30 самок сирийских хомячков. Возраст животных соответствовал диапазону 6–8 нед, масса тела самцов и самок была в пределах 100–115 г. Исследование выполнено с соблюдением принципов Европейской конвенции о защите позвоночных животных, используемых для экспериментов и других научных целей, и в соответствии с правилами надлежащей лабораторной практики. Определение интересующих биохимических показателей проводили в одинаковых условиях с использованием общепринятых преаналитических и аналитических методов. Забор крови у животных производили при помощи кардиальной пункции. В сыворотке крови животных регистрировали следующие показатели: уровень креатинина, мочевины, аланинаминотрансферазы, аспартатаминотрансферазы, щелочной фосфатазы, холестерина, триглицеридов, общего белка, альбумина, глобулинов, соотношение альбумин/глобулины, содержание глюкозы, общего билирубина. Полученные референтные диапазоны биохимических показателей в целом были схожи с данными, указанными в литературе. Отличия касались таких показателей, как мочевина, щелочная фосфатаза, аланинаминотрансфераза, аспартатаминотрансфераза и глюкоза, при этом полученные значения были выше таковых в источниках литературы. Для адекватной интерпретации экспериментальных значений важным аспектом в доклинических исследованиях является установление внутрилабораторных референтных интервалов биохимических показателей крови здоровых животных в каждом научном центре. Это связано с преаналитическими и аналитическими особенностями проведения анализа, породы животных и условий их содержания.
Введение
Хомячки используются в доклинических исследованиях уже более полувека [1]. Чаще всего это сирийские или золотистые хомячки (Mesocricetus auratus). Рассматриваемые животные обладают высокой скоростью размножения, простотой в обращении и коротким жизненным циклом [2]. Другой важной особенностью является то, что у данного вида редко возникают спонтанные заболевания, но они чувствительны к широкому спектру экспериментальных патогенов. Размер хомячка в отличие от мышей позволяет лучше изучить и визуализировать системы и органы, например, дыхательную или репродуктивную систему. В целом данный вид обладает исключительной широтой применения в доклинических исследованиях [3, 4].
В ряде исследований показано, что сирийские хомячки представляют собой релевантные тест-системы для изучения вирусных инфекций, поскольку их симптомы заболевания, патогенез и иммунные реакции схожи с таковыми у человека. К числу похожих вирусных заболеваний человека и сирийских хомячков относят вирус Западного Нила, первичные (вирусные) энцефалиты, вирус Нипах, вирус Эбола, вирус Пичинде, вирус Хартленда [1, 5, 6]. Сирийские хомячки также восприимчивы к инфекции SARS-CoV-2, в результате чего у животных развивается интерстициальная пневмония [7, 8].
Сирийских хомячков широко используют для изучения большого количества бактериальных и паразитарных инфекций человека, например, бабебиоза, лептоспироза, лейшманиоза [1, 9–12].
Хомячки также восприимчивы к индукции различных опухолевых процессов, у них развиваются такие типы опухолей, которые у других лабораторных животных формируются реже или их экспериментальное моделирование сложно осуществимо. К числу таковых можно отнести опухоли поджелудочной железы, мелкоклеточную карциному легкого, опухоли верхних дыхательных путей, плоскоклеточный рак полости рта и эстрогензависимые опухоли почек [13].
Сирийские хомячки чувствительны к индукции различных метаболических нарушений. Так, например, они подвержены развитию желчно-каменной болезни, характеризующейся нарушением обмена холестерина, и являются релевантной тест-системой для моделирования атеросклероза [14–16]. В отличие от мышей и крыс, у хомячков липидный профиль более схож с таковым у человека. Низкие значения желчных кислот в норме и синтез холестерина делают хомячков гораздо более чувствительными к холестеринемии. В отличие от мышей и крыс у рассматриваемых животных аполипопротеин (апоВ-100) имеет исключительно печеночное происхождение. У хомячков предсказуемо развивается атеросклероз в ответ на диетические манипуляции и сосудистые изменения, сопровождающие развитие атеросклеротических бляшек, похожих на те, которые формируются у людей.
Диета или некоторые химические агенты, например аллоксан или стрептозотоцин, способны индуцировать развитие диабета у сирийских хомячков. Диабет часто сопровождается дислипидемией — высоким уровнем липопротеинов низкой плотности (ЛПНП), липопротеинов очень низкой плотности и низким уровнем липопротеинов высокой плотности (ЛПВП). Диета с высоким содержанием фруктозы опосредует развитие инсулинорезистентности у сирийских хомячков, а также развитие дислипидемии, которая характеризуется высоким уровнем ЛПНП и хиломикронов при низком уровне ЛПВП. При этом высокожировая диета, содержащая небольшое количество холестерина, вызывает у хомячков диабет 2‑го типа, ожирение, гиперинсулинемию, гиперлипидемию, гиперхолестеринемию и гипертриглицеридемию [17–19].
Сирийских хомячков применяют в качестве тест-системы для моделирования амилоидоза с использованием казеина или подкожных инъекций липополисахарида [20, 21].
В отличие от других широко используемых лабораторных грызунов, у хомячков есть защечный мешок, который делает этих животных оптимальной биологической моделью в ходе доклинической оценки токсичности и местно-раздражающего действия лекарственных средств, предназначенных для местного применения. Данная тест-система позволяет максимально точно воспроизвести картину клинического применения препаратов в лекарственных формах, диспергируемых в ротовой полости, и оптимальна для их доклинического изучения [22].
Ввиду широкого перечня применения сирийских хомячков в качестве тест-системы в доклинических исследованиях существует необходимость проведения мониторинга их здоровья.
Цель настоящей работы — создание референтных интервалов основных биохимических показателей сыворотки крови здоровых лабораторных сирийских хомячков.
Материал и методы
Данные, используемые для формирования референтных интервалов, были получены от интактных животных за временной период июнь–декабрь 2022 г. в АО «НПО «ДОМ ФАРМАЦИИ». Все манипуляции и эксперименты были одобрены биоэтической комиссией. В исследовании задействовано 30 самцов и 30 самок (небеременные и нерожавшие, без учета фазы эстрального цикла) сирийских хомячков. Возраст животных соответствовал диапазону 6–8 нед, масса тела самцов и самок была в пределах 100–115 г. Животных содержали в одинаковых стандартных условиях вивария: температура воздуха 22–26 °С, относительная влажность 40–75%, 12‑часовой световой день. Кормление животных проводили в соответствии с Директивой 2010/63/EU1. Животные получали полнорационный комбикорм ЛБК-120 («Тосненский комбикормовый завод», Россия). Исследование выполнено с соблюдением принципов Европейской конвенции о защите позвоночных животных, используемых для экспериментов и других научных целей (Страсбург, 1986), и в соответствии с правилами надлежащей лабораторной практики. Определение интересующих биохимических показателей проводили в одинаковых условиях с использованием общепринятых преаналитических и аналитических методов. Забор крови у животных производили путем кардиальной пункции. Животные были эвтаназированы с применением диоксида углерода (СО2). Данный вид эвтаназии животных сопровождается минимальной болью, причиняющей страдания и дистресс. Кровь собирали натощак в вакуумные пластиковые пробирки объемом 3,5 мл с активатором свертывания и гелем (ООО «КОРВЕЙ», Россия). Затем для получения сыворотки кровь центрифугировали в течение 15 мин при 3000 оборотов в минуту при помощи центрифуги ОПн-3.04 «Дастан» (Киргизия). Полученную сыворотку переносили в стерильные пробирки, в которых определяли биохимические показатели. В сыворотке крови животных на автоматическом биохимическом анализаторе Rendom Access A-25 (BioSystems, Испания) с использованием соответствующих наборов регистрировали уровень следующих показателей: креатинин, мочевина, аланинаминотрансфераза, аспартатаминотрансфераза, щелочная фосфатаза, холестерин, триглицериды, общий белок, альбумин, глюкоза и общий билирубин. Исходя из количества общего белка у каждого животного, определяли количество глобулинов, а также рассчитывали соотношение альбумин/глобулины у хомячков. Концентрацию общего билирубина регистрировали с помощью набора реактивов («Вектор-Бест», Россия), для определения уровня остальных аналитов использовали биохимические наборы (BioSystems, Испания). Все статистические расчеты проводили с использованием программы GraphPad Prism 9.0 (США), статистические выбросы — с помощью метода Тьюки [23–25], вид распределения определяли, используя критерий Шапиро—Уилка, парные сравнения между животными разного пола проводили с применением U-критерия Манна—Уитни и t-критерия Стьюдента.
Результаты и обсуждение
В начале обработки полученных значений были исключены так называемые жесткие и мягкие выбросы, то есть данные, лежащие за пределами интервала Q3 и Q1 (1‑го и 3‑го квартилей). Верхний и нижний пределы рассчитывали следующим образом:
Q1–1,5IQR и Q3+1,5IQR.
Данные о доле статистических выбросов по каждому показателю и выходящих за пределы референтных интервалов представлены в табл. 1.
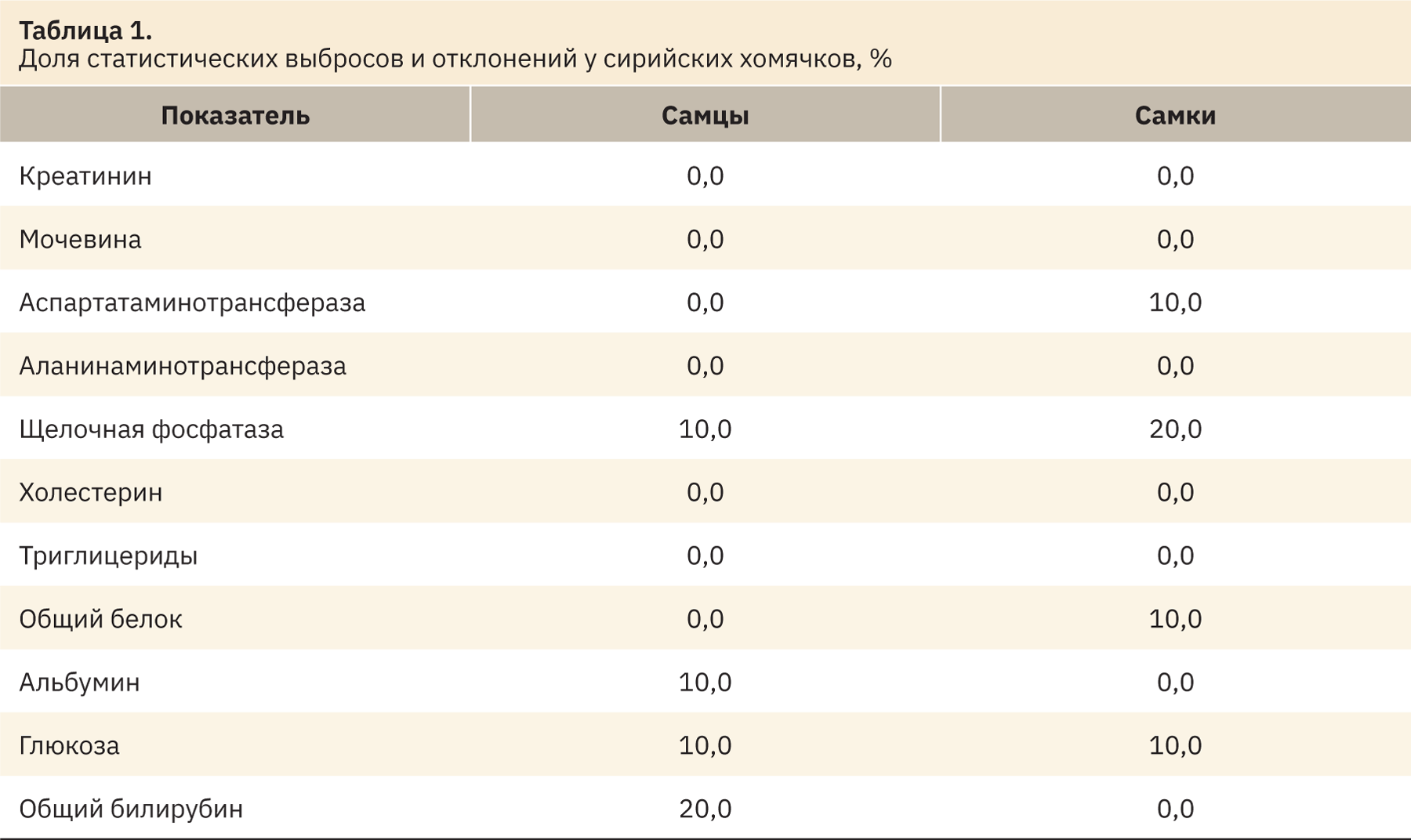
Наибольшие статистические выбросы и отклонения среди биохимических показателей крови самцов зарегистрированы в отношении общего билирубина (20%), щелочной фосфатазы, глюкозы и альбумина (10%) (см. табл. 1). У самок наибольшие статистические отклонения зарегистрированы в отношении щелочной фосфатазы (20%), аспартатаминотрансферазы, глюкозы и общего белка (10%). По всем остальным показателям статистических выбросов и отклонений не выявлено.
Вид распределения полученных значений определяли при помощи критерия Шапиро—Уилка. В зависимости от вида распределения референтные интервалы рассчитывали следующим образом:
Хср±1,96SD — для нормального распределения;
2,5–97,5‰ (процентили) — для ненормального распределения (табл. 2).
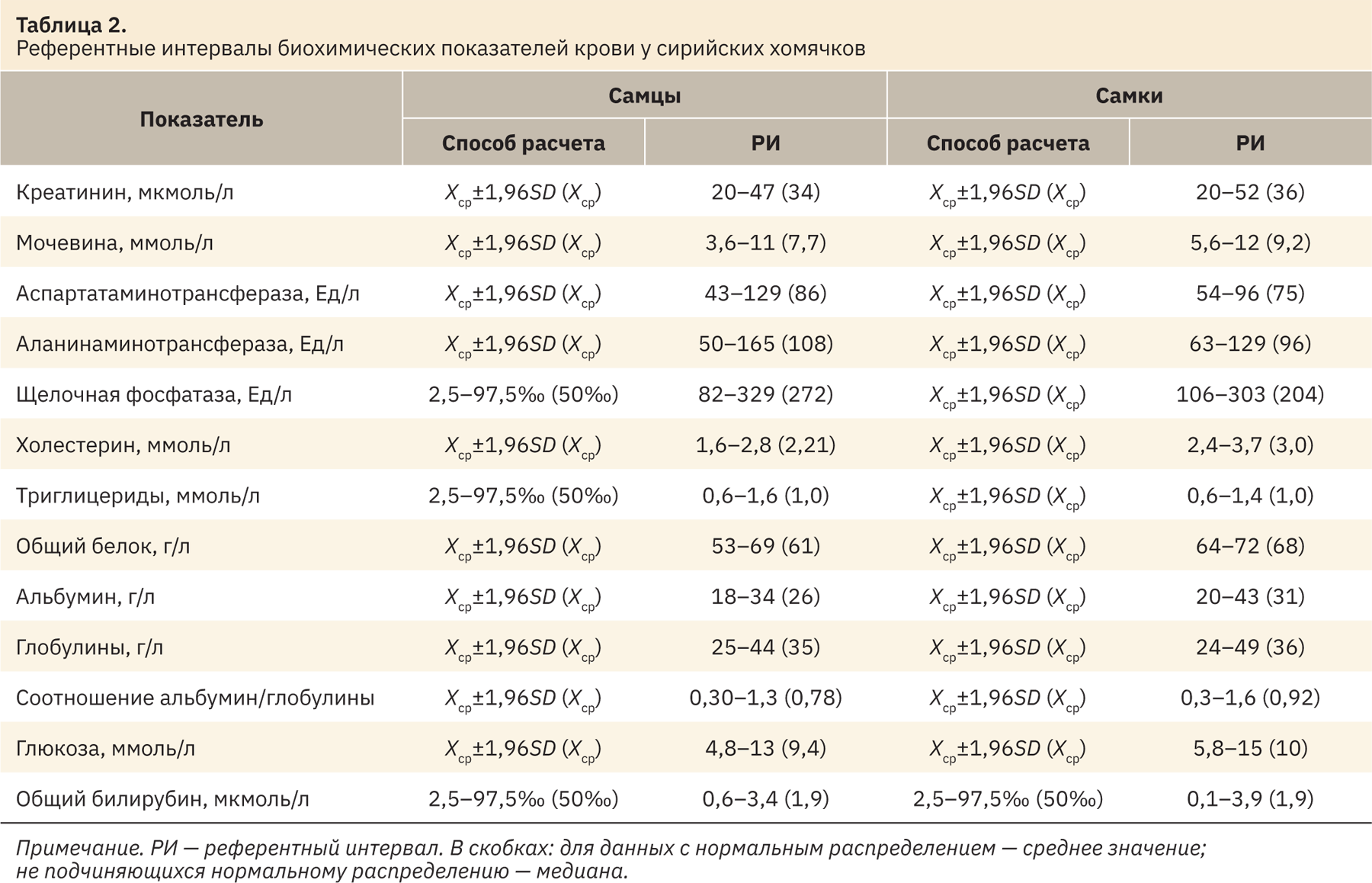
В табл. 2 представлены результаты референтных интервалов биохимических показателей крови хомячков.
Полученные диапазоны значений у самцов и самок сирийских хомячков сопоставимы между собой по всем рассматриваемым показателям, статистической разницы не выявлено (см. табл. 2).
При сравнении полученных интервалов с референтными значениями, указанными в источниках литературы (табл. 3), показано, что в целом диапазоны рассматриваемых показателей как самцов, так и самок схожи, но присутствуют и различия. По данным источников литературы, значения показателя мочевины и щелочной фосфатазы оказались выше более чем в 2 раза, также выше оказались и показатели аспартатаминотрансферазы, аланинаминотрансферазы и глюкозы, а уровень триглицеридов — ниже в 2 раза, чем в некоторых данных литературы. Такие различия могут быть связаны с преаналитическими и аналитическими особенностями проведения анализа, породы животных и условий их содержания. Именно поэтому лучшим решением для всех доклинических центров является установление своих собственных референтных интервалов у лабораторных животных. Значения креатинина, холестерина, общего белка, альбумина и общего билирубина соответствовали таковым из данных литературы.
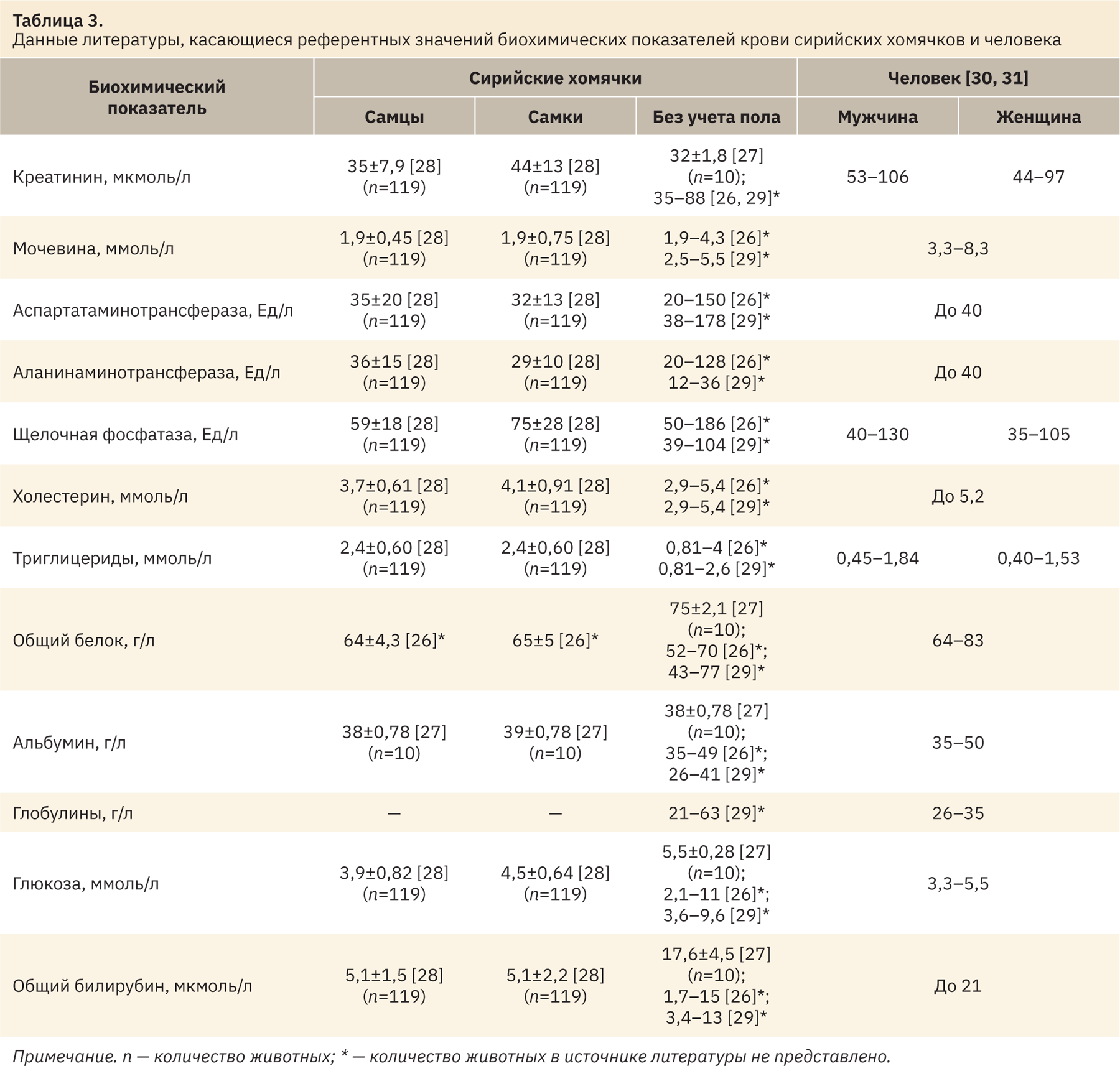
Сопоставляя полученные референтные интервалы биохимических показателей крови сирийских хомячков с таковыми у человека (см. табл. 3), можно сделать вывод, что верхняя граница референтного диапазона креатинина сирийских хомячков соотносится с нижней границей диапазона у человека. Таким образом, нормальные значения креатинина у рассматриваемых животных значительно ниже таковых у человека. Референтный диапазон мочевины сирийских хомячков cоответствует таким же данным у человека. Нижняя граница полученных диапазонов значений аспартатаминотрансферазы и аланинаминотрансферазы у сирийских хомячков соответствует верхней границе данных показателей у людей. Таким образом, нормальные значения этих показателей выше, а сами диапазоны шире, чем у человека. Верхняя граница референтного интервала щелочной фосфатазы у рассматриваемых животных превышает таковую у человека в 3 раза. Значения холестерина и триглицеридов здоровых сирийских хомячков схожи с таковыми человека. Нормальные диапазоны общего белка и альбумина рассматриваемых животных практически соответствуют данным человека — у людей верхняя граница незначительно выше, а верхняя граница глобулинов незначительно ниже, чем у хомячков. Диапазон содержания глюкозы у хомячков оказался в 3 раза шире, чем у человека.
Ниже дана характеристика представленным в статье биохимическим показателям крови данного вида животных, а также рассмотрены наиболее распространенные патологические и физиологические состояния, при которых возможны изменения данных показателей (табл. 4). Стоит также отметить, что практически все тестируемые фармакологические агенты и лекарственные средства будут в той или иной степени влиять на уровни биохимических показателей сыворотки крови сирийских хомячков.

Так, уровень глюкозы у рассматриваемых животных зависит от широкого перечня факторов — питания, анестезии, суточных колебаний, стресса и патологических состояний (например, сахарный диабет). Стресс и анестезия являются важными факторами, повышающими уровень глюкозы в крови хомячков. У данных животных также наблюдается циркадный ритм концентрации глюкозы с самым низким уровнем непосредственно перед началом темного периода времени и самым высоким уровнем в начале светлого периода [26].
Уровень холестерина в крови хомячков также зависит от таких факторов, как диета, суточные колебания и температура. Высокохолестериновая и высокотриглицеридная диета вызывает повышение уровня холестерина в плазме крови. Аномальные уровни обычно можно снизить путем голодания. Диета с высоким содержанием фруктозы приводит к повышению уровня липопротеинов низкой плотности. Высокоуглеводная диета повышает уровень триглицеридов в плазме крови у хомячков. Уменьшение продолжительности светлого времени дня (менее 10 ч) вызывает снижение концентрации холестерина, при этом не влияет на другие липиды плазмы крови хомячков. Низкая температура окружающей среды также вызывает снижение уровня холестерина в плазме крови, не влияя на уровень триглицеридов. При таких патологических состояниях, как хронический гепатит и желчно-каменная болезнь, у сирийских хомячков наблюдается гиперхолестеринемия [32].
Уровень мочевины в сыворотке крови зависит от качества и количества пищи. Так, диета, содержащая большое количество белка, вызывает у рассматриваемых животных повышение уровня мочевины. Также к повышению ее уровня ведут заболевания почек, поражение которых часто встречается у возрастных животных. Повышение сывороточного креатинина обнаруживается у хомячков с почечным амилоидозом и нефротическим синдромом [33, 34].
На уровень щелочной фосфатазы, помимо возраста животного и периода голодания, влияют такие патологические состояния, как переломы костей, неоплазии костных тканей, патология печени и холестаз. Также стоит учитывать, что у неполовозрелых хомячков, как и у других животных, отмечают более высокий уровень щелочной фосфатазы, чем у половозрелых, из‑за его высвобождения из растущих костей [26].
Повышение активности аланинаминотрансферазы отмечается у хомячков с патологией печени, вызванной токсическим действием вирусов или фармакологических веществ и соединений (например, ацетаминофен). У сирийских хомячков с хроническим гепатитом увеличение активности фермента напрямую коррелирует с количеством пораженных гепатоцитов. Метод забора крови также отражается на активности определяемых ферментов. Так, например, при кардиальной пункции наблюдается повышение активности ферментов — аланинаминотрансферазы, аспартатаминотрансферазы, лактатдегидрогеназы и креатинкиназы. Активность аспартатаминотрансферазы повышается у сирийских хомячков с печеночной неоплазией и метаболическими изменениями. Примечательно, что для сирийских хомячков с печеночной дисфункцией не характерно изменение уровня билирубина в сыворотке крови [35, 36].
На концентрацию общего белка при отсутствии патологии у сирийских хомячков влияет возраст. Так, общее количество альбумина снижается в течение первого года жизни, а уровень глобулинов, наоборот, увеличивается. Отношение альбумина к глобулину у хомячков также уменьшается с возрастом. У рассматриваемых животных, находящихся в спячке, выявлено повышение концентрации бета-глобулина, альбумина, при этом уровень гамма-глобулина снижается. Инфекции вирусной этиологии и различные поражения печени вызывают изменение концентрации альбумина и общего белка. При сахарном диабете отмечено повышение уровня альфа-2-глобулина. У возрастных хомячков обычно наблюдается амилоидоз, при котором снижается уровень альбумина и увеличивается содержание гамма-глобулина [26].
Были рассчитаны коэффициенты вариации рассмотренных биохимических показателей крови хомячков, что в грубом приближении соответствует межиндивидуальной вариабельности этих показателей в человеческой популяции. В широком смысле под этим определением подразумевается изменчивость качественных и/или количественных особенностей структуры и/или функций, присущих двум и более отдельным животным. Сравнительные данные приведены в табл. 5.
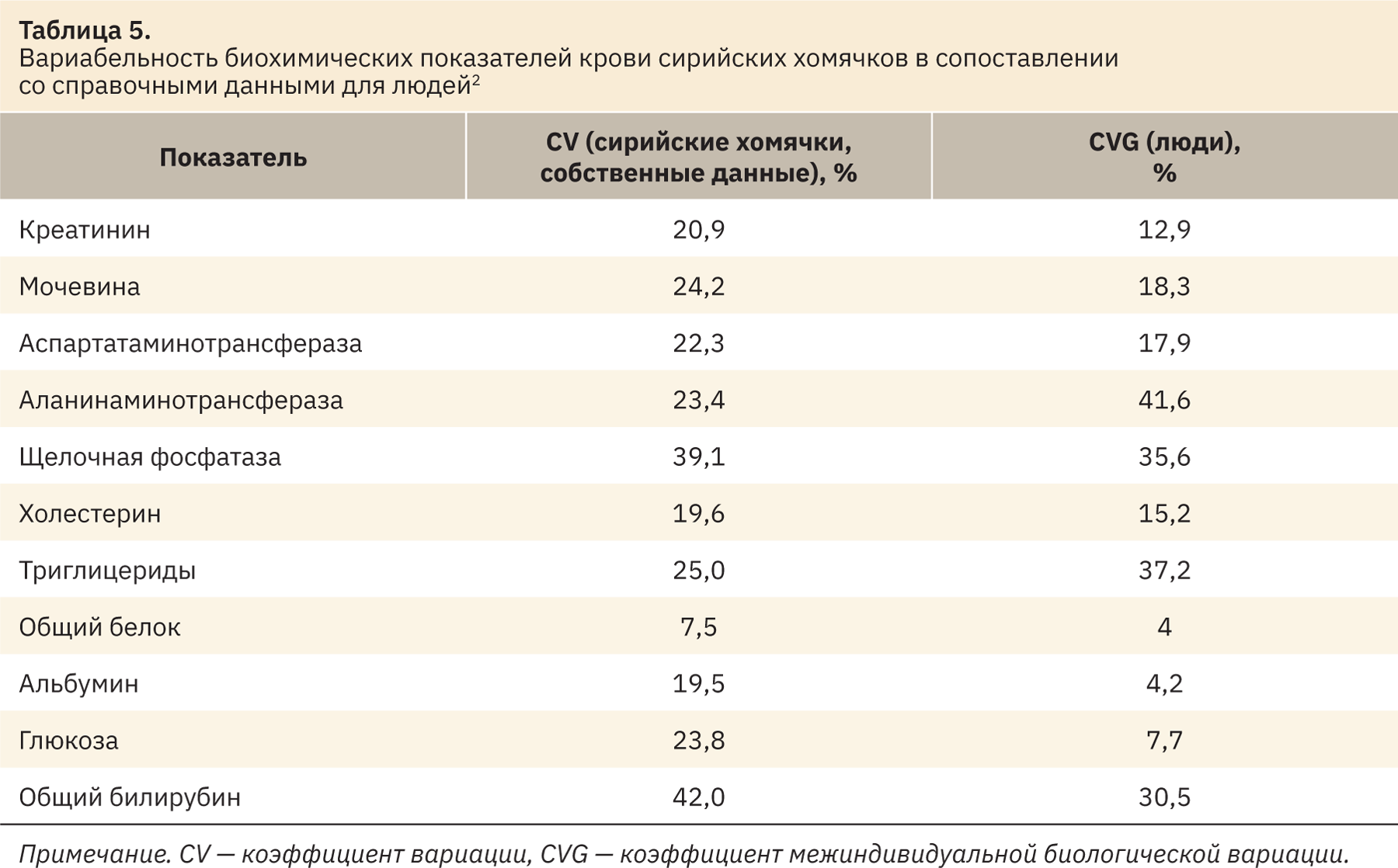
Схожая вариабельность отмечена по таким показателям, как мочевина, аспартатаминотрансфераза, щелочная фосфатаза, холестерин и общий белок. Различия выявлены среди показателей креатинина, альбумина, глюкозы, общего билирубина, при этом вариабельность у хомячков выше, чем у людей. Вариабельность аланинаминотрансферазы и триглицеридов у хомячков ниже, чем у людей. Данная информация может быть полезной при интерпретации полученных значений в доклинических исследованиях.
Заключение
Сирийские хомячки являются широко применяемой тест-системой в доклинических исследованиях, направленных на оценку безопасности и эффективности новых фармакологических веществ. В результате проведенного исследования установлены референтные интервалы наиболее часто оцениваемых биохимических показателей сыворотки крови сирийских хомячков. Полученные диапазоны являются полезным инструментом в области доклинических исследований и могут быть применены для мониторинга здоровья животных, изучения токсичности и фармакологической безопасности, контроля формирования модельных патологий и оценки эффективности фармакологических агентов.
Сведения о конфликте интересов
М.Н. Макарова является членом редакционной коллегии журнала «Лабораторные животные для научных исследований». Остальные авторы заявляют об отсутствии конфликта интересов, требующего раскрытия в данной статье.
Вклад авторов
М.В. Мирошников — анализ научной и методической литературы, написание, редактирование и доработка текста рукописи, ответственность за все аспекты работы, связанные с достоверностью данных.
К.Т. Султанова — написание и редактирование текста рукописи, обобщение результатов исследования, работа с табличным материалом.
М.А. Ковалева — анализ научной и методической литературы, научное редактирование текста рукописи.
М.Н. Макарова — идея разработки темы и обоснование актуальности работы, критический пересмотр содержания.
- Директива 2010/63/EU Европейского парламента и Совета Европейского союза по охране животных, используемых в научных целях / пер. с англ. Под ред. М.С. Красильщиковой, И.В. Белозерцевой. Санкт-Петербург, 2012. 48 с. [Direktiva 2010/63/EU Yevropeyskogo Parlamenta i Soveta Yevropeyskogo Soyuza po okhrane zhivotnykh, ispol’zuyemykh v nauchnykh tselyakh / transl. from English. Ed. M.S. Krasilshchikova, I.V. Belozertseva. St. Petersburg, 2012. 48 p. (In Russ.)].
- ГОСТ Р 53022.2–2008 Технологии лабораторные клинические. Требования к качеству клинических лабораторных исследований. Часть 2. Оценка аналитической надежности методов исследования (точность, чувствительность, специфичность) Москва, 2008. [GOST R 53022.2–2008 Tekhnologii labora tornye klinicheskie. Trebovaniya k kachestvu klinicheskih laboratornyh issledovanij. CHast’ 2. Ocenka analiticheskoj nadezhnosti metodov issledovaniya (tochnost’, chuvstvitel’nost’, specifi chnost’) Moskva, 2008. (In Russ.)].
Список источников
- Miao J., Chard L.S., Wang Z. et al. Syrian hamster as an animal model for the study on infectious diseases // Frontiers in immunology. 2019. N. 10. P. 2329.
-
Miedel E.L., Hankenson F.C. Biology and diseases of hamsters. Laboratory animal medicine. Academic Press, 2015. P. 209–245.
-
Hirose M., Ogura A. The golden (Syrian) hamster as a model for the study of reproductive biology: Past, present, and future // Reproductive medicine and biology. 2019. Vol. 18. N. 1. P. 34–39.
-
Chan J.F.W., Zhang A.J., Yuan S. et al. Simulation of the clinical and pathological manifestations of coronavirus disease 2019 (COVID-19) in a golden Syrian hamster model: implications for disease pathogenesis and transmissibility // Clinical infectious diseases. 2020. Vol. 71. N. 9. P. 2428–2446.
-
Warner B.M., Safronetz D., Kobinger G.P. Syrian hamsters as a small animal model for emerging infectious diseases: advances in immunologic methods. Emerging and Re-emerging Viral Infections. Springer, Cham, 2016. P. 87–101.
-
Iwatsuki-Horimoto K., Nakajima N., Ichiko Y. et al. Syrian hamster as an animal model for the study of human influenza virus infection // Journal of virology. 2018. Vol. 92. N. 4. P. e01693–17.
-
Bednash J.S., Kagan V.E., Englert J.A. et al. Syrian hamsters as a model of lung injury with SARS-CoV-2 infection: Pathologic, physiologic, and detailed molecular profiling // Translational Research. 2022. Vol. 240. P. 1–16.
-
Шипаева Е.В., Филон О.В., Зинченко А.В. и др. Доклинические исследования противовирусной активности гибридного белка RPH-137 и молнупиравира в отношении COVID-19 // БИОпрепараты. Профилактика, диагностика, лечение. 2022. Т. 22. № 4. С. 414–434. [SHipaeva E.V., Filon O.V., Zinchenko A.V. et al. Doklinicheskie issledovaniya protivovirusnoj aktivnosti gibridnogo belka RPH-137 i molnupiravira v otnoshenii COVID-19 // BIOpreparaty. Profilaktika, diagnostika, lechenie. 2022. Vol. 22. N. 4. P. 414–434. (In Russ.)].
-
Oliva R., Infante J.F., Gonzalez M. et al. Pathologic-clinical characterization of leptospirosis in a golden Syrian hamster model // Archives of Medical Research. 1994. Vol. 25. P. 165–170.
-
Zuerner R.L., Alt D.P., Palmer M.V. Development of chronic and acute golden Syrian hamster infection models with Leptospira borgpetersenii serovar Hardjo // Veterinary pathology. 2012. Vol. 49. N. 2. P. 403–411.
-
Cullen J.M., Levine J.F. Pathology of experimental Babesia microti infection in the Syrian hamster // Laboratory animal science. 1987. Vol. 37. N. 5. P. 640–643.
-
Lafuse W.P., Story R., Mahylis J. et al. Leishmania donovani infection induces anemia in hamsters by differentially altering erythropoiesis in bone marrow and spleen // PLoS One. 2013. Vol. 8. N. 3. P. e59509.
-
Wang Z., Cormier R.T. Golden Syrian Hamster Models for Cancer Research // Cells. 2022. Vol. 11. N. 15. P. 2395.
-
Gilloteaux J., Karkare S., Don A.Q. et al. Cholelithiasis induced in the Syrian hamster: Evidence for an intramucinous nucleating process and down regulation of cholesterol 7α-hydroxylase (CYP7) gene by medroxyprogesterone // Microscopy research and technique. 1997. Vol. 39. N. 1. P. 56–70.
-
Dillard A., Matthan N.R., Lichtenstein A.H. Use of hamster as a model to study diet-induced atherosclerosis // Nutrition & metabolism. 2010. Vol. 7. N. 1. P. 1–12.
-
Souidi M., Combettes-Souverain M., Milliat F. et al. Hamsters predisposed to sucrose-induced cholesterol gallstones (LPN strain) are more resistant to excess dietary cholesterol than hamsters that are not sensitive to cholelithiasis induction // The Journal of nutrition. 2001. Vol. 131. N. 6. P. 1803–1811.
-
Silva M., Lima W.G.D., Silva M.E. et al. Effect of streptozotocin on the glycemic and lipid profiles and oxidative stress in hamsters // Arq Bras Endocrinol Metab. 2011. Vol. 55. N. 1. P. 46–53.
-
Maurya S.K., Srivastava A.K. High fructose diet-induced glucose intolerance and dyslipidemia in adult Syrian golden hamsters // Indian Journal of Science and Technology. 2008. Vol. 1. N. 6.
-
Kasim-Karakas S.E., Vriend H., Almario R. et al. Effects of dietary carbohydrates on glucose and lipid metabolism in golden Syrian hamsters // Journal of Laboratory and Clinical Medicine. 1996. Vol. 128. N. 2. P. 208–213.
-
Hol P.R., Snel F.W.J.J., Niewold T.A. et al. Amyloid-enhancing factor (AEF) in the pathogenesis of AA-amyloidosis in the hamster // Virchows Archiv B. 1986. Vol. 52. N. 1. P. 273–281.
-
Webb C.F., Tucker P.W., Dowton S.B. Expression and sequence analyses of serum amyloid A in the Syrian hamster // Biochemistry. 1989. Vol. 28. N. 1. P. 4785–4790.
-
Калатанова А.В., Авдеева О.И., Макарова М.Н. и др. Использование защечных мешков хомяков при проведении доклинических исследований лекарственных средств, диспергируемых в полости рта // Фармация. 2016. Т. 65. № 7. С. 50–55. [Kalatanova A.V., Avdeeva O.I., Makarova M.N. et al. Ispol’zovanie zashchechnyh meshkov homyakov pri provedenii doklinicheskih issledovanij lekarstvennyh sredstv, dispergiruemyh v polosti rta // Farmaciya. 2016. Vol. 65. N. 7. P. 50–55. (In Russ.)].
-
Мирошников М.В., Макарова М.Н. Вариабельность биохимических показателей крови и установление референсных интервалов в доклинических исследованиях. Сообщение 4: мыши // Лабораторные животные для научных исследований. 2021. № 3. С. 64–70. [Miroshnikov M.V., Makarova M.N. Variabel’nost’ biohimicheskih pokazatelej krovi i ustanovlenie referensnyh intervalov v doklinicheskih issledovaniyah. Soobshchenie 4: myshi //Laboratornye zhivotnye dlya nauchnyh issledovanij. 2021. N. 3. P. 64–70. (In Russ.)].
-
Мирошников М.В., Султанова К.Т., Ковалева М.А. и др. Вариабельность биохимических показателей крови и установление референсных интервалов в доклинических исследованиях. Сообщение 5: Хорьки // Лабораторные животные для научных исследований. 2021. № 4. С. 29–39. [Miroshnikov M.V., Sultanova K.T., Kovaleva M.A. et al. Variabel’nost’ biohimicheskih pokazatelej krovi i ustanovlenie referensnyh intervalov v doklinicheskih issledovaniyah. Soobshchenie 5: Hor’ki // Laboratornye zhivotnye dlya nauchnykh issledovanii. 2021. N. 4. P. 29–39. (In Russ.)].
-
Мирошников М.В., Султанова К.Т., Ковалева М.А. и др. Вариабельность биохимических показателей крови и установление референтных интервалов в доклинических исследованиях. Сообщение 6: Яванские макаки //Лабораторные животные для научных исследований. 2022. № 2. С. 14–25. [Miroshnikov M.V., Sultanova K.T., Kovaleva M.A. et al. Variabel’nost’ biohimicheskih pokazatelej krovi i ustanovlenie referentnyh intervalov v doklinicheskih issledovaniyah. Soobshchenie 6: YAvanskie makaki // Laboratornye zhivotnye dlya nauchnyh issledovanij. 2022. N. 2. P. 14–25. (In Russ.)].
-
Washington I.M., Van Hoosier G. Clinical biochemistry and hematology. The laboratory rabbit, guinea pig, hamster, and other rodents. Academic Press, 2012. P. 57–116.
-
Kuznetsova E.V., Feoktistova N. Y., Naidenko S.V. et al. Seasonal changes in blood cells and biochemical parameters in the Mongolian hamster (Allocricetulus curtatus) // Biology Bulletin. 2016. Vol. 43. N. 4. P. 344–349.
-
Wolford S.T., Schroer R.A., Gohs F.X. et al. Reference range data base for serum chemistry and hematology values in laboratory animals // Journal of Toxicology and Environmental Health, Part A Current Issues. 1986. Vol. 18. N. 2. P. 161–188.
-
Field K.J., Sibold A.L. The laboratory hamster and gerbil. CRC Press, 1998.
-
Лившиц В.М., Сидельникова В.И. Биохимические анализы в клинике: справ. 3‑е изд. 2011. [Livshits V.M., Sidel’nikova V.I. Biokhimicheskie analizy v klinike: sprav. 3‑e izd. 2011 (In Russ.)].
-
Ингерлейб М.Б. Медицинские анализы. Самый полный современный справочник / М.Б. Ингерлейб. Москва: Изд-во АСТ, 2015. 416 с. [Ingerleib M.B. Meditsinskie analizy. Samyi polnyi sovremennyi spravochnik / M.B. Ingerleib. Moskva: Izd-vo AST, 2015. 416 p. (In Russ.)].
-
Lin X., Ma P., Yang C. et al. Dietary-induced elevations of triglyceride-rich lipoproteins promote atherosclerosis in the low-density lipoprotein receptor knockout Syrian Golden Hamster // Frontiers in cardiovascular medicine. 2021. Vol. 8.
-
Murphy J.C., Fox J.G., Niemi S.M. Nephrotic syndrome associated with renal amyloidosis in a colony of Syrian hamsters // Journal of the American Veterinary Medical Association. 1984. Vol. 185. N. 11. P. 1359–1362.
-
Inenaga T., Nishida E., Kawamura S. et al. Renal function tests on diabetes-induced and non-induced APA hamsters // Experimental animals. 2002. Vol. 51. N. 5. P. 437–445.
-
Podgorska E., Sniegocka M., Mycinska M. et al. Acute hepatologic and nephrologic effects of calcitriol in Syrian golden hamster (Mesocricetus auratus) // Acta Biochimica Polonica. 2018. Vol. 65. N. 3. P. 351.
- Brunnert S.R., Altman N.H. Laboratory assessment of chronic hepatitis in Syrian hamsters // Laboratory animal science. 1991. Vol. 41. N. 6. P. 559–562.



