Динамика посмертных изменений тел умерших лабораторных животных
Гущин Я.А., Беляева Е.В., Устенко Ж.Ю. Динамика посмертных изменений тел умерших лабораторных животных. Лабораторные животные для научных исследований. 2021; 4. https://doi.org/10.29296/2618723X-2021-04-08
Резюме
Патоморфологический анализ органов и тканей лабораторных животных является важными инструментом в современных биомедицинских исследованиях и считается неотъемлемой частью при разработке, тестировании и проверке безопасности новых лекарственных веществ. Однако в силу тех или иных причин не всегда есть возможность сразу провести вскрытие умерших животных, поэтому возникает необходимость сохранить тела для последующего изучения. Задача данного исследования – оценить динамику посмертных изменений лабораторных животных (мыши, крысы и кролики), выявить оптимальные условия хранения трупов (16–22, 2–4 или -18–22°С) и определить временной период, на который можно отложить процедуру некропсии без потери данных (от 12 до 72 ч и 2 мес в случае замораживания). Трупные явления анализировали макроскопически и микроскопически с применением полуколичественной оценки типичных посмертных изменений. Установлено, что быстрее всего трупные явления возникают при нахождении тел животных при комнатной температуре, кроме того, на скорость разложения влияет и размер животных. Так, у мышей с их небольшим объемом тела процессы аутолиза начинают развиваться через 18 ч после смерти, а к 72 ч становятся катастрофическими. В то же время у более крупных животных (крысы и кролики) развитие трупных изменений несколько задерживается, поэтому через 3 сут при температуре 16–22°С макроскопическая диагностика была еще возможна. Процессы распада можно значительно замедлить, как можно скорее поместив тела в холодильную камеру с температурой 2–4°С. Однако если для макроскопического анализа трупы всех изученных видов животных сохраняются и через 2 сут, хотя несколько хуже и через 3 сут после смерти, то отбор тканей для гистологического исследования должен быть произведен в течение 48 ч от момента смерти. Хранение трупов при температуре -18–22°С является крайней мерой, поскольку, несмотря на то что макроскопически строение органов никак не изменяется, страдает микроструктура тканей, подвергаясь криогенному повреждению.
Таким образом, в результате исследования выявлено оптимальное время, в течение которого можно провести патоморфологическое изучение трупов лабораторных животных после их незапланированной гибели без потери или с минимальной потерей информативности при различных условиях их хранения.
Введение
Патоморфологический анализ органов и тканей лабораторных животных – важный инструмент в современных биомедицинских исследованиях. Систематическое макроскопическое изучение задействованных в экспериментах животных, сбор биологического материала с последующим микроскопическим анализом являются неотъемлемой частью при разработке, тестировании и проверке безопасности новых лекарственных веществ.
В большинстве случаев патологоанатом работает с материалом, отобранным у животных, подвергшихся процедуре эвтаназии согласно намеченному плану исследования. К сожалению, в ряде случаев, особенно при изучении безопасности веществ, когда используют заведомо большие дозы тестируемых объектов, фиксируется внеплановая гибель животных. В таких случаях патологоанатом должен провести вскрытие, отобрать материал для гистологического исследования с целью обнаружения возникшей патологии и определения причины смерти [1–3]. Однако в силу тех или иных причин не всегда есть возможность сразу провести вскрытие умерших животных и возникает необходимость сохранить тела для последующего изучения. И тут решающую роль играет время, прошедшее между смертью животного и некропсией, поскольку сразу после смерти начинают развиваться неизбежные химические и физические изменения, которые последовательны, необратимы и неуклонно нарастают [4, 5]. Развивается посмертный аутолиз тканей, так как снижается метаболическая активность клеток и пропадает контроль ферментных систем [6–8]. Хотя порядок развития посмертных явлений относительно постоянен, однако на скорость процессов и сохранность тканей оказывает влияние большое количество факторов [4, 5, 9, 10]. В случае условий вивария доклинического научного центра – это преимущественно время и температура, в которой находится тело погибшего животного.
И хотя есть много научных трудов, в основном относящихся к области судебной медицины, связанных с изучением трупных явлений, в них крайне мало информации касательно лабораторных животных и их сохранности после гибели. В связи с чем было предложено оценить динамику посмертных изменений различных видов лабораторных животных, выявить оптимальные условия хранения трупов и определить временной период, на который можно отложить процедуру некропсии без потери данных.
Материал и методы
Исследование проведено в «НПО «Дом Фармации» (Ленинградская обл., Россия). В качестве биологических тест-систем были использованы самцы и самки лабораторных животных (мыши ISR, крысы Wistar и кролики Новозеландские) по 65 особей каждого вида. Для исследования отбирали животных из стоковой популяции, подлежащих выбраковке из гуманных соображений на основании проведенной оценки по шкалам определения боли и дистресса. Решение об эвтаназии принималось на основании объективных данных ветеринарными специалистами. Специально для данного исследования животных не эвтаназировали. Животные содержались в стандартных условиях в соответствии с санитарно-эпидемиологическими правилами СП 2.2.1.3218-14 и Директивой 2010/63/EU от 22 сентября 2010 г. по охране животных, используемых в научных целях. Эвтаназию мышей и крыс осуществляли при помощи СО2-камеры, кроликов – путем передозировки анестетика (смесь антагониста центральных α2-адренорецепторов, диссоциативного анестетика и транквилизатора). В обоих случаях без проведения обескровливания и с сохранением целостности тел.
Животные каждого вида были разделены на группы по 5 особей в зависимости от температуры хранения трупов – комнатная (16–22°С), холодильная камера (2–4°С) и морозильная камера (-18–22°С) и от времени, прошедшего с момента эвтаназии (от 12 до 72 ч и 2 мес). Характеристика групп представлена в табл. 1.
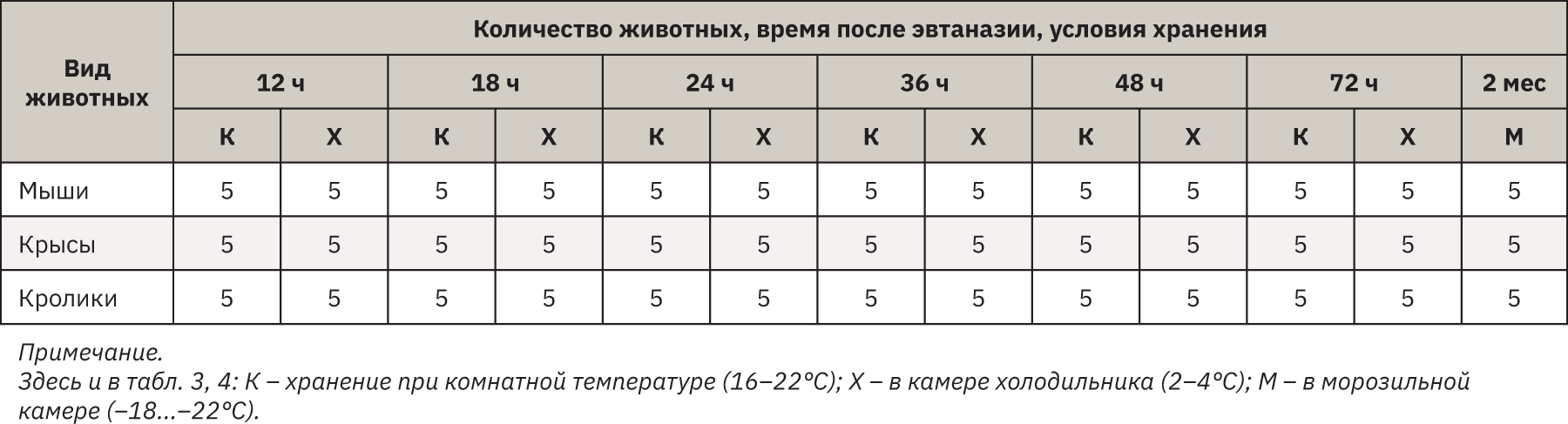
После эвтаназии трупы животных помещали в указанные выше температурные условия хранения, по истечении запланированного времени осуществляли макроскопическую оценку органов и тканей полуколичественно, в баллах по следующим 5 параметрам:
- трупное окоченение;
- изменения кожи;
- изменение цвета и плотности паренхиматозных органов;
- изменение кишечника (вздутие, изменение цвета, аутолиз);
- изменение цвета и плотности легких.
Трупное окоченение оценивалось от 0 (выраженное, затрагивает все тело) до 4 (полностью отсутствует).
Изменения кожи:
- 0 баллов – нормальное строение;
- 1–3 балла – визуальное изменение цвета кожи под шерстью, площадь трупных пятен и их цветовая интенсивность;
- 4 балла – выявление гнилостных изменений в виде выпадения шерсти, отека и отслоения от подлежащих тканей, цвет мог приобретать зеленоватый оттенок.
Изменение цвета и плотности паренхиматозных органов: при макроскопическом анализе трупных явлений внутренних органов выставлялась оценка 0 баллов при нормальном строении, от 1 до 4 баллов в зависимости от плотности ткани, интенсивности цвета и рисунка ткани, площади видимых изменений.
Оценка состояния кишечника в 0 баллов соответствовала нормальному строению, от 1 до 4 баллов ставилась в зависимости от площади аутолитических изменений, которую они затрагивают: во внимание принималось изменение цвета стенки органов, легкость их повреждения при механическом воздействии, а также выраженность газообразования.
При нормальном макроскопическом строении легких выставляли 0 баллов, в зависимости от объема поврежденной ткани (в процесс вовлечены только небольшие участки в отлогих местах или все доли), выраженности отека, изменения интенсивности цвета органа – от 1 до 4 баллов.
Затем для микроскопического исследования производили отбор фрагментов тканей, которые фиксировали в 10% растворе нейтрального формалина в течение 24 ч. Осуществляли гистологическую обработку образцов по общепринятой методике, заливали их в парафин и изготавливали гистологические срезы толщиной 5–7 мкм, которые окрашивали гематоксилином и эозином.
Было изучено строение 6 органов:
- сердца,
- легких,
- печени,
- почек,
- поджелудочной железы.
- кишечника.
Данные органы, с одной стороны, наиболее часто исследуют в экспериментах, с другой – имеют разную скорость посмертного аутолиза, исходя из чего их можно условно расставить от наиболее уязвимых к наименее в следующем порядке: кишечник, почки, поджелудочная железа, легкие, печень, сердце [11–15].
У всех животных в группе была проведена оценка гистологических изменений для каждого из 6 органов по балльной шкале от 0 до 4, где:
- 0 – строение не нарушено;
- 1 – минимальные изменения, затрагивают небольшие участки тканей, наблюдается изменение тинкториальных свойств клеток, их набухание, вакуолизация или иные дистрофические изменения с сохранением общей структуры;
- 2 – умеренно выраженные изменения затрагивают продолжительные участки или много небольших участков;
- 3 – значительные аутолитические изменения в клетках, полный их лизис, нарушается архитектоника ткани;
- 4 – процесс разложения распространяется практически на всю ткань, архитектоника ткани может только угадываться или полностью нарушена до неузнаваемости.
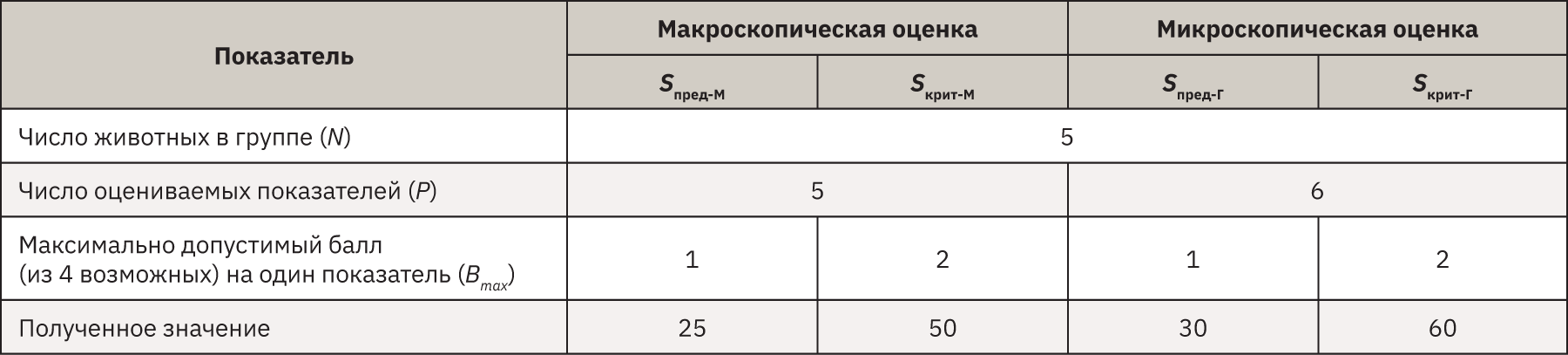
Полученные баллы всех животных в группе суммировали, тем самым получая общую сумму баллов отдельно для макроскопических (Sобщ-М) и микроскопических (Sобщ-Г) изменений в органах, что позволяло обобщить и качественно охарактеризовать выраженность некротических явлений в заданных точках времени. Для оценки пригодности исследуемого материала при диагностике полученные цифры сравнили с двумя условными границами:
- предельной (Sпред), при превышении которой точная диагностика хоть и возможна, но затруднительна;
- критической (Sкрит), при превышении которой патоморфологическое исследование неинформативно.
Для их расчета использовали значения, представленные в табл. 2, по следующей формуле:
S=N×P×Bmax.
Результаты и обсуждение
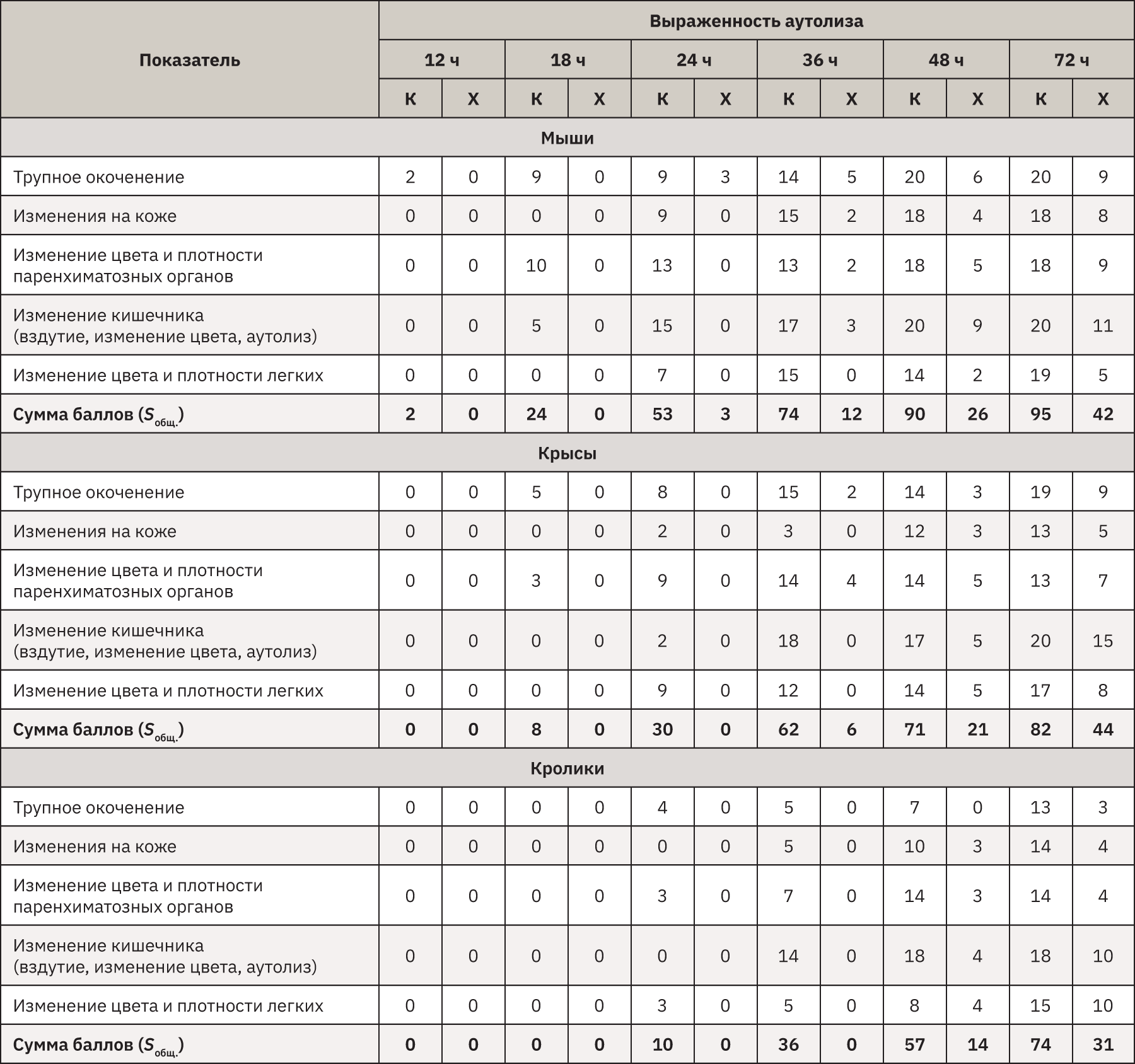
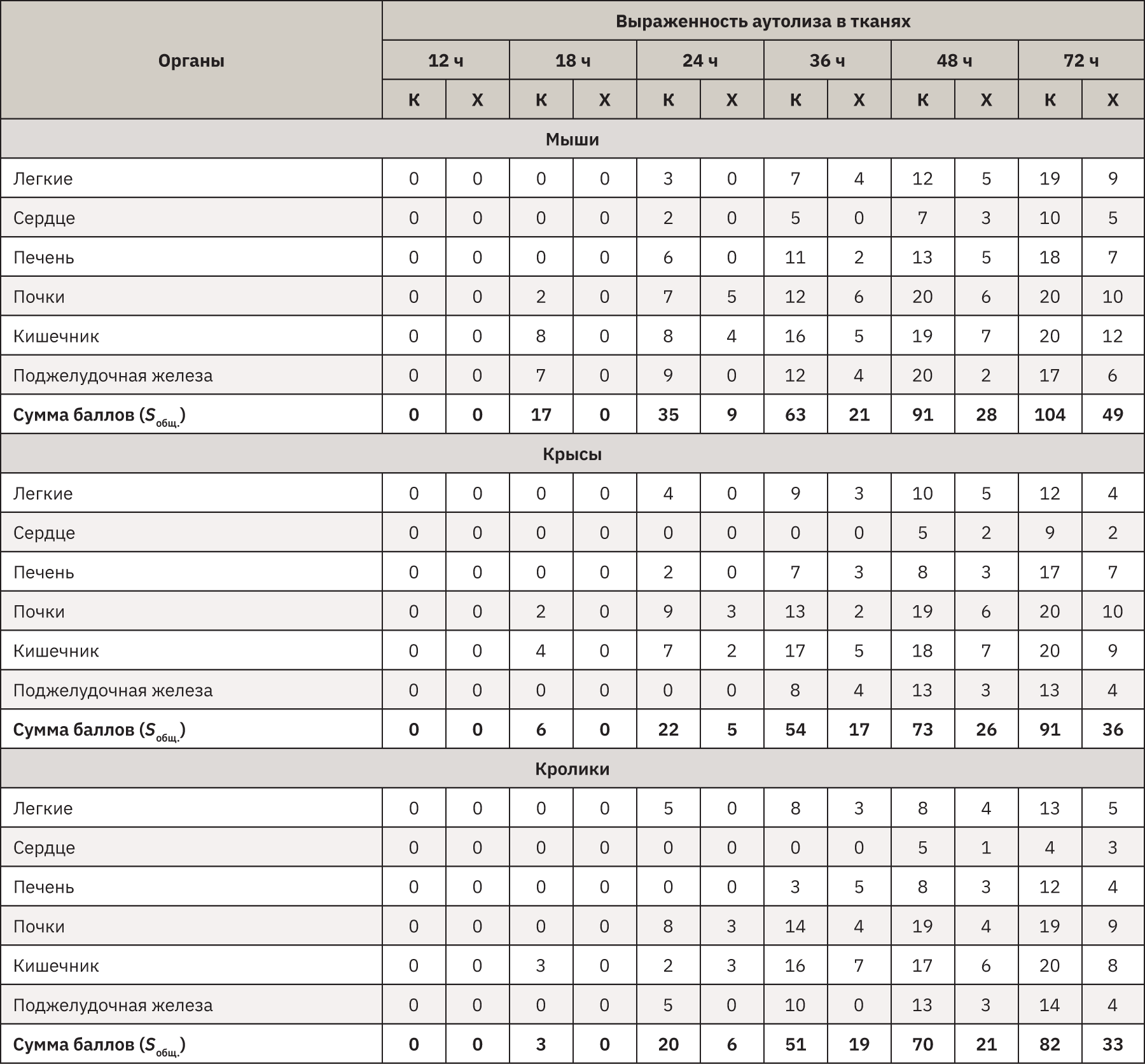
Результаты макроскопического исследования представлены в табл. 3 и на рис. 1.
Макроскопически первыми признаком наступившей смерти являлось трупное окоченение. Оно отмечено у всех видов животных уже через 12 ч после смерти независимо от условий хранения. Постепенно, к 72 ч после смерти животных в условиях комнатной температуры оно практически полностью пропадало. Особенно это касалось мышей, у которых наблюдалось начало его разрешения, начиная с 12 ч, а к 24 ч после смерти отсутствовало во всех отделах тела, хотя при нахождении в холодильнике в том же промежутке времени у трупов сохранялась ригидность мышц туловища. При этом у более крупных крыс и тем более кроликов при температуре 2–4°С даже через 72 ч трупное окоченение все же присутствовало, хоть и не очень выраженно.
Цвет кожных покровов – менее значимый признак смерти у животных из-за наличия шерсти. Трупные пятна можно было обнаружить только при тщательном осмотре, а оценить их площадь весьма приблизительно. Отмечается усиление интенсивности цвета пятен со временем, замедленное восстановление цвета после надавливания. В условиях холодильника кожные покровы почти не изменялись, но при комнатной температуре к 72 ч трупные изменения были выражены. Так, у мышей отмечены начальные проявления гниения: шерсть легко выпадала, кожа местами могла отслаиваться, а цвет подкожной клетчатки приобретал зеленоватый оттенок.
При вскрытии и макроскопической оценке у всех животных первые трупные явления можно было определить через 18 ч с момента смерти при условии хранения при комнатной температуре. Особенно это касается мелких животных – мышей, у которых в кишечнике процессы аутолиза развивались рано и быстро нарастали к 36 ч. В результате гниения и брожения химуса начиналось газообразование, нарастал отек тканей, они истончались и легко повреждались, желудок можно было порвать, захватив пинцетом. Также на паренхиматозных органах и легких в отлогих участках довольно быстро появлялись и интенсивно распространялись области темно-красного цвета, усиливался рисунок ткани. Эти органы становились дряблыми и к 72 ч выглядели отечными и легко травмировались при небольшом механическом воздействии, в легких на разрезе выделялась красноватая жидкость, так же, как и из просвета крупных бронхов. У остальных видов животных процессы распада несколько отставали по времени и интенсивности, но через 3 сут все равно хорошо выявлялись.
При температуре 2–4°С процессы разрушения тканей были сильно замедлены, в том числе в кишечнике, и даже через 72 ч внутренние органы всех животных, это касалось и мышей, находились в удовлетворительном состоянии, хотя при комнатной температуре к этому времени дифференциальная диагностика возможных патологических состояний была бы невозможна.
При хранении трупов всех видов животных в морозильной камере в течение 2 мес никаких макроскопических посмертных изменений не обнаружено, только отмечено, что после оттаивания тел трупное окоченение полностью пропадало.
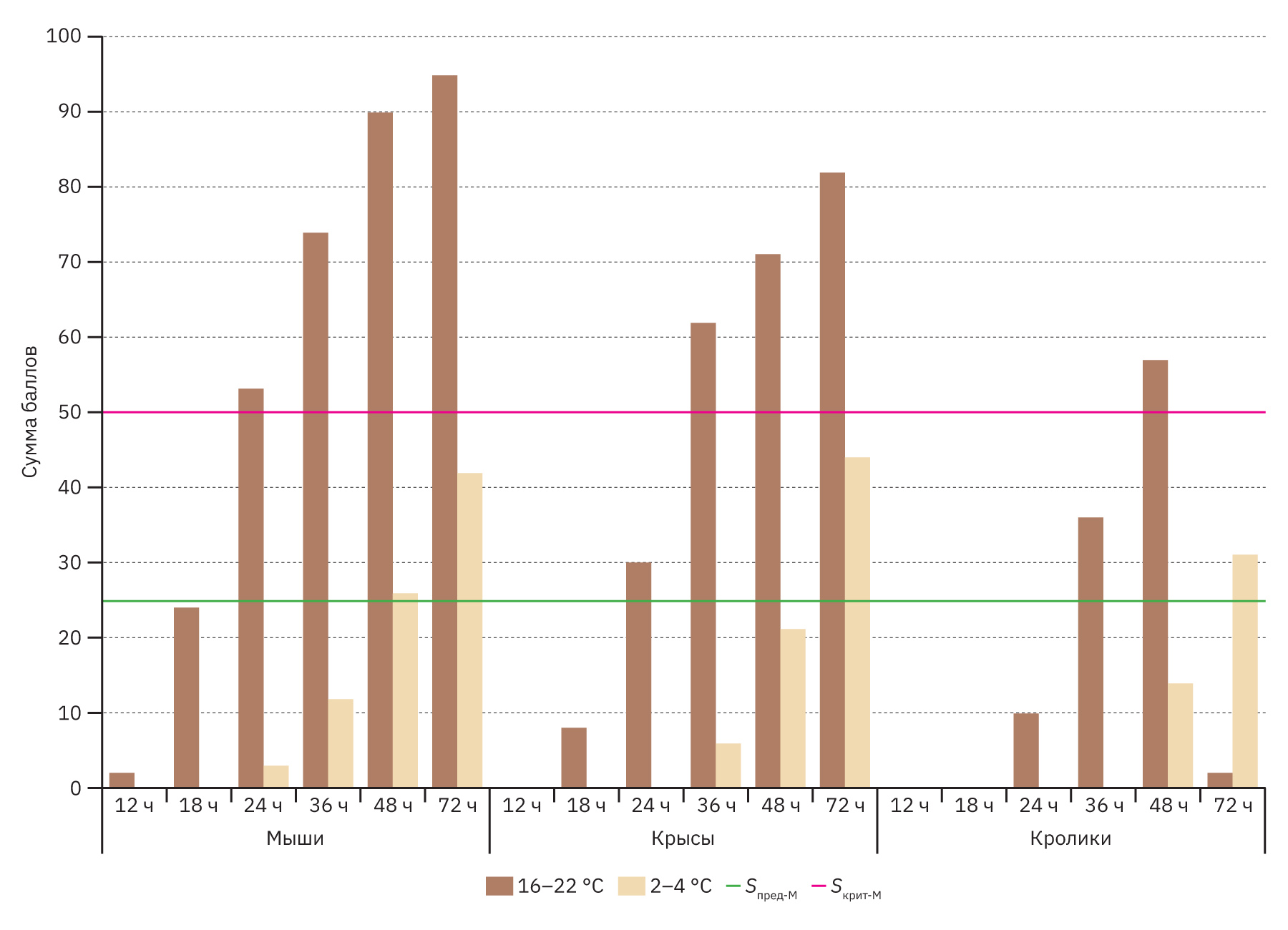
На диаграмме наглядно показано, что трупные изменения тел всех животных очень быстро наступали при хранении тел при температуре 16–22°С, в результате чего макроскопическая оценка трупов мышей была совершенно неинформативна через 24 ч, а крыс и кроликов – через 36 ч. Однако в условиях холодильной камеры общий интегративный показатель трупных изменений (Sобщ) у всех видов животных даже через 72 ч не превышал критический порог, т.е. макроскопическое исследование было проведено с незначительной потерей данных.
Результаты гистологического исследования представлены в табл. 4, 5 и на рис. 2 и 3.
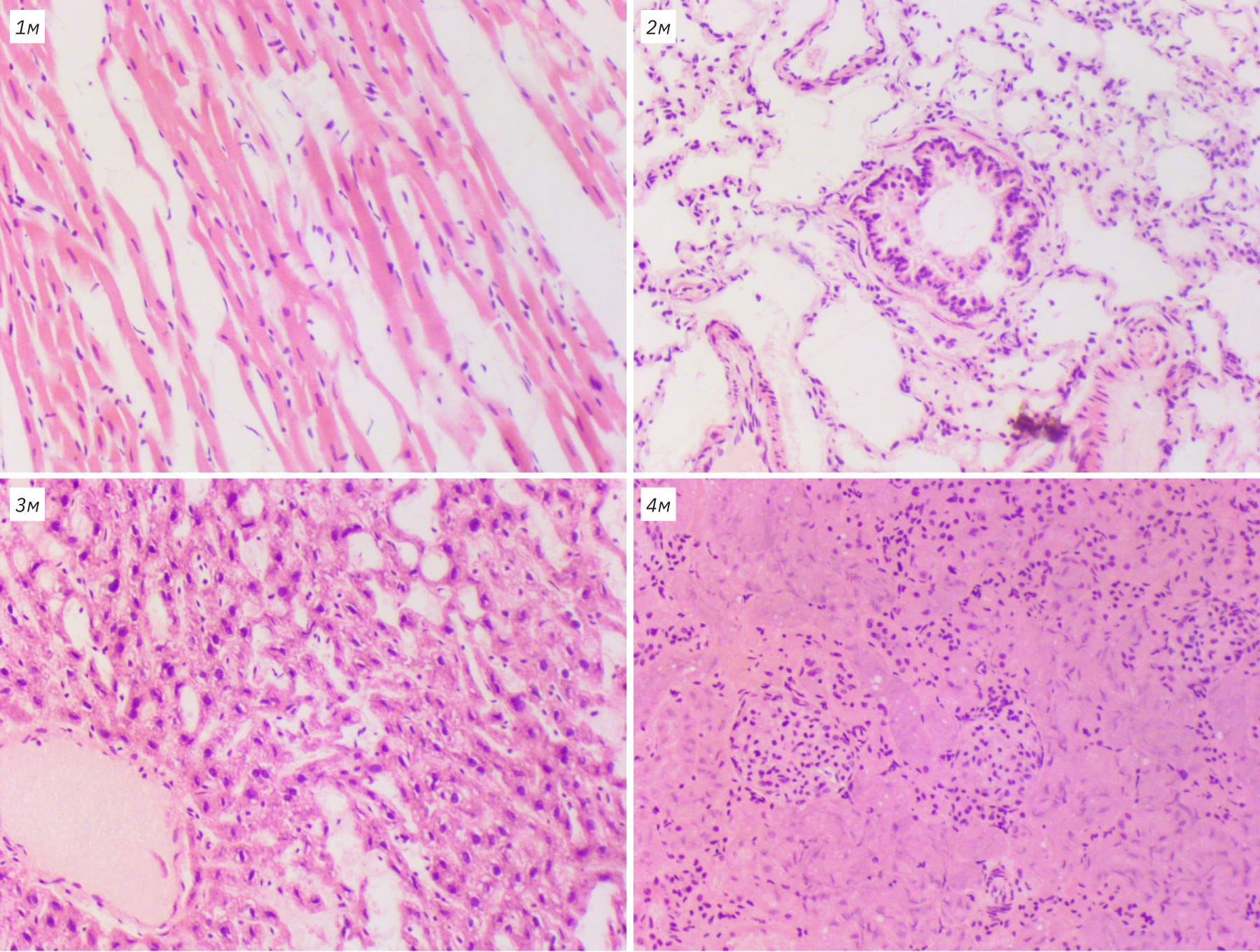
У животных всех исследованных видов первые микроскопические изменения можно было наблюдать в кишечнике. Аутолизу прежде всего подвергался покровный эпителий кишки, уже через 18 ч можно было наблюдать его десквамацию. При этом претерпевали изменения эпителиальные клетки, их клеточная стенка становилась нечеткой, цитоплазма мутнела, ядра уплотнялись и приобретали интенсивную окраску гематоксилином. Процесс разрушения с течением времени распространялся на нижележащие железистые структуры, а отдельные очаги сливались. Через 72 ч аутолиз затрагивал стенку кишки на всем протяжении, а структуру органа можно было определить только по отдельным элементам.
Ранние аутолитические изменения можно было наблюдать в ткани поджелудочной железы. Процесс развивался постепенно от экзокринной части железы, от более крупных протоков к более мелким. Клетки быстро разрушались, окраска ядер становилась интенсивно базофильной, контуры клеток размыты. С течением времени распад затрагивал экзокринную часть, хотя даже через 3 сут при комнатной температуре можно было выявить отдельные различимые панкреатические островки среди гомогенной массы, соединительнотканных элементов стромы и сосудов.
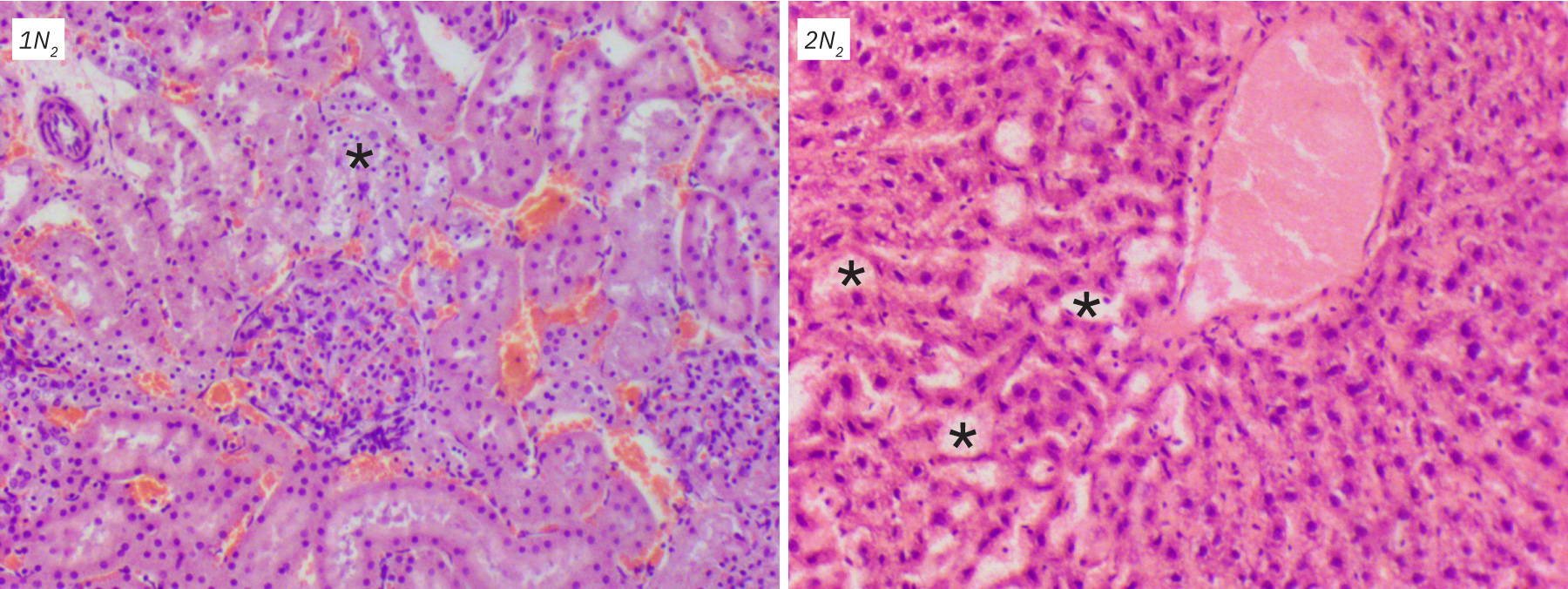
В почках прежде всего распад затрагивал эпителий извитых канальцев преимущественно в проксимальных отделах. Контуры клеток становились размытыми за счет отека и мелкой вакуолизации, цитоплазма мутнела, приобретала зернистый вид. Наблюдался распространяющийся кариопикноз, а затем кариорексис и лизис с потерей окрашиваемости. Просвет канальцев визуально увеличивался, в нем определялись аморфные зернистые массы. Клубочки были подвержены разрушению позднее, их структура оказалась более устойчива – только к 72 ч от них оставался контур. В нижележащих отделах (собирательные трубочки и лоханка) довольно рано можно было наблюдать отслоение эпителия от базальной мембраны.
В ткани печени гепатоциты как и большинство клеток претерпевали стадийные изменения. Вначале можно было наблюдать их набухание, цитоплазма приобретала зернистый вид, появлялись размытые вакуоли, и постепенно контуры клеток расплывались. Ядра, вначале слегка увеличенные, быстро уменьшались в размерах, подвергаясь лизису. Общая структура ткани сохранялась долго, но, начиная с периферии органа, постепенно теряла ровное балочное строение, которое через 72 ч только угадывалось за счет сохраненной стромы и сосудов.
Ранними проявлениями аутолиза в легких можно считать десквамацию эпителия бронхов, постепенно в их просвете скапливалась гомогенная масса, состоящая из остатков эпителия, а крупные бронхи оказывались полностью лишены эпителия. В респираторном отделе наблюдали усиливающийся отек межальвеолярных перегородок, выход жидкости, белка и эритроцитов в просвет альвеол, от чего через 36–72 ч легкие приобретали буро-розовый ячеистый вид с большим количеством формалинового пигмента.
Ткань сердца была наиболее устойчива к аутолитическим процессам. Ранним проявлением являлось усиление окраски кардиомиоцитов. Постепенно отдельные клетки набухали, вакуолизировались, полосчатый рисунок размывался, а ядра уплотнялись. При этом данные изменения имели очаговый характер и даже через 72 ч структура клеток и строение всей ткани были довольно отчетливы.
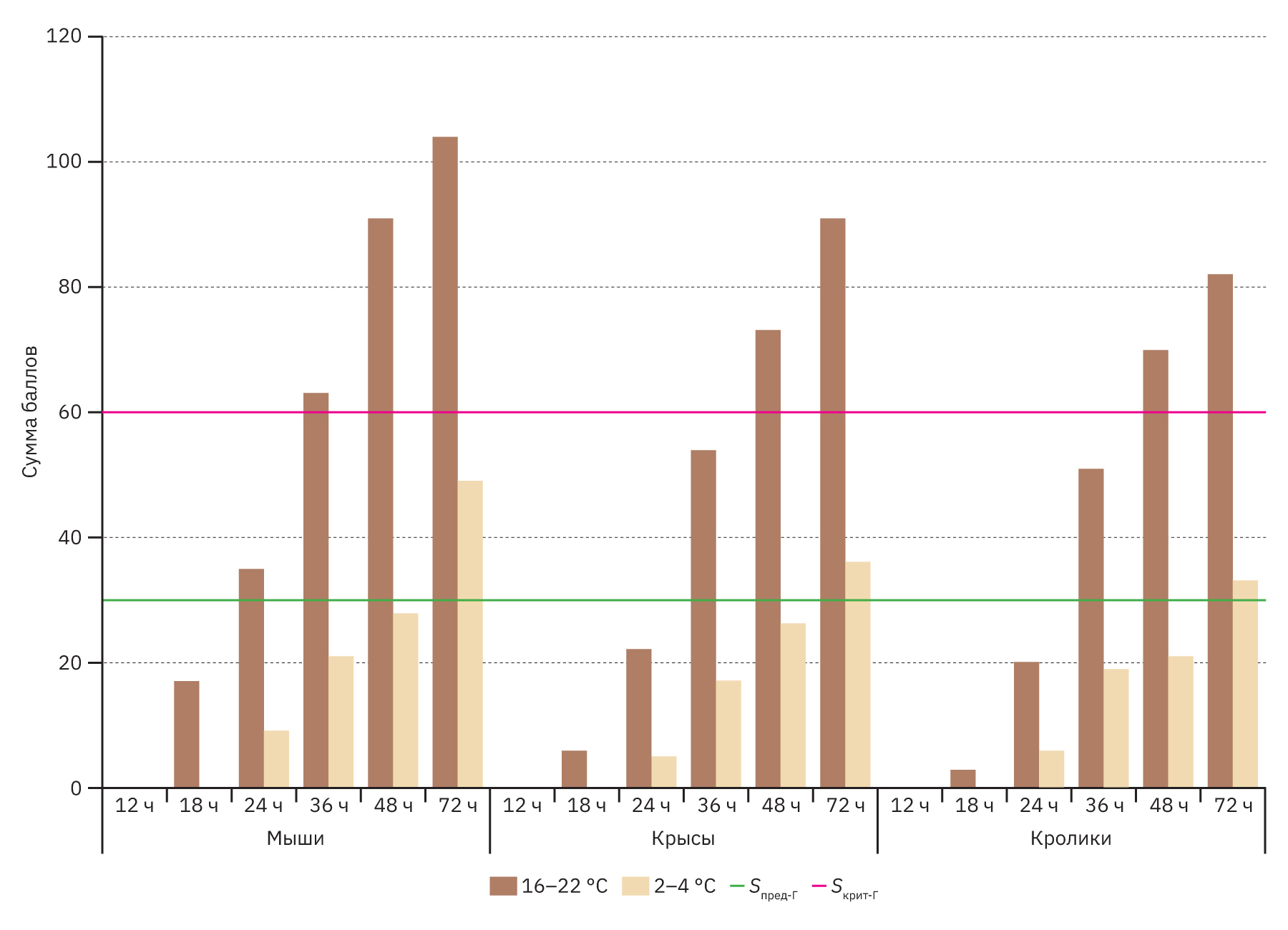
Как видно на рис. 2, при хранении трупов при комнатной температуре гистологическое исследование совершенно неинформативно уже через 36 ч в тканях мышей и через 48 ч в тканях крыс и кроликов. Однако при нахождении тел при температуре 2–4°С аутолитические процессы развиваются значительно медленнее: к 72 ч общий показатель аутолиза (Sобщ) только пересекал условную предельную границу, но так и не достигал критического порога, т.е. микроскопическое исследование в указанной временной точке возможно, хотя его информативность будет несколько снижена.
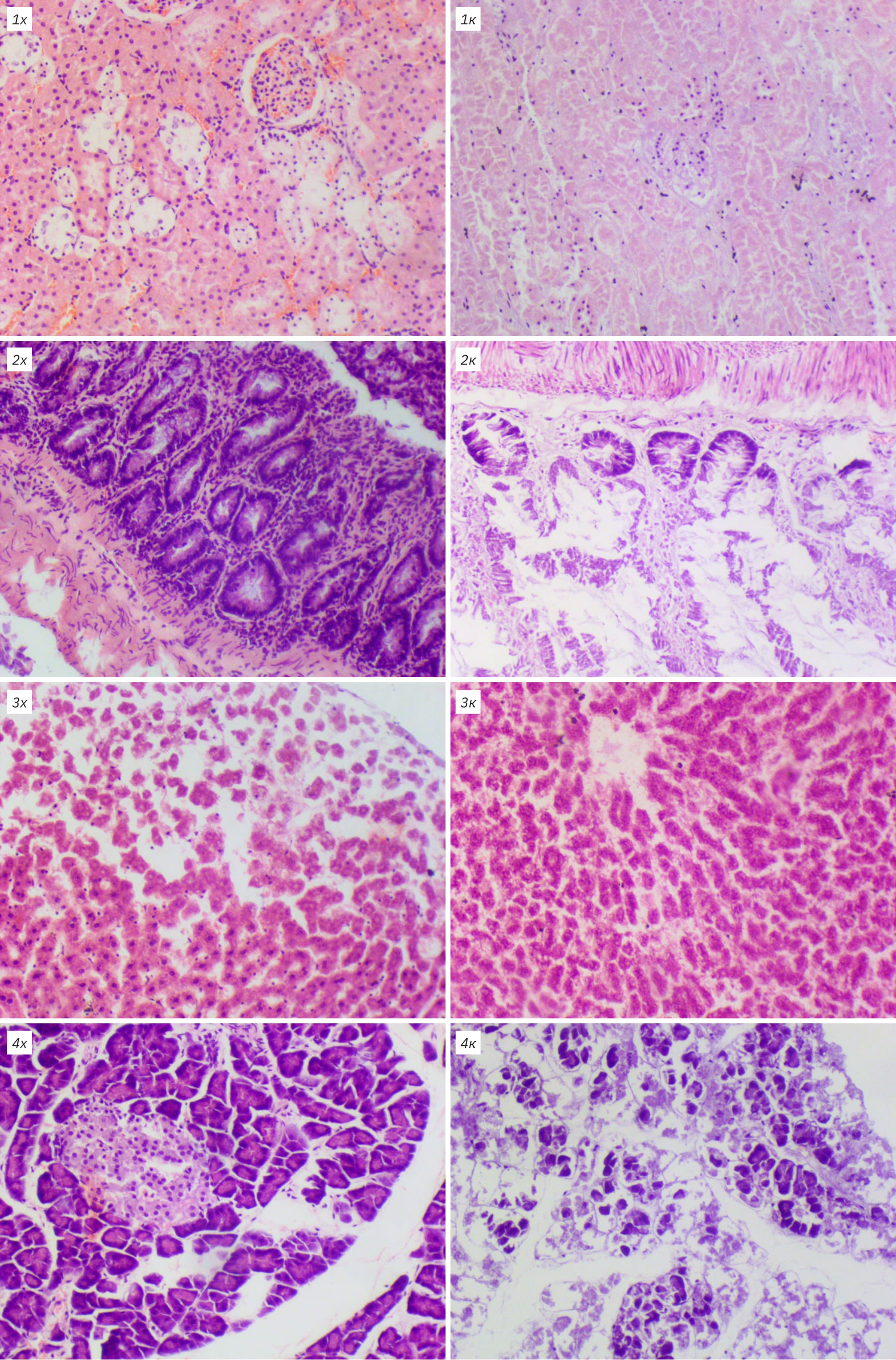
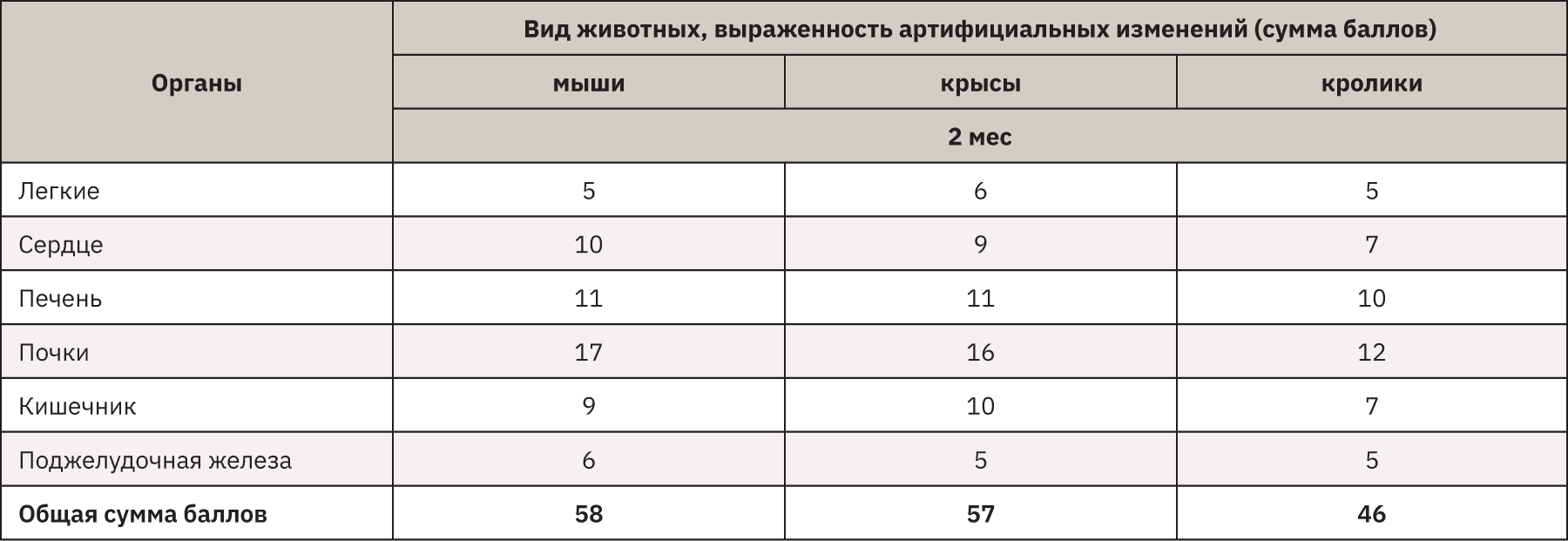
Отдельно стоит охарактеризовать изменения в результате хранения органов при -20оС на протяжении 2 мес. В тканях было отмечено появление разрывов и пустот. Особенно это касалось ткани печени и почек, где, помимо нарушения архитектоники, значительно страдали и клетки органов. Часть из них была полностью разрушена, у части ядра вакуолизированы, пикнотичны и деформированы. Данные изменения обусловлены не аутолизом, а физическими процессами замораживания и размораживания трупов, в результате которых жидкость, как внутриклеточная, так внеклеточная, сначала образует кристаллы, затем при таянии разрывает структуры и клетки [16, 17]. Поскольку такие повреждения нельзя рассматривать как посмертные, степень их выраженности оценивали субъективно, исходя из возможности микроскопического анализа срезов. Была применена балльная шкала: от 0 – нет изменений до 4 – выраженное нарушение архитектоники ткани на большом протяжении, а диагностика крайне затруднена.
Таким образом, в результате исследования было выявлено оптимальное время, в течение которого возможно проведение патоморфологического изучения трупов лабораторных животных после незапланированной гибели без потери или с минимальной потерей информативности при различных условиях их хранения.
Быстрее всего трупные явления возникают при нахождении тел животных при комнатной температуре. У мышей процессы аутолиза, протекая быстрее, чем у других видов, начинали развиваться уже через 18 ч после смерти, а к 72 ч становились катастрофическими, в результате чего диагностика патологических состояний, которые могли бы быть у животных, практически невозможна. То же самое относится и к микроскопическому строению их тканей. Процессы разложения, начавшиеся сразу после смерти животных, приводили к разрушению клеток и структур, в результате чего при комнатной температуре уже через 2,5 сут гистологическое исследование органов мышей было почти неинформативным. В то же время у более крупных животных – крыс и кроликов развитие трупных изменений несколько задерживалось, поэтому через 3 сут при температуре 16–22°С макроскопическая диагностика была еще возможна, хоть и не полноценна, однако при этом микроскопический анализ был неприемлем уже через 48 ч.
При хранении тел в холодильной камере при температуре 2–4°С процессы разложения протекали значительно медленнее. Это позволяло провести макроскопическое и микроскопическое исследование трупов животных через 3 сут без существенной потери данных.
В табл. 6 представлена зависимость качества гистологического материала от времени, прошедшего между смертью животного и вскрытием, при хранении тел в условиях холодильной камеры (2–4°С). При составлении данной таблицы по полученным суммарным баллам (Sобщ) в программе статистического анализа Prism были рассчитаны уравнения аппроксимации для каждого вида животных (табл. 7), что позволило вычислить Sобщ для временных точек 60 и 80 ч. Полученные значения являются приблизительными, поскольку в действительности процессы разложения зависят от многих неучтенных в данном случае факторов.


Отдельно стоит рассматривать хранение трупов при температуре -20°С. Макроскопически строение органов никак не изменялось, любые патологические состояния, видимые глазом, могли быть легко дифференцированы после размораживания тел. Однако при данном способе сильно страдала микроструктура, особенно органов, насыщенных водой (почки и печень), зная данную особенность и принимая во внимание артифициальные изменения, гистолог мог бы провести исследование, хоть и с некоторой потерей достоверности. Стоит заметить, что лучшую сохранность отдельных органов обеспечивает «шоковая» заморозка в жидком азоте (рис. 5) – метод, который не только допустим, но даже является золотым стандартом при проведении иммуногистохимических исследований [18], но он труден технически, поскольку требует специального оборудования.
Заключение
В представленной работе описаны посмертные изменения для отдельных видов лабораторных животных – мышь, крыса, кролик. Обоснованы оптимальные условия хранения трупов, определены временные периоды, когда можно отложить процедуру некропсии при условии сохранения качества материала. По результатам проведенного исследования можно сказать следующее.
- При внеплановой гибели лабораторных животных и невозможности проведения патоморфологического исследования в данный момент, все обнаруженные тела должны быть немедленно помещены в холодильную камеру с температурой около 2–4°С.
- Полноценное патоморфологическое исследование может быть проведено в течение 18 ч после смерти рассмотренных видов животных. Допустимо увеличить посмертный интервал до 60 ч с незначительной потерей качества исследования.
- Для сокращения времени между смертью и обнаружением умершего животного необходимо проводить осмотр места содержания животных с интервалом минимум 4–6 ч в течение рабочего дня, с обязательным обходом в начале и в конце 8-часовой смены.
- Замораживание трупов животных допустимо, но является крайней мерой, применяемой, если известно, что проведение патоморфологического исследования невозможно в ближайшие 48–60 ч.
- Сохранение тканей, используя жидкий азот, целесообразно для последующего выполнения специализированного исследования, например, иммуногистохимического, но необходимо учитывать, что данный метод потребует наличие специального оборудования, а также отработку протокола проведения манипуляций.
Вклад авторов
Гущин Я.А. – идея, концепция и дизайн исследования, написание и редактирование текста статьи, работа с литературными источниками.
Беляева Е.В. – проведение гистологического исследования, сбор и систематизация материала, составление таблиц.
Устенко Ж.Ю. – проведение некропсии, описание результатов макроскопического исследования
Сведения о конфликте интересов
Авторы заявляют об отсутствии конфликта интересов.
Список источников
- Brooks J.W. Postmortem Changes in Animal Carcasses and Estimation of the Postmortem Interval // Vet Pathol. –2016. – Vol. 53(5). – P 929-940. doi: 10.1177/0300985816629720
- Tavichakorntrakool R., Prasongwattana V., Sriboonlue P., Puapairoj A., Pongskul J., Khuntikeo N., Hanpanich W., Yenchitsomanus P., Wongkham C., Thongboonkerd V. // Serial analyses of postmortem changes in human skeletal muscle: a case study of alterations in proteome profile, histology, electrolyte contents, water composition, and enzyme activity. – 2008. – Vol. 2(9). – P. 1255-1264. doi: 10.1002/prca.200800051.
- Пермяков А.В., Витср В.И., Неволин Н.И. Судебно-медицинская гистология. Руководство для врачей. (Издание второе, переработанное и дополненное). – Ижевск-Екатеринбург; Экспертиза, 2003. – 214 с. [Permyakov A.V., Vitsr V.I., Nevolin N.I. Sudebno-meditsinskaya gistologiya. Rukovodstvo dlya vrachei. (Izdanie vtoroe, pererabotannoe i dopolnennoe). – Izhevsk-Ekaterinburg; Ehkspertiza, 2003. – 214 p. (In Russ).].
- Dettmeyer RB. Forensic histopathology: fundamentals and perspectives. Berlin Heidelberg: Springer-Verlag; 2011. doi:10.1007/978-3-319-77997-3
- Elmore S. Apoptosis: a review of programmed cell death // Toxicologic Pathology. – 2007. – Vol. 35. – P. 495-516 doi: 10.1080/01926230701320337.
- Henssge C., Madea B. Estimation of the time since death // Forensic Sci Int. – 2007. – Vol. 165. – P. 182-184. doi:10.1016/j.forsciint
- Madea B. Methods for determining time of death // Forensic Sci Med Pathol. – 2016. – Vol. 12. – P. 451-485. doi: 10.1007/s12024-016-9776-y
- Elizabeth F. McInnes, Editor Background Lesions in Laboratory Animals: A Color Atlas, Edinburgh: Saunders (Elsevier), 2011, 256 pp
- Roe W.D., Gartrell B.D., Hunter S.A. Freezing and thawing of pinniped carcasses results in artefacts that resemble traumatic lesions // Vet J. – 2012. – Vol. 194(3). – P. 326-31. doi: 10.1016/j.tvjl.2012.03.028
- Shi S.R., Liu C., Pootrakul L., Tang L., Young A., Chen R., Cote R.J., Taylor C.R. Evaluation of the value of frozen tissue section used as "gold standard" for immunohistochemistry // Am J Clin Pathol. – 2008. – Vol. 129(3). – P. 358-366. doi: 10.1309/7CXUYXT23E5AL8KQ
- Gebhart F.T., Brogdon B.G., Zech W.D., Thali M.J., Germerott T. Gas at postmortem computed tomography an evaluation of 73 non-putrefied trauma and non-trauma cases // Forensic Sci Int. – 2012. – Vol. 10; 222(1-3). – P. 162-169. doi: 10.1016/j.forsciint.2012.05.020.
- Cross R.F., Kohler E.M. Autolytic changes in the digestive system of germfree, escherichia coli monocontaminated, and conventional baby pigs // Can J Comp Med. – 1969. – Vol. 33(2). – P. 108-12.
- Cocariu E.A., Mageriu V., Stăniceanu F., Bastian A., Socoliuc C., Zurac S. Correlations Between the Autolytic Changes and Postmortem Interval in Refrigerated Cadavers // Rom J Intern Med. – 2016. – Vol. 54(2). – P. 105-12. doi: 10.1515/rjim-2016-0012.
- Tomita Y., Nihira M., Ohno Y., Sato S. Ultrastructural changes during in situ early postmortem autolysis in kidney, pancreas, liver, heart and skeletal muscle of rats // Leg Med (Tokyo). – 2004. – Vol. 6 (1). – P. 25-31. doi: 10.1016/j.legalmed.2003.09.001.
- Zissler A., Stoiber W., Steinbacher P., Geissenberger J., Monticelli F.C., Pittner S. Postmortem Protein Degradation as a Tool to Estimate the PMI: A Systematic Review // Diagnostics (Basel). – 2020. – Vol. 10(12). – P 1014. Published 2020 Nov 26. doi:10.3390/diagnostics10121014
- Решение Совета ЕЭК №89 «Об утверждении правил проведения исследований биологических лекарственных средств Евразийского экономического союза» от 03.11.2016 URL: http://www.eurasiancommission.org/ru/Lists/Decisions/DispForm.aspx?ID=2686 (дата обращения 09.2021)
- Рекомендация Коллегии ЕЭК от 21.05.2020 № 10 "О Руководстве по проведению доклинических исследований токсичности при повторном (многократном) введении действующих веществ лекарственных препаратов для медицинского применения" URL: http://www.eurasiancommission.org/ru/Lists/Decisions/DispForm.aspx?ID=4384 (дата обращения 09.2021 г)
- Решение Совета Евразийской экономической комиссии от 03.11.2016 N 78 (ред. от 23.04.2021) "О Правилах регистрации и экспертизы лекарственных средств для медицинского применения" URL: https://docs.eaeunion.org/docs/ru-ru/01411969/cncd_21112016_78 (дата обращения 09.2021 г.)



