Применение ингаляционной анестезии в доклинических исследованиях
Макарова М.Н. Применение ингаляционной анестезии в доклинических исследованиях. Лабораторные животные для научных исследований. 2020; 4. https://doi.org/10.29296/2618723X-2020-04-02
Резюме
Использование ингаляционной анестезии для наркотизации и оксигенации лабораторных животных сегодня применяется все шире, поскольку позволяет обеспечивать хорошо контролируемый наркоз. Важным аспектом применения ингаляционного наркоза является его доступность для исследовательских центров, в отличие от ряда инъекционных средств для наркоза, ограниченных к применению в Российской Федерации. Основные достоинства ингаляционного наркоза в доклинических исследованиях – высокая управляемость (возможность изменять глубину наркоза, длительного поддержания анестезии и быстрого пробуждения пациента), сочетание подачи анестетика с проведением искусственной вентиляции легких, т.е. управлением газообменом, хорошая сочетаемость с другими препаратами для общей анестезии и обеспечения прочих компонентов анестезиологического протокола.
Статья представляет собой обзор литературы. В ней рассмотрены подходы к расчету расхода ингаляционных анестетиков (севофлуран, десфлуран, изофлуран). Освещены механизм действия, взаимодействие, фармакологические эффекты, а также нежелательные реакции анестетиков. Рассмотрены вопросы фармакологической безопасности, описаны эффекты ингаляционных анестетиков на сердечно-сосудистую, дыхательную и центральную нервную системы. Представлена информация об особенностях наркотизации некоторых видов лабораторных животных (мышь, крыса, кролик, хорек, кошка, мини-пиг). На примере мини-пигов описано влияние комбинации препаратов на физиологические параметры в зависимости от длительности анестезии. Отдельное внимание уделено безопасности оператора при проведении анестезии. Обеспечение безопасности касается воздействия анестезирующих газов, обращения с газовыми баллонами и возможного злоупотребления лекарственными препаратами.
Представленные в обзоре данные литературы демонстрируют целесообразность разработки эффективных способов наркотизации с использованием одного препарата или комбинации препаратов в каждом испытательном центре, создание стандартных схем и протоколов анестезиологического обеспечения с конкретным режимом дозирования лекарственных средств для достижения легкой, умеренной и глубокой степени наркоза для разных видов животных. Указывается на необходимость оценки изменения биохимических показателей и физиологических параметров при проведении анестезии у лабораторных животных.
Введение
Ингаляционная анестезия может использоваться для животных большинства видов и разного возраста. Ее преимуществами являются быстрая индукция и хорошее восстановление после наркоза, оптимальный контроль наркоза и стабильные физиологические эффекты по сравнению с большинством инъекционных анестетиков. Ввиду минимального метаболизма большинства современных ингаляционных средств для наркоза они с меньшей вероятностью оказывают влияние на показатели, оцениваемые в исследовании [1, 2].
Недостатки ингаляционной анестезии – высокая стоимость и необходимость в очистных системах вентиляции, а также необходимость высокой технической компетентности персонала. Самый безопасный способ введения средств для наркоза – использование наркозного аппарата. С помощью испарителя средство для наркоза поступает в организм животных в точно заданной концентрации. Для процедур, которые занимают незначительное время, у мелких лабораторных животных можно использовать простую ингаляционную камеру, но в этом случае требуется осторожность, поскольку при открытии камеры может создаваться высокая концентрация паров анестетика в зоне дыхания оператора.
Анестезирующие средства доставляются к животному с помощью газа-носителя. В качестве такого газа-носителя может выступать медицинский кислород, но результатом этого будет высокий уровень кислорода в артериальной крови. Кислород в смеси с воздухом или закисью азота (N2O) поддерживает в организме животных физиологический уровень артериального кислорода. Закись азота также способствует развитию аналгезирующего действия без угнетения дыхания и позволяет снизить расход анестетика на 20–50%. При этом угнетение сердечно-сосудистой системы, характерное для применения ингаляционных средств для наркоза, резко снижается.
Поступление средств для наркоза может быть достигнуто с помощью ингаляционной камеры или маски, подобранной по размеру животного. Ингаляционная камера чаще применяется для грызунов и других мелких животных, которые слабо приучены к взаимодействию с человеком. Маска должна использоваться только для животных, которые привыкли к манипуляциям и оператору. Анестезию осуществляют, удерживая маску на животном, или газ вводят через эндотрахеальную трубку.
В данном обзоре предпринята попытка систематизировать основные механизмы действия ингаляционных анестетиков и закиси азота и рассмотреть их применение в исследованиях на лабораторных животных.
Расчет расхода анестетика
Расход препаратов для ингаляционной анестезии, таких как севофлуран, десфлуран и изофлуран, зависит от продолжительности анестезии, потока свежего газа и концентрации препарата в дыхательном контуре. Упрощенная формула для расчета расхода анестетика, предложенная J. Ehrenwerth и J. Eisenkraft в 1993 г., выглядит следующим образом [3]:
3 • FGF • об.% = расход анестетика (мл/ч),
где: 3 – коэффициент, FGF – fresh gas flow (поток свежего газа), л/мин, об.% – объемный процент на испарителе.
Эта формула расхода анестетика подходит для быстрого и приблизительного расчета.
Примеры среднего расхода анестетика при общей анестезии для:
- севофлурана — 3 • 1 • 4 = 12 мл/ч;
- десфлурана — 3 • 1 • 8 = 24 мл/ч;
- изофлурана — 3 • 1 • 2= 6 мл/ч.
Существует более сложная формула расхода анестетика, но при этом и наиболее точная:
расход анестетика (в мл) = (FGF • С • T) / (const • 100),
где: FGF – средний поток свежего газа, мл/мин; С – средняя концентрация анестетика, об.%; T – продолжительность анестезии, мин; const – константа анестетика (объем пара): севофлуран 184 мл, десфлуран 210 мл, изофлуран 195 мл.
Минимальная альвеолярная концентрация
Минимальная альвеолярная концентрация (МАК) используется как показатель эффективности ингаляционного анестетика и представляет собой концентрацию анестетика, которая вызывает неподвижность у 50% животных одного вида и соответствует легкой степени анестезии.
МАК одинакова для животных одного вида и колеблется в диапазоне от 10 до 20% между разными видами животных [4]. Чтобы достоверно достичь адекватной/средней глубины анестезии у 95% животных необходимо использовать 1,5 МАК. Для достижения глубокого наркоза используют 2,0 МАК, однако такая же доза может вызвать и передозировку [5]. При этом МАК снижается с возрастом животного, а самые высокие значения обнаруживаются у новорожденных. Премедикация опиоидами, α2-агонистами или транквилизаторами снижает МАК. Высокое значение МАК для N2O у животных указывает на то, что анестезию нельзя поддерживать одним N2O. Закись азота более эффективна для человека (МАК 104%) (табл. 1).
Механизм действия ингаляционных средств для анестезии
Закись азота. Закись азота (N2O) была открыта в 1793 г. английским ученым Джозефом Пристли. Закись азота нашла научное применение в качестве анестетика в клинической стоматологии и медицине в начале 1840-х годов. Горацию Уэллсу, американскому дантисту, удалили один зуб после вдыхания N2O – и это была первая демонстрация клинической анестезии. Затем последовал период широкого клинического использования N2O для стоматологической анестезии, за которым, к сожалению, – период отказа, когда было признано, что высокие концентрации, необходимые для анестезии, часто подвергали пациента риску тяжелой гипоксии и даже приводили к смерти от асфиксии. Хотя за последние 150 лет конкретный способ использования N2O значительно изменился, все же он по прежнему чаще других анестетиков применяется в стоматологии.
Сегодня медицинское применение N2O включает сбалансированную анестезию во время операции, при которой N2O часто сочетается с другими препаратами и в экстренных ситуациях. Закись азота также используется для подготовки водолазов к глубоким погружениям, потому что состояние имитирует дезориентацию и поведенческие изменения при декомпрессионной болезни.
Низкие концентрации N2O вызывают только анальгетический и анксиолитический эффекты без потери сознания. Как анальгетическое средство N2O давно используется в акушерстве для облегчения боли при родах. Закись азота также применяется для самостоятельного обезболивания онкологическими больными с целью облегчения боли и дискомфорта, связанных с рядом медицинских процедур, включая внутрисуставные инъекции, ректороманоскопию, колоноскопию, офтальмологические процедуры и взятие материала для биопсии. В Европе смесь 50% N2O : 50% О2 широко используется при неотложной медицинской помощи пациентам в местах происшествий и при их транспортировке.
Механизм анальгетического действия закиси азота. Механизм аналгезии N2O рассматривается как антиноцицептивное действие N2O на животных. Поскольку животные не могут сообщать об уменьшении болевых ощущений, обезболивание более точно определяется у животных как антиноцицепция или снижение реакции на раздражитель.
Опиоидная гипотеза антиноцицептивного действия N2O. Еще в 1943 г. полагали, что обезболивающий эффект N2O был сопоставимым с анальгетическим действием опиоидных анальгетиков, примерно 30% N2O считался столь же эффективным, как и 10–15 мг морфина. В середине 1970-х годов впервые продемонстрирована индуцированная N2O антиноцицепция у мышей и крыс, чувствительная к блокаде наркотическим антагонистом налоксоном [7, 8].
Индуцированная N2O аналгезия у людей также блокировалась налоксоном [9, 10]. Эта гипотеза была дополнительно подтверждена сообщениями о животных, нечувствительных к морфину, имеющих перекрестную толерантность к N2O [8, 11].
Факт, что перекрестная толерантность была односторонней (устойчивые к N2O животные не были перекрестно толерантными к морфину), привел B.A. Berkowitz и соавт. [11] к мысли, что N2O может оказывать фармакологическое действие через стимуляцию нейронного высвобождения эндогенных опиоидных пептидов. Опиоидный пептид, высвобождаемый N2O, идентифицирован как динорфин [12, 13].
Длительное лечение морфином приводит к десенситизации опиоидных рецепторов и/или механизмов передачи сигнала, что способствует перекрестной толерантности к N2O и зависит от тех же опиоидных рецепторов. При постоянном лечении с использованием N2O развивается толерантность, связанная с чрезмерным истощением запасов эндогенных опиоидных пептидов, так что последующее воздействие N2O не может высвободить достаточные количества опиоидных пептидов, чтобы вызвать антиноцицепцию [14].
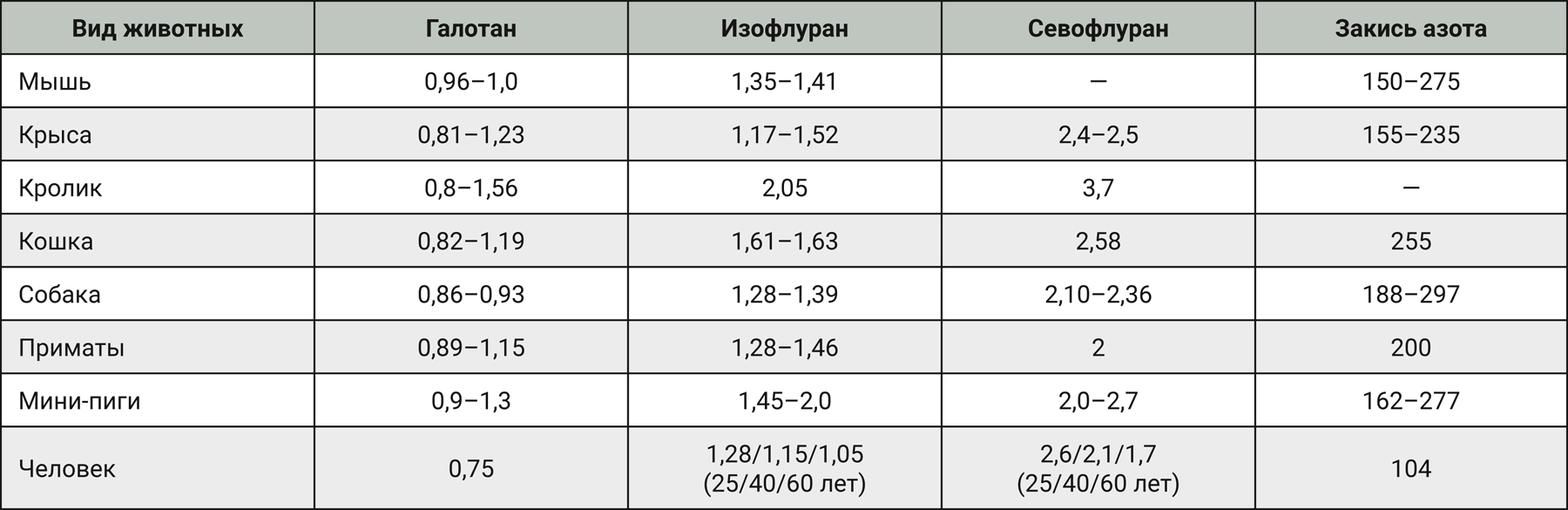
Участие оксида азота в антиноцицепции N2O. Оксид азота (NO) – эндогенный биологический регулятор. Антиноцицепция N2O вызывает дозозависимый антагонизм с помощью ряда аналогов L-аргинина, которые конкурентно ингибируют NO-синтазу (NOS). Оксид азота также играет ключевую роль в высвобождении опиоидного пептида. В экспериментах показано, что NO вызывает высвобождение эндогенных опиатов (динорфин), играющих посредническую роль в антиноцицептивном эффекте N2O. Расположение нервных окончаний, из которых высвобождается динорфин, и опиоидных рецепторов не определено [14]. Схема участия NO в антиноцицепции N2O представлена на рис. 1.
Примечание. DYN – динорфин, NOS – синтаза оксида азота, NO – оксид азота
Считается, что N2O стимулирует высвобождение нейронами эндогенных опиоидных пептидов динорфинов (DYNs); молекулярные аспекты того, как N2O инициирует этот процесс, пока неизвестны. Пресинаптическое нервное окончание за счет фермента синтазы оксида азота (NOS) участвует в образовании NO. Оксид азота, по-видимому, участвует в высвобождении DYN. Динорфин пересекает синаптическую щель и активирует постсинаптические опиоидные рецепторы.
Нисходящие пути, активируемые N2O. М. Fujinaga и М. Maze [15] предположили, что высвобождение эндогенных опиоидных пептидов и последующая стимуляция опиоидных рецепторов активируют нисходящие пути, которые модулируют ноцицептивную обработку в спинном мозге.
Норадренергический путь – самый важный нисходящий путь, тем не менее он находится под тоническим ингибированием γ-аминомасляной кислотой – ГАМКергическим путем. Стимуляция опиоидных рецепторов опиоидными пептидами, высвобождаемыми N2O, ингибирует ГАМКергический путь, вызывая таким образом растормаживание нисходящего норадренергического пути. Расторможенный норадренергический путь, по-видимому, модулирует ноцицептивную обработку спинного мозга. Закись азота индуцирует высвобождение эндогенных опиоидных пептидов, которые активируют опиоидные рецепторы на γ-аминомасляной кислоте – ГАМКергических ядрах моста. Этот путь в свою очередь активирует нисходящую норадренергическую систему в заднем роге спинного мозга, которая прямо или косвенно подавляет ноцицептивную обработку на уровне первичных афферентных нейронов и нейронов второго порядка, передающих сенсорные сигналы вверх – восходящий ноцицептивный путь.
Толерантность к антиноцицепции N2O. Как и в случае со многими центрально-опосредованными эффектами лекарств, непрерывное введение N2O приводит к развитию толерантности к антиноцицептивному эффекту N2O у экспериментальных животных [16] и к анальгетическому эффекту N2O у людей [17].
Исследование развития толерантности к N2O на различных линиях крыс показало, что линия крыс Fischer демонстрирует стойкий антиноцицептивный ответ на использование N2O, но не проявляет острой толерантности, тогда как линия крыс Lewis плохо реагирует на индуцированную N2O антиноцицепцию [18]. Помимо отличающейся чувствительности к N2O, у крыс Fisher и Lewis также различные нейрохимические и поведенческие реакции на другие препараты центрального действия [19, 20]. По сравнению с крысами Fisher слабореагирующая линия Lewis имеет более низкие базальные уровни эндогенных опиоидных пептидов, поэтому у крыс этой линии уровень опиоидных пептидов не повышается после введения морфина [20]. Это также согласуется с выводами о том, что поддержание высоких уровней опиоидного пептида за счет ингибирования фермента энкефалиназы может предотвратить развитие острой толерантности к N2O у крыс [21].
Механизм анксиолитического действия закиси азота. Имеются данные, что снижение беспокойства при вдыхании N2O является специфическим анксиолитическим действием, не зависящим от анальгетического эффекта N2O. При этом задействованные механизмы еще полностью не изучены.
Установлено, что N2O вызывает паттерны поведенческой реакции, напоминающие эффекты бензодиазепинов [14]. Рецепторы ГАМК опосредуют анксиолитическое действие, вызываемое хлордиазепоксидом и активацией N2O бензодиазепиновых рецепторов.
Исследования в приподнятом крестообразном лабиринте показали, что повышенная активность в открытом рукаве, вызываемая N2O и хлордиазепоксидом, блокируется неселективным ингибитором NOS, и это антагонистическое действие прекращается под влиянием L-аргинина [22, 23]. Также в экспериментах анксиолитическое действие N2O блокируется ингибитором гуанилилциклазы [24].
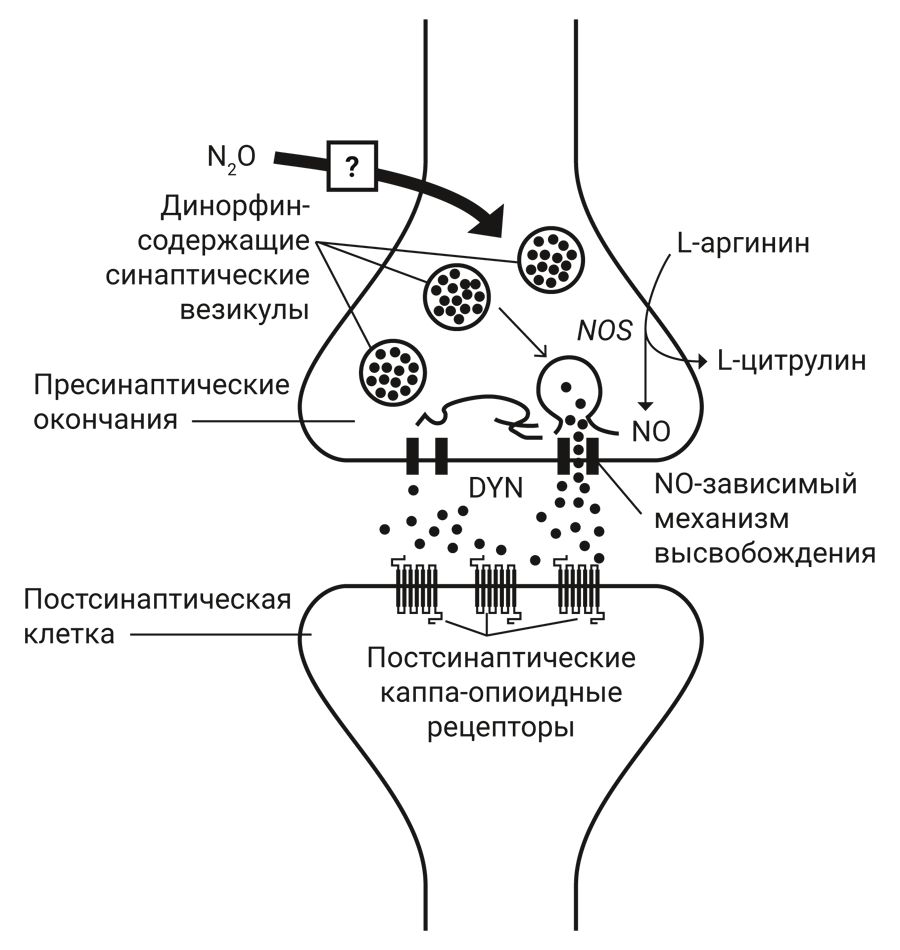
Известно, что цГМФ действует на несколько различных мишеней: цГМФ-зависимые протеинкиназы (PKG), цГМФ-зависимые катионные каналы или цГМФ-регулируемая фосфодиэстераза [25]. Анксиолитическое действие, индуцированное N2O, значительно ослабляется ингибиторами PKG [24] (рис. 2).
Примечание. BZ – бензодиазепин, GABA – γ-аминомасляная кислота, CaM – кальмодулин, NOS – синтаза оксида азота, PKG – GMP-зависимая протеинкиназа
Считается, что N2O вызывает активацию сайта связывания бензодиазепина (BZ). Это действие способствует активации сайта связывания γ-аминомасляной кислоты (ГАМК, GABA), что приводит к притоку хлорид-ионов в нейрон. Повышенная концентрация хлорид-иона в нейроне может вызвать активацию кальмодулина (CaM), который затем активирует фермент синтазу оксида азота (NOS). NOS обеспечивает образование NO, который стимулирует гуанилилциклазу, продуцирующую вторичный мессенджер циклический гуанозинмонофосфат (циклический GMP). Циклический GMP, в свою очередь, стимулирует циклическую GMP-зависимую протеинкиназу (PKG), которая приводит к анксиолитическому эффекту закиси азота.
Механизм анестезии при применении закиси азота. Из-за низкой активности в клинической практике N2O обычно используется для снижения минимальной альвеолярной концентрации второго ингаляционного агента для анестезии и увеличения скорости индукции (т.е. эффект второго газа [26]), а также для обеспечения или усиления обезболивающего компонента общей анестезии.
Долгое время предполагалось, что общие анестетики (например, N2O) действуют неспецифическим образом на мембраны нейронов, изменяют текучесть мембран и/или влияют на ионные каналы. Однако в дальнейшем было высказано предположение, что общие анестетики могут действовать на одно или несколько суперсемейств ионных каналов, управляемых лигандами, которые включают ГАМК, рецепторы глицина, никотинового ацетилхолина, 5-гидрокситриптамина и глутамата [27].
Рецепторы глутамата N-метил-D-аспартата (NMDA) также являются возможной мишенью для ингаляционных анестетиков. Подобно другим антагонистам NMDA, нейротоксический эффект N2O зависит от возраста и чувствителен к аттенуации ГАМКергическими препаратами [28, 29].
Предполагается, что общее свойство антагонизма рецептора NMDA может лежать в основе схожих фармакологических профилей N2O и кетамина. Фактически при совместном применении эти два препарата вызывают синергетическую нейротоксичность [30].
Механизмы действия ингаляционных анестетиков
Современные ингаляционные анестетики – это галогенированные углеводороды (галотан), галогенированные простые эфиры (изо-, дез-, эн-, севофлуран). Химические формулы представлены на рис. 3.
Все современные ингаляционные анестетики (галотан, изофлуран, энфлуран и др.) схожи по структуре и имеют идентичный механизм действия. Основной механизм их действия – усиление ингибирующего эффекта ГАМК путем взаимодействия с рецепторами ГАМК центральной нервной системы [31–35].
Полагают, что ингаляционные анестетики влияют на аллостерические центры ряда рецепторов, сопряженных с ионными каналами (рис. 4).
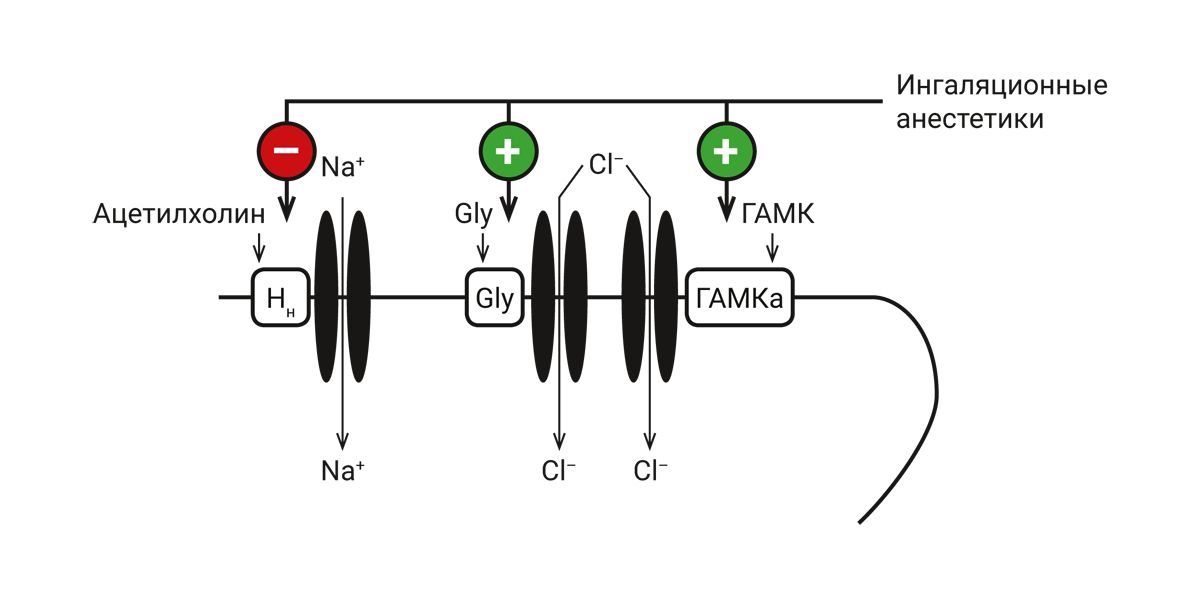
Примечание. Gly – глутаминовая кислота; Нн – холинорецепторы; ГАМК – γ-аминомасляная кислота; красный круг – тормозящие, зеленые – активирующие влияния анестетиков.
Ингаляционные анестетики блокируют аллостерические центры Нн-холинорецепторов, сопряженных с натриевыми каналами. При этом снижается сродство холинорецептора к ацетилхолину и обычная концентрация ацетилхолина не способна активировать рецептор и открыть канал. Нарушение тока ионов натрия в клетку приводит к прекращению генерации потенциалов действия.
Ингаляционные анестетики, так же, как и N2O, активируют аллостерические центры ГАМК- и глициновых рецепторов, сопряженных с хлоридными каналами. На фоне ингаляционных анестетиков чувствительность ГАМК- и глицинового рецептора к эндогенным лигандам многократно возрастает и даже ничтожно малые концентрации лигандов способны активировать рецептор и открыть канал. Поступление ионов хлора в клетку вызывает гиперполяризацию постсинаптической мембраны [31, 32].
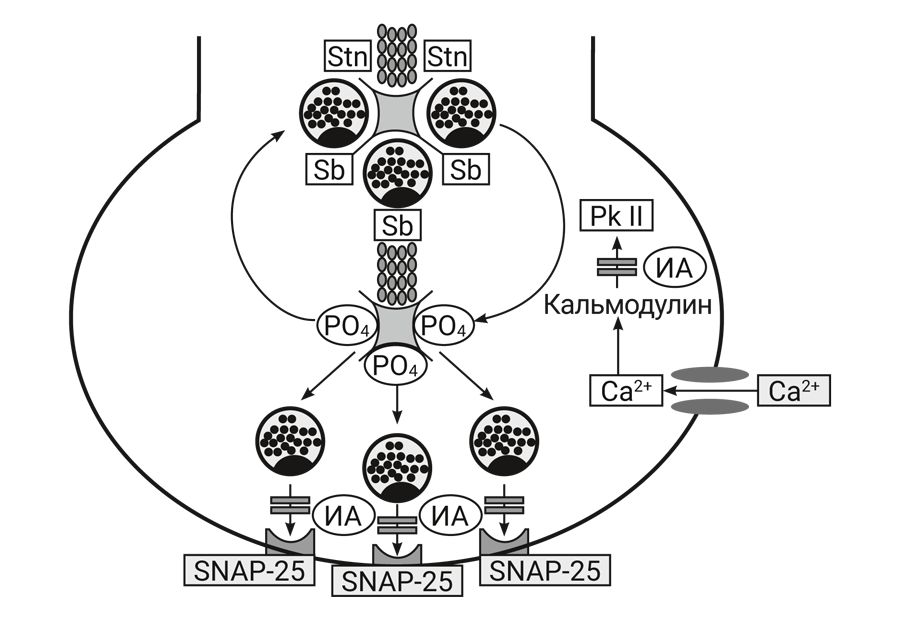
В последнее время показано, что ингаляционные анестетики нарушают процессы взаимодействия белков, ответственных за выброс медиатора из везикул пресинаптического окончания (рис. 5). В обычных условиях везикулы с медиатором, подобно гроздьям винограда, фиксированы на микротрубочках особым белком синтаксином. Под влиянием потенциала действия открываются кальциевые каналы пресинаптической мембраны, при этом в клетку поступают ионы кальция, которые активируют кальмодулин и зависимую от него протеинкиназу II типа, которая фосфорилирует синтаксин. В фосфорилированном состоянии синтаксин не способен фиксировать везикулы, и они отрываются от микротрубочек. В мембранах везикул находится белок синаптобревин, который легко связывается с белком SNAP-25, расположенным в пресинаптической мембране. Поэтому везикулы быстро «заякориваются» в мембране и выбрасывают медиатор в синаптическую щель. Ингаляционные анестетики нарушают процесс фосфорилирования синтаксина и везикулы не способны оторваться от микротрубочек, кроме того, ингаляционные анестетики инактивируют синаптобревин и везикулы не могут фиксироваться в пресинаптической мембране [36–40].
Таким образом, совместный механизм действия закиси азота и ингаляционных анестетиков во многом синергичен, что и обеспечивает их фармакологическую эффективность (рис. 6).
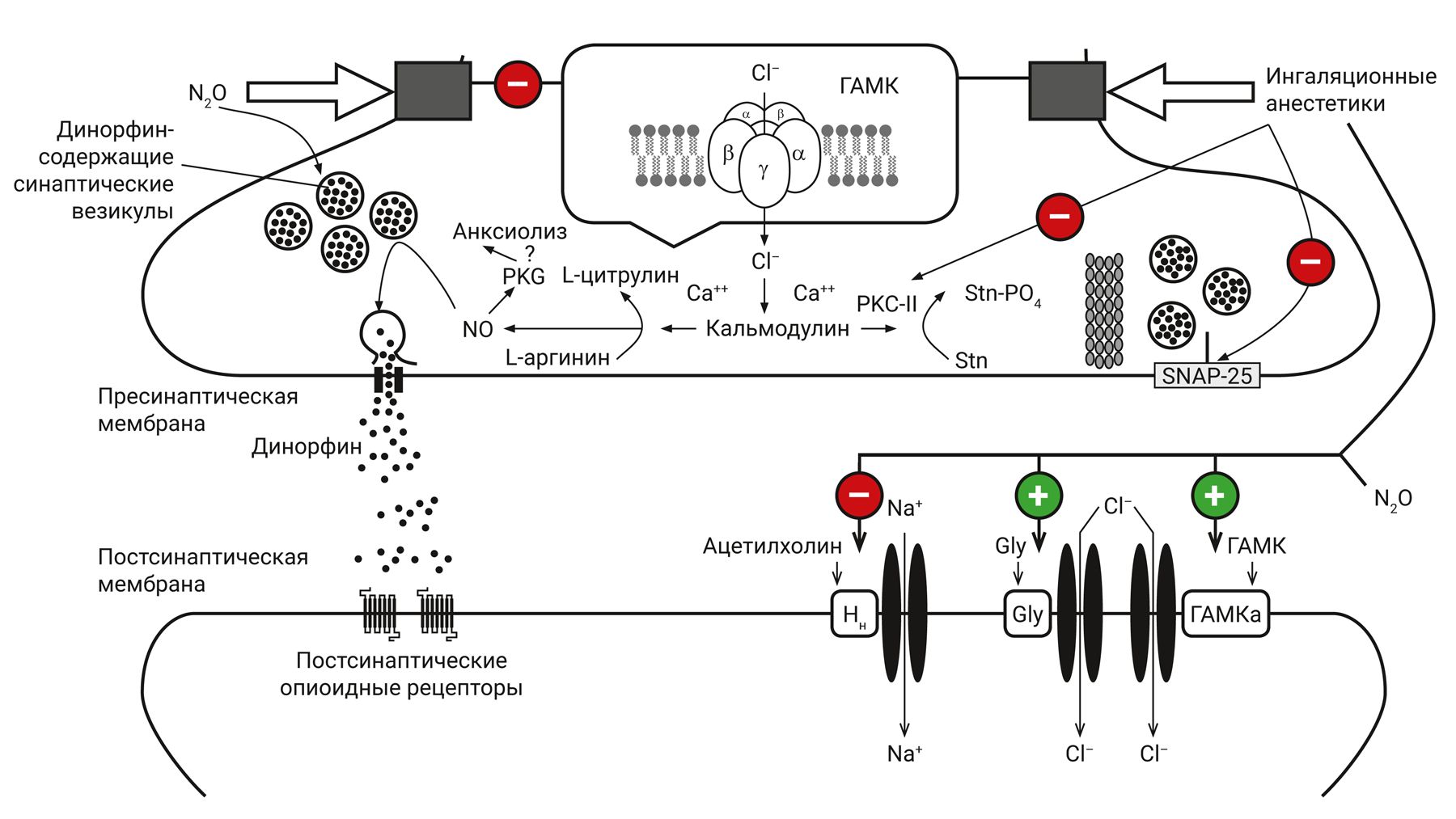
Примечание. Gly – глутаминовая кислота, Нн – холинорецепторы, ГАМК – γ-аминомасляная кислота, PKC-II – кальмодулин-зависимая протеинкиназа II типа; Stn – белок синтаксин; SNAP-25 – мембранный белок, компонент белкового комплекса SNARE; PKG – GMP-зависимая протеинкиназа; NO – оксид азота; красные круги – тормозящие, зеленые – активирующие влияния анестетиков
Фармакологическое действие ингаляционных анестетиков и закиси азота
Закись азота. Фармакокинетика: закись азота плохо растворяется в крови и липидах, поэтому при ингаляции обеспечивается быстрое введение в наркоз, а после прекращения подачи происходит такой же быстрый выход из него (в течение 4–5 мин). В организме закись азота практически не метаболизируется [31, 41–43].
Фармакодинамика:
- Анестезирующий эффект (способность вводить в наркоз) – закись азота оказывает слабое анестезирующее действие, т.е. хирургической стадии наркоза можно добиться при ингаляции чистой закиси азота под избыточным давлением. Поскольку для нормального газообмена уровень кислорода в воздухе не должен быть ниже 20% обычно применяют смесь 70–80% закиси азота и 20% кислорода. Такая смесь обеспечивает лишь поверхностный наркоз и может быть использована только для создания вводного наркоза и поддержания наркоза на фоне других анестетиков.
- В расчете на анальгетический эффект иногда используют ингаляции 45% смеси с закисью азота для обезболивания при инфаркте миокарда, родах (так как закись азота не влияет на тонус матки), при снятии швов, экстракции зубов. Аналгезию под влиянием анестезирующих газов, которая возникает без выключения сознания, называют рауш-наркоз.
- Миорелаксирующее действие у закиси азота не выражено, стадия возбуждения чрезвычайно короткая, проявляется в виде эйфории, «опьянения».
Эффект второго газа. Под эффектом «второго газа» понимают увеличение альвеолярной концентрации летучего анестетика, когда с вдыхаемым газом одновременно подается закись азота. Более быстрое поступление закиси азота в кровь вызывает уменьшение объема легких, в результате которого концентрация летучего анестетика в остаточном объеме увеличивается, что повышает альвеолярно-капилярный градиент парциального давления.
Закись азота (60–70% во вдыхаемой смеси) при сочетанном применении с другими анестетиками увеличивает их скорость поглощения, МАК галотана или изофлурана уменьшается примерно на 20–25% и, следовательно, снижается подавление сердечно-легочной функции [2]. Наименьшее соотношение O2: N2O должно быть 1:2, так, чтобы концентрация кислорода составляла не менее 33% [44].
Нежелательные эффекты закиси азота:
- Закись азота окисляет атом кобальта в составе цианокобаламина и нарушает активность зависимого от него фермента метионинсинтетазы, который участвует в процессе переноса метильных групп при синтезе ДНК в костном мозге. Поэтому при длительной ингаляции возможно возникновение анемии и нейтропении. Согласно данным Международного общества по изучению боли, в связи с угрозой этого осложнения максимальная длительность анестезии закисью азота не должна превышать 6 ч.
- После прекращения наркоза возможно развитие диффузионной гипоксии. Плохо растворимая в крови закись азота начинает интенсивно выделяться из крови в альвеолы и вытесняет из них кислород. Поскольку альвеолы лишаются кислорода, газообмен прекращается. Во избежание гипоксии после прекращения наркоза закисью азота в течение 4–5 мин проводят ингаляцию кислородом.
- Несмотря на то, что закись азота плохо растворяется в крови, ее растворимость в 15 раз выше, чем у кислорода, и в 30 раз лучше, чем у азота, поэтому при прекращении ингаляции она начинает выделяться в полости организма в количествах, значительно превышающих объемы газов атмосферного воздуха. Выделение закиси азота в кишечник приводит к развитию метеоризма, в придаточные пазухи носа – к чувству распирания и головной боли, в барабанную полость среднего уха – к боли и заложенности в ушах.
Эти нежелательные эффекты надо учитывать в период клинического наблюдения за животными после наркоза.
Галотан. Фармакокинетика: галотан лучше, чем закись азота, растворяется в крови и липидах, поэтому при его ингаляции введение в наркоз наступает относительно медленно (через 4–7 мин), а выход из наркоза продолжается 15–20 мин.
Фармакодинамика:
- Галотан высокоактивен, вызывает глубокий наркоз с достаточно выраженной аналгезией и миорелаксацией, поэтому применяется для введения в наркоз и поддержания наркоза при различных видах хирургических операций.
- При галотановом наркозе практически не выражена стадия возбуждения.
- Ганглиоблокирующее действие и снижение вагусного влияния на бронхи дают бронходилатирующий эффект.
- Галотан несколько снижает артериальное давление за счет блокады Нн-холинорецепторов вегетативных ганглиев и каротидных клубочков, а также вследствие угнетения сосудодвигательного центра продолговатого мозга и стимуляции продукции оксида азота в эндотелиальных клетках сосудов.
- Галотан снижает силу сердечных сокращений и сердечный выброс за счет нарушения процесса поступления ионов кальция в миокард. Также при использовании галотана возможно развитие брадикардии, так как он угнетает синусовый узел.
Нежелательные эффекты галотана:
- Галотан повышает внутричерепное давление, усиливая кровоток в сосудах головного мозга.
- Под влиянием галотана происходит угнетение сократительной активности миокарда и дыхательного центра.
- 20% галотан подвергается метаболизму с образованием фторэтанола, фторацетальдегида, трифторуксусной кислоты, которые накапливаются в мембранах гепатоцитов и могут привести к фатальному некрозу печени (частота развития у людей 1 случай на 10 000), поэтому повторное применение галотана допускаются не ранее чем через 6 мес после первой ингаляции.
- Введение на фоне галотана адреналина или норадреналина с целью повышения артериального давления может привести к развитию фибрилляции желудочков. Если необходимо поддержать артериальное давление во время галотанового наркоза, следует использовать фенилэфрин или метоксамин.
Изофлуран. Фармакокинетика: изофлуран несколько хуже галотана растворяется в системе газ–кровь–липиды, поэтому быстрее, чем галотан, обеспечивает ввод в наркоз и выход из него (в пределах 3–5 мин).
Фармакодинамика:
- Изофлуран обеспечивает глубокий наркоз с выраженной миорелаксацией.
- В отличие от галотана изофлуран не снижает сократительную функцию миокарда и не ухудшает кровоток во внутренних органах.
- Изофлуран практически не влияет на уровень внутричерепного давления.
Нежелательные эффекты:
- Изофлуран оказывает раздражающее действие на слизистые оболочки бронхов и усиливает секрецию бронхиальных желез. Скопление слизи в дыхательных путях может привести к их обтурации и развитию ателектаза. Для предупреждения этого при изофлурановом наркозе проводят премедикацию атропином (он снижает секрецию желез).
- Изофлуран практически не метаболизируется, поэтому не оказывает гепатотоксического действия.
Энфлуран. По основным характеристикам энфлуран близок к изофлурану (фактически он является его изомером). Однако энфлуран имеет ряд особенностей:
- По растворимости в крови и липидах он занимает промежуточное положение между галотаном и изофлураном, поэтому по скорости наступления наркоза и выхода из него он также находится между этими средствами.
- Может вызывать тоникоклонические судороги.
- В большей степени, чем галотан, повышает внутричерепное давление и мозговой кровоток.
Эффекты ингаляционных анестетиков на различные органы и системы
Влияние на дыхательную систему. Современные ингаляционные анестетики воздействуют на все звенья физиологии дыхания. Они оказывают бронходилатирующее действие за счет снижения внутриклеточной концентрации кальция и снижения чувствительности к нему, причем эффект более выражен в дистальных отделах дыхательных путей. Ингаляционные анестетики уменьшают скорость мукоцилиарного клиренса вследствие снижения частоты биения ресничек, нарушения синхронизма их работы или изменения свойств слизи, а также вызывают уменьшение количества сурфактанта в ткани. На фоне их применения снижаются дыхательный объем и минутная вентиляция легких, угнетается дыхательный ответ на гиперкапнию и гипоксию за счет центральных и периферических хеморецепторных механизмов [31, 41–43].
Влияние на сердечно-сосудистую систему. Ингаляционные анестетики снижают сократимость левого и правого желудочка, левого предсердия, диастолической функции левого желудочка и угнетают рефлекторный контроль артериального давления, опосредованный барорецепторами. Они по-разному влияют на нормальный и поврежденный миокард, в различной степени изменяя показатели постнагрузки левого желудочка. Системные гемодинамические эффекты ингаляционных анестетиков складываются из миокардиальных эффектов, прямого воздействия на артериальную и венозную сосудистую сеть и нарушений активности вегетативной нервной системы. При их применении повышается чувствительность миокарда к аритмогенным эффектам эпинефрина и в зависимости от концентрации последнего, степени и локализации повреждения внутри проводящих путей могут либо предотвратить, либо способствовать развитию предсердных или желудочковых аритмий при ишемии или инфаркте миокарда [31, 41–43].
Влияние на центральную нервную систему. Все современные ингаляционные анестетики могут снижать мозговой метаболизм до 60%. Влияние ингаляционных анестетиков на мозговой кровоток зависит от дозы. При использовании концентрации ниже MAК мозговой кровоток существенно не меняется. В концентрации выше 1 МАК мозговые сосуды расширяются, что приводит к увеличению мозгового кровотока и внутричерепного объема крови.
Анестезия также может влиять на уровень глюкозы в крови и концентрацию липидов, которые могут косвенно воздействовать на метаболизм мозга [45].
На церебральный метаболизм также действуют изменения температуры тела, в частности, переохлаждение часто встречается при длительной анестезии у маленьких животных. Например, гипергликемия значительно повышает риск глобальной ишемии головного мозга [46], модулируя механизмы и нейропротекторные свойства гематоэнцефалического барьера [47, 48].
Особенности наркотизации разных видов лабораторных животных
У крыс и мышей кислород можно использовать в качестве единственного газа-носителя, за исключением очень длительных процедур. При отсутствии механической вентиляции легких уровень углекислого газа CO2 во время анестезии в артериальной крови будет повышен. Для коротких процедур, где используются мыши, анестезию можно вызвать ингаляционным анестетиком в стеклянной банке. При стандартных условиях температуры и давления 1 мл жидкого изофлурана дает 182 мл газа. В сосуде емкостью 500 мл 0,11 мл жидкого изофлурана быстро испаряется, достигая концентрации 4%, при этом мышь, помещенная в банку, подвергнется анестезии в течение нескольких минут и проснется через 30–60 с после извлечения из банки. Животное никогда не должно контактировать с жидким анестетиком, в противном случае возникнет местное раздражение [2].
Если несколько мышей подвергают анестезии друг за другом в банке, необходимо принять меры для предотвращения недостатка кислорода. Для защиты персонала этот метод можно использовать, только применяя вытяжной шкаф с вентиляцией.
Все ингаляционные анестетики достаточно безопасны для кроликов, кошек, собак и хорьков [49, 50–52]. Анестезия с использованием суфентанила в сочетании с закисью азота описана у собак [53].
Для хорьков рекомендованы следующие режимы дозирования: 4–5% изофлуран для введения в наркоз и 1,5–3% для поддержания наркоза, 3–3,5% галотан для введения в наркоз и 0,5–2,5% для поддержания наркоза [54].
Закись азота наиболее востребована для животных массой тела >2 кг, так как для более мелких животных ингаляционные анестетики быстро поглощаются и без N2O [2]. Закись азота не рекомендуется использовать у травоядных, поскольку она легко диффундирует в наполненные газом сегменты кишечника.
Анестезию средствами для наркоза не следует проводить у кроликов без седативных препаратов, поскольку они неохотно вдыхают пары и могут длительно задерживать дыхание и сопротивляться [55, 56]. Вместо этого для премедикации можно использовать инъекционный анестетик короткого действия с последующим применением ингаляционной анестезии.
Для мини-пигов также используют N2O, но только в качестве дополнения к другим анестетикам. Это не сильнодействующий анестетик и поэтому его можно вводить в высоких концентрациях, но не рекомендуется применять N2O в концентрациях выше 75%. При этом N2O снижает дозу более сильнодействующих анестетиков (примерно на 50% уменьшает дозу изофлурана).
Изофлуран широко используется для обезболивания мини-пигов, он предпочтительнее галотана, поскольку его применение безопаснее, с его помощью легче регулировать глубину анестезии и он обеспечивает более быстрое введение в наркоз и выход из него [6].
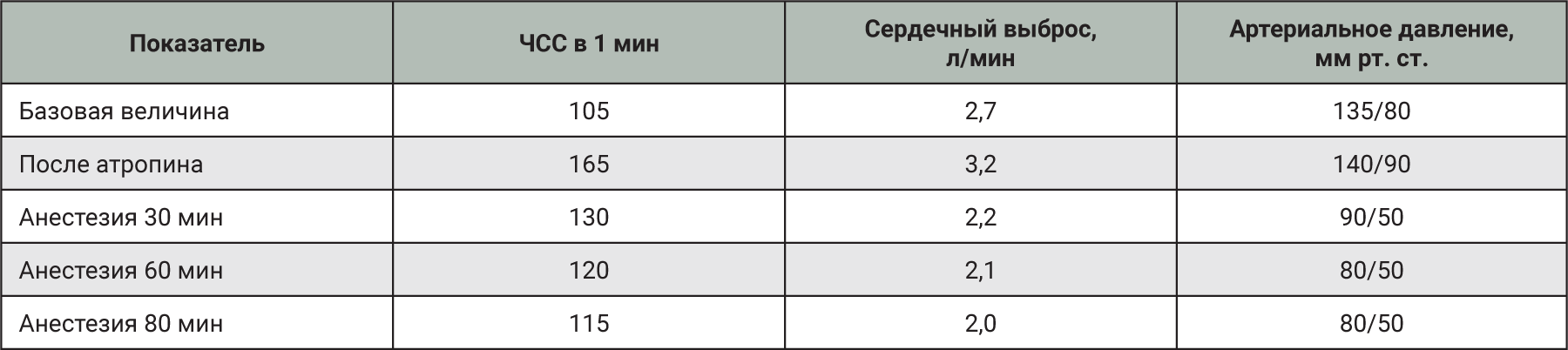
Также изофлуран хорошо сочетается с сильными анальгетиками, поскольку он обеспечивает только минимальный обезболивающий эффект, а в комбинации с анальгетиками его доза может быть существенно снижена [6]. Комбинация изофлурана и N2O была испытана на самках мини-пигов. Влияние на физиологические параметры мини-пигов при использовании комбинации 1,75–2,00% изофлурана со смесью N2O : О2 (1:3) представлено в табл. 2. Также в этом исследовании наблюдалось снижение артериального давления и увеличение частоты сердечных сокращений (ЧСС) в первый час анестезии. В целом комбинация изофлурана и N2O оказалась эффективна при применении у мини-пигов [6].
Десфлуран, севофлуран и энфлуран являются изомерами изофлурана, они также применяются для анестезии мини-пигов.
Поскольку десфлуран имеет низкую растворимость в крови, наступление наркоза и выход их него происходят очень быстро, поэтому можно легко регулировать глубину анестезии. Он более летуч, чем галотан и изофлуран, для него необходимы специальные испарители. Высокая цена десфлурана часто ограничивает его использование у мини-пигов.
Севофлуран широко используется у мини-пигов, он может быть препаратом выбора при повышенном риске, когда мини-пиги особи молодые или больные, поскольку он обеспечивает быстрый вывод из наркоза. В целом изофлуран и севофлуран (с закисью азота или без нее) являются универсальными агентами для анестезии свиней [6].
При применении энфлурана необходима соответствующая премедикация. Высокие концентрации энфлурана могут вызывать у свиней реакцию, напоминающую судороги, в связи с чем энфлуран постепенно исчезает с рынка.
Как и изофлуран, энфлуран можно комбинировать с N2O для обезболивания мини-пигов.
Комбинацию энфлурана и N2O исследовали на мини-пигах A.K.O. Alstrup и соавт. [6]. В отличие от других ингаляционных анестетиков энфлуран практически не метаболизируется, и это особенно важно в случае проведения повторной анестезии мини-пигов. Физиологические параметры, наблюдаемые у мини-пигов в возрасте 5 мес, при анестезии энфлураном и N2O представлены в табл. 3. Наблюдалось снижение артериального давления и увеличение ЧСС в течение первого часа анестезии. При таком типе анестезии у спонтанно дышащих мини-пигов может развиваться респираторный ацидоз, поэтому для длительных исследований рекомендуется искусственная вентиляция легких.
Далее приведены некоторые факторы, увеличивающие или уменьшающие МАК ингаляционных анестетиков у мини-пигов и других видов животных [6]:
- увеличивают – гипертермия, стимуляторы, ЦНС, амфетамин, эфедрин, физостигмин;
- уменьшают – гипотермия, премедикация, ацепромазин, мидазолам, ксилазин, другие анестетики, закись азота, кетамин, возраст, беременность.
Безопасность оператора при проведении анестезии
Обеспечение безопасности оператора при проведении анестезии касается воздействия анестезирующих газов, обращения с газовыми баллонами и возможного злоупотребления лекарственными препаратами.
Воздействие анестезирующих газов. Хроническое влияние ингаляционных анестетиков может приводить к заболеваниям печени и почек, абортам, бесплодию, врожденным дефектам и новообразованиям у людей [57]. Закись азота может подавлять функцию костного мозга и вызвать аборт. В большинстве стран есть правила, касающиеся использования анестезирующих газов. Правила включают оценку рисков, предотвращение и контроль воздействия, установку и обслуживание, меры контроля, мониторинг влияния, наблюдение за здоровьем персонала, информирование и обучение персонала.
Установлены пределы действия анестезирующих газов и рекомендации по ограничению воздействия. Обеспечение качественной работы вентиляционных систем сводят к минимуму влияние следовых газов.
Если невозможно избежать воздействия, рекомендуется использовать более безопасные анестетики, например, более безопасный, чем галотан, изофлуран. Системы поглощения анестетиков с активированным углем имеют ограниченное применение и поглощают галогенированные летучие вещества, но не закись азота.
Газовые баллоны. Газовые баллоны находятся под высоким давлением, а при их механическом повреждении (падение) или нагревании могут взорваться.
Баллоны нельзя хранить рядом с источниками тепла или горючего материала. Клапаны кислородного баллона и связанное с ними оборудование нельзя смазывать, не должны использоваться масла и смазки на углеродной основе. Их сочетание с высоким давлением кислородного баллона может вызвать взрыв.
Запрещается курение в непосредственной близости от баллона или подводящих трубок или попадание на них прямых солнечных лучей.
Список источников
- Hedenqvist, P., Hellebrekers L.J. Laboratory animal analgesia, anesthesia, and euthanasia. in Handbook of Laboratory Animal Science: Essential Principles and Practices 2nd edn., 2 Vol. 1 (eds. Hau, J. & van Hoosier, G.L., Jr.) 413–455 (CRC Press, Boca Raton, FL, 2003).
- Brunson D.B. Pharmacology of inhalation anesthetics, in Anesthesia and Analgesia in Laboratory Animals, Kohn, D.F., Wixson, S.K., White, W.J., and Benson, G.J., Eds., ACLAM and Academic Press, New York, 1997.
- Ehrenwerth J., Eisenkraft J. B. (eds); Anesthesia Equipment: Principles and Applications. Mosby-Year Book, St. Louis, 1993.
- Ludders, J.W., Inhalant anaesthetics, in Manual of Small Animal Anaesthesia and Analgesia, Seymour C. and Gleed R., Eds., BSAVA, 1999.
- Steffey, E.P., Inhalation anesthetics, in Lumb & Jones’ Veterinary Anesthesia, third ed., Thurmon, J.C., Tranquilli, W.J., and Benson, G.J., Eds., Williams & Wilkins, Baltimore, MD, 1996.
- Alstrup A.K.O. Anaesthesia and Analgesia in Ellegaard Göttingen minipigs. Jannerup.DK. Denmark (2010).
- Berkowitz B.A., Ngai S.H., Finck A.D. Nitrous oxide «analgesia»: resemblance to opiate action. Science. 1976; 194: 967-968.
- Berkowitz BA, Finck AD, Ngai SH. Nitrous oxide analgesia: reversal by naloxone and development of tolerance. J Pharmacol Exp Ther. 1977;203: 539-547.
- Chapman C.R., Benedetti C. Nitrous oxide effects on cerebral evoked potential to pain: partial reversal with a narcotic antagonist. Anesthesiology. 1979; 51: 135–138.
- Gillman M.A., Kok L., Lichtigfeld F.J. Paradoxical effect of naloxone on nitrous oxide analgesia in man. Eur J Pharmacol.1980; 61: 175-177.
- Berkowitz B.A., Finck A.D., Hynes M.D., Ngai S.H. Tolerance to nitrous oxide analgesia in rats and mice. Anesthesiology. 1979; 51: 309-312.
- Branda E.M., Ramza J.T., Cahill F.J., Tseng L.F., Quock R.M. Role of brain dynorphin in nitrous oxide antinociception in mice. Pharmacol Biochem Behav. 2000; 65: 217-221.
- Cahill F.J., Ellenberger E.A., Mueller J.L., Tseng L.F., Quock R.M. Antagonism of nitrous oxide antinociception in mice by intrathecally administered antisera to endogenous opioid peptides. J Biomed Sci. 2000; 7: 299-303.
- Emmanouil D.E., Quock R.M. Understanding the Actions of N2O. Anesth Prog. 2007; 54: 9-18
- Fujinaga M., Maze M. Neurobiology of nitrous oxideinduced antinociceptive effects. Mol Neurobiol. 2002; 25: 167-189.
- Zuniga J.R., Joseph S.A., Knigge K.M. The effects of nitrous oxide on the secretory activity of pro-opiomelanocortin peptides from basal hypothalamic cells attached to cytodex beads in a superfusion in vitro system. Brain Res. 1987; 420: 66-72.
- Rupreht J., Dworacek B., Bonke B., Dzoljic M.R., van Eijndhoven J.H., de Vlieger M. Tolerance to nitrous oxide in volunteers. Acta Anaesthesiol Scand. 1985; 29: 635-638.
- Fender C, Fujinaga M, Maze M. Strain differences in antinociceptive effect of nitrous oxide on tail flick test in rats. Anesth Analg. 2000;90:195–199.
- Beitner-Johnson D, Guitart X, Nestler EJ. Dopaminergic reward regions of Lewis and Fischer rats display different levels of tyrosine hydroxylase and other morphine- and cocaine-regulated phosphoproteins. Brain Res. 1991;561:147–150.
- Nylander I, Vlaskovska M, Terenius L. Brain dynorphin and enkephalin systems in Fischer and Lewis rats: effects of morphine tolerance and withdrawal. Brain Res. 1995;683:25–35.
- Rupreht J, Dworacek B, Ducardus R, Schmitz PI,Dzoljic MR. The involvement of the central cholinergic and endorphinergic systems in the nitrous oxide withdrawal syndrome in mice. Anesthesiology. 1983;58:524–526.
- Quock RM, Nguyen E. Possible involvement of nitric oxide in chlordiazepoxide-induced anxiolysis in mice. Life Sci.1992;51:PL255–260.
- Caton PW, Tousman SA, Quock RM. Involvement of nitric oxide in nitrous oxide anxiolysis in the elevated plusmaze.Pharmacol Biochem Behav. 1994;48:689–692.
- Li S, Doss JC, Hardee EJ, Quock RM. Involvement of cyclic GMP-dependent protein kinase in nitrous oxide-induced anxiolytic-like behavior in the mouse light/dark exploration test. Brain Res. 2005;1038:113–117.
- Denninger JW, Marletta MA. Guanylate cyclase and the •NO/cGMP signaling pathway. Biochim Biophys Acta. 1999;1411:334–350.
- Epstein RM, Rackow H, Salanitre E, Wolf GL. Influence of the concentration effect on the uptake of anesthetic mixtures: the second gas effect. Anesthesiology. 1964;25:364–371.
- Franks NP, Lieb WR. Do general anaesthetics act by competitive binding to specific receptors? Nature. 1984;310:599–601.
- Jevtovic-Todorovic V, Wozniak DF, Benshoff ND, Olney JW. A comparative evaluation of the neurotoxic properties of ketamine and nitrous oxide. Brain Res. 2001;895:264–267.
- Jevtovic-Todorovic V, Beals J, Benshoff N, Olney JW. Prolonged exposure to inhalational anesthetic nitrous oxide kills neurons in adult rat brain. Neuroscience. 2003;122:609–616.
- Jevtovic-Todorovic V, Benshoff N, Olney JW. Ketamine potentiates cerebrocortical damage induced by the common anaesthetic agent nitrous oxide in adult rats // Br J Pharmacol.2000;130:1692–1698.
- Анестезия Роналда Миллера. Под редакцией Р. Миллера. Руководство в 4-х томах. Седьмое издание. Перевод с английского, под общей редакцией К.М. Лебединского. Издательство Человек, 2015 год. 856 стр. [Anesteziya Ronalda Millera. Pod redaktsiei R. Millera. Rukovodstvo v 4-kh tomakh. Sed'moe izdanie. Perevod s angliiskogo, pod obshchei redaktsiei K.M. Lebedinskogo. Izdatel'stvo Chelovek, 2015. 856 p. (In Russ.)].
- Jones M.V., Brooks P.A., Harrison N.L. Enhancement of gamma-aminobutyric acid-activated Cl- currents in cultured rat hippocampal neurones by three volatile anaesthetics. The Journal of Physiology. 1992; 449: 279-293.
- Jenkins A., Franks N.P., Lieb W.R. Effects of temperature and volatile anesthetics on GABA(A) receptors// Anesthesiology. 1999. 90 (2): 484–491.
- Lin L.H., Chen L.L., Zirrolli J.A., Harris R.A. General anesthetics potentiate gamma-aminobutyric acid actions on gamma-aminobutyric acid A receptors expressed by Xenopus oocytes: lack of involvement of intracellular calcium// The Journal of Pharmacology and Experimental Therapeutics. 1992. 263 (2): 569–78.
- Krasowski M.D., Harrison N.L. The actions of ether, alcohol and alkane general anaesthetics on GABAA and glycine receptors and the effects of TM2 and TM3 mutations// British Journal of Pharmacology. 2000. 129 (4): 731–43.
- Ашмарин И.П. Биохимия мозга / И.П. Ашмарин [и др.]. – СПб: Изд-во СПбУ, 1999. – 328 с. [Ashmarin I.P. Biokhimiya mozga / I.P. Ashmarin [i dr.]. – SPb: Izd-vo SPbU, 1999. – 328 p. (In Russ.)].
- Зефиров А.Л. Везикулярный цикл в пресинаптическом окон¬чании//Росс. физиол. журн. – 2007. – Т. 93, № 5. – С. 544–562. [Zefirov A.L. Vezikulyarnyi tsikl v presinapticheskom okon-chanii//Ross. fiziol. zhurn. – 2007. – Vol. 93, № 5. – P. 544-562. (In Russ.)].
- Зефиров А.Л. Медиаторы и синапсы А.Л. Зефиров [и др.]. – Казань: КГМУ, 2003. – 65 с. [Zefirov A.L. Mediatory i sinapsy A.L. Zefirov [i dr.]. – Kazan': KGMU, 2003. – 65 p. (In Russ.)].
- Heuser, J.E. Review of electron microscopic evidence favouring vesicle exocytosis as the structural basis for quantal release during synaptic transmission / J.E. Heuser // Q. j. exp. physiol. – 1989. – Vol. 74, № 7. – P. 1051–1069.
- Lang, T. Core Proteins of the Secretory Machinery / T. Lang, R. Jahn // Pharmacology of neurotransmitter release. – Berlin: Springer-verlag Berlin Heidelberg, 2008. – Р. 107–127.
-
Лихванцев В.В. Опасности и осложнения общей анестезии. М.: ООО «Медицинское информационное агентство», 2014. [Likhvantsev V.V. Opasnosti i oslozhneniya obshchei anestezii. M.: JSC «Meditsinskoe informatsionnoe agentstvo», 2014.
(In Russ.)].
- Лихванцев В.В. Практическое руководство по анестезиологии. М.: ООО «Медицинское информационное агентство», 2011.[ Likhvantsev V.V. Prakticheskoe rukovodstvo po anesteziologii. M.: JSC «Meditsinskoe informatsionnoe agentstvo», 2011. (In Russ.)].
- Eger E. The pharmacology of inhaled anesthetics, 2010.
- Bowser P.R., Anesthetic options for fish, in Recent Advances in Veterinary Anesthesia and Analgesia:Companion Animals, Gleed, R.D. and Ludders, J.W., Eds., International Veterinary Information Service. 2001.
- Toyama H., Ichise M., Liow J.S., Modell K.J, Vines D.C., Esaki T., Cook M., Seidel J., Sokoloff L., Green M. V, Innis R.B. Absolute quantification of regional cerebral glucose utilization in mice by 18F-FDG small animal PET scanning and 2-14C-DG autoradiography. J Nucl Med 2004; 45: 1398-405.
- Jolkkonen J, Puurunen K, Koistinaho J, et al. Neuroprotecting by the alpha-2-adrenoceptor agonist, dexmedetomidine, in regional cerebral ischemia. Eur J Pharmacol 1999; 372: 31-6.
- Olsen AK, Smith DF. Anaesthesia for positron emission tomography scanning of animal brains. Laboratory Animals 2013; 47: 12-8.
- Cicero L., Fazzotta S., Palumbo V.D., Cassata G., Lo Monte A.I. Anesthesia protocols in laboratory animals used for scientific purposes // Acta Biomed 2018; Vol. 89, N. 3: 337-342.
- Skarda R.T., Bednarski R.M., Muir W.W., Hubbell J.A., Mason D.E. Sedation and anesthesia in dogs and cats with cardiovascular diseases. I. Anesthesia plan considering risk assessment, hemodynamic effects of drugs and monitoring// Schweiz Arch Tierheilkd. 1995;137(7):312-21.
- Skarda RT, Hubbell JA, Muir WW, Bednarski RM, Mason DE. Sedation and anesthesia in dogs and cats with cardiovascular diseases. III. Ventilation, respiratory monitoring, treatment for postoperative pain // Schweiz Arch Tierheilkd. 1996;138(6):312-8.
- Skarda RT, Muir WW, Bednarski RM, Hubbell JA, Mason DE.Sedation and anesthesia in dogs and cats with cardiovascular disease. II. Anesthesia planning with respect to pathophysiology, heart arrhythmia // Schweiz Arch Tierheilkd. 1995;137(12):543-51.
- Jones CL, Buchanan JW. Patent ductus arteriosus: anatomy and surgery in a cat. J Am Vet Med Assoc. 1981; 179(4): 364-369.
- Van Ham, L.M., Nijs, J., Mattheeuws, D.R., Vanderstraeten, G.G., Sufentanil and nitrous oxide anaesthesia for the recording of transcranial magnetic motor evoked potentials in dogs. Vet. Rec. 1996, 138(26): 642-645.
- Wenker C., Christen C. Ferrets in veterinary practice. Schweiz Arch Tierheilkd. 2002; 144(11): 575-584.
- Hedenqvist, P., Roughan, J.V., Antunes, L., Orr H., Flecknell P.A., Induction of anaesthesia with desflurane and isoflurane in the rabbit. Lab. Anim. 2001; 35(2): 172-179.
- Flecknell P., Roughan, J.V., Hedenqvist P. Induction of anaesthesia with sevoflurane and isoflurane in the rabbit, Lab. Anim. 1999 ;33(1): 41-46.
- Ludders, J.W., Inhalant anaesthetics, in Manual of Small Animal Anaesthesia and Analgesia, Seymour C. and Gleed R., Eds. BSAVA. 1999.



