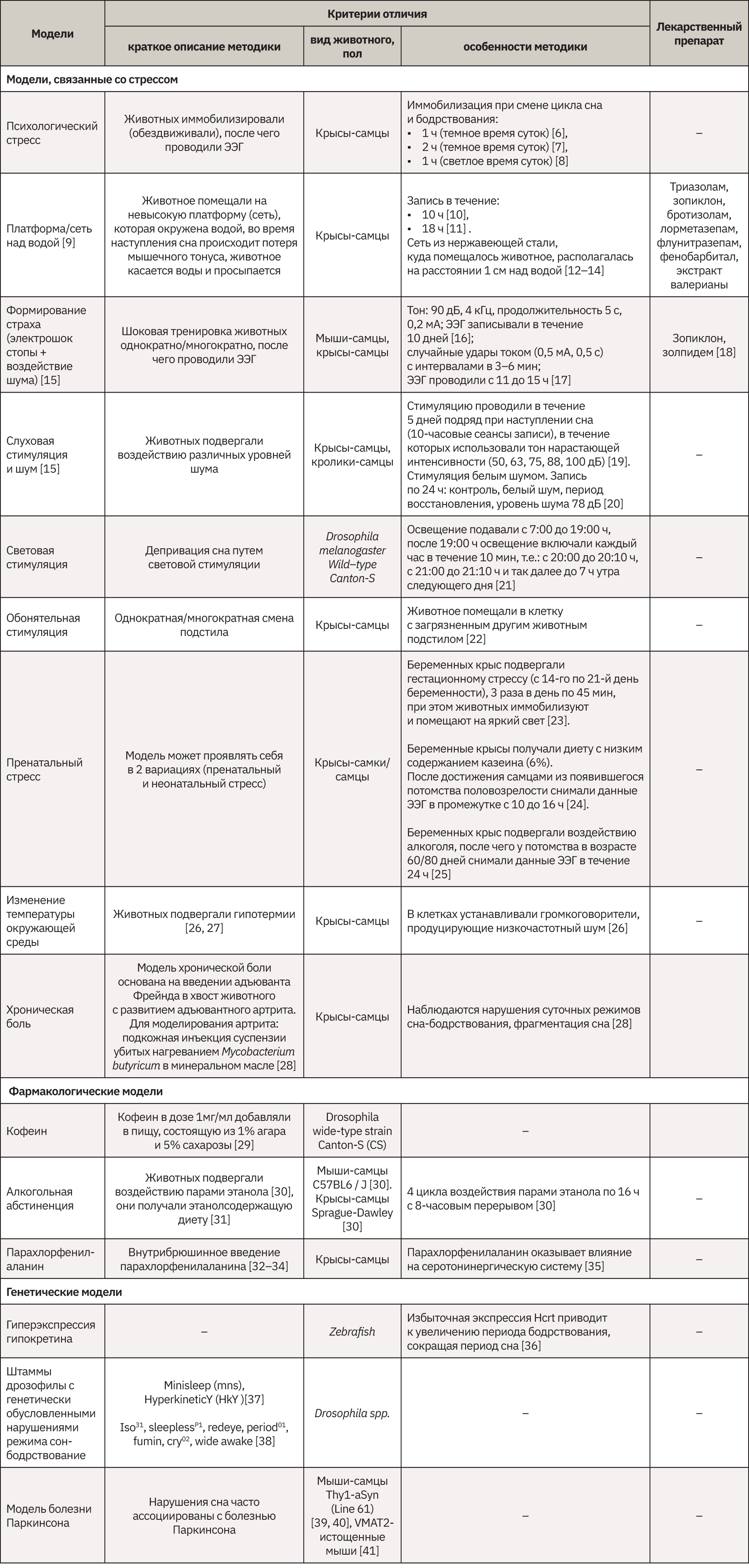
Выбор оптимальной модели инсомнии для сравнительной оценки препаратов на основе мелатонина
Демакова Н.В., Коротыхина М.А., Сысоев Ю.И., Каршин А.В., Анисимова Н.А., Ивкин Д.Ю. Выбор оптимальной модели инсомнии для сравнительной оценки препаратов на основе мелатонина. Лабораторные животные для научных исследований. 2021; 4. https://doi.org/10.29296/2618723X-2021-04-10
Резюме
В настоящее время распространенность бессонницы во всем мире охватывает 30–35% всего населения. На данном этапе фармацевтический рынок лекарственных препаратов для лечения этой патологии практически не пополняется, в связи с чем актуальным является создание новых более эффективных и/или безопасных средств.
Цель представленной работы – выбор и апробация оптимальной модели инсомнии для сравнительной оценки эффективности препаратов мелатонина.
Проведена оценка ряда имеющихся российских и зарубежных моделей инсомнии и методов ее изучения, в том числе на основании базы данных медицинских и биологических публикаций PubMed (https://pubmed.ncbi.nlm.nih.gov/). Рассмотренные модели были разделены на три больших блока: связанные со стрессорными факторами, фармакологические и генетические модели. Тест-системами для проведения исследований на моделях бессонницы из проанализированных источников литературы стали кролики, крысы, мыши, рыбы Danio rerio и дрозофилы. Для изучения сравнительной фармакодинамики нового лекарственного препарата на основе мелатонина и растительных компонентов в качестве наиболее подходящей в части, касающейся выраженности снотворного эффекта, была выбрана модель смены запахового следа. Суть ее сводится к смене у половозрелых самцов привычной клетки на клетку с несвежим подстилом, содержащим ольфакторный след другого гендерно-идентичного животного, что становится стрессорным фактором в виде ожидания агрессии и позволяет создать необходимые условия для проведения эксперимента.
Результаты исследования препарата мелатонина с фитокомплексом, содержащим экстракты сырья валерианы (Valeriana officinalis), пустырника (Leonurus cardiaca), боярышника (Crataegus sanguinea), мяты перечной (Mentha piperita) (+ масло мяты перечной), свидетельствуют о достоверном улучшении показателей соотношения индексов тета- и дельта-ритмов животных и индекса альфа-ритмов, которые приближаются к значениям контрольной группы здоровых животных. На основании электроэнцефалографического исследования можно сделать вывод о большей эффективности испытуемого комбинированного препарата в сравнении с референтным мелатонином. Смена ольфакторного следа является эффективной и легко воспроизводимой моделью, которая может быть использована не только при сравнительной оценке эффективности препаратов мелатонина, но и других фармакологических агентов для лечения бессонницы.
Введение
Сон представляет собой сложный физиологический процесс, подверженный влиянию большого количества внешних и внутренних факторов [1].
Дисбаланс неизменно приводит к развитию инсомнии, которая согласно Международной классификации болезней 11-го пересмотра характеризуется состоянием неудовлетворительной продолжительности и/или качества сна, при этом сохраняется в течение значительного отрезка времени и включает трудности засыпания, нахождения в состоянии сна или раннее окончательное пробуждение [2].
В мире распространенность бессонницы составляет примерно 30–35% [3], симптомы хронической бессонницы встречаются у женщин в 1,5 раза чаще, чем у мужчин. Нарушения сна могут появиться в любом возрасте, однако наиболее подвержены этому состоянию пожилые люди, что может быть обусловлено возрастными изменениями и наличием сопутствующих заболеваний [4]. На сегодняшний день ведущая модель инсомнии связана с повышенной возбудимостью. При изучении активности нервной системы выявлено, что повышенная возбудимость представляет собой конечное патофизиологическое звено, которое отвечает за нарушения регуляции цикла сон–бодрствование, в нем происходят усиление активности систем возбуждения, недостаточная функция систем сна либо сочетание этих нарушений [5].
Современный фармацевтический рынок лекарственных препаратов для лечения бессонницы практически не пополняется, большая часть имеющихся препаратов была произведена фармацевтическими компаниями достаточно давно, а модели, на которых проводили их оценку, могли устареть, поэтому необходимо было провести поиск и анализ существующих моделей инсомнии для выявления наиболее эффективной.
В соответствии с изложенным сформулирована цель исследования, заключающаяся в выборе и апробации оптимальной модели инсомнии для сравнительной оценки эффективности препаратов мелатонина.
Для достижения цели были поставлены следующие задачи:
1. обзор имеющихся отечественных и зарубежных моделей инсомнии и методов их изучения;
2. выбор модели, наиболее соответствующей фармакодинамике испытуемого препарата;
3. проведение сравнительной оценки препаратов мелатонина на выбранной модели.
В табл. 1 систематизирована информация, представлены наиболее часто используемые модели инсомнии и результаты проведенного поиска по препаратам, исследованным на этих моделях согласно статьям и регистрационным досье.
Объектом исследования являлись препараты мелатонина (монопрепарат и комбинация с фитокомплексом). Мелатонин, гормон эпифиза, играет ключевую роль в регуляции циркадных ритмов, оказывая влияние путем нормализации цикла сон–бодрствование. В силу данных особенностей фармакодинамики мелатонин широко используется в клинической практике для лечения расстройств сна при нарушениях биоритмов, перелетах со сменой часовых поясов, аномальной смене светового дня (арктическая ночь или день), при сдвиге рабочего времени (ночные смены, работа сутками), первичной бессоннице, нарушении цикла сон–бодрствование при старении или у детей с неврологическими нарушениями развития [42–44].
Для создания условий проведения эксперимента, соответствующих особенностям испытуемых препаратов, была выбрана наиболее подходящая и легко воспроизводимая модель инсомнии, заключающаяся в смене клетки с подстилом, отмеченным чужим ольфакторным (запаховым) следом. В качестве тест-системы использовали половозрелых крыс-самцов, для которых чужой гендерно-аналогичный запах является предвестником возможной агрессии.
Материал и методы
Для исследования выбраны аутбредные крысы-самцы массой 300±15 г в возрасте 14–16 нед.
Животных, полученных из питомника лабораторных животных «Рапполово» (ФГУП ПЛЖ «Рапполово» РАН), содержали по 1 особи в прозрачных поликарбонатных клетках для грызунов с подстилом в виде натурального гранулята стержневой части початков кукурузы Рехофикс (ООО «Реттенмайер Рус», Россия). Замену подстила проводили 1 раз в неделю. Клетки располагались в стеллажах, к которым подключено вентиляционно-приточное устройство Био.В.С. Vent II (Bioscape (EHRET), Германия). Клетки меняли 1 раз в неделю. Питьевую воду подавали ad libitum в стандартных питьевых бутылках с полной заменой воды 2 раза в неделю. Животных содержали в контролируемых условиях окружающей среды при температуре 20–26°C и относительной влажности 30–70%. В комнатах содержания животных поддерживали 12-часовой цикл освещения и осуществляли по крайней мере 10-кратную смену объема воздуха в час. Были сформированы 4 группы животных (n=10) (табл. 2), всего 40 животных на момент начала эксперимента.

Все манипуляции с животными проводили в соответствии с Директивой 2010/63/EU Европейского парламента и Совета Европейского Союза от 22 сентября 2010 г. по охране животных, используемых в научных целях. Исследование было выполнено с соблюдением принципов Европейской конвенции о защите позвоночных животных, применяемых для экспериментов и других научных целей (Страсбург, 1986), в соответствии с правилами надлежащей лабораторной практики и протоколом биоэтической комиссии СПХФУ №Rat-AO(BI)-2020 от 10.02.20.
Процедура имплантации электрокортикографических электродов
Кортикографические электроды изготавливали из нихромовой проволоки диаметром 0,5 мм (для регистрирующих и референтного электродов) и диаметром 0,16 мм (для заземляющего). Изоляцию осуществляли с помощью термоусадочной трубки, длина регистрирующей (неизолированной) части примерно 1 мм. Все электроды объединяли в гнездо на кабель BLS-8 c шагом 2,54 мм.
Для проведения хирургических манипуляций животных предварительно наркотизировали хлоралгидратом (400 мг/кг). Перед проведением операции на глаза животных наносили офтагель (Santen OY, Финляндия) для предотвращения пересыхания роговицы глаз. После подготовки поверхности черепа (удаление мышечно-фасциального слоя, надкостницы и коагуляции кровоточащих участков) просверливали отверстия соответствующих диаметров для электродов и фиксирующих винтов (глубина погружения сверла до 1 мм). Для предупреждения нагревания головного мозга сверление осуществляли короткими интервалами. Далее крысам имплантировали кортикографические электроды (рис. 1).
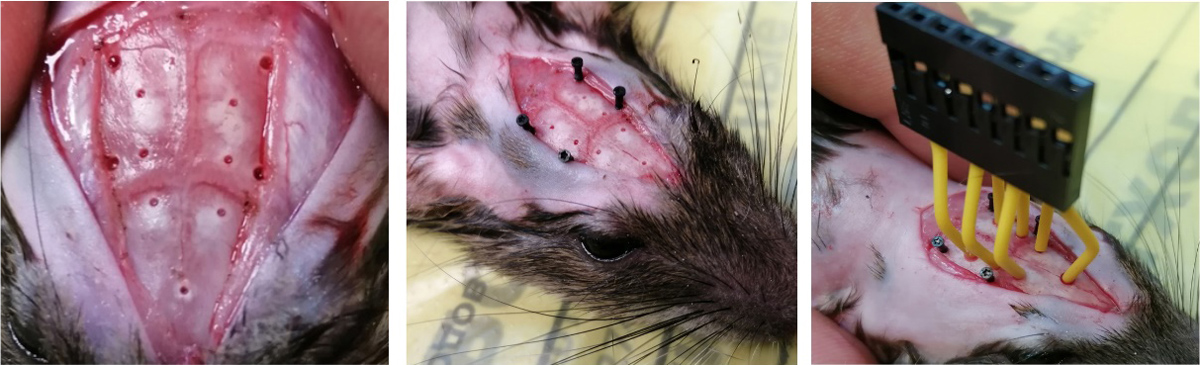
Координаты расположения электродов определяли с помощью стереотаксического атласа мозга крысы G. Paxinos, С. Watson [46]. Регистрирующие электроды были равномерно и симметрично распределены по поверхности полушарий головного мозга. Фронтальные электроды FP1 и FP2 располагали в области первичной двигательной коры (AP = 0.0, ML = 2.0, DV = 1.0), центральные С3 и С4 – первичной соматосенсорной коры (AP = –4.0, ML = 2.0, DV = 1.0), а затылочные O1 и O2 – вторичной зрительной коры (AP = –7.0, ML = 2.0, DV = 1.0). Референтный электрод устанавливали в носовую кость, заземляющий – под кожу в области шеи. Дополнительную фиксацию конструкций в черепе осуществляли с помощью стоматологической пластмассы Виллакрил С (Zhermack, Италия). После этого ушивали разрез кожи, проводили антисептическую обработку швов и прилежащей области.
После оперативного вмешательства крыс содержали в индивидуальных клетках со свободным доступом к воде и корму в течение всего периода исследования. Состояние животных отслеживали сразу после выхода из наркоза и далее ежедневно утром и вечером, по необходимости обрабатывали швы раствором йода. Для профилактики возникновения инфекции сразу после операции животным вводили бициллин-3 (500 ЕД/100 г внутримышечно). Также во избежание обезвоживания крысам вводили подкожно физиологический раствор в течение первых 3 дней после операции. Для обезболивания инъекционно применяли кетопрофен в дозе 5 мг/кг в течение 3 дней после оперативного вмешательства.
Регистрация и запись электрокортикограммы
Запись электрокортикографической активности у животных осуществляли не ранее чем через 7 дней после операции с помощью 8-канального энцефалографа Нейрон-Спектр-1 (Нейрософт, Россия) c полосой пропускания 0,5–35 Гц и частотой квантования 500 Гц. Регистрацию сигнала проводили одновременно с видеорегистрацией поведения в условиях домашней клетки при искусственном освещении. Длительность записи составляла 6 ч. Для дальнейшего анализа отбирали участки записи без артефактов.
Анализ полученных записей осуществляли с помощью программы Нейрон-Спектр.NET (Нейрософт, Россия). Рассчитывали соотношение индексов тета- и дельта-ритмов, а также индекса альфа-ритма. Дельта-ритмы характерны для состояния медленноволнового сна, седации, той или иной степени метаболических/дисциркуляторных расстройств [47]. Усиление активности тета-ритмов, особенно в отведениях над гиппокампом, свидетельствует об увеличении поисково-исследовательской активности [48]. Альфа-ритмы характерны при закрывании глаз и некоторых стадиях сна, однако определенное количество данных ритмов присутствует и в состоянии бодрствования [49].
Статистический анализ данных
Статистическую обработку полученных данных проводили с помощью пакета программы GraphPad Prism 7.00. Данные представлены в виде среднего ± стандартная ошибка среднего. Значимость различий между группами оценивали с помощью метода группирования выборок с наименее значимой разницей Фишера (Fishers LSD-test). Различия считали статистически значимыми при p < 0,05.
Результаты и обсуждение
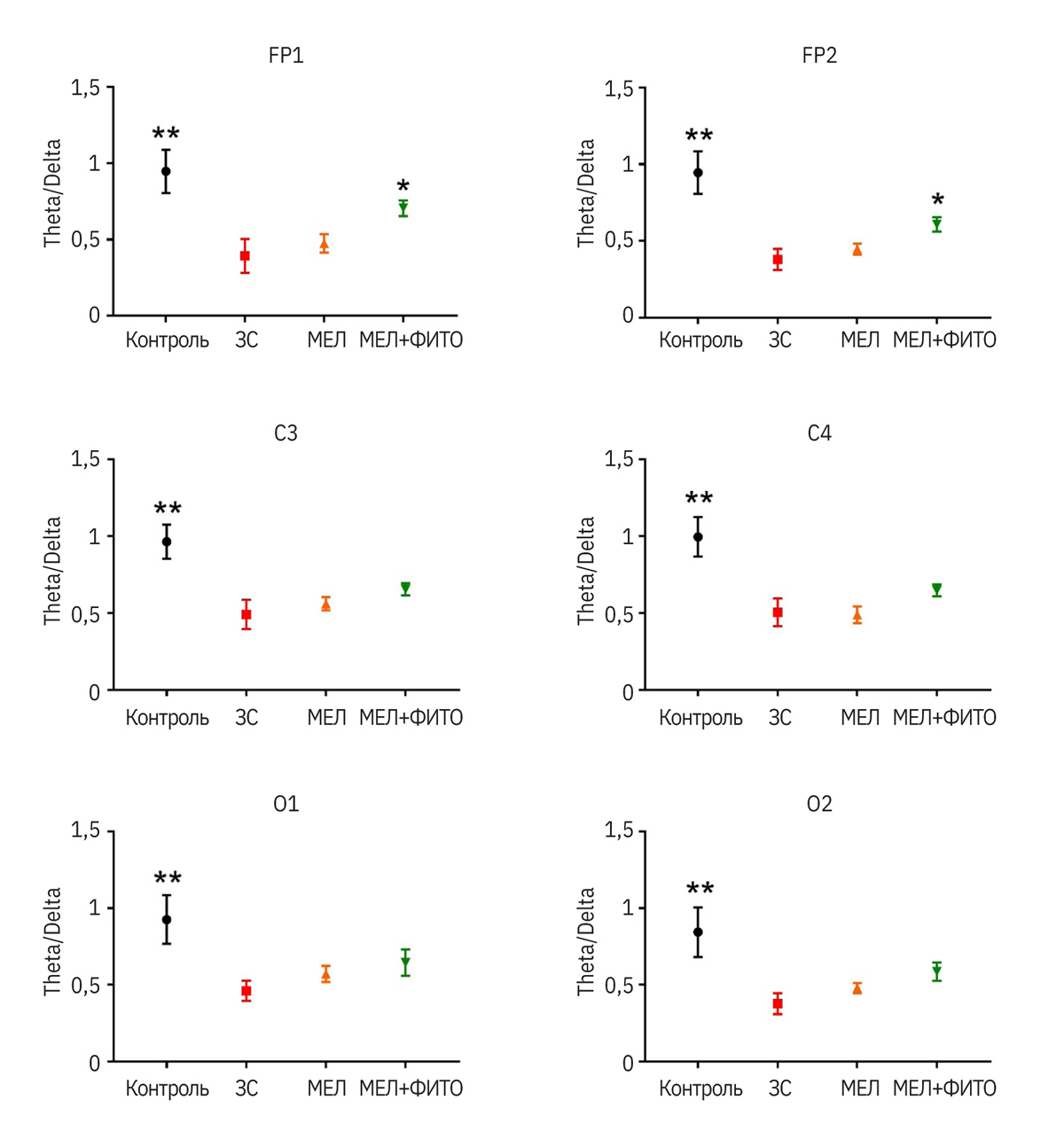
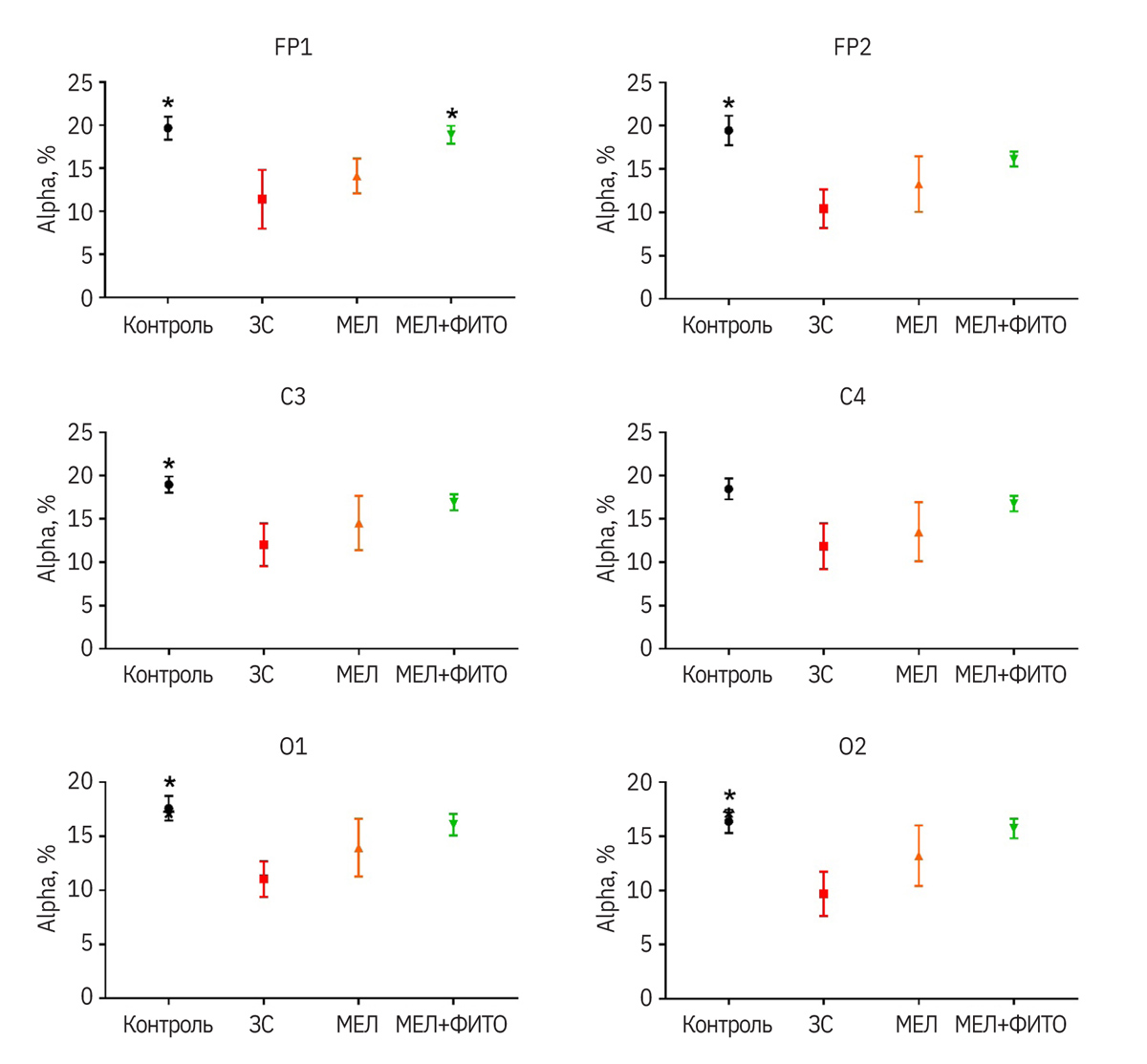
У крыс группы ЗС (ЗС – запаховый след; патология без лечения) было статистически значимо снижено соотношение тета- и дельта-ритмов во всех отведениях по сравнению с контрольной группой (p<0,01 для всех отведений) (рис. 2). Также у таких животных по сравнению с контролем индексы альфа-ритмов были меньше (p<0,05) (рис. 3).
Введение мелатонина не оказывало статистически значимого влияния на анализируемые показатели (см. рис. 2, 3). У животных, которым вводили препарат мелатонина с фито-комплексом, соотношения индексов тета- и дельта-ритмов в отведениях FP1 и FP2 были выше (p<0,05), чем у группы ЗС и приближались к значениям контрольной группы. В осталь- ных отведениях была видна четкая тенденция к увеличению данного показателя (см. рис. 2). Индекс альфа-ритмов у группы мелатонин + фитокомпоненты был выше (p<0,05) в отведении FP1 по сравнению с группой ЗС. Аналогично соотношению индексов тета- и дельта-ритмов в остальных отведе- ниях в этой группе данный показатель приближался к значениям контрольных животных (без статистически значимых различий) (см. рис. 3).
Данные, выявленные в эксперименте у животных, получавших мелатонин, в целом согласуются с таковыми, указанными в некоторых источниках литературы, в том числе S. Barbosa-Méndez и соавт. [50]. В то же время эффект комбинированного испы- туемого препарата превосходил полученный у мелатонина и приближался к таковому в группе животных без патологии.
В исследовании использовали оборудование ЦКП «Аналитический центр ФГБОУ ВО СПХФУ Минздрава России» в рамках соглашения № 075-15-2021-685 от 26 июля 2021 г. при финансовой поддержке Минобрнауки России.
Заключение
- Из 15 найденных в источниках литературы моделей оптимальной для изучения препаратов на основе мелатонина, по мнению авторов, является модель инсомнии, заключающаяся в смене клетки с ольфакторным следом.
- Препарат мелатонина с фитокомплексом, содержащим экстракты сырья валерианы, пустырника, боярышника, мяты перечной (+ масло мяты перечной) достоверно улучшал показатели соотношения индексов тета- и дельта-ритмов животных и индекса альфа-ритмов, которые приближались к значениям контрольной группы здоровых животных. На основании ЭЭГ-исследования можно сделать вывод о большей эффективности испытуемого комбинированного препарата в сравнении с референтным мелатонином.
Благодарности
Работа выполнена без спонсорской поддержки.
Вклад авторов
Н.В. Демакова – подготовка и участие в выполнении эксперимента, обсуждение полученных результатов, работа с источниками литературы, написание статьи, приведение текста статьи в соответствии с требованиями журнала
М.А. Коротыхина – подготовка и участие в выполнении эксперимента, обсуждение полученных результатов, работа с источниками литературы, написание статьи, приведение текста статьи в соответствии с требованиями журнала
Ю.И. Сысоев – подготовка и участие в выполнении эксперимента, проведение имплантации электрокортикографических электродов, анализ данных, обсуждение полученных результатов, написание статьи
А.В. Каршин – наработка испытуемого препарата, согласование дизайна эксперимента, утверждение окончательного варианта статьи
Н.А. Анисимова – анализ литературных источников
Д.Ю. Ивкин – разработка дизайна эксперимента, обобщение материала, обсуждение полученных результатов, написание статьи, утверждение окончательного варианта статьи для публикации
Сведения о конфликте интересов
Авторы заявляют об отсутствии конфликта интересов.
Список источников
- Bathory, E., & Tomopoulos, S. (2017). Sleep Regulation, Physiology and Development, Sleep Duration and Patterns, and Sleep Hygiene in Infants, Toddlers, and Preschool-Age Children. Current problems in pediatric and adolescent health care, 47(2), 29–42. https://doi.org/10.1016/j.cppeds.2016.12.001
- Revel, F. G., Gottowik, J., Gatti, S., Wettstein, J. G., & Moreau, J. L. (2009). Rodent models of insomnia: a review of experimental procedures that induce sleep disturbances. Neuroscience and biobehavioral reviews, 33(6), 874–899. https://doi.org/10.1016/j.neubiorev.2009.03.002
- Morin, C. M., Drake, C. L., Harvey, A. G., Krystal, A. D., Manber, R., Riemann, D., & Spiegelhalder, K. (2015). Insomnia disorder. Nature reviews. Disease primers, 1, 15026. https://doi.org/10.1038/nrdp.2015.26
- Стрыгин К.Н., Полуэктов М.Г. ИНСОМНИЯ. Медицинский Совет. 2017;(1S):52-58. https://doi.org/10.21518/2079-701X-2017-0-52-58 [Strygin K.N., Poluektov M.G. INSOMNIYA. Medicinskij Sovet. 2017;(1S):52-58. https://doi.org/10.21518/2079-701X-2017-0-52-58 (In Russ.)]
- Кемстач В.В., Коростовцева Л.С., Алёхин А.Н., и др. Исследования психофизиологических аспектов и этиопатогенеза инсомнии: российские и зарубежные подходы // Вестник Российского университета дружбы народов. Серия: Психология и педагогика. - 2020. - Т. 17. - №2. - C. 288-309. doi: 10.22363/2313-1683-2020-17-2-288-309 [Kemstach V.V., Korostovceva L.S., Alyohin A.N., i dr. Issledovaniya psihofiziologicheskih aspektov i etiopatogeneza insomnii: rossijskie i zarubezhnye podhody // Vestnik Rossijskogo universiteta druzhby narodov. Seriya: Psihologiya i pedagogika. - 2020. - V. 17. - №2. - p. 288-309. (In Russ.)]
- Bonnet, C., Léger, L., Baubet, V., Debilly, G., & Cespuglio, R. (1997). Influence of a 1 h immobilization stress on sleep states and corticotropin-like intermediate lobe peptide (CLIP or ACTH18-39, Ph-ACTH18-39) brain contents in the rat. Brain research, 751(1), 54–63. https://doi.org/10.1016/s0006-8993(96)01390-x
- Rampin, C., Cespuglio, R., Chastrette, N., & Jouvet, M. (1991). Immobilisation stress induces a paradoxical sleep rebound in rat. Neuroscience letters, 126(2), 113–118. https://doi.org/10.1016/0304-3940(91)90532-x
- Chang, F. C., & Opp, M. R. (2002). Role of corticotropin-releasing hormone in stressor-induced alterations of sleep in rat. American journal of physiology. Regulatory, integrative and comparative physiology, 283(2), R400–R407. https://doi.org/10.1152/ajpregu.00758.2001
- Grahnstedt, S., & Ursin, R. (1985). Platform sleep deprivation affects deep slow wave sleep in addition to REM sleep. Behavioural brain research, 18(3), 233–239. https://doi.org/10.1016/0166-4328(85)90031-2
- Ramm, P., & Smith, C. T. (1990). Rates of cerebral protein synthesis are linked to slow wave sleep in the rat. Physiology & behavior, 48(5), 749–753. https://doi.org/10.1016/0031-9384(90)90220-x
- Machado, R. B., Suchecki, D., & Tufik, S. (2006). Comparison of the sleep pattern throughout a protocol of chronic sleep restriction induced by two methods of paradoxical sleep deprivation. Brain research bulletin, 70(3), 213–220.
- Shinomiya, K., Shigemoto, Y., Okuma, C., Mio, M., & Kamei, C. (2003). Effects of short-acting hypnotics on sleep latency in rats placed on grid suspended over water. European journal of pharmacology, 460(2-3), 139–144. https://doi.org/10.1016/s0014-2999(02)02915-1
- Shinomiya, K., Shigemoto, Y., Omichi, J. et al. Effects of three hypnotics on the sleep-wakefulness cycle in sleep-disturbed rats. Psychopharmacology 173, 203–209 (2004). https://doi.org/10.1007/s00213-003-1727-0
- Shinomiya, K., Fujimura, K., Kim, Y., & Kamei, C. (2005). Effects of valerian extract on the sleep-wake cycle in sleep-disturbed rats. Acta medica Okayama, 59(3), 89–92. https://doi.org/10.18926/AMO/31980
- Pawlyk, A. C., Morrison, A. R., Ross, R. J., & Brennan, F. X. (2008). Stress-induced changes in sleep in rodents: models and mechanisms. Neuroscience and biobehavioral reviews, 32(1), 99–117. https://doi.org/10.1016/j.neubiorev.2007.06.001
- Sanford, L. D., Fang, J., & Tang, X. (2003). Sleep after differing amounts of conditioned fear training in BALB/cJ mice. Behavioural brain research, 147(1-2), 193–202. https://doi.org/10.1016/s0166-4328(03)00180-3
- Pawlyk, A. C., Jha, S. K., Brennan, F. X., Morrison, A. R., & Ross, R. J. (2005). A rodent model of sleep disturbances in posttraumatic stress disorder: the role of context after fear conditioning. Biological psychiatry, 57(3), 268–277.
- Huang, M. P., Radadia, K., Macone, B. W., Auerbach, S. H., & Datta, S. (2010). Effects of eszopiclone and zolpidem on sleep-wake behavior, anxiety-like behavior and contextual memory in rats. Behavioural brain research, 210(1), 54–66. https://doi.org/10.1016/j.bbr.2010.02.018
- Amici, R., Domeniconi, R., Jones, C. A., Morales-Cobas, G., Perez, E., Tavernese, L., Torterolo, P., Zamboni, G., & Parmeggiani, P. L. (2000). Changes in REM sleep occurrence due to rhythmical auditory stimulation in the rat. Brain research, 868(2), 241–250. https://doi.org/10.1016/s0006-8993(00)02337-4
- Khazan, N., & Sawyer, C. H. (1963). “Rebound” Recovery from Deprivation of Paradoxical Sleep in the Rabbit. Proceedings of the Society for Experimental Biology and Medicine, 114(2), 536–539. https://doi.org/10.3181/00379727-114-28725
- Zhang, Z. Q., Degejin, Geng, D., Zhang, Q., Tian, Y., Xi, Y., Wang, W. Q., Tang, H. Q., Xu, B., Lin, H. Y., & Sun, Y. K. (2016). Pharmacodynamic study on insomnia-curing effects of Shuangxia Decoction in Drosophila melanogaster. Chinese journal of natural medicines, 14(9), 653–660. https://doi.org/10.1016/S1875-5364(16)30077-2
- McKenna, J. T., Gamble, M. C., Anderson-Chernishof, M. B., Shah, S. R., McCoy, J. G., & Strecker, R. E. (2019). A rodent cage change insomnia model disrupts memory consolidation. Journal of sleep research, 28(2), e12792. https://doi.org/10.1111/jsr.12792
- Iturra-Mena, A. M., Arriagada-Solimano, M., Luttecke-Anders, A., & Dagnino-Subiabre, A. (2018). Effects of prenatal stress on anxiety- and depressive-like behaviours are sex-specific in prepubertal rats. Journal of neuroendocrinology, 30(7), e12609. https://doi.org/10.1111/jne.12609
- Datta, S., Patterson, E. H., Vincitore, M., Tonkiss, J., Morgane, P. J., & Galler, J. R. (2000). Prenatal protein malnourished rats show changes in sleep/wake behavior as adults. Journal of sleep research, 9(1), 71–79. https://doi.org/10.1046/j.1365-2869.2000.00179.x
- Sylvester, L., Kapron, C. M., & Smith, C. (2000). In utero ethanol exposure decreases rapid eye movement sleep in female Sprague-Dawley rat offspring. Neuroscience letters, 289(1), 13–16. https://doi.org/10.1016/s0304-3940(00)01261-1
- Alföldi, P., Rubicsek, G., Cserni, G. et al. Brain and core temperatures and peripheral vasomotion during sleep and wakefulness at various ambient temperatures in the rat. Pflugers Arch. 417, 336–341 (1990). https://doi.org/10.1007/BF00371001
- Amici, R., Zamboni, G., Perez, E., Jones, C. A., Toni, I., I, Culin, F., & Parmeggiani, P. L. (1994). Pattern of desynchronized sleep during deprivation and recovery induced in the rat by changes in ambient temperature. Journal of sleep research, 3(4), 250–256. https://doi.org/10.1111/j.1365-2869.1994.tb00139.x
- Landis, C. A., Levine, J. D., & Robinson, C. R. (1989). Decreased slow-wave and paradoxical sleep in a rat chronic pain model. Sleep, 12(2), 167–177. https://doi.org/10.1093/sleep/12.2.167
- Ko, C. H., Koon, C. M., Yu, S. L., Lee, K. Y., Lau, C. B., Chan, E. H., Wing, Y. K., Fung, K. P., & Leung, P. C. (2016). Hypnotic effects of a novel anti-insomnia formula on Drosophila insomnia model. Chinese journal of integrative medicine, 22(5), 335–343. https://doi.org/10.1007/s11655-014-1625-1
- Veatch L. M. (2006). Disruptions in sleep time and sleep architecture in a mouse model of repeated ethanol withdrawal. Alcoholism, clinical and experimental research, 30(7), 1214–1222. https://doi.org/10.1111/j.1530-0277.2006.00134.x
- Kubota, T., De, A., Brown, R. A., Simasko, S. M., & Krueger, J. M. (2002). Diurnal effects of acute and chronic administration of ethanol on sleep in rats. Alcoholism, clinical and experimental research, 26(8), 1153–1161. https://doi.org/10.1097/01.ALC.0000024292.05785.03
- Wang, Q., Ren, X., Zhang, X., Wang, G., Xu, H., Deng, N., Liu, T., & Peng, Z. (2020). Therapeutic Effect of Berberine on Insomnia Rats by ErbB Signaling Pathway. Medical science monitor : international medical journal of experimental and clinical research, 26, e921831. https://doi.org/10.12659/MSM.921831
- Xu, Y., Li, X., Man, D., Su, X., & A, G. (2020). iTRAQ-based proteomics analysis on insomnia rats treated with Mongolian medical warm acupuncture. Bioscience reports, 40(5), BSR20191517. https://doi.org/10.1042/BSR20191517
- Ren, X. J., Wang, G. Y., Zhang, X. P., Wang, Q. Q., & Peng, Z. P. (2020). Sedative and Hypnotic Effects and Transcriptome Analysis of Polygala tenuifolia in Aged Insomnia Rats. Chinese journal of integrative medicine, 26(6), 434–441. https://doi.org/10.1007/s11655-020-3087-6
- Dringenberg, H. C., Hargreaves, E. L., Baker, G. B., Cooley, R. K., & Vanderwolf, C. H. (1995). p-chlorophenylalanine-induced serotonin depletion: reduction in exploratory locomotion but no obvious sensory-motor deficits. Behavioural brain research, 68(2), 229–237. https://doi.org/10.1016/0166-4328(94)00174-e
- Prober, D. A., Rihel, J., Onah, A. A., Sung, R. J., & Schier, A. F. (2006). Hypocretin/orexin overexpression induces an insomnia-like phenotype in zebrafish. The Journal of neuroscience : the official journal of the Society for Neuroscience, 26(51), 13400–13410. https://doi.org/10.1523/JNEUROSCI.4332-06.2006
- Ko, C. H., Koon, C. M., Yu, S. L., Lee, K. Y., Lau, C. B., Chan, E. H., Wing, Y. K., Fung, K. P., & Leung, P. C. (2016). Hypnotic effects of a novel anti-insomnia formula on Drosophila insomnia model. Chinese journal of integrative medicine, 22(5), 335–343. https://doi.org/10.1007/s11655-014-1625-1
- Belfer, S. J., Bashaw, A. G., Perlis, M. L., & Kayser, M. S. (2021). A Drosophila model of sleep restriction therapy for insomnia. Molecular psychiatry, 26(2), 492–507. https://doi.org/10.1038/s41380-019-0376-6
- Chesselet, M. F., Richter, F., Zhu, C., Magen, I., Watson, M. B., & Subramaniam, S. R. (2012). A progressive mouse model of Parkinson's disease: the Thy1-aSyn ("Line 61") mice. Neurotherapeutics : the journal of the American Society for Experimental NeuroTherapeutics, 9(2), 297–314. https://doi.org/10.1007/s13311-012-0104-2
- McDowell, K. A., Shin, D., Roos, K. P., & Chesselet, M. F. (2014). Sleep dysfunction and EEG alterations in mice overexpressing alpha-synuclein. Journal of Parkinson's disease, 4(3), 531–539. https://doi.org/10.3233/JPD-140374
- Medeiros, D. C., Lopes Aguiar, C., Moraes, M., & Fisone, G. (2019). Sleep Disorders in Rodent Models of Parkinson's Disease. Frontiers in pharmacology, 10, 1414. https://doi.org/10.3389/fphar.2019.01414
- Sack, R. L., Auckley, D., Auger, R. R., Carskadon, M. A., Wright, K. P., Jr, Vitiello, M. V., Zhdanova, I. V., & American Academy of Sleep Medicine (2007). Circadian rhythm sleep disorders: part I, basic principles, shift work and jet lag disorders. An American Academy of Sleep Medicine review. Sleep, 30(11), 1460–1483. https://doi.org/10.1093/sleep/30.11.1460
- Schulz, P., & Steimer, T. (2009). Neurobiology of circadian systems. CNS drugs, 23 Suppl 2, 3–13. https://doi.org/10.2165/11318620-000000000-00000
- Jan, J. E., Reiter, R. J., Wasdell, M. B., & Bax, M. (2009). The role of the thalamus in sleep, pineal melatonin production, and circadian rhythm sleep disorders. Journal of pineal research, 46(1), 1–7. https://doi.org/10.1111/j.1600-079X.2008.00628.x
- Шекунова Е.В., Ковалева М.А., Макарова М.Н., Макаров В.Г. ВЫБОР ДОЗЫ ПРЕПАРАТА ДЛЯ ДОКЛИНИЧЕСКОГО ИССЛЕДОВАНИЯ: МЕЖВИДОВОЙ ПЕРЕНОС ДОЗ // Ведомости Научного центра экспертизы средств медицинского применения. 2020. Т. 10. № 1. С. 19-28. [Shekunova E.V., Kovaleva M.A., Makarova M.N., Makarov V.G. VYBOR DOZY PREPARATA DLYA DOKLINICHESKOGO ISSLEDOVANIYA: MEZHVIDOVOJ PERENOS DOZ // Vedomosti Nauchnogo centra ekspertizy sredstv medicinskogo primeneniya. 2020. T. 10. № 1. S. 19-28. (In Russ.)]
- Paxinos G., Watson C.The rat brain in stereotaxic coordinates. 7th edition. Acad. Press. 2013.
- Жирмунская Е.А. Клиническая энцефалография. М.: МЭЙБИ, 1991. 118 с. [Zhirmunskaya E.A. Klinicheskaya encefalografiya. M.: MEJBI, 1991. 118 p. (In Russ.)]
- Федотова, И. Р. Исследование структуры гиппокампальной тета-активности и ее регуляции при ориентировочном поведении крысы : специальность 03.00.13 : диссертация на соискание ученой степени кандидата биологических наук / Федотова Ирина Ростиславовна. – Москва, 2000. – 182 с.[Fedotova, I. R. Issledovanie struktury gippokampal'noj teta-aktivnosti i ee regulyacii pri orientirovochnom povedenii krysy : special'nost' 03.00.13 : dissertaciya na soiskanie uchenoj stepeni kandidata biologicheskih nauk / Fedotova Irina Rostislavovna. – Moskva, 2000. – 182 p. (In Russ.)]
- Физиология сна: Учебное пособие для ветеринарных врачей, зооинженеров, студентов факультета ветеринарной медицины, зооинженерного факультета и слушателей ФПК / В.В. Ковзов, В.К. Гусаков, А.В. Островский. – Витебск: УО ВГАВМ, 2005. – 59 с. [Fiziologiya sna: Uchebnoe posobie dlya veterinarnyh vrachej, zooinzhenerov, studentov fakul'teta veterinarnoj mediciny, zooinzhenernogo fakul'teta i slushatelej FPK / V.V. Kovzov, V.K. Gusakov, A.V. Ostrovskij. – Vitebsk: UO VGAVM, 2005. – 59 p. (In Russ.)]
- Barbosa-Méndez, S., & Salazar-Juarez, A. (2020). Melatonin does not produce sedation in rats: A chronobiological study. Chronobiology international, 37(3), 353–374. https://doi.org/10.1080/07420528.2019.1702554



