Вариабельность биохимических показателей крови и установление референсных интервалов в доклинических исследованиях. Сообщение 5: хорьки
Мирошников М.В., Султанова К.Т., Ковалева М.А. , Макарова М.Н. Вариабельность биохимических показателей крови и установление референсных интервалов в доклинических исследованиях. Сообщение 5: хорьки . Лабораторные животные для научных исследований. 2021; 4. https://doi.org/10.29296/2618723X-2021-04-04
Резюме
Несмотря на относительно небольшую численность в доклинических исследованиях, хорьки занимают определенную нишу и имеют несколько уникальных особенностей. Хорьков используют в качестве моделей при изучении желудочно-кишечных и опухолевых заболеваний, сердечно-сосудистой патологии, а также в исследованиях по изучению развития нервной и зрительной систем. Существует значительное сходство физиологии и морфологии легких хорьков и людей, в связи с чем этот вид животных используют в качестве модели для изучения муковисцидоза, гриппа и COVID-19. Цель данной работы – обобщение результатов биохимических показателей крови, полученных в проведенных ранее исследованиях на хорьках на базе НПО «Дом Фармации» в период с января по июнь 2021 г. для установления референсных значений наиболее часто определяемых биохимических показателей. Проведен ретроспективный анализ данных 11 показателей. Проанализирована выборка, состоящая из 112 хорьков (56 самцов и 56 самок), масса тела самок составляла 1200–1700 г, самцов – 1500–1900 г. Животные получены в ООО «Новые меха». Животных содержали в одинаковых стандартных условиях вивария: температура воздуха 22–26ºС, относительная влажность 40–75%, 12-часовой световой день. Кормление хорьков проводили в соответствии с Директивой 2010/63/EU Европейского парламента и Совета Европейского Союза от 22 сентября 2010 г. по охране животных, используемых в научных целях. Исследование выполнено с соблюдением принципов Европейской конвенции о защите позвоночных животных, используемых для экспериментов и других научных целей (Страсбург, 1986) и в соответствии с правилами надлежащей лабораторной практики. Определение биохимических показателей для всех животных проводили в равных условиях с использованием общепринятых аналитических методов. В сыворотке крови животных определяли следующие показатели: креатинин, мочевина, аланинаминотрансфераза, аспартатаминотрансфераза, щелочная фосфатаза, холестерин, триглицериды, общий белок, альбумин, глюкоза и общий билирубин. При сопоставлении полученных результатов и данных литературы было показано, что рассчитанные в АО НПО «Дом Фармации» референсные значения биохимических показателей хорьков в целом соотносятся с таковыми других научных центров и лабораторий, что свидетельствует о достоверности полученных данных. Представленные в статье референсные интервалы биохимического исследования крови хорьков подтверждают актуальность периодического пересмотра показателей и свидетельствуют о важности полученных результатов для адекватной интерпретации данных, установленных в лаборатории биохимии. Сравнительный анализ межиндивидуальной вариабельности биохимических показателей крови хорьков и человека демонстрирует наличие видовых различий, которые необходимо учитывать при рассмотрении результатов доклинических исследований.
Введение
Одна из основных целей доклинических исследований – представление доказательств безопасности и эффективности изучаемого соединения до начала клинических исследований [1]. Информация, полученная на данном этапе, – неотъемлемая часть дальнейшей разработки тестируемого соединения. В процессе планирования доклинических экспериментов важным аспектом является обоснование выбора конкретных моделей животных для исследования. Экспериментальная модель должна служить тестовой платформой, которая предлагает наилучшие физиологические характеристики для имитации клинических испытаний на людях [2]. Существующий подход к разработке моделей на лабораторных животных основан на сходстве этиологии и патогенеза заболевания у людей и животных [1–3]. Благодаря таким особенностям, как уход и размещение лабораторных животных, экономические затраты, этическая сторона исследований, а также возможность генетической модификации и репродукции, мелкие грызуны и зайцеобразные долгое время были предпочтительными видами в качестве экспериментальных моделей и по-прежнему доминируют среди животных, используемых в доклинических экспериментах. Однако в последние годы возрастает интерес и к другим видам животных, упущенным из внимания по экономическим и техническим причинам, анатомические или физиологические особенности которых более схожи с таковыми у человека [1].
Одной из интересных тестовых моделей является хорек [2, 3]. Несмотря на относительно небольшую численность в доклинических исследованиях, хорьки занимают определенную нишу и имеют несколько уникальных особенностей [4], например, являются альтернативой собакам и кошкам, так как по многим физиологическим и биохимическим параметрам соотносятся с этими животными [1, 2, 5, 6], о чем будет сказано более подробно далее. Хорьков используют как модель для изучения желудочно-кишечных заболеваний [7]. Примечательной является модель язвенной болезни желудка у хорьков, имеющих анатомическое и физиологическое сходство желудка с органом у человека. Кроме того, язвенная болезнь хорьков так же, как и у человека, ассоциирована с Helicobacter pylori [5, 8, 9].
Рассматриваемые животные также используется в качестве альтернативы кошкам в экспериментах по нейроэндокринологии, нейроанатомии и кардиологии [10]. Хорьки задействованы в исследованиях по изучению развития нервной и зрительной систем, а также формирования мозга плода, которое во многом схоже с развитием человеческого мозга. Исследования у новорожденных и ранних постнатальных хорьков предоставили важную информацию об органогенезе таламуса и коры головного мозга, зрительной и слуховой систем. Вместе с мышами хорьки стали моделью выбора для изучения развития зрительной системы млекопитающих [11–14].
Хорьки используются для изучения сердечно-сосудистых патологий – миокардита, инфаркта миокарда, ишемической болезни сердца. Было показано, что кардиоспецифичный тропонин I примерно на 90% идентичен таковому у человека, собак, кошек и хорьков [11–13, 15].
Хорьки выступают в качестве тест-системы при изучении потенциальных противоопухолевых агентов при моделировании различных видов карцином и лимфом, к тому же дыхательная система хорька представляет уникальную и идеальную систему для изучения молекулярных механизмов канцерогенеза при раке легких из-за воздействия дыма [14].
Существует значительное сходство физиологии и морфологии легких хорьков и людей, в связи с чем этот вид животных используют в качестве модели для изучения муковисцидоза и гриппа [16–19]. Так, грипп у хорька схож с гриппом человека – чаще всего поражаются верхние дыхательные пути, характерны чихание, выделения из носа, вялое состояние и гипертермия. Более того, типы A и B вируса гриппа человека естественным образом инфицируют хорьков, что дает возможность изучить патогенез данного заболевания [20].
В результате всего вышеизложенного неудивительно, что хорьки в качестве-тест системы широко используются для изучения патогенеза COVID-19 и передачи SARS-CoV-2. Так, после воздействия SARS-CoV-2 на слизистые оболочки хорька наблюдаются выделения из носа, хрипы, скопление слизи из ротоглотки, чихание и жидкий стул. В некоторых исследованиях зафиксированы пики повышенной температуры тела [21]. В одном из недавних исследований показано, что мембранный белок – ангиотензинпревращающий фермент-2 является рецептором SARS-CoV-2, который значительно схож у разных видов животных, таких как свиньи, хорьки, кошки, орангутанги, обезьяны и люди [22].
Хорьки широко используются в исследованиях, связанных с вирусологией, репродуктивной физиологией, анатомией и эндокринологией. Из-за сходства многих анатомических, метаболических и физиологических особенностей с человеческими использование хорька также продвигается в качестве альтернативы использованию собак и приматов. Помимо прочего, хорьки задействованы в токсикологических исследованиях в области экспериментальной тератологии. В научной литературе описаны реакции на вирус краснухи и хлорциклизин, который индуцирует хейлосхизис. К веществам, которые способны вызывать пороки развития у хорьков, относятся β-аминопропионитрил, талидомид, трипановый синий, салицилаты и ацетат метилазоксиметанола [10].
Расшифровка генома хорька показала соответствие человеческим большого количества генов, кодирующих ткани мозга, костей, сердца, легких, печени, почек, а также репродуктивной системы [23]. Ввиду анатомических и физиологических особенностей хорьков, а также вовлеченности этих животных в изучение инфекционных заболеваний вирусной этиологии, включая COVID-19, важным аспектом в доклинических исследованиях является установление референсных интервалов для данных лабораторных животных. В статье представлены референсные интервалы основных биохимических показателей хорьков для доклинических исследований и оценка частоты статистических выбросов для этих показателей.
Материал и методы
Для формирования референсных интервалов использовали данные, полученные от интактных животных в период с января по июнь 2021 г. (все проведенные эксперименты были одобрены биоэтической комиссией).
Животные были доставлены из питомника ООО «Новые меха» (Россия). Анализу подлежали данные, полученные от 56 самцов и 56 самок (небеременные и нерожавшие). Возраст самцов и самок хорьков составлял 9 мес, масса тела самок – 1200–1700 г, масса тела самцов – 1500–1900 г. Животных содержали в одинаковых стандартных условиях вивария: температура воздуха 22–26оС, относительная влажность 40–75%, 12-часовой световой день. Кормление хорьков проводили в соответствии с Директивой 2010/63/EU Европейского парламента и Совета Европейского Союза от 22 сентября 2010 г. по охране животных, используемых в научных целях. Исследование выполнено с соблюдением принципов Европейской конвенции о защите позвоночных животных, используемых для экспериментов и других научных целей (Страсбург, 1986) и в соответствии с правилами надлежащей лабораторной практики. Определение биохимических показателей для всех животных проводили в одинаковых условиях с использованием общепринятых аналитических методов. Для исследования использовали кровь, которую отбирали из локтевой вены животных в вакуумные пластиковые пробирки (ООО «Корвей», Россия). Для получения сыворотки кровь центрифугировали в течение 15 мин при 3000 об/мин на центрифуге ОПн-3.04 «Дастан» (Киргизия). Полученную сыворотку переносили во вторичные пробирки, в которых проводили определение биохимических показателей. В сыворотке крови животных на автоматическом биохимическом анализаторе Rendom Access A-25 (BioSystems, Испания) с использованием соответствующих наборов регистрировали следующие показатели: креатинин, мочевина, аланинаминотрансфераза (АЛТ), аспартатаминотрансфераза (АСТ), щелочная фосфатаза (ЩФ), холестерин (ХС), триглицериды (ТГ), общий белок, альбумин, глюкоза и общий билирубин (ОБ). Концентрацию ОБ определяли с помощью набора реактивов производства Вектор-Бест, Россия, для определения уровня остальных аналитов использовали биохимические наборы BioSystems, Испания. Статистическую обработку осуществляли с использованием пакета программ Statistica 10.0 (StatSoft, Россия) и GraphPad Prism 9 (США), статистические выбросы оценивали с помощью метода Тьюки, вид распределения определяли с помощью критерия Шапиро–Уилка, сравнение между животными разного пола проводили с применением U-критерия Манна–Уитни и t-критерия Стьюдента.
Результаты и обсуждение
Для устранения влияния аномальных значений из массива данных были исключены статистические выбросы, которые определяли отдельно для каждого показателя и пола животных по методу Тьюки [24]. Из дальнейшей работы были исключены как «extremes», или жесткие выбросы, так и «outliers», или мягкие выбросы. Были исключены данные, лежащие за пределами интервала Q3 и Q1 (1-го и 3-го квартилей). Межквартильный интервал IQR вычисляли как Q3–Q1. Верхний и нижний пределы рассчитывали следующим образом [25]:
Q1–1,5.IQR и Q3+1,5.IQR.
Данные о доле статистических выбросов по каждому показателю представлены в табл. 1.

Наибольшие статистические выбросы при анализе сыворотки крови хорьков отмечались в отношении глюкозы – 10,7 и 7,1% у самцов и самок соответственно.
Референсные интервалы для полученных результатов в зависимости от вида их распределения рассчитывали как:
Хср±1,96.SD – для нормального распределения (далее – Хср±1,96SD);
2,5–97,5 процентили (‰) для ненормального распределения.
Вид распределения определяли по критерию Шапиро–Уилка. Дополнительно проводили сравнение между животными разного пола, для чего использовали U-критерий Манна–Уитни (непараметрическое распределение) или t-критерий Стьюдента (параметрическое распределение).
Полученная биохимическая панель стандартных показателей исследуемых хорьков представлена в табл. 2.
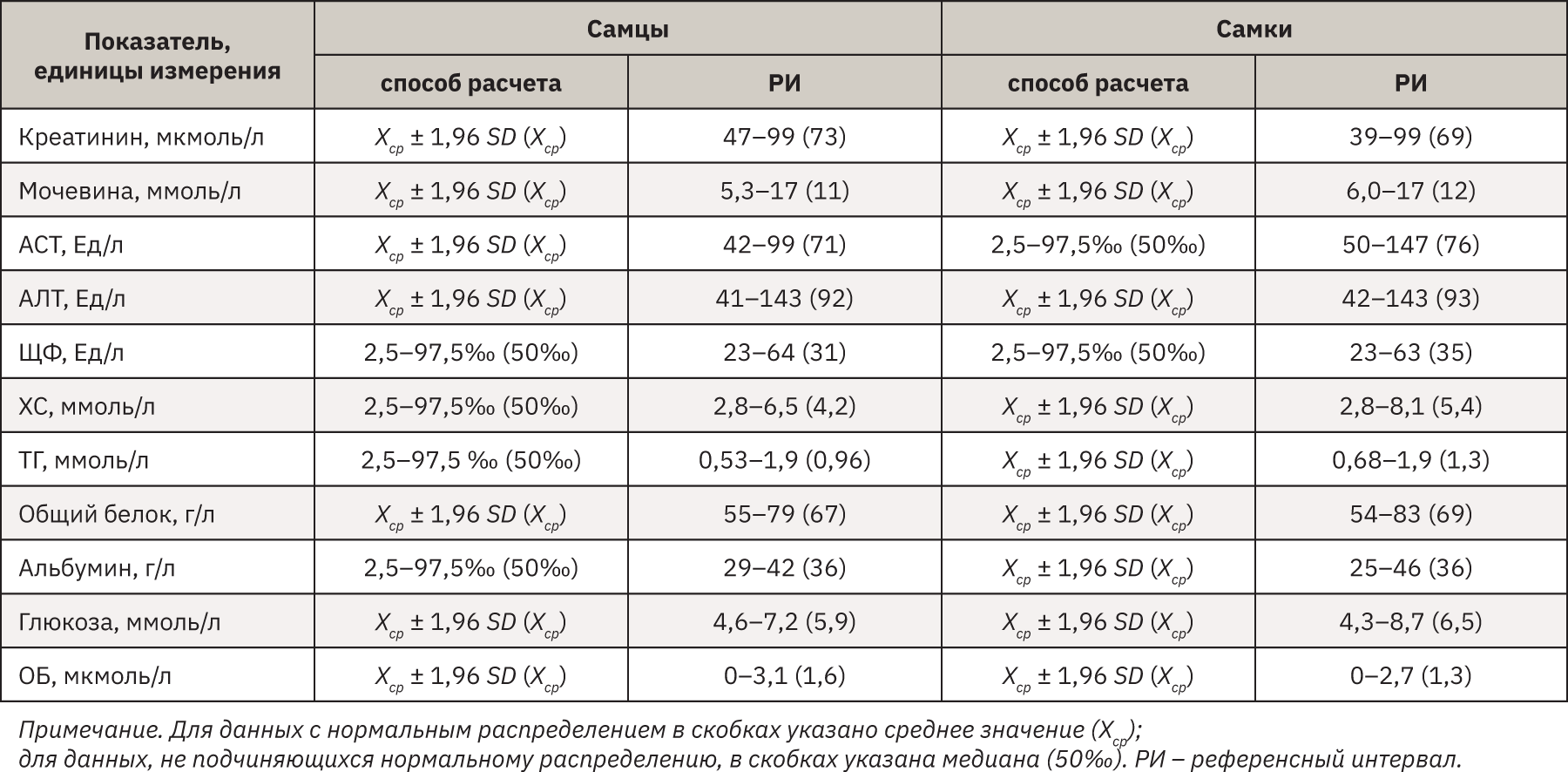
Большинство биохимических параметров хорьков имеет сходство с биохимическими параметрами собак и кошек [5].
Оценка функции печени хорьков аналогична большинству видов лабораторных животных, а также человеку. Необходимыми критериями оценки являются исследование печеночных ферментов – АЛТ и АСТ, а также ОБ. Хотя АЛТ и АСТ представляют собой ферменты, которые присутствуют во многих тканях и органах (сердце, эритроциты, головной мозг, скелетные мышцы), чаще всего изменения их концентрации в крови связаны с заболеваниями печени. Период полувыведения АЛТ у собак и хорьков составляет от 45 до 60 ч. Активность АЛТ у хорьков в печени в 3–10 раз выше, чем в других тканях . У большинства рассматриваемых животных с заболеванием печени уровень АЛТ > 275 Ед/л [26]. У человека превышение верхней границы нормы в 5–10 раз обнаруживается при таких заболеваниях, как хронический гепатит, холангит, опухоли печени, а превышение верхней границы нормы более чем в 15 раз отмечают при некрозе клеток печени (острый вирусный или токсический гепатит). Увеличение уровня АСТ наряду с концентрацией АЛТ отмечается при липидозе печени [6, 26]. Как и у многих других видов, оценка AСТ в сочетании с АЛТ или креатинкиназой полезна для дифференцировки печеночной и мышечной патологии.
Билирубин образуется в норме как результат расщепления белков, содержащих гем: гемоглобина, миоглобина и цитохрома в печени, селезенке и костном мозге. У хорьков гипербилирубинемия возникает редко, что, вероятно, связано с высокой экскрецией билирубина почками [27].
ЩФ представляет собой группу ферментов, гидролизующих монофосфаты во многих тканях организма. Наибольшую активность проявляют в клетках печени, костей, почек, слизистой оболочки кишечника и плаценты. Как и у человека, у хорьков в период активного роста регистрируется физиологическое повышение уровня ЩФ, снижающееся с возрастом. Если говорить о патологическом увеличении уровня ЩФ, то чаще всего оно встречается у хорьков при застое в желчных путях, обструкции желчных протоков, липидозе, остеопорозе и онкологических процессах в костной ткани [6, 27]. Возрастное снижение ЩФ у хорьков предположительно связано с прекращением быстрого роста костей, как и у других видов.
Для оценки функции почек хорьков, как и у человека, исследуют креатинин и мочевину в сыворотке крови.
Мочевина фильтруется в почечных канальцах, примерно 50% объема пассивно реабсорбируется в проксимальных отделах почечных канальцев, 10% активно реабсорбируется в собирательных трубочках. Уровень мочевины в сыворотке крови используется для оценки скорости клубочковой фильтрации (СКФ). Со снижением СКФ увеличивается интенсивность реабсорбции мочевины и возрастает ее уровень в крови. Однако определение концентрации этих показателей не является информативным в ранней диагностике почечной недостаточности животных, поскольку уровень мочевины и креатинина в сыворотке крови не увеличиваются вплоть до поражения 60–75% нефронов. К наиболее распространенным причинам увеличения уровня мочевины в сыворотке крови относятся гиповолемия и желудочно-кишечные кровотечения. К другим причинам увеличения уровня мочевины в крови можно отнести усиление катаболизма белка (например, при употреблении высокобелковой пищи), но при этом, как и при усиленном мышечном катаболизме, азотемии у здоровых животных не возникает [28].
Референсный интервал креатинина в сыворотке крови в норме у хорьков чаще имеет более узкий диапазон, чем у других лабораторных животных [29–31]. Повышение концентрации креатинина может быть результатом любого расстройства, которое вызывает снижение СКФ (гломерулопатии, гломерулонефриты) и/или снижение почечного кровотока. Креатинин равномерно распределяется во всех жидкостях организма, но диффундирует медленнее, чем мочевина. Приблизительно 4 ч необходимо для уравновешивания концентрации креатинина (по сравнению с 1,5 ч для мочевины).
Концентрация глюкозы в плазме (сыворотке) крови – интегральный показатель обмена углеводов в организме. Как и другие плотоядные животные, больные или голодающие хорьки способны поддерживать уровень глюкозы в пределах нормальных значений длительное время после начала патологического процесса [32]. Наиболее распространенным нарушением уровня глюкозы является гипогликемия, связанная с инсулиномой и избыточной выработкой инсулина β-клетками. Гипогликемия чаще всего связана с инсулиномой у хорьков, особенно особей старше 4 лет. Учитывая относительно высокую распространенность данного заболевания у хорьков по сравнению с другими мелкими млекопитающими, необходимо проводить измерение уровня глюкозы. У хорьков с индуцированной инсулиномой уровень глюкозы находится в пределах нормы до тех пор, пока в рационе зверьков присутствует высокобелковая пища. Другим распространенным исходом является декомпенсация регулируемой инсулиномы, вторичной по отношению к основному заболеванию, например, связанному с патологией желудочно-кишечного тракта, при которой нарушается или прерывается всасывание питательных веществ. При этом уровень глюкозы в крови ниже 3,3 ммоль/л является диагностическим для инсулиномы. Гипергликемию у хорьков можно наблюдать при стрессе. Стоит отметить, что истинный диабет у рассматриваемых животных встречается редко и сопровождается обычно гипергликемией и гиперхолестеринемией.
ХС – интегральный показатель липидного обмена и один из критериев диагностики атерогенных дислипидемий. Повышение уровня ХС и ТГ у хорьков наблюдается при сахарном диабете и выраженном холестатическом синдроме, связанном с холелитиазом, а также может быть следствием повышенного синтеза ХС в печени [33].
Общий белок – интегральный показатель белкового обмена. Уровень сывороточных белков хорька варьирует в зависимости от физического состояния животного и применения лекарственных средств [26]. При различной патологии печени, например циррозе или гепатите, наблюдается снижение соотношения альбумин/глобулин. В частности, алеутская болезнь (плазмоцитоз, вирусный плазмоцитоз, гипергаммаглобулинемия) и коронавирус у хорьков сопровождается гипергаммаглобулинемией [25].
Полученные в исследовании значения креатинина, мочевины, АСТ, АЛТ, ЩФ, ХС, ТГ, общего белка, альбумина, глюкозы и ОБ хорьков находятся на одном уровне как у самок, так и у самцов, статистической разницы не выявлено (р<0,05).
Стоит заметить, важной особенностью полученных биохимических данных является не отдельная интерпретация полученных результатов, а их совокупный анализ. Выявленное отклонение по одному отдельному параметру редко патогномонично для определения патологического процесса, чаще всего 2–3 параметра и более необходимо для оценки наличия патологии, особенно если она имеет субклинический характер [34]. Например, при заболеваниях печени у хорьков в несколько раз повышены АЛТ и АСТ: в основном АСТ при хроническом заболевании печени и АЛТ (>300 Ед/л) при остром заболевании печени. При липидозе печени у хорьков возможно повышение и уровня ОБ. Не стоит забывать и о том, что при любом подозрении на поражение печени хорька, как и у человека, можно обратить внимание на дополнительные тесты, такие как определение уровня гаммаглутамилтранспептидазы, уровня ЩФ, изменение содержания общего белка, альбумина и изменения активности лактатдегидрогеназы [35, 36]. Изменение количества общего белка, альбумина и печеночных ферментов у хорьков, как и у человека, можно увидеть и при воспалении, обезвоживании, лимфомах и коронавирусе [26, 37]. Повышение АЛТ, АСТ в совокупности с гипогликемией у хорьков также может встречаться при патологическом или физиологическом расширении пищевода (мегаэзофагус) [32]. При инсулиноме у хорьков регистрируются гипогликемия, повышение уровня АЛТ и АСТ [6].
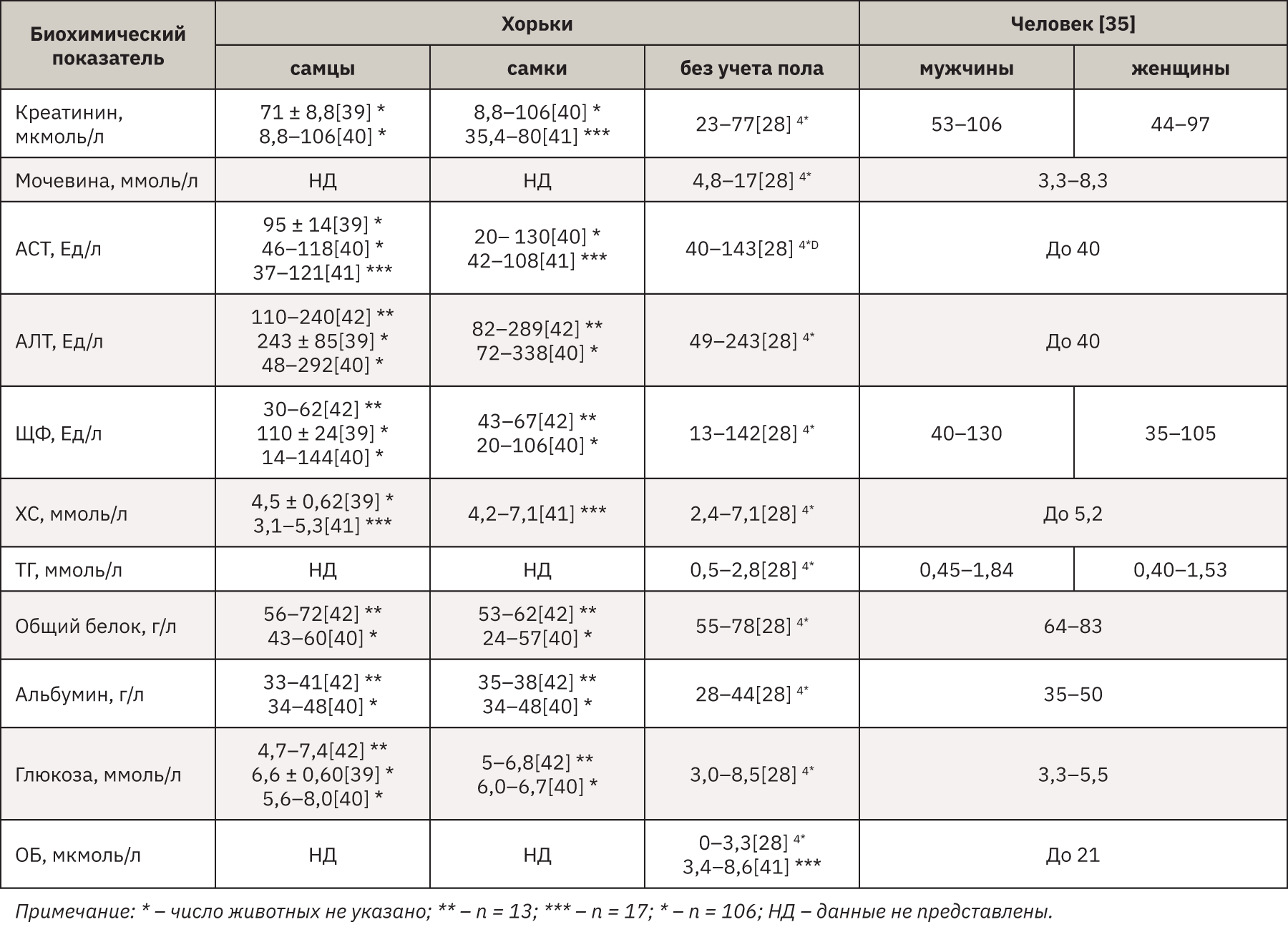
В табл. 3 представлены данные биохимических показателей крови хорьков различных пород на основании источников литературы, а также референсные интервалы человека. Был проведен перерасчет показателей, представленных в традиционных единицах, в единицы системы СИ [38].
При сопоставлении полученных результатов и данных литературы было показано, что рассчитанные в АО НПО «Дом Фармации» референсные значения биохимических показателей хорьков в целом соотносятся с таковыми других научных центров и лабораторий, что подтверждает достоверность полученных результатов.
Анализируя данные АО НПО «Дом Фармации» и литературы, касающиеся биохимических показателей крови хорьков, и соотнося их со значениями человека, показано, что концентрации креатинина, ТГ, общего белка и альбумина находятся на одном уровне. Концентрации мочевины, АСТ, АЛТ и ХС хорьков оказались выше таковых человека, а концентрации ЩФ и ОБ выше у человека. Данную информацию необходимо учитывать в дальнейших доклинических исследованиях на хорьках для правильной интерпретации полученных биохимических показателей.
В табл. 4 представлены краткие данные литературы некоторых схожих патологических состояний хорьков и человека, сопровождающиеся повышенным или пониженным содержанием того или иного биохимического показателя.

Так, увеличение концентрации креатинина и мочевины у хорьков и у человека (табл. 4) говорит о почечной недостаточности, а снижение рассматриваемых показателей сопровождается атрофией мышц или голоданием. Увеличение АСТ, АЛТ, ЩФ, ОБ, а также снижение концентрации ХС, общего белка и альбумина у хорьков и у людей часто сопровождается различными поражениями печени: гепатиты, ишемия тканей печени. Такое заболевание, как COVID-19, чаще всего сопровождается у хорьков и у людей повышением АСТ, АЛТ и снижением общего белка и альбумина. При инфаркте миокарда у обоих рассматриваемых видов отмечается повышенный уровень АЛТ и АСТ. Данная информация может быть полезной при моделировании того или иного патологического состояния на хорьках в доклинических исследованиях. Сопоставление изменений биохимических показателей у хорьков и человека в совокупности с некоторыми патологическими состояниями еще раз подтверждает значимость хорьков как тест-системы в доклинических исследованиях.
Для каждого показателя были рассчитаны коэффициенты вариации (CV=SD/Хср .100%), что в грубом приближении соответствует межиндивидуальной вариабельности этих показателей в человеческой популяции. Сравнительные данные приведены в табл. 5. Можно отметить сходную у хорька с человеком вариабельность по таким показателям, как ЩФ, мочевина, креатинин, АСТ, ХС и ТГ. В то же время значения общего белка, альбумина, глюкозы и ОБ хорьков и человека имеют различия, что может быть обусловлено видовыми особенностями.

Заключение
Хорьки как вид лабораторных животных занимают особую нишу в доклинических исследованиях. Данных животных используют для изучения патогенеза и лечения множества социально значимых заболеваний человека, включая респираторные вирусные инфекции, такие как грипп, COVID-19 и атипичную пневмонию, используют при изучении язвенной болезни, муковисцидоза, онкологических процессов, сердечно-сосудистых патологий. Представленные в статье референсные интервалы биохимического исследования крови хорьков нацелены на поддержание высокого уровня информированности научного сообщества в отношении этих показателей для адекватной интерпретации полученных данных в лабораториях при проведении доклинических исследований. Выявленная корреляция рассчитанных биохимических интервалов с информацией из источников литературы служит дополнительным подтверждением удовлетворительности результатов. Сравнительный анализ межиндивидуальной вариабельности биохимических показателей крови хорьков и человека демонстрирует наличие видовых различий, которые необходимо учитывать при рассмотрении результатов доклинических исследований.
Благодарности
Работа выполнена без спонсорской поддержки.
Вклад авторов
М.В. Мирошников – анализ научной и методической литературы, написание, редактирование и доработка текста рукописи, ответственность за все аспекты работы, связанные с достоверностью данных.
К.Т. Султанова – написание и редактирование текста рукописи, обобщение результатов исследования, работа с табличным материалом.
М.А. Ковалева – критический пересмотр содержания, анализ научной и методической литературы, редактирование текста рукописи.
М.Н. Макарова – идея, планирование дизайна статьи, редактирование текста рукописи.
Сведения о конфликте интересов
Авторы заявляют об отсутствии конфликта интересов.
Список источников
- Bähr A., Wolf E. Domestic animal models for biomedical research // Reproduction in domestic animals. – 2012. – Vol.47. – Р. 59-71.
- Park S.E., Schaer T.P. Preclinical animal models // Academic Entrepreneurship for Medical and Health Scientists. – 2019. – Vol.1. – №. 3. – Р. 20.
- Varga O.E., Hansen A.K., Sandøe P., Olsson I.A.S. Validating animal models for preclinical research: a scientific and ethical discussion // Alternatives to Laboratory Animals. – 2010. – Vol.38. – №. 3. – Р. 245-248.
- Ball R.S. Issues to consider for preparing ferrets as research subjects in the laboratory // ILAR journal. – 2006. – Vol. 47. – №. 4. – P. 348-357.
- Gad S. C. Pigs and ferrets as models in toxicology and biological safety assessment // International journal of toxicology. – 2000. – Vol. 19. – №. 3. – P. 149-168.
- Siegel A., Walton R. M. Hematology and Biochemistry of small mammals //Ferrets, Rabbits, and Rodents. – 2020. – P. 569.
- Fox J.G., Adrian L. Gastric Helicobacter infection in animals: natural and experimental infections // Helicobacter pylori Biology and Clinical Practice. – CRC Press, 2018. – P. 407-430.
- Whary M.T., Fox J.G. Natural and experimental Helicobacter infections // Comparative medicine. – 2004. – Vol. 54. – №. 2. – P. 128-158.
- Burkitt M.D., Duckworth C.A., Williams J.M. Helicobacter pylori-induced gastric pathology: insights from in vivo and ex vivo models // Disease models & mechanisms. – 2017. – Vol. 10. – №. 2. – P. 89-104.
- Fox J. G., Marini R. P. (ed.). Biology and Diseases of the Ferret. – John Wiley & Sons, 2014.
- Raila J., Gomez C., Schweigert F. J. The ferret as a model for vitamin A metabolism in carnivores // The Journal of nutrition. – 2002. – Vol. 132. – №. 6. – P. 1787S-1789S.
- Wang J., Ma Y., Sachs F. GsMTx4-D is a cardioprotectant against myocardial infarction during ischemia and reperfusion // Journal of molecular and cellular cardiology. – 2016. – Vol. 98. – P. 83-94.
- Van Riel D., Verdijk R., Kuiken T. The olfactory nerve: a shortcut for influenza and other viral diseases into the central nervous system //The Journal of pathology. – 2015. – Vol. 235 (№2). – P. 277-287.
- Barica, R., Engelhardtb, J., Gibbsc, R. Genomic and EST Sequencing of the Ferret (Mustela putorius furo). – 2013.
- Morrisey J. K. and Rebecca L. Malakoff, DVM, Diplomate ACVIM (Cardiology, Internal Medicine) //Ferrets, Rabbits and Rodents-E-Book: Clinical Medicine and Surgery. – 2020. – P. 55.
- Li Z., Jiang Q., Rezaei Sabet M. Conditions for in vitro maturation and artificial activation of ferret oocytes //Biology of reproduction. – 2002. – Vol. 66. – №. 5. – P. 1380-1386.
- Belser J.A., Pulit-Penaloza J.A., Maines T.R. Ferreting out influenza virus pathogenicity and transmissibility: Past and future risk assessments in the ferret model // Cold Spring Harbor perspectives in medicine. – 2020. – Vol. 10. – №. 7. – P. a038323.
- Nachbagauer R., Liu W.C., Choi A.A universal influenza virus vaccine candidate confers protection against pandemic H1N1 infection in preclinical ferret studies // npj Vaccines. – 2017. – Vol. 2. – №. 1. – P. 1-13.
- Крышень, К. Л., Кательникова, А. Е., Макарова, М. Н., Макаров, В. Г. Особенности экспериментальной работы с хорьками //Лабораторные животные для научных исследований. – 2019. – №. 2. [Kryshen K.L., Katelnikova А.Е., Makarova M.N., Makarov V.G. Peculiarities of Biomedical Experiments Involving Ferrets // Laboratory Animals for Science. – 2019. – №. 2. (in Russ.)].
- Maher J.A., DeStefano J. The ferret: an animal model to study influenza virus // Lab animal. – 2004. – Vol. 33. – №. 9. – P. 50-53.
- Cleary S.J., Pitchford S.C., Amison R. T. Animal models of mechanisms of SARS-CoV-2 infection and COVID-19 pathology // British journal of pharmacology. – 2020. – Vol. 177. – №. 21. – P. 4851-4865.
- Mardani, R., Vasmehjani, A. A., Zali, F. SARS-CoV-2 host diversity: An update of natural infections and experimental evidence //Journal of Microbiology, Immunology and Infection. – 2021. – Vol. 54. – №. 2. – Р. 175-181.
- Peng, X., Alföldi, J., Gori, K. The draft genome sequence of the ferret (Mustela putorius furo) facilitates study of human respiratory disease //Nature biotechnology. – 2014. – Vol. 32. – №. 12. – P. 1250-1255.
- Kannan K.S., Manoj K., Arumugam S. Labeling methods for identifying outliers // International Journal of Statistics and Systems. – 2015. – Т. 10. – №. 2. – С. 231-238.
- Giner J., Villanueva-Saz S., Tobajas A. P. SARS-CoV-2 seroprevalence in household domestic ferrets (Mustela putorius furo) // Animals. – 2021. – Vol. 11. – №. 3. – P. 667.
- Huynh M., Laloi F. Diagnosis of liver disease in domestic ferrets (Mustela putorius) // Veterinary Clinics: Exotic Animal Practice. – 2013. – Vol. 16. – №. 1. – P. 121-144.
- Hoffmann W.E., Solter P.F. Diagnostic enzymology of domestic animals //Clinical biochemistry of domestic animals. – 2008. – Vol. 6. – P. 351-378.
- Hein J., Spreyer F., Sauter-Louis C. Reference ranges for laboratory parameters in ferrets // Veterinary Record. – 2012. – Vol. 171. – №. 9. – P. 218-218.
- Greenacre C.B. Avian and Exotic Companion Animals //Nephrology and Urology of Small Animals. – 2011. – P. 855-876.
- Войтенко Н.Г., Макарова М.Н. Вариабельность биохимических показателей крови и установление референсных интервалов в доклинических исследованиях. Сообщение 3: карликовые свиньи // Лабораторные животные для научных исследований. – 2020. – №. 3. [Voitenko N.G., Makarova M.N. Variability of blood biochemical parameters and establishment of reference intervals in preclinical studies.Part 3: mini pigs. Laboratory Animals for Science. – 2020. – № 3. – P. 7–15(in Russ.)].
- Войтенко Н.Г., Макарова М.Н., Зуева А.А. Вариабельность биохимических показателей крови и установление референсных интервалов в доклинических исследованиях. Сообщение 1: крысы // Лабораторные животные для научных исследований. – 2020. – №. 1. – С. 47-53. [Voitenko N.G., Makarova M.N., Zueva A.A. Variability of blood biochemical parameters and establishing of reference ranges in nonclinical studies. Part 1: rats // Laboratory Animals for Science. – 2020. – № 1. – P. 42-53. (in Russ.)].
- Ellis C. Ferrets // Saunders Manual of Small Animal Practice. – 2006. – P. 1816.
- Hall B.A., Ketz-Riley C.J. Cholestasis and cholelithiasis in a domestic ferret (Mustela putorius furo) // Journal of Veterinary Diagnostic Investigation. – 2011. – Vol. 23. – №. 4. – P. 836-839.
- Mayer J. Interpreting the chemistry profile in ferrets // Proc North American Veterinary Conference. Orlando, FL, USA. – 2008.
- Лившиц В. М., Сидельникова В. И. Биохимические анализы в клинике: справ.-3-е изд. – 2011.
- Whalan J. E. A toxicologist's guide to clinical pathology in animals //Hematology, clinical chemistry, urinalysis. Switzerland: Springer International Publishing. – 2015.
- Mardani R. et al. Laboratory parameters in detection of COVID-19 patients with positive RT-PCR; a diagnostic accuracy study //Archives of academic emergency medicine. – 2020. – Р. 8. – №. 1.
- Конвертор единиц измерения используемых в лабораторной и медицинской практике в единицы международной системы СИ. – URL.: http://unitslab.com/ru (дата обращения: 08.2021 г.).
- Matchett C. A., Marr R., Berard F. M. The laboratory ferret. – CRC Press, 2019.
- Fudge A. M. Laboratory medicine: avian and exotic pets. – 2000.
- Greenacre C. B. Ferrets //Exotic Animal Laboratory Diagnosis. – 2020. – P. 17-44.
- Lee E.J., Moore W.E., Fryer H.C. Haematological and serum chemistry profiles of ferrets (Mustela putorius furo) //Laboratory Animals. – 1982. – Vol. 16. – №. 2. – P. 133-137.
- Kurtz D. M., Travlos G. S. (ed.). The clinical chemistry of laboratory animals. – CRC Press, 2017.
- Deng, X., Liu, B., Li, J. Blood biochemical characteristics of patients with coronavirus disease 2019 (COVID-19): a systemic review and meta-analysis //Clinical Chemistry and Laboratory Medicine (CCLM). – 2020. – Vol. 58. – №. 8. – P. 1172-1181.
- ГОСТ Р 53022.2–2008 Технологии лабораторные клинические. Требования к качеству клинических лабораторных исследований. Часть 2. Оценка аналитической надежности методов исследования (точность, чувствительность, специфичность) М., 2008. [GOST R 53022.2–2008 Tekhnologii laboratornye klinicheskie. Trebovaniya k kachestvu klinicheskih laboratornyh issledovanij. CHast' 2. Ocenka analiticheskoj nadezhnosti metodov issledovaniya (tochnost', chuvstvitel'nost', specifichnost') M., 2008. (In Russ.)]



