Динамика изменений с возрастом концентрации соматотропина в плазме крови и морфометрических параметров яичников у лабораторных самок мышей
Кательникова А.Е. , Трофимец Е.И., Матичин А.А., Фаустова Н.М., Гущин Я.А. , Макарова М.Н. Динамика изменений с возрастом концентрации соматотропина в плазме крови и морфометрических параметров яичников у лабораторных самок мышей. Лабораторные животные для научных исследований. 2020; 3. https://doi.org/10.29296/2618723X-2020-03-07
Резюме
Значительную часть регистрационного досье, формируемого с целью государственной регистрации нового лекарственного препарата (ЛП), составляют доклинические исследования. Однако в требованиях регуляторных документов по оценке безопасности фармакологического средства существенным образом не определена оценка эндокринного статуса. Тем не менее важно оценить препараты, разрабатываемые для фармацевтического рынка, на предмет их потенциального воздействия на данную систему и сравнить с нормами, описанным в литературе. Одним из гормонов, оценка влияния на который важна на этапе доклинических исследований ЛП, является гормон роста соматотропин (СТГ). Гормон роста не только ответствен за рост костей, развитие органов, метаболизм и энергетический гомеостаз, но и является одним из факторов регуляции полового созревания и фертильности у мужчин и женщин. Однако нормы уровня СТГ у лабораторных животных, используемых в доклинических исследованиях, освещены крайне мало. Мы предприняли попытку оценить уровень соматотропина в периферической крови интактных лабораторных аутбредных самок мышей в возрасте от 2 до 8 нед. Также в рамках данного эксперимента проведен морфометрический анализ состояния яичников у данных животных. По результатам исследования у аутбредных самок мышей концентрации СТГ в крови составляют от 0 до 3 нг/мл. Максимальная концентрация СТГ в плазме крови зафиксирована у самок мышей в возрасте 3 нед (2,79±0,34 (SD) нг/мл). Постепенно с увеличением возраста животного уровень гормона снижался и уже к 6-й неделе составлял 0,76±0,14 нг/мл. Полученные в эксперименте результаты по уровню СТГ у животных на начало полового созревания (приблизительно 12 дней – 2 нед) и среднему возрасту наступления пубертата у девочек (от 8 до 13 лет) сопоставимы. По результатам оценки морфометрических параметров яичников половая зрелость наступает у самок мышей в возрасте 8 нед. На 8-й неделе на фоне снижения уровня СТГ у всех животных в яичниках развиваются антральные (третичные) фолликулы и желтые тела. Для более полной оценки и разработки норм в отношении гормона роста будет интересно в дальнейшем провести оценку его уровня у аутбредных самцов мышей разного возраста, а также у других видов животных, включая негрызунов (кролики, карликовые свиньи и собаки).
Введение
Все новые лекарственные препараты (ЛП) до выхода на фармацевтический рынок должны пройти комплекс доклинических и клинических исследований. Значительную часть регистрационного досье, формируемого с целью государственной регистрации ЛП, составляют доклинические исследования. Данный этап исследования позволяет своевременно изучить эффективность и безопасность нового фармакологического средства. В рамках общей токсичности изучается большой комплекс показателей (масса тела, потребление корма и воды, клиническое наблюдение, клинический осмотр, клинический и биохимический анализы крови, массовые коэффициенты внутренних органов и др.) с оценкой влияния препарата практически на все системы организма. Однако в требованиях регуляторных документов существенным образом не определена оценка функционирования эндокринной системы [1–3]. В то же время сегодня в Европе активно разрабатываются такие требования в отношении пестицидов [4] и биоцидов [5]. В соответствии с руководствами анализ состояния эндокринного статуса не является обязательным и проводится в случае, если известны свойства тестируемого образца в отношении эндокринной системы. Некоторые ЛП (например, доксорубицин, салиномицин) оказывают негативное влияние на репродуктивную систему, развитие фолликулов, сперматогенез, и это действие может быть опосредовано, в том числе влиянием на эндокринную систему [6, 7]. Однако такую информацию с описанием возможных рисков можно найти не для всех новых соединений или она отсутствует, тогда ответственность при оценке уровня гормонов берет на себя исследователь. Тем не менее важно оценить препараты, разрабатываемые для фармацевтического рынка, на предмет их потенциального воздействия на эндокринную систему. Для этой цели подходят доклинические исследования безопасности ЛП, поскольку эндокринные системы у позвоночных сходны, многие виды животных реагируют одинаково и их гормональная чувствительность идентична. Одним из гормонов, оценка влияния на который важна на этапе доклинических исследований ЛП, является гормон роста соматотропин (СТГ). СТГ – пептидный гормон с молекулярной массой 22 кДа синтезируется и секретируется соматотропными клетками передней доли гипофиза. Исследования действия СТГ с использованием моделей трансгенных животных показали, что гормон роста не только ответствен за рост костей и развитие органов, но и является гормоном с четко выраженными катаболическими и анаболическими функциями во многих типах тканей на протяжении всей жизни организма [8, 9].
Основной мишенью СТГ является печеночная ткань. После связывания с рецептором СТГ стимулирует в клетках печени продукцию и секрецию инсулиноподобного фактора роста 1-го типа (ИФР-1). Нарушение секреции СТГ может привести к изменению обмена веществ. Ожирение, связанное со снижением секреции СТГ, тщательно изучено как у людей [10], так и у грызунов [11, 12]. Так, у мышей, выдержанных на диете с высоким содержанием жиров, увеличение массы тела не только уменьшало секрецию СТГ, но и ускоряло связанное с возрастом снижение выброса гормона в пульсирующей форме (в течение 1 сут) [11]. Снижение выброса СТГ в ответ на вызванное диетой увеличение массы тела может быть результатом повышения уровня свободных жирных кислот в крови, развития резистентности к лептину или гиперинсулинемии [9]. На сегодняшний день представлено достаточно данных о прямом влиянии СТГ на поджелудочную железу, в частности β-клетки, что может стать потенциальной основой для развития новых способов улучшения работы β-клеток при диабете [13, 14].
Способствуя развитию ожирения и диабета, изменение секреции СТГ может сказаться на других метаболических процессах и тем самым влиять на склонность организма к определенным заболеваниям. Например, тромбоэмболия легочной артерии чаще развивается у самцов мышей, чем у самок, при этом пульсирующее введение СТГ мышам с дефицитом гормона нормализовывало у самцов показатели системы гемостаза [15, 16]. В основном в работах для оценки уровня гормона или влияния на его секрецию в модельных экспериментах используют трансгенных мышей. Тем не менее в ряде экспериментов, моделирующих такие состояния, как сахарный диабет, ожирение или метаболический синдром, включая изучение токсичности лекарственного препарата, мишенью которого может являться СТГ, необходимо измерение его концентрации и соответственно сравнение со значениями, указанными в источниках литературы. Однако у лабораторных животных нормы уровня СТГ освещены крайне, мало.
Мы предприняли попытку оценить уровень соматотропина в периферической крови интактных лабораторных аутбредных самок мышей в возрасте от 2 до 8 нед. Самки были выбраны исходя из современной тенденции к использованию гормона роста для лечения бесплодия у женщин и его включения в протоколы ЭКО [17, 18]. Также в рамках данного эксперимента проведен морфометрический анализ состояния яичников у самок мышей разных возрастов.
Материал и методы
Исследование выполнено в соответствии с нормативными документами [19, 20].
В эксперименте использовали аутбредных самок мышей, полученных из питомника АО НПО «Дом Фармации» (Ленинградская обл., Россия). Характеристика групп представлена в табл. 1.
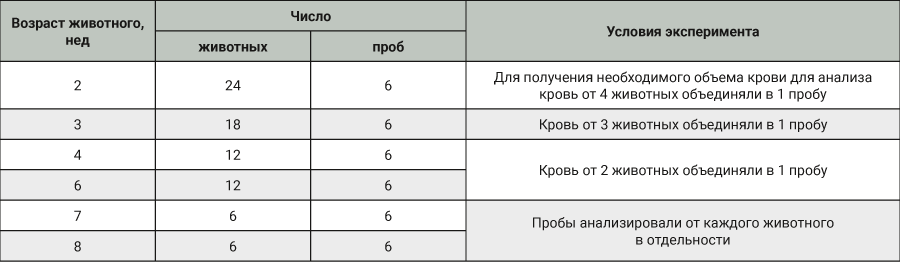
Животных содержали в стандартных условиях в соответствии с санитарно-эпидемиологическими правилами СП 2.2.1.3218-14 и с Директивой 2010/63/EU от 22 сентября 2010 г. по охране животных, используемыми в научных целях. Неполовозрелых животных в возрасте 2, 3 и 4 нед содержали с матерями. Для набора необходимого количества неполовозрелых самок мышей для эксперимента использовали 13 пометов. Мышей в возрасте 6, 7 и 8 нед содержали группами по 6 особей в клетке. В качестве корма использовали «Корм для содержания лабораторных животных» ПК-120-1, приготовленный по ГОСТу Р50258-92. Воду в стандартных поилках со стальными крышками-носиками давали ad libitum. В качестве подстила использовали древесные гранулы размером 6 мм из лиственных пород древесины.
У мышей в возрасте 7 и 8 нед отбирали кровь из полостей сердца в объеме 500 мкл, у остальных животных – максимально возможный объем. Перед проведением манипуляции с целью анестезии животные находились под воздействием СО2 до полной потери сознания. Отбор биоматериала у всех животных проводили в одно и то же время утром.
Кровь забирали в пробирки, содержащие в качестве антикоагулянта гепарин натрия (для 500 мкл крови в пробирку вносили 5 мкл раствора гепарина натрия концентрации 5000 МЕ/мл). Обязательным условием во время сбора образцов крови являлось размещение пробирок в штативах на хладоэлементах для поддержания необходимой температуры (2–8°C).
Кровь центрифугировали в течение 15 мин при 1000 g и температуре 2–8°C не позднее 30 мин от момента сбора и далее отбирали плазму. Анализ выполняли с использованием коммерческого набора для определения концентрации соматотропина Elisa kit for Growth Hormone (GH), № SEA044Mu, серия L190619110 (Cloud-Clone Corp., США) в соответствии с методикой, описанной в инструкции к набору. Аналитическая область методики 78–5000 пг/мл. Предел обнаружения 34 пг/мл, или 0,034 нг/мл. Оптическую плотность растворов измеряли на многофункциональном микропланшетном анализаторе CLARIOstar (BMG Labtech, Германия) при двух длинах волн 450 и 650 нм. Построение калибровочной зависимости и расчет концентрации соматотропина выполняли с помощью программного обеспечения Mars 3.31 (BMG Labtech, Германия). Для обработки данных была выбрана 4-параметрическая модель.
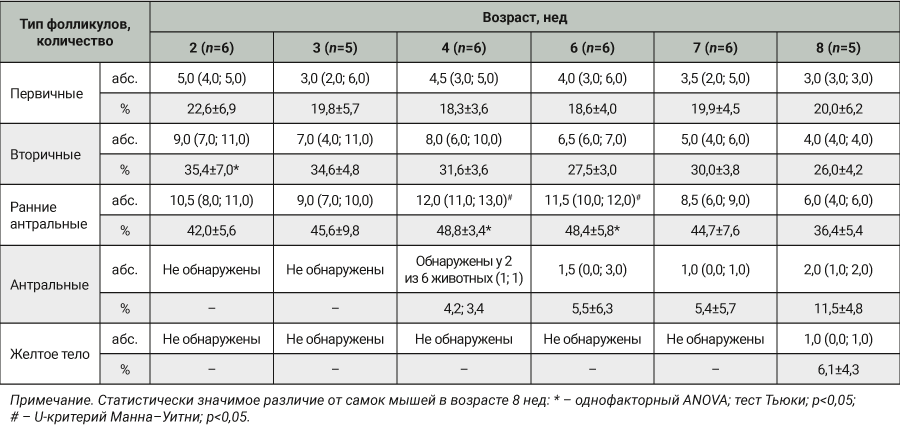
После забора крови у животных извлекали оба яичника для дальнейшего гистологического анализа. Материал фиксировали в 10% растворе нейтрального формалина в течение 24 ч, после чего по общепринятой методике заливали в парафин [21]. Затем изготавливали срезы толщиной 5–7 мкм, которые окрашивали гематоксилином и эозином. Анализ гистологических объектов проводили при помощи светооптического микроскопа Accu-Scope 3000 SERIES (Accu Scope Inc., США) при увеличении 40, 100 и 400. Для оценки функции яичников производили подсчет первичных, вторичных, ранних антральных, антральных фолликулов, желтых тел, а также патологических фолликулов в стадии атрезии в одном яичнике. Далее от общей суммы подсчитанных фолликулов вычисляли количество (%) определенного типа фолликулов в яичнике.
Статистический анализ выполняли с помощью программного обеспечения Statistica 10.0 (StatSoft, США). Данные по концентрации СТГ в крови животных и содержание (%) типа фолликула в яичнике подчинялись закону нормального распределения и были представлены в виде среднего значения (M) и стандартного отклонения (SD) (критерий Шапиро–Уилка; р>0,05). Результаты морфометрии не подчинялись закону нормального распределения и представлены в виде медианы (Me) и квартильного размаха (Q1; Q2) (критерий Шапиро–Уилка; р˂0,05). Выскакивающие значения определяли путем построения графиков (Box Whiskers). Различия считали достоверными при р˂0,05.
Результаты и обсуждение
При обработке данных выявлены выскакивающие значения в группах, где возраст животных составлял 3 и 8 нед (соответственно 1,24 и 2,04 нг/мл). Результаты измерения уровня СТГ у самок мышей представлены на рис. 1.
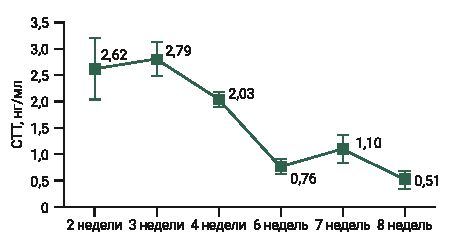
Максимальная концентрация СТГ в плазме крови зафиксирована у самок мышей в возрасте 3 нед (2,79±0,34 (SD) нг/мл). Постепенно с увеличением возраста животного уровень гормона снижался и уже к 6-й неделе составлял 0,76±0,14 нг/мл (снижение на 73%).
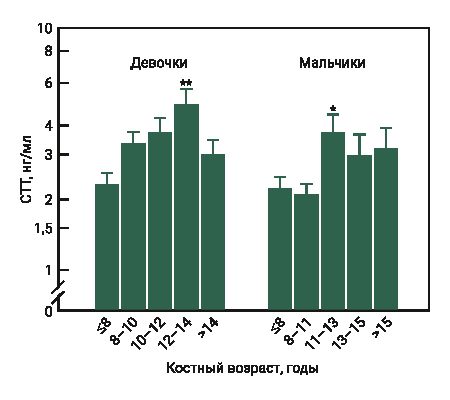
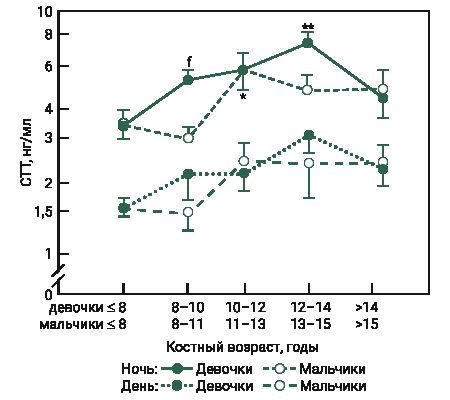
Установленные в эксперименте высокие концентрации СТГ у самок мышей в возрасте 2 и 3 нед соответствуют началу полового созревания, которое характеризуется активацией регуляторной оси гипоталамус–гипофиз–гонады и соответственно изменением уровня гонадотропина и половых стероидов в крови [22, 23]. Анаболические гормоны, которые являются кандидатами, влияющими на активацию гонадотропин-рилизинг-гормона в период полового созревания, включают ИФР-1 [24, 25]. Взаимодействие гормона роста с его основным медиатором ИФР-1 предполагает влияние/действие СТГ на половое созревание. Так, исследование R. Horikawa и соавт. [26], показало, что раннее лечение с использованием гормона роста японских детей, рожденных маленькими (отставание по росту и массе тела) для своего гестационного возраста, ускоряло наступление половой зрелости, которая первоначально была отсрочена у детей с такой патологией. S. Rose и соавт. [27] проверяли гипотезу, что секреция СТГ увеличивается в период полового созревания. Авторы измеряли уровень СТГ в образцах крови, полученных каждые 20 мин в течение 24 ч от 132 здоровых детей и подростков. Как у девочек, так и у мальчиков уровень гормона роста повышался в период полового созревания, причем увеличение среднего уровня было раньше у девочек, чем у мальчиков (рис. 2, 3).
По данным литературы, гипофиз начинает регулировать половую дифференциацию к 6-му дню у самцов мышей и до 12-го дня у самок. Влагалище у самки мыши может открыться уже на 24-й день после рождения [24]. Если учитывать начало полового созревания у самок мышей (приблизительно 12 дней) [23] и средний возраст наступления пубертата у девочек (от 8 до 13 лет) [28], то полученные в эксперименте результаты у животных в начале полового созревания сопоставимы. У мышей в возрасте 2 и 3 нед уровень СТГ составил в дневное время 2,62 и 2,79 нг/мл соответственно (см. рис. 1), у девочек в возрастной группе 8 и 8–10 лет – приблизительно от 1,5 до 2,5 нг/мл в дневное время и от 3,5 до 4,5 нг/мл в ночное (см. рис. 2, 3).
В целом физиологический уровень соматотропного гормона у человека колеблется в диапазоне от 0 до 10 нг/мл [29]. В проведенном эксперименте концентрация СТГ у мышей составила от 0 до 3 нг/мл.
Таким образом, СТГ не только ответствен за рост костей, развитие органов, метаболизм и энергетический гомеостаз, но и является одним из факторов регуляции полового созревания. Помимо описанного, СТГ также может оказывать влияние на репродуктивную функцию у мужчин и женщин, улучшая фертильность. Взаимодействие гормона роста и его основного медиатора ИФР-1 с элементами гипоталамо-гипофизарно-тестикулярной оси и их роль в сперматогенезе были исследованы in vivo на различных животных (мыши и крысы). В естественных условиях исследования с использованием незрелых и зрелых гипофизэктомированных крыс и СТГ-дефицитных мутантных самцов мышей и крыс показали, что ИФР-1 играет важную роль в регуляции стероидо- и сперматогенеза. В настоящее время продолжаются исследования на животных и на человеке роли ИФР-1 при идиопатическом бесплодии. Так, после лекарственной терапии гормоном роста, отмечался положительный эффект у 10% мужчин, страдающих идиопатическим бесплодием [30].
Результаты недавно проведенного исследования [17] показали, что применение СТГ улучшает качество ооцитов и, следовательно, эмбрионов. Полученные результаты согласуются с данными большинства аналогичных исследований [18, 31–35], свидетельствующих в пользу гипотезы, что гормон роста стимулирует яичниковый стероидогенез, рост и развитие фолликулов, а также повышает ответ яичников на стимуляцию овуляции гонадотропинами [36]. Так, по данным исследования [17], среди обследованных женщин в результате проведения программы ЭКО беременность наступила только в группе больных, получавших рекомбинантный соматотропный гормон.
По результатам микроскопического исследования яичники всех экспериментальных животных имели правильное гистологическое строение. В корковом веществе определялись многочисленные фолликулы на разной стадии зрелости. У всех самок мышей независимо от возраста среди фолликулов встречались примордиальные, состоящие из ооцита и окруженные одним слоем уплощенных фолликулярных клеток; однослойные (первичные) и многослойные (вторичные) фолликулы, образованные ооцитом и кубическими клетками гранулезы; ранние антральные фолликулы, в которых среди гранулезных клеток определяется начало формирования полости. Большое количество вторичных и ранних антральных фолликулов зарегистрировано у самок в возрасте от 2 до 6 нед, причем статистически значимо выше, чем у самок мышей 8 нед (р˂0,05; табл. 2). Антральные, или третичные, фолликулы в единичных количествах встречались у самок в возрасте 4 нед, и далее их количество увеличивалось к 8-й неделе. В возрасте 4 нед в крови у животных снижается концентрация СТГ по полученным данным и открывается влагалище у самок, по данным литературы [24], соответственно в возрасте 8 нед самки мышей достигают половой зрелости, о чем также говорят обнаруженные при микроскопии желтые тела в яичниках. Атретические тела (фолликулы физиологически обратного развития) у исследованных животных не выявлены. В табл. 2 представлены результаты данных морфометрического анализа ткани яичников.
Заключение
При изучении общей токсичности лекарственных веществ и некоторых видов специфической токсичности (например, репродуктивная токсичность), следует определять уровень СТГ, поскольку гормон не только ответствен за рост костей, развитие органов, метаболизм и энергетический гомеостаз, но и является одним из факторов регуляции полового созревания и фертильности у мужчин и женщин. Например, несмотря на то что есть данные о прямом токсическом действии препарата Доксорубицин на фолликулы яичника, опосредованном влиянии на секрецию гормона эстрадиола и созревание ооцитов [7], эффект может быть обусловлен также действием препарата на СТГ. Однако работ, которые бы напрямую оценивали влияние препарата на уровень СТГ, не найдено.
У аутбредных самок мышей концентрация СТГ в крови составляет от 0 до 3 нг/мл, что может быть нормой при данных условиях эксперимента. Для более полной оценки и разработки норм в отношении гормона роста будет интересно в дальнейшем провести оценку его уровня у аутбредных самцов мышей разных возрастов, а также у других видов животных, включая не грызунов (кролики, карликовые свиньи и собаки).
По результатам оценки морфометрических параметров яичников большое количество вторичных и ранних антральных фолликулов зарегистрировано у самок в возрасте от 2 до 6 нед. Третичные (антральные) фолликулы, которые в дальнейшем становятся зрелыми и готовы к овуляции, начинают появляться в единичных количествах у самок мышей в возрасте 4 нед. В возрасте 8 нед на фоне снижения уровня СТГ у всех самок есть антральные фолликулы и желтые тела, что говорит об овуляции у животных и их половой зрелости.
Вклад авторов
А.Е. Кательникова – концепция и дизайн исследования, написание текста статьи
Е.И. Трофимец – концепция и дизайн исследования, сбор данных
А.А. Матичин – концепция и дизайн исследования, редактирование текста статьи
Н.М. Фаустова – сбор и анализ данных
Я.А. Гущин – сбор и анализ данных
М.Н. Макарова – идея исследования, редактирование текста статьи
Список источников
- Organisation for Economic Co-operation and Development. Test no. 453: Combined chronic toxicity/carcinogenicity studies. – OECD Publishing, 2018.
- Test No. 407: Repeated Dose 28-day Oral Toxicity Study in Rodents
- Test No. 414: Prenatal Developmental Toxicity Study
- Anon. Commission Regulation (EU) No 283/2013 of 1 March 2013 setting out the data requirements for active substances, in accordance with Regulation (EC) No 1107/2009 of the European Parliament and of the Council concerning the placing of plant protection products on the market //Official Journal of the European Union L93. – 2013. – С. 1-83.
- Union E. Regulation (EU) No 528/2012 of the European Parliament and of the Council of 22 May 2012 concerning the making available on the market and use of biocidal products //Off J Eur Union L. – 2012. – Т. 167. – С. 1-116.
- Ojo O. O., Bhadauria S., Rath S. K. Dose-dependent adverse effects of salinomycin on male reproductive organs and fertility in mice //PloS one. – 2013. – Т. 8. – №. 7. – С. e69086. DOI: 10.1371/journal.pone.0069086
- Xiao S. et al. Doxorubicin has dose-dependent toxicity on mouse ovarian follicle development, hormone secretion, and oocyte maturation //Toxicological Sciences. – 2017. – Т. 157. – №. 2. – С. 320-329. DOI: 10.1093/toxsci/kfx047
- Воротникова С. Ю., Пигарова Е. А., Дзеранова Л. К. Метаболические эффекты гормона роста //Ожирение и метаболизм. – 2011. – №. 4. – С.55-59. [Vorotnikova S. YU., Pigarova E. A., Dzeranova L. K. Metabolicheskie effekty gormona rosta //Ozhirenie i metabolizm. – 2011. – №. 4. – P.55-59. (In Russ.)]
- Huang L., Huang Z., Chen C. Rhythmic growth hormone secretion in physiological and pathological conditions: Lessons from rodent studies //Molecular and cellular endocrinology. – 2019. – Т. 498. – С. 110575. DOI: 10.1016/j.mce.2019.110575
- Veldhuis J. D. et al. Differential impact of age, sex steroid hormones, and obesity on basal versus pulsatile growth hormone secretion in men as assessed in an ultrasensitive chemiluminescence assay //The Journal of Clinical Endocrinology & Metabolism. – 1995. – Т. 80. – №. 11. – С. 3209-3222. DOI: 10.1210/jcem.80.11.7593428
- Huang L. et al. The decline in pulsatile GH secretion throughout early adulthood in mice is exacerbated by dietary-induced weight gain //Endocrinology. – 2012. – Т. 153. – №. 9. – С. 4380-4388. DOI: 10.1210/en.2012-1178
- Steyn F. J. et al. Impairments to the GH-IGF-I axis in hSOD1G93A mice give insight into possible mechanisms of GH dysregulation in patients with amyotrophic lateral sclerosis //Endocrinology. – 2012. – Т. 153. – №. 8. – С. 3735-3746. DOI: 10.1210/en.2011-2171
- Poidvin A. et al. Risk of diabetes treated in early adulthood after growth hormone treatment of short stature in childhood //The Journal of Clinical Endocrinology & Metabolism. – 2017. – Т. 102. – №. 4. – С. 1291-1298. DOI: 10.1210/jc.2016-3145
- Gutefeldt K. et al. Dysregulated growth hormone‐insulin‐like growth factor‐1 axis in adult type 1 diabetes with long duration //Clinical endocrinology. – 2018. – Т. 89. – №. 4. – С. 424-430. DOI: 10.1111/cen.13810
- Wong J. H. et al. Sex differences in thrombosis in mice are mediated by sex-specific growth hormone secretion patterns //The Journal of clinical investigation. – 2008. – Т. 118. – №. 8. – С. 2969-2978. DOI: 10.1172/JCI34957
- Donahue L. R., Beamer W. G. Growth hormone deficiency in'little'mice results in aberrant body composition, reduced insulin-like growth factor-I and insulin-like growth factor-binding protein-3 (IGFBP-3), but does not affect IGFBP-2,-1 or-4 //Journal of endocrinology. – 1993. – Т. 136. – №. 1. – С. 91-104. DOI: 10.1677/joe.0.1360091
- Ниаури Д. А. Эффективность применения соматотропного гормона в программах ЭКО/ЭКО+ ИКСИ у женщин со «слабым» ответом яичников на стимуляцию гонадотропинами //Журнал акушерства и женских болезней. – 2015. – Т. 64. – №. 6. – С. 43–50. [Niauri D. A. Effektivnost' primeneniya somatotropnogo gormona v programmah EKO/EKO+ IKSI u zhenshchin so «slabym» otvetom yaichnikov na stimulyaciyu gonadotropinami //ZHurnal akusherstva i zhenskih boleznej. – 2015. – Vol. 64. – №. 6. – P. 43–50. (In Russ.)]
- HU Z. Effects of growth hormone supplementation in patients undergoing IVF/ICSI-ET with poor ovarian response to gonadotropin //Journal of Reproduction and Contraception. – 2014. – Т. 25. – №. 1. – С. 32–40. DOI: 10.7669/j.issn.1001-7844.2014.01.0032
- Приказ Министерства здравоохранения Российской Федерации от 01.04.2016 № 199н "Об утверждении Правил надлежащей лабораторной практики". [Prikaz Ministerstva zdravoohraneniya Rossijskoj Federacii ot 01.04.2016 № 199n "Ob utverzhdenii Pravil nadlezhashchej laboratornoj praktiki" (In Russ.)]
- Решение Совета ЕЭК № 81 от 03.11.16 «Об утверждении Правил надлежащей лабораторной практики Евразийского экономического союза в сфере обращения лекарственных средств». [Reshenie Soveta EEK № 81 ot 03.11.16 «Ob utverzhdenii Pravil nadlezhashchej laboratornoj praktiki Evrazijskogo ekonomicheskogo soyuza v sfere obrashcheniya lekarstvennyh sredstv». (In Russ.)]
- Мужикян А.А., Макарова М.Н., Гущин Я.А. Особенности гистологической обработки органов и тканей лабораторных животных // Международный вестник ветеринарии. – 2014. – № 2. – С. 103–109. [Muzhikyan A.A., Makarova M.N., Gushchin YA.A. Osobennosti gistologicheskoj obrabotki organov i tkanej laboratornyh zhivotnyh // Mezhdunarodnyj vestnik veterinarii. – 2014. – № 2. – P. 103–109. (In Russ.)]
- Pinter O. et al. Differences in the onset of puberty in selected inbred mouse strains //9th European Congress of Endocrinology. – BioScientifica, 2007. – Т. 14.
- Dutta S., Sengupta P. Men and mice: relating their ages //Life sciences. – 2016. – Т. 152. – С. 244-248. DOI: 10.1016/j.lfs.2015.10.025
- DiVall S. A. et al. Divergent roles of growth factors in the GnRH regulation of puberty in mice //The Journal of clinical investigation. – 2010. – Т. 120. – №. 8. – С. 2900-2909. DOI: 10.1172/JCI41069
- Brüning J. C. et al. Role of brain insulin receptor in control of body weight and reproduction //Science. – 2000. – Т. 289. – №. 5487. – С. 2122-2125. DOI: 10.1126/science.289.5487.2122
- Horikawa R. et al. Evaluation of growth hormone treatment efficacy in short Japanese children born small for gestational age: Five-year treatment outcome and impact on puberty //Clinical Pediatric Endocrinology. – 2017. – Т. 26. – №. 2. – С. 63-72. DOI: 10.1297/cpe.26.63
- ROSE S. R. et al. Spontaneous growth hormone secretion increases during puberty in normal girls and boys //The Journal of Clinical Endocrinology & Metabolism. – 1991. – Т. 73. – №. 2. – С. 428-435. DOI: 10.1210/jcem-73-2-428
- https://rzgmu.ru/images/files/c/13414.pdf
- Норма в медицинской практике: справ. пособие/под ред. А.В.Литвинова. –М.: МЕДпресс-информ, 2014. – 144 с. [Norma v medicinskoj praktike: sprav. posobie/pod red. A.V.Litvinova. –M.: MEDpress-inform, 2014. – 144 p. (In Russ.)]
- Демяшкин Г. А. Морфологическая характеристика сперматогенеза в норме и при идиопатическом бесплодии (иммуногистохимический аспект) // Вестник медицинского института "РЕАВИЗ": реабилитация, врач и здоровье. 2015. №. 4. С. 107-119. [Demyashkin G. A. Morfologicheskaya harakteristika spermatogeneza v norme i pri idiopaticheskom besplodii (immunogistohimicheskij aspekt) // Vestnik medicinskogo instituta "REAVIZ": reabilitaciya, vrach i zdorov'e. 2015. №. 4. P. 107-119. (In Russ.)]
- Kyrou D. How to improve the probability of pregnancy in poor responders undergoing in vitro fertilization: a systematic review and meta-analysis // Fertility and sterility. – 2009. – Т. 91. – №. 3. – С. 749–766. DOI: 10.1016/j.fertnstert.2007.12.077
- De Ziegler D. The value of growth hormone supplements in ART for poor ovarian responders //Fertility and sterility. – 2011. – Т. 96. – №. 5. – С. 1069–1076. DOI: 10.1016/j.fertnstert.2011.09.049
- Yovich J. L., Stanger J. D. Growth hormone supplementation improves implantation and pregnancy productivity rates for poor-prognosis patients undertaking IVF //Reproductive biomedicine online. – 2010. – Т. 21. – №. 1. – С. 37–49. DOI: 10.1016/j.rbmo.2010.03.013
- Izadyar F. Preimplantation bovine embryos express mRNA of growth hormone receptor and respond to growth hormone addition during in vitro development //Molecular Reproduction and Development: Incorporating Gamete Research. – 2000. – Т. 57. – №. 3. – С. 247-255. DOI: 10.1002/1098-2795 (200011)57:3<247::AID-MRD6>3.0.CO; 2-Q
- Izadyar F. Messenger RNA expression and protein localization of growth hormone in bovine ovarian tissue and in cumulus oocyte complexes (COCs) during in vitro maturation // Molecular Reproduction and Development: Incorporating Gamete Research. – 1999. – Т. 53. – №. 4. – С. 398-406. DOI: 10.1002/ (SICI)1098-2795 (199908)53:4<398::AID-MRD5>3.0.CO; 2-I
- Homburg R. Growth hormone facilitates ovulation induction by gonadotrophins //Clinical endocrinology. – 1988. – Т. 29. – №. 1. – С. 113-117., Owen E. J. Co-treatment with growth hormone of sub-optimal responders in IVF-ET //Human Reproduction. – 1991. – Т. 6. – №. 4. – С. 524-528. DOI: 10.1111/j.1365-2265.1988.tb00252.x



