Экспериментальное моделирование карциномы яичника
Муразов Я.Г. , Нюганен А.О. , Артемьева А.С. Экспериментальное моделирование карциномы яичника. Лабораторные животные для научных исследований. 2020; 3. https://doi.org/10.29296/2618723X-2020-03-05
Резюме
Несмотря на достигнутые успехи в хирургическом и лекарственном лечении рака яичников (РЯ), смертность среди женщин от этого злокачественного новообразования остается высокой. Эпителиальный РЯ (ЭРЯ) является доминирующим гистологическим типом, а серозная карцинома высокой степени злокачественности (СКВСЗ) – это основной подтип ЭРЯ, на который приходится около 90% случаев смерти. В настоящее время имеются данные о дуалистическом происхождении СКВСЗ. Нерешенным остается вопрос: развивается ли она в результате метапластической трансформации и просто морфологически напоминает опухоли яйцевода (аналог фаллопиевых труб у женщин) или все же первично возникает из клеток яйцевода? Понимание биологии опухолевого роста, оценка эффективности и безопасности фармакологических средств, новых методов лечения (включая нормо- и гипертермическую внутрибрюшинную химиотерапию), изучение прогностических и предиктивных биомаркеров невозможны без воспроизводимых экспериментальных моделей in vivo, обеспечивающих приемлемую предсказуемость результатов доклинических испытаний для дальнейших клинических исследований. В обзоре представлены данные об основных группах экспериментальных моделей ЭРЯ у лабораторных животных. Описаны преимущества и недостатки спонтанных, канцероген-индуцированных, генно-инженерных, сингенных моделей. Описаны трансгенные модели с инактивацией обоих путей p53 и Rb, генов Brca 1/2 , Pten и Tp53 в секреторном эпителии фаллопиевых труб (яйцеводов) мышей с двойным нокаутом генов Dicer и Pten. Приведены сведения о моделях, основанных на трансплантации ксенографтов клеточных линий человека (A2780, OVCAR-3 и SKOV-3), а также о PDX-моделях (patient-derived xenograft) у иммунодефицитных животных. Рассмотрены особенности основных способов трансплантации ксенографтов (ортотопический и гетеротопический). Дана морфологическая характеристика моделируемых злокачественных новообразований. Описан метастатический потенциал экспериментальных моделей, приведены сведения о локальной и системной диссеминации опухолей, формировании асцита. Кратко представлены собственные результаты изучения сингенной high-grade-карциномы яичников у крыс-самок Wistar. Для каждой группы модели обозначены применимые области исследований. Статья будет интересна широкому кругу специалистов, занимающихся фундаментальными и регистрационными доклиническими исследованиями.
Введение
По данным GLOBOCAN, в мире рак яичника (РЯ) занимает 7-е место в структуре онкологической заболеваемости среди женщин и является самым летальным онкогинекологическим заболеванием [1]. До 90% случаев РЯ имеют эпителиальное происхождение (эпителиальный РЯ – ЭРЯ), остальные – неэпителиальной природы [2]. Серозная карцинома высокой степени злокачественности (СКВСЗ) составляет >70% всех случаев ЭРЯ и ассоциирована примерно с 90% случаев смерти от ЭРЯ. Из-за отсутствия специфических клинических симптомов на ранних стадиях около 80% больных ЭРЯ диагностируются уже на стадии распространенного процесса. Внутрибрюшинная диссеминация опухоли является превалирующим путем метастазирования ЭРЯ [3]. Пациентки с ЭРЯ и перитонеальным канцероматозом имеют 5-летнюю общую выживаемость на уровне 25–29%, в то время как на ранних стадиях она составляет более 90% [4]. Учитывая неудовлетворительные мировые онкоэпидемиологические показатели, характерные для РЯ, значительную долю больных с диссеминированными формами, высокую летальность и частоту рецидивов, а также ограниченный арсенал противоопухолевых агентов, необходимы дальнейший поиск эффективных средств лечения и изучение биологии опухолевого роста данного злокачественного новообразования. Эти задачи можно решить только при наличии воспроизводимых экспериментальных моделей in vivo, обеспечивающих приемлемую предсказуемость результатов доклинических испытаний для дальнейших клинических исследований.
Модели, основанные на спонтанном канцерогенезе яичника
Описаны модели РЯ, основанные на спонтанном канцерогенезе у кур, некоторых линий мышей, крыс Wistar и Sprague-Dawley и приматов из семейства мартышковых. Спонтанные аденокарциномы яичника кур развиваются с низкой частотой среди животных моложе 2 лет [5]. У грызунов спонтанные опухоли по гистологическому типу довольно разнообразны: тубулярная аденома, папиллярная цистаденома, аденокрацинома, мезотелиома, опухоли стволовых клеток, гранулезные опухоли и опухоли полового тяжа [6]. У макак возникают спонтанно стромальные, но не эпителиальные опухоли, характерные для человека [7]. Спонтанные опухоли яичника у всех животных указанных видов непригодны для экспериментальных исследований, так как требуется длительное время для развития, а частота их возникновения крайне низкая.
Канцероген-индуцированные модели
Известны химически индуцированные модели РЯ, которые появились в конце 1960-х годов. Следует отметить, что ни один из химических канцерогенов напрямую не связан с патогенезом ЭРЯ. Для индукции химического канцерогенеза яичников применяются 7,12-диметилбенз[a]антрацен; 20-метилхолантрен; 1,3-бутадиен; 2-[4- (5-нитро-2-фурил)-2-тиазолил] гидразид муравьиной кислоты и N-метил-N-нитрозомочевина [8–11]. Использование в качестве канцерогена 7,12-диметилбенз[a]антрацена позволяет получить массивные опухоли, иногда с внутрибрюшинными очагами и геморрагическим асцитом [12]. Индуцированные данными канцерогенами опухоли представляют собой опухоли поверхностного эпителия яичника, что подтверждает происхождение этих карцином из поверхностного эпителия. Однако эти опухоли состоят из клеток, напоминающих злокачественные клетки или эндометрия, или яйцевода (аналог фаллопиевых труб человека), и организованы в виде железистых или папиллярных структур, близких по строению к серозным карциномам эндометрия и яичников соответственно. Поэтому спорным остается вопрос относительно происхождения этих химически индуцированных опухолей: развились они непосредственно из поверхностного эпителия яичника в результате метапластической трансформации и просто морфологически напоминают опухоли яйцевода или все же первично возникли из клеток яйцевода [6]. Происхождение СКВСЗ остается предметом для дискуссий. В настоящее время имеются данные о дуалистическом происхождении СКВСЗ из поверхностного эпителия яичников и из эпителия маточных труб [13]. Кроме того, канцероген-индуцированные модели РЯ характеризуются большим разбросом во времени появления опухолей и частотой возникновения, непредсказуемым гистологическим вариантом и до конца неизученными молекулярными механизмами канцерогенеза. Работа с канцерогенами требует специальных условий и навыков, а также небезопасна как для исследователей, так и для технического персонала экспериментально-биологических клиник (вивариев). Основным предназначением канцероген-индуцированных моделей следует считать исследования по химиопрофилактике рака.
Генно-инженерные модели
Такие модели основаны на прямом введении онкогенов или инактивации генов-онкосупрессоров непосредственно в яйцеводе и довольно сложно воспроизводимы. Первая модель описана у самок трансгенных мышей, экспрессирующих трансформирующий вектор SV40 под контролем промотора гена рецептора антимюллерова гормона II типа (Mullerian inhibitory substance type II receptor). У мышей возникали двусторонние опухоли яичника с частотой 50%. По гистологическому типу это были низкодифференцированные карциномы с редко встречающимися кистами и папиллярными структурами на поверхности яичника. Наблюдалась внутрибрюшинная диссеминация опухолей с поражением сальника и формированием асцита [14]. Двойной нокаут генов Dicer и Pten у мышей позволил получить модель ЭРЯ, клинически сходную с СКВСЗ у человека. Опухоль первично вырастает в яйцеводе, распространяясь затем в яичники и брюшную полость, с формированием асцита и гибелью 100% животных [15]. Также известны трансгенные модели на мышах с инактивацией генов Brca 1/2, Pten и Tp53 в секреторном эпителии фаллопиевых труб (яйцеводов), что отчасти воспроизводит молекулярно-генетические изменения при СКВСЗ [16]. Описаны трансгенные модели с инактивацией обоих путей p53 и Rb [17]. Область применения генно-инженерных моделей – исследования химиопрофилактических агентов, изучение процессов инициации и прогрессии канцерогенеза. Модели реалистично воспроизводят микроокружение опухоли, а также известные генетические нарушения. Основными недостатками трансгенных моделей являются их трудоемкость, дороговизна, существенные временные затраты на индукцию опухолей. Кроме того, моделируемые генетические изменения лишь отчасти воспроизводят таковые, характерные для спонтанных СКВСЗ у человека.
Ксенографты. Общая характеристика
Известны модели ЭРЯ, основанные на трансплантации ксенографтов человека (клеточных линий, опухолевой ткани или асцитической жидкости) иммунодефицитным животным: бестимусным SCID-мышам (severe combined immunodeficient mice) и NOD-мышам (the nonobese diabetic mice). Необходимо отметить, что использование иммунодефицитных животных не позволяет в полной мере изучить влияние микроокружения на рост опухоли и противоопухолевый иммунный ответ. Для трансплантации ксенографтов ЭРЯ используется три пути введения: подкожный (эктопический), внутрибрюшинный и ортотопический (в яичниковую сумку) [18, 19]. Ключевые особенности каждого из способов трансплантации приведены в таблице.
Ксенографты клеточных линий человека
Несмотря на ряд существенных недостатков, ксенотрансплантация клеточных линий человека наиболее часто применяется в качестве моделей ЭРЯ. В настоящее время известно около 100 клеточных линий человека, используемых для ксенотрансплантации. Они перевиваются подкожно, внутрибрюшинно или ортотопически [20]. Наиболее часто используются линии A2780, OVCAR-3 и SKOV-3. Эти опухоли, как правило, характеризуются неясной, недифференцированной морфологией с комплексными генетическими изменениями, так как были получены от пациентов с распространенными стадиями ЭРЯ, вероятно, уже получившими противоопухолевое лечение химиотерапевтическими средствами. A2780 получена из эндометриоидного подтипа РЯ, а SKOV-3 наиболее очевидно получена из светлоклеточного подтипа РЯ [21]. Клеточная линия OVCAR3 близка к СКВСЗ. В доклинических исследованиях с использованием ксенотрансплантатов линии OVCAR3 была продемонстрирована противоопухолевая активность ряда агентов, например, анти-VEGF препаратов (VEGF – сосудистый эндотелиальный фактор роста) в монорежиме или комбинации с химиотерапией (паклитаксел). В дальнейшем эти результаты нашли подтверждение в рамках клинических исследований [22]. В проведенном S. Domcke и соавт. анализе панели из 47 клеточных линий РЯ установлено, что наиболее часто используемые линии значительно отличаются по молекулярно-генетическому профилю от образцов опухолей СКВСЗ, что осложняет интерпретацию результатов доклинического изучения эффективности новых противоопухолевых средств, механизмов развития резистентности и возникновения нежелательных явлений. Значимые различия выявлены для вариаций числа копий генов, мутаций и изменения экспрессионного профиля матричной рибонуклеиновой кислоты (мРНК) [23]. Основные преимущества ксенографтов клеточных линий человека – простота моделей, быстрота роста опухолей, воспроизводимость, а также реалистичность опухолевой прогрессии. К недостаткам следует отнести гомогенность и моноклональность клеток возникающих опухолей и их низкую предсказуемость для человека. Использование иммунодефицитных животных не позволяет моделировать взаимодействие опухоли с ее микроокружением в контексте развития иммунного ответа, воспаления, васкуляризации, взаимодействия со стромальными компонентами. Установлено, что противоопухолевый иммунный ответ и иммунное микроокружение опухолей яичника играют важную роль в формировании метастазов [24]. Необходимо также отметить высокую стоимость данных моделей и необходимость специальных условий для содержания тест-систем.
Модели PDX (patient-derived xenograft)
Модели основаны на гетеротрансплантации свежей опухолевой ткани или асцитической жидкости, полученной от пациентов, иммунодефицитным мышам. Трансплантация может осуществляться ортотопически, подкожно или внутрибрюшинно. Первая ортотопическая трансплантация РЯ человека была выполнена в 1993 г. под капсулу яичника бестимусной мыши. Энграфтмент опухолей наблюдался у 40% животных. Авторы отмечали локальный опухолевый рост, а также развитие метастазов в париетальной брюшине, сальнике, толстой кишке и образование асцита [25]. По данным J. Wu и соавт. [26], при подкожной или ортотопической (путем подшивания опухоли к яичнику) трансплантации образцов опухоли от 27 пациентов с различными вариантами РЯ (СКВСЗ, метастатический ЭРЯ, пограничные опухоли яичника, светлоклеточная карцинома, гранулезоклеточная опухоль яичника и др.) формирование опухолей (tumor formation rate, TFR) отмечено у 18,52% мышей, что несколько ниже значений, описанных в литературе (диапазон 25–100%). В работе F.Ricci и соавт. [27] получено 138 ксенографтов ЭРЯ из опухолей человека в процессе циторедуктивных вмешательств или парацентеза по поводу асцита. Из них 25% успешно перевивались мышам-самкам NCr-nu/nu. Трансплантацию выполняли подкожно (для солидных образцов опухоли), внутрибрюшинно (для асцитных вариантов) или ортотопически под сумку яичника (солидные и асцитные опухоли). При внутрибрюшинной и ортотопической трансплантации наблюдали рост опухолей яичника III степени злокачественности с диффузной диссеминацией в брюшную полость, иногда с формированием асцита. Опухоль достигала массы в 1 г и при внутрибрюшинном и при подкожном введении ксенографтов, однако происходило это за разное время: в течение 1–15 мес для подкожных, 1–4 мес для внутрибрюшинных. Перевиваемые ксенографты были очень чувствительны, чувствительны и резистентны к цисплатину [27]. Известны способы трансплантации ксенографтов опухолей человека под капсулу почки. В работе C-H.Lee и соавт. [28] различные варианты опухолей яичников (папиллярная серозная аденокарцинома, пограничные и доброкачественные муцинозные цистаденомы, гранулезоклеточные опухоли, пограничные серозные опухоли, переходные и недифференцированные опухоли поверхностного эпителия яичника грейда 3) трансплантировались под капсулу почки SCID/NOD мышам. Степень энграфтмента составила >95%. Широкое распространение PDX-модели получили благодаря схожести с ЭРЯ человека гетерогенности опухолей, молекулярно-генетических нарушений и процессов прогрессирования. Эти модели обеспечивают приемлемую предсказуемость результатов доклинических исследований в отношении патологии у человека. Несмотря на ряд преимуществ PDX-моделей, они все же не лишены существенных недостатков. Довольно часто при трансплантации ксенографтов человека у иммунодефицитных животных наблюдается развитие лимфопролиферативных заболеваний с атипичной диссеминацией опухоли и поражением органов средостения, гепатоспленомегалией и CD45+ лимфобластной атипией. При этом не наблюдается энграфтмента опухолей яичника [29]. Кроме того, PDX-модели генетически нестабильны, что выражается в изменении числа копий генов (copy number alterations) после пассажа опухолей in vivo, что, несомненно, следует учитывать при интерпретации результатов изучения противоопухолевых агентов, полученных на PDX-моделях [30]. Как уже было отмечено, для PDX-моделей сильно варьирует время развития опухолей, а степень энграфтмента зависит от характеристик трансплантируемой опухоли, линии мышей и способа трансплантации ксенографтов. PDX-модели малопригодны для изучения противоопухолевого иммунитета и взаимодействия опухоли со стромальными компонентами, так как имплантируемая строма человека впоследствии замещается мышиной [31]. Разработка, культивирование и поддержание PDX-моделей требуют специальных условий, существенных временных и финансовых затрат.
Сингенные модели
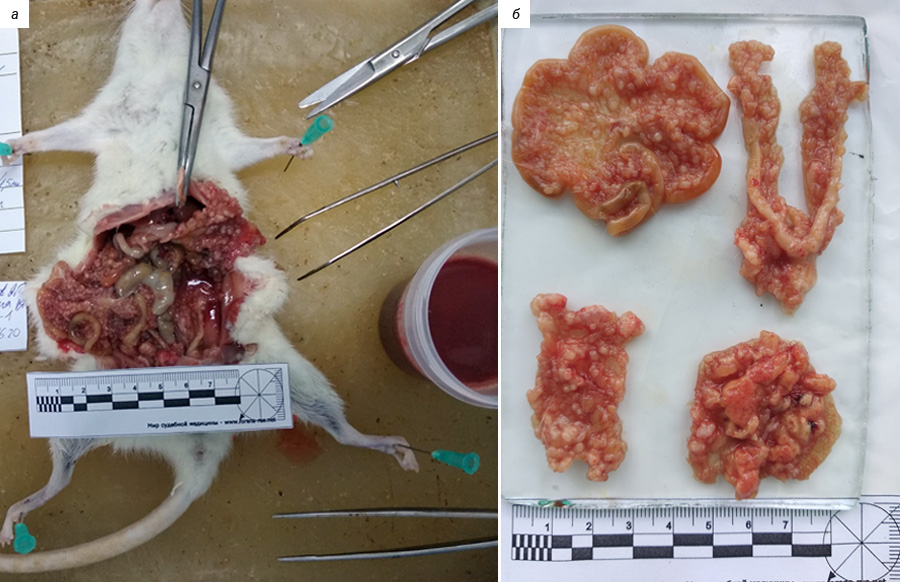
Эта группа моделей основана на трансплантации иммунокомпетентным реципиентам опухолевых клеток, полученных от той же самой линии (или вида) животных. В 60-х годах прошлого века в Институте экспериментальной и клинической онкологии АМН СССР (ныне НМИЦ онкологии им. Н.Н. Блохина) была получена асцитная опухоль яичника, перевиваемая внутрибрюшинно аутбредным крысам-самкам Wistar. Исходная опухоль была обнаружена случайно у 9-месячной крысы-самки Wistar, мать которой получала во время беременности и лактации 7,12-диметилбенз[a]антрацен. Опухоль обширно метастазировала в брюшину и сальник с формированием асцита. Полученная опухолевая взвесь и асцит (папиллярная аденокарцинома) были многократно перевиты крысам-самкам Wistar внутрибрюшинно [32].
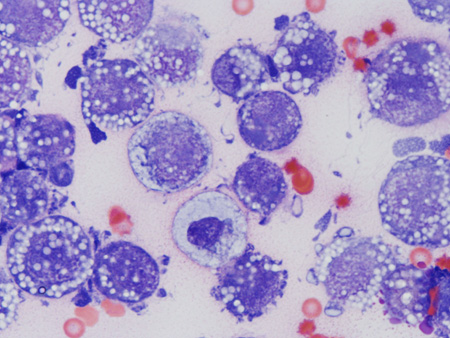
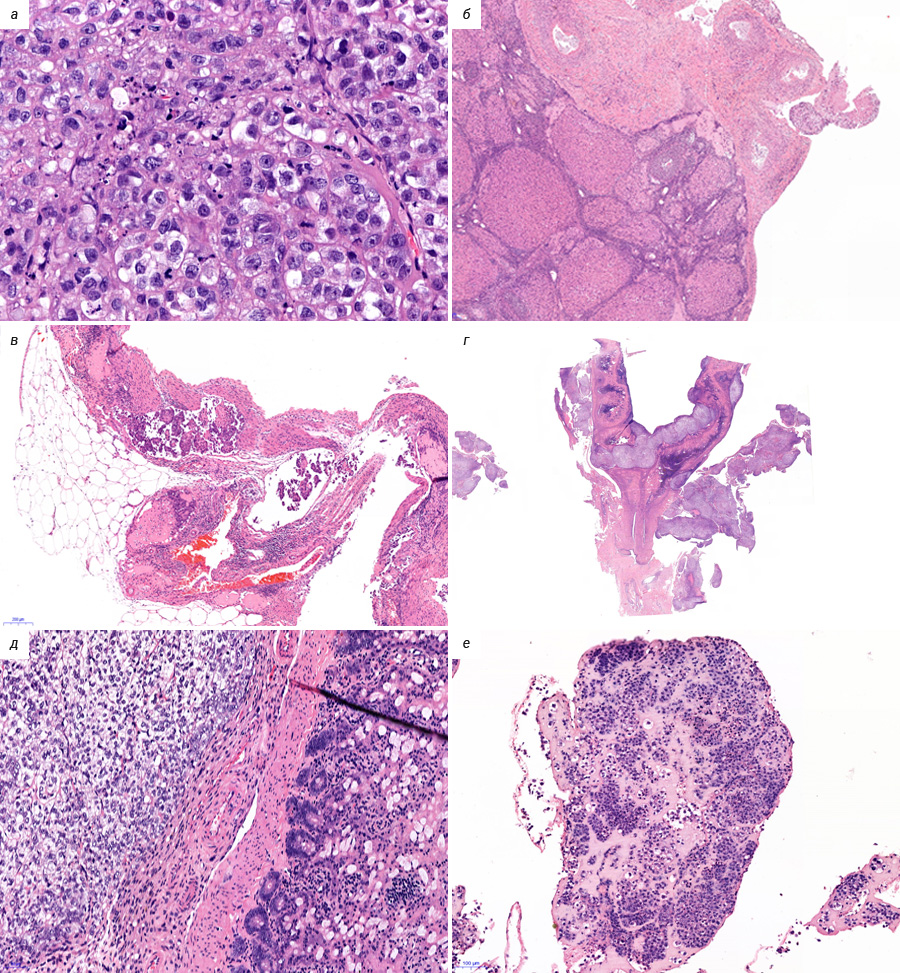
В лаборатории химиопрофилактики рака и онкофармакологии НМИЦ онкологии им. Н.Н. Петрова асцитная карцинома яичников у крыс Wistar поддерживается в банке экспериментальных опухолей. Она широко применяется в разведочных онкофармакологических исследованиях, в апробации новых средств интраперитонеальной химиотерапии и химиоперфузионных технологий [33]. После внутрибрюшинной трансплантации асцитической жидкости, содержащей 1×107 клеток в 0,5 мл физиологического раствора, у крыс-самок Wistar в течение 2–3 нед наблюдается развитие диссеминированного ЭРЯ с перитонеальным канцероматозом и геморрагическим асцитом (рис. 1, 2). При гистологическом исследовании аутопсийного материала обнаруживаются поля инвазивной злокачественной опухоли папиллярно-солидного строения, состоящей из округлых клеток со скудной эозинофильной или оптически пустой цитоплазмой, с крупными резко атипичными полиморфными ядрами и высоким ядерно-цитоплазматическим соотношением (рис. 3). Данная гистологическая картина характерна для серозной карциномы high-grade. Модель воспроизводит поздние стадии (III–IV стадии) ЭРЯ у женщин. Она позволяет провести разведочный анализ фармакологических свойств тестируемых агентов (включая, но не ограничиваясь противоопухолевой активностью), изучать биологию опухолевого роста.
В работе S. Sekiya и соавт. [34] описана внутрибрюшинная перевивка клеточной линии недифференцированной аденокарциномы яичника (ROT68/C1) новорожденным крысятам Sprague-Dawley (через 48 ч после рождения) по 5×105 клеток. У животных в 100% случаев развиваются метастазы в брюшной полости и легких. Существенным недостатком этой модели является выбор в качестве животных-реципиентов новорожденных крыс.
Классическим примером сингенного РЯ является мышиная клеточная линия ID8, полученная от мышей линии C57BL/6 в результате спонтанной трансформации клеток поверхностного эпителия яичника при многократном пассаже (>20 пассажей) in vitro [35]. Трансплантируется иммунокомпетентным мышам этой же линии по 5×106 клеток. Подкожные опухоли формируются в течение 4 мес и не метастазируют. При внутрибрюшинной трансплантации метастазируют в диафрагму, брюшину, брыжейку и сальник с формированием геморрагического асцита. Опухоли и асцит формируются примерно в течение 90 дней [36]. Клеточная линия ID8 может трансплантироваться ортотопически под сумку яичника. Вводится по 1×106 клеток в физиологическом растворе с фосфатным буфером (PBS). Через 90 дней у мышей линии C57BL/6 возникали массивные первичные опухоли яичника, перитонеальный канцероматоз и геморрагический асцит. Наблюдались гиперваскуляризация опухолей и формирование серозного эпителиального канцероматоза [37]. Еще одна сингенная опухоль яичника была получена в результате спонтанной злокачественной трансформации клеточной линии поверхностного эпителия яичников M0505 при многократном пассаже клеток (линия STOSE). Трансплантируется мышам линии FVB/N по 1×107 клеток внутрибрюшинно или по 4×104 под мембрану яичников. Прививаемость составляет 100%. При перевивке под мембрану сумки яичника наблюдались обширные внутрибрюшинные метастазы и асцит. По гистологическому типу опухоль схожа с СКВСЗ, однако все же гистология является смешанной, включает очаги муцинозных, недифференцированных и папиллярных серозных структур [38]. Известна сингенная линия NuTu-19, представляющая собой низкодифференцированную карциному яичников. Трансплантируется внутрибрюшинно по 1×106 клеток крысам-самкам линии Fischer 344. Через 4 нед после трансплантации у 80% животных наблюдалось развитие перитонеального канцероматоза и геморрагического асцита [39]. Сингенные модели позволяют изучать развитие противоопухолевого иммунного ответа, эпителиально-стромальные взаимодействия, процессы васкуляризации опухоли. Использование иммунокомпетентных животных обеспечивает низкую частоту инфекционных осложнений в сравнении с иммунодефицитными животными. Основной недостаток сингенных моделей обусловлен тем, что прививаются аллографты, т.е. опухоли, которые растут только на том виде (линии) животных, на котором они изначально были получены. Это в определенной степени затрудняет экстраполяцию результатов доклинических исследований на патологию у человека, но тем не менее позволяет провести разведочный анализ противоопухолевой активности тестируемых агентов, изучать биологию опухолевого роста, взаимодействие ее с микроокружением.
Заключение
В эру персонализированной медицины крайне важен правильный выбор моделей у лабораторных животных. Несмотря на бурное развитие клеточных технологий, появление 3D-моделей опухолей (органоиды), исследования, проводимые на лабораторных животных, остаются важной частью доклинических испытаний тестируемых фармакологических агентов и методов лечения, фундаментальных работ. Трансплантация иммунодефицитным животным ксенографтов человека считается основным способом моделирования эпителиального РЯ, хотя сопряжена с высокими временными и финансовыми затратами. Тем не менее не стоит забывать о сингенных моделях. Они позволяют не только провести разведочный анализ фармакологических свойств тестируемых агентов, но и тестировать новые подходы к локальному (внутрибрюшинному) лечению диссеминированных форм эпителиального РЯ, изучать биологию опухолевого роста, ее взаимодействие с микроокружением.
Благодарности
Работа выполнена без спонсорской поддержки.
Вклад авторов
Муразов Я.Г. – концепция, сбор и систематизация материала, написание, редактирование текста статьи
Нюганен А.О. – сбор и систематизация материала, редактирование текста статьи
Артемьева А.С. – критические замечания, редактирование текста статьи.
Список источников
- Bray F, Ferlay J, Soerjomataram I, Siegel RL, Torre LA, Jemal A. Global cancer statistics 2018: GLOBOCAN estimates of incidence and mortality worldwide for 36 cancers in 185 countries. CA Cancer J Clin. 2018; 68 (6): 394–424. doi: 10.3322/caac.21492.
- Momenimovahed Z, Tiznobaik A, Taheri S, Salehiniya H. Ovarian cancer in the world: epidemiology and risk factors. Int J Womens Health. 2019; 11: 287–299. Published 2019 Apr 30. doi: 10.2147/IJWH.S197604.
- van Baal JOAM, van Noorden CJF, Nieuwland R, Van de Vijver KK, Sturk A, van Driel WJ, Kenter GG, Lok CAR. Development of Peritoneal Carcinomatosis in Epithelial Ovarian Cancer: A Review. J Histochem Cytochem. 2018 Feb; 66 (2): 67-83. doi: 10.1369/0022155417742897.
- Helderman, R., Löke, D. R., Kok, H. P., Oei, A. L., Tanis, P. J., Franken, N., & Crezee, J. (2019). Variation in Clinical Application of Hyperthermic Intraperitoneal Chemotherapy: A Review. Cancers, 11 (1), 78. https: //doi.org/10.3390/cancers11010078.
- Fredrickson TN. Ovarian tumors of the hen. Environ Health Perspect. 1987; 73: 35-51. doi: 10.1289/ehp.877335.
- Kuhn E, Tisato V, Rimondi E, Secchiero P. Current Preclinical Models of Ovarian Cancer. J Carcinog Mutagen 2015, 6: 2.
- Cooper TK, Gabrielson KL. Spontaneous lesions in the reproductive tract and mammary gland of female non-human primates. Birth Defects Res B Dev Reprod Toxicol. 2007; 80 (2): 149-170. doi: 10.1002/bdrb.20105.
- Krarup T. Oocyte destruction and ovarian tumorigenesis after direct application of a chemical carcinogen (9: 0-dimethyl-1: 2-benzanthrene) to the mouse ovary. Int J Cancer. 1969; 4 (1): 61-75. doi: 10.1002/ijc.2910040109.
- Toth B. Susceptibility of guinea pigs to chemical carcinogens: 7,12-Dimethylbenz (a)anthracene and urethan. Cancer Res. 1970; 30 (10): 2583-2589.
- Tunca JC, Ertürk E, Ertürk E, Bryan GT. Chemical induction of ovarian tumors in rats. Gynecol Oncol. 1985; 21 (1): 54-64. doi: 10.1016/0090-8258 (85)90232-x.
- Nishida T, Sugiyama T, Katabuchi H, Yakushiji M, Kato T. Histologic origin of rat ovarian cancer induced by direct application of 7,12-dimethylbenz (a)anthracene. Nihon Sanka Fujinka Gakkai Zasshi. 1986; 38 (4): 570-574.
- Chuffa LG, Fioruci-Fontanelli BA, Mendes LO, Fávaro WJ, Pinheiro PF, Martinez M, Martinez FE. Characterization of chemically induced ovarian carcinomas in an ethanol-preferring rat model: influence of long-term melatonin treatment. PLoS One. 2013 Dec 18; 8 (12): e81676. doi: 10.1371/journal.pone.0081676.
- Zhang S, Dolgalev I, Zhang T, Ran H, Levine DA, Neel BG. Both fallopian tube and ovarian surface epithelium are cells-of-origin for high-grade serous ovarian carcinoma. Nat Commun. 2019; 10 (1): 5367. Published 2019 Nov 26. doi: 10.1038/s41467-019-13116-2.
- Connolly DC, Bao R, Nikitin AY, Stephens KC, Poole TW, Hua X, Harris SS, Vanderhyden BC, Hamilton TC. Female mice chimeric for expression of the simian virus 40 TAg under control of the MISIIR promoter develop epithelial ovarian cancer. Cancer Res. 2003 Mar 15; 63 (6): 1389-97.
- Kim J, Coffey DM, Creighton CJ, Yu Z, Hawkins SM, Matzuk MM. High-grade serous ovarian cancer arises from fallopian tube in a mouse model. Proc Natl Acad Sci USA. 2012; 109 (10): 3921-3926. doi: 10.1073/pnas.1117135109.
- Perets R, Wyant GA, Muto KW, Bijron JG, Poole BB, Chin KT, Chen JY, Ohman AW, Stepule CD, Kwak S, Karst AM, Hirsch MS, Setlur SR, Crum CP, Dinulescu DM, Drapkin R. Transformation of the fallopian tube secretory epithelium leads to high-grade serous ovarian cancer in Brca; Tp53; Pten models. Cancer Cell. 2013 Dec 9; 24 (6): 751-65. doi: 10.1016/j.ccr.2013.10.013.
- Sherman-Baust CA, Kuhn E, Valle BL, Shih IeM, Kurman RJ, Wang TL, Amano T, Ko MS, Miyoshi I, Araki Y, Lehrmann E, Zhang Y, Becker KG, Morin PJ. A genetically engineered ovarian cancer mouse model based on fallopian tube transformation mimics human high-grade serous carcinoma development. J Pathol. 2014 Jul; 233 (3): 228-37. doi: 10.1002/path.4353.
- Shaw TJ, Senterman MK, Dawson K, Crane CA, Vanderhyden BC. Characterization of intraperitoneal, orthotopic, and metastatic xenograft models of human ovarian cancer. Mol Ther. 2004; 10 (6): 1032-1042. doi: 10.1016/j.ymthe.2004.08.013.
- Magnotti E, Marasco WA. The latest animal models of ovarian cancer for novel drug discovery. Expert Opin Drug Discov. 2018; 13 (3): 249-257. doi: 10.1080/17460441.2018.1426567.
- Hernandez L, Kim MK, Lyle LT, Bunch KP, House CD, Ning F, Noonan AM, Annunziata CM. Characterization of ovarian cancer cell lines as in vivo models for preclinical studies. Gynecol Oncol. 2016 Aug; 142 (2): 332-40. doi: 10.1016/j.ygyno.2016.05.028.
- Hallas-Potts, A., Dawson, J.C. & Herrington, C.S. Ovarian cancer cell lines derived from non-serous carcinomas migrate and invade more aggressively than those derived from high-grade serous carcinomas. Sci Rep 9, 5515 (2019). https: //doi.org/10.1038/s41598-019-41941-4.
- Tudrej P, Kujawa KA, Cortez AJ, Lisowska KM. Characteristics of in Vivo Model Systems for Ovarian Cancer Studies. Diagnostics (Basel). 2019; 9 (3): 120. Published 2019 Sep 14. doi: 10.3390/diagnostics9030120.
- Domcke S, Sinha R, Levine DA, Sander C, Schultz N. Evaluating cell lines as tumour models by comparison of genomic profiles. Nat Commun. 2013; 4: 2126. doi: 10.1038/ncomms3126.
- Preston CC, Goode EL, Hartmann LC, Kalli KR, Knutson KL. Immunity and immune suppression in human ovarian cancer. Immunotherapy. 2011; 3 (4): 539-556. doi: 10.2217/imt.11.20.
- Fu X, Hoffman RM. Human ovarian carcinoma metastatic models constructed in nude mice by orthotopic transplantation of histologically-intact patient specimens. Anticancer Res. 1993; 13 (2): 283-286.
- Wu J, Zheng Y, Tian Q, Yao M, Yi X. Establishment of patient-derived xenograft model in ovarian cancer and its influence factors analysis. J Obstet Gynaecol Res. 2019; 45 (10): 2062-2073. doi: 10.1111/jog.14054.
- Ricci F, Bizzaro F, Cesca M, Guffanti F, Ganzinelli M, Decio A, Ghilardi C, Perego P, Fruscio R, Buda A, Milani R, Ostano P, Chiorino G, Bani MR, Damia G, Giavazzi R. Patient-derived ovarian tumor xenografts recapitulate human clinicopathology and genetic alterations. Cancer Res. 2014 Dec 1; 74 (23): 6980-90. doi: 10.1158/0008-5472.
- Lee CH, Xue H, Sutcliffe M, Gout PW, Huntsman DG, Miller DM, Gilks CB, Wang YZ. Establishment of subrenal capsule xenografts of primary human ovarian tumors in SCID mice: potential models. Gynecol Oncol. 2005 Jan; 96 (1): 48-55. doi: 10.1016/j.ygyno.2004.09.025.
- Butler KA, Hou X, Becker MA, Zanfagnin V, Enderica-Gonzalez S, Visscher D, Kalli KR, Tienchaianada P, Haluska P, Weroha SJ. Prevention of Human Lymphoproliferative Tumor Formation in Ovarian Cancer Patient-Derived Xenografts. Neoplasia. 2017 Aug; 19 (8): 628-636. doi: 10.1016/j.neo.2017.04.007.
- Ben-David U, Ha G, Tseng YY, Greenwald NF, Oh C, Shih J, McFarland JM, Wong B, Boehm JS, Beroukhim R, Golub TR. Patient-derived xenografts undergo mouse-specific tumor evolution. Nat Genet. 2017 Nov; 49 (11): 1567-1575. doi: 10.1038/ng.3967.
- Scott CL, Mackay HJ, Haluska P Jr. Patient-derived xenograft models in gynecologic malignancies. Am Soc Clin Oncol Educ Book. 2014; e258-e266. doi: 10.14694/EdBook_AM.2014.34.e258.
- Погосянц, Е.Е., Пригожина Е.Л., Еголина Н.А. Перевиваемая асцитная опухоль яичника крысы (штамм ОЯ). Вопросы онкологии. 1962; 8 (11): 29-36. [Pogosyants, E.E., Prigozhina E.L., Egolina N.A. Perevivaemaya astsitnaya opukhol' yaichnika krysy (shtamm OYa). Vopr Oncol. 1962; 8 (11): 29-36, (In Russian)].
- Беспалов В.Г., Жабин А.А., Стуков А.Н., Беляева О.А., Муразов Я.Г., Семёнов А.Л., Коньков С.А., Крылова И.М. Синергизм противоопухолевого действия диоксадэта и цисплатина на модели асцитной опухоли яичника. Сибирский онкологический журнал. 2013; (1): 42-46. [Bespalov VG, Zhabin AA, Stukov AN, Beliaeva OA, Murazov IG, Semenov AL, Kon’kov SA, Krylova IM. Sinergizm protivoopukholevogo deistviya dioksadehta i cisplatina na modeli astsitnoi opukholi yaichnika. Siberian journal of oncology. 2013; (1): 42-46. (In Russ.)].
- Sekiya S, Iwasawa H, Takamizawa H. Comparison of the intraperitoneal and intravenous routes of cisplatin administration in an advanced ovarian cancer model of the rat. Am J Obstet Gynecol. 1985; 153 (1): 106-111. doi: 10.1016/0002-9378 (85)90605-2.
- Roby KF, Taylor CC, Sweetwood JP, Cheng Y, Pace JL, Tawfik O, Persons DL, Smith PG, Terranova PF. Development of a syngeneic mouse model for events related to ovarian cancer. Carcinogenesis. 2000 Apr; 21 (4): 585-91. doi: 10.1093/carcin/21.4.585.
- Wilkinson-Ryan I, Pham MM, Sergent P, Tafe LJ, Berwin BL. A Syngeneic Mouse Model of Epithelial Ovarian Cancer Port Site Metastases. Transl Oncol. 2019 Jan; 12 (1): 62-68. doi: 10.1016/j.tranon.2018.08.020. Epub 2018 Sep 27.
- Greenaway J, Moorehead R, Shaw P, Petrik J. Epithelial-stromal interaction increases cell proliferation, survival and tumorigenicity in a mouse model of human epithelial ovarian cancer. Gynecol Oncol. 2008 Feb; 108 (2): 385-94. doi: 10.1016/j.ygyno.2007.10.035.
- McCloskey CW, Goldberg RL, Carter LE, Gamwell LF, Al-Hujaily EM, Collins O, Macdonald EA, Garson K, Daneshmand M, Carmona E, Vanderhyden BC. A new spontaneously transformed syngeneic model of high-grade serous ovarian cancer with a tumor-initiating cell population. Front Oncol. 2014 Mar 18; 4: 53. doi: 10.3389/fonc.2014.00053.
- Hornung R, Major AL, McHale M, Liaw LH, Sabiniano LA, Tromberg BJ, Berns MW, Tadir Y. In vivo detection of metastatic ovarian cancer by means of 5-aminolevulinic acid-induced fluorescence in a rat model. J Am Assoc Gynecol Laparosc. 1998 May; 5 (2): 141-8. doi: 10.1016/s1074-3804 (98)80080-7.



