Апробация модели хронического остеоартроза на кроликах
Ковалева М.А., Гущин Я.А. Апробация модели хронического остеоартроза на кроликах. Лабораторные животные для научных исследований. 2019; 4. https://doi.org/10.29296/2618723X-2019-04-03
Резюме
Остеоартроз (ОА) – гетерогенная группа заболеваний различной этиологии. Прогрессирует в синовиальных суставах с постепенным развитием хронической боли, ограничением двигательной способности пациентов. В настоящее время остеоартроз (ОА) является социально-значимой патологией, влияющей на качество и продолжительность жизни пациентов. Основные нарушения при ОА – процессы дегенерации и деструкции – развиваются на уровне суставного хряща. За последние годы представления ученых о природе и механизмах развития ОА претерпели значительные изменения. Несколько десятилетий назад патологические изменения в хряще при ОА рассматривались только как следствие естественной возрастной инволюции и дегенерации. В настоящее время ключевая роль в развитии болезни отводится воспалительному процессу и изменениям субхондральной кости. В зарубежной литературе часто используется термин «остеоартрит», подчеркивающий ведущую роль воспаления в развитии заболевания. Существенный вклад в раскрытие механизмов патогенеза ОА вносят доклинические исследования. Существует множество методов моделирования экспериментальной патологии, в том числе и хирургических, в результате которых в тканевых компонентах суставов воспроизводят изменения, аналогичные таковым при ОА у человека.
Цель данной работы – апробировать моделирование экспериментального хронического ОА по методу М. Yoshioka, установить возможность использования данного подхода для оценки фармакологической активности препаратов для терапии ОА.
ОА индуцировали путем перерезки передней крестовидной связки коленного сустава кролика по методу М. Yoshioka. Исследование выполнено на 20 самцах кроликов, в ходе эксперимента было проведено измерение окружности и патоморфологическое исследование сустава. В качестве препарата позитивного контроля были использованы Хондроитина сульфат натрия, раствор для внутримышечного введения 100 мг/мл в дозе 6,72 мг/кг, негативного – Кетопрофен, капсулы 320 мг в дозе 16 мг/кг.
Было показано, что перерезка передней крестовидной связки левого коленного сустава кролика приводит к развитию экспериментальной патологии, характеризующейся выраженными патоморфологическими изменениями сустава: возникновением эрозий, участков фрагментации и расслоения, фиброзом суставной капсулы и связок. Препарат позитивного контроля Хондроитина сульфат натрия оказал выраженный терапевтический эффект, который заключался в уменьшении окружности сустава и был подтвержден патоморфологическим исследованием. В группе животных, получавших Кетопрофен, наблюдали только уменьшение окружности сустава.
Таким образом, результаты показали, что данный методический подход воспроизводит некоторые аспекты патологического изменения сустава, характерные для ОА, и приемлем для оценки фармакологической эффективности препаратов, предназначенных для патогенетической терапии ОА.
Введение
Остеоартроз (ОА) – гетерогенная группа заболеваний различной этиологии [1]. Прогрессирует в синовиальных суставах с постепенным развитием хронической боли, ограничением двигательной способности пациентов, что отражается на качестве и продолжительности их жизни и имеет важное социальное и экономическое значение [2].
Клинические симптомы ОА в среднем наблюдаются у 15% населения земного шара. В нашей стране, по данным эпидемиологического исследования в рамках межрегиональной программы «Социальные и экономические последствия РЗ» (обследованы 76 136 человек в 12 регионах Российской Федерации), распространенность ОА составила 13,3%. Наиболее частая локализация ОА – коленные суставы. Принимая во внимание увеличение среднего возраста популяции нашей планеты (удельный вес населения 60 лет и старше превышает 10%), ОА уже в ближайшие годы может занять четвертое место по причинам инвалидности. Основные цели терапии ОА по всем современным рекомендациям – уменьшение боли и улучшение качества жизни пациентов, что должно привести к снижению потребности в обезболивающих средствах и уменьшить необходимость хирургического лечения [1, 3]. Согласно современной классификации препаратов, используемых в лечении ОА [4], их подразделяют на следующие группы:
- симптоматические средства быстрого действия (нестероидные противовоспалительные средства, опиоидные анальгетики, кортикостероиды и другие). Данные препараты оказывают влияние на клинические симптомы заболевания (боль, воспаление, отек и другие);
- симптом-модифицирующие средства замедленного действия (глюкозамин, хондроитин, диацереин, гиалуроновая кислота и другие). Данные препараты имеют «отсроченный» эффект по сравнению с симптоматическими средствами, но эффект их сохраняется на протяжении длительного времени. Такие препараты обладают хондромодифицирующим действием, предупреждая деградацию суставного хряща.
Несмотря на достаточно широкий выбор симптом-модифицирующих препаратов поиск новых лекарственных средств для эффективной патогенетической терапии ОА является актуальной задачей.
Как известно, доклинический этап является неотъемлемой частью жизненного цикла любого инновационного лекарственного препарата, в связи с чем выбор адекватной экспериментальной модели является залогом получения релевантных данных.
Целью нашего исследования являлось воспроизведение экспериментальной модели ОА путем перерезки передней крестовидной связки левого коленного сустава кролика по методу М. Yoshioka [5] установление возможности оценки фармакологической активности препаратов для терапии ОА.
Материалы и методы
Экспериментальное исследование выполнено на 20 половозрелых самцах кроликов породы Калифорнийские. Возраст животных к началу исследования –14–16 нед., масса – 3–3,5 кг (КФХ ИП Потапчук М.П.). В период адаптации и последующего эксперимента животные содержались в стандартных условиях вивария. Кроликов содержали в индивидуальных боксах с решетчатым полом без подстила, с зоной для отдыха (сплошной пол), снабженных автоматической ниппельной системой поения. Кормление животных проводили в соответствии с Директивой 2010/63/EU Европейского парламента и совета Европейского Союза от 22 сентября 2010 г. по охране животных, используемых в научных целях. Исследование было выполнено с соблюдением принципов «Европейской конвенции о защите позвоночных животных, используемых для экспериментов и других научных целей» (Страсбург, 1986) в соответствии с правилами надлежащей лабораторной практики. Исследование было одобрено на заседании биоэтической комиссии №1.24/13 от 09.07.2013.
Животные были разделены на 4 группы по 5 кроликов в каждой:
- 1-я группа – ложнооперированные (ЛО), хирургический доступ без перерезки крестовидной связки коленного сустава и терапии;
- 2-я группа – животные с экспериментальным ОА;
- 3-я группа – животные с экспериментальным ОА, получавшие терапию препаратом Хондроитин сульфат натрия, раствор для внутримышечного введения 100 мг/мл (фармакологическая группа – репарации тканей стимулятор) в дозе 6,72 мг/кг внутримышечно (что эквивалентно дозе для человека 100 мг);
- 4-я группа – животные с экспериментальным ОА, получавшие терапию препаратом Кетопрофен, капсулы 320 мг (фармакологическая группа – нестероидные противовоспалительные препараты) в дозе 16 мг/кг перорально (что эквивалентно дозе для человека 320 мг). Препарат вводили в виде суспензии в 1% растворе крахмала.
Препараты вводили животным 1 раз в 3 дня. Длительность исследования – 57 дней.
Моделирование экспериментального ОА выполняли по методу Yoshioka М. Для этого у животного под общей анестезией (внутривенное введение смеси 2,6 мг/кг Zoletil 100 (Virbac, Франция) с 1 мг/кг Рометара (Bioveta, Чешская Республика) проводили подготовку операционного поля, выбривая шерсть в области левого коленного сустава. После обработки операционного поля раствором антисептика с латеральной стороны левого колена выполняли разрез длиной 5-
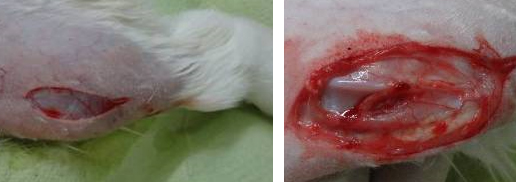
Далее производилась визуализация передней крестовидной связки (рис. 2).
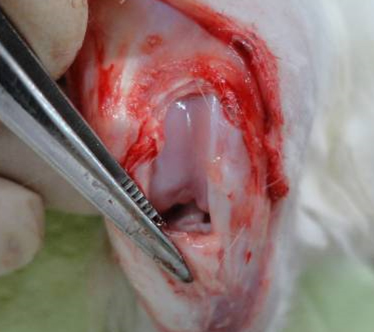
Перерезали крестовидную связку, операционную рану послойно ушивали. После формирования экспериментальной патологии животным на протяжении 3 дней внутримышечно вводили Цефтриаксон (ОАО «Биосинтез», Россия) в дозе 34 мг/кг в 0,9% растворе натрия хлорида с целью предотвращения развития инфекционных послеоперационных осложнений.
Степень выраженности клинических признаков ОА оценивали еженедельно путем измерения окружности сустава при помощи гибкой сантиметровой ленты. Массу тела экспериментальных животных регистрировали еженедельно для коррекции дозы препаратов. Для оценки морфологических изменений ткани сустава на 57-й день осуществляли эвтаназию животных с целью проведения патоморфологического исследования. Животные были эвтаназированы воздушной эмболией сердца, выполненной под общей анестезией (2,6 мг/кг Zoletil 100 (Virbac, Франция) с 1 мг/кг Рометара (Bioveta, Чешская Республика).
Макроскопически оценивали следующие показатели: цвет хряща, цвет синовиальной жидкости, наличие обрывков хряща в синовиальной жидкости, появление локальных зон размягчения хряща, наличие вертикальных трещин, наличие эрозий, наличие фрагментаций и расслоений в хряще, наличие остеофитов, наличие кист, утолщение синовиальной оболочки, фиброз суставной капсулы, фиброз связок, уплотнение и утолщение костной пластинки, участки остеосклероза. В ходе некропсии оценивали следующие показатели: наличие локальных зон размягчения хряща, наличие эрозий, наличие фрагментаций и расслоений в хряще, утолщение синовиальной оболочки, фиброз суставной капсулы, фиброз связок, уплотнение и утолщение костной пластинки участки остеосклероза. Степень выраженности признаков оценивали в баллах: 0 – отсутствие изменений; 1 – слабовыраженные изменения; 2 – умеренно выраженные изменения; 3 – выраженные изменения. Для подтверждения результатов макроскопической оценки проводилось гистологическое исследование. С этой целью исследуемый материал фиксировали в 10% формалине в течение 24 ч. Затем сустав был помещен на три недели в декальцинирующий электролитный раствор (смесь соляной и муравьиной кислот). После чего материал промывали проточной водой, пропитывали парафином, приготавливали гистологические срезы, окрашивали их гематоксилином и эозином, исследовали световой микроскопией.
Для оценки результатов исследования использовали пакет прикладных статистических программ Statistica 6.0 (StatSoft, США). Результаты представлены в виде среднего арифметического ± ошибка средней или медианы ± квартальный размах. Для оценки данных с признаками нормального распределения использовался однофакторный дисперсионный анализ (ANOVA). Для последующего межгруппового сравнения использовался апостериорный критерий Ньюмена–Кейлса. Для описания данных, не подчиняющихся закону нормального распределения, использовали критерий Манна–Уитни. Различия определялись при 0,05 уровне значимости.
Результаты и обсуждение
Результаты исследования показали, что перерезка передней крестовидной связки привела к развитию экспериментальной патологии, сопровождающейся увеличением окружности сустава и патоморфологическими изменениями сустава.
На фоне систематического применения препарата Хондроитина сульфат натрия, раствор для внутримышечного введения 100 мг/мл, в дозе 6,72 мг/кг наблюдали статистически значимое уменьшение окружности поврежденного сустава с 36 дня исследования, к концу исследования окружность сустава была меньше на 13% по сравнению с данным показателем в контрольной группе.
В группе животных, получавших препарат Кетопрофен, наблюдали статистически значимое уменьшение окружности поврежденного сустава с 29-го дня исследования, к концу исследования окружность сустава была меньше на 20% по сравнению с данным показателем в контрольной группе (табл. 1).
Таблица 1
Значения окружности сустава экспериментальных животных, см (M±m); n=5
|
Группа |
День исследования |
||||||||
|
1 |
8 |
15 |
22 |
29 |
36 |
43 |
50 |
56 |
|
|
ЛО |
12,7±0,3 |
12,9±0,3 |
12,1±0,3 |
12,7±0,3 |
12,6±0,3 |
12,7±0,3 |
12,7±0,3 |
12,3±0,3 |
12,8±0,3 |
|
Контрольная |
12,5±0,2 |
16,8±0,3* |
16,6±0,3* |
16,9±0,2* |
16,3±0,2* |
16,5±0,2* |
16,5±0,3* |
16,7±0,1* |
16,9±0,1* |
|
Хондроитина сульфат натрия, 6,72 мг/кг |
12,6±0,2 |
16,9±0,2* |
16,2±0,3* |
16,3±0,5* |
16,1±0,3* |
15,7±0,2*# |
15,1±0,1*# |
14,6±0,2*# |
14,7±0,2*# |
|
Кетопрофен, 16 мг/кг |
12,3±0,3 |
16,7±0,2* |
16,5±0,2* |
16,3±0,5* |
15,4±0,2*# |
15,2±0,2*# |
14,7±0,1*# |
14,2±0,3*# |
13,5±0,3*# |
Примечание:* – статистически значимые отличия от ЛО группы, критерий Ньюмена–Кейлса, p<0,05. # – статистически значимые отличия от контрольной группы, критерий Ньюмена–Кейлса, p<0,05.
При визуальной оценке поведения в клетке проживания в группе, получавшей Кетопрофен в дозе 16 мг/кг, наблюдали, что животные начинали опираться на поврежденную лапу уже с 15 дня исследования, что может быть связано с обезболивающим действием препарата.
При патоморфологическом исследовании у животных всех экспериментальных групп при визуальном осмотре хрящ был белого цвета, синовиальная жидкость прозрачная. Как в контрольной группе, так и в группе, получавшей лечение, не было обнаружено обрывков хряща в синовиальной жидкости, вертикальных трещин, остеофитов и кист. Результаты макроскопического исследования суставов экспериментальных животных приведены в табл. 2.
Таблица 2
Морфологическая характеристика суставов экспериментальных животных; баллы Me(Q1; Q3); n=5
|
Определяемый показатель |
ЛО |
Контрольная |
Хондроитина сульфат натрия, 6,72 мг/кг |
Кетопрофен, 16 мг/кг |
|
Наличие локальных зон размягчения хряща |
0,0 (0,0; 0,0) |
1,0 (1,0; 1,0)* |
1,0 (1,0; 1,0)* |
1,0 (1,0; 1,0)* |
|
Наличие эрозий |
0,0 (0,0; 0,0) |
2,0 (1,0; 3,0)* |
1,0 (1,0; 1,0)* |
2,0 (1,0; 3,0)* |
|
Наличие фрагментаций и расслоений в хряще |
0,0 (0,0; 0,0) |
1,0 (1,0; 2,0)* |
1,0 (0,0; 1,0) |
1,0 (1,0; 2,0)* |
|
Утолщение синовиальной оболочки |
0,0 (0,0; 0,0) |
0,5(0,0; 1,0) |
0,0 (0,0; 1,0) |
0,5(0,0; 1,0) |
|
Фиброз суставной капсулы |
0,0 (0,0; 0,0) |
1,0 (1,0; 1,0)* |
1,0 (0,0; 1,0) |
1,0 (1,0; 1,0)* |
|
Фиброз связок |
0,0 (0,0; 0,0) |
1,0 (1,0; 1,0)* |
1,0 (1,0; 1,0) |
1,0 (1,0; 1,0)* |
|
Уплотнение и утолщение костной пластинки |
0,0 (0,0; 0,0) |
1,0 (1,0; 1,0)* |
1,0 (0,0; 1,0) |
1,0 (1,0; 1,0)* |
|
Участки остеосклероза |
0,0 (0,0; 0,0) |
1,0 (1,0; 1,0)* |
0,0 (0,0; 1,0) # |
1,0 (1,0; 1,0)* |
Примечание:* – статистически значимые отличия от ЛО группы, критерий Манна–Уитни, p<0,05; # – статистически значимо отличается от контрольной группы критерий Манна–Уитни, p<0,05.
В ходе макроскопического исследования были выявлены значительные отличия суставной поверхности животных ложнооперированной и контрольной групп (рис. 4, 5). В контрольной группе наблюдались деформационные изменения сустава (см. рис. 5) с разрастанием окружающей фиброзной ткани, локальные зоны размягчения, умеренно выраженные эрозии (в отдельных случаях отмечались глубокие эрозии, достигающие субхондрального слоя), наличие фрагментаций и расслоений в хряще, утолщение синовиальной оболочки, уплотнение и утолщение костной пластинки, участки остеосклероза.
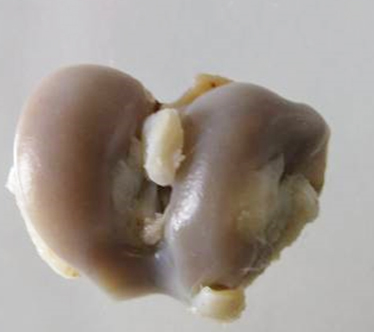

На фоне применения препарата Хондроитина сульфат натрия, в дозе 6,72 мг/кг макроскопическая картина была схожа с контрольной группой, однако проявления патологии были менее выражены. При внутримышечном введении препарата Хондроитина сульфат натрия, в дозе 6,72 мг/кг также наблюдалось снижение количества случаев фрагментации и расслоения в хрящах, при внутрисуставном введении наблюдалось снижение количества участков остеосклероза.
В группе животных, получавших препарат Кетопрофен в дозе 16 мг/кг, макроскопическая картина была сопоставима с контрольной группой.
После морфологической оценки суставов было проведено гистологическое исследование суставного хряща и субхондральной кости (рис. 6–9).
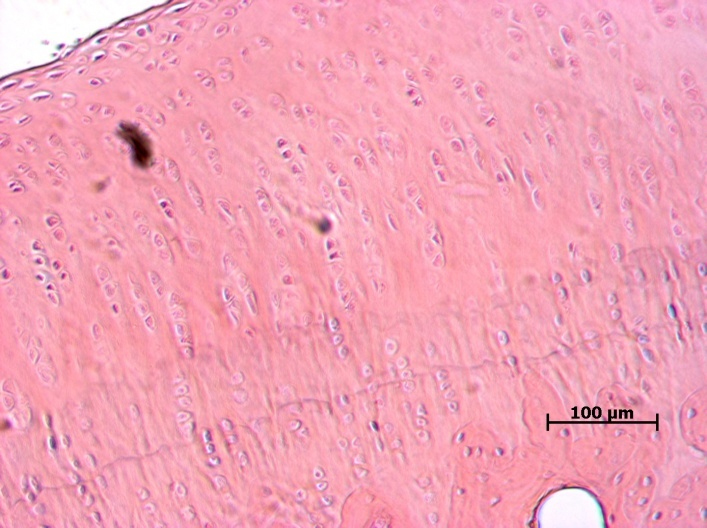
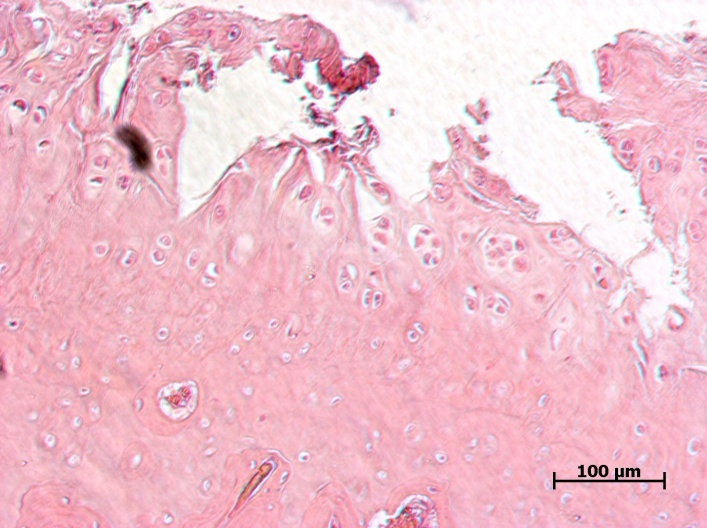
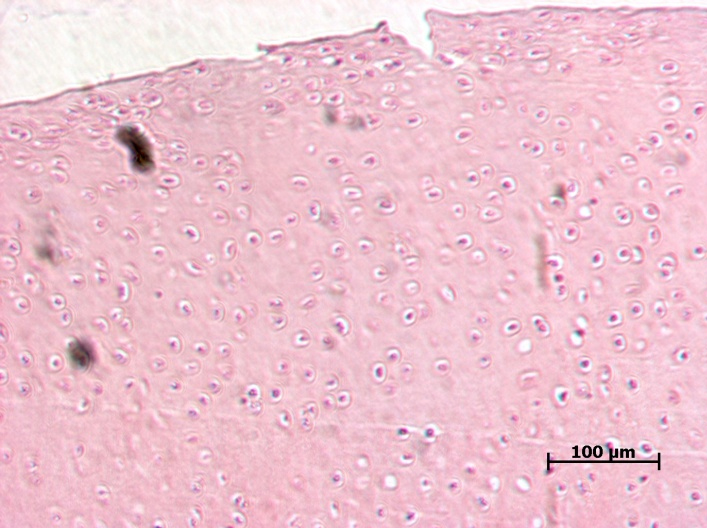
У животных ложнооперированной группы при гистологическом исследовании не было выявлено никаких патологических изменений. У животных наблюдали неизмененный суставной хрящ. Видны поверхностная, переходная (промежуточная) и глубокая (радиальная) зоны. Кальцифицированный хрящ отделен от остальных слоев волнистой границей. Поверхностный слой узкий, образован тангенциально расположенными коллагеновыми волокнами, среди которых, наряду с клетками фибробластического ряда, обнаруживаются также дискоидальной формы хондроциты, располагающиеся здесь в несколько слоев. В переходной зоне хондроциты округлой или овальной формы, объединены в группы по 3–4 клетки. В межклеточном веществе хорошо выражен перицеллюлярный, капсулярный и межтерриториальный матрикс, содержащий большое количество коллагеновых фибрилл. Глубокая зона суставного хряща образована межклеточным веществом и группами зрелых хондроцитов овальной, слегка уплощенной формы, расположенными радиально, по ходу ветвления волокон.
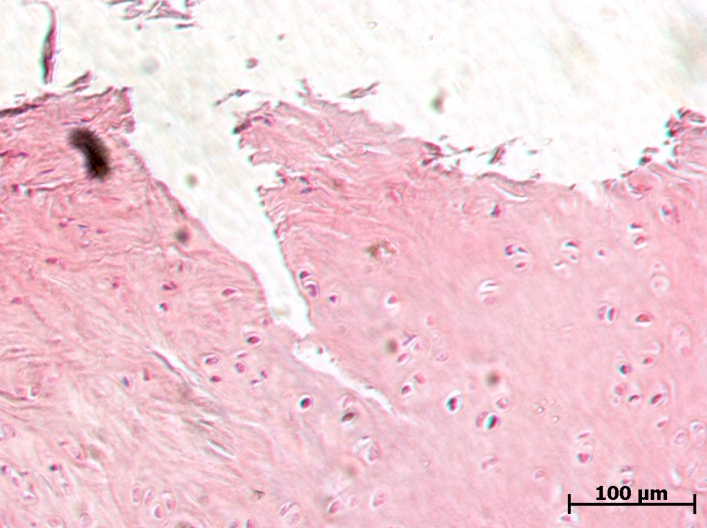
В группе контрольных животных выявлена тяжелая форма артроза. Фибрилляция и расщепление суставного хряща. Скопление клеток в поверхностной зоне. Признаки тяжелых дегенеративных изменений суставного хряща с глубокими изъязвлениями, с формированием горизонтальных трещин в кальцифицированном слое и расщеплением его от подлежащей субхондральной кости. Отек и разволокнение хрящевого матрикса. Данные патологические изменения свидетельствуют о развитии ОА.
На фоне терапии препаратом Хондроитина сульфат натрия в дозе 6,72 мг/кг (см. рис. 8) гистологическая картина характеризовалась существенным снижением признаков дегенеративных изменений хряща. У животных данной группы наблюдали деформацию и повреждения поверхностного слоя суставного хряща. Сохранившиеся хондроциты поверхностного слоя с признаками кариолизиса; в клетках промежуточного и радиального слоев обнаруживается перицеллюлярный отек и кариопикноз. Хотя признаки патологии отмечены, они были выражены в меньшей степени, чем в контрольной группе.
В группе животных, получавших Кетопрофен в дозе 16 мг/кг (см. рис. 9), микроскопически также наблюдали дегенеративные изменения хрящевой ткани, однако патологические процессы были менее выражены по сравнению с контрольной группой животных, затрагивая преимущественно поверхностный слой, хотя в отдельных случаях можно было наблюдать глубокое поражение до кальцифицированного слоя с его отслоением от субхондральной кости.
Таким образом, по результатам клинических наблюдений и патоморфологического исследования можно судить об успешном формировании патологии. Препарат положительного контроля Хондроитина сульфат натрия, в дозе 6,72 мг/кг привел к снижению выраженности патологических изменений, что позволяет рассматривать данный методический подход подходящим для оценки фармакологической эффективности лекарственных средств. Кетопрофен в дозе 16 мг/кг способствовал снижению окружности сустава, при этом не оказал влияния на ткань суставного хряща.
Заключение
В ходе проведенного исследования установлено, что перерезка передней крестовидной связки левого коленного сустава кролика по методу Yoshioka М. приводит к развитию экспериментальной патологии, характеризующейся выраженными патоморфологическими изменениями сустава: возникновением эрозий, участков фрагментации и расслоения, фиброзом суставной капсулы. Препарат позитивного контроля Хондроитина сульфат натрия в дозе 6,72 мг/кг (фармакологическая группа – репарации тканей стимулятор), способствовал восстановлению структуры хряща, нарушенной в результате моделирования патологии. Препарат Кетопрофен в дозе 16 мг/кг не оказал влияния на ткань суставного хряща, при этом эффективно снижал окружность сустава. Апробированную экспериментальную модель можно считать адекватной для изучения фармакологической активности препаратов, применяемых для патогенетической терапии ОА.
Таким образом, для оценки эффективности лекарственных кандидатов может быть использован базовый дизайн, приведенный в табл. 3.
Таблица 3
Базовый дизайн изучения фармакологической активности препарата, предназначенного для терапии остеоартроза
| Манипуляции | Неделя исследования | ||||||||
| 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 | |
|
Индукция патологии |
|
|
|
|
|
|
|
|
|
|
Введение препаратов |
Согласно клинической схеме применения |
||||||||
|
Измерение массы тела |
|
|
|
|
|
|
|
|
|
|
Клинический осмотр |
|
|
|
|
|
|
|
|
|
|
Измерение окружности сустава |
|
|
|
|
|
|
|
|
|
|
Эвтаназия |
|
|
|
|
|
|
|
|
1 день |
|
Патоморфологическое исследование |
|
|
|
|
|
|
|
|
1 день |
Исходя из задач исследования и специфики (особенностей, мишеней) фармакологического действия изучаемого лекарственного кандидата, базовый дизайн может быть дополнен рядом других показателей, например, биохимические исследования хряща (определение содержания гликозаминогликанов), гематологический анализ, ультразвуковое исследование, иммуногистохимический анализ, патоморфологические исследования с морфометрической оценкой толщины хряща и т.д.
Список источников
- Хитров Н.А. Остеоартроз – болезнь с воспалительными и катаболическими процессами в суставах // Трудный пациент. – 2012; 1 (10): 41–45. [Khitrov N.A. Osteoartroz – bolezn' s vospalitel'nymi i katabolicheskimi protsessami v sustavakh // Trudnyi patsient. – 2012; 1 (10): 41–45 (In Russ)].
- Чичасова Н.В. Современные международные и национальные рекомендации по ведению больных остеоартрозом // Ревматология. – 2017; 5: 132–140 [Chichasova N.V. Sovremennye mezhdunarodnye i natsional'nye rekomendatsii po vedeniyu bol'nykh osteoartrozom // Revmatologiya. – 2017; 5: 132–140 (In Russ)].
- Галушко Е.А., Большакова Т.В., Виноградова И.Б., Иванова О.Н., Лесняк О.М., Меньшикова Л.В., Петрачкова Т.Н., Эрдес Ш.Ф. Структура ревматических заболеваний среди взрослого населения России по данным эпидемиологического исследования (предварительные результаты) // Научно-практическая ревматология. – 2009; 1: 11–17 [Galushko E.A., Bol'shakova T.V., Vinogradova I.B., Ivanova O.N., Lesnyak O.M., Men'shikova L.V., Petrachkova T.N., Erdes Sh.F. Struktura revmaticheskikh zabolevanii sredi vzroslogo naseleniya Rossii po dannym epidemiologicheskogo issledovaniya (predvaritel'nye rezul'taty) // Nauchno-prakticheskaya revmatologiya. – 2009; 1: 11–17 (In Russ)].
- Jordan K.M., Arden N.K., Doherty M. EULAR recommendations 2003: an evidence based approach to the management of knee osteoarthritis: report of a task force of the Standing Committee for International Clinical Studies Including Therapeutic Trials (ESCISIT) // Annals of the Rheumatic Diseases. – 2003; 62: 1145–1155. DOI:10.1136/ard.2003.011742.
- Yoshioka M, Coutts RD, Amiel D, Hacker SA. Characterization of a model of osteoarthritis in the rabbit knee // Osteoarthritis Cartilage. 1996; 4 (2): 87–98. DOI:10.1016/s1063-4584(05)80318-8.



