Оценка гнездового поведения как индикатора уровня стресса у лабораторных мышей
Акимова М.А., Макарова М.Н., Акимов Д.Ю. Оценка гнездового поведения как индикатора уровня стресса у лабораторных мышей . Лабораторные животные для научных исследований. 2021; 2. https://doi.org/10.29296/2618723X-2021-02-05
Резюме
Неотъемлемой частью надлежащей лабораторной практики является гуманное отношения и сведение до минимума стресса у лабораторных животных. Хронический стресс у лабораторных животных может повлиять на чистоту получаемых данных, например, в ряде поведенческих тестов.
Для измерения общего благополучия животных в научных и животноводческих целях необходимы объективные методы оценки уровня стресса для конкретных видов лабораторных животных. Современные методы оценки благополучия лабораторных мышей либо занимают много времени, либо требуют дорогостоящего оборудования, либо являются инвазивными, что, в свою очередь, также влияет на показатель благополучия животных. В условиях большого числа животных в виварии или питомнике лабораторных животных использование этих методов в рутинной практике на постоянной основе, как правило, нецелесообразно. На сегодняшний день требуется разработка неинвазивных информативных методов, внедрение которых в практику доклинических центров может существенно повлиять на благополучие животных и позволит мониторировать наличие/отсутствие стресса у животных, проживающих в лабораторных условиях. Проведенный эксперимент был нацелен на изучение гнездования как показателя здоровья и благополучия лабораторных мышей при групповом и индивидуальном содержании, а также при наличии разных факторов стресса. План исследования был одобрен биоэтической комиссией АО «НПО «Дом Фармации». Исследование проведено на 95 животных, из них 65 самцов и 30 самок, полученных в питомнике АО «НПО «Дом Фармации». В качестве факторов стресса использовались одиночное содержание, холодовой стресс и срединная лапаротомия. В качестве гнездового материала использовали однослойный картонный стаканчик объемом 180 мл плотностью 210 г/м2.
Оценка гнездового поведения велась по показателям «Количество животных в стаканчике», «Степень изгрызания стаканчика» и «Тест интегрирования гнездового материала в гнездо».
По результатам проведенного исследования установлено, что заинтересованность самцов и самок аутбредных мышей в гнездовом материале была на высоком уровне. В ходе эксперимента выявлено, что индикаторами для выявления стресса у лабораторных мышей могут служить такие показатели, как «Степень изгрызания стаканчика» и «Тест интегрирования гнездового материала в гнездо». Показатель «Количество животных в стаканчике» оказался малоинформативен в условиях использованных тестов.
Введение
Лабораторная мышь, полученная от дикой мыши (Mus musculus), является преимущественно ночным, очень социальным животным. Хотя лабораторные мыши частично адаптированы к жизни в неволе, они похожи на своих диких собратьев и строят гнезда. Обеспечение среды обитания, позволяющей им вести естественный образ жизни, улучшает их благополучие [1].
Обогащение окружающей среды обеспечивает сенсорную и двигательную стимуляцию содержащихся в неволе животных и предоставляет им более широкий выбор действий и некоторый контроль над окружающей их средой обитания [2, 3]. Подстил и материалы для гнездования, убежища и бумажные стаканчики являются наиболее часто используемыми ресурсами для обогащения среды мышей и обычно должны быть представлены в каждой клетке, если нет веского обоснования не делать этого. Предоставление мышам возможности вести себя типично для их вида, например, строить логово или собирать пищу, может значительно улучшить их жизнь в лаборатории. Грызение также является важным поведением для благополучия мышей; поскольку их зубы постоянно растут в течение всей жизни, неспособность грызть может привести к неправильному прикусу (разрастанию резцов) и, как следствие, к недоеданию. В исследованиях J.D. Bailoo et al. (2018) у животных без обогащения среды наблюдались признаки нарушения благополучия, такие как беспокойство и ненормальное повторяющееся поведение [2].
C.S. Leidinger et al. (2019) доказал, что во время размножения недостаток обогащения среды приводит к более высокой смертности детенышей, снижению веса потомства и задержке развития [4].
Лабораторные мыши в дикой природе живут семейными группами, обычно состоящими из доминирующего самца, нескольких самок с потомством и подчиненных самцов [5]. Мыши, проживающие в гармоничных группах, оказывают друг другу социальную поддержку («социальную буферизацию») в стрессовой ситуации [6]. Примером является исследование Pham et al. (2010), в котором после операции мышам был предоставлен выбор самостоятельно употреблять анальгетик, имеющийся в одной из их бутылок с водой, в течение 2 послеоперационных недель. Показано, что в социально обогащенной среде мыши сами принимали меньше обезболивающего, чем мыши, у которых не было этого. Полученные данные доказывают, что обогащение среды может способствовать уменьшению потребности в обезболивании у животных, подвергшихся инвазивным процедурам [7].
Согласно рекомендациям ГОСТ 33216-2014, мышей следует содержать при температуре от 20 до 24°С. При групповом содержании температура в клетках со сплошным дном чаще бывает выше комнатной и даже при хорошо работающей вентиляции может превышать ее на 6°С. Материал для строительства гнезд и домики позволяют животным самостоятельно контролировать микроклимат. Особое внимание следует уделять поддержанию температуры в барьерных системах и там, где содержатся животные, лишенные шерстного покрова [8]. Однако термонейтральная зона мышей находится между 26 и 34°C, поэтому они могут испытывать холодовой стресс в лаборатории, если им не предоставлен материал для гнездования, позволяющий регулировать температуру их тела и микроклимат в клетке.
Должно быть обеспечено достаточное количество гнездового материала, позволяющего им создавать хорошие гнезда, в центре которых температура может достигать 30–32°C [9, 10]. B.N. Gaskill, S.A. Rohr и E.A. Pajor (2011) установили, что мыши корректируют форму гнезда в зависимости от температуры окружающей среды. Таким образом, гнездовой материал может быть решением проблемы несоответствия между лабораторной температурой и температурными предпочтениями мыши [9–16].
Оценка боли и стресса у лабораторных животных обычно включает измерение физиологических и поведенческих показателей. На сегодняшний день оценка боли у лабораторных мышей включает оценку одного из следующих показателей: двигательная активность, потребление пищи и воды, прибавка или потеря массы тела, качество шерсти и т.д. Каждый из этих методов имеет ограничения. Многие из них требуют обработки, анализа образцов или одновременного контроля и поэтому не подходят для рутинной оценки. Кроме того, отдельные физиологические параметры неспецифичны для боли и стресса, а также не полностью характеризуют испытываемый животными дискомфорт [17, 18]. Влияние боли на двигательную активность изучается часто, но дефицит локомоции может быть либо побочным эффектом анестезии и обезболивания, либо признаком боли. Поэтому предполагается, что грызуны мало и не всегда очевидно демонстрируют поведение, указывающее на продолжающуюся боль, или вообще не проявляют его [19, 20].
Помимо оценки боли и стресса у животных, которые находятся в эксперименте, также важной остается задача оценки благополучия животных, проживающих в питомнике лабораторных животных, их благополучие необходимо оценивать на рутинной основе при ежедневном контроле.
Предоставленные данные свидетельствуют об актуальности проблемы предоставления среды обогащения лабораторным мышам как фактора влияющего на развитие стресса.
Целью настоящего исследования являлось изучение гнездования как показателя здоровья и благополучия лабораторных мышей при групповом и индивидуальном содержании при разных факторах стресса.
Задачами исследования являлись оценка пригодности картонного стаканчика в качестве материала для обогащения среды и индикатора благополучия самцов и самок мышей при разных уровнях стресса и разработка критериев оценки благополучия животных, пригодных для рутинного анализа.
Материалы и методы
Исследование проведено на базе АО «НПО «Дом Фармации» в 2020 г. Эксперимент одобрен биоэтической комиссией (БЭК) №2.34/20.
В качестве тест-системы использовались самцы и самки аутбредных мышей. В качестве группы контроля были выбраны животные обоих полов в стандартных групповых условиях размещения [8]. В исследовании S.S. Arndt et al. (2009) относительно одиночного содержания лабораторных мышей как фактора стресса, самцы и самки давали схожие реакции [11]. В ряде исследований доказано, что самцы острее реагируют на послеоперационную боль и холод, чем самки [12–14].
Оценка использования гнездового материала у беременных самок была обоснована естественными инстинктивными поведенческими реакциями, основанными на желании постройки гнезда для своего потомства [15, 16].
В эксперименте использованы 95 животных (65 самцов и 30 самок в возрасте 6–8 нед., из них 5 беременных самок в возрасте 8–10 нед). После окончания эксперимента все животные были возвращены в ветеринарную службу.
В качестве гнездового материала использовали однослойный картонный стаканчик объемом 180 мл и плотностью 210 г/м2.
Характеристика экспериментальных групп представлена в табл. 1.
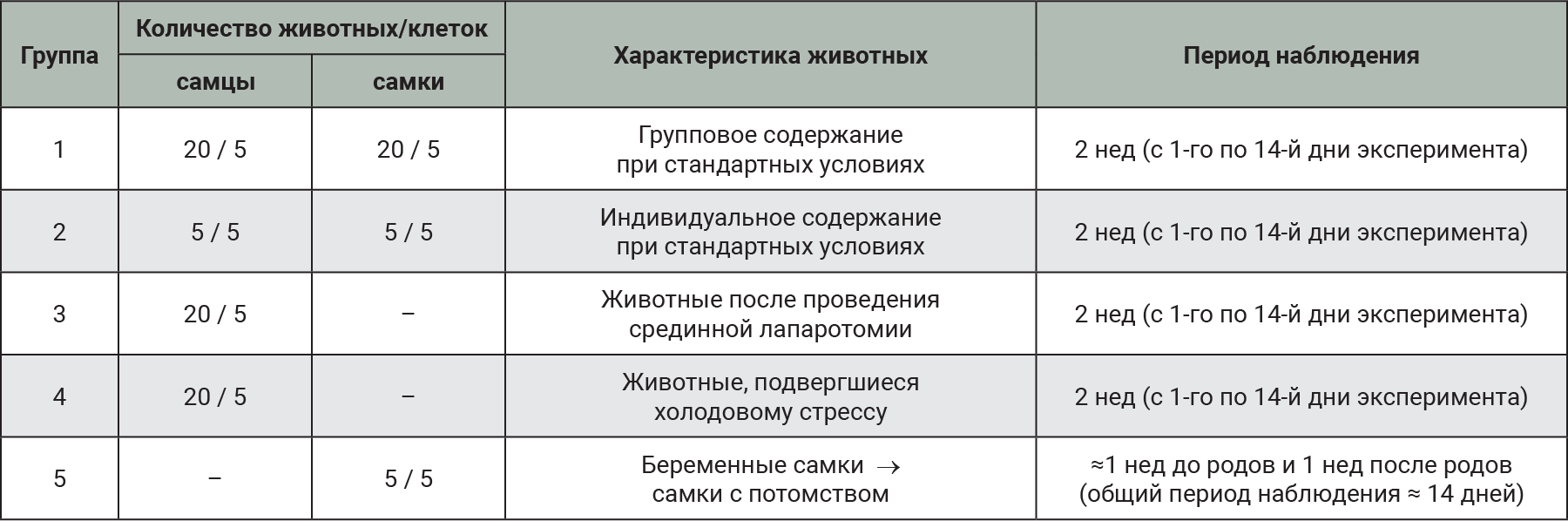
Животные группы №1
Животных группы №1 содержали по 4 особи одного пола в клетке (5 клеток по 4 самца; 5 клеток по 4 самки) в течение 2 нед при стандартных условиях в соответствии с Директивой 2010/63/EU Европейского парламента и совета Европейского союза от 22 сентября 2010 г. по охране животных, используемых в научных целях (табл. 2).

На 2-й неделе после замены подстила был предоставлен новый стаканчик. Также со 2-го дня эксперимента у животных ежедневно 1 раз в день проводили тест интегрирования гнездового материала в гнездо.
Животные группы №2
Животных группы №2 содержали индивидуально в течение 2 нед со стаканчиками в качестве материала для обогащения среды. Со 2-го дня до 14-го дня эксперимента у животных ежедневно 1 раз в день изучали гнездовое поведение и проводили тест интегрирования гнездового материала в гнездо.
Животные группы №3
Животных группы №3 содержали по 4 особи в клетке. В 1-й день эксперимента животным группы №3 был предоставлен стаканчик. Далее в период с 1-го по 7-й дни эксперимента за животными осуществляли ежедневное наблюдение и изучение гнездового поведения. Со 2-го дня эксперимента у животных ежедневно проводился тест интегрирования гнездового материала в гнездо. На 8-й день эксперимента у животных была проведена срединная лапаротомия с предварительной депривацией корма на 4 ч. Непосредственно перед операцией животные были введены в состояние наркоза с помощью ветеринарных препаратов Золетил®100 (Virbac, Франция) и Ксила (Interchemie, Нидерланды). После наступления глубокого наркоза животных фиксировали на операционном столике в положении на спине. Далее в области операционного поля на вентральной брюшной стенке был удален шерстный покров. Операционное поле обрабатывалось антисептическим раствором. Далее выполнен послойный разрез по белой линии живота с последующим послойным ушиванием раны: брюшную стенку – простым узловатым швом, кожу – простым узловатым швом. После наложения швов все операционное поле было обработано террамицином.
В послеоперационный период в течение 3 дней животным обрабатывали раны дезинфицирующим средством. В данный период в клетку содержания животного был помещен новый стаканчик. Наблюдение за животными, изучение гнездового поведения и тестирование времени интегрирования гнездового материала в гнездо проводили ежедневно 1 раз в день до 14-го дня эксперимента.
Животные группы №4
В 1-й день эксперимента животным группы №4 был предоставлен стаканчик. Далее в период с 1-го по 7-й дни эксперимента за животным осуществляли ежедневное наблюдение и изучение гнездового поведения. Также у животных ежедневно проводили тест интегрирования гнездового материала в гнездо (со 2-го дня эксперимента). На 8-й день эксперимента животных подвергали холодовому стрессу (температура от +2 до +8°С) в течение 4 ч, для чего клетку с животными помещали в холодильник без освещения. После 4 ч в холодильнике животных помещали в клетку с новым стаканчиком и ежедневно 1 раз в день изучали гнездовое поведение и проводили тест интегрирования гнездового материала в гнездо (до 14-го дня эксперимента).
Животные группы №5
В данную группу были включены самки мышей примерно на 13-м дне беременности. У самок изучали гнездовое поведение вплоть до родов. После родов самкам был предоставлен новый стаканчик, затем в течение 7 дней изучали гнездовое поведение и тест интегрирования гнездового материала в гнездо.
Оценка гнездового поведения у животных
Оценка гнездового поведения проводилась так же, как описано в статье B.N. Gaskill et al. (2013) [10]. Оценка животных проводилась по критериям, представленным в табл. 3.
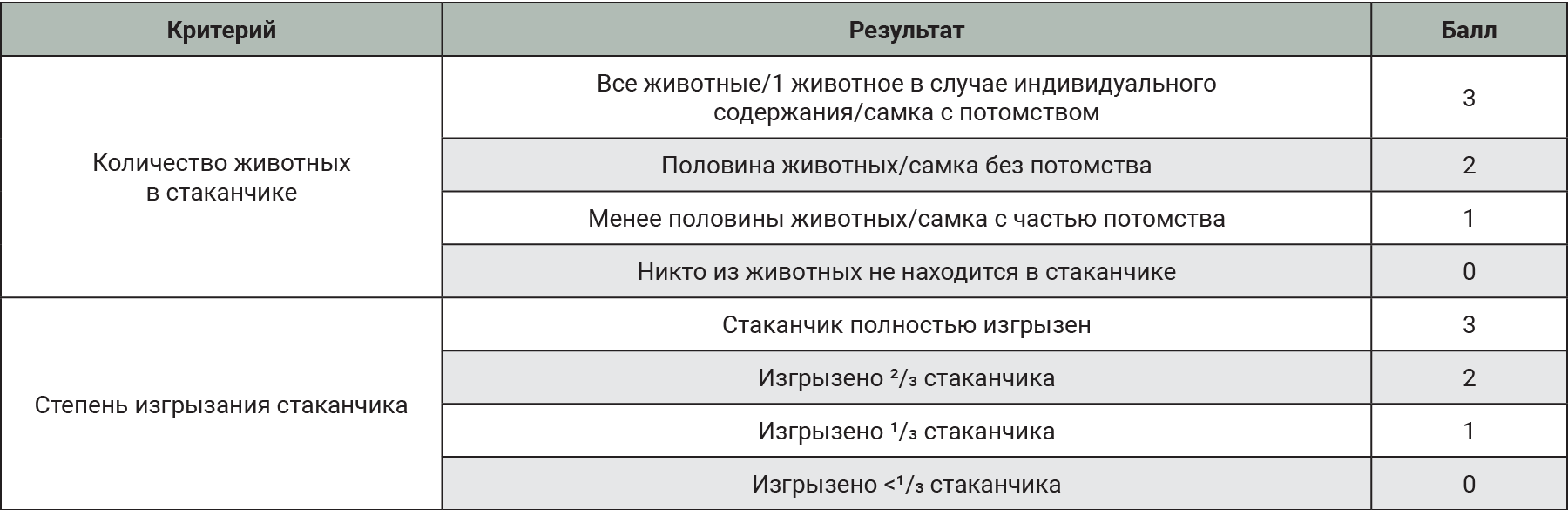
Оценку эффективности критерия в качестве индикатора фактора стресса оценивали на основании суммы баллов за весь период в группах №1–4. В группе №5 сумма баллов по каждому показателю была учтена только с 1-го по 7-й день в сравнении с самками 1-й группы за аналогичный период и рассматривалась отдельно.
Тест интегрирования гнездового материала в гнездо
Для проведения данного теста вырезали фрагмент (стенки) стаканчика размером 3 × 3 см. В течение первых 3 ч с момента включения света в боксе данный фрагмент стаканчика помещали в клетку содержания на противоположную сторону от центрального гнезда (стаканчика). Через 10 мин после помещения фрагмента стаканчика возвращались к клетке содержания и регистрировали результаты.
Если фрагмент стаканчика отсутствовал на своем первоначальном месте, то тест оценивался как положительный. Если фрагмент стаканчика оставался на исходном месте, то тест оценивался как отрицательный.
Данные по оценке гнездового поведения оценены в баллах, рассчитаны медиана и квартильный размах. Статистический анализ не выполнялся.
Результаты и обсуждение
На 1-м этапе работы оценивали применимость показателя «Количество животных в стаканчике» как индикатора фактора стресса у лабораторных мышей (табл. 4).
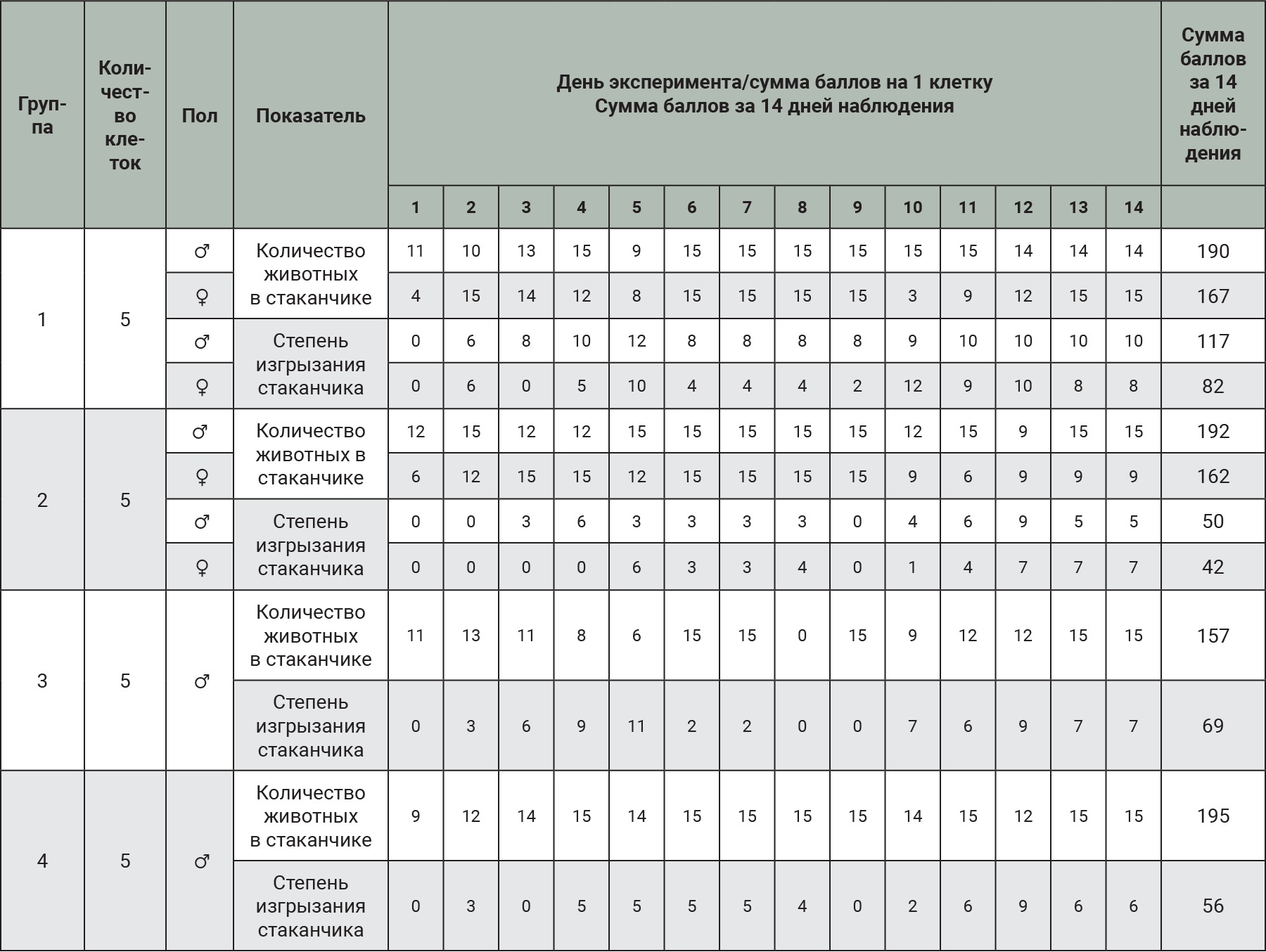
В условиях стандартного размещения по 4 головы в клетке и в отсутствие стрессовых факторов самцы по показателю количество животных в стаканчике имели в сумме 190 баллов за 14 дней из 210 возможных. Этот же показатель у самцов группы №2 при одиночном содержании составил 192 балла. На фоне существенного стресса (проведение лапаротомии) для животных группы №3 данный показатель снизился до 157 баллов, в основном за счет операционного дня, когда животные подвергались наркозу. У самцов 4-й группы на 8-й день эксперимента был проведен холодовой стресс, по исследуемому показателю за 14 дней в данной группе результат составил 195 баллов.
У самок 1-й группы при содержании групповым методом по 4 головы в клетке и 2 группы при одиночном содержании сумма баллов за 14 дней по показателю «Нахождение животных в стаканчике» практически не отличалось и составило соответственно 167 и 162 балла.
На основании данного этапа эксперимента мы можем говорить, что исследуемый показатель по сумме баллов у самок был ниже, нежели у самцов, однако он не может являться индикаторным показателем для оценки стресса, так как значимо не отличался между группами одного пола.
По показателю изгрызания стаканчика самцы 1-й группы имели в сумме 117 баллов, при этом в группе №2 при одиночном содержании по этому же показателю – всего 50 баллов. В группах №3 и №4 показатель был также значительно ниже, чем у самцов 1-й группы – соответственно 69 и 56 баллов.
У самок 1-й группы сумма баллов по данному показателю составила 82, что почти вдвое превышало данный показатель 2-й группы (42 балла).
Анализируя применимость показателя изгрызания стаканчика в качестве индикаторного показателя, мы можем утверждать, что данный параметр подходит для оценки уровня стресса как для самцов, так и для самок. Данные, полученные для животных 1-й группы, могут быть приняты за показатель благополучия животных.
В 5-й группе сумма баллов по каждому показателю была учтена только с 1-го по 7-й день (до родов) в сравнении с самками 1-й группы за аналогичный период и рассматривалась отдельно (табл. 5).

Что касается показателя количества животных в стаканчике, мы не можем однозначно утверждать о его применимости как индикатора стресса.
Сумма баллов между самками 1-й и 5-й групп практически не отличалась и составляла соответственно 83 и 93, однако стоит отметить, что у самок 5-й группы, начиная с 4-го дня, возрастает динамика по нахождению животных в стаканчике перед родами (рис. 1).
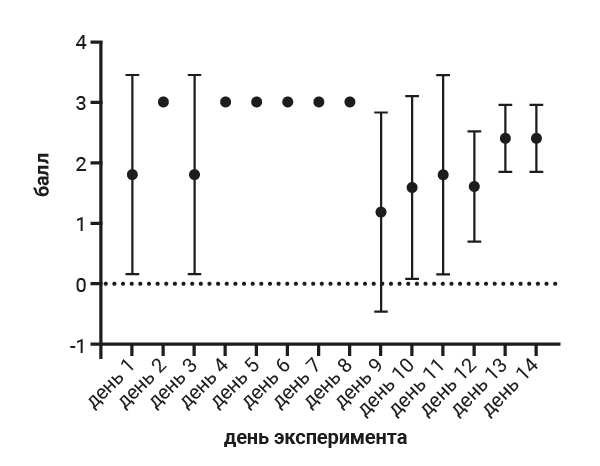
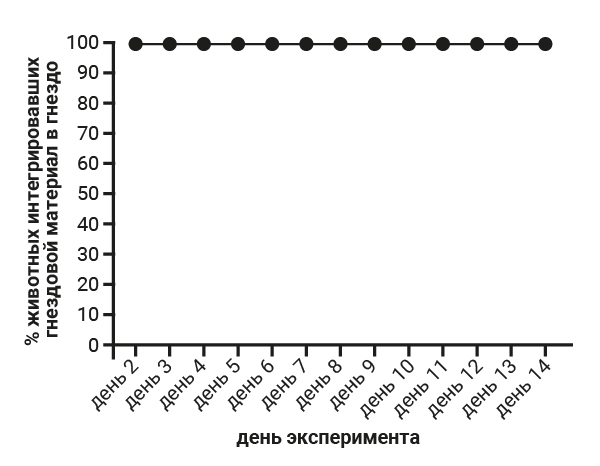
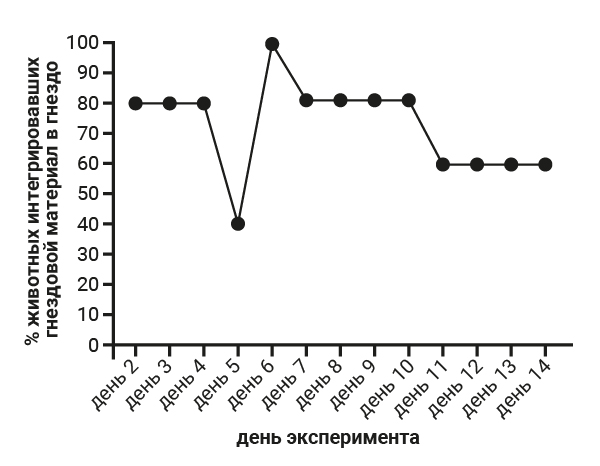
Степень изгрызания стаканчика у самок 5-й группы ожидаемо выше и составляет 38 баллов, тогда как в 1-й группе – 29 баллов, что, на наш взгляд, связано с инстинктом построить гнездо перед родами. На следующем этапе работы мы проводили анализ результатов теста интегрирования гнездового материала в гнездо. При проведении теста интегрирования гнездового материала в гнездо установлено, что самцы 1-й группы интегрировали гнездовой материал в 100% случаев (рис. 2), а показатели самцов группы №2, где содержание животных было одиночным, не были однородными и интегрирование гнездового материала в гнездо в данной группе в 100% случаев было установлено только 1 раз за весь эксперимент. В основном показатель достигал отметки в 60–80% (рис. 3).
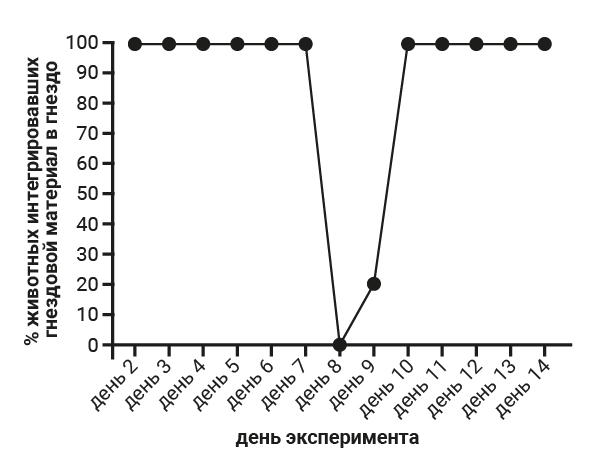
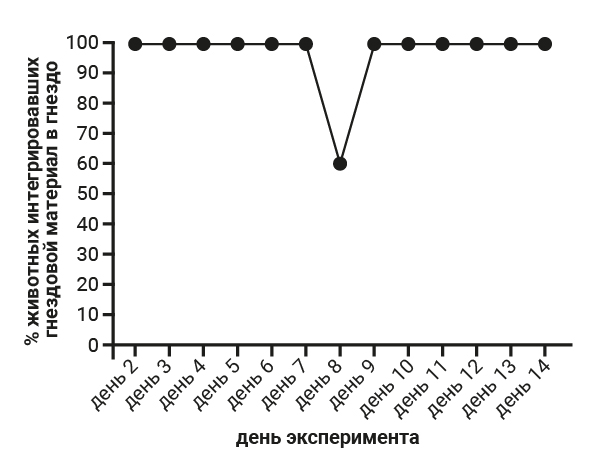
На 8-й день эксперимента самцам 3-й группы была проведена срединная лапаротомия. При проведении теста интегрирования гнездового материала в гнездо установлено, что во все дни, кроме 8-го и 9-го, животные интегрировали гнездовой материал в гнездо в 100% случаев. На 8-й день, в день проведения срединной лапаротомии результат теста показал 0%, затем на 9-й день результат увеличился до 20%, что связано с воздействием боли, которая постепенно снизилась уже к 10-му дню до предоперационного уровня, это подтверждается процентом интегрирования гнездового материала в 100% случаев (рис. 4). У самцов 4-й группы интегрирование гнездового материала в гнездо наблюдалось в 100% случаев на протяжении всего эксперимента, за исключением 8-го дня, когда проводился тест «Холодовой стресс», в этот день только 60% животных интегрировали гнездовой материал в гнездо (рис. 5).
Самки всех групп, независимо от способа содержания и физиологического статуса, интегрировали гнездовой материал в гнездо в 100% случаев (рис. 6).
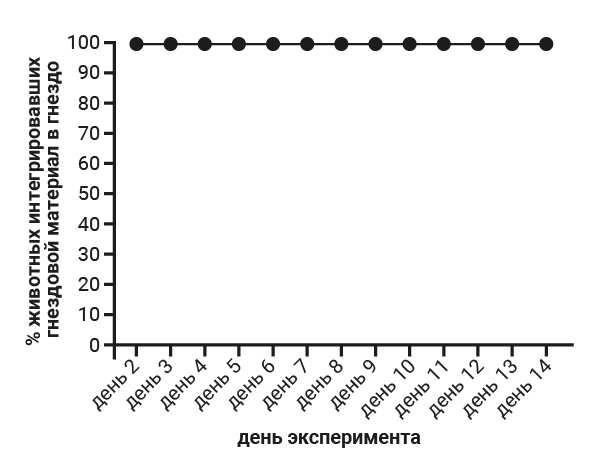
По результатам проведения теста интегрирования гнездового материала у мышей можно заключить, что в случаях воздействия на организм лабораторных животных факторов стресса и боли данный показатель является индикаторным.
Заключение
По результатам исследования сделаны следующие выводы:
- представленные результаты в той или иной степени могут быть успешно использованы для выявления факторов стресса и боли у лабораторных мышей;
- заинтересованность в стаканчике как в гнездовом материале как у самцов, так и у самок была на достаточно высоком уровне у всех экспериментальных животных, которые использовали его фрагменты для строительства гнезда или же использовали его как логово, что свидетельствует о применимости стаканчика в качестве гнездового материала/логова у лабораторных мышей;
- нахождение животных в стаканчике не является индикаторным показателем стресса;
- показатели «Изгрызание стаканчика» и «Интегрирование гнездового материала в гнездо» являются индикаторными и могут служить для оценки стресса у лабораторных мышей.
Одной из глобальных задач надлежащей лабораторной практики является минимизация и облегчение боли и стресса у лабораторных животных. Однако современные методы оценки благополучия лабораторных мышей трудоемки и требуют значительных экономических затрат, в ряде случаев инвазивны, следовательно неприменимы для оценки стресса в рутинной практике в условиях крупных питомников и доклинических центров.
Внедрение неинвазивных тестов по оценке гнездования животных как методов мониторинга благополучия лабораторных мышей в условиях их проживания и размножения представляется целесообразным.
Вклад авторов
М.А. Акимова – координация планирования и выполнения исследовательской работы, анализ и интерпретация результатов, обобщение результатов.
М.Н. Макарова – критический пересмотр содержания статьи.
Д.Ю. Акимов – анализ источников литературы, анализ и интерпретация результатов.
Сведения о конфликте интересов
Авторы заявляют об отсутствии конфликта интересов.
Список источников
- Hutchinson E., Avery A., Vandewoude S. Environmental enrichment for laboratory rodents//Institute of Laboratory Animal Research Journal. 2010; 46: 148–161. doi: 10.1093/ilar.46.2.162
- Bailoo J.D., Murphy E., Boada-Saña M., Varholick J.A., Hintze S., Baussière, C., Würbel H. Effects of cage enrichment on behavior, welfare and outcome variability in female mice//Frontiers in Behavioural Neuroscience. 2018; 12: 232. doi: 10.3389/fnbeh.2018.00232
- Baumans V., Van Loo P.L.P., Pham T.M. Environmental enrichment for laboratory rodents and rabbits: requirements of rodents, rabbits, and research. // Institute of Laboratory Animal Research Journal; 37. – №. 2: 101-114. doi: 10.1093/ilar.46.2.162
- Leidinger C.S., Thöne-Reineke C., Baumgart N., Baumgart J. Environmental enrichment prevents pup mortality in laboratory mice// Laboratory animals. 2019; 53 (1): 53–62. doi: 10.1177/0023677218777536
- Liss C., Litwak K., Reinhardt V., Tilford D. Comfortable quarters for laboratory animals. // Animal Welfare Institute. 2015: 21.
- Crawley J.N., Belknap J.K., Collins A., Crabbe J.C., Frankel W., Henderson N., Hitzemann R.J., Maxson S.C., Miner L.L., Silva A.J., Wehner J.M., Wynshaw-Boris A., Paylor R.//Behavioral phenotypes of inbred mouse strains: implications and recommendations for molecular studies. Psychopharmacology (Berl). 1997; 132: 107–124.
- Pham T.M., Hagman B., Codita A. Housing environment influences the need for pain relief during post-operative recovery in mice//Physiology and Behaviour. 2010; 99 (5): 663–668. doi: 10.1016/j.physbeh.2010.01.038
- ГОСТ 33216-2014 Руководство по содержанию и уходу за лабораторными животными. Правила содержания и ухода за лабораторными грызунами и кроликами [GOST 33216-2014 Rukovodstvo po soderzhaniyu i ukhodu za laboratornymi zhivotnymi. Pravila soderzhaniya i ukhoda za laboratornymi gryzunami i krolikami (In Russ.)]
- Gaskill B.N., Rohr S.A., Pajor E.A. Working with what you’ve got: Changes in thermal preference and behavior in mice with or without nesting material//Journal of Thermal Biology. 2011; 36 (3): 193–199. doi: 10.1016/j.jtherbio.2011.02.004
- Gaskill B.N., Gordon C.J., Pajor E.A., Lucas J.R., Davis J.K., Garner J.P. Impact of nesting material on mouse body temperature and physiology// Physiology and Behavior. 2013; 110: 87–95. doi: 10.1016/j.physbeh.2012.12.018
- Arndt S.S., Laarakker M.C., Lith H.A., Staay F.J., Gieling E., Salomons A.R., Ohl F. Individual housing of mice—impact on behaviour and stress responses // Physiology & behavior. 2013; 97: 385–393.
- Arras M., Rettich A., Cinelli P., Kasermann H.P., Burki K. Assessment of post-laparotomy pain in laboratory mice by telemetric recording of heart rate and heart rate variability / BMC veterinary research. 2007; 3 (1): 1–10.
- Wolfe A.M., Kennedy L.H., Na J.J., Nemzek-Hamlin J.A. Efficacy of tramadol as a sole analgesic for postoperative pain in male and female mice// Journal of the American Association for Laboratory Animal Science. 2015; 54 (4): 411–419.
- Cichoń M., Chadzińska M., Książek A., Konarzewski M. Delayed effects of cold stress on immune response in laboratory mice// Proceedings of the Royal Society of London. Series B: Biological Sciences. 2002; 269 (1499): 1493–1497.
- Noirot E. The onset of maternal behavior in rats, hamsters, and mice a selective review //Advances in the Study of Behavior. 1972; 4: 107–145.
- Noirot E., Goyens J. Changes in maternal behavior during gestation in the mouse //Hormones and Behavior. 1971; 2 (3): 207–215.
- Karas A.Z., Danneman P.J., Cadillac J.M. Strategies forAssessing and Minimizing Pain //Anesthesia and analgesia in laboratory animals. 2008: 195.
- Mogil J.S., Crager S.E. What should we be measuring in behavioral studies of chronic pain in animals? // Pain. 2004; 112 (1): 12-15. doi: 10.1016/j.pain.2004.09.028
- Stasiak K.L., Maul D.O.N., French E., Hellyer P.W., Vandewoude S. Species-specific assessment of pain in laboratory animals //Journal of the American Association for Laboratory Animal Science. 2003; 42 (4): 13–20.
- Rock M.L., Karas A.Z., Rodriguez K.B.G., Gallo M.S., Pritchett-Corning K., Karas R.H., Gaskill B.N. The time-to-integrate-to-nest test as an indicator of wellbeing in laboratory mice //Journal of the American Association for Laboratory Animal Science. 2014; 53 (1): 24–28.



