Апробация модели инфекционного, ассоциированного Helicobacter pylori, воспаления желудочно-кишечного тракта у лабораторных песчанок
Гущин Я.А., Крышень А.А. Апробация модели инфекционного, ассоциированного Helicobacter pylori, воспаления желудочно-кишечного тракта у лабораторных песчанок. Лабораторные животные для научных исследований. 2020; 3. https://doi.org/10.29296/2618723X-2020-03-08
Резюме
Язвенная болезнь (ЯБ) желудка и двенадцатиперстной кишки – хроническое рецидивирующее заболевание, протекающее с чередованием периодов обострения и ремиссии, основное проявление которого – образование дефекта в стенке желудка и двенадцатиперстной кишки.
Одним из основных факторов развития ЯБ является инфицирование Helicobacter pylori. Это микроаэрофильные, неспорообразующие, грамотрицательные, изогнутые палочковидные или кокковидные бактерии. Они играют важную роль в усилении агрессивных свойств желудочного содержимого и ослаблении защитных свойств слизистой оболочки желудка и двенадцатиперстной кишки. Высокая частота формирования хронического гастрита, вызванного H. pylori, обусловливает соответственно и значительный уровень развития онкологических заболеваний. Поэтому отработка модели H. pylori-индуцированных гастродуоденальных заболеваний in vivo для поиска альтернативной терапии инфекции H. pylori является актуальной в настоящее время.
Таким образом, цель исследования – отработка модели инфекционного, ассоциированного H. pylori воспаления желудочно-кишечного тракта с возможностью оценки тяжести развившейся патологии по микроскопическим изменениям в тканях желудочно-кишечного тракта.
В качестве тест-системы задействовано 30 половозрелых самцов лабораторных песчанок. Животных положительного контроля инфицировали суспензией свежей культуры H. pylori в концентрации 2.109 КОЕ/мл в объеме 0,5 мл при внутрижелудочном введении 1 раз в день в течение 2 дней. Животным группы отрицательного контроля по аналогичной схеме вводили стерильный триптон-соевый бульон (среда для культивирования H. pylori). При морфологическом анализе за основу была принята Международная классификация хронического гастрита (Сиднейская система и ее Хьюстонская модификация).
В результате проведенного исследования у лабораторных песчанок через 24 нед эксперимента сформировалась патология слизистой оболочки желудка. Через 8 нед у инфицированных животных зарегистрированы начальные проявления катарального гастрита. К концу 16-й недели эксперимента, помимо усилившихся проявлений гастрита, выявлены бактерии, по своим морфологическим формам соответствующие H. pylori. К концу исследования в слизистой оболочке желудка, помимо воспалительного компонента, развились атрофия желез, эрозивно-язвенное поражение слизистой оболочки, а при специфической окраске у животных в слизистой оболочке желудка выявлены бактериальные формы, соответствующие H. pylori. Патологические изменения отмечены преимущественно в антральном отделе желудка. Выбранная система оценки тяжести патологии была достаточно объективна, так как позволяла полноценно анализировать развитие патологии.
Однако использование данного штамма H. pylori не привело к формированию язвенных и метаплазийных изменений при наблюдении на 24-й неделе развития патологии, как ожидалось исходя из данных литературы, также за время эксперимента не удалось добиться развития дуоденита. Вероятно, использованный штамм бактерий не обладал достаточной вирулентностью, что необходимо учитывать в дальнейших исследованиях.
Введение
Язвенная болезнь (ЯБ) желудка и двенадцатиперстной кишки – хроническое рецидивирующее заболевание, протекающее с чередованием периодов обострения и ремиссии, основное проявление которого – образование дефекта (язвы) в стенке желудка и/или двенадцатиперстной кишки, проникающего (в отличие от эрозий) в подслизистый слой [1].
Этиология ЯБ разнообразна, поэтому влияющие факторы разделены на 2 группы: модифицируемые и немодифицируемые. Немодифицируемыми факторами являются генетическая предрасположенность, увеличенное количество обкладочных клеток в железах желудка и вследствие этого – стойко высокий уровень соляной кислоты в желудочном соке, значительное содержание в сыворотке крови пепсиногенов I, II и так называемой ульцерогенной фракции пепсиногена в желудочном содержимом, повышенные высвобождение гастрина в ответ на прием пищи и чувствительность обкладочных клеток к гастрину, переход от биологического «лета» к биологической «зиме», и наоборот (физиологические десинхронозы), и многие другие. К модифицируемым факторам относят прием нестероидных противовоспалительных препаратов, стрессогенные ситуации, наличие вредных привычек (курение, злоупотребление алкоголем), профессиональные вредности, нарушение стереотипа питания, но прежде всего инфицирование Helicobacter pylori.
H. pylori – это микроаэрофильные, неспорообразующие, грамотрицательные, изогнутые палочковидные или кокковидные бактерии, населяющие слизистые оболочки нижних отделов желудка и двенадцатиперстной кишки [2].
H. pylori играет важную роль в усилении агрессивных свойств желудочного содержимого и ослаблении защитных свойств слизистой оболочки желудка и двенадцатиперстной кишки. Эти бактерии имеют широкий набор факторов патогенности, в том числе ферменты агрессии: муциназу, протеазу, уреазу, фосфолипазу А1, А2, С, факторы ацидопротекции, разрушающие защитный слой слизистой оболочки, а также различные цитотоксины. Наиболее патогенные – CagA-, VacA-позитивные штаммы Н. pylori. Они обладают способностью к продукции уникального экзотоксина, оказывающего специфическое повреждающее действие на эпителиоциты желудка – формирование в их цитозоле крупных вакуолей, что приводит к гибели эпителиальных клеток. Н. pylori способствует высвобождению в слизистой оболочке желудка интерлейкинов, лизосомальных энзимов, фактора некроза опухоли. Это вызывает развитие воспалительных процессов в слизистой оболочке желудка. Обсеменение слизистой оболочки желудка Н. pylori сопровождается развитием поверхностного антрального гастрита и дуоденита и приводит к повышению выработки гастрина и снижению продукции соматостатина с последующим усилением секреции соляной кислоты. Избыточное количество соляной кислоты, попадая в просвет двенадцатиперстной кишки, в условиях относительного дефицита панкреатических бикарбонатов способствует прогрессированию дуоденита и, кроме того, обусловливает образование в двенадцатиперстной кишке участков желудочной метаплазии (перестройка эпителия дуоденальной слизистой оболочки по желудочному типу), быстро заселяемых Н. pylori. В дальнейшем при неблагоприятном течении, особенно при наличии дополнительных этиологических факторов, в участках метаплазированной слизистой оболочки формируется язвенный дефект [1].
По данным из разных регионов РФ, H. pylori обнаруживают у 65–92% взрослых [3]. Высокая частота формирования хронического хеликобактерного гастрита обусловливает высокую частоту развития других заболеваний, ассоциированных с H. pylori. В нашей стране ежегодно регистрируют более 37 тыс. новых случаев рака желудка, который занимает 4-e место в структуре онкологической заболеваемости и 2-е место в структуре смертности при онкологических заболеваниях.
Основная причина неэффективной эрадикации H. pylori является антибиотикорезистентность [4, 5]. Клиническое значение имеет резистентность H. pylori к кларитромицину (антибиотик 1-й линии терапии для эрадикации), метронидазолу (антибиотик альтернативного варианта 1-й линии терапии для эрадикации) и левофлоксацину (антибиотик 2-й и 3-й линии терапии для эрадикации).
Отработка модели H. pylori-индуцированных гастродуоденальных заболеваний in vivo для поиска альтернативной терапии инфекции H. pylori является актуальной в настоящее время.
Таким образом, цель исследования – отработка модели инфекционного, ассоциированного H. pylori воспаления желудочно-кишечного тракта (ЖКТ) у лабораторных песчанок. Для этого были поставлены следующие задачи:
- индуцировать патологию ЖКТ внутрижелудочным введением суспензии H. pylori лабораторным песчанкам;
- выбрать систему оценки тяжести развившейся патологии по микроскопическим изменениям в тканях ЖКТ (желудок и двенадцатиперстная кишка);
- проанализировать прогрессирование патологии в динамике через 8, 16 и 24 нед.
Материал и методы
В данном исследовании в качестве тест-системы были использованы 30 половозрелых самцов лабораторных песчанок, поскольку данный вид животных успешно применялся в исследованиях по экспериментальному заражению H. pylori с развитием у животных язвы желудка, двенадцатиперстной кишки и кишечной метаплазии [6–12].
Животных содержали в стандартных условиях в соответствии с санитарно-эпидемиологическими правилами СП 2.2.1.3218-14 «Санитарно-эпидемиологические требования к устройству, оборудованию и содержанию экспериментально-биологических клиник (вивариев)» (29 августа 2014 г.) и с Директивой 2010/63/EU Европейского парламента и совета Европейского союза от 22 сентября 2010 г. по охране животных, используемых в научных целях.
Животные были распределены на 2 группы по 15 особей: 1-я группа – отрицательный контроль и 2-я группа – положительный контроль с индукцией патологии.
Моделирование патологии
В литературе описаны экспериментальные модели гастродуоденальных заболеваний с использованием различных видов лабораторных животных [13–16].
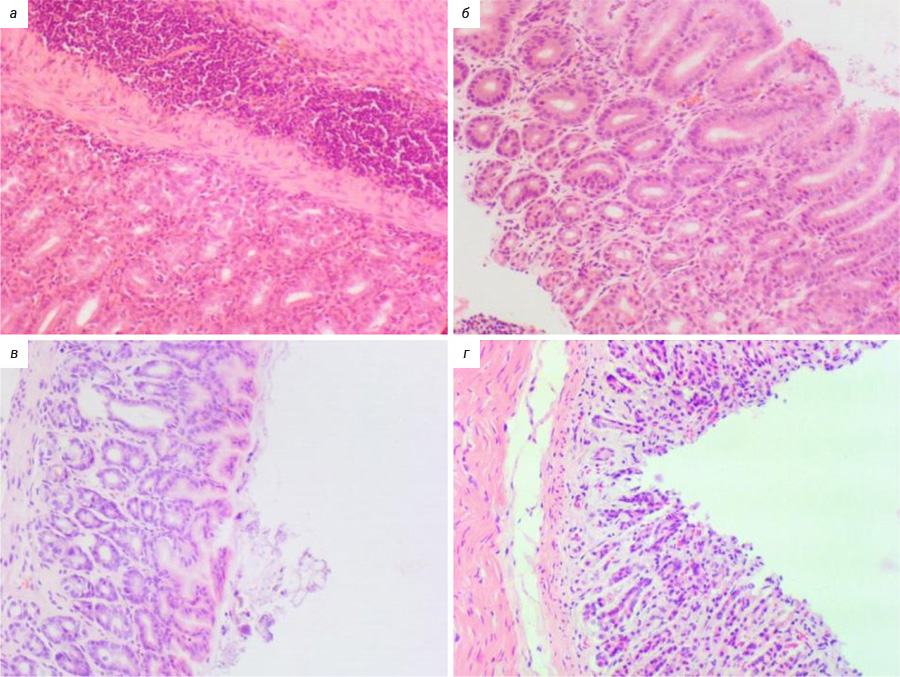
Песчанка (когтистая песчанка, Meriones unguiculatus) – вид грызунов рода малых песчанок. Этих животных чаще всего используют в исследованиях по изучению патогенеза H. pylori, поскольку они имеют анатомически схожую складчатую структуру желудка, необходимую для развития бактерий в анаэробных условиях. Модель на песчанках отражает многие особенности воспаления желудка, вызванного H. pylori, вплоть до формирования аденокарциномы желудка. Многочисленные исследования показали, что экспериментальное заражение песчанок H. pylori приводило к развитию у животных язвы желудка, двенадцатиперстной кишки и кишечной метаплазии [17, 18]. Последовательность возникновения патологии ЖКТ у песчанок в сравнении с человеком представлена на рис. 1.
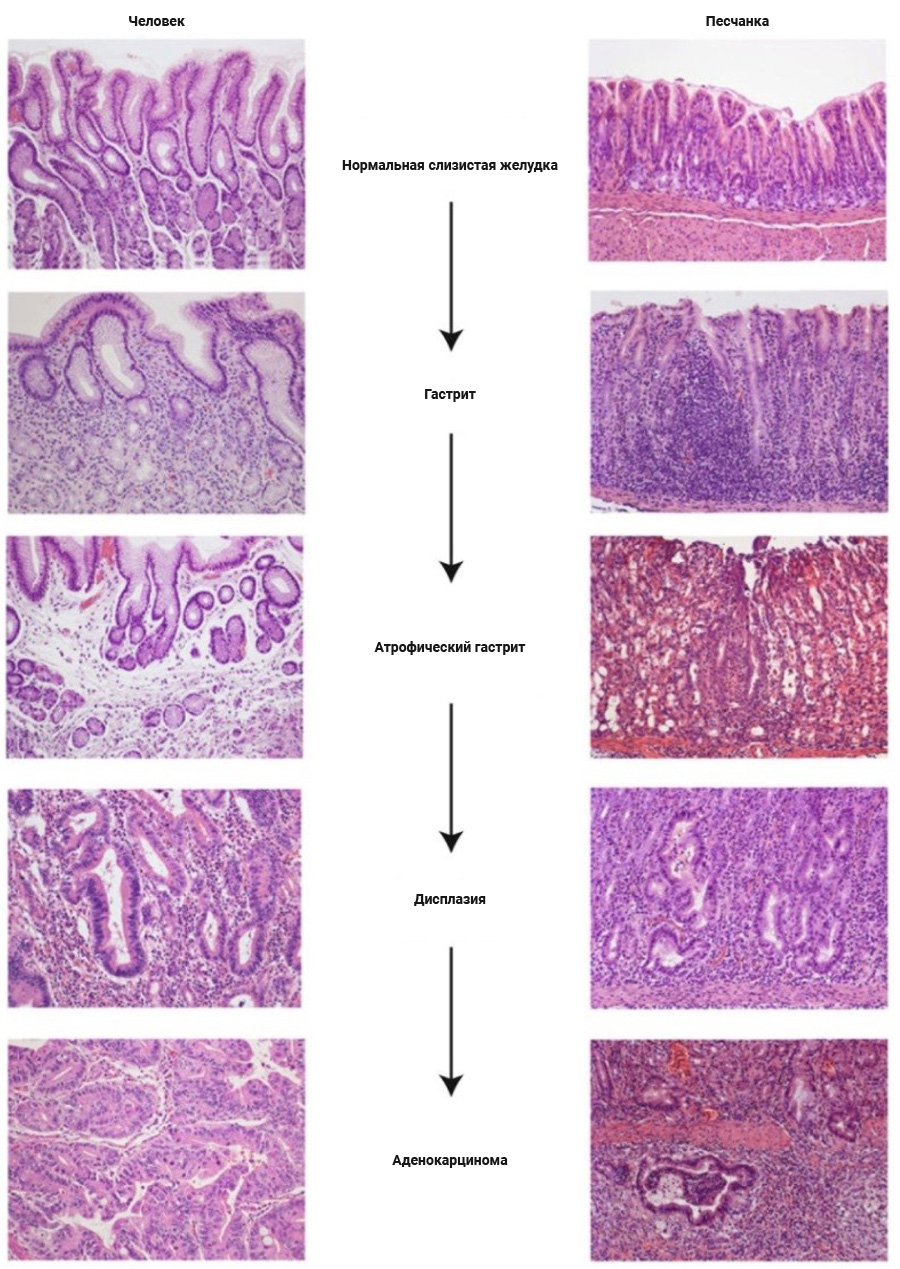
Животных 2-й группы (положительный контроль) внутрижелудочно 1 раз в день в течение 2 дней инфицировали суспензией свежей культуры H. pylori (клинический изолят, полученный из коллекции Санкт-Петербургского НИИ эпидемиологии и микробиологии им. Пастера) в концентрации 2.109 КОЕ/мл в объеме 0,5 мл. Животным 1-й группы (отрицательный контроль) по аналогичной схеме вводили стерильный триптон-соевый бульон (среда для культивирования H. pylori).
Патоморфологический анализ
Из каждой группы были взяты по 5 животных, на 8, 16 и 24-й неделе проведена их эвтаназия с извлечением желудка и части двенадцатиперстной кишки для последующего гистологического анализа. При этом было изготовлено по 3 продольных среза от пилорического до кардиального сфинктера (рис. 2), из данных срезов изготовлены микропрепараты, окрашенные гематоксилином и эозином, а также метиленовым синим для визуализации H. рylori.
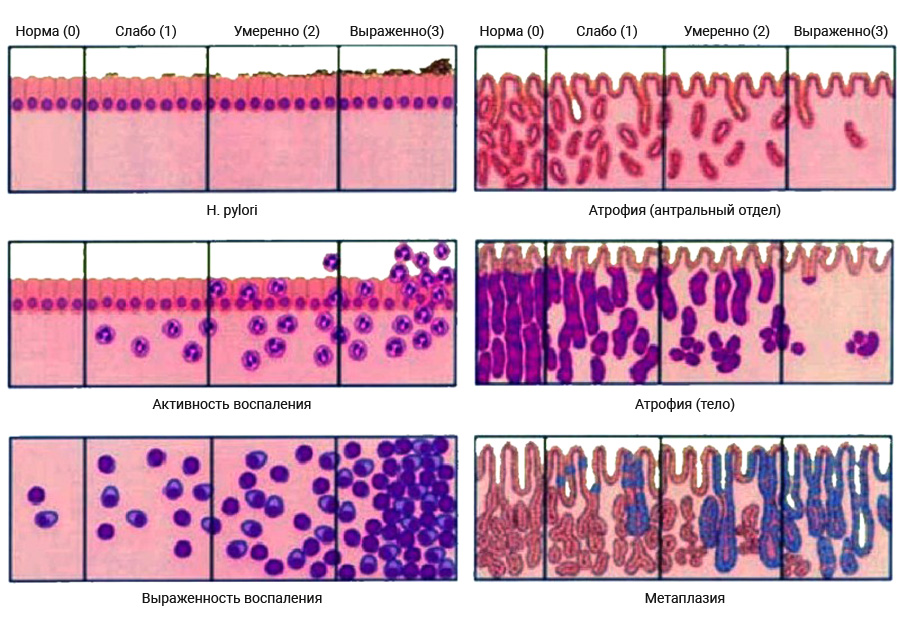
В 1990 г. на 9-м Международном конгрессе гастроэнтерологов была принята первая полноценная система классификации хронического гастрита, названная Сиднейской. В дальнейшем ее неоднократно пересматривали и модифицировали, но и по сей день эта классификация не утратила своей актуальности [19–21]. Однако данные системы направлены прежде всего для выработки тактики лечения пациента, исходя из этиологии, тяжести заболевания и выявленного риска малигнизации. В случае доклинических исследований не ставится цель планировать лечение, а оценивается текущее состояние животного и проводится сравнительная оценка эффективности исследуемого препарата. Именно поэтому в нашем случае были выбраны следующие показатели:
- локализация (антральный отдел, тело, пангастрит);
- активность воспаления;
- выраженность: воспаления, атрофии, метаплазии, обсеменения слизистой оболочки H. pylori.
Для морфологической оценки степени выраженности патологии использованы визуально-аналоговые шкалы, предложенные в Сиднейской системе. В данном случае применяли балльную оценку: 0 – норма, 1 – слабая выраженность, 2 – умеренная, 3 – выраженная (рис. 3).
Результаты
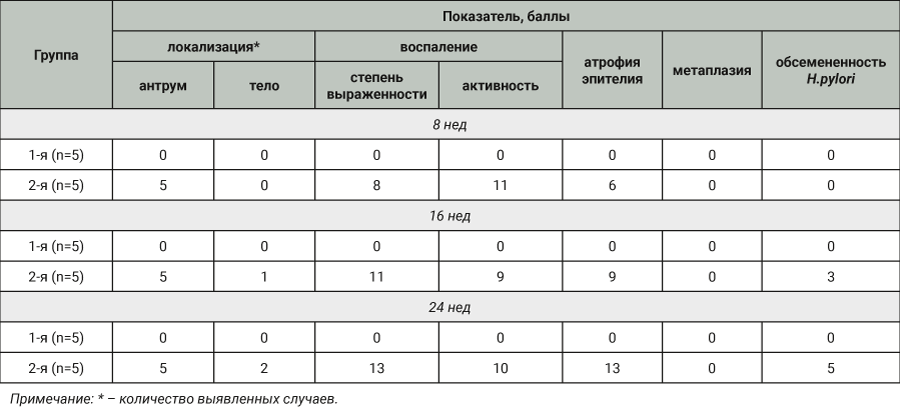
Выявлено, что пероральное введение культуры H. рylori песчанкам приводило к возникновению и прогрессированию экспериментальной патологии в течение 24 нед. Развитие патологии сопровождалось морфологическими изменениями слизистой оболочки желудка, характерными для катарального гастрита с тенденцией к хронизации процесса. Результаты морфометрического исследования представлены в таблице.
У всех животных отрицательного контроля строение желудка на протяжении всего исследования соответствовало норме. Стенка желудка представлена слизистой, мышечной и серозной оболочкой. В слизистой оболочке имелись высокие ворсинки, ямочно-шеечные отделы не углублены, выявлялись равномерное распределение желез и единичные лимфоциты. Мышечная оболочка представлена пучками гладкомышечных волокон, серозная оболочка образована рыхлой соединительной тканью и покрыта мезотелием (рис. 4).
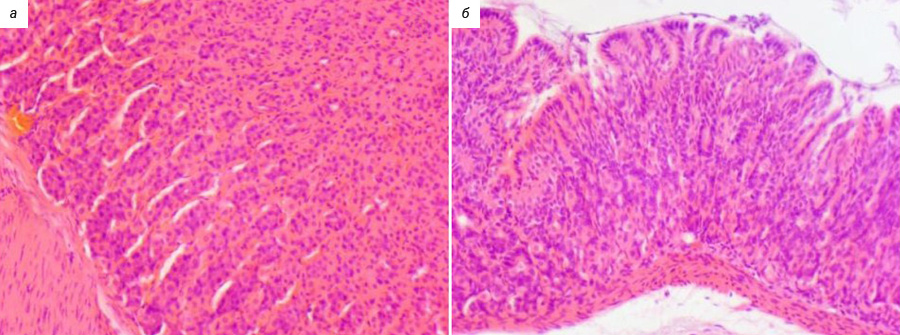
На 8-й неделе у животных с моделированной патологией выявлена очаговая лимфоидная инфильтрация в подслизистом слое. Эпителий сохранен, без атрофии, в собственной пластинке определялась незначительная воспалительная инфильтрация (рис. 5А). У ряда животных на фоне активного воспаления в расширенных железах выявлены скопления нейтрофилов (рис. 5Б). В одном случае обнаружена глубокая эрозия (рис. 6). Однако при окраске метиленовым синим H. pylori не выявлены.
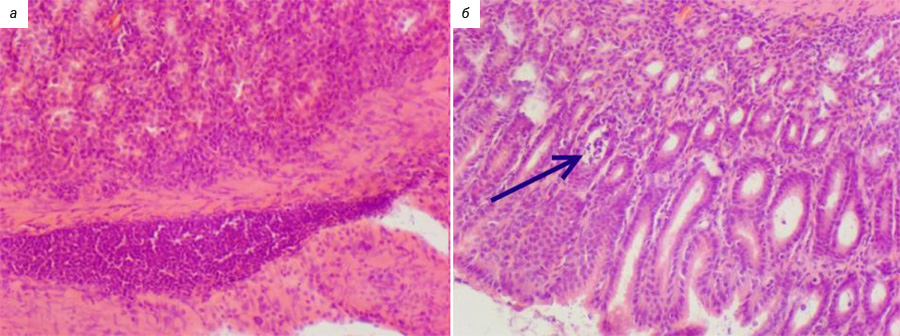
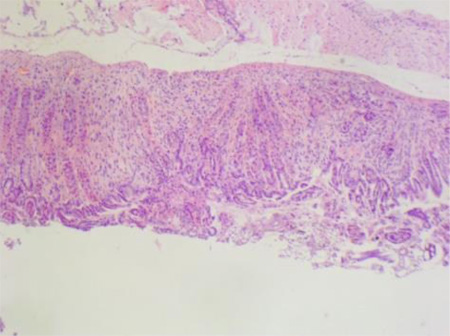
К 16-й неделе в группе положительного контроля у всех животных выявлены признаки катарального гастрита различной степени выраженности (рис. 7). Эпителий на большем протяжении сохранен, со слабо и умеренно выраженной атрофией. Можно наблюдать участки десквамации поверхностного эпителия. В собственной пластинке слизистой оболочки определялась воспалительная инфильтрация преимущественно лимфомакрофагальная, у ряда животных с наличием гранулоцитов как показатель активности воспалительного процесса. Железы расширены, с признаками атрофии клеток, в просвете наблюдались клетки воспаления. Патологический процесс в основном затрагивал антральный отдел желудка и только в одном случае отмечено поражение во всех отделах.
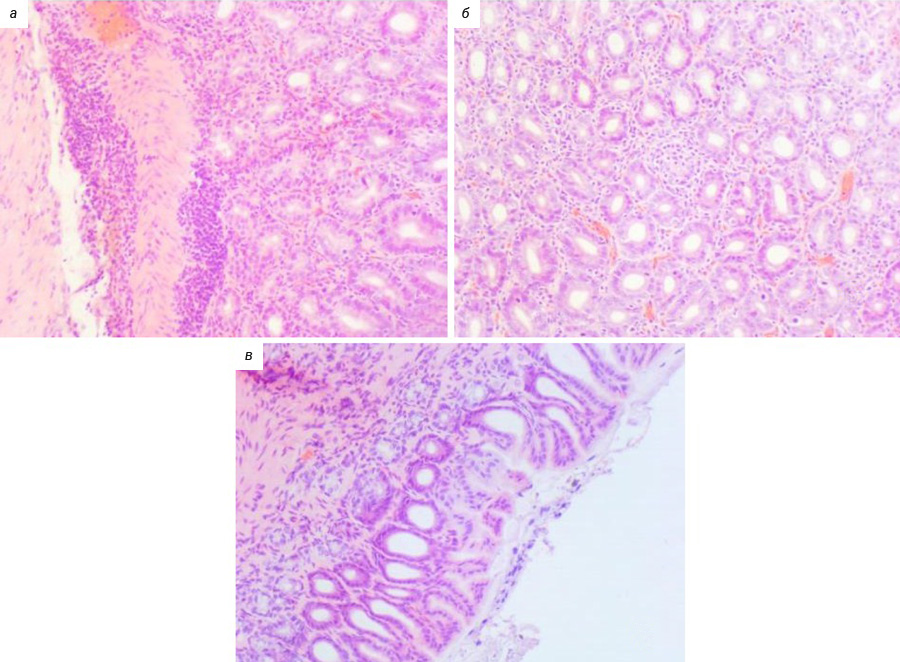
При окраске метиленовым синим у нескольких животных группы положительного контроля обнаружены характерные для H. pylori морфологические формы бактерий, которые располагались на поверхности эпителия (рис. 8).
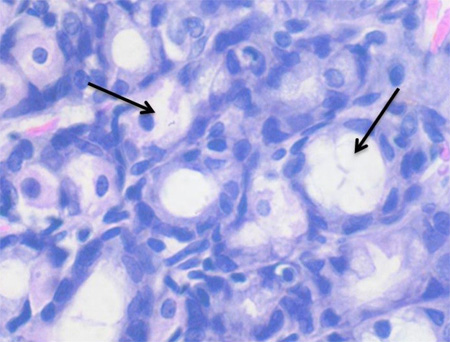
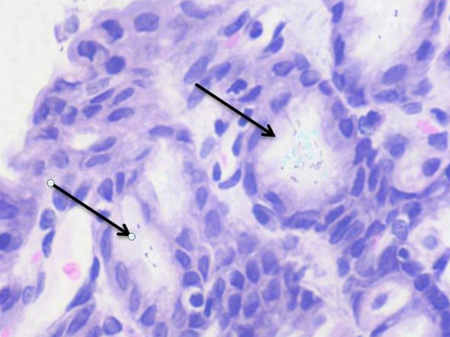
К концу исследования (24-я неделя) у всех животных с моделированием патологии выявлены признаки катарального гастрита от умеренной до сильной степени выраженности (рис. 9). Патологические изменения развились в антральном отделе желудка, у двух животных отмечено возникновение пангастрита. Эпителий на большем протяжении сохранен, но присутствовали участки умеренной и небольшие участки тяжелой атрофии. Определялись множественные участки лимфомакрофагальной воспалительной инфильтрациии с небольшим количеством нейтрофилов. Часть желез расширена, эпителий атрофичен, в просвете наблюдались скопления клеток воспаления. В двух случаях отмечены эрозии поверхностного эпителия, и в одном – глубокая язва. При окраске метиленовым синим у двух животных в группе положительного контроля выявлены бактерии с морфологией H. рylori, лежащие небольшими группами на эпителии и сконцентрированные в просвете желез (рис. 10).
Заключение
В результате проведенного исследования по отработке модели инфекционного, ассоциированного H. pylori воспаления ЖКТ у лабораторных песчанок к 24-й неделе эксперимента сформировалась патология слизистой оболочки желудка.
В течение 8 нед у животных негативного контроля, инфицированных H. pylori, зарегистрированы очаговая лимфоидная инфильтрация в подслизистом слое, незначительная воспалительная инфильтрация, расширение просвета желез, в которых определялись скопления нейтрофилов, в одном случае выявлена эрозия слизистой оболочки. К концу 16-й недели эксперимента у всех животных с моделированием патологии обнаружены признаки катарального гастрита различной степени выраженности, слабовыраженная атрофия с участками десквамации, умеренная лимфоцитарная инфильтрация, а также бактерии, по своим морфологическим формам соответствующие H. pylori. Поражение затрагивало преимущественно антральный отдел желудка. Через 24 нед после формирования патологии у всех животных обнаружены патоморфологичекие изменения в тканях желудка. Помимо воспалительного компонента, присутствовали атрофия желез, эрозивно-язвенное поражение слизистой оболочки, при специфической окраске метиленовым синим у нескольких животных выявлены бактериальные формы, соответствующие H. pylori. Патологические изменения отмечены преимущественно в антральном отделе желудка, но у 2 из 5 животных наблюдалось поражение как антрального отдела, так и тела желудка.
Однако использование данного штамма H. pylori не привело к формированию язвенных и метаплазийных изменений при наблюдении на 24-й неделе развития патологии, как ожидалось, исходя из сведений, приведенных в литературе. Также за время эксперимента не удалось добиться развития дуоденита. В дальнейших исследованиях для формирования инфекционного воспаления ЖКТ, возможно, необходимо использовать более вирулентный штамм H. pylori.
Вклад авторов
Гущин Я.А. – сбор и анализ данных, написание и редактирование текста статьи
Крышень А.А. – концепция и дизайн исследования, сбор и систематизация материала, редактирование текста.
Список источников
- Язвенная болезнь желудка и двенадцатиперстной кишки: Руководство для врачей общей практики (семейных врачей)/ Ассоциация врачей общей практики (семейных врачей) Российской Федерации. 2015. 23 [Yazvennaya bolezn' zheludka i dvenadtsatiperstnoi kishki: Rukovodstvo dlya vrachei obshchei praktiki (semeinykh vrachei)/ Assotsiatsiya vrachei obshchei praktiki (semeinykh vrachei) Rossiiskoi Federatsii. 2015. 23 (In Russ)].
- Marshall B.J, H. Royce D.I. Annear C.S. et al. Original isolation of Campylobacter pyloridis from gastric mucosa // Microbios Letters. 1984. No 25. 83-88.
- Ивашкин В.Т., Маев И.В., Лапина Т.Л. и др. Лечение инфекции Helicobacter pylori: мейнстрим и новации (Обзор литературы и резолюция Экспертного совета Российской гастроэнтерологической ассоциации 19 мая 2017 г.) // Российский журнал Гастроэнтерологии, Гепатологии, Колопроктологии. 2017. № 27 (4). 4-21 DOI: 10.22416/1382-4376-2017-27-4-4-21 [Ivashkin V.T., Maev I.V., Lapina T.L. i dr. Lechenie infektsii Helicobacter pylori: meinstrim i novatsii (Obzor literatury i rezolyutsiya Ehkspertnogo soveta Rossiiskoi gastroehnterologicheskoi assotsiatsii 19 maya 2017 g.) // Rossiiskii zhurnal Gastroehnterologii, Gepatologii, Koloproktologii. 2017. № 27 (4). 4-21 DOI: 10.22416/1382-4376-2017-27-4-4-21 (In Russ)].
- Megraud F., Coenen S., Versporten A., Kist M., Lopez-Brea M., Hirschl A.M. Andersen L.P., Goossens H., Glupczynski Y., study group participants. Helicobacter pylori resistance to antibiotics in Europe and its relationship to antibiotic consumption // Gut. 2013. Vol. 62. P.34-42. DOI: 10.1136/gutjnl-2012-302254
- Thung I., Aramin H., Vavinskaya V. et al. Review antibiotic resistance // Alimentary Pharmacology &Therapeutics. 2016. Vol. 43. P.514-533.
- Hirayama F, Takagi S, Kusuhara H, Iwao E, Yokoyama Y, Ikeda Y. Induction of gastric ulcer and intestinal metaplasia in Mongolian gerbils infected with Helicobacter pylori // Journal of Gastroenterology. 1996. Vol. 31. P.755–757. DOI: 10.1007/BF02347631
- Matsumoto S, Washizuka Y, Matsumoto Y, Tawara S, Ikeda F, Yokota Y, Karita M. Induction of ulceration and severe gastritis in Mongolian gerbil by Helicobacter pylori infection // Journal of Method of Microbiology. – 1997. – Vol. 46. – P.391–397 DOI: 10.1099/00222615-46-5-391.
- Honda S, Fujioka T, Tokieda M, Gotoh T, Nishizono A, Nasu M. Gastric ulcer, atrophic gastritis, and intestinal metaplasia caused by Helicobacter pylori infection in Mongolian gerbils // Scandinavian Journal of Gastroenterology. – 1998. – Vol. 33. – P.454–460.
- Ikeno T, Ota H, Sugiyama A, Ishida K, Katsuyama T, Genta RM, Kawasaki S. Helicobacter pylori-induced chronic active gastritis, intestinal metaplasia, and gastric ulcer in Mongolian gerbils // American Journal of Pathology. 1999. Vol. 154. P.951–960. DOI: 10.1080/00365529850171990
- Ohkusa T, Okayasu I, Miwa H, Ohtaka K, Endo S, Sato N. Helicobacter pylori infection induces duodenitis and superficial duodenal ulcer in Mongolian gerbils // Gut. 2003. Vol. 52. P.797–803. DOI: 10.1136/gut.52.6.797
- Nakagawa S. Osaki T. et al. Long-Term Infection of Mongolian Gerbils with Helicobacter pylori: Microbiological, Histopathological, and Serological Analyses // Clinical and diagnostic laboratory immunology. 2005. P.347–353. DOI: 10.1128/CDLI.12.2.347-353.2005
- Noto M.J., Romero-Gallo J. et al. The Mongolian Gerbil: A Robust Model of Helicobacter pylori-Induced Gastric Inflammation and Cancer // Methods in molecular biology. 2016. Vol.1422. P.263-280. DOI: 10.1128/mBio.00955-19
- Kodama M., Murakami K., Sato R. et al. Helicobacter pylori-infected animal models are extremely suitable for the investigation of gastric carcinogenesis // World Journal of Gastroenterology. – 2005. – Vol. 11, No 45. – P.7063-7071. DOI: 10.3748/wjg.v11.i45.7063
- Nancy S. Taylor, James G. Fox. Animal Models of Helicobacter-Induced Disease: Methods to Successfully Infect the Mouse // Methods in molecular biology. 2012. Vol. 921. P.131–142. DOI: 10.1007/978-1-62703-005-2_18
- Werawatganon D. Simple animal model of Helicobacter pylori infection // World Journal of Gastroenterology. 2014. Vol. 20, No 21. P.6420-6024. DOI: 10.3748/wjg.v20.i21.6420
- Handbook of Laboratory Animal Science. Volume III: Animal models. Second Edition. 2005. – P. 58
- Hirayama F, Takagi S, Kusuhara H, Iwao E, Yokoyama Y, Ikeda Y. Induction of gastric ulcer and intestinal metaplasia in Mongolian gerbils infected with Helicobacter pylori // Journal of Gastroenterology. 1996. Vol. 31. P.755–757. DOI: 10.1007/BF02347631
- Matsumoto S, Washizuka Y, Matsumoto Y, Tawara S, Ikeda F, Yokota Y, Karita M. Induction of ulceration and severe gastritis in Mongolian gerbil by Helicobacter pylori infection // Journal of Method of Microbiology. – 1997. – Vol. 46. – P.391–397. DOI: 10.1136/gut.52.6.797
- Аруин Л.И., Кононов А.В., Мозговой С.И. Новая Классификация хронического гастрита // Актуальные вопросы патологической анатомии: Материалы III съезда Рос. общества патологоанатомов. Самара. 2009. Т. 1. С. 5-8 [Ivashkin V.T., Maev I.V., Lapina T.L. i dr. Lechenie infektsii Helicobacter pylori: meinstrim i novatsii (Obzor literatury i rezolyutsiya Ehkspertnogo soveta Rossiiskoi gastroehnterologicheskoi assotsiatsii 19 maya 2017 g.) // Rossiiskii zhurnal Gastroehnterologii, Gepatologii, Koloproktologii. 2017. № 27 (4). 4-21 (In Russ)].
- Зак М. Ю. Классификация хронического гастрита: от Сиднейской системы к системе OLGA. Сучасна гастроентерологія. 2010. № 6 (56). С. 116–126 [Zak M. Yu. Klassifikatsiya khronicheskogo gastrita: ot Sidneiskoi sistemy k sisteme OLGA. Suchasna gastroenterologіya. 2010. № 6 (56). S. 116–126 (In Russ)].
- Misiewicz J. The Sydney System: a new classification of gastritis. Introduction // J. Gastroenterol. Hepatol. 1991; 6 (3): 207–8. DOI: 10.1111/j.1440-1746.1991.tb01467.x



