Новое в науке и практике доклинических исследований
Макаров В.Г., Макарова М.Н. Новое в науке и практике доклинических исследований. Лабораторные животные для научных исследований. 2020; 2. https://doi.org/10.29296/2618723X-2020-02-07
Резюме
В статье дана краткая характеристика некоторых интересных публикаций о новых исследованиях в науке и практике доклинических исследований. Приведены результаты исследования, свидетельствующего о возможности использования десневой венопункции в качестве альтернативного минимально травматичного метода отбора крови у морских свинок для гематологического анализа крови.
В другой публикации дана сравнительная оценка 6 наиболее часто используемых в настоящее время методов отбора крови у мышей (ампутация кончика хвоста; пункция подъязычной, хвостовой, поднижнечелюстной и подкожной вен; пункция ретробульбарного синуса при анестезии изофлураном).
Интересным представляется исследование об использовании ползунков для новорожденных при послеоперационной защите кроликов. При этом показано, что они более удобны, чем воротники, не только в отношении обеспечения адекватного социального поведения кроликов, но и в плане скорости заживления, меньшей травматизации места операционного разреза, а также более экономичны.
Еще одна публикация посвящена оценке новой системы содержания лабораторных животных так называемых индивидуально вентилируемых клеток, которые имеют множество преимуществ перед обычными системами вентиляции, позволяя снизить у животных стрессовые реакции, физиологические и гормональные нарушения, ослабляющие здоровье животных.
Для исследователей, занимающихся проблемами полости рта и зубов, будет интересна публикация о моделировании диетиндуцированного генерализованного пародонтита у крыс и об экспериментальной оценке такой модели.
Новое в методах выполнения процедур
В статье Journal of the American Association for Laboratory Animal Science за ноябрь 2019 г., посвященной сравнительному анализу гематологических и бактериологических показателей крови, взятой из десневой вены и полой вены у морских свинок, приводятся преимущества и недостатки указанных методов [1]. Авторы указывают, что методы сбора крови у морских свинок по сравнению с другими грызунами ограничены из-за их короткой шеи и конечностей, а также отсутствия хвоста. В связи с указанным они предлагают новый метод забора крови для морских свинок — десневую венопункцию, при которой используется десневая вена, расположенная в десне чуть ниже пары нижнечелюстных резцов.
В эксперименте применяли морских свинок Dunkin Hartley. Для отбора крови десну промывали либо только стерильным физиологическим раствором, либо стерильным физиологическим раствором с последующей обработкой разведенным раствором хлоргексидина. Далее вводили инсулиновый шприц каудально примерно на 3-5 мм вглубь десны непосредственно под нижними резцами. При этом исследователи отбирали не менее 250 мкл крови для гематологического анализа и не менее 200 мкл для бактериологического 1 раз в неделю в течение 6 нед. Контролем служили морские свинки, у которых кровь забирали из полой вены после предварительной дезинфекции кожи в месте отбора проб с использованием хлоргексидина и спирта.
В результате проведенных исследований показано, что десневая венопункция является менее травматичным методом отбора крови, чем процедура, проводимая из полой вены. При этом достоверных различий в показателях полного гематологического анализа крови не выявлено за весь изучавшийся период. Однако в бактериологическом анализе обнаружен рост количества бактерий во всех 5 образцах крови из десневых вен, обработанных только физиологическим раствором, и в 2 из 5 образцов, обработанных разбавленным хлоргексидином, в то время как количество бактерий не росло ни в одном образце крови из полой вены. Таким образом, результаты настоящего исследования свидетельствуют, что десневая венопункция может использоваться в качестве альтернативного минимально травматичного метода отбора крови у морских свинок для гематологического анализа крови, но не подходит для посева крови с последующей бактериологической оценкой.
Другие исследователи [2] впервые провели сравнительный анализ 6 наиболее часто используемых в настоящее время методов отбора крови у мышей (боковой разрез хвоста; ампутация кончика хвоста; пункция подъязычной, поднижнечелюстной и подкожной вен; пункция ретробульбарного синуса при анестезии изофлураном). И хотя, как заключают авторы, ни один из методов существенно не превосходил другие как по влиянию на общее состояние, так и по иммунологическим и гистопатологическим показателям, все же имелись некоторые различия между ними. Так, например, на 2-й день после отбора крови наибольшее снижение массы тела отмечалось при использовании метода ампутации кончика хвоста, наименьшее — при взятии крови из хвостовой вены (р = 0,010). На 10-е сутки мыши из группы пункции ретробульбарного синуса потеряли значительно больше массы тела по сравнению с группами пункции подкожных (р = 0,008) и подчелюстных (р = 0,024) вен. Одновременно группа мышей, у которых кровь отбирали сублингвально, потеряли значительно (р = 0,020) больше массы тела, чем группа отбора крови путем пункции подкожных вен.
Кроме различий во влиянии на массу тела, отмечались отличия и в результатах гистопатологического исследования (табл. 1). Как видно из табл. 1, наиболее существенные различия между группами животных регистрировались в отношении длительности острого воспаления, которая была минимальной при отборе крови с помощью подъязычной пункции и пункции ретробульбарного синуса, а максимальной при ампутации кончика хвоста. В последнем случае отмечалось также неполное заживление места забора крови. Отбор крови с помощью подъязычной пункции сопровождался развитием микроабсцессов со 2-го по 8-й день после процедуры, при других методах этого не наблюдалось.
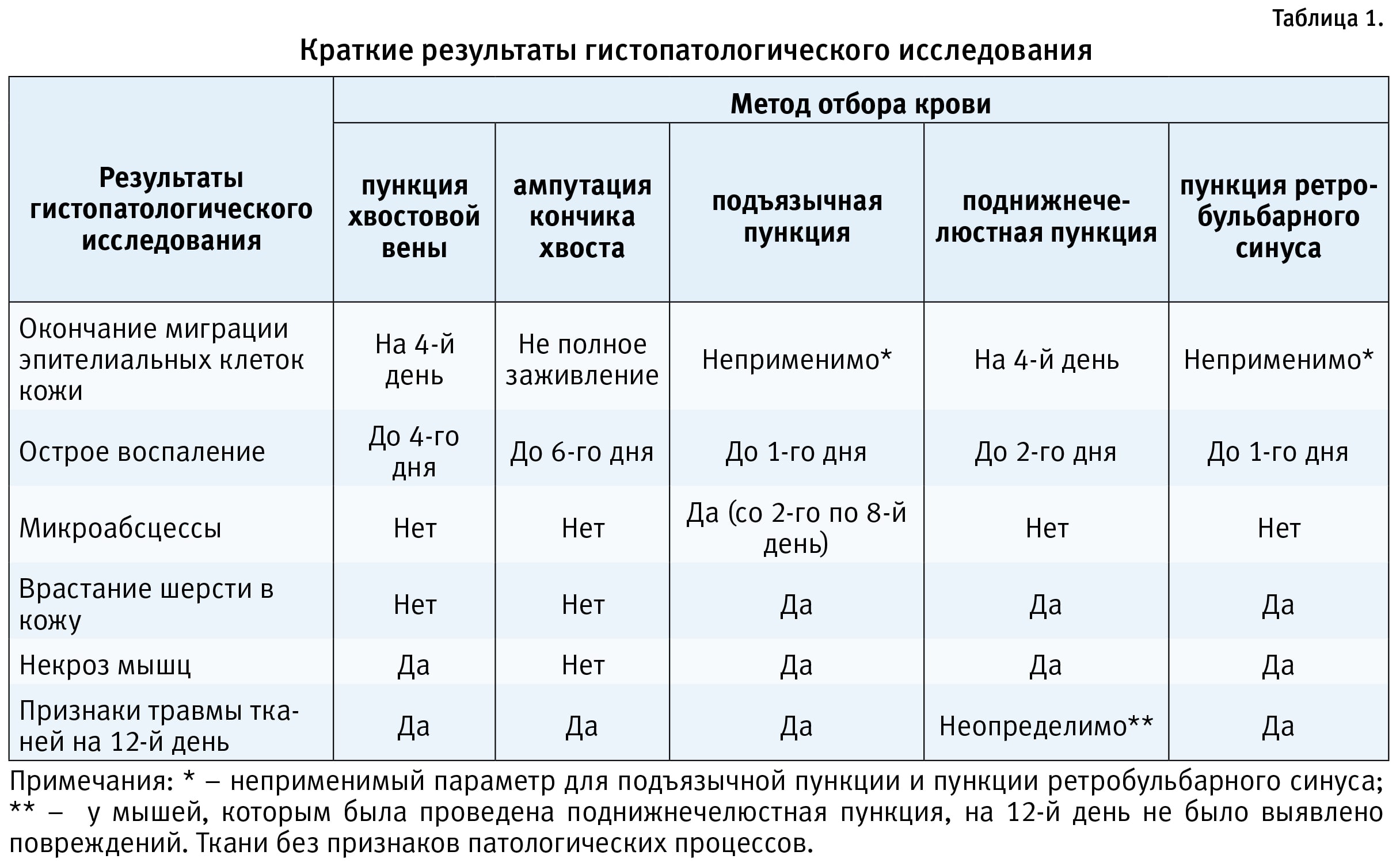
Следует отметить некоторые различия и в уровне кортикостерона: при венепункции из области головы уровень кортикостерона крови был выше, чем при отборе крови из хвостовой вены. Из 6 исследованных методов взятия проб крови наиболее неблагоприятное влияние на животных оказали ретробульбарная синусовая пункция и сублингвальная пункция, использование которых без анестезии вызывает выраженный стресс у животных. В заключение авторы отмечают, что совершенно безвредных процедур отбора крови нет, поэтому в каждом случае необходимо руководствоваться принципом минимизации повреждений в организме и влияния на полученные данные при проведении конкретного исследования в зависимости от длительности эксперимента, количества отборов крови в динамике (одноразовый или многократный) и др.
Новое в уходе за лабораторными животными
В статье K.A. Bartley и C.H. Johnson [3] рассматривается вопрос о возможности и эффективности применения ползунков новорожденных для послеоперационной защиты заживающих ран у новозеландских белых кроликов, наиболее часто используемых в биомедицинских исследованиях. При этом авторы отмечают, что обычно для защиты заживающих ран у экспериментальных животных применяются «Елизаветинские» воротники (у нас — воротник пластиковый защитный), которые ограничивают проявление типичных форм поведения, в том числе копрофагии, ухода за собой и социального поведения. Кроме того, защитные воротники часто спадают у кроликов, когда они трутся о клетку, что вызывает травмирование области операционного разреза и необходимость дополнительного лечения, увеличивая сроки выздоровления и искажая результаты исследования.
Авторы проанализировали результаты наблюдения за 154 интактными самцами новозеландских белых кроликов (возраст от 2 до 3 мес) после проведенной бедренной ангиопластики. Кролики были распределены на 2 группы: в 1-й группе (72 животных) использовали воротник пластиковый защитный, во 2-й группе (82 животных) — ползунки. При этом оценивали социальное поведение, затраты на обеспечение послеоперационного ухода, частоту послеоперационных осложнений, сроки выздоровления.
Для животных 1-й группы использовали защитные воротники из полиэтилена низкой плотности, они имели диаметр от 28 до 38 см (рис. 1). Во 2-й группе применяли ползунки для младенцев от 0 до 3 мес из 100% хлопка с полностью эластичным поясом (рис. 2), разработанные для детей массой тела 5-7 кг и длиной 60-63 см. В ползунках прорезали щель длиной 5-7 см для размещения гениталий и хвоста, что позволяло животному свободно мочиться и испражняться внутри клетки. И воротники, и ползунки надевали на кроликов сразу после операции, во время восстановления после наркоза сроком на 10 дней, что достаточно для заживления раны. В течение 10-дневного послеоперационного восстановительного периода на кроликах были и пластиковый воротник, и детские ползунки.


Исследования показали, что использование ползунков для послеоперационной защиты у кроликов было более успешно, чем воротников, как в отношении обеспечения адекватного социального поведения, так и в плане скорости заживления, меньшей травматизации места операционного разреза, при этом существенно уменьшались затраты на дальнейший послеоперационный уход.
X. Wang и соавт. [4] исследовали новую систему содержания лабораторных животных, получившую название «индивидуально вентилируемые клетки» (ИВК), широко используемые в настоящее время. Системы ИВК обладают многочисленными преимуществами, включая относительно низкие затраты, простоту эксплуатации и высокую степень изоляции, что позволяет защитить животных от воздействия внешней среды (инфекций, аллергенов и др.), а персонал от выделений животных в воздух вивариев. По сравнению с непроветриваемыми клетками в ИВК более низкий уровень аммиака, СО2 и меньшая влажность на фоне большего содержания кислорода. Постоянная вентиляция клеток уменьшает накопление вредных газов, обеспечивает сушку подстилки, а также позволяет снизить у животных стрессовые реакции, физиологические и гормональные нарушения, ослабляющие здоровье животных.
Важным техническим показателем систем ИВК является режим вентиляции, определяемый как кратность воздухообмена (КВО) за один час, который существенно влияет на микросреду клетки и здоровье лабораторных животных. Авторы исследовали режимы вентиляции с частотой обмена воздуха 40, 60 и 80 раз в час. В каждой клетке содержалось по 5 мышей, а внутри каждой стойки было по 6 клеток. Эксперимент длился 3 нед. При этом оценивали как состояние воздушной среды в клетках, так и показатели здоровья животных. Изучаемые параметры окружающей среды включали суточные уровни аммиака, а также температуру и относительную влажность воздуха в клетках и помещении. Для оценки состояния здоровья мышей регистрировали массу тела, уровень гормонов стресса (кортикостерон, гормон роста и адреналин), Т-лимфоцитов (CD4 и CD8), содержание иммуноглобулинов (IgG, IgM и IgA) и иммунных клеткок. Кроме того, в качестве контроля использовали две клетки с открытым верхом, находившиеся в этом же помещении, в которых содержалось по 5 животных в каждой.
Проведенные исследования показали, что КВО, равная 40, не обеспечивает поддержание здоровой воздушной среды в клетке и в ближайшем окружении. При КВО 80 высокая скорость обмена воздуха вызывала дискомфорт у мышей и отрицательно влияла на физиологические показатели состояния организма. Оптимальной по воздействию и на воздушную среду, и на показатели здоровья животных оказалась КВО 60 раз в час. Показатели контрольной группы были наиболее близки с группой, где КВО равнялась 60.
Новое в моделировании исследований на животных
В статье журнала Comparative Medicine за октябрь 2019 г. [5], посвященной диетиндуцированному генерализованному пародонтиту у крыс линии Льюис, авторы на основании анализа литературы разработали оптимальную модель пародонтита у грызунов, экспериментальную оценку которой они и приводят в данной публикации. Так, в статье предлагаются не только конкретный рацион питания для индуцирования пародонтита, но и конкретные методы оценки его эффективности, а также методология эксперимента. При этом исследователи использовали модифицированный синтетический рацион питания AIN93G (Purina TestDiet, St Louis, MO), обогатив его сахарозой (70% от общей энергоценности рациона) и казеином (18%) — СК-рацион. Этот рацион вызывал нарушение микрофлоры полости рта, что способствовало развитию воспаления и пародонтита без механического вмешательства. Контрольные животные находились на стандартном для крыс синтетическом рационе питания.
Для исследования были взяты крысы линии Льюис 5-недельного возраста, которых разделили на 3 группы: 1-я и 2-я группы получали стандартный рацион питания, а 3-я находилась на СК-рационе. При этом животные 1-й группы служили исходным контролем и подверглись эвтаназии через неделю нахождения на стандартном рационе, а животные 2-й и 3-й групп получали соответствующие рационы питания в течение 24 нед.
При оценке состояния животных и развития признаков пародонтита проводили гистологические и гистохимические исследования тканей пародонта, анализ экспрессии генов воспалительных цитокинов, денситометрию костной ткани, определяли концентрации лептина и инсулина в сыворотке крови и ряд других показателей состояния пародонта и организма в целом. Для итоговой оценки пародонтита использовали 5-балльную систему: отсутствие нарушений, незначительный, легкий, умеренный и тяжелый пародонтит. В результате применения указанной модели исследователям удалось добиться развития у подопытных животных пародонтита легкой (гиперплазия и воспаление десен, накопление зубного (бактериального) налета) и умеренной (эрозии, язвы и гиперплазия десен, выраженное накопление бактериального налета, разрушение периодонтальной связки, умеренная резорбция альвеолярной кости) степени тяжести.
Таким образом, авторы делают вывод, что предлагаемая модель (крысы) является перспективной для моделирования пародонтита легкой и средней степени тяжести, близкого по своей форме таковому у человека.
Благодарности
Работа выполнена без спонсорской поддержки.
Вклад авторов
Макарова М.Н. – идея, работа с источниками литературы, написание, редактирование текста.
Макаров В.Г. – сбор и систематизация данных, написание отдельных фрагментов текста.
Сведения о конфликте интересов
Авторы заявляют об отсутствии конфликта интересов.
Список источников
- Personett A.R., Santangelo K.S., Kendall L.V., Sadar M.J. Hematologic Parameters and Blood Cultures from the Gingival Vein Compared with the Cranial Vena Cava in Guinea Pigs. J. Amer. Assoc. Lab. Anim. Sci., 2019. – Vol. 58(6). – P. 817-822. Doi: 10.30802/AALAS-JAALAS-19-000039.
- Sørensen D.B., Metzdorff S.B., Jensen L.K., Andersen K.H., Teilmann A.C., Jensen H.E., Frøkiaer, H. Time-dependent Pathologic and Inflammatory Consequences of Various Blood Sampling Techniques in Mice. J. Amer. Assoc. Lab. Anim. Sci., 2019. Vol. 58(3). – P. 362–372. Doi:10.30802/aalas-jaalas-18-000064.
- Bartley K.A., Johnson C.H. Human Infant Pants for Postoperative Protection during Social Housing of New Zealand White Rabbits (Oryctolagus cuniculus). J. Amer. Assoc. Lab. Anim. Sci., 2019 Vol. 58(4). – P. 510-516. Doi: 10.30802/AALAS-JAALAS-18-000116.
- Wang X., Zhang Y., Lu T., Qi J., Liu H., Jin Z., Chen H. The effect of cage ventilation rate on the health of mice housed in Individually Ventilated Cages. – Scand. J. Laboratory Animal Science, 2019, Vol. 45, Number 3. – 9 p.
- Messer J.G, La S., Kipp D.E., Castillo E.J., Yarrow J Comp Med. 2019 Oct; 69(5): 384–400..F., Jorgensen M., Wnek R.D., Kimmel D.B., Aguirre J.I. Diet-induced Generalized Periodontitis in Lewis Rats. Comp. Med. 2019 Oct; 69(5): 384–400. DOI: 10.30802/AALAS-CM-18-000113.



