Бактериальные инфекции легких. Модели на животных
Хайбунасова Л.Р., Боровкова К.Е., Салмова Ю.В. Бактериальные инфекции легких. Модели на животных. Лабораторные животные для научных исследований. 2020; 2. https://doi.org/10.29296/2618723X-2020-02-06
Резюме
Пневмония является основной причиной заболеваемости и смертности во всем мире, особенно среди детей и пожилых людей. Нозокомиальная пневмония в условиях стационара — одно из наиболее серьезных инфекционных осложнений, часто вызываемых оппортунистическими патогенами. Существует острая потребность в более совершенных методах лечения и профилактики пневмонии. Поэтому были разработаны модели на животных для лучшего понимания патогенеза заболевания, тестирования новых лекарственных средств и вакцин. В настоящем обзоре обобщены данные научных исследований бактериальной пневмонии, смоделированной на животных, а также основные возбудители заболевания, пути введения инфекционных агентов и оцениваемые показатели. Возбудителями бактериальной пневмонии являются различные микроорганизмы, в данном обзоре рассмотрены Streptococcus pneumoniae, Legionella pneumophila, Haemophilus influenzae, Neisseria meningitidis, Escherichia coli, Pseudomonas aeruginosa, Staphylococcus aureus, Acinetobacter baumannii, Klebsiella pneumoniae.
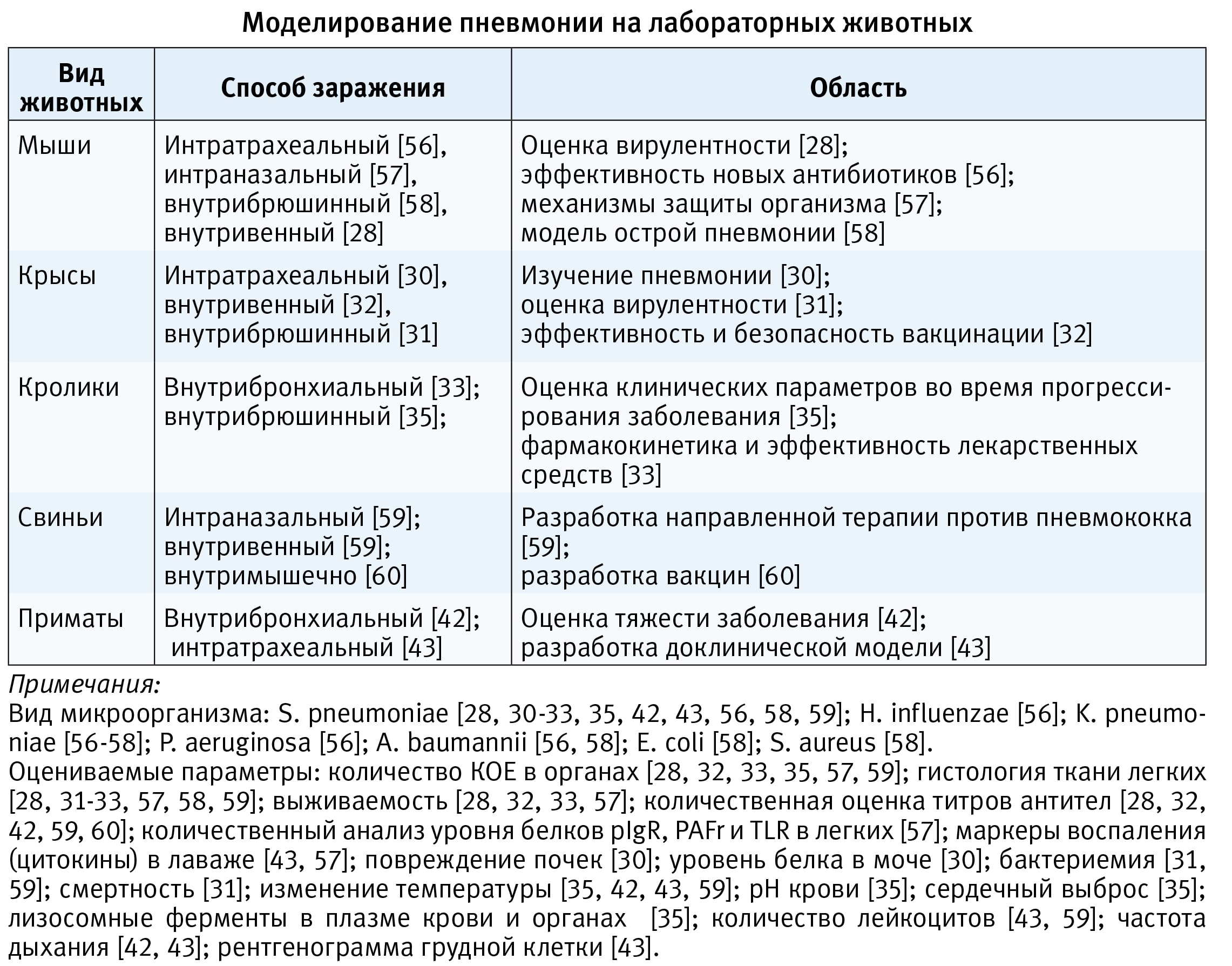
Самым популярным микроорганизмом, используемым для моделирования пневмонии, является Streptococcus pneumoniae. Согласно данным, приводимым в научных статьях, в качестве тест-системы для моделирования бактериальной пневмонии используют мышей, крыс, кроликов, свиней и приматов. Наиболее подходящими животными для исследования бактериальной пневмонии являются мыши. Данный вид животных прост в обращении, при этом можно использовать достаточное количество особей для оценки полученных результатов. Основными оцениваемыми параметрами исследования пневмонии являются результаты клинических проявлений, показатели выживаемости, бактериемии, количества бактерий в легких, патологические и гистологические характеристики, количественная оценка титров антител, маркеров воспаления и др. В зависимости от цели исследования используют разные способы введения инокулята. Для определения вирулентности применяют внутривенный и внутрибрюшинный способы введения, для изучения эффективности новых антибиотиков — интратрахеальный, при разработке новых вакцин от бактериальной пневмонии животным вводят инокулят внутримышечно. Выбор животных зависит от цели исследования, поставленных задач и вида микроорганизма, способа заражения и оцениваемых параметров.
Введение
Пневмония — это не отдельное заболевание, а группа специфических инфекций, каждая из которых имеет разную эпидемиологию, патогенез и клиническое течение [1].
В группе риска находятся дети и пожилые люди. Большинство людей, которые переболели пневмонией легких, подвержены осложнениям, связанным со снижением когнитивных функций, депрессиями, сердечно-сосудистым заболеваниям и уменьшением продолжительности жизни [2]. Несмотря на применение эффективных антибиотиков и интенсивной терапии, смертность, связанная с пневмонией, существенно не снизилась с 1960-х годов [3].
Во всем мире пневмония является основной причиной детской смертности, особенно среди детей в возрасте до 5 лет [4]. У детей бактериальная пневмония чаще всего вызывается такими микроорганизмами, как Streptococcus pneumoniae и Haemophilus influenzae типа b (Hib). На первом месте в числе возбудителей пневмонии стоит Streptococcus pneumoniae, тогда как вторым по значимости возбудителем является Haemophilus influenzae типа b (Hib) [5].
Повышенный риск у пожилых людей, вероятно, обусловлен нарушением защитных функций организма и имеющейся сопутствующей патологией (сердечная недостаточность, заболевания печени и основные заболевания легких), увеличивающими риск аспирационной пневмонии, которая может возникать из-за дисфагии и гастроэзофагеальной рефлюксной болезни [6].
Среди внутрибольничных заболеваний пневмония стоит на 1-м месте по числу смертей. Большому риску подвержены пациенты, находящиеся в отделении интенсивной терапии [7]. Основными возбудителями госпитальной пневмонии при искусственной вентиляции легких (ИВЛ) чаще всего являлись Pseudomonas aeruginosa, Staphylococcus aureus и Acinetobacter baumannii. Однако последние данные показывают, что бактерии семейства Enterobacteriaceae, в частности Escherichia coli, в настоящее время являются частыми возбудителями госпитальной пневмонии при ИВЛ [8].
На данный момент в мире стоит острая необходимость в более совершенных методах лечения и профилактики заболевания, требуются новые знания о патогенезе пневмонии. Фармакологические модели с использованием лабораторных животных необходимы для лучшего понимания механизмов, лежащих в основе появления устойчивых штаммов и расшифровки взаимодействия хозяина и патогена, особенно когда речь идет о полимикробной инвазии, при исследовании новых методов лечения и осложнений, которые вызывает пневмония.
Данный обзор посвящен описанию наиболее часто используемых моделей животных при изучении бактериальной пневмонии, обобщены данные научных исследований бактериальной пневмонии смоделированной на грызунах, кроликах, свиньях и приматах.
Бактериальные штаммы
Streptococcus pneumoniae — грамположительная бактерия — внеклеточный, условно-патогенный микроорганизм, который колонизирует поверхность слизистой оболочки человека. Около 27–65% детей и 10% взрослых являются носителями S. pneumoniae [9]. Бактерия приводит к развитию таких заболеваний, как пневмония, локальные инфекции среднего уха, гнойный менингит, и способна активно проникать в кровоток, вызывая бактериемию и сепсис [10].
Legionella pneumophila — грамотрицательная внутриклеточная бактерия — распространенный патоген, вызывающий больничные и внебольничные пневмонии. Это один из наиболее распространенных возбудителей тяжелой пневмонии, уровень смертности 10% в Европе и Северной Америке [11]. На данный момент сообщается только об одном случае передачи L. pneumophila от человека к человеку [12], подавляющее большинство случаев связано с заражением воздушно-капельным путем из-за загрязненной воды. Зараженная вода распределяется в виде водно-воздушного аэрозоля системами кондиционирования воздуха [13].
Haemophilus influenza представляет собой грамотрицательные коккобациллы, встречаются инкапсулированные и неинкапсулированные штаммы (нетипируемые H. influenzae, NTHi). NTHi является опасным патогеном, который вызывает у детей средний отит, синусит, конъюнктивит и пневмонию, у взрослых инфекцию дыхательных путей, главным образом у пациентов с хронической обструктивной болезнью легких [14]. Инкапсулированные штаммы разделяют на 6 серотипов (Hia-f). Серотип Hib является основным возбудителем бактериального менингита среди детей во всем мире [15].
Neisseria meningitidis — грамотрицательная бактерия, которая бессимптомно колонизирует носоглотку у 4–20% людей [16]. Основной путь передачи патогена воздушно-капельный от человека к человеку. Менингококки могут вызывать опасные для человека заболевания, такие как менингококковая септицемия, менингит или пневмония [17].
Escherichia coli — грамотрицательная, неспоровая, факультативно анаэробная бактерия семейства Enterobacteriaceae [18]. Несмотря на то что накоплено огромное количество данных о патогенности E. Coli, вызывающей кишечные, урологические заболевания, заболевания центральной нервной системы и кровотока, имеется мало данных об инфекциях в легких [19].
Pseudomonas aeruginosa — грамотрицательный облигатный аэроб. Является условно-патогенным микроорганизмом, который вызывает заболевания у людей с ослабленным иммунитетом. Наиболее часто становится возбудителем внутрибольничных инфекций. P. aeruginosa провоцирует заболевания различной этиологии, при этом часто поражаются дыхательная система и мочевыводящие пути [20].
Staphylococcus aureus — грамположительный условно-патогенный микроорганизм, вызывающий широкий спектр заболеваний. Примерно 30% людей во всем мире являются носителями S. aureus. Является частым возбудителем нозокомиальных инфекций [21].
Acinetobacter baumannii — грамотрицательная коккобацилла. Вызывает в основном внутрибольничные инфекции. A. baumannii является основным возбудителем внутригоспитальной пневмонии, связанной с ИВЛ [22].
Klebsiella pneumonia — грамотрицательная инкапсулированная неподвижная бактерия, которая обитает в окружающей среде, в том числе в почве и поверхностных водах [23]. K. pneumoniae может провоцировать серьезные инфекции у людей с ослабленным иммунитетом, такие как пневмония, бактериемия или менингит [24].
Модели пневмонии с использованием лабораторных животных
Модель пневмонии можно воспроизвести на разнообразных видах животных. Выбор вида животных зависит от задач, поставленных в исследовании. Самыми недорогими и с этической точки зрения наиболее привлекательными являются немлекопитающие животные (насекомые и рыбы). Использование таких моделей дает ограниченный результат, но может быть полезно для получения информации о врожденных иммунных реакциях организма и вирулентных свойствах патогенных микроорганизмов, вызывающих бактериальные инфекции легких [25].
Также можно встретить исследования на свиньях и собаках. Самой предпочтительной моделью в трансляционных исследованиях легких являются некрупные животные (например, грызуны). Такие модели идеально соответствуют принципам 3R, небольшой размер и высокая скорость размножения делают их наиболее практичными и доступными для лабораторных исследований [26].
Модели на мышах
Модели на мышах часто используют при изучении пневмококковой пневмонии. Поскольку основные исследования проводятся на мышах, то имеется огромное количество научных работ, связанных с изучением организма мыши и иммунитета в целом. Наиболее часто используют мышей для оценки эффективности антибиотиков, фармакокинетики, патогенеза заболевания, факторов вирулентности и тестирование вакцин [27].
Модели пневмонии на мышах позволяют анализировать различные параметры, включая выживаемость животных после заражения, присутствие бактерий в легких и крови, уровни воспаления и гистологию ткани легких. Кроме того, используются при количественной оценке титров антител и противомикробных препаратов, в фармакокинетических исследованиях вакцин и лекарственных препаратов [28]. При исследовании пневмонии мышей содержат в индивидуально-вентилируемой системе для защиты персонала и окружающей среды от инфекционных агентов [29].
Как у людей, так и у мышей пневмококковая инфекция является результатом сложного взаимодействия бактериальных факторов и факторов хозяина, что сильно влияет на тяжесть и локализацию заболевания. Различные линии мышей по-разному реагируют на пневмококковую нагрузку с точки зрения сроков, тяжести и исхода заболевания, и это не всегда может быть транслировано на человека.
Модели на крысах
Модели на крысах используются редко по сравнению с мышами для моделирования бактериальных инфекций легких. Более крупные размеры органов сравнительно с мышами позволяют собрать больше биологического материала, однако экспериментальные группы обычно меньше, из-за чего может быть значительная погрешность в статистических результатах. Индукция легочной пневмонии осуществляется при введении инфекционного агента внутривенным, внутрибронхиальным или внутрилегочным путем. Дизайн исследований обычно основан на изучении выживаемости животных, наблюдении за общей клинической картиной, гистологическом исследовании легких, определении количества бактерий в легких и крови. Крысы в основном используются в исследованиях для изучения особенностей течения пневмонии, возникающей у пациентов с сопутствующими заболеваниями [30]. Также можно встретить научные труды, где модели экспериментальной пневмонии на крысах используются для исследования вирулентности различных пневмококковых серотипов [31] и оценки эффективности и безопасности антипневмококковой вакцинации [32].
Модели на кроликах
Модели пневмококковой пневмонии на кроликах подходят для изучения патогенеза, выживаемости, прогрессирования заболевания, а также фармакокинетических и фармакодинамических характеристик новых терапевтических и иммунизационных средств [33]. Кролики также обычно полезны для оценки различных пневмококковых серотипов и резистентных фенотипов у штаммов [34]. Модели на кроликах также подходят для изучения сепсиса. Введенные внутрибрюшинно пневмококки позволяют исследователям оценивать клинические параметры во время прогрессирования заболевания [35].
Модели на свиньях
Свиньи имеют сходство с людьми с точки зрения анатомии, генетики и физиологии. Животные всеядны и имеют адаптивную и врожденную иммунную систему, которая на 80% близка к человеческой [36]. В сравнении с грызунами и более мелкими животными модели на свиньях из-за своих размеров и схожей анатомии с человеком используют для проведения различных хирургических и нехирургических процедур [37]. Эксперименты на свиньях имеют большую прогностическую и терапевтическую ценность, чем исследования, проведенные на грызунах [38]. Для оценки пневмонии, связанной с ИВЛ, больше всего подходят модели на свиньях, так как животные должны находиться в положении лежа (для предотвращения ателектаза) [39].
Модели на приматах
Наиболее привлекательной моделью являются приматы, иммунитет и физиология которых сходны с человеческим и они, как правило, подвержены воздействию человеческих патогенов. Однако использование приматов в исследованиях вызывает серьезные этические проблемы [40]. Приматы не являются естественными носителями пневмококков, в исследованиях отсутствуют данные выделения пневмококков из носоглотки у приматов. Однако есть сведения об экспериментальном заражении приматов человеческим штаммом S. pneumoniae, в результате около 100% животных имели признаки колонизации через 2 нед и около 60% животных — через 7 нед после заражения, эти данные свидетельствуют о том, что приматы отличная человекоподобная модель для изучения носительства [41]. У приматов, зараженных S. Pneumoniae, развиваются аналогичные симптомы, которые наблюдаются у людей с инфекцией нижних дыхательных путей, характеризующейся лихорадкой, бактериемией, кашлем и затрудненным дыханием [42]. Приматы подходят для исследований, связанных с изучением патогенеза. Исследования легочных инфекций на бабуинах подтвердили, что возрастающие дозы пневмококковой инокуляции (серотип 19A-7) вызывают реакцию хозяина в диапазоне от легкого течения заболевания (106 КОЕ) до тяжелой пневмонии (109 КОЕ). Уровень цитокинов в бронхоальвеолярном лаваже подтвердил тяжелую пневмонию [43]. Другая группа исследователей показала, что у павиана, зараженного S. pneumoniae (серотип 4) 109 КОЕ, через 4 дня после заражения возникли симптомы бактериальной пневмонии. Клинические результаты были аналогичны тем, которые развивались у людей, и включали кашель, тахипноэ, одышку, тахикардию и лихорадку. У всех животных развились лейкоцитоз и бактериемия через 24 ч после заражения. Тяжелая воспалительная реакция после заражения нашла свое отражение в повышении уровня сывороточных цитокинов, включая интерлейкины (IL) 1Ra, IL-6 и IL-8. УЗИ легких выявило пораженные пневмонией доли легких, что было подтверждено при патоморфологическом исследовании. Выраженность патологии легких имела высокую степень корреляции с тяжестью заболевания [44].
Типы моделей пневмонии
«Один удар» — модель острой пневмонии
Эта модель пневмонии считается простой из-за метода введения бактериального инокулята в легкие. Интратрахеальная инстилляция является наиболее часто используемым методом исследования пневмонии и включает введение бактериальной суспензии непосредственно в трахею или легкие [45]. Данный метод предоставляет наиболее точный контроль над установленной дозой. Однако в этом методе приходится прибегать к хирургическому вскрытию трахеи, что влечет за собой последующее зашивание разреза, провоцирующее воспалительную реакцию в органе, что может оказать существенное влияние на конечный результат. С другой стороны, эндотрахеальное введение бактерий требует интубирования животного для облегчения закапывания бактериального раствора в легкие и является таким же точным методом, как и метод интратрахеальной инстилляции [46]. Менее инвазивными методами считают интраназальное введение, при котором установленная бактериальная доза вводится каплями в ноздри животным [47], или аэрозольное введение, которое применяют для агрессивных животных [48]. Тем не менее точная доза, достигающая нижних дыхательных путей в обоих методах, не может быть просчитана, и у животных часто развиваются инфекции верхних дыхательных путей [47] или другие инфекции, помимо пневмонии [48]. При аэрозольном методе для контроля установленной дозы требуется немедленно после аэрозолизации подвергнуть несколько животных эвтаназии для количественного подсчета бактерий [48].
Искусственная вентиляция легких как модель пневмонии
ИВЛ является важным компонентом в патогенезе пневмонии. Как было показано, при ИВЛ развивается стерильная воспалительная реакция в легких, при которой возникают различные повреждения тканей, такие как чрезмерное растяжение легких, баротравма и травма избыточным объемом, утечка воздуха из-за нарушения стенки воздушного пространства, отек легких и ателектаз (повторное открытие и закрытие альвеол) [49].
Для создания моделей ИВЛ на животных были использованы два основных способа. В первом способе бактериальная суспензия вводится в легкие до проведения ИВЛ [50], во втором бактериальную суспензию вводят после вентиляции, что имитирует более естественную эволюцию заболевания [51]. Однако при применении второго способа результаты показывают повышенную бактериальную нагрузку на легкие, более тяжелое течение заболевания и высокую смертность по сравнению с первым способом [51].
Показано, что экспериментально индуцированный стеноз трахеи наряду с длительной механической вентиляцией легких (до 4 дней) вызывает спонтанное развитие пневмонии с эндогенной микробиотой у поросят, также в данном исследовании обнаружены оппортунистические возбудители пневмонии человека, такие виды как Pseudomonas и Klebsiella [39].
Агаровая (хроническая) модель пневмонии
Данная модель первоначально была разработана на крысах и используется в области изучения муковисцидоза [52]. Для формирования биопленки в качестве внеклеточных полимерных веществ применяются гранулы альгината агара или водорослей, в которые загружаются бактерии, смешиваются с минеральным маслом и эмульгатором сорбитан-моноолеата для повышения однородности гранул. Для контрольных групп животных готовят стерильные шарики с использованием фосфатно-солевого буферного или физиологического раствора, однако стерильные шарики могут сами по себе вызвать воспалительный ответ, приводящий к увеличению клеточных инфильтратов в легких и повышенному выделению цитокинов, что может существенно повлиять на результаты исследования [53].
Интересно, что хотя бактерии могут мигрировать из агарозных шариков in vivo, бактериальный рост происходит медленно и ограничивается шариками, аналогично процессу, который наблюдается у бактерий, существующих в биопленках [54]. Кроме того, нарушается клиренс бактерий, и у животных реже развивается острый сепсис. Агаровая модель способна лучше моделировать хроническую инфекцию легких, наблюдаемую у человека, в отношении гистопатологических особенностей, повышения уровня нейтрофилов в легких и накопления цитокинов в жидкости [55].
Заключения и выводы
Наиболее часто исследователи моделируют пневмонию на мышах. Основные оцениваемые параметры исследований: сбор данных о патогенезе, выживаемости, определение количества бактерий в легких и крови, патологических и гистологических характеристик, количественная оценка титров антител. Также на мышах исследуется вирулентность бактериальных штаммов, изучаются эффективность новых антибиотиков и механизмы защиты организма. Способы введения инокулята зависят от задач, поставленных в исследовании, так, для оценки вирулентности используют внутривенный способ введения. При изучении эффективности новых антибиотиков бактериальный инокулят вводят интратрахеально. Крысы в основном используются в исследованиях для изучения особенностей течения пневмонии, вирулентности различных пневмококковых серотипов и оценки эффективности и безопасности антипневмококковой вакцинации. Модель бактериальной пневмонии на кроликах подходит для определения клинических параметров во время прогрессирования заболевания и эффективности лекарственных средств, при этом используют внутрибронхиальный и внутрибрюшинный пути введения инокулята. Эксперименты на свиньях имеют большую прогностическую и терапевтическую ценность, поэтому модели на свиньях используют при разработке терапии, направленной для лечения пневмококковой пневмонии, и вакцин. Модели на приматах подходят для исследований, связанных с оценкой тяжести заболевания. Все вышесказанное мы попытались систематизировать в таблице, которая может позволить исследователю сориентироваться во множестве моделей и выбрать дизайн исследования, соответствующий поставленным задачам.
Пневмококковая инфекция у людей разнообразна и многогранна, и ни одна экспериментальная модель на животных не способна полностью имитировать болезнь человека. Тем не менее, несмотря на ограничения, эксперименты на животных остаются, несомненно, ценным инструментом для выяснения патогенетических механизмов заболевания. Этот обзор дает представление о разработке и применении различных моделей на животных, используемых для имитации и изучения пневмонии. Все модели на животных являются полезными инструментами для выяснения аспектов патогенеза заболевания и тестирования эффективности антибиотиков и других методов лечения. Основные методы заражения описаны в этом обзоре. Использование мышей как моделей удобно с экономической точки зрения, они просты в обращении, что позволяет проводить скрининг лекарств и вакцин с высокой статистической мощностью. Более крупные животные обладают преимуществом в виде повышенной легкости выполнения хирургических процедур, но они являются более дорогостоящими, а полученные результаты могут не иметь статистической значимости из-за использования более маленьких групп.
Развитие пневмококкового заболевания зависит как от бактериальных факторов (например, капсульный серотип и другие детерминанты вирулентности), так и от факторов хозяина (например, генетический фон, иммунный ответ, возраст, пол). Прежде чем приступить к изучению пневмококковой инфекции in vivo, следует тщательно продумать выбор не только животных, но и бактериальных штаммов.
Благодарности
Работа выполнена без спонсорской поддержки.
Вклад авторов
Л.Р. Хайбунасова – сбор данных литературных источников, сбор и анализ данных, написание и редактирование текста статьи
М.Н. Макарова – концепция и дизайн исследования, редактирование текста статьи, научное консультирование и утверждение окончательного варианта статьи для публикации
К.Е. Боровкова – редактирование текста статьи, научное консультирование
Ю.В.Салмова – оформление текста статьи
Сведения о конфликте интересов
Авторы заявляют об отсутствии конфликта интересов.
Список источников
- Levison ME. Pneumonia, Including Necrotizing Pulmonary Infections (Lung Abscess) In: Braunwald E, Fauci AS, Hauser SL, Longo DL, Kasper DL, Jameson JL, editors. Harrison’s principles of internal medicine. 15. New York: McGraw-Hill; 2001. pp. 1475–1484.
- Quinton LJ, Walkey AJ, Mizgerd JP. Integrative Physiology of Pneumonia. Physiol Rev. 2018 Jul 1;98(3):1417-1464. doi: 10.1152/physrev.00032.2017. PMID: 29767563; PMCID: PMC6088146.
- Cilloniz C, Liapikou A, Martin-Loeches I, et al. Twenty-year trend in mortality among hospitalized patients with pneumococcal community-acquired pneumonia. PLoS One 2018; 13: e0200504. doi:10.1371/journal.pone.0200504.
- McCollum ED, King C, Hollowell R, Zhou J, Colbourn T, Nambiar B, Mukanga D, Burgess DCH. Predictors of treatment failure for non-severe childhood pneumonia in developing countries—systematic literature review and expert survey—the first step towards a community focused mHealth risk-assessment tool? BMC Pediatr. 2015;15:547. doi: 10.1186/s12887-015-0392-x.
- Walker CLF, Rudan I, Liu L, Nair H, Theodoratou E, Bhutta ZA, O’Brien KL, Campbell H, Black RE. Global burden of childhood pneumonia and diarrhoea. Lancet (London, England) 2013;381:1405–1416. doi: 10.1016/S0140-6736(13)60222-6
- Akgün KM, Crothers K, Pisani M. Epidemiology and management of common pulmonary diseases in older persons. J Gerontol a Biol Sci Med Sci 2012;67:276–91.
- Chastre J, Fagon JY. Pneumonia in the ventilator-dependent patient. In: Tobin MJ, editor. Principles and practice of mechanical ventilation. New York: McGraw-Hill; 1994. p. 857–890.
- Kollef MH, Ricard J-D, Roux D, Francois B, Ischaki E, Rozgonyi Z, et al. A randomized trial of the amikacin fosfomycin inhalation system for the adjunctive therapy of gram-negative ventilator-associated pneumonia: IASIS Trial. Chest. 2017;151:1239–46. 10.1016/j.chest.2016.11.026
- Yahiaoui RY, et al. Prevalence and antibiotic resistance of commensal Streptococcus pneumoniae in nine European countries. Future Microbiol. 2016;11:737–744.
- Mitchell TJ. 2003. The pathogenesis of streptococcal infections: from tooth decay to meningitis. Nat Rev Microbiol 1:219–230. doi:10.1038/nrmicro771] Weiser JN, Ferreira DM, Paton JC. 2018. Streptococcus pneumoniae: transmission, colonization and invasion. Nat Rev Microbiol 16:355–367. doi:10.1038/s41579-018-0001-8.
- Stout JE, Yu VL. Legionellosis. New Eng J Med. 1997;337:682–687. doi: 10.1056/NEJM199709043371006
- Correia A. M., Ferreira J. S., Borges V., Nunes A., Gomes B., Capucho R., et al. (2016). Probable Person-to-Person Transmission of Legionnaires’. Dis. N. Engl. J. Med. 374 497–498. 10.1056/NEJMc1505356
- van Heijnsbergen E., Schalk J. A., Euser S. M., Brandsema P. S., den Boer J. W., de Roda Husman A. M. (2015). Confirmed and potential sources of Legionella reviewed. Environ. Sci. Technol. 49 4797–4815. 10.1021/acs.est.5b00142
- Murphy TF, Faden H, Bakaletz LO, et al. Nontypeable Haemophilus influenzae as a pathogen in children. Pediatr Infect Dis J. 2009;28:43–48. doi: 10.1097/INF.0b013e318184dba2
- Peltola H. Worldwide Haemophilus influenzae type b disease at the beginning of the 21st century: global analysis of the disease burden 25 years after the use of the polysaccharide vaccine and a decade after the advent of conjugates. Clin Microbiol Rev. 2000;13:302–317. doi: 10.1128/CMR.13.2.302
- Christensen H., May M., Bowen L., Hickman M., & Trotter C. L. (2010). Meningococcal carriage by age: a systematic review and meta‐analysis. The Lancet Infectious Diseases, 10, 853–861. 10.1016/S1473-3099(10)70251-6
- Nassif X. Interaction mechanisms of encapsulated meningococci with eukaryotic cells: what does this tell us about the crossing of the blood-brain barrier by Neisseria meningitidis? Curr Opin Microbiol. 1999;2:71–77. doi: 10.1016/S1369-5274(99)80012-5
- Rojas-Lopez M, Monterio R, Pizza M, Desvaux M, Rosini R. Intestinal pathogenic Escherichia coli: insights for vaccine development. Front Microbiol. 2018; 9: 1–17
- Croxen MA, Finlay BB (2010) Molecular mechanisms of Escherichia coli pathogenicity. Nat Rev Microbiol 8:26–38
- Tacconelli E., Carrara E., Savoldi A., Harbarth S., Mendelson M., Monnet D. L., et al. . (2017). Discovery, research, and development of new antibiotics: the WHO priority list of antibiotic-resistant bacteria and tuberculosis. Lancet Infect. Dis. 18, 318–327. 10.1016/S1473-3099(17)30753-3
- Wertheim HF, Melles DC, Vos MC, van Leeuwen W, van Belkum A, Verbrugh HA, Nouwen JL. 2005. The role of nasal carriage in Staphylococcus aureus infections. Lancet Infect Dis 5:751–762. doi:10.1016/S1473-3099(05)70295-4.
- Demirdal T, Sari US, Nemli SA. Is inhaled colistin beneficial in ventilator associated pneumonia or nosocomial pneumonia caused by Acinetobacter baumannii? Ann Clin Microbiol Antimicrob. 2016;15(1):1–6.
- Bagley ST. 1985. Habitat association of Klebsiella species. Infect Control 6:52–58.
- Tsay RW, Siu LK, Fung CP, Chang FY. 2002. Characteristics of bacteremia between community-acquired and nosocomial Klebsiella pneumoniae infection: risk factor for mortality and the impact of capsular serotypes as a herald for community-acquired infection. Arch Intern Med 162:1021–1027. doi:10.1001/archinte.162.9.1021.
- Kurz C.L, Ewbank J.J. Caenorhabditis elegans: an emerging genetic model for the study of innate immunity. Nat Rev Genet 2003;4:380–390. doi:10.1038/nrg1067
- Russell WMS, Burch RL. The principles of humane experimental technique. Michigan: Methuen; 1959.
- Austrian, R. 1986. Pneumococcal pneumonia. Diagnostic, epidemiologic, therapeutic and prophylactic considerations. Chest90:738-743
- Ren, B., A. Szalai, S. K. Hollingshead, and D. E. Briles. 2003. Both family 1 and family 2 PspA proteins can inhibit complement deposition and confer virulence to a capsular serotype 3 strain of Streptococcus pneumoniae. Infect. Immun.71:75-85.
- Боровкова К.Е., Крышень А.А., Крышень К.Л., Петрова А.В., Макарова М.Н. Особенности работы с лабораторными животными в условиях микробиологической лаборатории. Лабораторные животные для научных исследований. 2019; 1. https://doi.org/10.29296/2618723X-2019-01-09
- Kuikka, A., J. Syrjanen, O. V. Renkonen, and V. V. Valtonen. 1992. Pneumococcal bacteraemia during a recent decade. J. Infect. 24:157-168
- Saladino R.A., Stack A.M., Fleisher G.R., Thompson C.M., Briles D.E., Kobzik l Siber G.R. Development of a model of low-inoculum Streptococcus pneumoniae intrapulmonary infection in infant rats. Infect. Immun. 1997;65:4701–4704.
- Iinuma H., Okinaga K. Prevention of pneumococcal bacteremia by immunization with type 6 pneumococcal capsular polysaccharide vaccine in splenectomized rats. J. Infect. Dis. 1989;160:66–75. doi: 10.1093/infdis/160.1.66.
- Piroth, L., L. Martin, A. Coulon, C. Lequeu, M. Duong, M. Buisson, H. Portier, and P. Chavanet. 1999. Development of a new experimental model of penicillin-resistant Streptococcus pneumoniae pneumonia and amoxicillin treatment by reproducing human pharmacokinetics. Antimicrob. Agents Chemother. 43:2484-2492.
- Kalin M. Pneumococcal serotypes and their clinical relevance. Thorax. 1998;53:159–162. doi: 10.1136/thx.53.3.159
- Guckian J.C., Morrey B.F., Kirby H.B. Role of lysosomes and cathepsin inhibitor in plasma during pneumococcal infection. J. Infect. Dis. 1970;122:290–302. doi: 10.1093/infdis/122.4.290.
- Groenen MA, Archibald AL, Uenishi H, Tuggle CK, Takeuchi Y, Rothschild MF, Rogel-Gaillard C, Park C, Milan D, Megens HJ, Li S, Larkin DM, Kim H, Frantz LA, Caccamo M, Ahn H, Aken BL, Anselmo A, Anthon C, Auvil L, Badaoui B, Beattie CW, Bendixen C, Berman D, Blecha F, Blomberg J, Bolund L, Bosse M, Botti S, Bujie Z, Bystrom M, Capitanu B, Carvalho-Silva D, Chardon P, Chen C, Cheng R, Choi SH, Chow W, Clark RC, Clee C, Crooijmans RP, Dawson HD, Dehais P, De Sapio F, Dibbits B, Drou N, Du ZQ, Eversole K, Fadista J, Fairley S, Faraut T, Faulkner GJ, Fowler KE, Fredholm M, Fritz E, Gilbert JG, Giuffra E, Gorodkin J, Griffin DK, Harrow JL, Hayward A, Howe K, Hu ZL, Humphray SJ, Hunt T, Hornshoj H, Jeon JT, Jern P, Jones M, Jurka J, Kanamori H, Kapetanovic R, Kim J, Kim JH, Kim KW, Kim TH, Larson G, Lee K, Lee KT, Leggett R, Lewin HA, Li Y, Liu W, Loveland JE, Lu Y, Lunney JK, Ma J, Madsen O, Mann K, Matthews L, McLaren S, Morozumi T, Murtaugh MP, Narayan J, Nguyen DT, Ni P, Oh SJ, Onteru S, Panitz F, Park EW, Park HS, Pascal G, Paudel Y, Perez-Enciso M, Ramirez-Gonzalez R, Reecy JM, Rodriguez-Zas S, Rohrer GA, Rund L, Sang Y, Schachtschneider K, Schraiber JG, Schwartz J, Scobie L, Scott C, Searle S, Servin B, Southey BR, Sperber G, Stadler P, Sweedler JV, Tafer H, Thomsen B, Wali R, Wang J, Wang J, White S, Xu X, Yerle M, Zhang G, Zhang J, Zhang J, Zhao S, Rogers J, Churcher C, Schook LB. 2012. Analyses of pig genomes provide insight into porcine demography and evolution. Nature 491:393–398. doi:10.1038/nature11622.
- Summerfield A. Special issue on porcine immunology: An introduction from the guest editor. Dev. Comp. Immunol. 2009;33:265–266. doi: 10.1016/j.dci.2008.07.014.
- Aigner B, Renner S, Kessler B, Klymiuk N, Kurome M, Wunsch A, Wolf E. 2010. Transgenic pigs as models for translational biomedical research. J Mol Med (Berl) 88:653–664. doi:10.1007/s00109-010-0610-9.
- Marquette CH, Wermert D, Wallet F, et al. Characterization of an animal model of ventilator-acquired pneumonia. Chest 1999;115:200-9. 10.1378/chest.115.1.200
- Bennett RS, Huzella LM, Jahrling PB, et al. Nonhuman primate models of ebola virus disease. Curr Top Microbiol Immunol 2017; 411: 171–193.
- Philipp M.T., Doyle L.A., Martin D.S., Plauché G.B., Phillippi-Falkenstein K.M., Bohm R.P., Jr. A rhesus macaque model of Streptococcus pneumoniae carriage. J. Med. Primatol. 2012;41:60–66. doi: 10.1111/j.1600-0684.2011.00512.x
- Berendt R.F., Long G.G., Walker J.S. Influenza alone and in sequence with pneumonia due to Streptococcus pneumoniae in the squirrel monkey. J. Infect. Dis. 1975;132:689–693. doi: 10.1093/infdis/132.6.689.
- Kraft B.D., Piantadosi C.A., Benjamin A.M., Lucas J.E., Zaas A.K., Betancourt-Quiroz M., Woods C.W., Chang A.L., Roggli V.L., Marshall C.D., et al. Development of a novel preclinical model of pneumococcal pneumonia in nonhuman primates. Am. J. Respir. Cell Mol. Biol. 2014;50:995–1004. doi: 10.1165/rcmb.2013-0340OC.
- Reyes L.F., Restrepo M.I., Hinojosa C.A., Soni N.J., Shenoy A.T., Gilley R.P., Gonzalez-Juarbe N., Noda J.R., Winter V.T., de la Garza M.A., et al. A Non-Human Primate Model of Severe Pneumococcal Pneumonia. PLoS ONE. 2016;11:e0166092. doi: 10.1371/journal.pone.0166092
- McConnell KW, McDunn JE, Clark AT, et al. Streptococcus pneumoniae and Pseudomonas aeruginosa pneumonia induce distinct host responses. Crit Care Med 2010;38:223-41. 10.1097/CCM.0b013e3181b4a76b
- Rello J, Afessa B, Anzueto A, et al. Activity of a silver-coated endotracheal tube in preclinical models of ventilator-associated pneumonia and a study after extubation. Crit Care Med 2010;38:1135-40. 10.1097/CCM.0b013e3181cd12b8
- Miller MA, Stabenow JM, Parvathareddy J, et al. Visualization of murine intranasal dosing efficiency using luminescent Francisella tularensis: effect of instillation volume and form of anesthesia. PLoS One 2012;7:e31359. 10.1371/journal.pone.0031359
- Mizgerd JP, Skerrett SJ. Animal models of human pneumonia. Am J Physiol Lung Cell Mol Physiol 2008;294:L387-98. 10.1152/ajplung.00330.200753
- Cabrera-Benitez NE, Laffey JG, Parotto M, et al. Mechanical ventilation-associated lung fibrosis in acute respiratory distress syndrome: a significant contributor to poor outcome. Anesthesiology 2014;121:189-98. 10.1097/ALN.0000000000000264
- Nahum A, Hoyt J, Schmitz L, et al. Effect of mechanical ventilation strategy on dissemination of intratracheally instilled Escherichia coli in dogs. Crit Care Med 1997;25:1733-43. 10.1097/00003246-199710000-00026
- Lin CY, Zhang H, Cheng KC, et al. Mechanical ventilation may increase susceptibility to the development of bacteremia. Crit Care Med 2003;31:1429-34. 10.1097/01.CCM.0000063449.58029.81
- Cash HA, Woods DE, McCullough B, et al. A rat model of chronic respiratory infection with Pseudomonas aeruginosa. Am Rev Respir Dis 1979;119:453-9
- Growcott EJ, Coulthard A, Amison R, et al. Characterisation of a refined rat model of respiratory infection with Pseudomonas aeruginosa and the effect of ciprofloxacin. J Cyst Fibros. 2011;10(3):166‐174. doi:10.1016/j.jcf.2010.12.007
- Hodgson AE, Nelson SM, Brown MR, et al. A simple in vitro model for growth control of bacterial biofilms. J Appl Bacteriol 1995;79:87-93. 10.1111/j.1365-2672.1995.tb03128.
- van Heeckeren AM, Schluchter MD. Murine models of chronic Pseudomonas aeruginosa lung infection. Lab Anim 2002;36:291-312. 10.1258/002367702320162405
- Lewandowski T.F., Mininger C.L., Singley C.M., Sucoloski S., Rittenhouse S.A. Robust Pneumonia Model in Immunocompetent Rodents to Evaluate Antibacterial Efficacy against S. pneumoniae, H. influenzae, K. pneumoniae, P. aeruginosa or A. Baumannii. J. Vis. Exp. 2017;119:e55068
- Hinojosa E., Boyd A.R., Orihuela C.J. Age-associated inflammation and toll-like receptor dysfunction prime the lungs for pneumococcal pneumonia. J. Infect. Dis. 2009;200:546–554. doi: 10.1086/600870.
- Dietert K, Gutbier B, Wienhold SM, Reppe K, Jiang X, Yao L, Chaput C, Naujoks J, Brack M, Kupke A, Peteranderl C, Becker S, von Lachner C, Baal N, Slevogt H, Hocke AC, Witzenrath M, Opitz B, Herold S, Hackstein H, Sander LE, Suttorp N, Gruber AD. Spectrum of pathogen- and model-specific histopathologies in mouse models of acute pneumonia. PLoS One. 2017 Nov 20;12(11):e0188251. doi: 10.1371/journal.pone.0188251. PMID: 29155867; PMCID: PMC5695780.
- De Greeff A., Van Selm S., Buys H., Harders-Westerveen J.F., Tunjungputri R.N., De Mast Q., Van der Ven A.J., Stockhofe-Zurwieden N., De Jonge M.I., Smith H.E. Pneumococcal colonization and invasive disease studied in a porcine model. BMC Microbiol. 2016;16:102. doi: 10.1186/s12866-016-0718-3.
- Meurens F., Summerfield A., Nauwynck H., Saif L., Gerdts V. The pig: A model for human infectious diseases. Trends Microbiol. 2012;20:1. doi: 10.1016/j.tim.2011.11.002.



