Основные подходы к обеспечению качества биологических тест-систем в исследованиях GLP-статуса
Зайцева М.А., Потапенко Е.Г., Кашина Т.В., Верведа А.Б. Основные подходы к обеспечению качества биологических тест-систем в исследованиях GLP-статуса. Лабораторные животные для научных исследований. 2020; 2. https://doi.org/10.29296/2618723X-2020-02-03
Резюме
В основополагающем документе по надлежащей лабораторной практике (GLP) – OECD Guide 1:1998 OECD Principles of good laboratory practice (Принципы надлежащей лабораторной практики) указывается, что тест-системы подразделяются на физические, химические и биологические, которые могут представлять собой животных, а также растения, бактерии, изолированные органы, клетки/клеточные структуры.
В настоящей статье описывается, как содержатся «биологические тест-системы» — лабораторные животные. Условия содержания лабораторных животных и процессы контроля за состоянием их здоровья должны не только удовлетворять научным соображениям в отношении исследования, но и учитывать международное и национальное законодательство по содержанию и защите животных, в частности соответствовать на территории Российской Федерации Постановлению главного государственного санитарного врача РФ от 29.08.14 №51 об утверждении СП 2.2.1.3218-14 «Санитарно-эпидемиологические требования к устройству, оборудованию и содержанию экспериментально-биологических клиник (вивариев)». При этом должны быть получены доказательства соответствия биологических тест-систем определенным требованиям — стандартам качества как самих лабораторных животных, так и условий содержания при проведении доклинических исследований.
Для определения показателей качества лабораторных животных оценивается клинический и микробиологический статус. В части условий окружающей среды фиксируются температура, влажность, освещенность, шум, кратность воздухообмена, газовый состав воздуха. Для снижения уровня микробной обсемененности и создания условий, предотвращающих распространение инфекционных заболеваний, необходимо регулярное проведение санитарной обработки помещений зоны содержания тест-систем, а также мероприятий по дезинфекции, дезинсекции и дератизации. Корм, подстил и вода подлежат обязательному контролю качества по составу и микробиологической чистоте в процессе использования. Для поддержания статуса здоровья и гарантии благополучия экспериментальных животных в испытательном центре доклинических исследований необходимы комплексная программа, включающая контроль лабораторных животных, среды обитания, помещений, вспомогательных материалов, а также план действий в случае выявления заболевания или неблагополучия.
Введение
В основополагающем документе по надлежащей лабораторной практике (GLP) – OECD Guide 1:1998 OECD Principles of good laboratory practice (Принципы надлежащей лабораторной практики) указывается, что тест-системы подразделяются на физические, химические и биологические, которые могут представлять собой животных, а также растения, бактерии, изолированные органы, клетки/клеточные структуры. Корректный выбор и этичное использование тест-систем, обеспечение прозрачности документации эксперимента при наличии системы контроля качества исследования, а также соответствие биологической модели целям и задачам эксперимента составляют три основополагающих элемента, призванных обеспечить высокий уровень экспериментального исследования [1].
Однако на достижение цели качественного проведения доклинического исследования могут влиять различные категории угроз. К основным возможным источникам риска при проведении доклинических исследований можно отнести персонал, тест-системы, испытуемые объекты, помещения, условия окружающей среды, оборудование и средства измерений, методы и процедуры исследований, документирование, внешние заинтересованные стороны. Тест-системы, с одной стороны, могут стать одной из угроз для получения достоверных и надежных результатов исследований, с другой – могут быть в той или иной степени подвержены влиянию других источников риска, что требует комплексного подхода к вопросам гарантии качества.
Решению большинства представленных проблем способствует внедрение и эффективное функционирование систем менеджмента качества и управления рисками, которые являются основой для достижения и поддержания высокого уровня качества доклинических исследований лекарственных препаратов [2]. Обеспечение качества лабораторных животных и условий их содержания являются одними из ключевых задач существующих систем управления в организации, проводящей доклинические исследования.
В соответствии с требованиями проведения доклинических исследований Good Laboratory Practice, GLP, а также Постановлением главного государственного санитарного врача РФ от 29.08.14 №51 об утверждении СП 2.2.1.3218-14 «Санитарно-эпидемиологические требования к устройству, оборудованию и содержанию экспериментально-биологических клиник (вивариев)» все лабораторные животные, используемые для экспериментальных работ, должны быть полностью здоровы перед началом эксперимента [3]. Международные правила предусматривают необходимость разработки в учреждении специальной программы, обеспечивающей поддержание статуса здоровья и гарантирующей благополучие экспериментальных животных.
Такая программа должна включать:
- контроль лабораторных животных (клинический статус, микробиологический статус);
- контроль среды обитания (температура, влажность, освещенность, шум, кратность воздухообмена, газовый состав воздуха);
- контроль помещений (санитарное состояние, в том числе дезинфекция, дезинсекция и дератизация);
- контроль вспомогательных материалов (корм, вода, подстил);
- план действия в случае выявления заболевания или неблагополучия.
Контроль животных
Клинический контроль животных. Животные должны поступать из специализированного питомника на специально оборудованном транспорте, где поддерживается соответствующая оптимальная температура, в сопровождении ветеринарной документации с предоставлением информации о здоровье и проведенных профилактических/диагностических мероприятиях.
Для животных, полученных из специализированных питомников, устанавливается следующий срок карантина: для мышей и крыс 14 сут, для морских свинок и кроликов 21 сут. Срок карантина может быть продлен по согласованию с заказчиком доклинического исследования.
Животных рассаживают в клетки в соответствии с нормативами плотности посадки. Клетки с животными размещают по комнатам только после тщательного ветеринарного осмотра и люминесцентного просвечивания волосяного покрова для диагностики микроспории. Все полученные данные заносятся в соответствующие журналы за подписью ветеринарного врача.
Оптимальным является обслуживание одним работником животных одного вида. В случае невозможности подобного прикрепления необходимо соблюдать следующую последовательность при работе: морские свинки, мыши, крысы, кролики. Такая последовательность обслуживания обусловлена чувствительностью лабораторных животных к появлению возможной инфекции.
Во время карантина животные подвергаются ежедневному клиническому осмотру со стороны ветеринарной службы, при необходимости проводятся термометрия и диагностические исследованиям. Все данные о состоянии здоровья животных заносятся в специальные ветеринарные журналы «Клинический осмотр животных во время карантина» и «Журнал регистрации отбора проб и результатов диагностических исследований».
Дальнейшее распределение животных происходит по окончании карантина или адаптации и только при наличии отметки о клиническом здоровье животного.
Для идентификации групп мелких животных (крысы, мыши, морские свинки) используют этикетки, в которых указывается основная информация в соответствии с действующими процедурами: например, вид, пол, масса или возраст животных, дата начала и дата окончания эксперимента, название эксперимента, ФИО и подпись экспериментатора. Помимо этого, мелких животных идентифицируют индивидуально путем окрашивания/выстригания соответствующих участков тела (крысы, мыши), нанесения татуировок, применения ушных бирок или путем учета характерных природных пятен окраски (морские свинки).
Для идентификации крупных животных (кролики) при индивидуальном содержании используются соответствующие этикетки.
Животные, находящиеся в эксперименте, ежедневно осматриваются независимо ветеринарным врачом и экспериментатором. Все отклонения в состоянии здоровья (поведение и поза в клетке и на открытой площадке, наличие судорог, реакция на тактильные, болевые, звуковые и световые раздражители, состояние кожного и волосяного покрова, видимых слизистых оболочек, частота и характер дефекации и диуреза, отклонения в потреблении корма и воды) фиксируются в листе первичной документации эксперимента.
Микробиологический контроль статуса здоровья животных осуществляется с применением бактериологических/серологических, паразитологических и патоморфологических исследований с привлечением патоморфологической службы лаборатории или независимой сертифицированной организации. Исследованиям подвергаются животные во время карантина и животные, содержащиеся в экспериментальных конвенциональных условиях более 1 мес. Аналогичная процедура используется и для животных, находящихся в индивидуально-вентилируемых клетках.
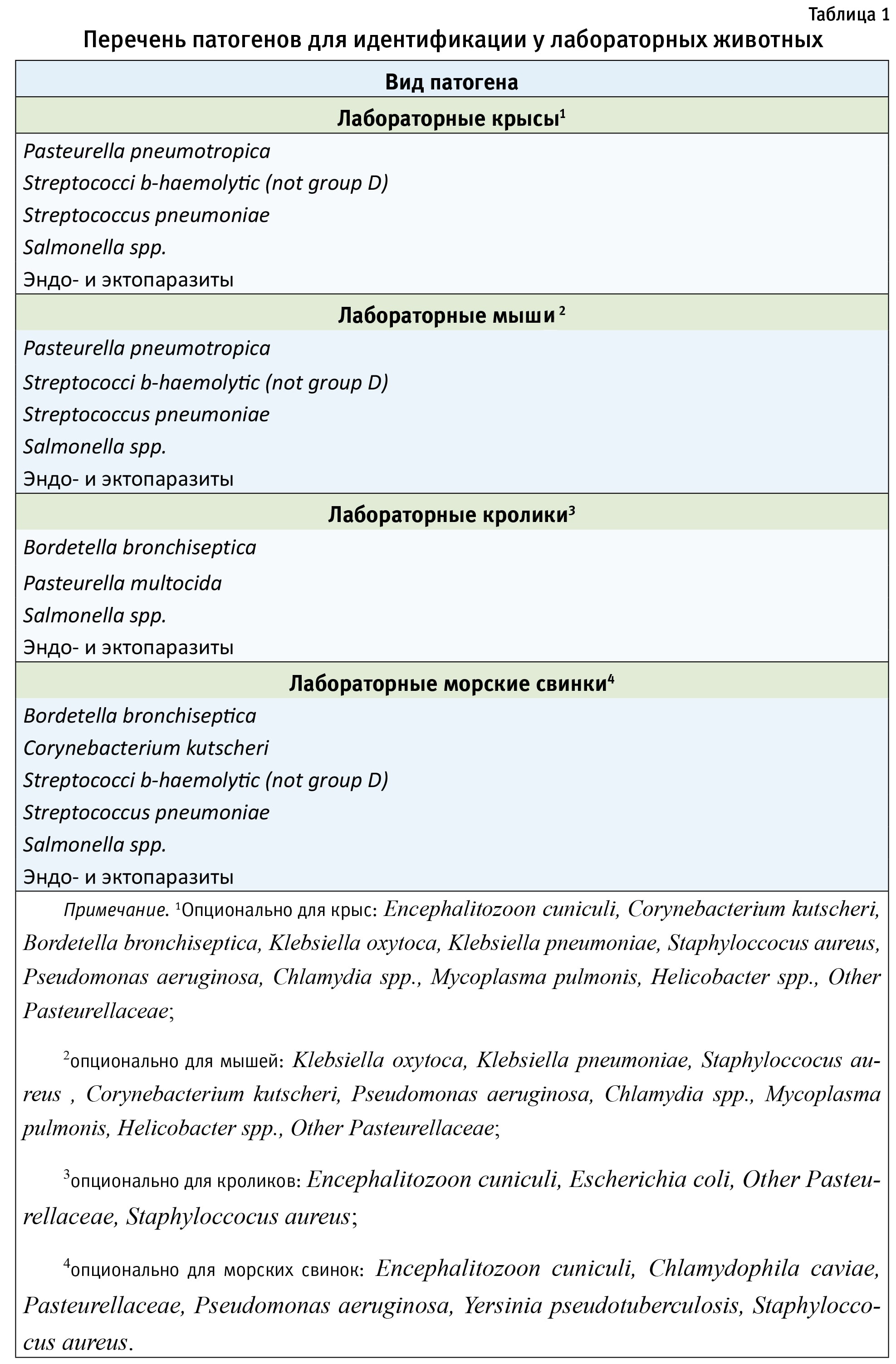
Для своевременного выявления заболеваний рекомендуется отбирать пробы и проводить исследования на наличие инфекционных заболеваний в соответствии со списком, рекомендованным FELASA (2015) [4], и графиком поставки животных.
Перечень патогенов для идентификации у основных видов лабораторных животных представлен в табл. 1. Кратность мониторинга для всех указанных видов лабораторных животных составляет 1 раз в 3 мес.
Контроль среды обитания
Различные параметры среды обитания подлежат контролю и при необходимости корректировке.
Температура и влажность воздуха. Измерение температуры и влажности должны проводиться ежедневно в каждом помещении зоны содержания тест-систем и регистрироваться в специальном индивидуальном журнале.
Для измерения температуры и влажности внутри помещения используются электронные или цифровые термометры-гигрометры, которые ежедневно фиксируют средние показатели данных параметров, а также их минимальное и максимальное значение в течение суток.
Рекомендуемые допустимые диапазоны температуры и относительной влажности для содержания лабораторных животных следующие:
- мыши, крысы, морские свинки — 18-260С;
- кролики — 16-220С;
- для всех видов лабораторных животных влажность 30-70%.
Температурный режим в помещениях должен поддерживается с помощью системы автоматического контроля температуры воздуха, установленной в приточных установках вентиляционной системы.
Освещенность. Комнаты содержания животных должны быть оборудованы реле времени и иметь 12-часовой цикл освещения. Норма освещенности: 325 лк на расстоянии
Шум. Шумовой фон создают сами животные, включенная вентиляция, персонал при выполнении манипуляций с животными. Уровень интенсивности шума в помещениях содержания животных в присутствии персонала не должен превышать 85 дБ.
Кратность воздухообмена и газовый состав. Воздухообмен в помещениях для животных должна обеспечивать изолированная приточно-вытяжная вентиляция, состоящая из приточных и вытяжных установок, систем кондиционирования и оснащенная фильтрами тонкой очистки, что позволяет избежать возможного перекрестного контаминирования среди животных.
Многоступенчатая структура вентиляционной системы гарантирует необходимую кратность циркуляции воздуха (8–10-кратная смена воздуха/час) в комнатах содержания лабораторных животных, что в свою очередь позволяет независимо от параметров наружного воздуха поддерживать оптимальный газовый состав, температуру и влажность среды обитания животных.
Контроль помещений
С целью снижения уровня микробной обсемененности и создания условий для предотвращения распространения инфекционных заболеваний необходимо регулярное проведение санитарной обработки помещений зоны содержания тест-систем, а также мероприятий по дезинфекции, дезинсекции и дератизации.
Смена клеток и подстила. Смена клеток и подстила осуществляется 1-3 раза в неделю в зависимости от вида животных для обеспечения сухости и чистоты. Решетки для клеток, разделители для корма, держатели для этикеток меняются еженедельно.
Смена подстила проводится с помощью специальной станции для пересадки животных, при работе которой возникает 2 ламинарных потока воздуха, исключающие возможность контаминации окружающей среды и сменных клеток с чистым подстилочным материалом.
После окончания смены подстила грязные материалы транспортируются в дезинфекционно-моечное отделение.
В дезинфекционно-моечном отделении, используя станцию по сбору подстилочного материала, из клеток удаляют загрязненную подстилку в полиэтиленовые пакеты с маркировкой «Отходы класса «Б». Для обеззараживания подстил обрабатывается дезинфектантом с активным хлором, пакеты плотно завязываются и выносятся на мусорную площадку для последующей утилизации.
В дальнейшем освобожденные клетки подвергаются мойке и автоклавированию. Для повышения качества мойки используют специальные моющие средства, обладающие дезинфицирующими свойствами, одобренные производителем оборудования и разрешенные к применению в ветеринарии. Контролирует качество мойки визуально ветеринарный врач. Контроль качества автоклавирования осуществляют с помощью индикаторных тест-полосок.
Санитарная обработка помещений. Работы по уборке и дезинфекции помещений проводятся ежедневно с применением механических, физических и химических средств и состоят из следующих этапов:
-
Предварительная уборка — перед началом работ осуществляют влажную уборку пола с последующей УФ-обработкой помещения.
-
Текущая уборка — поддержание чистоты пола и рабочих поверхностей в течение всего рабочего дня.
-
Заключительная уборка в конце рабочего дня — сухая уборка помещения (обметаются стеллажи, столы и другие рабочие поверхности, подметается пол, протирается пыль, собирается и выносится мусор) и влажная уборка пола с применением дезинфицирующих средств и последующей УФ-обработкой помещения.
-
Еженедельная генеральная уборка проводится в дополнение к ежедневной текущей уборке в конце рабочей недели и включает более полную санитарную обработку помещений (стены, окна, двери, вентиляционные каналы и др.)
Весь инвентарь для уборки должен иметь четкую маркировку с указанием номера помещения, храниться в строго установленном месте и использоваться только по прямому назначению в конкретном помещении.
Для санитарной обработки помещений применяются дезинфицирующие средства и/или дезинфицирующие средства с моющим компонентом, прошедшие государственную регистрацию и официально разрешенные к применению на объектах ветеринарного надзора.
Дезинфицирующие средства должны обладать широким спектром действия, не иметь стойкого неприятного запаха, быть безопасными для животных и обрабатываемых поверхностей.
Режим применения дезинфицирующих средств выбирают по рекомендации производителя согласно инструкции.
Контроль проведенной уборки визуально оценивает ветеринарный врач, о чем делает пометку в листе учета текущих уборок конкретного помещения.
Значительно улучшает санитарную уборку помещений применение бактерицидных облучателей. Режим работы облучателей ежедневный, однократный или повторно-кратковременный и зависит от назначения помещений, их размера, а также от характера проводимых работ и типа самого прибора.
Бактерицидные облучатели закрытого типа — рециркуляторы — предназначены для облучения воздуха и поверхностей в помещениях как в отсутствие, так и в присутствии людей и животных и используются в комнатах содержания животных. Бактерицидные облучатели открытого типа используются в манипуляционных комнатах при отсутствии людей и животных.
На каждый облучатель составляется индивидуальный журнал учета работы, где отражаются время включения и выключения облучателя, а также суммарная наработка часов за месяц/год за подписью ответственного лица.
Для оценки эффективности работы конкретного облучателя и возможности дальнейшей его эксплуатации аккредитованный испытательный лабораторный центр проводит:
- ежегодно измерение характеристик УФ-излучения каждого облучателя;
- один раз в 6-12 мес отбор проб воздуха в каждом помещении, пробы подвергаются лабораторному исследованию по следующим показателям: общая микробная чистота, количество колоний S. aureus в 1 м3 воздуха.
Все проводимые исследования фиксируются в соответствующих актах/протоколах за подписью ответственного.
Дезинфекция, дезинсекция и дератизация. Помимо ежедневной текущей и еженедельной генеральной уборки с применением дезинфицирующих средств, в конце каждого месяца проводят дезинфекцию всех помещений «чистой» и «грязной» зоны с применением дезинфицирующего средства в более высокой концентрации.
По окончании дезинфекции на бланке организации составляется акт о проделанной работе за подписями ответственных и делается запись в журнале учета дезинфекции, дезинсекции и дератизации (форма №10-вет).
Хранение дезинфицирующих средств осуществляется в строго установленном месте, под замком.
Для учета поступления и расхода дезинфицирующих средств необходимо вести «Журнал учета получения и расхода дезинфицирующих средств».
Весь инвентарь, используемый для уборки в процессе дезинфекции, должен иметь четкую маркировку, храниться в строго установленном месте и использоваться только по прямому назначению.
Дезинфекция проводится по утвержденному технологическому плану с учетом эпизоотической обстановки и включает несколько этапов:
- предварительная очистка рабочих поверхностей, сбор и вынос мусора;
- дезинфекция помещения и рабочих поверхностей с применением дезинфицирующих средств;
- заключительная УФ-обработка помещения.
Дезинфекцию, а также дератизацию и дезинсекцию специальными средствами дополнительно проводит дезотряд государственной станции профилактической дезинфекции согласно договору, ежеквартально, с составлением акта о проведенной работе.
Минимум ежеквартально для контроля качества проведенной дезинфекции после обработки дезинфицирующими средствами берутся смывы со стен и обработанных поверхностей для последующего микробиологического исследования. Результаты фиксируются в соответствующих протоколах за подписью ответственного.
Контроль вспомогательных материалов
Корм. Кормить животных необходимо доброкачественным полнорационным гранулированным комбикормом. Комбикорма должны обеспечивать потребности организма в основных питательных и минеральных веществах, витаминах и микроэлементах и исключать необходимость введения в корм дополнительных ингредиентов, если это не предусмотрено условиями эксперимента.
Комбикорм должен быть изготовлен в соответствии со стандартом «Комбикорма полнорационные для лабораторных животных».
Закупаемый корм должен поступать в оригинальной упаковке производителя, с указанием названия и адреса производителя, номера ГОСТа, рецептуры корма и даты изготовления. Вся партия корма должна иметь сопроводительную бухгалтерскую документацию и ветеринарное свидетельство по форме №3-вет.
Корм необходимо хранить на поддонах или стеллажах в сухих, чистых, хорошо проветриваемых помещениях, не имеющих посторонних запахов, при температуре от +5°С до +25°С и относительной влажности 50–60%. Сроки хранения корма определяются согласно рекомендации производителя.
Вода. Вода для питья лабораторных животных должна соответствовать ГОСТу Р 51232-98 «Вода питьевая. Общие требования к организации и методам контроля качества», быть доброкачественной, в ней должны отсутствовать примеси, возбудители инфекций, яйца гельминтов, простейших организмов.
Вода наливается в стерильные бутылочки. Бутылочки для воды подлежат периодической замене, не реже 1 раза в 4 дня. Доливание воды не допускается.
Качество воды контролируется 1 раз в 3-6 мес, для этого проводится:
- химический анализ (рН, цветность, мутность, окисляемость, наличие нитратов, нитритов, хлоридов, сульфатов, аммония, алюминия, марганца, меди, цинка, железа, ртути и нефтепродуктов);
- микробиологический анализ на чистоту (возбудители инфекций, яйца гельминтов, простейшие организмы).
Подстил. Мелкие грызуны содержатся в клетках в прямом контакте с подстилочным материалом. В качестве подстилки можно использовать опилки, стружку, мелкую щепу лиственных древесных пород или наполнитель из стержней кукурузы.
Подстил для лабораторных животных должен отвечать требованиям ТУ, также не должен иметь посторонних примесей при минимальном содержании пыли и обладать хорошими адсорбирующими свойствами. Частота смены подстила может варьировать от 1 до 3 раз в неделю в зависимости от вида животных и плотности их посадки.
Подстил должен храниться на поддонах или стеллажах в сухих, чистых, не имеющих посторонних запахов помещениях.
Заключение
Для решения задачи обеспечения качества биологических тест-систем рекомендована программа мониторинга здоровья лабораторных животных, обеспечивающая соблюдение требований санитарных норм и правил, а также принципов надлежащей лабораторной практики при включении в доклинические исследования здоровых животных.
Реализация предложенной программы будет способствовать повышению качества достижения основных целей при проведении доклинических исследований – получению достоверных результатов экспериментов, снижению рисков при соблюдении требований действующего законодательства.
Сведения о конфликте интересов
Авторы заявляют об отсутствии конфликта интересов.
Список источников
- Коробейникова Е.П., Комарова Е.Ф. Лабораторные животные - биомодели и тест-системы в фундаментальных и доклинических экспериментах в соответствии со стандартами надлежащей лабораторной практики (НЛП/GLP). Журнал фундаментальной медицины и биологии. 2016. 1: 30-6. [Korobeynikova E.P., Komarova E.F. Laboratory animals – biomodels and test systems in fundamental and preclinical experiments according to the good laboratory practice (GLP) standards. ZHurnal fundamental'noj mediciny i biologii. 2016. 1: 30-6. (In Russ.)]
- Зайцева МА, Иванов МБ, Пикалова ЛВ, Кашина ТВ. Цели и политика качества при проведении доклинических исследований. Фундаментальные исследования. 2013; 9:239–42. [Zaytseva M.A., Ivanov M.B., Pikalova L.V., Kashina TV. Quality purposes and policy at preclinical testing conducting. Fundamental'nye issledovaniya. 2013; 9:239–42 (In Russ.)]
- ГОСТ 33044-2014 от 01.08.2015 «Принципы надлежащей лабораторной практики».
- http://www.felasa.eu/working-groups/recommendation/recommendations-for-health-monitoring-of-rodent-and-rabbit-colonies/



