Характеристика поведения гетерозиготных мышей с мутациями L100P и Q31L в гене DISC1
Чижова Н.Д. , Липина Т.В., Амстиславская Т.Г. Характеристика поведения гетерозиготных мышей с мутациями L100P и Q31L в гене DISC1. Лабораторные животные для научных исследований. 2019; 3. https://doi.org/10.29296/2618723X-2019-03-02
Резюме
Шизофрения и депрессия — многофакторные заболевания, патогенез которых складывается из сложного взаимодействия генетических особенностей организма и факторов среды. Эти заболевания зачастую перекликаются друг с другом и по ряду негативных симптомов, и по факторам, повышающим риск их развития. Это предполагает потенциальное совпадение в патофизиологии и/или этиологии этих расстройств. На основе многочисленных исследований установлены генетические ассоциации между локусом гена DISC1 (Disrupted-In-Schizophrenia-1) и психиатрическими заболеваниями в разных популяциях у человека. В частности, показано, что биологические процессы в нейронах, протекающие с участием белка DISC1 и его интерактома, могут оказывать влияние на развитие шизофрении и депрессии. Для изучения этих биохимических процессов и тестирования новых методов лечения разработаны валидные анимальные DISC1-генетические модели данных психопатологий. Так, в составе УНУ НИИ физиологии и фундаментальной медицины СО РАМН (Новосибирск) имеются мыши генетических линий DISC1-L100P—/— и DISC1-Q31L—/—, моделирующих шизофрено- и депрессивноподобные эндофенотипы соответственно.
В ходе эксперимента были получены мыши, сочетающие в себе различающиеся мутантные аллели гена DISC1 (L100P и Q31L) и исследованы фенотипические особенности проявления их эмоционального, социального и когнитивного поведения. Выявлены различия и сходства у мышей DISC1-L100P+/—/Q31L+/— по сравнению с L100P+/— в одних тестах и с Q31L+/— — в других. Выявленные половые различия в экспрессии отдельных поведенческих паттернов, а также наличие когнитивных нарушений в тесте PPI позволяют рассматривать мышей DISC1-L100P+/—/Q31L+/— в качестве перспективной экспериментальной модели шизофрении.
Введение
На сегодняшний день многочисленными исследованиями гена DISC1 (Disrupted-In-Schizophrenia-1) установлены генетические ассоциации между локусом этого гена и психиатрическими заболеваниями в разных популяциях у человека [1, 2], которые подтверждаются наличием валидных DISC1-генетических моделей психопатологий. Известно, что биологические процессы в нейронах, протекающие с участием белка DISC1 и его интерактома (совокупность протеинов, взаимодействующих с ним), могут играть важную роль в патологии шизофрении и депрессии [3–5].
Шизофрения — это полиморфное психическое расстройство, характеризующееся позитивными (галлюцинации, бред и расстройства мышления), негативными (пониженная мотивация, ангедония, упрощение эмоциональных реакций, скудность речи, снижение социального функционирования) и когнитивными — ключевыми (дефицит исполнительных функций мозга, нарушение концентрации внимания, дефицит кратковременной памяти) симптомами [6]. Установлено, что у шизофрении есть генетическая основа, а различные патогенные факторы могут провоцировать начало ее проявления. Так, согласно гипотезе нейроразвития, взаимодействия определенных генетических элементов (различных аллелей некоторых генов) с неблагоприятными факторами окружающей среды приводят к нарушениям в формировании головного мозга, что впоследствии способствует проявлению симптомов шизофрении [7]. Выявлено множество генов, связанных с развитием этой психопатологии. Такие аллели имеют различную степень риска развития заболевания — высокорисковые с большей вероятностью приведут к шизофрении, чем низкорисковые, — и распространенность в популяциях. Тем не менее, генетика шизофрении до конца не изучена, поскольку существует большое разнообразие аллелей, взаимодействие которых друг с другом настолько сложно, что затрудняет прогнозирование фенотипических проявлений [8].
Большое депрессивное расстройство (БДР) — это длительное психическое заболевание, развитие которого также связано с определенными генетическими факторами и воздействием окружающей среды, как физического, так и психологического плана. Данная психопатология характеризуется «депрессивной триадой»: сниженное настроение и утрата способности переживать радость, нарушения мышления, двигательная заторможенность [9].
Шизофрения и депрессия вносят ощутимый вклад в глобальное бремя болезней [10]. Данные заболевания зачастую перекликаются друг с другом, как по факторам, повышающим риск развития, так и по ряду негативных симптомов [11]. Такая взаимосвязь между шизофренией и депрессией предполагает потенциальное совпадение в патофизиологии и/или этиологии этих расстройств.
Существует множество различных анимальных экспериментальных моделей ментальных расстройств с той или иной степенью валидности. Однако многие генетические модели психопатологий основаны на одной генетической мутации, что не отражает наблюдаемой картины генетического разнообразия психических расстройств у человека, и, следовательно, может являться препятствием для трансляции результатов в клинические исследования. Кроме того, поиск адекватных моделей шизофрении и депрессии осложняется гетерогенностью симптомов, а также трудностями в установлении надежной патологической этиологии [12]. Создание же такой модели заболевания на грызунах, которая обладала бы всеми ее патологическими характеристиками, — весьма сложная задача.
Таким образом, присутствие в одной модели как шизофрено-, так и депрессивноподобного эндофенотипов может быть полезным для понимания механизмов их сопутствующего развития и тестирования новых методов лечения сложных психических состояний. В связи с этим представляется перспективным изучить влияния взаимодействия нескольких аллелей гена, связанного с развитием этих заболеваний, на поведение животного. Такое исследование возможно провести с использованием мышей мутантных линий DISC1-Q31L и DISC1-L100P из УНУ НИИФФМ [13].
Данные мутации были созданы при сотрудничестве лаборатории профессора Дж. Родера с исследователями биоресурсного центра RIKEN [14]. Мыши линии DISC1-L100P несут точечную мутацию (замена одного нуклеотида) во 2-м экзоне гена DISC1, приводящую к замене лейцина на пролин в положении 100-й аминокислоты, а у мышей линии DISC1-Q31L — глутамина на лейцин в положении 31-й аминокислоты в DISC1-протеине. На основании ряда исследований выявлено соответствие линии мышей DISC1-L100P—/— генетической модели шизофрении, а DISC1-Q31L—/— — модели депрессии, согласно критериям модели психического расстройства [5, 14-20].
Целью данной работы было получение самцов и самок мышей, несущих 2 мутации в гене DISC1 — L100P и Q31L, и выявление фенотипических особенностей проявления их эмоционального, социального и когнитивного поведения.
Материал и методы
С целью получения экспериментальных животных были использованы половозрелые гомозиготные мыши генетических линий DISC1-L100P—/— и DISC1-Q31L—/— из УНУ «Биологическая коллекция — генетические биомодели нейропсихических заболеваний» (№ 493387) НИИ физиологии и фундаментальной медицины [13] в качестве родительских особей. Всего было взято: 2 самки и 2 самца DISC1-L100P—/—, 3 самца DISC1-Q31L—/—, а также 14 самок и 3 самца линии C57BL/6NCrl (WT, дикий тип), используемых в качестве контроля. Все мыши содержались в виварии НИИФФМ в пластиковых клетках (OptiMice Biotech A.S.; 34 × 29 × 15 см), со световым режимом 12:12 (свет — с 6:00 ч, темнота — с 18:00 ч) при температуре около 23оС. Корм («ПроКорм» для лабораторных крыс и мышей); воду животные получали в неограниченном количестве.
Тестирование полученных экспериментальных мышей в возрасте 2–3,5 мес проводили между 9:00 и 16:00 ч. Перед экспериментами мышей помещали в экспериментальную комнату на 30 мин для габитуации. Между тестированиями каждой мыши оборудование очищалось 70% раствором этанола для удаления запахов. Условия работы с животными соответствовали международным нормам (Council of the European Communities Directive 86/609/EES).
Эмоциональное поведение оценивалось в тестах «приподнятый крестообразный лабиринт» (ПКЛ) [21], «открытое поле» (ОП) [22] — в течение 5 мин и в тесте «подвешивание за хвост» (ПХ) [23] — с помощью компьютеризованного оборудования фирмы Noldus International Technology.
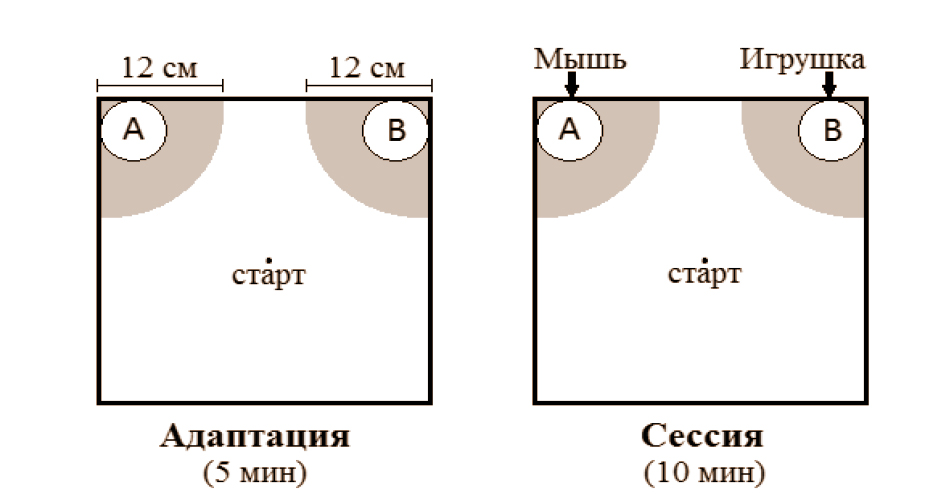
Социальное поведение исследовалось в тесте на социальную мотивацию [24], который был модифицирован следующим образом. 2 полых цилиндра одинакового размера (6,5 × 6,5 × 10,5 см) располагались в углах у одной стенки экспериментальной камеры (40 × 40 × 37 см) из оргстекла. Тестирование проводили в 2 этапа, между которыми мышь возвращали в домашнюю клетку на 1–2 мин: 1-й этап — адаптация. Мышь помещали в центр экспериментальной установки на 5 мин; 2-й этап — сессия. Внутрь контейнера А помещалась незнакомая мышь дикого типа такого же пола, возраста и веса, что и тестируемые животные, а в контейнер В — нейтральный предмет без запаха и вкуса (игрушка — стеклянный контейнер с синим содержимым), после чего в центр установки снова помещали испытываемую мышь уже на 10 мин. В течение обоих этапов регистрировали продолжительность нахождения и число заходов мыши в исследуемые зоны (сектора в углах А и В радиусами 12 см) с помощью оборудования фирмы Noldus International Technology. В этом эксперименте участвовали только самцы. Схема теста представлена на рис. 1.
Когнитивное поведение оценивалось в 3 тестах. Тестирование в Т-образном лабиринте (ТЛ) проводилось аналогично описанному [25], при этом стартовым был рукав А, расположенный под прямым углом к остальным рукавам (В и С), а стенки самого лабиринта были прозрачными. Все измерения фиксировались экспериментатором вручную. Тест на сенсорно-моторную фильтрацию (престимульное торможение реакции вздрагивания, PPI) проводился, согласно протоколу [18] в звукоизоляционной камере SR-Lab Startle Response System. Использовались следующие звуковые сигналы: стимулы, вызывающие реакцию вздрагивания, – 110 дБ; престимулы мощностью 72, 78, 82, 86 дБ; фоновый шум – 65 дБ. Тест на выработку условной реакции пассивного избегания (память страха, ПС) был проведен в экспериментальных установках Gemini Avoidance System (San-Diego Instruments) в соответствии с описанием [26] для тока силой 0,5 мА.
Статистический анализ результатов выполняли с помощью пакета программ Statistica 10 for Windows 8. Для определения нормальности распределения данных использовали критерий Шапиро–Уилка. При нормальном распределении (p>0,05) сравнивали средние значения с помощью дисперсионного анализа ANOVA (с повторными измерениями для тестов на социальную мотивацию и PPI) и последующим post-hoc-анализом с применением LSD критерия Фишера. При отсутствии нормального распределения (p<0,05) применяли непараметрический ранговый анализ Краскела–Уоллиса (для теста на память страха).
Результаты и обсуждение
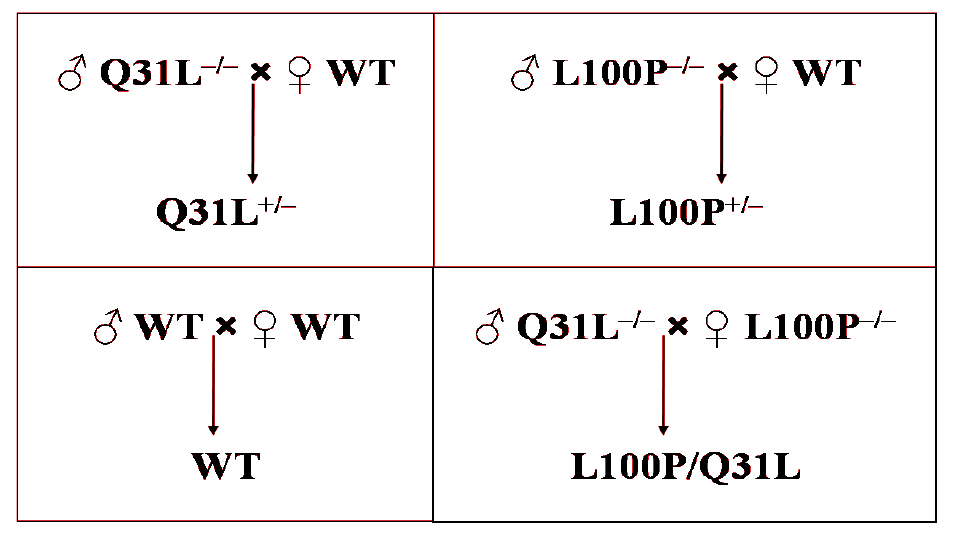
Получение мышей. Для достижения максимального количества потомков родителей ссаживали по 3 особи (2 самки и 1 самец), в итоге сформировав 8 родительских гнезд. Схема скрещивания показана на рис. 2.
Отсадка помета производилась в возрасте 1 мес в аналогичные клетки по 2–7 особей, раздельно по полу. Численность получившихся экспериментальных групп см. в табл. 1.
Таблица 1
Количество мышей в группах
|
Пол |
Генотип |
|||
|
WT |
Q31L+/– |
L100P+/– |
L100P/Q31L |
|
|
Самцы |
10 |
11 |
12 |
9 |
|
Самки |
7 |
13 |
8 |
8 |
«Приподнятый крестообразный лабиринт». Среди основных показателей тревожности выявлены различия в предпочтении рукавов лабиринта. Найдено влияние генотипа [F(3,62)=5,33; p<0,01] на время, проведенное в открытых рукавах лабиринта. Самки Q31L+/– достоверно проводили больше времени в закрытых (p<0,05) и меньше в открытых (p<0.01) рукавах в сравнении с WT (рис. 3, табл. 2). Самки с двумя мутациями отличались от Q31L+/– – они предпочитали проводить больше времени в открытых рукавах лабиринта (p<0,01) и меньше в закрытых (p<0,05), но при этом не отличались от контрольных самок (p>0,05); также они проводили больше времени в закрытых рукавах, чем самцы (p<0,05).
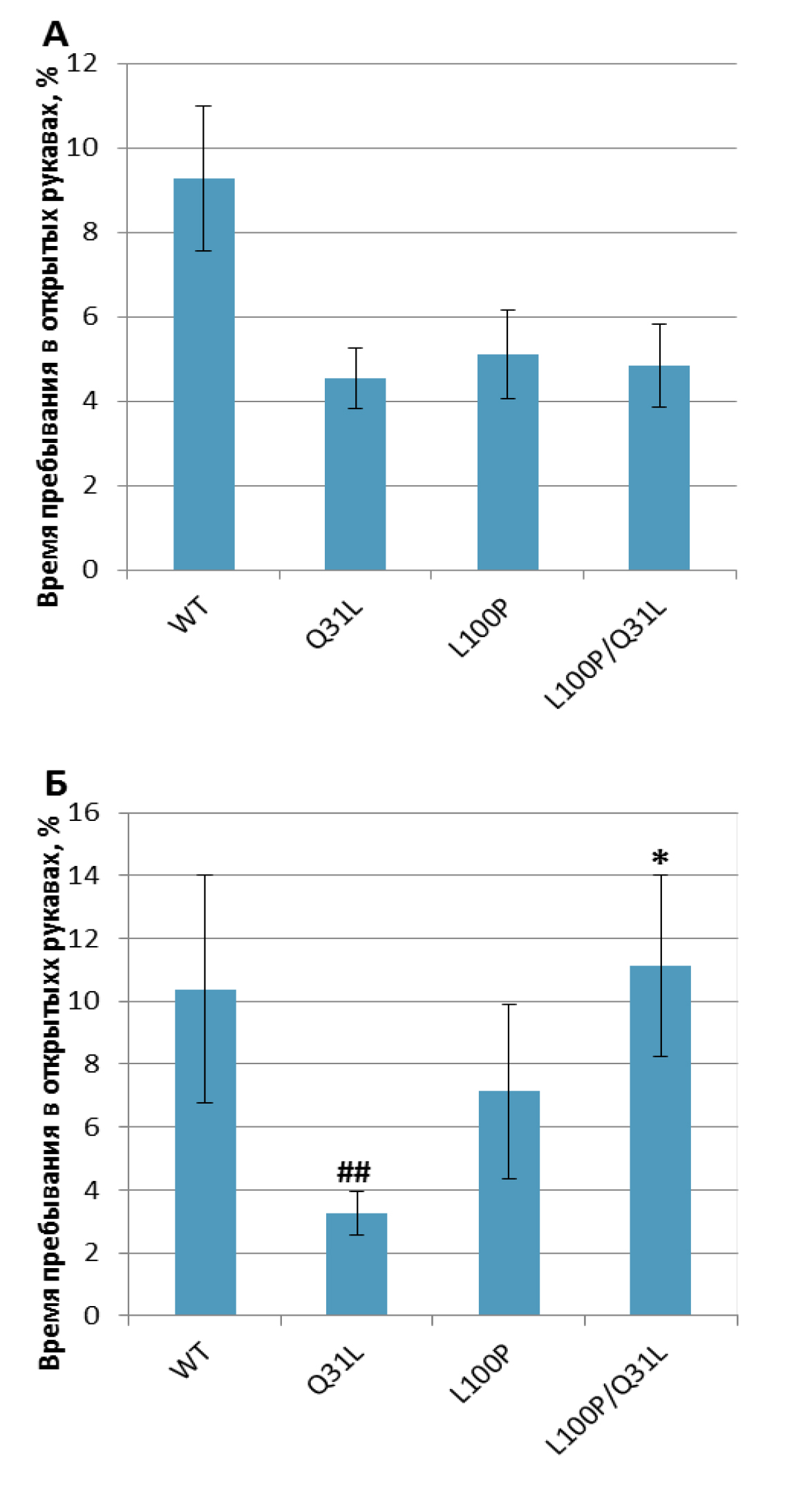
Таблица 2
Поведение мышей в приподнятом крестообразном лабиринте
|
Показатели |
Самцы |
Самки |
||||||
|
WT |
Q31L+/– |
L100P+/– |
L100P/ Q31L |
WT |
Q31L+/– |
L100P+/– |
L100P/ Q31L |
|
|
Центр, % |
14,17±2,45 |
12,06±1,67 |
10,4±1,4 |
15,16±2,56 |
12,5±2,3 |
8,61±0,98 |
12,78±2,53 |
12,91±1,83 |
|
Закрытый рукав, % |
76,52±4,06 |
80,01±3,79 |
84,51±2,07 |
79,58±2,6 |
77,11±5,48 |
88,06±1,7 # |
80,1±4,96 |
75,96±4,54 * ^ |
|
Head-dips |
3,22±0,5 |
6,55±1,63 ## |
1,88±0,38 |
2,44±0,3 |
3,14±0,8 |
4,38±0,93 |
1,37±0,26 ^ |
3,43±0,66 |
|
N |
10 |
11 |
10 |
9 |
7 |
13 |
7 |
8 |
Примечание. * – p<0,05 по сравнению с самцами; ## – p<0,01 по сравнению с WT; ^ – p<0,05 по сравнению с Q31L.
Обнаружено влияние генотипа на частоту заглядываний под лабиринт (head-dips) [F(3,66)=50,58; p<0,001]. Самцы Q31L+/– совершили наибольшее их количество (p<0,01), при этом самцы дикого типа, L100P+/– и L100P/Q31L не отличались между собой (p>0,05). Самки Q31L+/– совершали большее количество заглядываний только по сравнению с L100P+/– (p<0,05).
«Открытое поле». Выявлено влияние генотипа на двигательную активность (пройденный путь) [F(3,63)=3,42; p<0.05] и продолжительность пребывания мыши в центре и у стенок «открытого поля» [F(3,62)=3,19; p<0,05]. Также был обнаружен эффект генотипа [F(3,58)=9,18; p<0,001] и взаимодействия генотипа и пола [F(3,58)=4,04; p<0,05] на длительность замирания при посадке в установку. Самки L100P+/– и L100P/Q31L были менее подвижны, чем WT (p<0,01 и p<0,05 соответственно; рис. 4).
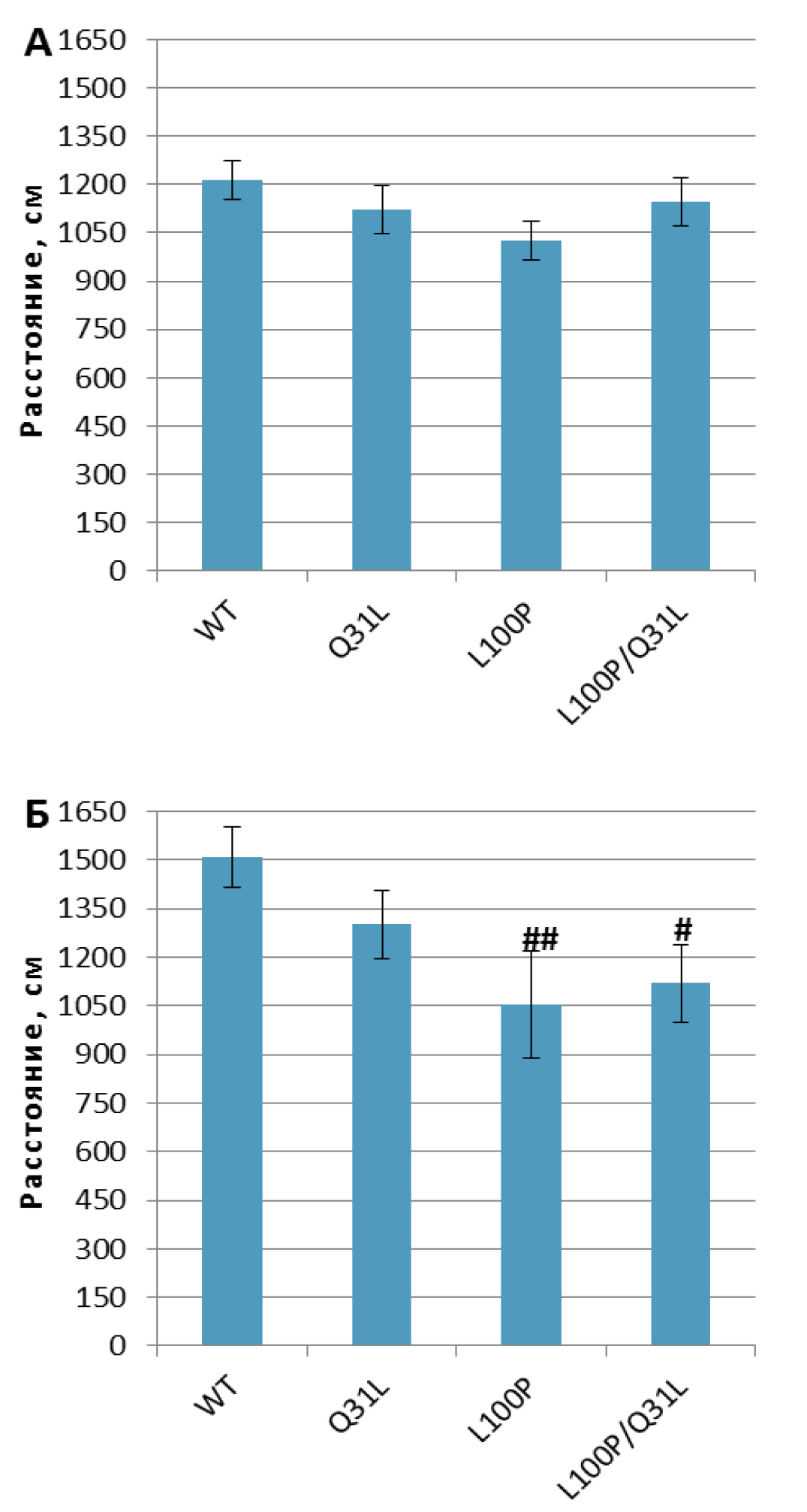
Примечание. # – p<0,05, ## – p<0,01 по сравнению с WT.
Самки Q31L+/– и L100P/Q31L замирали меньше, чем самки L100P+/– (p<0,01; табл. 3) и WT (p<0,01 и p<0,05 соответственно).
Таблица 3
Поведение мышей в тесте «открытое поле»
|
Показатели |
Самцы |
Самки |
||||||
|
WT |
Q31L+/– |
L100P+/– |
L100P/ Q31L |
WT |
Q31L+/– |
L100P+/– |
L100P/ Q31L |
|
|
Периметр, % |
94,87±0,76 |
96,1±0,47 |
96,39±0,74 |
95,85±0,81 |
93,92±0,88 |
96,62±0,62 # |
94,24±1,41 |
97,26±0,46 ## |
|
Латентное время, с |
4,6±0,67 |
2,69±0,43 # |
2,46±0,74 ## |
1,6±0,32 ## |
3,43±0,65 |
1,16±0,21 ## |
4,6±0,86 |
1,58±0,59 # |
|
n |
9 |
10 |
10 |
8 |
7 |
13 |
7 |
8 |
Примечание. # – p<0,05, ## – p<0,01 по сравнению с WT.
Самцы Q31L+/– (p<0,05), L100P+/– и L100P/Q31L (p<0.01) замирали меньше по сравнению с диким типом; самки Q31L+/– и L100P/Q31L предпочитали проводить меньше времени в центре открытого поля по сравнению с L100P+/– (p<0,05) и WT (p<0,05 и p<0,01) и больше по периметру соответственно (рис. 5).
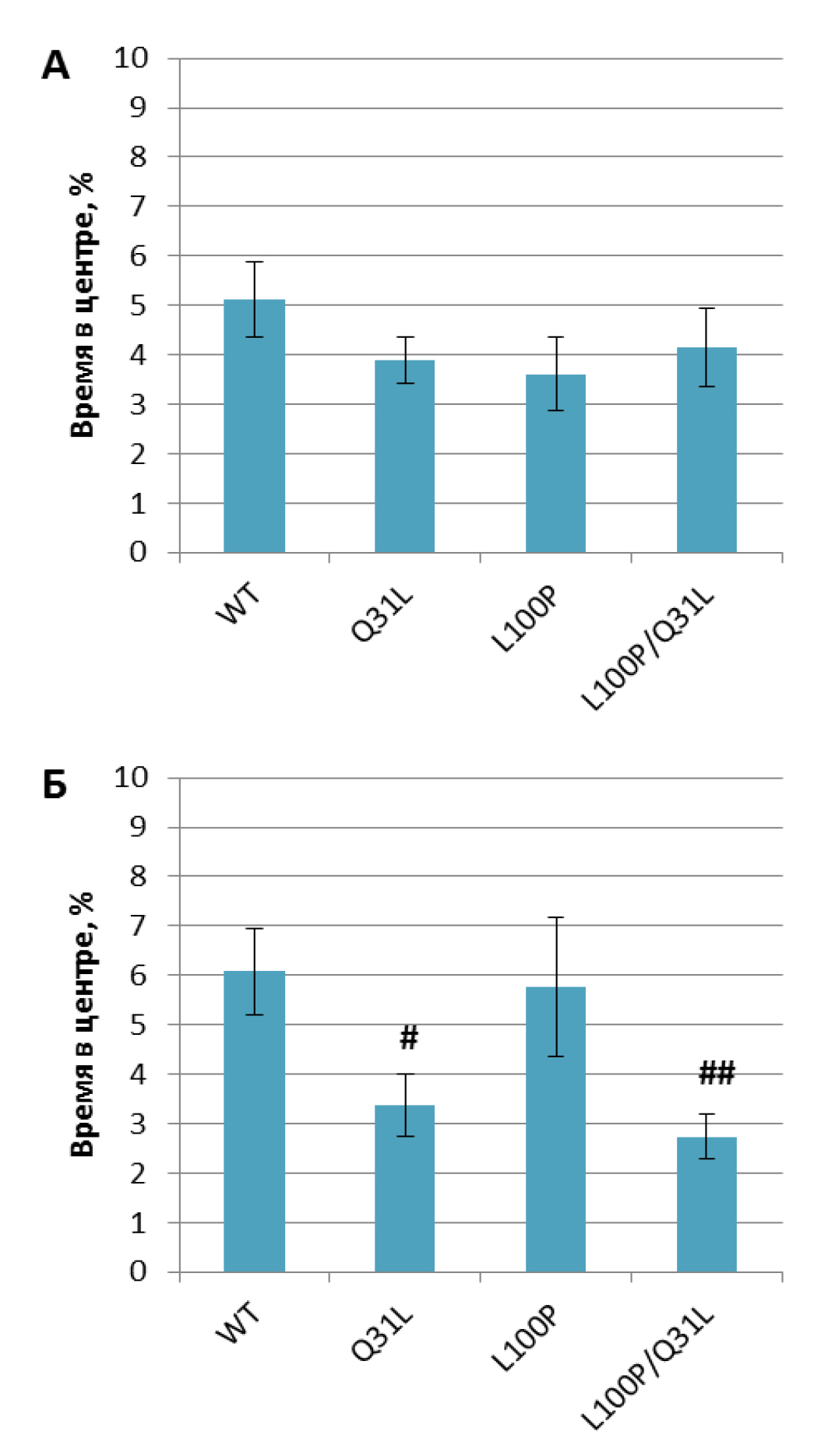
Примечание. # – p<0,05, ## – p<0,01 по сравнению с WT
«Т-образный лабиринт». Обнаружено влияние пола [F(1,62)=4,32; p<0,05] на количество совершенных входов в рукава лабиринта, что отражает двигательную активность. Показано меньшее их количество у самок с двумя мутациями по сравнению с диким типом (p<0,05; табл. 4). Ни в одной группе не было обнаружено различий в спонтанном чередовании (p>0,05).
Таблица 4
Поведение мышей в Т-образном лабиринте
|
Показатели |
Самцы |
Самки |
||||||
|
WT |
Q31L+/– |
L100P+/– |
L100P/ Q31L |
WT |
Q31L+/– |
L100P+/– |
L100P/ Q31L |
|
|
Спонтанный выбор, % |
51,27±3,87 |
58,96±4,34 |
58,36±3,06 |
64,64±7,52 |
48,92±7,11 |
54,32±5,42 |
55,54±5,9 |
52,09±6,65 |
|
Число заходов в рукава |
12,38±1,25 |
11,5±1 |
10,9±0,78 |
10,75±1,01 |
16±2 |
13,08±1,67 |
13,86±1,64 |
11±1,15 # |
|
N |
8 |
10 |
10 |
8 |
7 |
13 |
7 |
7 |
Примечание. # – p<0,05 по сравнению с WT.
Социальная мотивация. RMANOVA выявил влияние фактора «мышь» [F(1,34) =151,38; p<0,001] на продолжительность времени, проведённого в зонах А и Б, и число заходов в них [F(1,33) = 58,86; p<0,001]. Все самцы демонстрировали предпочтение социального контакта, проводя больше времени у цилиндра с мышью внутри (p<0,01; рис. 6) и чаще подходя к нему (p<0,01; p<0,05 для WT; табл. 5). Кроме того, у самцов L100P+/– отмечено большее время, проведенное рядом с мышью, по сравнению с диким типом (p<0,01).
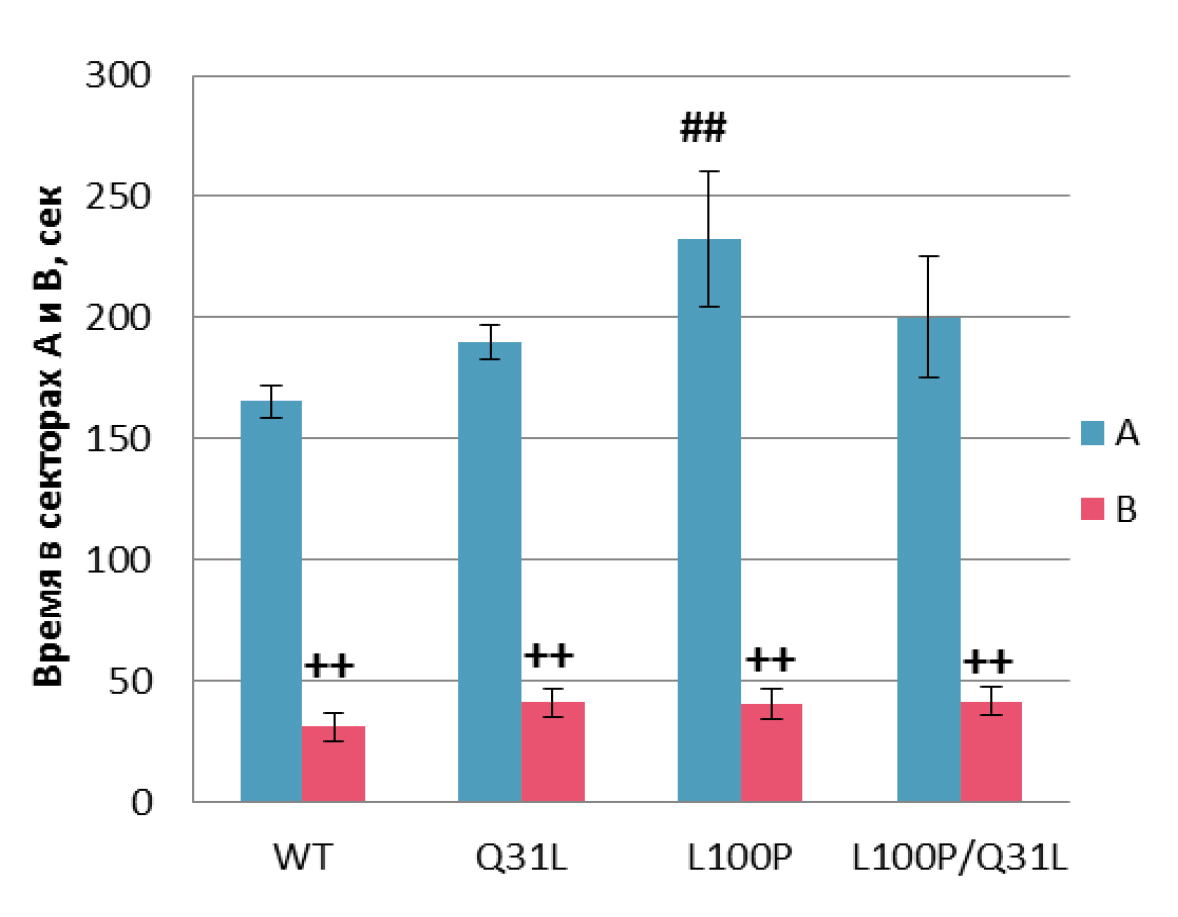
Примечание. ## – p<0,01 по сравнению с WT; ++ – p<0,01 по сравнению с сектором А.
Таблица 5
Поведение мышей в тесте на социальную мотивацию
|
Показатели |
Самцы |
||||
|
WT |
Q31L+/– |
L100P+/– |
L100P/Q31L |
||
|
Подходы к контейнеру |
A (Мышь) |
33,78±6,8 |
51,7±3,92 |
40,3±4,22 |
41,88±5,27 |
|
B (Предмет) |
20,8±4,24 + |
24,4±2,51 ++ |
21±2,7 ++ |
20,13±3,07 ++ |
|
|
n |
10 |
10 |
10 |
8 |
|
Примечание. + – p<0,05, ++ – p<0,01 по сравнению с сектором А.
«Подвешивание за хвост». MANOVA не обнаружил достоверного влияния ни генотипа [F(3,64)=1,49; p>0,05], ни пола [F(1,64)=1,83; p>0,05], однако самцы L100P/Q31L демонстрировали меньшее замирание, чем L100P+/– (p<0,05; рис. 7), не отличаясь при этом от Q31L+/– (p>0,05).
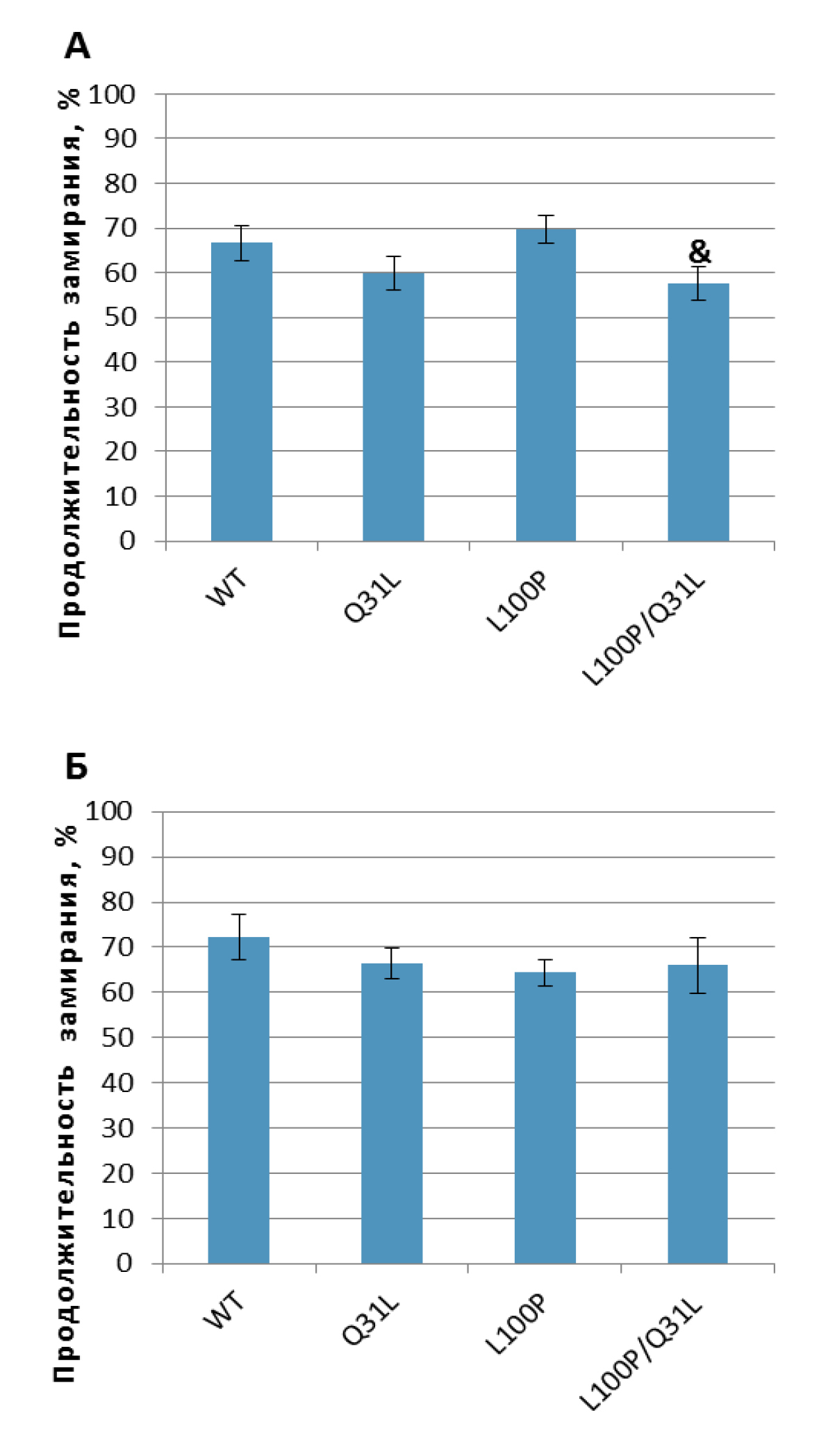
Примечание. & – p<0,05 по сравнению с L100P.
«Престимульное торможение реакции вздрагивания». Анализ с помощью RMANOVA выявил эффект генотипа [F(3,57)=8,54; p<0,001], престимулов [F(3,171)=95,18; p<0,001], а также взаимодействие генотипа и престимулов [F(9,171)=2,87; p<0,01]. Post-hoc анализ показал дефицит торможения реакции вздрагивания у самок L100P+/– по сравнению с самцами в ответ на стимулы 72, 86 (p<0,01) и 78 дБ (p<0,05) и с самками WT в ответ на 72 дБ (p<0.05; рис. 8Б). Самцы этой группы проявили повышенный относительно дикого типа PPI в ответ на сигнал 78 и 86 дБ (p<0,05; рис. 8А). В сравнении с Q31L+/– мыши L100P+/– показали меньшее PPI в ответ на стимулы: самцы – 72 и 78 дБ (p<0,05), самки – 72, 78, 86 (p<0,01) и 82 дБ (p<0,05). Самки Q31L+/– показали большее, чем у дикого типа, торможение реакции вздрагивания в ответ на стимулы 78 (p<0,01), 82 и 86 дБ (p<0.05), а самцы – в ответ на все сигналы (p<0,01). Меньшая выраженность PPI наблюдалась в ответ на 72, 78 (p<0,01) и 82, 86 дБ (p<0,05) у самцов L100P/Q31L по сравнению с Q31L+/– (p<0,01). Показатели PPI у самок с двумя мутациями в ответ на сигнал мощностью 72 дБ были достоверно ниже, чем у Q31L+/–, но выше, чем у L100P+/– (p<0,05), а также выше в сравнении с L100P+/– в ответ на 86 дБ (p<0,05).
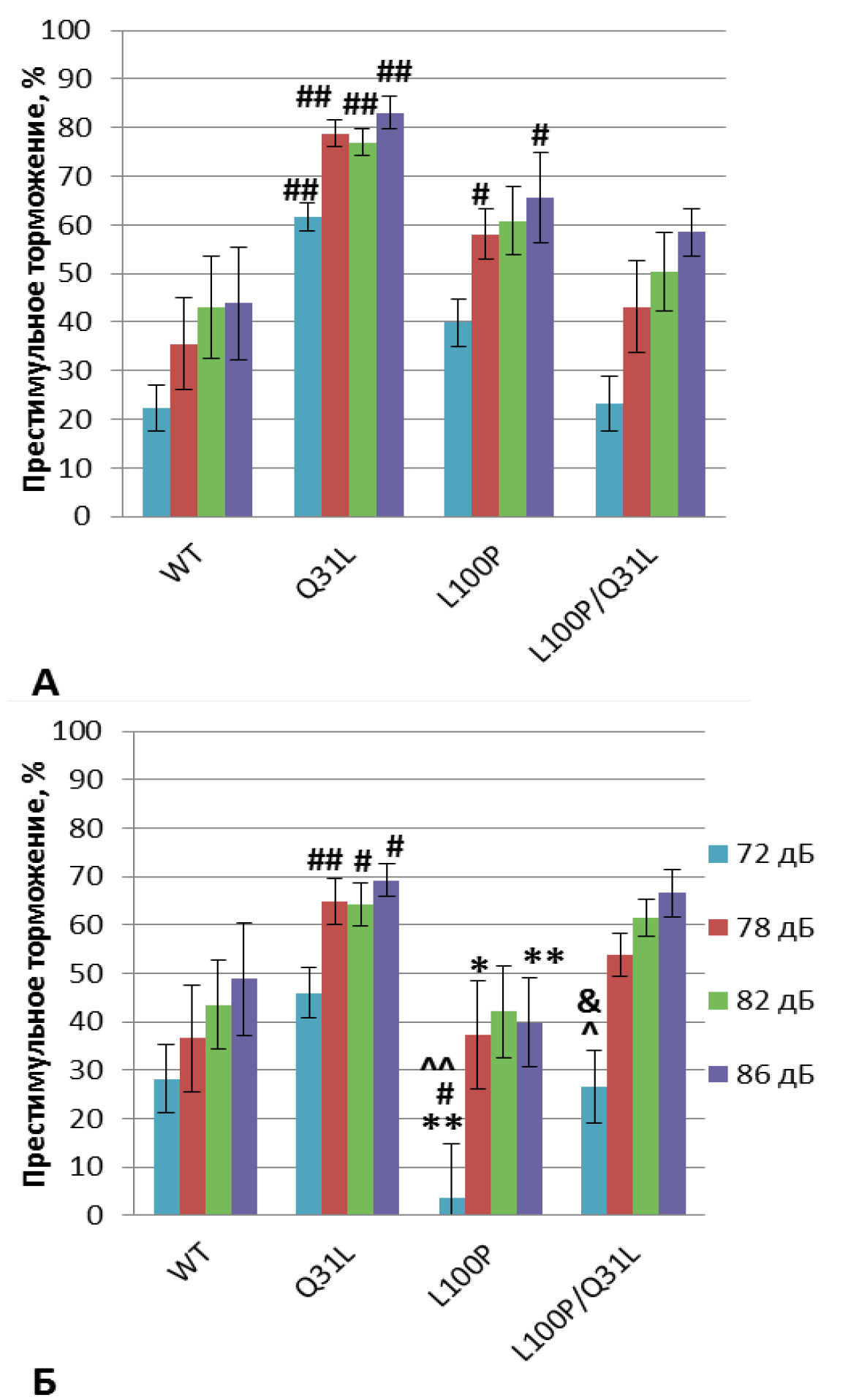
Примечание. * – p<0,05, ** – p<0,01 по сравнению с самцами; # – p<0,05, ## – p<0,01 по сравнению с WT; ^ – p<0,05, ^^ – p<0,01 по сравнению с Q31L; & – p<0.05 по сравнению с L100P.
Обнаружен эффект генотипа на реакцию вздрагивания [F(3,61)=2,95; p<0,05]. Самки L100P/Q31L и Q31L+/– вздрагивали слабее самцов (p<0,05; рис. 9). Также самки Q31L+/– вздрагивали слабее самок WT (p<0,05), а самцы с двумя мутациями и самцы Q31L+/– вздрагивали сильнее L100P+/– (p<0,05).
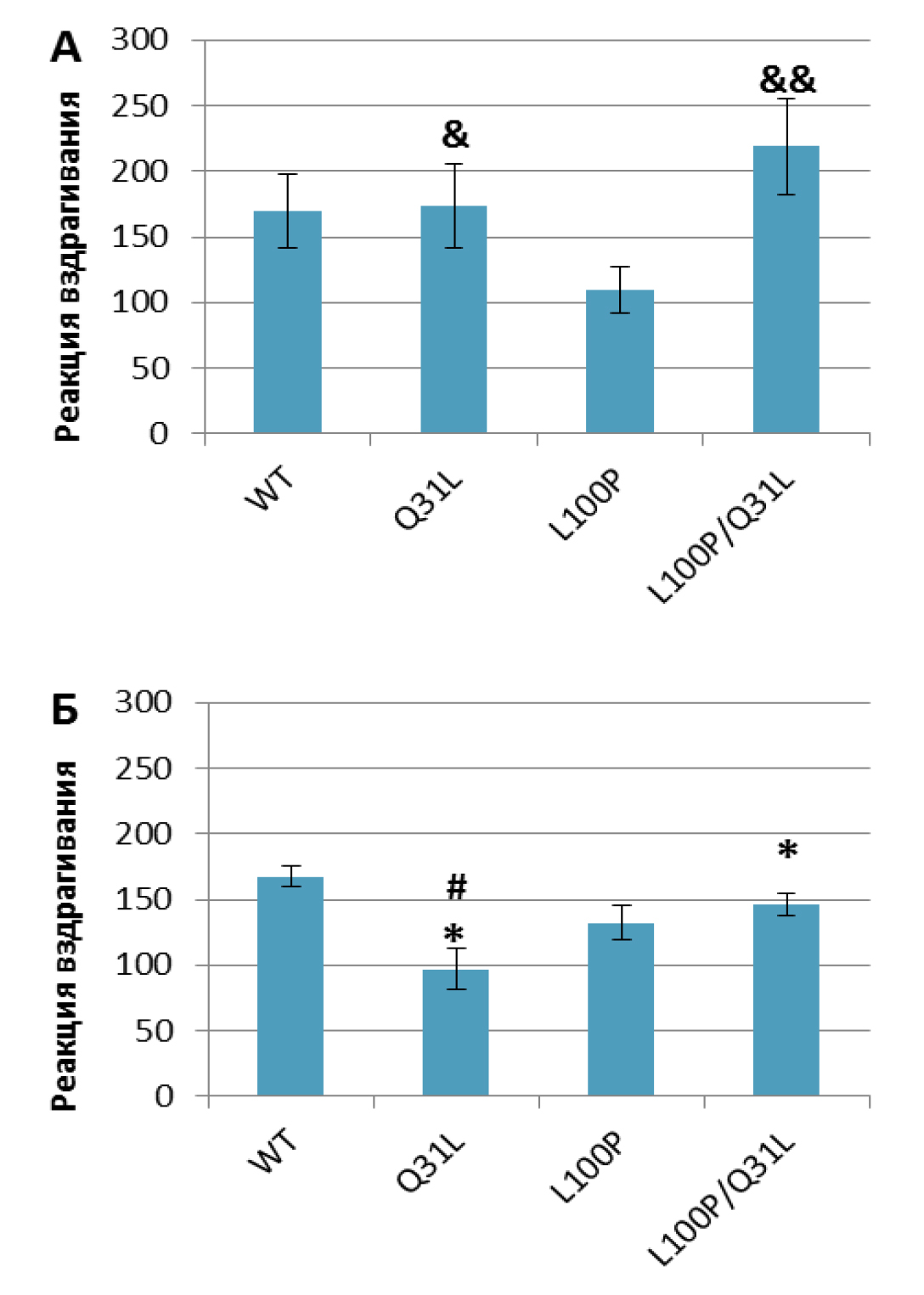
Примечание. * – p<0,05 по сравнению с самцами; # – p<0,05 по сравнению с WT; & – p<0,05, && – p<0,01 по сравнению с L100P.
Память страха. Не обнаружено статистически значимых различий в латентном времени перехода в темный отсек (p>0,05; табл. 6).
Таблица 6
Условная реакция пассивного избегания в тесте на память страха
|
Показатели |
Самцы |
Самки |
||||||
|
WT |
Q31L+/– |
L100P+/– |
L100P/ Q31L |
WT |
Q31L+/– |
L100P+/– |
L100P/ Q31L |
|
|
Латентный период перехода, с |
120,73±21,2 |
141,16±20,19 |
143,88±18,92 |
123,24±23,53 |
157,01±13,92 |
123,78±17,85 |
149,78±19,15 |
143,36±21,25 |
|
N |
8 |
10 |
11 |
8 |
7 |
13 |
8 |
8 |
В данном исследовании использовались гетерозиготные мыши с мутациями, патологические характеристики которых в полной мере проявляются в гомозиготном состоянии. Поэтому эта работа дает возможность сравнить предрасположенности к психопатологиям у мышей Q31L+/–, L100P+/– и L100P/Q31L. Сравнительная характеристика обнаруженных поведенческих фенотипов приведена в табл. 7.
Таблица 7
Сравнение обнаруженных поведенческих фенотипов у мышей, мутантных по гену DISC1
|
Поведение (тест) |
Самцы |
Самки |
||||
|
Q31L+/– |
L100P+/– |
L100P/Q31L |
Q31L+/– |
L100P+/– |
L100P/Q31L |
|
|
Тревожность (ПКЛ) |
= |
= |
= |
> |
= |
= L |
|
Исследовательская активность (ПКЛ) |
> |
= |
= L |
= |
= |
= Q |
|
Тревожность (ОП) |
= |
= |
= |
> |
= |
> Q |
|
Двигательная активность (ОП) |
= |
= |
= |
= |
< |
< L |
|
Рабочая память (ТЛ) |
= |
= |
= |
= |
= |
= |
|
Социальная мотивация (СТ) |
= |
> |
= |
– |
– |
– |
|
Неподвижность (ПХ) |
= |
= |
= Q |
= |
= |
= |
|
Реакция вздрагивания |
= |
= |
= Q |
< |
= |
= L |
|
Престимульное торможение реакции вздрагивания (PPI) |
> |
> (78, 86) |
= L |
> (78, 82, 86) |
< (72) |
= Q (78, 82, 86) LQ (72) |
|
Память страха (ПС) |
= |
= |
= |
= |
= |
= |
Примечание. Символами <, > и = показано сравнение с WT того же пола – меньше, больше и не отличается соответственно; символ «–» означает «не изучались». Фенотипическое сходство мышей DISC1-L100P/Q31L с DISC1-L100P+/– и DISC1-Q31L+/– того же пола отмечено буквами L и Q соответственно, а промежуточное положение – LQ. Для теста PPI отмечены также сигналы (дБ), в ответ на который торможение различалось с контролем либо имело сходство с другой линией.
Проведенные тесты позволяют оценить такие компоненты эмоционального поведения, как активность, тревожность и поведенческое отчаяние. Согласно данным литературы, мыши с мутацией DISC1-L100P проявляют гиперактивность в ОП: гомо-, но не гетерозиготные самцы [14], гомо- и гетерозиготные самцы и самки [27]. В проведенной нами работе ее не было показано для мышей L100P+/–, при этом самки L100P/Q31L проявляли меньшую двигательную активность, чем WT в 2 тестах. Объяснить такое снижение замиранием мышей в начале теста «открытое поле» можно только у самок L100P+/–, так как оно у них заметно повышено. Это не исключает большее количество и/или длительность замираний в течение остального времени эксперимента у самок Q31L+/– и L100P/Q31L, что может быть следствием большей чувствительности этих мышей к аверсивным условиям теста (яркому свету). В пользу повышенной тревожности [28] этих самок говорит и большее время нахождения их по периметру установки, нежели в центре. Стоит отметить, что повышенную тревожность в ПКЛ, выражающуюся в предпочтении закрытых рукавов лабиринта открытым, проявили только самки Q31L+/–, в то время как поведение самок с двумя мутациями, как и L100P+/–, не отличалось от контроля. Таким образом, учитывая большую ориентированность теста ПКЛ на измерение тревожности, самки L100P/Q31L являются скорее более эмоциональными, а не тревожными, с повышенной чувствительностью к неизбегаемым условиям "открытого поля". В отношении всех мутантных самцов такие тенденции не прослеживаются: ни их активность, ни тревожность в ОП и ПКЛ не отличалась от контрольных, но при этом в начале теста «открытое поле» все они замирали меньше WT. В целом отсутствие повышенной двигательной активности может объясняться различиями в методике проведения ОП. Так, например, в исследовании [29] 10-минутный тест не показал отличий в активности гомозиготных самцов L100P–/– от контроля, так же, как и в данной работе, поскольку использовалось регулярное освещение экспериментальной установки, а не более интенсивное освещение (500–600 Люкс), при котором данная линия проявляет гиперактивность [18].
Исследовательская активность в ПКЛ оценивалась как частота заглядываний под лабиринт: она была повышена у самцов Q31L+/–, а среди самок – у L100P+/– снижена относительно самок Q31L+/–, что не совпадает с результатами исследования гетеро- и гомозигот DISC1-L100P [27]. Это также, возможно, связано с различиями экспериментальных условий между лабораториями, и как показано ранее, ПКЛ является тестом чувствительным к изменениям, например, освещения, материала из которого сделан ПКЛ [30].
Социальный дефицит и поведенческое отчаяние – показатели депрессивноподобного поведения, которое проявляется у гомозиготных мышей DISC1-Q31L–/– [14]. В данной работе социальное поведение у всех групп самцов было в норме, что говорит в пользу отсутствия социальных нарушений у мышей, несущих только одну мутацию DISC1-Q31L. Поведенческое отчаяние, выражающееся в длительности замирания при подвешивании за хвост, отсутствовало у всех мышей, подтверждая ранние исследования гетерозигот мутантных линий [14], однако этот показатель у самцов L100P/Q31L отличался от L100P+/– и был больше похож на Q31L+/–. Таким образом, полученные нами результаты позволяют говорить о недостаточности влияния только одной аллели с мутацией DISC1-Q31L для проявления у мышей депрессивноподобного эндофенотипа.
Нарушения когнитивного поведения, сходные с симптомами шизофрении, являются наиболее перспективными в ее моделировании. При сравнении показателей PPI у L100P+/– и L100P/Q31L с Q31L+/– (у которых не проявляется нарушений даже в гомозиготном состоянии) можно увидеть относительный дефицит престимульного торможения реакции вздрагивания у самок L100P+/–, что особенно заметно в ответ на сигнал мощностью 72 дБ, и самцов этого генотипа в ответ на стимулы в 72 и 78 дБ. Примечательно, что самки L100P+/– полностью отличались от самцов, демонстрируя дефицит PPI, и, следовательно, в гетерозиготном состоянии проявляя шизофреноподобное поведение. Также у самцов с двумя мутациями был снижен его уровень в ответ на все стимулы, не отличаясь при этом от L100P+/–, а PPI у самок L100P/Q31L был несколько ближе к Q31L+/–, принимая промежуточное значение между L100P+/– и Q31L+/– для 72 дБ. Ранние исследования показали негативный эффект мутации DISC1-L100P на PPI у мышей [14]: значительный дефицит наблюдался у L100P–/–, но менее выраженный у L100P+/– и L100P/Q31L, что схоже с наблюдаемой в нашей работе картиной.
Выработка условной реакции пассивного избегания не отличалась между генотипами в гетерозиготном состоянии, в отличие от гомозиготных мышей линий DISC1-Q31L–/– и DISC1-L100P–/– [6], что свидетельствует о рецессивности данных мутаций в отношении памяти страха. То же самое наблюдается и с рабочей памятью, измеренной в Т-образном лабиринте.
В целом наблюдались различия и сходства у мышей, несущих 2 мутации в гене DISC1, с L100P+/– в одних тестах и Q31L+/– – в других, однако мутация DISC1-L100P влияла на поведение мышей в большей степени, приводя к связываемым с шизофреноподобным эндофенотипом нарушениям. При дальнейшем исследовании модели DISC1-L100P/Q31L возможно подтверждение его наличия с помощью более валидных тестов, например, на латентное торможение. Целесообразно также изучить взаимодействие сочетания 2 данных мутаций с окружающей средой. В частности известно, что материнская иммунная активация приводит к усугублению проявлений шизофреноподобного поведения у гетерозиготных самцов L100P+/– [19]. В то же время хроническое социальное поражение вызывает у них проявление тревожной симптоматики [31], а, учитывая неоднозначность реакции на него у гетерозиготных мышей Q31L+/–, перспективно исследование совместного взаимодействия мутаций DISC1-L100P и DISC1-Q31L с этим стрессором для изучения модели.
Заключение
В ходе работе были получены мыши, гетерозиготные по 2 мутациям в гене DISC1 (L100P и Q31L), для которых были выявлены особенности в тестах на эмоциональное (открытое поле) и когнитивное поведение (PPI), а также показаны половые различия в уровне тревожности и двигательной активности. В тесте на социальное поведение отличий найдено не было. В связи с когнитивными нарушениями в тесте PPI и потенциальной уязвимости к специфическим факторам среды мыши DISC1-L100P/Q31L представляют интерес для дальнейшего изучения в качестве перспективной экспериментальной модели шизофрении.
Благодарности
В работе использованы генетические линии мышей, входящие в состав уникальной научной установки (УНУ) «Биологическая коллекция – генетические биомодели нейропсихических заболеваний» (№ 493387) НИИФФМ. Работа выполнена при поддержке Комплексной программы фундаментальных исследований СО РАН «Междисциплинарные интеграционные исследования» (2018–2020 гг.), название проекта: «Комплексный подход для создания антипсихотиков нового поколения».
Список источников
- Chubb J.E., Bradshaw N.J., Soares D.C., Porteous D.J. Millar J.K., The DISC locus in psychiatric illness. Molecular Psychiatry. 2008; 13 (1): 36–64. DOI:10.1038/sj.mp.4002106
- Bradshaw N.J., Porteous D.J. DISC1-binding proteins in neural development, signaling and schizophrenia. Neuropharmacology. 2012; 62 (3): 1230–41. DOI:10.1016/j.neuropharm.2010.12.027
- Cross-Disorder Group of the Psychiatric Genomics Consortium, et al. Genetic relationship between five psychiatric disorders estimated from genome-wide SNPs. Nat. Genet. 2013; 45 (9): 984–94. DOI:10.1038/ng.2711
- Network and Pathway Analysis Subgroup of Psychiatric Genomics Consortium. Psychiatric genomewide association study analyses implicate neuronal, immune and histone pathways. Nature Neurosci. 2015; 18 (2): 199–209. DOI:10.1038/nn.3922
- Lipina T.V., Roder J.C. Disrupted-In-Schizophrenia-1 (DISC1) interactome and mental disorders: impact of mouse models. Neurosci Biobehav Rev. 2014; 45: 271–94. DOI: 10.1016/j.neubiorev.2014.07.001
- Arguello P.A., Gogos J.A. Modeling madness in mice: one piece at a time. Neuron. 2006; 52 (1): 179–96. DOI:10.1016/j.neuron.2006.09.023
- Lewis D.A., Levitt P. Schizophrenia as a Disorder of Neurodevelopment. Annual Review of Neuroscience. 2002; 25 (1): 409–32. DOI:10.1146/annurev.neuro.25.112701.142754
- Samson J.N., Wong A.H.C. Chapter 1 The Genetics of Schizophrenia. In: Drug Discovery for Schizophrenia. The Royal Society of Chemistry. – 2015; pp. 1–27. DOI:10.1039/9781782622499-00001
- Wang S-M., Han C., Lee S-J., Jun T-Y., Patkar A.A., Masand P.S., Pae C-U. Second Generation Antipsychotics in the Treatment of Major Depressive Disorder: An Update. Chonnam Med J. 2016; 52 (3): 159–172. DOI: 10.4068/cmj.2016.52.3.159
- Whiteford H.A., Ferrari A.J., Degenhardt L., Feigin V., Vos T. The Global Burden of Mental, Neurological and Substance Use Disorders: An Analysis from the Global Burden of Disease Study 2010. PLOS ONE. 2015; 10 (2): e0116820. DOI:10.1371/journal.pone.0116820
- Häfner H., Maurer K., An der Heiden W. ABC schizophrenia study: an overview of results since 1996. Soc Psychiatry Psychiatr Epidemiol. 2013; 48 (7): 1021–31. DOI:10.1007/s00127-013-0700-4
- Samsom J.N., Wong A.H.C. Schizophrenia and Depression Co-Morbidity: What We have Learned from Animal Models. Frontiers in Psychiatry. 2015; 6. DOI:10.3389/fpsyt.2015.00013
- Петрова Е.С., Громова А.В., Анисименко М.С., Рубан Л.А., Егорова С.А., Петровская И.Ф., Амстиславская Т.Г., Липина Т.В. Поддержание генетически модифицированных линий мышей: вклад в развитие биоколлекций в России. Лабораторные животные для научных исследований. 2018; 2. DOI:10.29296/2618723X-2018-02-01
- Clapcote S.J., Lipina T.V., Millar K.J. Mackie S., Christie S., Ogawa F., Lerch J.P., Trimble K., Uchiyama M., Sakuraba Y., Kaneda H., Shiroishi T., Houslay M.D., Henkelman R.M., Sled J.G., Gondo Y., Porteous D.J., Roder J.C. Behavioral phenotypes of Disc1 missense mutations in mice. Neuron. 2007; 54 (3): 387–402. DOI:10.1016/j.neuron.2007.04.015
- Lipina T.V., Fletcher P.J., Lee F.H., Wong A.H., Roder J.C. Disrupted-in-schizophrenia-1 Gln31Leu polymorphism results in social anhedonia associated with monoaminergic imbalance and reduction of CREB and β-arrestin-1,2 in the nucleus accumbens in a mouse model of depression. Neuropsychopharmacology. 2013; 38 (3): 423–36. DOI:10.1038/npp.2012.197
- Lipina T.V., Haque F.N., McGirr A., Boutros P.C., Berger T., Mak T.W., Roder J.C., Wong A.H. Prophylactic valproic acid treatment prevents schizophrenia-related behaviour in Disc1-L100P mutant mice. PLOS One. 2012; 7 (12): e51562. DOI:10.1371/journal.pone.0051562
- Lipina T.V., Kaidanovich-Beilin O., Patel S., Wang M., Clapcote S.J., Liu F., Woodgett J.R., Roder J.C. Genetic and pharmacological evidence for schizophrenia-related Disc1 interaction with GSK-3. Synapse. 2011; 65 (3): 234–48. DOI:10.1002/syn.20839
- Lipina T.V., Niwa M., Jaaro-Peled H., Fletcher P.J., Seeman P., Sawa A., Roder J.C. Enhanced dopamine function in DISC1-L100P mutant mice: implications for schizophrenia. Genes Brain Behav. 2010; 9 (7): 777–89. DOI:10.1111/j.1601-183x.2010.00615.x
- Lipina T.V., Zai C., Hlousek D., Roder J.C., Wong A.H. Maternal immune activation during gestation interacts with Disc1 point mutation to exacerbate schizophrenia-related behaviors in mice. J. Neurosci. 2013; 33 (18): 7654–66. DOI:10.1523/JNEUROSCI.0091-13.2013
- Willner P. The validity of animal models of depression. Psychopharmacology (Berl). 1984; 83 (1): 1–16. DOI:10.1007/BF00427414
- Rodgers R.J., Cole J.C. (1994) The elevated plus-maze: pharmacology, methodology and ethology. In: Cooper SJ, Hendrie CA (eds) Ethology and psychopharmacology. Wiley, Chichester: 9–44.
- Seibenhener M. L., Wooten M. C. Use of the Open Field Maze to Measure Locomotor and Anxiety-like Behavior in Mice. JoVE. 2015; (96), e52434. DOI:10.3791/52434
- Berrocoso E., Ikeda K., Sora I., Uhl G.R., Sánchez-Blázquez P., Mico J.A. Active behaviours produced by antidepressants and opioids in the mouse tail suspension test. International Journal of Neuropsychopharmacology. 2013; 16 (1): 151-62. DOI:10.1017/S1461145711001842
- Kaidanovich-Beilin O, Lipina T, Vukobradovic I, Roder J, Woodgett JR. Assessment of social interaction behaviors. JoVE. 2011; (48): e2473. DOI:10.3791/2473
- Lipina T.V., Palomo V., Gil C., Martinez A., Roder J.C. Dual inhibitor of PDE7 and GSK-3-VP1.15 acts as antipsychotic and cognitive enhancer in C57BL/6J mice. Neuropharmacology. 2013; 64: 205–14. DOI:10.1016/j.neuropharm.2012.06.032
- Дубровина Н.И., Храпова М.В., Липина Т.В. Особенности формирования памяти о страхе у мышей с депрессивно- и шизофреноподобным фенотипами: влияние пола и возраста. Рос. физиол. журн. им. И.М. Сеченова. 2017; 103 (1): 10–21.
- Walsh, J., Desbonnet, L., Clarke, N., Waddington, J.L., O’Tuathaigh, C.M. Disruption of exploratory and habituation behavior in mice with mutation of DISC1: an ethologically based analysis. J. Neurosci. Res. 2012; 90 (7): 1445–53. DOI:10.1002/jnr.23024
- Prut L., Belzung C. The open field as a paradigm to measure the effects of drugs on anxiety-like behaviors: a review. Europ J Pharmacol. 2003; 463 (1-3): 3–33. DOI:10.1016/S0014-2999(03)01272-X
- Cui L., Sun W., Yu M., Li N., Guo L., Gu H., Zhou Y. Disrupted-in-schizophrenia1 (DISC1) L100P mutation alters synaptic transmission and plasticity in the hippocampus and causes recognition memory deficits. Molecular Brain. 2016; 9 (1). DOI:10.1186/s13041-016-0270-y
- Rodgers R.J., Johnson N.J. Factor analysis of spatiotemporal and ethological measures in the murine elevated plus-maze test of anxiety. Pharmacol. Biochem. Behav. – 1995. Vol. 52; 2: 297–303.
- Haque F.N., Lipina T.V., Roder J.C., Wong A.H.C. Social defeat interacts with Disc1 mutations in the mouse to affect behavior. Behavioural Brain Research. 2012; 233 (2): 337–44. DOI:10.1016/j.bbr.2012.05.037



