Моделирование у мышей C57BL/6J повторной описторхозной инфекции трематодой O. felineus (Rivolta, 1884)
Вишнивецкая Г.Б., Катохин А.В., Напримеров В.А., Завьялов Е.Л., Августинович Д.Ф. Моделирование у мышей C57BL/6J повторной описторхозной инфекции трематодой O. felineus (Rivolta, 1884). Лабораторные животные для научных исследований. 2019; 2. https://doi.org/10.29296/2618723X-2019-02-01
Резюме
Описторхоз – инфекционное заболевание, возникающее при попадании личинок трематод семейства Opisthorchiidae в желудочно-кишечный тракт млекопитающих. Основным возбудителем описторхоза в Европе и РФ является представитель данного семейства – кошачья двуустка, Opisthorchis felineus (O. felineus).
В настоящее время описторхоз рассматривают как системное заболевание, при котором страдает не только печень, основное место локализации паразитов, и другие органы и системы, в том числе центральная нервная. Поэтому актуально исследование этой паразитарной инфекции и моделирование описторхоза на лабораторных животных.
На самцах мышей линии C57BL/6J моделировали хронический описторхоз при однократном и двукратном инфицировании животных метацеркариями трематоды O. felineus, полученными из инфицированных язей, выловленных из реки Обь в Новосибирской области. Все эксперименты проводили в SPF-виварии. Сравнивали 3 группы животных: 1-я – контрольные неинфицированные (n=10); 2-я – однократно инфицированные личинками O. felineus (n=12); 3-я – повторно инфицированные через 3 мес после 1-й инвазии (n=18).
Введение личинок осуществляли внутрижелудочно с помощью специализированных зондов. Через 6 мес от начала эксперимента было обнаружено большее количество гельминтов в печени мышей после двукратного инфицирования по сравнению с однократным. Причем увеличение числа гельминтов отмечено за счет неполовозрелых форм паразита, при этом размер половозрелых форм O. felineus варьировал от 1,5 до 3 мм.
На фоне двукратного инфицирования установлено усиление негативного воздействия гельминтов на физиологическое состояние хозяина паразита. У этих животных наблюдалась повышенная активность фермента аланинаминотрансферазы (АЛТ) в сыворотке крови, основного маркера воспалительных процессов в печени. Кроме того, у мышей снижалась масса тела к концу эксперимента и наблюдалась гепатоспленомегалия. При однократном инфицировании увеличения весовых индексов печени и селезенки были менее выраженными, а активность АЛТ не отличалась от контрольных значений.
Следовательно, мыши линии C57BL/6J могут быть использованы для моделирования описторхоза в лабораторных условиях, причем двойное инфицирование оказывает более выраженное негативное воздействие на организм хозяина.
Введение
Описторхоз — инфекционное заболевание, возникающее при попадании личинок трематод семейства Opisthorchiidae в желудочно-кишечный тракт млекопитающих. Инфицирование происходит при поедании недостаточно термически обработанной рыбы из семейства карповых (Cyprinidae), которая является носителем метацеркарий — личинок этого опасного для человека паразита. Основной возбудитель описторхоза в Европе и России — представитель данного семейства — кошачья двуустка, Opisthorchis felineus (O. felineus). В качестве дефинитивного хозяина O. felineus, кроме человека, зарегистрировано 33 вида рыбоядных млекопитающих [1]. Самый крупный очаг O. felineus-индуцированного описторхоза находится в Обь-Иртышском бассейне. Степень зараженности населения в прибрежных областях рек Обь и Иртыш, охватывающих 14 регионов РФ и 4 региона Казахстана с населением приблизительно 15 млн человек, равна 500 человек на 100 000 населения, при этом в некоторых сельских районах средней части реки Обь эта величина достигает 100% [2, 3].
Внедряясь в желчные протоки печени, личинки O. felineus способствуют развитию заболеваний, прежде всего печени. На фоне хронического описторхоза развиваются такие заболевания, как холангит, холангиохолецистит, холангиогепатит, холангитический цирроз печени [4]. Отмечают связь между описторхозом, вызванным O. felineus, и опухолями в печени [5, 6]. Кроме того, описторхоз рассматривают как системное заболевание, при котором происходят нарушения в других органах и системах организма, вплоть до центральной нервной системы (ЦНС) [7].
Актуальность исследования особенностей инвазии паразита и системных изменений в организме хозяина после заражения O. felineus обусловлена продолжающимся поиском эффективной терапии этого заболевания. Однако проведение этих исследований требует удобных, дешевых и легко воспроизводимых моделей описторхоза. Чаще всего описторхоз моделируют на сирийских хомячках, что объясняется лучшей приживаемостью описторхид у этих животных. Иногда исследования проводят на других представителях млекопитающих (лисицах, песчанках, крысах), еще реже используют мышей, хотя в природных популяциях гельминт O. felineus обнаруживается у разных мышеобразных грызунов (водяная и европейская рыжая полевка, малая лесная, желтогорлая, полевая и домовая мыши) [8]. Обнаружена равная степень заражения личинками O. felineus у сирийских хомячков и мышей линии C57BL/6 на острой стадии (2 нед) экспериментального описторхоза [9], тогда через 6 мес после инфицирования наблюдаются значительные межвидовые различия по количеству паразитов в желчных протоках печени. При равной дозе инфицирования (100 метацеркарий на 1 животное) у хомячков отмечалось 32,0±2,0 паразитов [10], тогда как у мышей только 10,9±4,0 [11]. Однако учитывая разницу в массе печени у инфицированных животных (около 2 г – у мышей и 6,5–7 г – у хомячков), паразитарная нагрузка (количество паразитов на 1 г печени) у 2 видов животных оказалась сопоставимой. На основании этих данных было высказано предположение, что мыши линии C57BL/6J также могут быть использованы для моделирования описторхоза в лабораторных условиях.
Поскольку в природных популяциях инфицирование млекопитающих происходит зачастую многократно, в нашей работе исследовали эффективность инфицирования и развитие паразитов при однократном и двукратном введении личинок трематоды O. felineus мышам линии C57BL/6J. При этом планировали оценить не только степень инфицирования животных, но и их состояние по ряду физиологических показателей, поскольку известно, что кратность заражения во многих случаях коррелирует со степенью проявления патологических признаков у хозяина паразита [12].
Материал и методы
Животные. Работа выполнена на базе ЦКП «SPF-виварий» Института цитологии и генетики Сибирского отделения РАН (ИЦиГ СО РАН). В исследовании были использованы 40 самцов мышей в возрасте 11–12 нед. Животные содержались в клетках OptiMICE (Animal Care Systems, США), оснащенных индивидуальной системой подачи чистого воздуха, на базе ЦКП «SPF-виварий» ИЦиГ СО РАН при искусственном световом режиме 10:2:12 ч (свет:сумерки:темнота), температуре воздуха 22–26°С и влажности 40–50%. Животные имели свободный доступ к воде и гранулированному корму для лабораторных грызунов SPF-категории содержания «Чара» (ЗАО Ассортимент-Агро, Россия). Поили животных деионизированной водой, полученной на установке Millipore, после обогащения минеральной добавкой «Северянка» (ООО «Эко-Проект», Санкт-Петербург). В качестве подстилочного материала применяли обеспыленные гранулы лиственных пород древесины. Корм и подстилку перед каждым использованием автоклавировали при температуре 121°С. В каждой клетке было не более 4 мышей. Все процедуры проводили в соответствии с директивами European Communities Council от 24 ноября 1986 г. (86/609/EEC), а также заключением Комиссии по биоэтике ИЦиГ СО РАН (протокол № 26 от 13 марта 2015 г.).
Получение метацеркарий O. felineus. Личинки O. felineus были получены из инфицированных язей, выловленных из реки Обь в Новосибирской области. Рыбный фарш подвергали ферментативной обработке (11 мл концентрированной HCl + 7 г пепсина на 1 л воды) и инкубировали при температуре 37°C в течение ночи с последующей фильтрацией и осаждением в 0,9% растворе хлористого натрия. Под микроскопом определяли жизнеспособность отобранных метацеркарий для дальнейшего внутрижелудочного введения животным.
Процедура эксперимента. Животные были разделены на 3 группы: 1-я – контрольные (неинфицированные) животные (n=10); 2-я – однократно инфицированные личинками гельминтов O. felineus в дозе 90 метацеркарий на каждую особь (n=12); 3-я – повторно инфицированные через 3 мес после 1-го введения личинок паразита (n=18). Введение личинок осуществляли внутрижелудочно с помощью зондов (Braintree Scientific, Inc.). Через 6 мес от начала эксперимента всех мышей умерщвляли декапитацией и производили забор крови для дальнейшего биохимического исследования. Кроме этого, определяли массу печени и селезенки, которую далее пересчитывали на 1 г массы тела. Печень с желчным пузырем помещали в физиологический раствор для подсчета в дальнейшем числа марит O. felineus, извлеченных из желчных протоков. Состояние зрелости гельминтов определяли, используя микроскоп Altami CM0745 при 10 – 40-кратном увеличении.
Биохимический анализ. Цельную кровь, собранную при декапитации животных, центрифугировали (3000 об/мин, 20 мин, при 4°С), отделяли сыворотку, которую хранили при температуре -70°С до определения активности ферментов аланинаминотрансферазы (АЛТ) и аспартатаминотрансферазы (АСТ). При анализе использовали стандартные наборы реактивов (Analyticon Biotechnologies AG, Германия). Измерения выполнены на биохимическом полуавтоматическом анализаторе «Stat Fax 4500 Plus» (Awareness Technology, США).
Статистика. Все показатели оценивали с помощью однофакторного дисперсионного анализа с последующим post hoc сравнением групп по критерию Fisher LSD, используя пакет программ Statistica 6.0. Корреляции между показателями в группах определяли непараметрическим анализом по Спирмену (Spearman rank correlation coefficient). Данные представлены как среднее ±SEM. Различия считались статистически значимыми при p < 0,05 и на уровне тенденции – при 0,05 < p < 0,1.
Результаты и обсуждение
При подсчете количества гельминтов O. felineus в желчных протоках печени были установлены некоторые особенности, связанные с кратностью инфицирования животных. В обеих группах инфицированных мышей обнаружены как половозрелые мариты гельминтов с развитыми половыми органами, так и неполовозрелые, у которых визуализировались только 2 ветви кишечника, заполненные черным содержимым (рис. 1). При этом размер марит в обоих случаях варьировал. После однократного инфицирования, наряду с мелкими незрелыми маритами, были половозрелые размером около 3 мм. После двукратного инфицирования также присутствовали мелкие неполовозрелые мариты, а размер половозрелых варьировал от 1,5 до 3 мм.
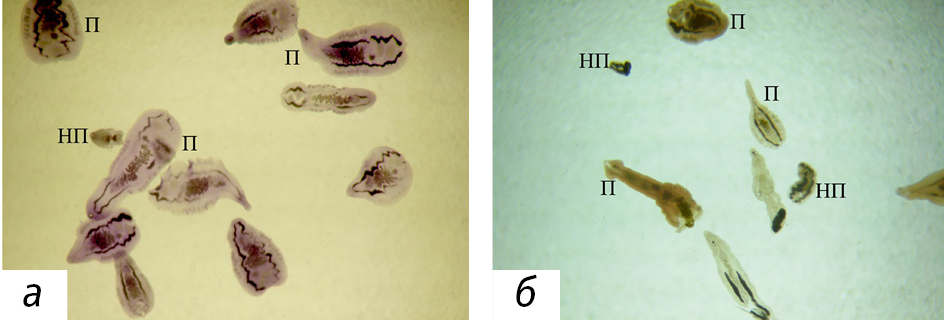
Таким образом, можно предположить, при каждом последующем инфицировании мышей время созревания паразитов увеличивается. Подсчет всех гельминтов показал, через 6 мес после однократного инфицирования в печени мышей присутствовали преимущественно взрослые мариты O. felineus (рис. 2). При повторном инфицировании через 3 мес после первого число мелких неполовозрелых марит в печени мышей было больше, чем после однократного (p < 0,05), при этом несколько увеличивалось и число половозрелых. Обратную зависимость величины тела O. felineus от интенсивности заражения хозяина паразита отмечают и другие исследователи [13].
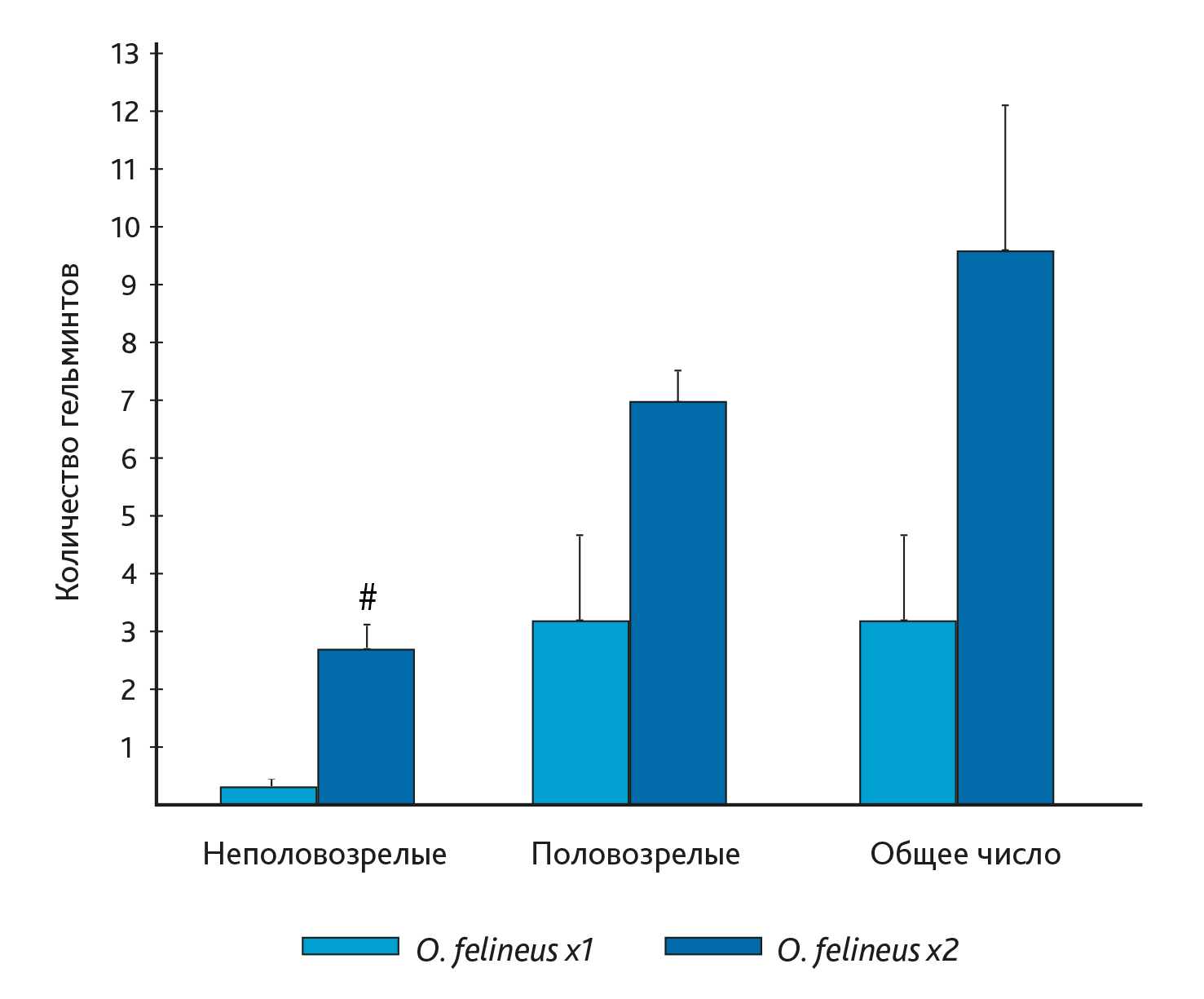
Примечание: # p < 0‚05 – по сравнению с однократным инфицированием.
Согласно полученным данным можно заключить, что у мышей для созревания гельминтов требуется более 3 мес, причем повторное инфицирование животных увеличивает срок созревания вновь внедрившихся паразитов. Это отличает мышей от хомячков, у которых уже через 2 нед после инфицирования личинками O. felineus все мариты были половозрелыми [9]. Видимо, этим объясняется то, что при моделировании описторхоза в лабораторных условиях чаще всего используют сирийских хомячков и лишь в единичных случаях – мышей [14, 15]. Учитывая, что мыши – всеядные животные, а хомячки питаются преимущественно растительной пищей, не рыбой, которая является промежуточным хозяином для описторхид, можно предположить, что у мышей эволюционно выработались механизмы устойчивости против трематодных инфекций. Следует подчеркнуть, что выявление этих механизмов сопротивления трематодным инфекциям – не менее важная задача, чем изучение механизмов повышенной чувствительности к заражению. Оба этих направления исследования в равной степени актуальны в борьбе с описторхозной патологией у людей и животных. Возможно, устойчивость к инфекции O. felineus связана с высоким уровнем иммунной защиты у мышей. Так, по сравнению с сирийскими хомячками, у мышей C57BL/6J в крови значительно выше уровень лимфоцитов [9], главных клеток, осуществляющих контроль и иммунную защиту организма при инфекциях. Кроме того, у них почти в 2 раза больше относительная масса селезенки [9], основного органа периферической иммунной системы, в котором происходит пролиферация и дифференцировка T- и B-лимфоцитов крови. Как показали наши результаты, масса селезенки возрастает значительно на фоне инфицирования O. felineus у мышей обеих групп, причем в большей степени при двукратном инфицировании (рис. 3). При этом в обеих группах инфицированных животных относительные массы печени и селезенки коррелировали с общим число паразитов, извлеченных из печени (при однократном инфицировании: r=0,86, p=0,001 и r=0,73, p=0,011 соответственно; при двукратном инфицировании r=0,61, p=0,009 и r=0,71, p=0,001 соответственно). Учитывая то, что у мышей с двойным инфицированием снижалась масса тела и увеличивалась относительная масса печени и селезенки, можно говорить о более тяжелых последствиях повторного инфицирования личинками трематоды O. felineus у мышей C57BL/6J.
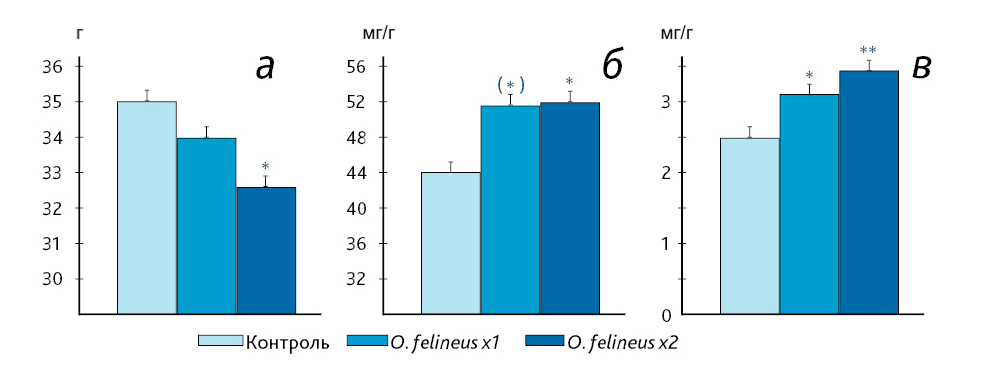
Примечание. * – p < 0‚05; ** – p < 0‚01; (*) – 0‚05 < p < 0‚1 (тенденция) – по сравнению с контролем.
Результаты биохимических исследований подтверждают это предположение. Установлено, что у мышей после двукратного инфицирования повышается активность фермента АЛТ – главного маркера различных заболеваний печени (рис. 4). Поскольку этот показатель статистически значимо коррелировал с числом гельминтов как при однократном (r=0,81, p=0,004), так и при двукратном (r=0,66, p=0,015) инфицировании животных, можно говорить, что изменение этого показателя обусловлено развитием экспериментального описторхоза. Повышенный уровень активности другого фермента – АСТ – был обнаружен у мышей через 6 мес после однократного инфицирования, при двукратном инфицировании значение этого показателя было средним между показателем в контрольной группе мышей и у мышей с однократным инфицированием. Поскольку корреляционной связи между активностью АСТ и общим числом паразитов в печени в обоих случаях инфицирования не установлено (r=0,04, p=0,919 – при однократном и r=0,14, p=0,636 – при двукратном инфицировании), можно полагать, что АСТ в меньшей степени, чем АЛТ, отражает развитие патологического процесса. Тем более, что и в процентном отношении повышение уровня АЛТ при однократном и двукратном инфицировании было более выраженным (на 40 и 103% соответственно), чем повышение АСТ (на 25 и 11% соответственно). Фермент АЛТ находится в цитоплазме гепатоцитов, а АСТ является митохондриально-цитоплазматическим ферментом с выраженным преобладанием в митохондриях [16]. Повышение АСТ в крови свидетельствует о поражении преимущественно митохондрий, а повышение АЛТ – о более глубоких нарушениях в клетке, связанных с нарушением целостности плазматических мембран гепатоцитов. Таким образом, полученные биохимические данные свидетельствуют о более значимых нарушениях в печени у мышей на фоне двукратного инфицирования трематодой O. felineus, чем и обусловлена гибель гепатоцитов.
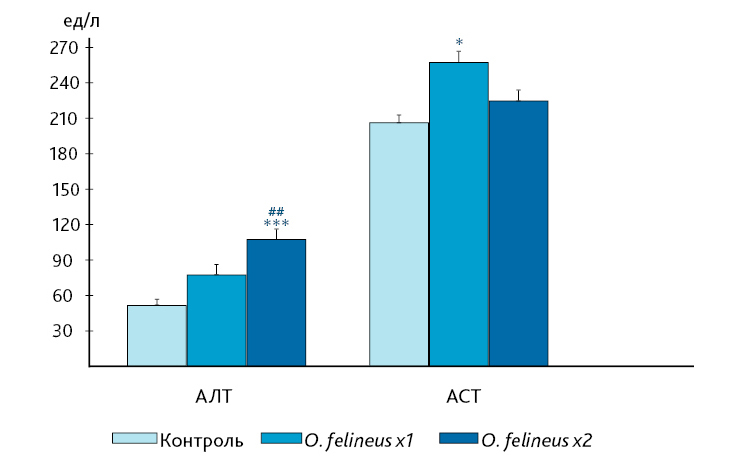
Примечание. * p < 0‚05; *** p < 0‚001; – по сравнению с контролем; ## p < 0‚01 – по сравнению с однократным инфицированием.
У людей хронический описторхоз приводит к изменению системы взаимодействий изучаемых биохимических показателей, в том числе обнаруживается значимая связь между активностью АЛТ и АСТ [17]. В нашем исследовании была получена высокая корреляционная связь между активностью 2 ферментов у мышей при двукратном инфицировании (r=0,57, p=0,041), тогда как у контрольных особей и у животных с однократным инфицированием таких значимых корреляций не обнаружено (r=-0,29, p=0,492 и r=0,20, p=0,580 соответственно). Это также свидетельствует о более выраженном развитии патологического процесса у мышей после двукратного инфицирования.
Заключение
Как показали результаты проведенного исследования, мыши линии C57BL/6J, наравне с сирийскими хомячками, являются хорошим лабораторным объектом при моделировании O. felineus-вызванного описторхоза. Через 3 мес после инфицирования в желчных протоках печени животных обнаружены половозрелые и неполовозрелые мариты паразита. Повторное инфицирование мышей спустя 3 мес после 1-го увеличивало их количество преимущественно за счет числа неполовозрелых особей O. felineus. Двойное инфицирование оказывало более выраженное негативное воздействие на организм хозяина и сопровождалось повышением активности фермента АЛТ – основного маркера воспаления в печени. Кроме того, дважды инфицированные мыши характеризовались более выраженным снижением массы тела и увеличением весового индекса печени и селезенки, что является признаками описторхоза. Считаем, что мыши линии C57BL/6J могут быть использованы для исследования механизмов развития описторхоза, а также для преклинических исследований эффективности новых антигельминтных препаратов.
Благодарности
Работа выполнена при финансовой поддержке РФФИ (грант №17-04-00790) и бюджетного проекта ФИЦ ИЦиГ СО РАН (№0324-2019-0041). Исследования проведены с использованием оборудования Центра генетических ресурсов лабораторных животных ФИЦ ИЦиГ СО РАН, поддержанного Минобрнауки России (Уникальный идентификатор проекта RFMEFI62117X0015).
Список источников
- Бэер С.А., Беляков Ю.В., Сидоров Е.Г. Методы изучения промежуточных хозяев возбудителя описторхоза. Алма-Ата: Наука, 1987: 88.
- Беэр С.А. Биология возбудителя описторхоза. М.: Товарищество научных изданий КМК, 2005: 336.
- Yurlova N.I., Yadrenkina E.N., Rastyazhenko N.M., Serbina E.А., Glupov V.V. Opisthorchiasis in Western Siberia: Epidemiology and distribution in human, fish, snail, and animal populations. Parasitol. Int. 2017; 66 (4): 355–64. doi: 10.1016/j.parint.2016.11.017.
- Николаева Н., Николаева Л., Гигилева Н. Описторхоз (эпидемиология, клиника, диагностика, лечение). Врач, 2005; 7: 17–20.
- Байкова О.А., Николаева Н.Н., Грищенко Е.Г., Николаева Л.В. Холангиокарцинома, ассоциированная с хроническим описторхозом и клонорхозом. Здоровье и образование в XXI веке. 2018; 20 (4): 27–32.
- Яблоков Д.Д. Описторхоз человека. Томск: Наука, 1979; 237.
- Ахмедов В.А., Критевич М.А. Хронический описторхоз как полиорганная патология. Вестник НГУ. Серия: Биология, клиническая медицина. 2009; 7 (1): 118–21.
- Власов Е.А. Гельминты диких млекопитающих Центрально-Черноземного заповедника (фауна, экология, патогенное значение). Дисс. на соиск. уч. степ. канд. биол. наук. Курск, 2016; 167.
- Avgustinovich D.F., Orlovskaya I.A., Toporkova L.B., Vishnivetskaya G.B., Katokhin A.V., Lvova M.N., Kashina E.V., Bondar N.P., Feofanova N.A., Mordvinov V.A. Experimental opisthorchiasis: study of blood cell composition, hematopoiesis, and startle reflex in laboratory animals. Russ. J. Genet. Appl. Res. 2017; 7:82–92.
- Августинович Д.Ф., Вишнивецкая Г.Б., Пирожкова Д.С., Цыганов М.А., Вавилин В.А., Пахарукова М.Ю., Шилов А.Г., Дударев В.Г., Мордвинов В.А. Влияние N-(4-метил-3-хлорфенил)-2-ацетокси-3,5-дихлорбензамида на половозрелых и ювенильных особей O. felineus в условиях in vitro и in vivo. Сиб. научн. медицин. журн. 2017; 37 (3): 17–26.
- Avgustinovich D.F., Katokhin A.V., Kontsevaya G.V., Lvova M.N., Vishnivetskaya G.B., Kashina E.V., Marenina M.K., Maksimova G.A., Zav’yalov E.L., Mordvinov V.A. A comparative study of Opisthorchis felineus (Rivolta, 1884) infection in inbred C57BL/6 and outbred CD-1 mice. Паразитология. 2018; 52 (1): 19–31.
- Подклетнова Л.Ф., Степанова Т.Ф. Влияние кратности заражения на хозяино-паразитарные отношения при описторхозе. Мед. паразитол. паразитар. болезни. 2003; 1: 16–21.
- Сидоров Е.Г. Природная очаговость описторхоза. Алма-Ата: Наука, 1983: 240.
- Пельгунов А.Н. Разработка новых методов обеззараживания рыб и рыбной продукции от метацеркарий Opisthorchis felineus Rivolta, 1884. Рос. паразитол. журн. 2015; 3: 80–5.
- Nair S.S., Bommana A., Pakala S.B., Ohshiro K., Lyon A.J., Suttiprapa S., Periago M.V., Laha T., Hotez P.J., Bethony J.M., Sripa B., Brindley P.J., Kumar R. Inflammatory response to liver fluke Opisthorchis viverrini in mice depends on host master coregulator MTA1, a marker for parasite-induced cholangiocarcinoma in humans. Hepatology. 2011; 54(4):1388-97. doi: 10.1002/hep.24518.
- Кишкун А.А. Клиническая лабораторная диагностика: учебное пособие. М.:ГЭОТАР-Медиа. 2013; 976.
- Бакштановская И.В., Степанова Т.Ф. Анализ комплекса биохимических показателей функций печени при хроническом описторхозе. Мед. паразитол. паразитар. болезни, 2005; 4: 18–21.



