Сравнительное исследование использования высококалорийных диет, обогащенных разным количеством липидов, для моделирования метаболического синдрома
Ковалева М.А., Гущин Я.А., Макарова М.Н., Макаров В.Г. Сравнительное исследование использования высококалорийных диет, обогащенных разным количеством липидов, для моделирования метаболического синдрома. Лабораторные животные для научных исследований. 2019; 1. https://doi.org/10.29296/2618723X-2019-01-04
Резюме
В настоящее время одной из главных причин распространения резистентности к инсулину, которая в дальнейшем приводит к развитию ожирения, сахарного диабета 2-го типа и метаболического синдрома (МС), является особенность современного пищевого поведения человека, его склонность к неограниченному приему высококалорийной пищи. Питание – элемент образа жизни, который можно контролировать и тем самым непосредственно влиять на здоровье, как отдельного человека, так и нации в целом. В связи с этим воспроизведение МС у лабораторных животных с помощью высококалорийных диет, – наиболее рациональный и актуальный метод моделирования МС. Модель алиментарного ожирения позволяет понять причины развития и прогрессирования МС, а также исследовать потенциальные лекарственные препараты для его профилактики и лечения. Цель работы – сравнить степень выраженности проявлений патологических изменений липидного и углеводного обмена на фоне экспериментального метаболического синдрома у лабораторных мышей, индуцированного диетами, обогащенными разным содержанием липидов: D12451 (содержание жира 45%) и D12492 (содержание жира 60%). Начиная с 4-й недели исследования, у лабораторных мышей, получавших высококалорийные диеты, обогащенные липидами, наблюдали достоверное увеличение массы тела, которое к концу исследования составляло около 10% – в группе D12451 (содержание жира 45%) и 30% – в группе D12492 (содержание жира 60%). Выявлена умеренная гипергликемия и тенденция к повышению активности фермента дипептидилпептидазы 4-го типа. На 21-й неделе в группе животных, получавших D12492 (содержание жира 60%), в ходе глюкозотолерантного теста установлено развитие толерантности к глюкозе. На фоне применения исследуемых высококалорийных жировых диет у лабораторных мышей выявлены структурные и функциональные изменения в печени, что нашло отражение в снижении содержания гликогена в печени и развитие крупно- и мелкокапельного стеатогепатоза. На основании полученных результатов можно сделать вывод о возможности применения диет, обогащенных липидами на 45 и 60%, для моделирования экспериментального МС на молодых 8-недельных аутбредных самцах мышей. Установлены оптимальные сроки формирования устойчивых патологических изменений, характерных для алиментарного МС, которые составили: 13 нед – на фоне применения D12451 (содержание жира 45%) и 17 нед – на фоне применения D12492 (содержание жира 60%). Следует отметить, что применение более калорийного рациона D12492 с содержанием липидов 60% приводит к метаболическим нарушениям не только липидного, но и углеводного обмена, что нашло отражение в развитии толерантности глюкозы, установленной в ходе глюкозотолерантного теста.
Введение
Метаболический синдром представляет собой многофакторный комплекс патологических изменений в организме. Поэтому выбор адекватной экспериментальной модели – основополагающий фактор при изучении патогенеза данного состояния и поиска новых лекарственных препаратов для его терапии и лечения. С целью моделирования ожирения, дислипидемии и резистентности к инсулину у лабораторных грызунов применялись различные типы диет с высоким содержанием жиров. Стандартное соотношение основных нутриентов (по калорийности от суточного рациона) для грызунов, как правило, составляет около 26% белка, 63% углеводов и 11% жира, в то время как богатая жирами диета предполагает существенное увеличение их доли в рационе – до 60% от общей суточной калорийности.
В литературных источниках приводятся убедительные данные о том, что рацион грызунов с высоким содержанием жиров животного и растительного происхождения в течение нескольких недель приводит к развитию у лабораторных животных ожирения, гипергликемии и гиперинсулинемии, гипертриглицеридемии, нарушению толерантности к глюкозе, повышению уровня холестерина и липопротеинов низкой плотности (ЛПНП) [1–3]. Однако результаты моделирования МС на животных с помощью диеты, обогащенной только жирами, зависят от их генотипа, пола, возраста животного, а также продолжительности воздействия диеты. Несмотря на то, что диета с высоким содержанием жиров вызывает у грызунов развитие большинства симптомов МС, характерных для человека, она существенно отличается от пищевого рациона человека, что следует учитывать при проведении доклинических исследований потенциальных препаратов для терапии МС.
Цель нашего исследования – сравнительное изучение стандартных высококалорийных диет, обогащенных разным содержанием липидов: D12451 – содержание 45% и D12492 – содержание 60% (Research Diets, Inc., США) для моделирования алиментарного метаболического синдрома на половозрелых аутбредных самцах мышей.
Материал и методы
Экспериментальное исследование выполнено на 60 половозрелых беспородных самцах лабораторных мышей. Возраст животных к началу исследования – 8 нед, масса – 25–30 г (питомник лабораторных животных НПО «Дом Фармации»), которые в период адаптации и последующего эксперимента содержались в стандартных условиях вивария. Исследование было выполнено с соблюдением принципов «Европейской конвенции о защите позвоночных животных, используемых для экспериментов и других научных целей» (Страсбург, 1986) в соответствии с правилами надлежащей лабораторной практики (Приказ Министерства здравоохранения Российской Федерации №199н от 01.04.2016 «Об утверждении Правил надлежащей лабораторной практики»). Исследование было одобрено на заседании биоэтической комиссии НПО «Дом Фармации» № БЭК 4.21/13.
Животные были разделены на 3 группы по 20 животных в каждой: 1-я группа – интактная, животные со стандартной диетой, получали корм для содержания лабораторных животных, приготовленный по ГОСТ Р 50258-92 (массовая доля жира не более 6%); 2-я группа – животные с экспериментальным МС, получали стандартную диету D12451 (содержание жира 45%, Research Diets, Inc., США), 3-я группа – животные с экспериментальным МС, получали стандартную диету D12492 (содержание жира 60%, Research Diets, Inc., США). Длительность исследования – 21 нед.
За развитием признаков МС наблюдали еженедельно по показателям: концентрация глюкозы в периферической крови и масса тела. Для оценки возможных морфологических изменений в печени на 4–6-й и 21-й неделе осуществляли эвтаназию животных (по 5 животных из каждой группы) с целью проведения гистологического исследования. На 21-й неделе дополнительно для оставшихся животных были проведены: глюкозотолерантный тест (ГТТ), определение активности депиптидилпептидазы 4-го типа (ДПП 4) в плазме крови и концентрации холестерина и триглицеридов в сыворотке крови. Также было определено содержание гликогена в гомогенате печени.
Массу тела экспериментальных животных регистрировали на 1-й, 4-й, 8-й, 12-й, 16-й, 21-й неделе. Процедуру осуществляли на электронных весах Vibra AJ-1200CE.
Определение глюкозы выполняли экспресс-методом при помощи глюкометра OneTouch Horizоn (Lifescan, США). Осуществляли забор крови у лабораторных мышей из хвостовой вены.
Глюкозотолерантный тест проводили у лабораторных животных натощак после 4 часового голодания, доступ к воде ограничен не был. Самцы мышей получали углеводную нагрузку раствором глюкозы (ЗАО «Вектон») внутрижелудочно в дозе 3 г/кг. Концентрацию глюкозы в крови измеряли в точках 0 (фоновое значение), 30, 60, 90 и 120 мин при помощи глюкометра OneTouch Horizоn (Lifescan, США).
Концентрации холестерина и триглицеридов определяли на биохимическом анализаторе Random Access А-25 (BioSystems, Испания) с использованием реагентов фирмы BioSystems (Испания) в пробах сыворотки крови без следов гемолиза.
Измерение ДПП-4 проводили однократно на 21-й неделе исследования спектрофотометрическим методом, применяя в качестве хромагенного субстрат Gly-L-Pro p-nitroanilide [4].
В соответствии с Директивой 2010/63/EU Европейского Парламента и Совета Европейского Союза по охране животных, используемых в научных целях от 22 сентября 2010 г. животные были эвтаназированы помещением в СО2-камеру, в условиях постепенного заполнения камеры диоксидом углерода. В процессе некропсии проводили забор печени у каждого животного и делили ее на 2 равные части. Одну часть для гистологического исследования фиксировали в 10% растворе забуференного формалина в течение 24 ч, после чего по общепринятой методике выполняли заливку материала в парафин. Далее изготавливали гистологические срезы толщиной 5–7 мкм, которые окрашивали гематоксилином и эозином. Морфологическое исследование гистологических препаратов выполнялось при помощи светооптического микроскопа Carl Zeiss (Германия). Критериями гистологической оценки служили баллонная дистрофия, крупно- и мелкокапельный стеатоз.
Вторую часть печени использовали для оценки содержания гликогена. После извлечения фрагмент печени замораживали при температуре -20°С в течение 24 ч. Далее точные навески органа измельчали, содержание гликогена печени проводили колориметрическим методом количественного определения моно-, олиго- и полисахаридов, основанным на их способности при нагревании с серной кислотой давать производное фурфурола, которое с антроном образует окрашенное соединение. Измерение проводили на многофункциональном спектрофотометре xMark (Bio-Rad, США) при длине волны 625 нм.
Результаты исследования оценивали с помощью пакета прикладных статистических программ Statistica 10.0 (StatSoft, США), и представляли их в виде среднего арифметического ± ошибка средней. Статистическую значимость различий 2 средних определяли с помощью критерия Тьюки. Нулевую статистическую гипотезу об отсутствии различий и связей отвергали при p<0,05.
Результаты и обсуждение
В группах самцов мышей, получавших стандартные высококалорийные диеты, с 4-й недели исследования наблюдали статистически значимое увеличение массы тела, которое сохранялось до конца эксперимента. Наибольший прирост массы тела наблюдали в группе, получавшей рацион D12492 с содержанием жира 60%. К 21-й неделе исследования масса тела животных данной группы в среднем была на 30% выше, чем в интактной группе, которая получала стандартный рацион с содержанием жира 6% (рис. 1).
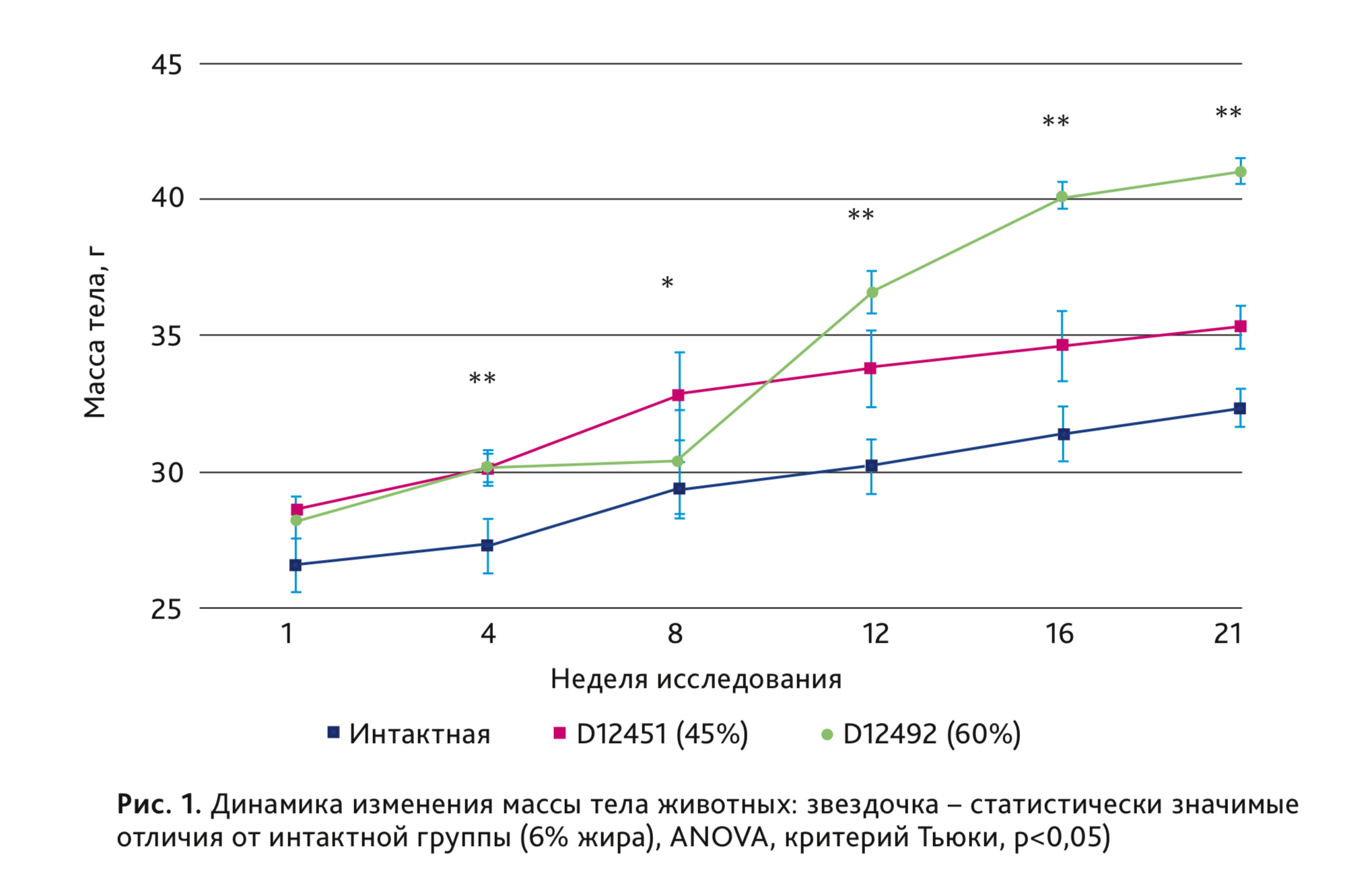
При изучении в сыворотке крови концентраций холестерина и триглицеридов клинически значимых изменений в группах животных, получавших высококалорийные рационы, выявлено не было. Способность аутбредных мышей поддерживать уровень холестерина и триглицеридов даже в условиях диеты с высоким и очень высоким содержанием жиров показывает, что они не склонны к развитию атеросклеротических повреждений, которые со временем могли бы привести к повышению артериального давления [5].
Одним из важнейших критериев МС является гипергликемия, обусловленная инсулинорезистентностью. Определение концентрации глюкозы в крови самцов мышей проводили еженедельно, натощак (Начиная с 5-й недели исследования наблюдали статистически значимые отличия между интактной группой (6% жира) и группами, получавшими высококалорийные рационы (ANOVA, критерий Тьюки, p<0,05; рис. 2).

Начиная со 2-й недели исследования, в группах животных, получавших высококалорийные рационы D12451 и D12492, концентрация глюкозы в крови натощак была статистически выше, чем у животных интактной группы. Данные изменения сохранялись до конца эксперимента, и в среднем увеличение составляло 35%. Гипергликемия была выражена больше у животных, получавших D12492 с содержанием жира 60%. Устойчивое повышение концентрации глюкозы в периферической крови у животных данной группы наблюдали с 13-й недели. Тогда, как в группе животных, получавших D12451 с содержанием жира 45%, устойчивое повышение концентрации глюкозы в периферической крови наблюдали с 17-й недели. Данные изменения ожидаемы, поскольку применение рациона с большим содержанием жиров у молодых грызунов приводит к большему увеличению концентрации глюкозы в крови, что и наблюдали с 17-й недели [6].
С целью подтверждения наличия у экспериментальных животных толерантности к глюкозе на 21-й неделе исследования проводили глюкозотолерантный тест. Концентрация глюкозы в крови животных была измерена в точках 0, 30, 60, 90, 120 мин. В ходе анализа гликемических кривых установлено, что в группе животных, получавших рацион, с содержанием липидов 60% жиров (D12492). В течение 21-й недели, развивалось нарушение метаболизма глюкозы: спустя 30 мин после введения раствора глюкозы животному в дозе 3 г/кг концентрация глюкозы в крови составила свыше 15 ммоль/л, через 120 мин – превышала 11 ммоль/л (ANOVA, р>0,05). В группе животных, получавших рацион, обогащенный содержанием липидов 45% жиров, на протяжении 21-й недели толерантности к глюкозе выявлено не было.
Механизм воздействия на организм диеты, обогащенной липидами, связывают со снижением экспрессии инсулиновых рецепторов, ингибированием окисления жирных кислот, уменьшением количества переносчика ГЛЮТ4 и нарушением его транслокации в клеточную мембрану. Возможно, поэтому продолжительное 21-недельное применение высококалорийной жировой диеты в конечном итоге приводит к умеренной гипергликемии и нарушению толерантности к глюкозе у мышей [7].
Согласно данным литературы, в клинической практике развитие МС часто сопровождается повышением активности фермента ДПП-4 [8, 9]. Точный механизм данных изменений неизвестен. Со временем данные нарушения приводят к преждевременной инактивации инкретиновых гормонов, в частности глюкагоноподобного пептида-1 (ГПП-1), что ведет к прогрессированию развития МС [10].
В нашем эксперименте у самцов мышей на 21-й неделе исследования был выполнен анализ активности ДПП-4 (табл. 1).
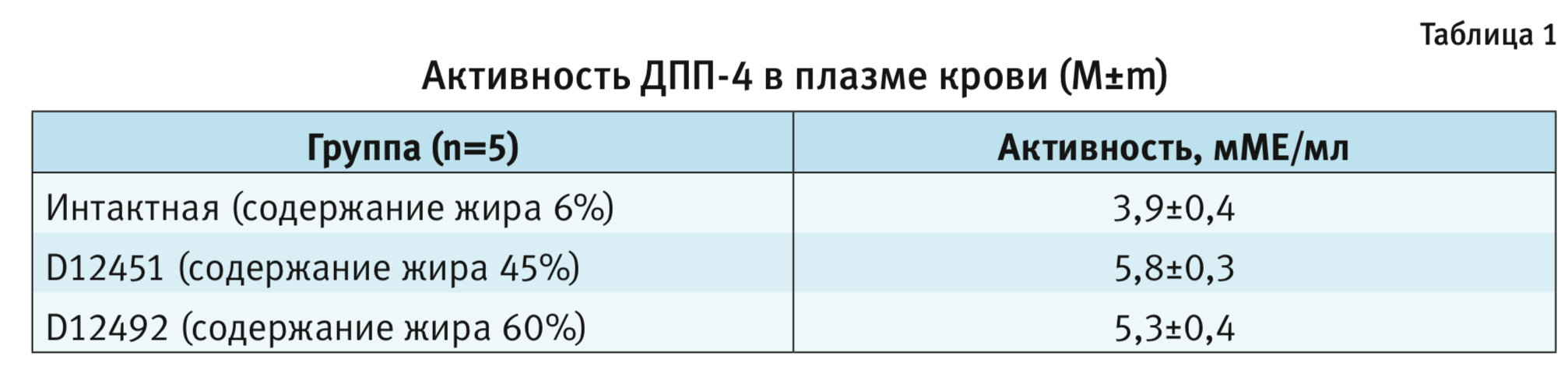
Статистически достоверных отличий между группами в активности ДПП-4 плазмы крови экспериментальных животных отмечено не было (ANOVA, р>0,05). Однако была выявлена тенденция к увеличению активности данного фермента в группах, получавших диеты с 45 и 60% содержанием липидов. Схожие изменения патобиохимических процессов наблюдаются и в организме человека при МС.
Накопление глюкозы в печени происходит в виде гликогена – полимеризованной формы глюкозы. Количественное определение гликогена в печени мышей было выполнено на 21-й неделе колориметрическим методом (табл. 2).
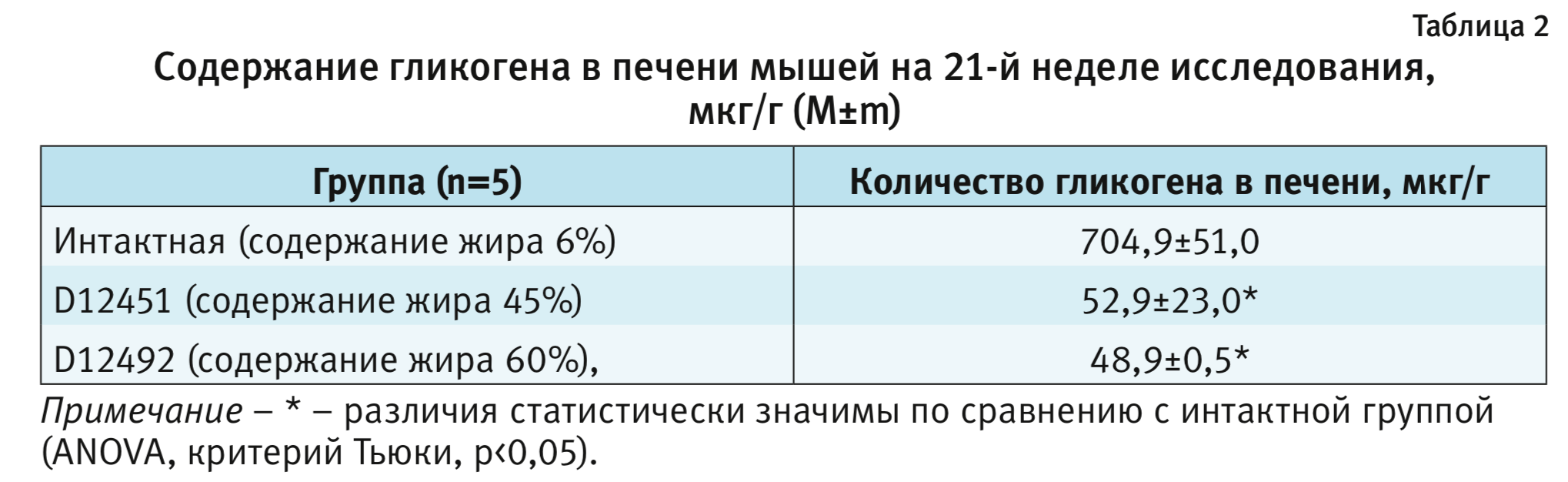
В группах животных, получавших высококалорийную диету, с содержанием липидов как 45%, так и 60%, наблюдали значительное снижение концентрации гликогена в гомогенате печени ≈ в 14 раз. Полученные данные могут быть связаны со снижением синтетической функции печени в результате пониженной активации гликогенсинтазы в результате инактивации субстрата инсулинового рецептора типов 1 и 2 (IRS-1 и IRS-2) протеинкиназой С-ε (PKC-ε). По данным литературы снижение содержания гликогена в печени является одним из основных показателей развития алиментарного МС [11].
В ходе проведенного гистологического исследования (рис. 3–7) было установлено, что микроскопическое строение печени в группе интактных животных сохранено: ткань имела упорядоченное балочное строение без признаков дистрофии и воспаления. У экспериментальных животных, получавших высококалорийный рацион, с содержанием липидов как 45, так и 60%, прослеживается последовательность возникающих изменений развития патологического процесса. У экспериментальных животных данных групп была выявлена жировая дистрофия гепатоцитов различной степени выраженности. На первых неделях исследования выявлены признаки гиалиново-капельной белковой дистрофии гепатоцитов, в дальнейшем установлено развитие мелкокапельной жировой дистрофии, при которой клетки содержали в цитоплазме мелкие жировые вакуоли, придающие им пенистый вид. К 21-й неделе исследования жировые включения увеличивались и диагносцировался выраженный крупнокапельный стеатоз, часто в сочетании с гидропической дистрофией.
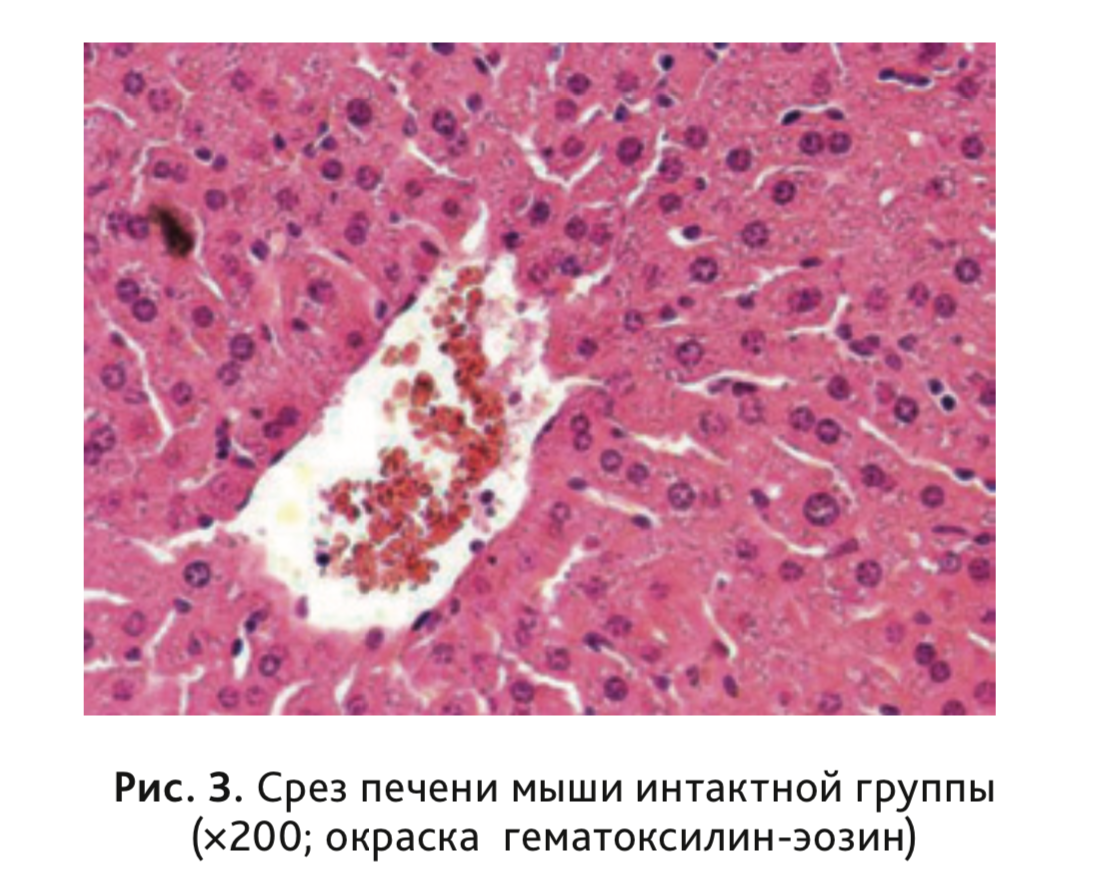
Данные изменения наиболее ярко выражены в группе животных, получавших рацион, с содержанием липидов 60%, у которых патологические изменения обнаруживались с 4-й недели и достигали максимальной выраженности к 6-й недели, сохраняясь до конца исследования. В группе животных, получавших рацион, с содержанием липидов 45% геалиново-капельную дистрофию и признаки стеатоза наблюдали лишь с 6-й недели, и только к концу исследования (21-я неделя) у некоторых животных была обнаружена мелкокапельная и редко – слабовыраженная крупнокапельная жировая дистрофия гепатоцитов.
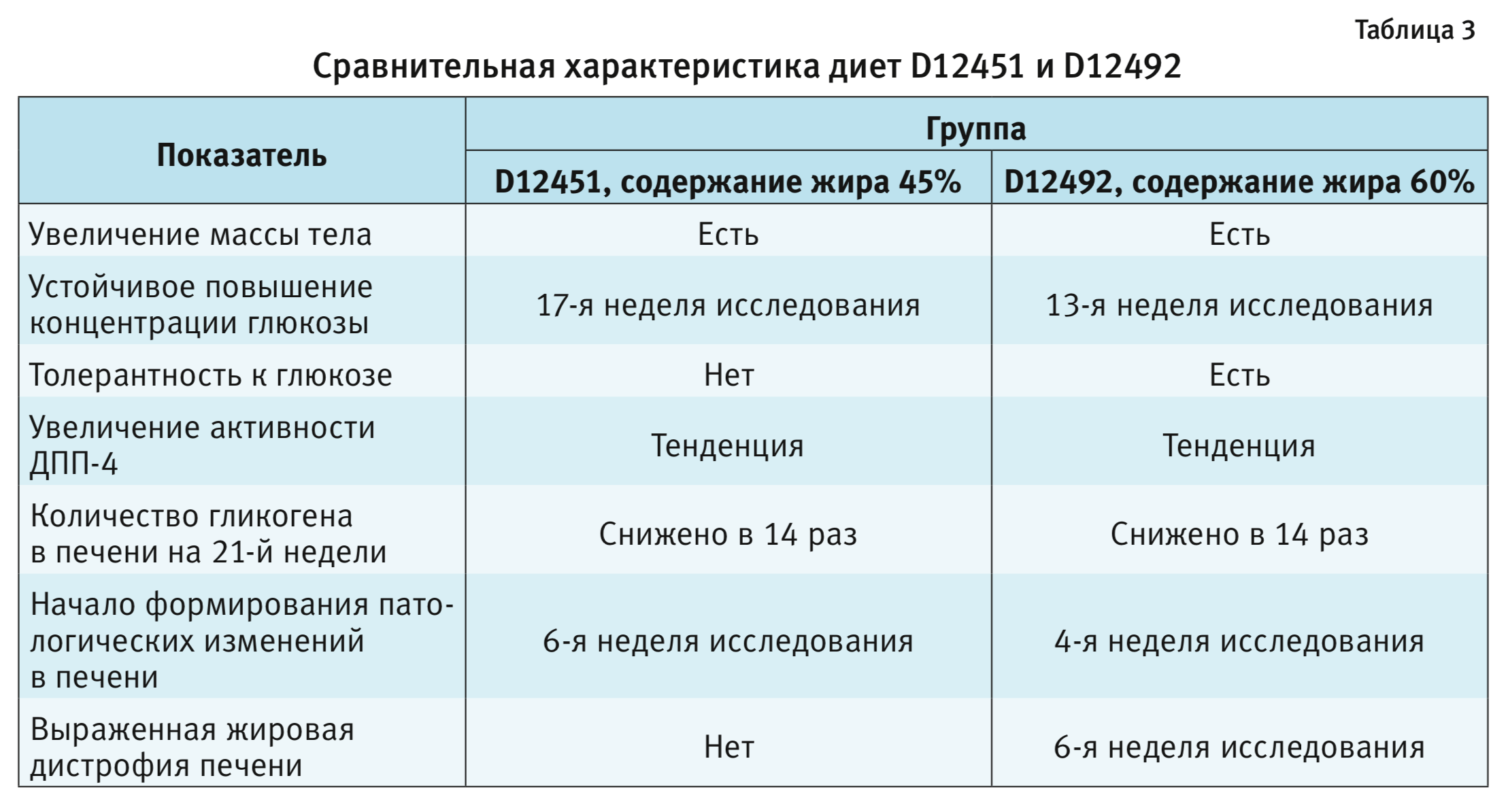
Полученные нами данные о структурных изменениях печени соответствуют результатам исследований R. Kobayasi и соавт. [11]. Сравнительная характеристика диет D12451 и D12492 представлена в табл. 3.
Заключение
В ходе проведенного исследования установлено, что на фоне применения высококалорийных диет, обогащенных липидами, у
аутбредных 8-недельных самцов мышей развивается экспериментальная патология, характеризующаяся увеличением массы
тела, умеренной гипергликемией, толерантностью к глюкозе, структурными и функциональными изменениями в печени, что
нашло отражение в уменьшении накопления гликогена и в формировании крупно- и мелкокапельного стеатоза, также
тенденции к увеличению активности ДПП-4. Таким образом, для формирования алиментарного метаболического синдрома у
молодых самцов мышей могут быть использованы обе исследуемые диеты: D12451 – содержание жира 45% и D12492
– содержание жира 60% (Research Diets, Inc., США). На основании данных о стабильном увеличении концентрации
глюкозы в периферической крови и динамике развития патологических изменений печени могут быть рекомендованы
следующие сроки формирования патологии: 17 нед – на фоне применения D12451 – содержание жира 45%
и
13 нед – на фоне применения D12492 – содержание жира 60%.
Список источников
- Lei F. Zhang X.N., Wang W., Xing D.M., Xie W.D., Su H., Du L.J. Evidence of antiobesity effects of the pomegranate leaf extract in high-fat diet induced obese mice. International Journal of Obesity. 2007. Vol. 31; 6: 1023–29. DOI:10.1038/sj.ijo.0803502.
- Hsu C.L., Wu C.H., Huang S.L., Yen G.C. Phenolic compounds rutin and o-coumaric acid ameliorate obesity induced by high-fat diet in rats. Journal of Agricultural and Food Chemistry. 2009. Vol. 57; 2:. 425–31. DOI:10.1021/jf802715t.
- Buettner R., Parhofer K.G., Woenckhaus M., Wrede C.E., Kunz-Schughart L.A., Schölmerich J., Bollheimer L.C Defi ning high-fat-diet rat models: metabolic and molecular effects of different fat types // Journal of Molecular Endocrinology. 2006. Vol. 36; 3: 485–501. DOI:10.1677/jme.1.01909.
- Макаренко И.Е., Фаустова Н.М., Ванатиев Г.В., Уракова И.Н., Пожарицкая О.Н., Макарова М.Н., Макаров В.Г., Шиков А.Н. Оценка эффективности препарата из гонад морских ежей. Фармация. 2015; 2: 47–50.
- Gajda A.M., Pellizzon M.A., Ricci M.R., Ulman E.A. Diet-Induced Metabolic Syndrome in Rodent Models animal. LABNEWS. 2007. March: 9..
- Buettner R., Scholmerich J., Bollheimer L.C. High-fat Diets: Modeling the Metabolic Disorders of Human Obesity in Rodents. Obesity. 2007. Vol. 15; 4: 798–808. DOI:10.1038/oby.2007.608.
- de Castro U.G.M., dos Santos R.A.S., Silva M.E., de Lima W.G., Campagnole-Santos M.J., Alzamor A.C. Age-dependent effect of high-fructose and high-fat diets on lipid metabolism and lipid accumulation in liver and kidney of rats. Lipids in Health and Disease. 2013. Vol. 12; 136: 1–11. DOI:10.1186/1476-511X-12-136.
- Fadini G.P., Albiero M., Menegazzo L., de Kreutzenberg S.V., Avogaro A. The increased dipeptidyl peptidase-4 activity is not counteracted by optimized glucose control in type 2 diabetes, but is lower in metformin-treated patients. Diabetes, Obesity and Metabolism. 2012. Vol. 14: 518–22. DOI:10.1111/j.1463-1326.2011.01550.x.
- Ravassa S., Barba J., Coma-Canella I., Huerta A., López B., González A., Díez J. The activity of circulating dipeptidyl peptidase-4 is associated with subclinical left ventricular dysfunction in patients with type 2 diabetes mellitus. Cardiovascular Diabetology. 2013. Vol. 7; 12: 143. DOI:10.1186/1475-2840-12-143.
- Cho Y.M., Fujita Y., Kieffer T.J. Glucagon-like peptide-1: glucose homeostasis and beyond. Annual review of physiology. 2014. Vol. 76:. 535–59. DOI:10.1146/annurev-physiol-021113-170315.
- Erion, D.M., Shulman G.I Diacylglycerol-mediated insulin resistance. Nature medicine. 2010. Vol. 16; 4: 400–2. DOI:10.1038/nm0410-400.
- Kobayasi R., Akamine E.H., Davel A.P., Rodrigues M.A., Carvalho C.R., Rossoni L.V. Oxidative stress and inflammatory mediators contribute to endothelial dysfunction in high-fat diet-induced obesity in mice. Journal of Hypertension. 2010. Vol. 28; 10: 2111–9. DOI:10.1097/HJH.0b013e32833ca68c.



